治疗多发性硬化症的方法
1.相关申请的交叉引用
2.本技术要求2019年7月22日提交的美国临时专利申请号62/877,108的优先权的权益,该申请的公开内容全文以引用方式并入本文。
技术领域
3.本公开涉及治疗多发性硬化症的方法。
背景技术:
4.多发性硬化症(ms)是中枢神经系统的慢性自身免疫炎性疾病,其影响全球250万人。疾病的特征在于脱髓鞘和轴突丧失,导致神经功能缺损和严重残疾。ms的两个主要亚型是复发型ms(rms),其代表85%的ms患者并且包括复发-缓解性疾病(rrms),临床孤立综合征和活动继发性进行性疾病;和原发性进行性ms(ppms),其仅影响15%的ms患者。
5.复发被定义为在不存在持续超过24小时的发热或感染的情况下新出现的神经症状。复发可在数天或数周内完全恢复,或导致持续性残余缺陷和残疾累积。
6.ms的自然史通常分为两个部分重叠的阶段,主要炎症阶段和主要退行性阶段:在由炎症机制驱动的复发缓解性ms的初始阶段之后,患者经历特征在于独立于复发发生的症状的持续恶化的继发性进行性ms,ms的退行性阶段。大多数目前可用的疾病改善治疗(dmt)解决了ms的炎症阶段,并且在退行性阶段不太有效。
7.目前的医疗实践鼓励早期干预疾病改善治疗,目的是优化长期临床结果。
8.管理ms的关键目标是降低复发率和预防或至少延迟疾病进展。批准用于ms的大多数疾病改善药物必须通过注射或输注(皮下[s.c.]、肌内[i.m.]或静脉内[i.v.]途径)施用。最近,口服施用的新疾病改善药物已经被批准用于rms。
[0009]
以下可注射药物已在至少一个国家批准用于治疗ms:
[0010]
·
干扰素(ifn)β-1a,30mcg,i.m.,一周一次
[0011]
·
ifnβ-1a,22mcg或44mcg,s.c.,每周3次
[0012]
·
ifnβ-1b,250mcg,s.c.,每隔一天
[0013]
·
聚乙二醇化ifnβ-1a,125mcg,皮下,每隔2周
[0014]
·
醋酸格拉替雷,20mg,s.c.,一天一次(o.d.)或40mg,皮下,每周3次
[0015]
·
醋酸格拉替雷,20mg,s.c.,o.d.,
[0016]
·
那他珠单抗,300mg,i.v.,每隔4周
[0017]
·
米托蒽醌,i.v.,每隔3个月
[0018]
·
输注用阿仑单抗浓缩液,1.2ml中12mg阿仑单抗(10mg/ml)
[0019]
若干种口服药物也已批准用于ms:
[0020]
·
芬戈莫德,0.5mg,口服,o.d.,
[0021]
·
特立氟胺,7mg、14mg,o.d.,
[0022]
·
富马酸二甲酯(bg-12),肠溶硬胶囊,120mg/240mg,一天两次
[0023]
·
克拉屈滨,40mg至100mg,口服,每治疗周
[0024]
鞘氨醇1-磷酸(s1p)在淋巴细胞运输中起核心作用。s1p由许多细胞类型合成和分泌,包括血小板,红细胞和肥大细胞,并引起多种生理反应。从初级和次级淋巴器官的淋巴细胞流出依赖于s1p1受体。s1p1受体调节剂阻断淋巴细胞从淋巴组织迁移到淋巴和血管循环中,从而减少外周淋巴细胞计数并防止淋巴细胞募集到炎症部位。撤回s1p1受体激动剂后,功能性淋巴细胞从它们的隔离部位返回循环。不依赖于归巢机制的其他功能,诸如b淋巴细胞的抗体生成、粒细胞和单核细胞的第一线免疫学保护以及抗原依赖性t细胞活化和扩增不受此机制的影响。
[0025]
s1p本身诱导多效性作用,其由位于内皮细胞、血管和心脏平滑肌细胞以及心肌细胞上的五种g蛋白偶联受体s1p1-s1p5的家族介导。已经被fda和ema批准用于治疗ms的第一种s1p受体调节剂芬戈莫德(fty720,)对s1p1受体不是选择性的,但是与s1p3、s1p4和s1p5相互作用。
[0026]
珀奈莫德(亚氨基噻唑烷酮衍生物)是s1p1的口服活性的选择性调节剂,其通过阻断淋巴细胞从淋巴器官的流出而引起外周血中淋巴细胞计数的快速、剂量依赖性且可逆的降低。t细胞和b细胞对珀奈莫德介导的隔离最敏感。相比之下,单核细胞,自然杀伤(nk)细胞和嗜中性粒细胞计数未被珀奈莫德降低。
[0027]
目前在ms中至少有十三种具有不同功效和安全性的已批准dmt。可注射的干扰素(干扰素β-1a和β1b)和醋酸格拉替雷相对安全但缺乏功效。口服疗法诸如芬戈莫德(鞘氨醇1-磷酸(s1p)受体调节剂)、西尼莫德(s1p受体调节剂)、特立氟胺和富马酸二甲酯对复发的减少具有较高的作用,但具有安全性、耐受性或药代动力学问题。最高功效的dmt、单克隆抗体那他珠单抗、阿仑单抗和奥瑞珠单抗在安全性(进行性多灶性白质脑病,自身免疫性疾病,恶性肿瘤的风险)方面具有折衷。因此,仍然存在对在安全和良好耐受的同时在预防复发和残疾累积方面具有高效的新产品的未满足的需要。
[0028]
另外,大多数目前的dmt不能显示对疲劳的有益效果。随着ms患者的发病率为38%至83%,疲劳的治疗在ms治疗中仍然是关键的未满足的需要。
技术实现要素:
[0029]
在一些方面,本公开涉及避免患有多发性硬化症和疲劳的人类患者的疲劳相关症状恶化的方法,包括评估患者的疲劳相关症状,并且向患者施用珀奈莫德的有效方案,其中该方案足以避免疲劳相关症状恶化。
[0030]
在一些方面,本公开涉及避免患有多发性硬化症和疲劳的人类患者的疲劳相关症状恶化的方法,包括向患者施用珀奈莫德的有效方案,其中该方案足以避免疲劳相关症状恶化。
[0031]
在其他方面,本公开涉及减少患有多发性硬化症的患者的组合独特活动性病变(cual)的数量的方法,该方法包括向患者施用珀奈莫德的有效方案,其中该方案足以使cual的数量相对于接受不包含珀奈莫德的护理治疗标准的处于基本上相同的疾病进展水平的患者群体减少至少40%。
[0032]
在其他方面,本公开涉及在避免患有多发性硬化症和疲劳的人类患者的疲劳相关症状恶化的方法中使用的珀奈莫德,所述方法包括评估患者的疲劳相关症状,并且向患者施用珀奈莫德的有效方案,其中该方案足以避免疲劳相关症状恶化。
[0033]
在其他方面,本公开涉及在避免患有多发性硬化症和疲劳的人类患者的疲劳相关症状恶化的方法中使用的珀奈莫德,所述方法包括向患者施用珀奈莫德的有效方案,其中该方案足以避免疲劳相关症状恶化。
[0034]
在其他方面,本公开涉及在减少患有多发性硬化症的患者的组合独特活动性病变(cual)的数量的方法中使用的珀奈莫德,所述方法包括使用以下方案向患者施用珀奈莫德:该方案有效地使cual的数量相对于接受不包含珀奈莫德的护理治疗标准的处于基本上相同的疾病进展水平的患者群体减少至少40%。
[0035]
在其他方面,本公开涉及珀奈莫德在制备用于避免患有多发性硬化症和疲劳的人类患者的疲劳相关症状恶化的药物中的用途,其中所述药物适于使用有效地避免疲劳相关症状恶化的方案来施用。
[0036]
在又一些方面,本公开涉及珀奈莫德对于制备用于减少患有多发性硬化症的患者的组合独特活动性病变(cual)的数量的药物的用途,其中所述药物适于使用以下方案来施用:该方案有效地使cual的数量相对于接受不包含珀奈莫德的护理治疗标准的处于基本上相同的疾病进展水平的患者群体减少至少40%。
[0037]
本公开还提供了包含珀奈莫德的药物产品。通常,所述药物产品是包装件或被包装并且包括以有效地避免疲劳相关症状恶化的方案向患有多发性硬化症和疲劳的人类患者施用珀奈莫德的说明书。
附图说明
[0038]
图1示出实施例1中描述的研究的测试策略。
[0039]
图2a示出复发的初级和主要补充分析的概述(具有99%cl的森林图)。在图2a中,n(pon)=珀奈莫德组中受试者的数量;rate(pon)=珀奈莫德组中的平均率;n(ter)=特立氟胺组中的受试者数量;并且rate(ter)=特立氟胺组中的平均率。*=按协议设置进行;**=缺失edss的复发被归咎为确认复发。图2b示出疲劳症状和影响问卷-复发性多发性硬化症(fsiq-rms)的概念框架;*=项目也存在于身体影响子域中。
[0040]
图3a示出通过就诊fsiq-rms每周症状评分从基线到第108周的变化。mmrm(主要分析)分析集:全分析集。在图3a中,具有可用基线和至少一个基线后结果的受试者包括在分析中,由此mmrm=混合效应重复测量模型,其具有非结构化协方差、治疗、就诊、就诊互动治疗、就诊互动基线作为固定效应,基线fsiq评分、edss层(《=3.5,》3.5)、过去2年在先随机化层(y,n)中的dmt作为协变量。
[0041]
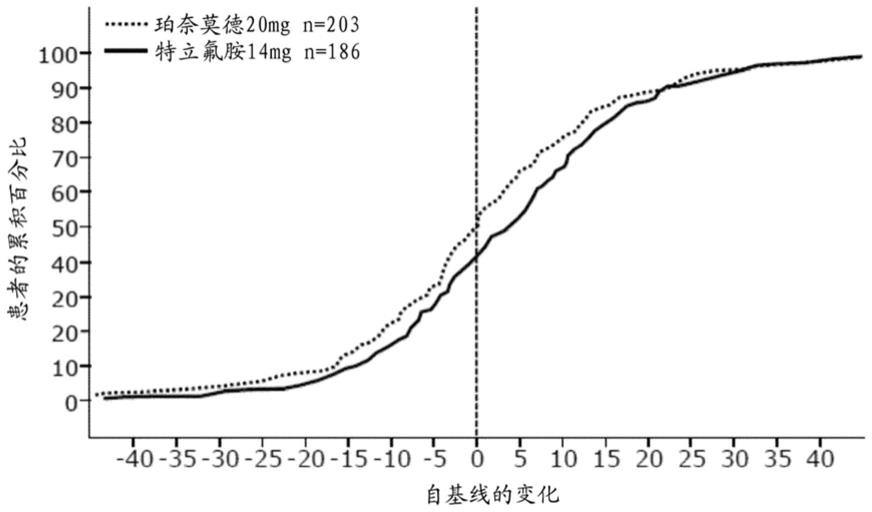
图3b示出fsiq-rms每周症状评分在第108周从基线变化的累积分布函数。
[0042]
图4是kaplan-meier曲线(主要分析),其示出至研究结束(eos)前12周确认的残疾
累积(cda)的时间:分析集:全分析集。在图4中,事件=12周cda,并且没有事件的受试者在其最后edss评估时被审查而没有edss增加。呈现了无分层kaplan-meier估计。曲线图上的条显示估计的逐点95%置信区间。p值是双侧的并且基于分层对数秩检验。从具有wald置信界限的分层cox回归获得的风险比估计。在随机化层(y,n)之前的过去2年中,通过edss层(≤3.5;》3.5)和疾病改善治疗来对分析进行分层。
[0043]
图5是kaplan-meier曲线(主要分析),其示出至eos前24周cda的时间:分析集:全分析集。在图5中,事件=24周cda,并且没有事件的受试者在其最后edss评估时被审查而没有edss增加。呈现了无分层kaplan-meier估计。曲线图上的条显示估计的逐点95%置信区间。p值是双侧的并且基于分层对数秩检验。从具有wald置信界限的分层cox回归获得的风险比估计。在随机化层(y,n)之前的过去2年中,通过edss层(≤3.5;》3.5)和疾病改善治疗来对分析进行分层。
[0044]
图6示出12导联心电图(ecg)心率和在第1天的给药前按小时的绝对变化(分析集:安全集)。按照递增滴定方案,在第1天的珀奈莫德剂量是2mg。
[0045]
图7是森林图(具有99%cl),其示出直至eos的确认复发的初级和灵敏度分析的概述(分析集:全分析集)。在图7中,n(pon)=珀奈莫德组中的受试者;rate(pon)=珀奈莫德组中的年复发率;n(ter)=特立氟胺组中的受试者,并且rate(ter)=特立氟胺组中的年复发率。竖直实线参考主要分析的治疗效果。负二项式模型应用于wald置信界限,偏移:直至eos的日志时间(年)。针对以下协变量调整主要分析:edss层(≤3.5;》3.5);在随机化层(y,n)之前的过去2年中的dmt;以及在进入研究之前一年中的复发数量(≤1;≥2)。
[0046]
图8是森林图(具有99%cl),其示出直至eos的确认复发的亚组分析(分析集:全分析集)。在图8中,p*=相互作用p值;n(pon)=珀奈莫德组中受试者的数量;rate(pon)=珀奈莫德组中的平均率;n(ter)=特立氟胺组中受试者的数量,并且rate(ter)=特立氟胺组中的平均率。在每个亚组中负二项式模型单独应用于wald置信界限,偏移:直至eos的日志时间(年)。相互作用p值来自模型中相互作用项的似然比检验,该模型具有治疗、亚组和亚组相互作用的治疗。竖直实线参考主要分析的治疗效果。针对以下协变量调整主要分析:edss层(≤3.5;》3.5);在随机化层(y,n)之前的过去2年中的dmt;以及在进入研究之前一年中的复发数量(≤1;≥2)。亚组分析未针对协变量进行调整。
[0047]
图9示出对于身体影响子域在fsiq-rms中从基线到第108周的变化。
[0048]
图10示出对于认知/情感影响子域在fsiq-rms中从基线到第108周的变化。
[0049]
图11示出对于应对影响子域在fsiq-rms中从基线到第108周的变化。
[0050]
图12示出基线疲劳低于中值的患者的fsiq-rms每周症状评分从基线到第108周的变化。
[0051]
图13示出基线疲劳低于中值的患者的fsiq-rms每周症状评分在第108周从基线变化的累积分布函数。
[0052]
图14示出基线疲劳高于中值的患者的fsiq-rms每周症状评分从基线到第108周的变化。
[0053]
图15示出基线疲劳高于中值的患者的fsiq-rms每周症状评分在第108周从基线变化的累积分布函数。
[0054]
图16示出在随机化之前两年没有dmt治疗的患者的fsiq-rms每周症状评分从基线
到第108周的变化。
[0055]
图17示出在随机化之前两年没有dmt治疗的患者的fsiq-rms每周症状评分在第108周从基线变化的累积分布函数。
[0056]
图18示出在基线处没有gd /t1病变的患者的fsiq-rms每周症状评分从基线到第108周的变化。
[0057]
图19示出在基线处没有gd /t1病变的患者的fsiq-rms每周症状评分在第108周从基线变化的累积分布函数。
[0058]
图20示出在基线处患有gd /t1病变的患者的fsiq-rms每周症状评分从基线到第108周的变化。
[0059]
图21示出在基线处患有gd /t1病变的患者的fsiq-rms每周症状评分在第108周从基线变化的累积分布函数。
[0060]
图22示出基线edss≤3.5的患者的fsiq-rms每周症状评分从基线到第108周的变化。
[0061]
图23示出基线edss≤3.5的患者的fsiq-rms每周症状评分在第108周从基线变化的累积分布函数。
[0062]
图24示出在基线处具有一次或更少复发的患者的fsiq-rms每周症状评分从基线到第108周的变化。
[0063]
图25示出在基线处具有一次或更少复发的患者的fsiq-rms每周症状评分在第108周从基线变化的累积分布函数。
[0064]
图26示出在基线处具有两次或更多复发的患者的fsiq-rms每周症状评分从基线到第108周的变化。
[0065]
图27示出在基线处具有两次或更多复发的患者的fsiq-rms每周症状评分在第108周从基线变化的累积分布函数。
具体实施方式
[0066]
在本公开中,除非上下文另行明确指出,否则单数形式“一个”、“一种”、“该”和“所述”包括复数含义,并且对具体数值的引用至少包括该具体值。因此,例如,对“材料”的引用是指此类材料中的至少一种,以及本领域的技术人员已知的该材料的等同物等。
[0067]
当使用描述符“约”或“基本上”将值表示为近似值时,应当理解,该具体值构成了另一个实施方案。一般来讲,术语“约”或“基本上”的使用表示近似值,这些近似值可根据所公开的主题试图获得的期望特性而变化,并且将在使用该近似值的特定上下文中基于其功能进行解释。本领域的技术人员将能够按常规解释这些近似值。在一些情况下,用于特定值的有效数字的数目可以是确定词语“约”或“基本上”的范围的一种非限制性方法。在其他情况下,可以使用一系列值中使用的梯度来为每个值确定可用于术语“约”或“基本上”的预期范围。在存在的情况下,所有范围均包括端值在内并且是可组合的。即,对范围内规定的值的引用包括该范围内的每一个值。
[0068]
当提供一个列表时,除非另行指出,否则应当理解,该列表中的每个单独元素和该列表的每种组合都被理解为单独的实施方案。例如,作为“a、b或c”呈现的实施方案的列表将被理解为包括实施方案“a”、“b”、“c”、“a或b”、“a或c”、“b或c”或者“a、b或c”。
[0069]
应当理解,为了清楚起见,本公开的某些特征在单独实施方案的上下文中进行阐述,但也可以组合形式提供在单个实施方案中。也就是说,除非明显不相容或被排除在外,否则每个单独实施方案被认为可与任何其他实施方案组合,并且这种组合被视为另一个实施方案。相反地,为简明起见,本公开的各种特征在单个实施方案的上下文中进行阐述,也可单独地或以任何子组合形式提供。还应当注意,权利要求书可制定为排除任何任选的元素。同样地,这一声明旨在当结合权利要求元素的表述“单独地”、“唯一地”等使用此类专用术语时或使用“负”限制时充当先行基础。最终,尽管实施方案可描述为一系列步骤的一部分或更普遍结构的一部分,但每个所述步骤本身也可被视为独立的实施方案。
[0070]
在一些方面,本公开涉及避免患有多发性硬化症和疲劳的人类患者的疲劳相关症状恶化的方法,包括任选地评估患者的疲劳相关症状;以及向患者施用珀奈莫德的有效方案,其中该方案足以避免疲劳相关症状的恶化。如本文所述,疲劳是与多发性硬化症相关联的疲劳。
[0071]
在某些方面,该方法针对在开始用珀奈莫德治疗之前约两年内未经对于多发性硬化症的先前疾病改善治疗(dmt)的患者。在一些实施方案中,该方法针对在用珀奈莫德开始治疗之前具有≤3.5的基线扩展残疾状态量表(edss)分数的患者。在其他实施方案中,该方法针对在用珀奈莫德开始治疗之前没有gd /t1病变的患者。
[0072]
在其他方面,本公开涉及减少患有多发性硬化症的患者的组合独特活动性病变(cual)的数量的方法,该方法包括向患者施用珀奈莫德的有效方案,其中该方案足以使cual的数量相对于接受不包含珀奈莫德的护理治疗标准的处于基本上相同的疾病进展水平的患者群体减少至少40%。
[0073]
在一些方面,对患有多发性硬化症的人类患者进行本公开的方法。在一些实施方案中,患者的多发性硬化症是复发性多发性硬化症。在其他实施方案中,复发性多发性硬化症包括复发-缓解性疾病、临床孤立综合征或活动继发性进行性疾病。
[0074]
如本文所用,术语“避免疲劳相关症状恶化”是指防止患者的疲劳相关症状相对于患者在基线处的疲劳相关症状变得更差,其中基线是指在用珀奈莫德开始治疗之前的时间段。该时间段通常在用珀奈莫德开始治疗之前至多约45天,包括在开始用珀奈莫德开始治疗之前至多约40天、至多约35天、至多约30天、至多约25天、至多约20天、至多约15天或至多约10天。通过避免恶化,该方法另外涉及稳定或改善疲劳相关症状。
[0075]
在本公开的方法的一些实施方案中,评估患者的疲劳相关症状。在本公开的方法的一些实施方案中,在开始用珀奈莫德开始治疗之前未评估患者的疲劳相关症状。如本文所用,“疲劳相关症状”是指患者所经历的疲劳症状。
[0076]
在一些方面,疲劳相关症状是患者在进行常规日常活动(例如,家务、庭院劳动、购物、工作)时所经历的症状。在一些实施方案中,疲劳相关症状是患者在进行常规日常活动时所经历的那些症状,并且包括身体疲倦、精神疲倦、身体虚弱、缺乏精力、感觉疲乏或感觉困倦。
[0077]
在其他实施方案中,疲劳相关症状是(1)身体疲倦、(2)精神疲倦、(3)身体虚弱、(4)缺乏精力、(5)感觉疲乏、(6)在进行日常活动时感觉困倦,和(7)在休息时感觉疲乏。
[0078]
在一些实施方案中,在开始珀奈莫德施用之前,例如在基线处评估患者的疲劳相关症状。在其他实施方案中,患者的疲劳相关症状在珀奈莫德施用开始后评估,以例如在用
珀奈莫德治疗期间监测疲劳相关症状。在一些实施方案中,在开始珀奈莫德施用之前和开始珀奈莫德治疗之后,评估患者的疲劳相关症状。
[0079]
可通过从患者确定患者所经历的疲劳的任何症状的性质和严重程度来评估患者的疲劳相关症状。在一些实施方案中,使用患者报告的结果(pro)问卷评估患者的疲劳相关症状。
[0080]
在一些实施方案中,患者报告的结果问卷是疲劳症状和影响问卷-复发性多发性硬化症(fsiq-rms)(可从mapi research trust获得)。fsiq-rms是ms特异性20项pro量度,其包括2个域:一个测量ms症状和一个测量ms相关影响。参见hudgens s等人,development and validation of the fsiq-rms:a new patient-reported questionnaire to assess symptoms and impacts of fatigue in relapsing multiple sclerosis,value health,2019年4月,第22卷,第4期,第453-466页,doi:10.1016/j.jval.2018.11.007,epub 2019年2月21日,pubmed pmid:30975397。通过7个症状项和13个影响项(在3个影响子域中:身体、认知和情绪、以及应对),fsiq-rms是rms患者中疲劳相关症状和影响的全面、有效和可靠的量度。图2b描绘了fsiq-rms的概念框架。
[0081]
在一些实施方案中,患者报告的结果问卷是fsiq-rms的症状域。fsiq-rms症状域(fsiq-rms-s)由七项组成,评估疲劳相关症状,回忆期为24小时,在11分数字评级量表上测量;标准化症状域评分在0至100的范围内,其中较高的分数指示较大的疲劳。该域(即,问卷的第1部分)在连续7天完成。
[0082]
fsiq-rms影响域(fsiq-rms-i)由13项组成,评估疲劳相关症状的影响,回忆期为7天,在5分语言描述符量表上测量,标准化影响域评分在0至100的范围内,其中较高的分数指示较大影响。
[0083]
在本公开的方法的一些方面,向患者施用珀奈莫德的有效方案。有效方案是在人类组织系统中引发研究人员、医师或其他临床医生所寻求的生物学或医学反应的方案,其包括减轻所治疗的疾病或病症的一种或多种症状。
[0084]
如本文所用,术语“珀奈莫德”是指化合物(r)-5-[3-氯-4-(2,3-二羟基-丙氧基)-苯并[z]亚基]-2-([z]-丙基亚氨基)-3-邻甲苯基-噻唑烷-4-酮,其具有以下结构:
[0085][0086]
在一些实施方案中,“珀奈莫德”也指珀奈莫德的药学上可接受的盐。术语“药学上可接受的盐”是指保留主题化合物的期望的生物活性并且表现出最小不期望的毒理效应的盐。此类盐包括无机或有机酸和/或碱加成盐,这取决于主题化合物中碱性和/或酸性基团的存在。有关参考文献请参见例如handbook of pharmaceutical salts,properties,selection and use,p.heinrich stahl、camille g.wermuth编辑,wiley-vch,2008年,以及pharmaceutical salts and co-crystals,johan wouters和luc qu
éré
编辑,rsc publishing,2012年。
[0087]
应理解,本公开涵盖任何形式的珀奈莫德,包括无定形以及结晶形式。还应理解,珀奈莫德的结晶形式涵盖所有类型的结晶形式,包括多晶型物、溶剂化物和水合物、盐和共晶体(当相同的分子可以与不同的共晶体形成剂共结晶时),前提条件是它们适合于药物施用。在一些实施方案中,珀奈莫德呈结晶形式a或结晶形式c,如wo 2010/046835中所述,其以引用方式并入本文。在一些实施方案中,珀奈莫德呈结晶形式c。
[0088]
应当注意,本文所述的珀奈莫德的量在珀奈莫德游离碱基础上列出。也就是说,该量指示除例如溶剂(诸如在溶剂化物中)或抗衡离子(诸如在药学上可接受的盐中)之外所施用的珀奈莫德分子的量。
[0089]
在一些实施方案中,有效方案包括珀奈莫德的日剂量。在一些实施方案中,口服施用珀奈莫德的日剂量。
[0090]
在一些实施方案中,每天施用珀奈莫德的日剂量一次。
[0091]
在一些实施方案中,珀奈莫德的日剂量为约15mg至约25mg。在另外的实施方案中,珀奈莫德的日剂量为约15mg、约16mg、约17mg、约18mg、约19mg、约20mg、约21mg、约22mg、约23mg、约24mg或约25mg。在某些实施方案中,珀奈莫德的日剂量为约20mg。
[0092]
在一些实施方案中,每天一次口服施用约20mg的珀奈莫德。
[0093]
在其他实施方案中,有效方案包括递增滴定,随后是珀奈莫德的每日维持剂量。递增滴定是给药程序,其中在数天的周期内逐渐增加珀奈莫德的日剂量,以施用维持剂量结束。
[0094]
在一些实施方案中,该方案包括在本公开的方法开始时递增滴定。在其他实施方案中,该方案包括在中止本公开的方法后在重新开始该方法时递增滴定。如本文所用,“在中止后重新开始该方法时”意指在重新开始治疗前中断施用珀奈莫德至少一天、至少两天或优选至少3天。在一些实施方案中,该方案包括在方法开始时或在方法中止后重新开始时的递增滴定步骤。
[0095]
在本公开的方法的一些实施方案中,美国专利号10,220,023中公开了递增滴定方案,该专利以引用方式并入本文。例如,在某些方面,递增滴定包括每天口服施用一次:在第1天和第2天约2mg的珀奈莫德;在第3天和第4天约3mg的珀奈莫德;在第5天和第6天约4mg的珀奈莫德;在第7天约5mg的珀奈莫德;在第8天约6mg的珀奈莫德;在第9天约7mg的珀奈莫德;在第10天约8mg的珀奈莫德;在第11天约9mg的珀奈莫德;以及在第12天、第13天和第14天约10mg的珀奈莫德。
[0096]
在本公开的方法的其他实施方案中,递增滴定包括每天口服施用一次:在第1天和第2天2mg的珀奈莫德;在第3天和第4天3mg的珀奈莫德;在第5天和第6天4mg的珀奈莫德;在第7天5mg的珀奈莫德;在第8天6mg的珀奈莫德;在第9天7mg的珀奈莫德;在第10天8mg的珀奈莫德;在第11天9mg的珀奈莫德;以及在第12天、第13天和第14天10mg的珀奈莫德。
[0097]
在一些实施方案中,维持剂量为每天一次约20mg的珀奈莫德。
[0098]
在一些实施方案中,该方案包括在方法开始时或在方法中止后重新开始时的递增滴定步骤,包括每天口服施用一次:在第1天和第2天2mg的珀奈莫德;在第3天和第4天3mg的珀奈莫德;在第5天和第6天4mg的珀奈莫德;在第7天5mg的珀奈莫德;在第8天6mg的珀奈莫德;在第9天7mg的珀奈莫德;在第10天8mg的珀奈莫德;以及在第11天9mg的珀奈莫德;在第12天、第13天和第14天10mg的珀奈莫德,然后每天一次施用20mg的珀奈莫德。
[0099]
在所公开的方法的一些方面,该方案足以避免疲劳相关症状的恶化。当与例如在基线处施用珀奈莫德方案之前的患者的疲劳相关症状(如本文所述评估)相比,施用珀奈莫德方案之后的患者的疲劳相关症状(如本文所述评估)改善或未改变时,方案足以避免疲劳相关症状的恶化。
[0100]
在其他实施方案中,本公开的方法涉及减少患者的组合独特活动性病变(cual)的数量。
[0101]
cual是新的gd t1病变,加上新的或扩大的t2病变(不对病变进行重复计数)。cual的累积数量被认为是炎性ms疾病活动度的可靠结果量度。疾病活动度的放射学证据通常用于支持疾病诊断并以无疾病活动度证据(neda)、临床(复发或残疾累积)或放射学(mri上的脑损伤)视角为目标告知治疗决策。参见lublin fd,disease activity free status in ms,mult scler relat disord,2012年1月,第1卷,第1期,第6-7页,doi:10.1016/j.msard.2011.08.001,epub 2011年8月27日,pubmed pmid:25876444。
[0102]
使用磁共振成像(mri)技术检测cual。
[0103]
在所公开的方法的这一方面,向患者施用的珀奈莫德方案足以使cual的数量相对于接受护理治疗标准的处于基本上相同的疾病进展水平的患者群体减少至少40%。也就是说,与正在接受护理治疗标准的具有基本上相同程度的ms进展的患者相比,施用珀奈莫德方案的患者将获得少至少40%的cual。
[0104]
在一些实施方案中,向患者施用的珀奈莫德方案足以使cual的数量相对于接受护理治疗标准的处于基本上相同的疾病进展水平的患者群体减少至少20%至约65%。在一些实施方案中,向患者施用的珀奈莫德方案足以使cual的数量相对于接受护理治疗标准的处于基本上相同的疾病进展水平的患者群体减少至少30%。在一些实施方案中,向患者施用的珀奈莫德方案足以使cual的数量相对于接受护理治疗标准的处于基本上相同的疾病进展水平的患者群体减少至少50%。在一些实施方案中,向患者施用的珀奈莫德方案足以使cual的数量相对于接受护理治疗标准的处于基本上相同的疾病进展水平的患者群体减少至少55%。
[0105]
如本文所用,术语“护理治疗标准”是指医师规定的ms治疗。在一些实施方案中,护理标准包括以下、由以下组成或基本上由以下组成:施用已经由管理机构批准的ms治疗。在一些实施方案中,护理治疗标准是干扰素(ifn)β-1a,30mcg,i.m.,一周一次ifnβ-1a,22mcg或44mcg,s.c.,每周3次ifnβ-1b,250mcg,s.c.,每隔一天聚乙二醇化ifnβ-1a,125mcg,皮下,每隔2周醋酸格拉替雷,20mg,s.c.,一天一次(o.d.)或40mg,皮下,每周3次醋酸格拉替雷,20mg,s.c.,o.d.,那他珠单抗,300mg,i.v.,每隔4周米托蒽醌,i.v.,每隔3个月输注用阿仑单抗浓缩液,1.2ml中12mg阿仑单抗(10mg/ml)芬戈莫德,0.5mg,口服,o.d.,特立氟胺,7mg、14mg,o.d.,富马酸二甲酯(bg-12),肠溶硬胶囊,120mg/240mg,一天两次或克拉屈滨,40mg至100mg,口服,每治疗周
[0106]
在一些实施方案中,护理治疗标准包括不是珀奈莫德的s1p受体调节剂。
[0107]
在其他实施方案中,护理治疗标准包括特立氟胺。在一些实施方案中,护理治疗标准包括每天一次口服施用约14mg的特立氟胺。
[0108]
在一些实施方案中,患者未经对于多发性硬化症的先前疾病改善治疗(dmt)。在一些实施方案中,在开始用珀奈莫德治疗之前约两年内,患者未经对于多发性硬化症的先前疾病改善治疗(dmt)。在一些实施方案中,相对于不包含珀奈莫德的护理治疗标准(诸如特立氟胺),未经对于多发性硬化症的dmt的患者由于使用珀奈莫德以解决疲劳而实现了改善的功效。因此,关于这些患者和其他患者,所公开的方法为医疗保健提供者提供了与护理标准相比改善的结果的选项。
[0109]
在一些实施方案中,该方法针对具有≤3.5的基线扩展残疾状态量表(edss)分数的患者。在一些实施方案中,该方法针对在基线处没有gd /t1病变的患者。
[0110]
本公开还提供了包含珀奈莫德的药物产品。通常,药物产品是包装件或被包装,例如瓶、小袋或泡罩包装。
[0111]
在一些实施方案中,包装件包括说明书。在某些实施方案中,说明书用于以有效地避免疲劳相关症状恶化的方案向患有多发性硬化症和疲劳的人类患者施用珀奈莫德。在其他实施方案中,包装件提供说明书和/或疲劳相关症状数据,该数据针对在约两年的周期内未经对于多发性硬化症的先前疾病改善治疗(dmt)的患者。在另外的实施方案中,包装件提供说明书和/或疲劳相关症状数据,该数据针对具有≤3.5的基线扩展残疾状态量表(edss)分数的患者。在又一些实施方案中,包装件提供说明书和/或疲劳相关症状数据,该数据针对在基线处没有gd /t1病变的患者。
[0112]
如本文所用,术语“组水平”是指患者组之间的组水平变化或差异,例如当比较治疗组时在临床试验中观察到的结果的组水平差异。例如,图3a示出珀奈莫德20mg和特立氟胺14mg随时间推移的基线的平均变化-并且其视觉上示出治疗组中从基线的变化的分离或差异。
[0113]
如本文所用,术语“患者水平”是指个体或患者体内变化水平。如本文所用,“临床上有意义的”是指治疗效果的实际重要性以及其对症状和/或日常生活是否具有真正真实的、可感知的、显著的效果。例如,当解释来自患者报告结果(pro)的数据时,定义pro评分在预定时间段内的变化水平是有帮助的,该变化水平应被解释为治疗益处。各种术语用于这种变化水平,包括有意义的变化阈值(mct)。该阈值可用于进行应答者分析,其中如果个体患者的pro评分变化水平超过mct,则该患者是应答者。可以比较治疗组之间的应答者比例以评估治疗效果。例如,在本文公开的某些实施方案中,在fsiq-rms每周症状评分上,使用-6.3的mct,分析了在珀奈莫德和特立氟胺治疗组中应答者的百分。还计算了稳定或改善的类别中受试者的百分比。并且应答者的百分比也可以在曲线图(累积分布函数)上可视化,该曲线图示出患者的累积百分比,其示出相应治疗组中所有可能的变化水平。因此,使用mct和相关联应答者分析评价患者体内变化,以提供对从统计学检验得出的p值的附加解释。
[0114]
如本文所用,术语“统计学上显著的”是指两个或更多个变量之间的关系由除偶然以外的某些事物引起的可能性。小于0.05(通常≤0.05)的p值是统计学显著性的常见度量,
并且指示针对无效假设的有力证据,因为零正确的概率小于5%(并且结果是随机的)。
[0115]
提供以下实施例以举例说明本公开中描述的一些概念。虽然实施例被认为是提供实施方案,但其不应被认为限制本文所述的更一般的实施方案。
[0116]
实施例a:疲劳症状和影响问卷-复发性多发性硬化症(fsiq-rms)
[0117]
用于以下实施例的患者报告的结果问卷是疲劳症状和影响问卷-复发性多发性硬化症(fsiq-rms)。fsiq-rms是ms特异性20项pro量度,其包括2个域:一个测量ms症状(7项)和一个测量ms相关影响(13项)。7个症状项和13个影响项(在3个影响子域中:身体、认知和情绪、以及应对)在下文中呈现。
[0118]
ms症状域
–
7项
[0119]
对于ms症状域,fsiq-rms询问患者对于项目1-6在进行常规日常活动(例如,家务、庭院劳动、购物、工作等)的同时,或者对于项目7在休息(例如,看书、看电视等)的同时在过去24小时内复发ms的疲劳相关症状。要求患者在0至10的量表上选择最佳描述其体验的回答,并要求患者不要跳过任何问题,没有正确或错误的答案。
[0120]
项目1-在过去24小时内,在进行常规日常活动时,您感觉身体有多疲倦?
[0121][0122]
项目2-在过去24小时内,在进行常规日常活动时,您感觉精神有多疲倦?
[0123][0124]
项目3-在过去24小时内,在进行常规日常活动时,您感觉身体有多虚弱?
[0125][0126]
项目4-在过去24小时内,在进行常规日常活动时,您如何评价自己的精力?
[0127][0128]
项目5-在过去24小时内,在进行常规日常活动时,您感觉有多疲乏?
[0129][0130]
项目6-在过去24小时内,在进行常规日常活动时,您感觉有多困倦?
[0131][0132]
项目7-在过去24小时内,在休息时,您感觉有多疲乏?
[0133][0134]
ms-相关影响
–
13项
[0135]
对于ms相关影响域,fsiq-rms询问在过去7天内患者的生活如何受到复发性ms的疲劳相关症状的影响。要求患者在0至4的量表上选择最佳描述其体验的回答,并要求患者不要跳过任何问题,没有正确或错误的答案。
[0136]
项目1-想想您过去7天内疲劳相关的症状,您在办事(例如杂货店购物或者去银行或atm)上有多困难?
[0137][0138]
项目2-想想您过去7天内疲劳相关的症状,您在清晰地交流上有多困难?
[0139][0140]
项目3-想想您过去7天内疲劳相关的症状,您在清楚地思考上有多困难?
[0141][0142]
项目4-想想您过去7天内疲劳相关的症状,激励自己进行常规日常活动对您来说有多困难?
[0143][0144]
项目5-想想您过去7天内疲劳相关的症状,您在做室内家务琐事上有多困难?
[0145][0146]
项目6-想想您过去7天内疲劳相关的症状,您在步行上有多困难?
[0147][0148]
项目7-想想您过去7天内疲劳相关的症状,您在维护与亲近的人的关系上有多困难?
[0149]
[0150]
项目8-想想您过去7天内疲劳相关的症状,您在参加社交活动(诸如看电影或外出就餐)上有多困难?
[0151][0152]
项目9-想想您过去7天内疲劳相关的症状,您有多沮丧?
[0153][0154]
项目10-想想您过去7天内疲劳相关的症状,您健忘的频率如何?
[0155][0156]
项目11-想想您过去7天内疲劳相关的症状,您多久需要小睡?
[0157][0158]
项目12-想想您过去7天内疲劳相关的症状,您多久需要小憩一下?
[0159][0160]
项目13-想想您过去7天内疲劳相关的症状,您多久需要重新安排您的计划?
[0161][0162]
实施例1.
[0163]
研究设计
[0164]
进行了前瞻性、多中心、随机、双盲、活性对照、平行组、iii期、优效性研究。该研究被设计成在患有复发性ms的成年受试者中比较20mg珀奈莫德与14mg特立氟胺的功效、安全性和耐受性。
[0165]
随机化:受试者以1:1比率随机分配珀奈莫德20mg或特立氟胺14mg,通过在随机化(是,否)之前的过去两年中早先使用ms疾病改善治疗(dmt)并通过基线扩展残疾状态量表(edss)分数(edss≤3.5,edss》3.5)进行分层。
[0166]
纳入标准
[0167]
该研究招募了年龄在18至55岁之间且确诊为ms的成年男性和女性受试者,如2010年版本的mcdonald诊断标准所定义[polman ch等人,diagnostic criteria for multiple sclerosis:2010revisions to the mcdonald criteria,ann neurol,2011年,第69卷,第2期,第292-302页],其具有从发作开始的复发过程(即,复发-缓解性多发性硬化症和伴有叠加复发的继发性进行性多发性硬化症[spms])。该试验包括最多15%的伴有叠加复发的spms受试者。
[0168]
受试者患有活动性疾病,其证据是在基线edss评估前12至1个月内发生一次或多次ms发作,或在基线edss评估前24至1个月内发生两次或多次ms发作,或在基线edss评估前6个月内进行的mri上的脑的一个或多个钆增强(gd )病变。所招募的受试者可以走动,edss分数最高至5.5(包括端值在内)。受试者未接受过治疗(即,过去任何时间都未接受过ms疾病改善治疗)或之前接受过干扰素(ifn)β-1a、ifnβ-1b、醋酸格拉替雷、富马酸二甲酯或那他珠单抗治疗。
[0169]
排除标准:
[0170]
患有显著医学病症或治疗此类病症(例如,心血管、肺、免疫、肝、眼科、眼部)的受试者或者哺乳期或妊娠期妇女不符合进入研究的条件。
[0171]
根据研究者的意见,患有mri禁忌症或具有临床相关医疗或外科病症的受试者因参与研究而面临风险,不符合进入研究的条件。
[0172]
研究/治疗持续时间:
[0173]
对于个体受试者,研究的最大持续时间为约118周,其包括6周筛选,108周治疗和4周安全随访。过早中止治疗的受试者可选择停留在治疗后观察期(ptop)长达108周。
[0174]
该研究由以下时期组成:
[0175]
随机化前周期-随机化之前至多45天。
[0176]
治疗周期:双盲治疗周期持续108周。其包括随机化访视,在随机化后两周、四周和12周进行访视,并且随后每12周访视。
[0177]
治疗结束(eot):
[0178]
eot访视在第108周(或在研究药物提前中止的情况下更早)进行。在所有情况下,eot访视在研究药物最后剂量后一天,但不晚于研究药物最后剂量后7天进行。
[0179]
完成治疗直至第108周的受试者符合参加根据单独协议进行的延长研究的条件。出于任何原因而过早地中止研究药物的受试者不符合延长研究的条件。
[0180]
过早中止研究药物治疗的受试者随后在研究者判断下根据当地护理标准进行治疗,并在治疗后观察周期进行随访。
[0181]
治疗后安全随访(fu)周期:
[0182]
特立氟胺从血浆缓慢消除。所有受试者在研究药物的最后剂量后使用加速消除程序。要求在研究药物的最后剂量后进行安全性fu。
[0183]
所有受试者都进入安全fu周期:
[0184]
对于进入延长研究的受试者,fu周期在研究药物的最后剂量后开始,并在研究药物最后剂量后14天-22天以安全性fu访视(fu1)结束,或在研究药物的最后剂量后23天-37天以简短fu2结束(如果在fu1处评估对特立氟胺加速消除程序的依从性不足)。
[0185]
对于未进入延长研究的受试者,安全fu周期在研究药物的最后剂量后持续30天,并且包括分别在研究药物的最后记录后14天-22天和30天-37天的两次安全fu访视(fu1,fu2)。
[0186]
治疗后观察周期(ptop):
[0187]
过早中止研究治疗的受试者进入ptop,该ptop持续直到随机化后108周(即,计划eot周期)。其包括最初安排的每12周访视时的简短评估时间表。
[0188]
研究结束(eos)
[0189]
当治疗、安全fu和ptop(如果适用的话)完成时,达到eos。
[0190]
对于完成108周治疗周期并进入延长研究的受试者,eos访视对应于最后研究药物剂量后14天-22天进行的fu访视(fu1)或对应于最后研究药物剂量后23天-37天进行的简短fu2访视(如果出于与特立氟胺加速消除程序的依从性原因而需要)。
[0191]
对于所有其他受试者,eos访视对应于30天fu访视(fu2)或对应于ptop的最后访视(即,ptop的第108周访视),以最后为准。
[0192]
研究治疗:
[0193]
治疗周期包括递增滴定周期(从第1天至第14天)和维持周期(第15天直到eot)。
[0194]
在研究的初始阶段期间,在递增滴定周期中的研究药物以双模拟方式施用。珀奈莫德(或匹配安慰剂)作为片剂呈现,而特立氟胺14mg(或匹配安慰剂)作为胶囊呈现(即,每天施用一个片剂和一个胶囊)。在稍后阶段,通过每天施用含有珀奈莫德或特立氟胺中任一者的一个胶囊来替换双模拟材料(片剂和胶囊)。
[0195]
在维持周期中,研究治疗包括每日施用含有珀奈莫德20mg或特立氟胺14mg的一个胶囊。
[0196]
为了减小珀奈莫德的第一剂量效应,从第1天到第14天实施递增滴定方案:
[0197]
第1天和第2天,2mg。
[0198]
第3天和第4天,3mg。
[0199]
第5天和第6天,4mg。
[0200]
第7天,5mg。
[0201]
第8天,6mg。
[0202]
第9天,7mg。
[0203]
第10天,8mg。
[0204]
第11天,9mg。
[0205]
第12天、第13天和第14天,10mg。
[0206]
第15天直到eot,20mg。
[0207]
用于功效的初级分析集:全分析集(fas)包括所有随机化受试者。根据治疗评价受试者,将其随机分配。
[0208]
主要功效变量/主要时间点:主要终点是直至研究结束时(eos)的年复发率(arr),定义为每受试者年确认的复发数量。包括直至eos的所有可用数据,无论是否中止治疗(itt方法)。
[0209]
次要功效变量和测试策略:按照图1中概述的统计测试策略分析四个次要功效终点。
[0210]-通过fsiq-rms患者报告的结果的症状域测量的疲劳相关症状从基线到第108周的变化[疲劳]
[0211]-脑mri上从基线到第108周的组合独特活动性病变的累积数量[cual]
[0212]-扩展残疾状态量表(edss)上从基线到eos的前12周确认残疾累积(cda)的时间[12周cda]
[0213]-edss上从基线到eos的前24周cda的时间[24周cda]
[0214]
有关测试策略的示意图,请参见图1。
[0215]
主要终点加幂为α=0.01。测试的次要终点的总体为α=0.05。
[0216]
研究的样品大小基于主要终点,并且假设用于所确认复发的数量的负二项式分布确定。在假设arr对于特立氟胺14mg为0.320并且对于珀奈莫德20mg为0.215(其对应于0.67的率比)且使用分散=0.9的情况下,1100个受试者的样本大小(每个治疗组550)对于1%的显著性水平将提供约90%的幂。第一年的年退出率为约15%,第二年的年退出率为约7.5%。
[0217]
统计方法
[0218]
全分析集(fas)包括所有随机化受试者。为了尽可能遵守意向治疗原则,根据受试者已被随机分配的治疗来评价受试者。
[0219]
按照协议集(pps)包括fas中包含的所有受试者,没有任何重大的协议偏差,影响主要/次要终点的评估,发生在随机化之前或随机化时。
[0220]
安全集(saf)包括接受至少一个剂量的研究治疗的所有随机化受试者。基于所采取的实际治疗来分析受试者,而不是随机化治疗。
[0221]
具有负二项分布的广义线性模型适合主要功效终点arr。双侧假设以模型参数μp20mg和μt14mg表示。主要的无效假设是珀奈莫德20mg与特立氟胺14mg之间的arr(μ)没有差异。
[0222]
无效假设通过负二项式回归模型中的双侧wald检验进行测试,双侧显著性水平对于决定性证据为0.01,而对于实证研究为0.05。与特立氟胺14mg相比,对于珀奈莫德20mg的
平均arr的相对减少计算双侧99%和95%wald置信区间。
[0223]
使用确认复发的负二项式模型对fas进行arr终点的主要统计分析,其中分层变量先前使用疾病改善治疗(dmt)和edss类别以及在进入研究之前的一年中复发的数量包括在研究的模型和时间中作为偏移变量。对pps进行灵敏度分析,并且该灵敏度分析还基于源自基线变量的不同亚组。
[0224]
如果对arr的初级分析导致以0.05的总体双侧显著性水平拒绝无效假设以支持珀奈莫德20mg,则测试次要功效终点。使用撤退方法测试与以下三个次要终点相关的假设系列:fsiq-rms从基线到第108周的绝对变化;cual从基线到第108周的累积数量;从基线直至eos的12周cda时间。随后以分层方式测试从基线直至eos的24周cda时间;在剩余的α处。
[0225]
使用fas群体分析终点。还使用pps群体分析所有次要终点。
[0226]
主要目标
[0227]
在减少患有rms的受试者的复发方面确定珀奈莫德是否比特立氟胺更有效。
[0228]
结果
[0229]
处置和基线特征:总共1133名受试者被随机分配到研究中,567名受试者接受珀奈莫德20mg,并且566名受试者接受特立氟胺14mg。整个治疗和研究中止在两个治疗组之间平衡,83%的受试者完成了治疗。平均年龄为36.7岁,并且64.9%的受试者是女性。大多数受试者在欧洲招募,其中50.6%来自eu国家。平均基线edss分数为2.6,并且平均疾病持续时间为7.6年。平均研究前12个月复发率为1.3,并且42.6%的受试者具有≥1钆增强(gd )t1病变。治疗组在人口统计学和基线疾病特征方面总体上是平衡的。
[0230]
1.受试者和治疗信息
[0231]
总共筛选了1468名患者。在那些受试者中,1133名受试者在28个国家的162个地点被随机分配(567名受试者被随机分配珀奈莫德20mg,并且566名受试者被随机分配特立氟胺14mg),1131名受试者接受至少一个剂量的研究药物。表1中概述了受试者的处置,并且表2中示出了治疗中止的原因(主要原因)的总结。整体治疗和研究中止在两个治疗组上均是平衡的。在珀奈莫德20mg和特立氟胺14mg中,分别总计6.5%和2.5%的受试者由于ae或耐受性相关原因而停药,而1.9%和4.3%的受试者由于功效相关原因而停药。研究期间报告了2例死亡-均使用特立氟胺14mg。
[0232]
1.1处置和治疗中止信息
[0233][0234]
[0235][0236]
1.2人口统计特征和基线特征
[0237]
通过以下各项对随机化进行分层:在随机化前的过去两年的先前dmt(是:39.5%;否:60.5%)和基线处的edss分数(≤3.5:83.3%;》3.5:16.7%)。平均年龄为36.7岁,并且大多数受试者(64.9%)为女性。大多数受试者在欧洲招募,其中50.6%来自eu国家。平均基线edss分数为2.6,平均疾病持续时间为7.6年,并且97.4%是rrms受试者。平均研究前12个月复发率为1.3,并且42.6%的受试者在脑mri上具有≥1种gd t1病变。治疗组在人口统计学和基线疾病特征方面总体上是平衡的(表3和表4)。
[0238][0239]
[0240][0241][0242]
1.3暴露程度
[0243]
平均治疗暴露(不考虑中止)在珀奈莫德20mg组中为96.7周,而在特立氟胺14mg组
中为97.5周。珀奈莫德20mg的累积暴露为1045名受试者-年,而对于特立氟胺14mg组为1057名受试者-年。
[0244][0245]
2.主要终点分析
[0246]
主要功效终点:与特立氟胺14mg相比,珀奈莫德20mg在统计学上显著降低直至eos的arr(确认的复发)30.5%(对于珀奈莫德20mg,arr=0.202;而对于特立氟胺14mg,arr=0.290,比率比:0.695[99%cl:0.536:0.902],p=0.0003)。主要终点结果是稳健的,所有灵敏度和补充分析都与初级分析一致。
[0247]
复发被定义为在前次复发发作后至少30天出现的新的、恶化的或复发的神经学症状,并且在没有发热或感染的情况下持续至少24小时。
[0248]
由治疗神经科医师评价新的、恶化的或复发的神经学症状,如果上述定义的所有要素均得到验证,并且在不存在对受试者症状的另一更好解释的情况下,该事件被认为是复发。复发的发作日期对应于症状的发作日期。
[0249]
只有当受试者的症状伴随与受试者的症状一致的edss/fs(功能系统)评分增加时,治疗神经科医师才确认复发,该评分来自先前临床稳定的edss/fs评估(即,在任何先前复发发作后至少30天进行),由功效评估者获得并且与以下一致:
[0250]-增加至少一半步长(0.5分;除非edss=0,否则需要增加至少1.0分),或者
[0251]-至少两个fs评分中增加至少1.0分,或者
[0252]-至少一个fs评分中增加至少2.0分(不包括膀胱/肠和大脑)。
[0253]
使用确认复发的负二项式回归模型对fas进行初级统计分析直至eos,其中治疗作为因素,并且二进制分层变量(edss≤3.5与edss》3.5;在随机化之前过去2年内的dmt[是/否])和进入研究之前一年中的复发数量(类别≤1(或缺失)和≥2)包括在模型中。模型还包括偏移变量,其被定义为从随机化直至eos的研究时间日志(以年为单位)。
[0254]
与特立氟胺14mg相比,珀奈莫德20mg在统计学上显著降低直至eos的arr(确认的复发)30.5%(对于珀奈莫德20mg,arr=0.202;而对于特立氟胺14mg,arr=0.290,比率比:0.695[99%cl:0.536:0.902],p=0.0003)。
validation of the fsiq-rms:a new patient-reported questionnaire to assess symptoms and impacts of fatigue in relapsing multiple sclerosis,value health,2019年4月,第22卷,第4期,第453-466页,doi:10.1016/j.jval.2018.11.007,epub 2019年2月21日,pubmed pmid:30975397。通过7个症状项和13个影响项(在3个影响子域中:身体、认知和情绪、以及应对),fsiq-rms是rms患者中疲劳相关症状和影响的全面、有效和可靠的量度。
[0265]
fsiq-rms症状域(fsiq-rms-s)由七项组成,评估疲劳相关症状,回忆期为24小时,在11分数字评级量表上测量;标准化症状域评分在0至100的范围内,其中较高的分数指示较大的疲劳。该域(即,问卷的第1部分)在连续7天完成。
[0266]
fsiq-rms影响域(fsiq-rms-i)由13项组成,评估疲劳相关症状的影响,回忆期为7天,在5分语言描述符量表上测量,范围从无影响到极大影响;影响域评分在0至100的范围内,其中较高的分数指示较大的影响。由于fsiq-rms的影响域(即,问卷的第2部分)具有7天的回忆期,因此在完成第1部分的最后一天(即,第七天)完成。
[0267]
fsiq-rms在随机化前周期期间,在第6次、第7次、第10次和第12次访视(第12周、第24周、第60周、第84周)、和第14次访视(eot),以及在由于复发的事先未安排访视(r1、r2等)或如下所述的其他事先未安排访视(u1、u2等)时完成。如果适用,在ptop中的对应访视时执行fsiq-rms。
[0268]
随机化前周期期间fsiq-rms的完成如下:在第1次访视(筛选)时,向根据本次访视期间(但在接收到实验室评估结果之前)所做的评估看来符合条件的受试者提供了包含fsiq-rms的电子设备。
[0269]
一旦实验室评估的结果确认了受试者的合格性,并且在此期间没有进行其他评估排除受试者,现场协调员就联系并要求受试者开始完成fsiq-rms。在家中,受试者在7天内完成了fsiq-rms的症状域(即,问卷的第1部分)。在第七天,受试者完成了fsiq-rms的影响域(即,问卷的第2部分)。从该评估捕获的信息用作fsiq-rms的基线数据。理想地,fsiq-rms在随机化前的连续7天内完成。
[0270]
随机化后,受试者在家中每天完成fsiq-rms的症状域(即,问卷的第1部分),从访视当天晚上开始,即在施用fsiq-rms时(问卷管理周期的第1天)和随后的6天期间(即总共超过7天)。受试者在下一次安排的访视时返回完成的fsiq-rms日记。在第七天,受试者完成了fsiq-rms的影响域(即,问卷的第2部分)。如果适用,在ptop结束时,fsiq-rms在第14a次访视(第108周)之前完成,理想地,在访视之前连续7天期间完成。
[0271]
在fsiq-rms的症状域中从基线至第108周变化的次要终点的结果(在7天周期内评估)已显示出珀奈莫德20mg优于特立氟胺14mg的优效性。
[0272]
3.2mri-从基线到第108周的组合独特活动性病变(cual)。
[0273]
cual是新的gd t1病变,加上新的或扩大的t2病变(不对病变进行重复计数)。
[0274]
cual的累积数量被认为是炎性ms疾病活动度的可靠结果量度。疾病活动度的放射学证据通常用于支持疾病诊断并以无疾病活动度证据(neda)、临床(复发或残疾累积)或放射学(mri上的脑损伤)视角为目标告知治疗决策。参见lublin fd,disease activity free status in ms,mult scler relat disord,2012年1月,第1卷,第1期,第6-7页,doi:10.1016/j.msard.2011.08.001,epub2011年8月27日,pubmed pmid:25876444。
sclerosis,2015年3月26日,ema/chmp/771815/2011,第2版,committee for medicinal products for human use(chmp)。在temso和tower研究中,特立氟胺14mg显示出12周cdp风险的统计学显著降低。参见o'connor p等人,n engl j med.2011年,第365卷,第1293-30页;confavreux c等人,tower trial group,oral teriflunomide for patients with relapsing multiple sclerosis(tower):a randomised,double-blind,placebo-controlled,phase 3trial,lancet neurol,2014年3月,第13卷,第3期,第247-256页,doi:10.1016/s1474-4422(13)70308-9。epub 2014年1月23日。pubmed pmid:24461574。
[0284]
12周cda是基线edss分数为0.0的受试者的edss增加至少1.5,或基线edss分数为1.0至5.0的受试者的edss增加至少1.0,或基线edss分数≥5.5的受试者的edss增加至少0.5,这将在12周后得到证实。
[0285]
基线edss被定义为随机化之前记录的最后edss分数。满足上述标准的初始edss增加被定义为残疾累积的开始。
[0286]
所有edss测量(有或没有复发,在安排或事先未安排访视时)用于确定残疾累积的开始。然而,在任何正在进行的复发之外的安排访视(即,事先未安排访视不能用作确认性访视)时获得用于确认残疾累积的edss分数。在该上下文中,复发持续时间定义为开始日期和结束日期之间的周期(如果可用的话),并且如果结束日期不可用或持续时间长于90天,则限制为自开始起90天。
[0287]
为了确认edss增加是持续的,在开始和12周edss确认(减去7天访视时间窗)之间的所有edss测量需要显示edss增加,满足如上定义的残疾累积标准。
[0288]
在珀奈莫德20mg和特立氟胺14mg组中,分别在10.1%和12.4%的受试者中观察到12周的cda,直至eos。与特立氟胺14mg相比,对于珀奈莫德20mg,未发现12周cda的风险在统计学上显著不同(风险比:0.83[95%cl,0.58比1.18];对数秩:p=0.2939)。因此,停止正式测试程序。参见表a3;还参见图4。
[0289]
[0290]
3.4 edss-前24周确认残疾累积(cda)的时间
[0291]
24周cda未进行正式测试,仅以探索性方式进行评价。在珀奈莫德20mg和特立氟胺14mg组中,分别在8.1%和9.9%的受试者中观察到24周的cda,直至eos。与特立氟胺14mg相比,对于珀奈莫德20mg,未发现24周cda的风险在标称α=0.05下在统计学上显著不同(风险比:0.84[95%cl,0.57比1.24];对数秩:p=0.3720)。参见图5。
[0292]
24周cda是基线edss分数为0.0的受试者的edss增加至少1.5,或基线edss分数为1.0至5.0的受试者的edss增加至少1.0,或基线edss分数≥5.5的受试者的edss增加至少0.5,这将在24周后得到证实。
[0293]
基线edss被定义为随机化之前记录的最后edss分数。满足上述标准的初始edss增加被定义为残疾累积的开始。
[0294]
所有edss测量(有或没有复发,在安排或事先未安排访视时)用于确定残疾累积的开始。然而,在任何正在进行的复发之外的安排访视(即,事先未安排访视不能用作确认性访视)时获得用于确认残疾累积的edss分数。在该上下文中,复发持续时间定义为开始日期和结束日期之间的周期(如果可用的话),并且如果结束日期不可用或持续时间长于90天,则限制为自开始起90天。
[0295]
为了确认edss增加是持续的,在开始和24周edss确认(减去7天访视时间窗)之间的所有edss测量需要显示edss增加,满足如上定义的残疾累积标准。
[0296]
在该研究中,与特立氟胺14mg相比,珀奈莫德20mg将12周和24周cda的风险分别降低17%和16%,然而该差异没有达到统计学显著性。该研究对于12周或24周的cda没有加幂,因此结果在统计学上不一定会有差异。
[0297]
4.安全性
[0298]
4.1所有不良事件的总结
[0299]
治疗期ae(teae)的概述呈现于表8中。
[0300][0301]
总体而言,在两个治疗组中经历至少一种teae的受试者的比例是相似的(分别为珀奈莫德20mg和特立氟胺14mg组中88.8%和88.2%受试者)。
[0302]
珀奈莫德20mg组中的最常见的teae是alt增加(19.5%)、鼻咽炎(19.3%)、头痛(11.5%)和上呼吸道感染(10.6%)。珀奈莫德20mg组中最常见的teae是alt增加(19.5%与
特立氟胺组中的9.4%),鼻咽炎(19.3%与16.8%),头痛(11.5%与12.7%)和上呼吸道感染(10.6%与10.4%)。
[0303]
与6.0%的特立氟胺14mg受试者相比,8.7%的珀奈莫德20mg受试者中报告了导致过早治疗中止的teae[参见表9]。虽然事件数量较低,但导致治疗中止的ae类型差异主要是由对呼吸系统和黄斑水肿的预期类别作用驱动的。研究中没有感染导致永久性研究治疗中止。
[0304][0305]
研究报告了两例死亡,一例因冠状动脉功能不全,一例因多发性硬化症。两例死亡均发生在接受特立氟胺14mg的受试者中。
[0306]
在两个治疗组中经历至少一种sae的受试者的比例是相似的(分别为珀奈莫德20mg和特立氟胺14mg组中8.7%和8.1%受试者)。
[0307]
表10中呈现了解决珀奈莫德的预期风险的特别感兴趣的ae(aesi)的概述。最常见的aesi被报告为肝胆病症/肝酶异常类别(在珀奈莫德20mg相比于特立氟胺14mg中分别为25.7%与14.5%),其次是高血压类别(10.1%与9.0%)和肺事件(8.0%与2.7%)。
[0308][0309]
与特立氟胺(8.3%)相比,经历alt增加》3xuln的受试者的比例在珀奈莫德组中较高(17.3%),而与珀奈莫德(0.7%)相比,经历alt增加》8xuln的受试者在特立氟胺组中较高(2.1%)。根据个案审查,大部分alt/ast增加≥3xuln是作为单次短暂无症状事件发生的,通过继续治疗或在协议强制治疗中止后解决。除了一例胆红素增加≥2xuln外,其他所有病例均发生在治疗前胆红素增加的患者中。一例潜在hy定律发生在先前存在转氨酶升高(alt》5xuln)的受试者中,并且该事件在治疗中止后2周内完全解决。
[0310]
在第1天治疗期心率和节律(包括低血压)aesi的发生率在珀奈莫德20mg组(2.1%)中比在特立氟胺14mg组(0.4%)中更高。参见表10a。然而,在珀奈莫德中第1天的第一剂量aesi的总体发生率低(2.1%)。这些事件都不是严重的,也没有导致研究治疗的永久终止。对于大约99%的受试者,满足给药后4小时的出院标准。未观察到2度或更高程度的av阻滞。ecg hr效应:给药后2小时的最低点(西尼莫德-3-4小时,芬戈莫德-约6小时)。低hr异常值的发生率低(给药后hr≤40bpm),所有3例患者的治疗前hr《55bpm,这是已知的s1p受体调节剂给药后心动过缓的危险因素。
[0311]
在给药后2小时,与给药前相比,平均心率降低对于珀奈莫德20mg达到最大值,-8.7bpm,相比之下对于特立氟胺14mg为-1.7bpm(图6)。在珀奈莫德20mg组中有3名受试者在给药后无症状hr≤40bpm(特立氟胺14mg中没有);所有这些受试者的治疗前hr《55bpm,这将需要根据西尼莫德[uspi]的管理优先级进行给药后监测。
[0312][0313]
实施例1a:fsiq-rms和身体、认知和应对影响
[0314]
fsiq-rms的身体,认知/情绪和应对影响子域从基线到第108周的变化分别在图9、图10和图11中示出。
[0315]
图9、图10和图11示出了基于全分析集,对于珀奈莫德20mg治疗组和特立氟胺14mg治疗组在组水平的fsiq-rms身体、认知/情绪和应对影响子域。
[0316]
实施例1b:从基线到第108周的变化-基线疲劳低于中值
[0317]
基线疲劳低于中值的患者的fsiq-rms每周症状评分从基线到第108周的平均变化在图12中示出。变化的累积分布函数在图13中示出。结果汇总于下表11a中。基线疲劳(即,基线处的每周症状评分)提供在表11b中,并用于本实施例中低于中位数的基线疲劳和实施例1c中高于中位数的基线疲劳。
[0318]
与在108周内使用特立氟胺%的约55%相比,在108周内使用珀奈莫德的几乎65%的低基线疲劳患者保持稳定或改善。
[0319]
表11a.从基线到第108周的变化,基线疲劳低于珀奈莫德和特立氟胺的中值
[0320][0321]
表11b.基线疲劳(基线处fsiq的症状评分)。
[0322][0323][0324]
实施例1c:从基线到第108周的变化-基线疲劳高于中值
[0325]
基线疲劳高于中值的患者的fsiq-rms每周症状评分从基线到第108周的平均变化在图14中示出。变化的累积分布函数在图15中示出。
[0326]
实施例1d:从基线到第108周的变化-无先前dmt治疗的患者
[0327]
在开始治疗之前在约两年内没有先前dmt治疗的患者的fsiq-rms每周症状评分从基线到第108周的平均变化在图16中示出。变化的累积分布函数在图17中示出。结果汇总于下表12中。
[0328]
患者改善在31.4%的使用珀奈莫德的患者中有临床意义(p=0.052),并且约75%的使用珀奈莫德的患者在第108周保持稳定或改善(p=0.003)。
[0329]
表12:没有先前的珀奈莫德和特立氟胺的dmt治疗的患者从基线到第108周的变化
[0330][0331]
实施例1e:在基线处没有gd t1病变的患者从基线到第108周的变化
[0332]
在基线处没有gd t1病变的患者的fsiq-rms每周症状评分的变化从基线到第108周的平均变化在图18中示出。变化的累积分布函数在图19中示出。结果汇总于下表13中。
[0333]
在没有基线gd t1病变的情况下,具有稳定或改善的疲劳症状的患者表现出珀奈莫德与特立氟胺的统计学显著差异,对于珀奈莫德为约68%,对于特立氟胺为约57%(p=0.021)。
[0334]
表13.在基线处没有gd t1病变的患者从基线到第108周的变化
[0335][0336]
实施例1f:在基线处有gd t1病变的患者从基线到第108周的变化
[0337]
在基线处具有gd t1病变的患者的fsiq-rms每周症状评分的变化从基线到第108周的平均变化在图20中示出。变化的累积分布函数在图21中示出。
[0338]
实施例1g:从基线到第108周的变化-基线edss≤3.5
[0339]
具有较低基线edss的患者的fsiq-rms每周症状评分的变化从基线到第108周的平均变化在图22中示出。变化的累积分布函数在图23中示出。结果汇总于下表14中。
[0340]
表14.具有≤3.5的基线edss的患者从基线到第108周的变化
[0341][0342]
实施例1h:从基线到第108周的变化-在基线处具有一次或更少先前复发的患者
[0343]
在基线处具有一次或更少先前复发的患者的fsiq-rms每周症状评分的变化从基线到第108周的平均变化在图24中示出。变化的累积分布函数在图25中示出。
[0344]
实例1i:从基线到第108周的变化-在基线处具有两次或更多先前复发的患者
[0345]
在基线处具有两次或更多先前复发的患者的fsiq-rms每周症状评分的变化从基线到第108周的平均变化在图26中示出。变化的累积分布函数在图27中示出。
[0346]
实施例2:预先指定的mri终点和无疾病活动度证据(neda)状态。
[0347]
在该研究中,评估了预先指定的基于mri的终点,并且无疾病活动度证据(neda)状态。
[0348]
患有rms(扩展残疾状态量表分数:0-5.5)的患者(18岁-55岁)随机(1:1)接受珀奈莫德(pon)20mg或特立氟胺(ter)14mg持续108周。mri评估为:t2病变的体积;新的钆增强(gd )t1病变和新的/扩大t2病变的平均数量;以及在第108周不存在活动性mri病变。从基线到第108周评估neda-3状态(不存在确认复发、年度mri上的gd t1病变和新的/扩大t2病变、以及12周确认残疾累积)。
[0349]
总共985/1133(86.9%)随机化患者完成了研究。从基线到第108周对于pon与ter的mri发现分别为:t2病变总体积从基线的变化的最小二乘方(ls)平均差(pon-ter):-399.2mm3(95%cl:-651.5;-146.8,p=0.002);每个扫描的新gd t1病变的平均数量:0.18与0.43(率比[rr]:0.42,95%cl:0.31;0.56,p《0.0001);每年的新的/扩大t2病变的平均数量:1.40与3.16(rr:0.44,95%cl:0.36;0.54,p《0.0001);pon与ter优势比(or[95%cl]),对于不存在新的gd t1病变:2.18(1.61;2.95,p《0.0001)以及不存在新的/扩大t2病变:1.71(1.30;2.25,p=0.0001)。在第108周,28.2%(159/564)pon与18.3%(102/558)ter患者or:1.70,cl:1.27;2.28,p=0.0004)实现neda-3。第108周未实现neda-3状态的最常见原因是存在新的/扩大t2病变。
[0350]
与用特立氟胺治疗的那些患者相比,用珀奈莫德治疗的患者表现出更高比例的实现neda-3状态的患者。
[0351]
结论
[0352]
该研究证明了珀奈莫德优于活性对照的优异功效。该研究是第一项研究,其显示了在预定义的次要终点(疾病特异性验证的pro)中对疲劳症状的统计学显著作用,以关键的未满足的需求为目标。
[0353]
该研究还证明,珀奈莫德的安全性特征似乎与先前观察到的珀奈莫德的安全性发现和其他s1p受体调节剂的已知安全性特征一致。逐渐递增滴定似乎成功地减轻了珀奈莫德的第一剂量效应,并且支持对没有症状性心动过缓风险因素的患者放弃首剂量监测。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。