1.本发明涉及使用dna(例如,质粒和辅助噬菌体、或具有染色体整合的辅助噬菌体基因的质粒)的噬菌体和包含噬菌体蛋白的转导颗粒的生产,以及噬菌体、辅助噬菌体、试剂盒、组合物和涉及这些的方法。颗粒可特别用于将有毒的有效载荷递送到靶细菌内用于抗菌作用。实施方案使得能够生产此类颗粒的高纯度组合物用于医学或环境用途以及用于遏制颗粒,其可以用于遏制抗菌作用、控制给药或降低获得不期望的外源基因的风险。
背景技术:
2.辅助噬菌体将噬菌粒dna包装到噬菌体病毒颗粒内的用途是已知的。一个实例是用于大肠杆菌(e coli)宿主细胞中的m13ko7辅助噬菌体(一种m13的衍生物)。其它实例是r408和cm13。
技术实现要素:
3.本发明涉及噬菌体和转导颗粒的生产,并且提供了:在第一配置中包含以下的试剂盒a)第一dna;和b)一种或多种第二dna;其中(i)dna一起包含产生包装的噬菌体颗粒所需的所有噬菌体结构蛋白基因,所述包装的噬菌体颗粒包含第一dna的拷贝;(ii)第一dna不包含所述基因或包含至少一种但并非全部所述基因;并且其中一种或多种第二dna包含所述基因的剩余部分;(iii)第一dna包含用于产生包装的噬菌体颗粒的噬菌体包装信号;和(iv)第二dna缺乏将第二dna包装到噬菌体颗粒内所需的核苷酸序列(例如,包装信号);其中当共存于用于产生包含第一dna的包装噬菌体的宿主细菌中时,所述dna是可操作的,其中所述噬菌体需要第二dna用于其复制,以产生进一步的噬菌体颗粒。
4.还提供了产生噬菌体的方法,所述方法包括在包含dna的细胞中表达噬菌体蛋白基因,其中产生了包含第一dna的包装噬菌体,其中所述噬菌体需要第二dna用于其复制,以产生进一步的噬菌体颗粒。
5.在第二配置中辅助噬菌体群体,其中所述辅助噬菌体能够包装第一噬菌体,其中所述第一噬菌体不同于辅助噬菌体,并且所述辅助噬菌体不能自我复制。
6.在第三配置中
包含第一噬菌体群体的组合物,其中所述第一噬菌体需要根据第一配置的辅助噬菌体用于复制;并且其中由所述组合物包含的少于[20%]的总噬菌体是此类辅助噬菌体。
[0007]
在第四配置中产生第一噬菌体的方法,其中所述第一噬菌体需要辅助噬菌体以复制,所述方法包括(a)提供包含包装信号的dna;(b)将dna引入宿主细菌细胞内;(c)其中所述宿主细菌细胞包含辅助噬菌体,或者其中所述辅助噬菌体与步骤(b)同时或序贯地引入细菌细胞内;(d)其中所述辅助噬菌体是根据本发明的;(e)引起或允许辅助噬菌体产生噬菌体蛋白,其中所述包装信号在宿主细胞中被识别,由此使用蛋白质产生第一噬菌体,所述第一噬菌体包装dna;(f)其中所述宿主细胞中的辅助噬菌体复制被抑制或降低,从而限制了辅助噬菌体的可用性;(g)任选地裂解宿主细胞并获得第一噬菌体;(h)从而产生包含第一噬菌体的组合物,所述第一噬菌体需要辅助噬菌体用于复制,其中通过限制辅助噬菌体的可用性来防止或降低第一噬菌体的繁殖。
[0008]
在第五配置中一种噬菌体产生系统,其用于产生包含目标核苷酸序列的噬菌体(例如,前述权利要求任何的第一噬菌体)(nsi噬菌体),所述系统包含组分(i)至(iii):(i)第一dna;(ii)第二dna;和(iii)nsi噬菌体产生因子(npf)或编码npf的可表达核苷酸序列;其中a)第一dna编码辅助噬菌体(例如,前述权利要求任一项中的所述第一辅助噬菌体);b)第二dna包含目标核苷酸序列(nsi);c)当该系统由细菌宿主细胞包含时,辅助噬菌体蛋白由第一dna表达以形成噬菌体,所述噬菌体在npf的存在下包装第二dna,从而产生nsi噬菌体;d)该系统缺乏形成包装第一dna的噬菌体所需的辅助噬菌体产生因子(hpf),或缺乏编码功能性hpf的可表达核苷酸序列;或者该系统包括包含或编码功能性hpf的核苷酸序列,该系统进一步包含用于在宿主细胞中靶向灭活hpf序列的手段,以消除或最小化包含第一dna的辅助噬菌体的产生;和由此该系统能够生产包含nsi噬菌体群体的产物,其中每个nsi噬菌体需要所述辅助噬菌体用于繁殖,其中所述产物中的nsi噬菌体不与辅助噬菌体混合,或由所述产物包含的少于[20%]的总噬菌体是所述辅助噬菌体。
[0009]
本发明还提供了:用于细菌的抗菌处理中的组合物,所述组合物包含改造的可移动遗传元件(mge),其能够在第一物种或菌株的第一细菌宿主细胞中动员,所述细胞包含第一噬菌体基因组,
其中在所述细胞中使用由噬菌体编码的蛋白质动员mge,并且抑制第一的复制,其中所述mge编码抗菌剂或编码此类试剂的组分。
[0010]
包含在其中整合的mge的核酸载体,其中所述载体能够将mge或其拷贝转移到宿主细菌细胞内。
[0011]
非自我复制的转导颗粒,其包含本发明的所述mge或载体。
[0012]
包含多个转导颗粒的组合物,其中每个颗粒包含根据本发明的mge或载体,其中所述转导颗粒能够将mge、或者编码试剂或组分的核酸或其拷贝转移到靶细菌细胞内,其中(i)靶细胞被抗菌剂杀死;(ii)靶细胞的生长或增殖降低;或(iii)使靶细胞对抗生素敏感,由此所述抗生素对细胞是有毒的。
[0013]
包含多种非自我复制的转导颗粒的组合物,其中每个颗粒包含根据本发明的mge或质粒,其中所述转导颗粒能够将mge、或者编码试剂或组分的核酸或其拷贝转移到靶细菌细胞内,其中所述试剂是crispr/cas系统,并且所述组分包含编码crrna或指导rna的核酸,所述核酸可与靶细菌细胞中的cas一起工作,以将cas引导至细胞的靶核酸序列以修饰序列,由此(i)靶细胞被抗菌剂杀死;(ii)靶细胞的生长或增殖降低;或(iii)使靶细胞对抗生素敏感,由此所述抗生素对细胞是有毒的。
[0014]
产生多个转导颗粒的方法,所述方法包括将本发明的组合物与所述第一物种的宿主细菌细胞组合,其中所述细胞包含第一噬菌体,允许将多个所述mge引入宿主细胞内,并且在其中表达第一噬菌体编码的蛋白质,并且通过第一噬菌体蛋白包装mge拷贝的条件下,培养宿主细胞以产生多个转导颗粒,并且任选地将转导颗粒与细胞分开,并获得与细胞分开的多个转导颗粒。
[0015]
细菌宿主细胞,其包含第一噬菌体和本发明的mge、载体或颗粒,其中所述试剂对与宿主细胞相同物种的细胞是有毒的,并且其中所述宿主细胞已进行改造,使得所述试剂对宿主细胞是无毒的。
[0016]
包含第一噬菌体的细菌宿主细胞,其中所述细胞由试剂盒包含,所述试剂盒进一步包含本发明的组合物,其中所述试剂对与宿主细胞相同物种的细胞是有毒的,并且其中所述宿主细胞已进行改造,使得所述试剂对宿主细胞是无毒的。
[0017]
细菌宿主细胞,其包含第一噬菌体和本发明的mge、载体或颗粒,其中所述试剂对宿主细胞是无毒的,但所述试剂对与宿主细胞的物种或菌株不同的物种或菌株的第二细胞是有毒的,其中所述mge在可由宿主细胞产生的转导颗粒中是可动员的,所述转导颗粒能够将mge或其拷贝转移到所述第二细胞内,由此使所述第二细胞暴露于抗菌剂。
[0018]
包含第一噬菌体的细菌宿主细胞,其中所述细胞由试剂盒包含,所述试剂盒进一步包含本发明的组合物,其中所述试剂对宿主细胞是无毒的,但所述试剂对与宿主细胞的物种或菌株不同的物种或菌株的第二细胞是有毒的,其中所述mge在可由宿主细胞产生的转导颗粒中是可动员的,所述转导颗粒能够将mge或其拷贝转移到所述第二细胞内,由此使所述第二细胞暴露于抗菌剂。
[0019]
细菌宿主细胞,其包含本发明的mge、载体或颗粒以及在一个或多个诱导型启动子
的控制下的核酸,其中所述核酸编码产生转导颗粒所需的所有结构蛋白,所述转导颗粒包装mge或质粒的拷贝,其中所述试剂对宿主细胞是无毒的,但所述试剂对与宿主细胞的物种或菌株不同的物种或菌株的第二细胞是有毒的,其中所述mge在可由宿主细胞产生的转导颗粒中是可动员的,所述转导颗粒能够将mge或其拷贝转移到所述第二细胞内,由此使所述第二细胞暴露于抗菌剂。
[0020]
质粒,其包含(a)编码用于在靶细菌细胞中表达的抗菌剂或其组分的核苷酸序列;(b)用于控制试剂或组分表达的组成型启动子;(c)任选的ters核苷酸序列;(d)复制起点(ori);和(e)噬菌体包装序列(任选地pac、cos或其同源物);和该质粒缺乏(f)编码对于产生转导颗粒(任选地噬菌体)所需的噬菌体结构蛋白的所有核苷酸序列,或质粒缺乏至少一种此类序列;和(g)任选地terl。
[0021]
细菌宿主细胞,其包含不能自我复制的辅助噬菌体的基因组,任选地其中所述基因组作为原噬菌体存在,以及根据本发明的质粒,其中所述辅助噬菌体可操作以在转导颗粒中包装质粒的拷贝,其中所述颗粒能够感染抗菌剂对其有毒的细菌靶细胞。
[0022]
制备多个转导颗粒的方法,所述方法包括培养根据本发明的多种宿主细胞,任选地诱导辅助噬菌体的裂解周期,并且在其中产生包含质粒的包装拷贝的转导颗粒的条件下温育细胞,并且任选地从细胞中分离颗粒,以获得多个转导颗粒。
[0023]
可通过本发明的方法获得的多个转导颗粒,其用于医学中,例如用于治疗或预防人或动物受试者被靶细菌细胞感染,其中将转导颗粒施用于受试者,用于感染靶细胞并使用抗菌剂杀死细胞。
[0024]
制备多个转导颗粒的方法,所述方法包括(a)产生宿主细胞,其基因组包含编码产生转导颗粒所需的结构蛋白的核酸,所述转导颗粒可以包装第一dna,其中所述基因组缺乏噬菌体包装信号,其中所述蛋白质的表达处于诱导型启动子的控制下;(b)产生编码抗菌剂或其组分的第一dna,其中所述dna包含噬菌体包装信号;(c)将dna引入宿主细胞内;(d)诱导宿主细胞中结构蛋白的产生,由此产生包装dna的转导颗粒;(e)任选地分离多个转导颗粒;和(f)任选地将颗粒配制成药物组合物,用于施用于人或动物用于医学用途。
[0025]
通过该方法可获得的多个转导颗粒。
[0026]
一种宿主细菌细胞,包括a)第一dna;和b)一种或多种第二dna;其中(i)dna一起包含产生转导颗粒所需的所有基因,该转导颗粒包含由噬菌体结构蛋
白包装的第一dna的拷贝;(ii)第一dna缺乏产生所述颗粒所需的至少一个功能性必需基因(例如,编码噬菌体结构蛋白);并且其中所述一种或多种第二dna包含所述功能性必需基因;(iii)所述第一dna包含用于产生所述颗粒的噬菌体包装信号;和(iv)第二dna缺乏将第二dna包装到转导颗粒内所需的核苷酸序列;其中需要第二dna来包装第一dna以产生颗粒,其中dna在细胞中可操作以产生包含噬菌体结构蛋白的转导颗粒,所述噬菌体结构蛋白包装第一dna的拷贝。
附图说明
[0027]
图1:具有加上方框的非必需基因的p2基因组的遗传图;图2:sapibov1的示意图;图3:(a)p2和p4的图
ꢀ–ꢀ
噬菌体p2和卫星噬菌体p4的基因组体系结构和调节网络;p2中的加上灰色方框的区域被缺失,并且替换为卡那霉素标记物序列,并且以虚线所示的方框显示了包括cos位点的p4区域,所述cos位点包括在cgv中;(b)p94基因组图;图4:sa100生产菌株的示意性视图
ꢀ–ꢀ
缺陷型辅助噬菌体仅在诱导后开启噬菌体生产;由于噬菌体包装的dna序列已从辅助物中取出并置于cgv
™
上,因此仅cgv
™
分子被包装到合成噬菌体颗粒内;图5:感染效率
ꢀ–ꢀ
随着sa100颗粒与emg-2的比率(moi)增加的感染的emg-2细胞的百分比;图6:通过sa100的cgv
™
递送
ꢀ–ꢀ
在用含有p114或p94的sa100感染mg1655_pks细胞(a)、或用含有p114的sa100感染x1-blue_pks细胞(b)后的总cfu和含有cgv
™
的cfu;图7:与未感染的对照相比,使用野生型和优化拷贝数的cgv
™
,通过sa100递送的cgv
™
的靶细胞杀死
ꢀ–ꢀ
通过sa100递送的cgv
™
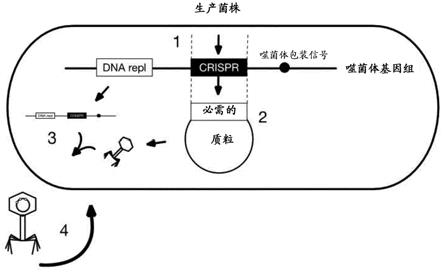
的两种靶菌株的杀死效率(第2条、第4条和第6条);图8:标绘的是以每5毫升粪便样品(n=15)的菌落形成单位(cfu)表示的丰度。显示了两组,crispr诱导的和非诱导的。当在含有链霉素的琼脂平板上测定cfu时,两组之间没有观察到差异;和图9:标绘的是以每5毫升粪便样品(n=15)的菌落形成单位(cfu)表示的丰度。显示了两组,crispr诱导的和非诱导的。使用斯氏t检验计算统计差异,显示了在补充有壮观霉素和链霉素的琼脂板上,在crispr非诱导组中,在48小时后丰度中的统计学显著增加(p值=0.011)。这显示了cgv(含有壮观霉素标记物)可以通过非自我复制颗粒sa100来递送;图10:1.将crispr系统插入包含至少包装信号和dna复制模块的噬菌体基因组,从而产生载体,例如质粒(我们称为crispr guided vector
™
,cgv);crispr系统可以包含编码cas(例如,cas3或cas9)的核酸和/或一种或多种crrna或grna,当cas是cas3时任选地还包括级联蛋白;2.必需基因在噬菌体中被去除或突变,并且功能由来自质粒的反式表达提供(或者这可能替代地来自整合在宿主细菌细胞(又名生产菌株)染色体中的必需基因);3.cgv复制和在cgv上编码的功能编码的噬菌体样转导颗粒中包装,但至少一种必
需功能从质粒或染色体反式表达;和4.生产菌株上通过繁殖周期生产。有利地防止了在其他细菌菌株上的繁殖。
具体实施方式
[0028]
本发明涉及使用dna(例如,具有辅助噬菌体的质粒)的噬菌体生产,以及噬菌体、辅助噬菌体、组合物和涉及这些的方法。本发明可用于例如遏制在离体和体内环境中的噬菌体,降低通过噬菌体获得抗生素抗性或其它基因的风险,以及控制环境中的噬菌体给药。在实例中,也可以限制或消除有用噬菌体群体被辅助噬菌体的污染,从而控制噬菌体繁殖并增强噬菌体组合物中的所需噬菌体的比例,所述噬菌体组合物例如药剂、除草剂和其中可以有用地使用噬菌体的其它试剂。因此,本发明提供了下述实施方案。
[0029]
试剂盒,其包含以下:a)第一dna;和b)一种或多种第二dna;其中(i)dna一起包含产生包装的噬菌体颗粒或转导颗粒所需的所有噬菌体结构蛋白基因,所述包装的噬菌体颗粒或转导颗粒包含第一dna的拷贝;(ii)第一dna不包含所述基因或包含至少一种但并非全部所述基因;并且其中一种或多种第二dna包含所述基因的剩余部分;(iii)第一dna包含用于产生包装的噬菌体颗粒的噬菌体包装信号;和(iv)第二dna缺乏将第二dna包装到噬菌体颗粒内所需的核苷酸序列;其中当共存于用于产生包含第一dna的包装噬菌体的宿主细菌中时,所述dna是可操作的,其中所述噬菌体需要第二dna用于其复制,以产生进一步的噬菌体颗粒。
[0030]
例如,第二dna缺乏用于包装第二dna的包装信号。另外地或可替代地,第二dna缺乏辅助噬菌体复制所需的核苷酸序列。任选地,当第二dna由辅助原噬菌体包含时,核苷酸序列编码σ因子,或者包含σ因子识别位点、dna聚合识别位点、或辅助噬菌体dna复制所需的基因的启动子。
[0031]
在一个实例中,第二dna由m13或基于m13的辅助噬菌体包含。m13编码噬菌体包装所需的下述蛋白质:-a) piii:宿主识别b) pv:外壳蛋白c) pvii、pviii、pix:膜蛋白d) pi、piv、pxi:用于将噬菌体易位到细胞外空间的通道。
[0032]
在这个实例中,第二dna缺乏编码这些蛋白质的一种或多种基因,例如,缺乏编码piii的基因、编码pv的基因、编码pvii的基因、编码pviii的基因、编码pix的基因、编码pi的基因、编码piv的基因和/或编码xi的基因。
[0033]
在一个实施方案中,(i)的噬菌体颗粒能够感染靶细菌,所述噬菌体包含目标核苷酸序列(nsi),其能够在靶细菌中表达蛋白质或rna,或者其中所述nsi包含可在靶细菌中工作的调节元件。在一个实例中,nsi能够与靶细胞染色体或由靶细胞包含的附加体重组,以修饰染色体或附加体。任选地,这在方法中进行,其中(例如,使用指导核酸酶,例如cas、
talen、锌指或大范围核酸酶;或限制性核酸内切酶,在预定位点处)切割染色体或附加体,并且同时或序贯地通过包含第一dna的噬菌体颗粒感染细胞,其中所述dna被引入细胞内,并且所述nsi或其序列在切割位点处或附近被引入染色体或附加体内。在一个实例中,第一dna包含可操作以执行切割的crispr/cas系统的一种或多种组分(例如,至少包含编码用于靶向待切割位点的指导rna或crrna的核苷酸序列),并且进一步包含nsi。
[0034]
在一个实施方案中,nsi或者其编码的蛋白质或rna在靶细菌中的存在介导靶细胞杀死、或靶细胞生长或繁殖的下调,或者介导由靶细胞基因组编码的一种或多种rna或蛋白质的表达的关闭、或其下调。
[0035]
在一个实施方案中,nsi或者其编码的蛋白质或rna在靶细菌中的存在介导靶细胞生长或繁殖的上调,或者介导由靶细胞基因组编码的一种或多种rna或蛋白质的表达的开启、或其上调。
[0036]
在一个实施方案中,nsi编码对靶细菌有毒的crispr/cas系统的组分。
[0037]
在一个实施方案中,该dna是如任何前述段落中定义的第一dna。
[0038]
在一个实施方案中,第一dna由载体(例如,质粒或穿梭载体)包含。
[0039]
在一个实施方案中,第二dna由载体(例如,质粒或穿梭载体)、辅助噬菌体(例如,辅助噬菌粒)包含,或整合在宿主细菌细胞的基因组中。
[0040]
一个实施方案提供了包含第一dna和第二dna的细菌细胞。任选地,在其中转移第一dna(例如包含对靶细菌有毒的crispr/cas系统的组分的第一dna)之前,细胞缺乏功能性crispr/cas系统。一个实施方案提供了包含多种细胞的抗菌组合物,其中每种细胞任选地根据这个段落,用于施用于人或动物受试者用于医学用途。
[0041]
提供了产生噬菌体的方法,所述方法包括在宿主细菌细胞中表达噬菌体蛋白基因,其中产生了包含第一dna的包装噬菌体,其中所述噬菌体需要第二dna用于其复制,以产生进一步的噬菌体颗粒。任选地,该方法包括分离噬菌体颗粒。
[0042]
提供了包含可通过该方法获得的噬菌体颗粒群体的组合物,用于施用于人或动物受试者,用于治疗靶细菌细胞的感染,其中所述噬菌体能够感染且杀死靶细胞。
[0043]
提供了处理离体环境的方法,所述方法包括使环境暴露于可通过该方法获得的噬菌体颗粒群体,其中所述环境包含靶细菌,并且所述噬菌体感染且杀死靶细菌。在一个实例中,与噬菌体施用同时或序贯地向受试者进一步施用试剂。在一个实例中,该试剂是除草剂、农药、杀虫剂、植物肥料或清洁剂。
[0044]
任选地,该方法用于遏制环境中的处理。
[0045]
任选地,该方法用于控制环境中的噬菌体处理的给药。
[0046]
任选地,该方法用于降低环境中通过噬菌体获得外源基因序列的风险。
[0047]
提供了治疗人或动物受试者中的靶细菌感染的方法,所述方法包括使细菌暴露于可通过生产方法获得的噬菌体颗粒群体,其中所述噬菌体感染且杀死靶细菌。
[0048]
任选地,用于治疗的方法用于遏制受试者中的治疗。
[0049]
任选地,用于治疗的方法用于遏制其中存在受试者的环境中的治疗。
[0050]
任选地,用于治疗的方法用于控制受试者中的噬菌体治疗的给药。
[0051]
任选地,用于治疗的方法用于降低受试者中通过噬菌体获得外源基因序列的风险。
[0052]
任选地,用于治疗的方法用于降低在其中存在受试者的环境中,通过噬菌体获得外源基因序列的风险。
[0053]
任选地,本文的靶细菌由受试者的微生物群系,例如肠道微生物群系包含。可替代地,微生物群系是皮肤、头皮、头发、眼、耳、口腔、咽喉、肺、血液、直肠、肛门、阴道、阴囊、阴茎、鼻或舌微生物群系。
[0054]
在一个实例中,与噬菌体施用同时或序贯地向受试者进一步施用药剂。在一个实例中,药剂是抗生素、抗体、免疫检查点抑制剂(例如抗pd-1、抗pd-l1或抗ctla4抗体)、过继细胞疗法(例如car-t疗法)或疫苗。
[0055]
在一个实例中,本发明采用辅助噬菌体用于包装目标噬菌体核酸。因此,本发明提供了下述说明性方面:1. 一种辅助噬菌体群体,其中所述辅助噬菌体能够包装第一噬菌体核酸,以产生第一噬菌体颗粒,其中所述第一噬菌体不同于辅助噬菌体,并且所述辅助噬菌体本身不能产生辅助噬菌体颗粒。
[0056]
2. 一种组合物,其包含第一噬菌体群体,其中所述第一噬菌体需要根据方面1的辅助噬菌体,用于第一噬菌体颗粒的复制;并且任选地,其中由所述组合物包含的少于20、15、10、5、4、3、2、1、0.5、0.4、0.2或0.1%的总噬菌体颗粒是此类辅助噬菌体的颗粒。
[0057]
在一个实例中,该组合物包含辅助噬菌体,并且由该组合物包含的少于1%的总噬菌体颗粒是此类辅助噬菌体的颗粒。在一个实例中,该组合物包含辅助噬菌体,并且由该组合物包含的少于0.5%的总噬菌体颗粒是此类辅助噬菌体的颗粒。在一个实例中,该组合物包含辅助噬菌体,并且由该组合物包含的少于0.1%的总噬菌体颗粒是此类辅助噬菌体的颗粒。在一个实例中,该组合物包含辅助噬菌体,并且由该组合物包含的少于0.01%的总噬菌体颗粒是此类辅助噬菌体的颗粒。在一个实例中,该组合物包含辅助噬菌体,并且由该组合物包含的少于0.001%的总噬菌体颗粒是此类辅助噬菌体的颗粒。在一个实例中,该组合物包含辅助噬菌体,并且由该组合物包含的少于0.0001%的总噬菌体颗粒是此类辅助噬菌体的颗粒。在一个实例中,该组合物包含辅助噬菌体,并且由该组合物包含的少于0.00001%的总噬菌体颗粒是此类辅助噬菌体的颗粒。在一个实例中,该组合物包含辅助噬菌体,并且由该组合物包含的少于0.000001%的总噬菌体颗粒是此类辅助噬菌体的颗粒。在一个实例中,该组合物包含辅助噬菌体,并且由该组合物包含的少于0.0000001%的总噬菌体颗粒是此类辅助噬菌体的颗粒。在一个实例中,该组合物包含辅助噬菌体,并且由该组合物包含的少于0.00000001%的总噬菌体颗粒是此类辅助噬菌体的颗粒。
[0058]
在一个实例中,群体包括至少103、104、105或106个噬菌体颗粒,例如,如转导测定指示的。在一个实例中,群体包含至少103个噬菌体颗粒和例如不超过10
14
个颗粒。在一个实例中,群体包含至少104个噬菌体颗粒和例如不超过10
14
个颗粒。在一个实例中,群体包含至少105个噬菌体颗粒和例如不超过10
14
个颗粒。在一个实例中,群体包含至少106个噬菌体颗粒和例如不超过10
14
个颗粒。为了具有第一噬菌体浓度的测量,例如,当第一噬菌体基因组含有抗生素标记物时,可以执行标准转导测定。因此,在这种情况下,第一噬菌体能够感染靶细菌,并且在1ml的样品中,该群体包含至少103、104、105或106个转导颗粒,其可以通过以下进行测定:以感染复数《0.1感染敏感细菌,并且通过在20至37摄氏度下,例如在20或37摄氏度下,在体外在对应于抗生素标记物的选择性琼脂平板上铺平板,测定感染的细胞的数
目。
[0059]
任选地由组合物包含的至少99.9、99.8、99.7、99.6、99.5、99.4、99.3、99.2、99.1、90、85、80、70、60、50或40%的总噬菌体颗粒是第一噬菌体的颗粒。
[0060]
在一个实例中,第一噬菌体基因组包含f1复制起点。
[0061]
在一个实例中,辅助噬菌体是大肠杆菌噬菌体。在一个实例中,第一噬菌体是大肠杆菌、艰难梭菌(c dificile)、链球菌属(streptococcus)、克雷伯氏菌属(klebsiella)、假单胞菌属(pseudomonas)、不动杆菌属(acitenobacter)、肠杆菌科(enterobacteracea)、厚壁菌门(firmicutes)或拟杆菌门(bacteroidetes)噬菌体。在一个实例中,辅助噬菌体是改造的m13噬菌体。
[0062]
在一个实例中,第一噬菌体基因组包含噬菌粒,其中所述噬菌粒包含在辅助噬菌体的存在下,用于包装第一噬菌体颗粒的包装信号。
[0063]
第一噬菌体颗粒可以含有例如如本文定义的目标核苷酸序列(nsi),例如编码可在靶细菌中工作的crispr/cas系统的组分的nsi,所述靶细菌可以被第一噬菌体颗粒感染。一旦在靶细菌内部,第一噬菌体dna就无法在不存在辅助噬菌体的情况下包装,以形成第一噬菌体颗粒。这有用地遏制第一噬菌体基因组及其编码产物(蛋白质和/或核酸)的活性,以及在包含已暴露于第一噬菌体的靶细菌的环境中,限制或控制了nsi及其编码产物的给药。这可用于例如控制由人或动物受试者包含的环境、植物或其它环境(例如,土壤或食品(foodstiff)或食品成分)的医学处理。
[0064]
3. 任何前述方面的辅助噬菌体或组合物,其中每个第一噬菌体的基因组缺乏编码第一噬菌体结构蛋白的基因。
[0065]
4. 方面2或3的组合物,其中所述组合物包含辅助噬菌体dna。
[0066]
5. 方面4的组合物,其中所述dna包含辅助dna片段。
[0067]
6. 任一项前述方面的辅助噬菌体或组合物,其中所述辅助噬菌体为原噬菌体形式。
[0068]
因此,原噬菌体整合在宿主细胞的染色体中。
[0069]
噬菌体结构蛋白的实例是噬菌体外壳蛋白、领蛋白(collar protein)和噬菌体尾丝蛋白。
[0070]
7. 方面2或3中任一项的组合物,其中所述组合物不包含辅助噬菌体dna,所述辅助噬菌体dna包含20个邻接核苷酸或更多个(例如20至25、30、35、40、50或100个核苷酸)的序列,例如不包含辅助噬菌体dna。
[0071]
这可以例如如常规的使用dna探针(基于已知的辅助噬菌体(heper phge)基因组序列设计的)与pcr进行测定。在一个实例中,该组合物可以包含残留的辅助原噬菌体dna,但另外基本上缺乏辅助dna。
[0072]
8. 方面2至5和7中任一项的组合物,其中所述辅助噬菌体能够感染宿主细菌,并且所述组合物不包含宿主细菌。
[0073]
9. 方面2至8中任一项的组合物,其中所述组合物是宿主细菌细胞的裂解产物,其中所述裂解产物包含辅助原噬菌体dna,例如,此类dna包含辅助噬菌体dna的20个邻接核苷酸或更多个(例如20至25、30、35、40、50或100个核苷酸)。
[0074]
10. 方面2至8中任一项的组合物,其中所述组合物是宿主细菌细胞的裂解产物,
其中所述裂解产物已进行加工(例如,过滤),以去除全部或一些辅助噬菌体dna;或者该组合物是缺乏细胞材料的宿主细菌细胞的裂解产物。
[0075]
11. 方面2至10中任一项的组合物,其中所述组合物不包含辅助噬菌体颗粒。
[0076]
12. 方面2至11中任一项的组合物,其中由所述组合物包含的至少95%(例如100%)的噬菌体颗粒是第一噬菌体颗粒。
[0077]
在另一个实施方案中,组合物包含第二噬菌体颗粒,其中所述第二噬菌体不同于第一噬菌体,并且不是辅助噬菌体。
[0078]
13. 方面2至12中任一项的组合物,其中所述群体包含至少103、104、105或106个噬菌体颗粒,如转导测定中指示的。
[0079]
14. 任何前述方面的辅助噬菌体或组合物,其中所述第一噬菌体能够在辅助噬菌体(例如,辅助原噬菌体)的存在下在宿主细菌中复制,其中所述第一噬菌体包含用于杀死第一菌株或物种的靶细菌的抗菌手段,其中所述靶细菌具有不同的菌株或物种,并且所述抗菌手段不可操作以杀死靶细菌。
[0080]
15. 一种包含噬菌体群体的组合物,所述群体包含(a)第一噬菌体的第一亚群,其需要辅助噬菌体用于包装第一噬菌体;(b)包含辅助噬菌体的噬菌体的第二亚群,其中所述辅助噬菌体如任何前述方面中所述。
[0081]
16. 任何前述方面的辅助噬菌体或组合物,其中所述辅助噬菌体是噬菌粒。
[0082]
17. 一种组合物,其包含(a)如任何前述方面中所述的辅助噬菌体群体;和(b)核酸载体群体,其包含含有第一噬菌体包装信号的载体dna;(c)其中所述辅助噬菌体能够包装载体dna,以产生第一噬菌体。
[0083]
18. 方面17的组合物,其中所述载体是噬菌体。
[0084]
19. 方面17的组合物,其中所述载体是质粒或噬菌粒。
[0085]
20. 方面19的组合物,所述载体是可以在第一细菌中复制的穿梭载体(例如,puc载体),其中在辅助噬菌体的存在下,所述载体可以进一步复制并包装到第二细菌(宿主细菌)中的第一噬菌体内,其中所述第一细菌具有与宿主细菌的菌株或物种不同的菌株或物种。
[0086]
21. 方面20的组合物,其中所述第一噬菌体能够感染与第二细菌(以及任选地第一细菌)不同的菌株或物种的第三细菌。
[0087]
22. 方面17至21中任一项的组合物,其中所述第一噬菌体能够在辅助噬菌体(例如,辅助原噬菌体)的存在下在宿主细菌中复制,其中所述第一噬菌体包含用于杀死第一菌株或物种的靶细菌的抗菌手段,其中所述宿主细菌具有不同的菌株或物种,并且所述抗菌手段不可操作以杀死宿主细菌。
[0088]
23. 任何前述方面的辅助噬菌体或组合物,其中所述基因组缺乏包装信号(例如,下文的seq id no:2),其中所述辅助噬菌体不能自我复制。
[0089]
24. 方面23的辅助噬菌体或组合物,其中所述信号是pac或cos序列。
[0090]
25. 任何前述方面的辅助噬菌体或组合物,其中所述辅助噬菌体基因组能够在宿主细胞中复制。
[0091]
因此,基因组能够核酸复制但不能包装辅助噬菌体。
[0092]
26. 方面1至24中任一项的辅助噬菌体或组合物,其中所述基因组缺乏产生辅助噬菌体颗粒所需的核苷酸序列。
[0093]
27. 方面26的辅助噬菌体或组合物,其中所述核苷酸序列编码σ因子(例如,σ-70),或者包含σ因子识别位点、dna聚合识别位点、或辅助噬菌体dna复制所需的基因的启动子。
[0094]
28. 任何前述方面的辅助噬菌体或组合物,其中所述辅助噬菌体是温和噬菌体。
[0095]
29. 方面1至27中任一项的辅助噬菌体或组合物,其中所述辅助噬菌体是裂解性噬菌体。
[0096]
30. 任何前述方面的辅助噬菌体或组合物,其中所述第一噬菌体能够感染靶细菌,所述第一噬菌体包含目标核苷酸序列(nsi),其能够在靶细菌中表达蛋白质或rna(例如,grna或crrna),或者其中所述nsi包含可在靶细菌中工作的调节元件。
[0097]
31. 方面30的辅助噬菌体或组合物,其中所述nsi或者其编码的蛋白质或rna在靶细菌中的存在介导靶细胞杀死、或靶细胞生长或繁殖的下调,或者介导由靶细胞基因组编码的一种或多种rna或蛋白质的表达的关闭、或其下调。
[0098]
32. 方面30的辅助噬菌体或组合物,其中所述nsi或者其编码的蛋白质或rna在靶细菌中的存在介导靶细胞生长或繁殖的上调,或者介导由靶细胞基因组编码的一种或多种rna或蛋白质的表达的开启、或其上调。
[0099]
33. 根据方面2至32中任一项的抗菌组合物,其中所述第一噬菌体能够感染靶细菌,并且每个第一噬菌体包含用于杀死靶细菌的改造的抗菌手段。
[0100]
通过使用术语“改造的”,对于技术人员显而易见的是,相关的手段已引入并且是 并非天然存在于噬菌体中。例如,该手段是重组、人工或合成的。
[0101]
34. 方面14、22或33的组合物,其中所述抗菌手段包含crispr/cas系统的一种或多种组分。
[0102]
35. 权利要求34的组合物,其中所述组分包含:(i)编码指导rna(例如,单个指导rna)、或包含用于产生指导rna的crispr阵列的dna序列,其中所述指导rna能够靶向靶细菌的基因组;(ii)编码cas核酸酶的dna序列;和/或(iii)编码级联的一种或多种组分的dna序列。
[0103]
在一个实例中,本文的cas是cas9。在一个实例中,本文的cas是cas3。cas可以与由靶细菌编码的cas等同。
[0104]
36. 方面14、22或33至35中任一项的组合物,其中所述抗菌手段包含编码指导核酸酶的核酸,例如cas核酸酶、talen、锌指核酸酶或大范围核酸酶。
[0105]
37. 任何前述方面的辅助噬菌体或组合物,其中所述辅助噬菌体用于对人或动物受试者实践的医学中,或所述组合物是用于对人或动物受试者实践的医学中的药物组合物。
[0106]
在一个实例中,动物是牲畜或伴侣宠物动物(例如,牛、猪、山羊、绵羊、马、犬、猫或兔)。在一个实例中,动物是昆虫(处于其生命周期的任何阶段的昆虫,例如卵、幼虫或蛹)。在一个实例中,动物是原生动物。在一个实例中,动物是头足类动物。
[0107]
38. 方面2至36中任一项的组合物,其中所述组合物是除草剂、农药、食品或饮料
加工助剂、食品或饮料添加剂、石油化学或燃料加工助剂、净水剂、化妆品添加剂、洗涤剂添加剂或环境(例如,土壤)添加剂或清洁剂。
[0108]
39. 方面1至37中任一项的辅助噬菌体或组合物,其用于治疗人或动物受试者的疾病或状况的遏制方法中,其中所述疾病或状况由靶细菌介导,并且所述靶细菌由受试者包含,所述方法包括将组合物施用于受试者,由此使所述靶细菌暴露于抗菌手段且被杀死,并且遏制第一噬菌体的繁殖。
[0109]
第一噬菌体不能自我复制并且需要辅助噬菌体或第二dna来实现这一点,有用地提供了在组合物的作用位置(例如肠道)和/或受试者的环境中的遏制,例如,当暴露于受试者的分泌物例如尿和粪便时,所述分泌物否则可能含有复制的第一噬菌体。辅助噬菌体或第二dna不能自我包装限制了由第一噬菌体形成包装颗粒所需的因子的可用性,因此通过限制第一噬菌体的繁殖提供了遏制。例如,这对于遏制由第一噬菌体提供的抗菌活性(例如crispr/cas杀死原理)可能是有用的。
[0110]
40. 一种细菌细胞或多种细菌细胞,其包含任何前述方面的辅助噬菌体或组合物,其中所述第一噬菌体能够在细胞中在辅助噬菌体的存在下复制。
[0111]
细胞可以例如充当第一噬菌体的基因组的载体,其中一旦载体细菌已施用于待处理的环境,例如土壤或人肠道或本文所述的其它环境,所述第一噬菌体dna就能够从载体水平转移到靶细菌。在一个实例中,环境由人或动物受试者包含,并且载体在受试者中是共生或益生的。例如,载体细菌是乳杆菌属(lactobacillus)(例如罗伊氏乳杆菌(l reuteri)或乳酸乳球菌(l lactis))、大肠杆菌或链球菌属(例如嗜热链球菌(s thermophilus))细菌。水平转移可以是质粒(例如接合质粒)转移至靶细菌或靶细菌的第一噬菌体感染,其中所述第一噬菌体先前已包装在载体中。载体的使用也可用于经口施用或其它途径,其中所述载体可以对于噬菌体、辅助物或组合物提供免于受试者中的胃酸或其它恶劣环境的保护。此外,载体可以配制成饮料,例如益生菌饮料,例如适应的yakult(yakult)(商标)、actimel(商标)、kevita(商标)、activia(商标)、jarrow(商标)或用于人消费的类似饮料。
[0112]
41. 方面40的细胞,其用于施用于人或动物受试者用于医学用途,其包括使用第一噬菌体杀死靶细菌,其中所述靶细菌介导受试者中的疾病或状况。
[0113]
在一个实例中,当受试者是人时,受试者不是胚胎。
[0114]
42. 方面41的细胞,其中所述细胞包含辅助噬菌体,并且在受试者中是共生或益生的。
[0115]
43. 一种杀死环境中的靶细菌的方法,任选地其中所述方法不对人或动物进行实践,其中所述方法包括使环境暴露于根据方面42的细胞、或者通过方面57至65中任一项的方法获得或可获得的组合物,其中所述环境暴露于或已暴露于第一噬菌体或在辅助噬菌体的存在下产生第一噬菌体的所述载体,其中所述第一噬菌体能够在环境中复制并杀死靶细菌。
[0116]
44. 方面40至43中任一项的或方法,其中所述细胞是大肠杆菌、乳杆菌属(例如乳酸乳球菌或罗伊氏乳杆菌)、或链球菌属(例如嗜热链球菌)细胞。
[0117]
45. 方面40至44的细胞或方法,其中向受试者施用或已施用包含第一噬菌体的细胞。
[0118]
46. 方面2至45中任一项的组合物,其与靶细菌细胞组合,其中所述第一噬菌体能
够感染靶细菌细胞。
[0119]
47. 方面1至42和44至46中任一项的辅助噬菌体、组合物或细胞,或者通过方面57至65中任一项的方法获得或可获得的组合物,在杀死靶细菌的抗菌剂制造中的用途,用于环境中的抗菌遏制,例如离体遏制;或者包含环境的人或动物受试者中的遏制。
[0120]
48. 方面1至42和44至46中任一项的辅助噬菌体、组合物或细胞,或者通过方面57至65中任一项的方法获得或可获得的组合物,在杀死靶细菌的抗菌剂制造中的用途,用于降低通过第一噬菌体获得外源基因的风险。
[0121]
例如,这可用于降低通过噬菌体的抗生素抗性基因的风险,例如当噬菌体在环境中的其它噬菌体或质粒的存在下时。
[0122]
49. 方面1至42和44至46中任一项的辅助噬菌体、组合物或细胞,或者通过方面57至65中任一项的方法获得或可获得的组合物,在杀死靶细菌的抗菌剂制造中的用途,用于降低通过第一噬菌体获得一种或多种抗生素抗性基因的风险。
[0123]
50. 一种降低通过第一噬菌体获得外源基因的风险的方法,所述方法包括(a)提供方面2至42和44至46中任一项的组合物,或者通过方面57至65中任一项的方法获得或可获得的组合物;和(b)使靶细菌暴露于所述组合物,其中所述第一噬菌体感染靶细菌;(c)其中所述辅助噬菌体不能自我复制,并且从而限制了第一噬菌体的繁殖,其中防止或降低了第一噬菌体的繁殖,从而降低了第一噬菌体获得外源基因(例如抗生素抗性基因)的风险。
[0124]
51. 一种遏制环境(例如离体)中的抗菌活性的方法,所述方法包括(a)提供根据方面2至42和44至46中任一项的抗菌组合物,或者通过方面57至65中任一项的方法获得或可获得的组合物;和(b)使环境中的靶细菌暴露于所述组合物,其中所述细菌暴露于第一噬菌体和抗菌手段并且被杀死;(c)其中所述辅助噬菌体不能自我复制,并且从而限制了第一噬菌体的繁殖,其中防止或降低了第一噬菌体的繁殖,从而遏制抗菌活性。
[0125]
52. 一种控制环境(例如离体)中的第一噬菌体的给药的方法,所述方法包括(a)提供根据方面2至42和44至46中任一项的抗菌组合物,或者通过方面57至65中任一项的方法获得或可获得的组合物;和(b)使环境中的靶细菌暴露于所述组合物,其中所述细菌被第一噬菌体感染;(c)其中所述辅助噬菌体不能自我复制,并且从而限制了第一噬菌体的繁殖,其中防止或降低了第一噬菌体的繁殖,从而控制环境中的第一噬菌体的给药。
[0126]
53. 方面43至45、51和52中任一项的方法,或者方面47的用途,其中所述环境是人或动物微生物群系,例如肠道微生物群系。
[0127]
54. 方面43至45、51和52中任一项的方法,或者方面47的用途,其中所述环境是以下的微生物群系:土壤;植物,植物的部分(例如叶、果实、蔬菜或花)或植物产物(例如果肉);水;水路;流体;食品或其成分;饮料或其成分;医疗装置;化妆品;洗涤剂;血液;体液;医疗仪器;工业仪器;石油钻机;石油化学加工、贮存或运输仪器;车辆或容器。
[0128]
55. 方面43至45、51和52中任一项的方法,或者方面47的用途,其中所述环境是已
施用该组合物的人或动物受试者的离体体液(例如尿、血液、血液制品、汗、眼泪、痰或唾液)、身体固体(bodily solid)(例如粪便)或组织。
[0129]
56. 方面43至45、51和52中任一项的方法,或者方面47的用途,其中所述环境是已施用该组合物的人或动物受试者的体内体液(例如尿、血液、血液制品、汗、眼泪、痰或唾液)、身体固体(例如粪便)或组织。
[0130]
57. 一种产生第一噬菌体的方法,其中所述第一噬菌体需要辅助噬菌体以复制,所述方法包括(a)提供包含包装信号的dna;(b)将dna引入宿主细菌细胞内;(c)其中所述宿主细菌细胞包含辅助噬菌体,或者其中所述辅助噬菌体与步骤(b)同时或序贯地引入细菌细胞内;(d)其中所述辅助噬菌体是根据任何前述方面的;(e)引起或允许辅助噬菌体产生噬菌体外壳蛋白,其中所述包装信号在宿主细胞中被识别,由此使用蛋白质产生第一噬菌体,所述第一噬菌体包装dna;(f)其中所述宿主细胞中的辅助噬菌体颗粒产生被抑制或降低,从而限制了辅助噬菌体颗粒的可用性;(g)任选地裂解宿主细胞并获得第一噬菌体;(h)从而产生包含第一噬菌体的组合物,所述第一噬菌体需要辅助噬菌体用于复制,其中通过限制辅助噬菌体在组合物中的可用性,来防止或降低第一噬菌体颗粒的进一步产生。
[0131]
在一个实施方案中,dna被噬菌粒或克隆载体(例如穿梭载体,例如puc载体)包含。
[0132]
可能存在适度量的辅助噬菌体dna复制,以致使第一噬菌体蛋白有效地产生,或者应该完全消除辅助噬菌体dna的复制。
[0133]
58. 方面57的方法,其中在(c)中,所述辅助噬菌体是在细菌细胞染色体中整合的原噬菌体。
[0134]
59. 方面59的方法,其中(e)包括例如使用uv、丝裂霉素来诱导辅助噬菌体dna的复制和/或蛋白质的表达。
[0135]
60. 方面57至59中任一项的方法,其中(g)包括使所述第一噬菌体与细胞材料或辅助噬菌体dna进一步分开。
[0136]
61. 方面57至60中任一项的方法,其中所述组合物包含第一噬菌体颗粒群体,其中所述组合物不包含辅助噬菌体dna和/或颗粒。
[0137]
62. 方面57至61中任一项的方法,其中(a)的dna包含用于杀死靶细菌的改造的抗菌手段。
[0138]
63. 方面62的方法,其中所述抗菌手段包含crispr/cas系统的一种或多种组分。
[0139]
64. 方面63的方法,其中所述组分包含:(i)编码指导rna(例如,单个指导rna)、或包含用于产生指导rna的crispr阵列的dna序列,其中所述指导rna能够靶向靶细菌的基因组;(ii)编码cas(例如,cas9、cas3、cpf1、casx或casy)核酸酶的dna序列;和/或(iii)编码级联的一种或多种组分(例如,casa)的dna序列。
[0140]
65. 方面62至64中任一项的方法,其中所述抗菌手段包含编码指导核酸酶的核
酸,所述指导核酸酶例如cas核酸酶、talen、锌指核酸酶或大范围核酸酶。
[0141]
66. 方面1至42和44至46中任一项的辅助噬菌体、组合物或细胞,或者通过方面57至65中任一项的方法获得或可获得的组合物,其用于人或动物受试者中的靶细菌的抗菌治疗,由此抗菌治疗在所述受试者中被遏制。
[0142]
67. 方面1至42和44至46中任一项的辅助噬菌体、组合物或细胞,或者通过方面57至65中任一项的方法获得或可获得的组合物,其用于人或动物受试者的肠道中的靶细菌的抗菌治疗,由此降低了受试者的一种或多种身体排泄物中的抗菌活性。
[0143]
这可用作降低或消除受试者外的第一噬菌体活性的安全措施。
[0144]
68. 方面67的辅助噬菌体、组合物或细胞,其中消除了受试者的一种或多种身体排泄物中的抗菌活性。
[0145]
69. 方面1至42和44至46中任一项的辅助噬菌体、组合物或细胞,或者通过方面57至65中任一项的方法获得或可获得的组合物,其用于控制人或动物受试者,例如受试者的肠道中的靶细菌的抗菌治疗的给药。
[0146]
有用的是,限制或消除了第一噬菌体的繁殖,因此可以控制或甚至在狭窄的预期范围内预先确定受试者中的给药。这例如对于包含第一噬菌体或组合物的药剂是有用的,并且在fda和类似管理机构批准此类药物之前可以是有帮助的。
[0147]
可替代地,给药是本文公开的环境例如土壤等的给药,其中还期望限制第一噬菌体或组合物活性,以限制活性在自然和其它地形中的扩散。
[0148]
70. 方面1至42和44至46中任一项的辅助噬菌体、组合物或细胞,或者通过方面57至65中任一项的方法获得或可获得的组合物,其用于固定人或动物受试者,例如受试者的肠道中的靶细菌的抗菌治疗的给药。
[0149]
71. 一种噬菌体产生系统,其用于产生包含目标核苷酸序列的噬菌体(例如,任何前述方面的第一噬菌体)(nsi噬菌体),所述系统包含组分(i)至(iii):(a)第一dna;(b)第二dna;和(c)nsi噬菌体产生因子(npf)或编码npf的可表达核苷酸序列;其中(d)第一dna编码辅助噬菌体(例如,任何前述方面中所述的所述第一辅助噬菌体);(e)第二dna包含目标核苷酸序列(nsi);(f)当该系统由细菌宿主细胞包含时,辅助噬菌体蛋白由第一dna表达以形成噬菌体,所述噬菌体在npf的存在下包装第二dna,从而产生nsi噬菌体;和(g)该系统缺乏形成包装第一dna的辅助噬菌体颗粒所需的辅助噬菌体产生因子(hpf),或缺乏编码功能性hpf的可表达核苷酸序列;或者该系统包括包含或编码功能性hpf的核苷酸序列,该系统进一步包含用于在宿主细胞中靶向灭活hpf序列的手段,以消除或最小化包含第一dna的辅助噬菌体的产生;由此该系统能够生产包含nsi噬菌体群体的产物,其中每个nsi噬菌体需要所述辅助噬菌体用于繁殖,任选地其中所述产物中的nsi噬菌体不与辅助噬菌体混合,或由所述产物包含的少于20%的总噬菌体是所述辅助噬菌体。
[0150]
如果存在辅助噬菌体复制以产生颗粒的残留能力,例如在辅助噬菌体基因组中的辅助噬菌体包装信号或其它hpf核苷酸序列突变(例如,通过其中的核苷酸的缺失、取代或添加),以击倒形成噬菌体颗粒的能力的情况下,则本发明在其概念内包括相对低水平的辅助噬菌体颗粒产生。优选地,例如通过从辅助噬菌体基因组中缺失全部或部分序列或者使序列失活,不存在辅助噬菌体颗粒的产生。
[0151]
72. 一种产生第一噬菌体的方法,其中所述第一噬菌体需要辅助噬菌体以复制,所述方法包括(a)在宿主细胞中提供方面71的系统;(b)引起或允许产生辅助噬菌体蛋白,由此包装第二dna以产生第一噬菌体;和(c)任选地裂解宿主细胞并获得包含第一噬菌体的组合物。
[0152]
73. 方面72的方法,其中步骤(c)包括从细胞材料中分离第一噬菌体。
[0153]
74. 方面72或73的方法,其中所述组合物包含第一噬菌体群体,其中由所述组合物包含的少于20、10、5、4、3、2、1、0.5或0.1%的总噬菌体是辅助噬菌体。
[0154]
75. 方面72至74中任一项的方法,其中所述第二dna包含用于杀死靶细菌的改造的抗菌手段。
[0155]
76. 方面75的方法,其中所述抗菌手段包含crispr/cas系统的一种或多种组分。
[0156]
77. 方面76的方法,其中所述组分包含:(i)编码指导rna(例如,单个指导rna)、或包含用于产生指导rna的crispr阵列的dna序列,其中所述指导rna能够靶向靶细菌的基因组;(ii)编码cas核酸酶的dna序列;和/或(iii)编码级联的一种或多种组分的dna序列。
[0157]
78. 方面75至77中任一项的方法,其中所述抗菌手段包含编码指导核酸酶的核酸,所述指导核酸酶例如cas核酸酶、talen、锌指核酸酶或大范围核酸酶。
[0158]
79. 方面71至78中任一项的方法的系统,其中所述第一噬菌体能够感染靶细菌,所述nsi能够在靶细菌中表达蛋白质或rna,或者其中所述nsi包含可在靶细菌中工作的调节元件。
[0159]
80. 方面79的系统或方法,其中所述nsi或者其编码的蛋白质或rna在靶细菌中的存在介导靶细胞杀死、或靶细胞生长或繁殖的下调,或者介导由靶细胞基因组编码的一种或多种rna或蛋白质的表达的关闭、或其下调。
[0160]
81. 方面79的系统或方法,其中所述nsi或者其编码的蛋白质或rna在靶细菌中的存在介导靶细胞生长或繁殖的上调,或者介导由靶细胞基因组编码的一种或多种rna或蛋白质的表达的开启、或其上调。
[0161]
82. 方面71至81中任一项的方法的系统,其中所述npf和hpf各自为包装信号,例如seq id no:2,或者与其具有至少70、80、90、95、96、97、98或99%同一性的序列,或者是来自不同物种的同源物。
[0162]
83. 方面82的方法的系统,其中每个信号是pac或cos序列,或者是同源物。
[0163]
84. 方面71至81中任一项的方法的系统,其中所述hpf是辅助噬菌体复制所需的核苷酸序列。
[0164]
85. 方面71至81中任一项的方法的系统,其中所述hpf编码σ因子(例如,σ-70),或者包含σ因子识别位点、dna聚合识别位点、或辅助噬菌体dna复制所需的基因的启动子、辅助噬菌体整合酶、辅助噬菌体切除酶或辅助噬菌体复制起点。
[0165]
86. 一种组合物,其包含可通过方面72至85中任一项的方法获得的第一噬菌体群体,其中每个第一噬菌体的基因组缺乏编码噬菌体蛋白的基因。
[0166]
87. 方面86的组合物,其中所述第一噬菌体包含如方面75至78中任一项中所述的抗菌手段。
[0167]
88. 方面87的组合物,其包含与第一dna或其片段相同的dna。
[0168]
89. 方面88的组合物,其中所述组合物的dna与第一dna相同,并且缺乏辅助噬菌体包装信号。
[0169]
90. 方面86至89中任一项的组合物,其用于人或动物受试者中的靶细菌的抗菌治疗,由此抗菌治疗在所述受试者中被遏制。
[0170]
91. 方面86至89中任一项的组合物,其用于人或动物受试者的肠道中的靶细菌的抗菌治疗,由此降低了受试者的一种或多种身体排泄物中的抗菌活性。
[0171]
92. 方面91的组合物,其中消除了受试者的一种或多种身体排泄物中的抗菌活性。
[0172]
93. 方面86至89中任一项的组合物,其用于控制人或动物受试者,例如受试者的肠道中的靶细菌的抗菌治疗的给药。
[0173]
94. 方面86至89中任一项的组合物,其用于固定人或动物受试者,例如受试者的肠道中的靶细菌的抗菌治疗的给药。
[0174]
95. 一种分离的dna,其包含产生噬菌体颗粒所需的辅助噬菌体基因组的所有结构蛋白基因,其中所述dna缺乏产生包装的辅助噬菌体所需的辅助噬菌体产生因子(hpf),任选地其中当dna整合到宿主细菌细胞的基因组中时,所述dna包含一种或多种启动子用于基因的表达。
[0175]
96. 方面95的dna,其中所述dna缺乏任何噬菌体包装信号。
[0176]
97. 方面95或96的dna,其中所述hpf是编码σ因子的核苷酸序列,或者包含σ因子识别位点、dna聚合识别位点、辅助噬菌体dna复制所需的基因的启动子、编码辅助噬菌体整合酶的核苷酸序列、编码辅助噬菌体切除酶的核苷酸序列或辅助噬菌体复制起点。
[0177]
98. 方面95至97中任一项的dna,其中所述dna包含编码crispr/cas系统阻遏物的核苷酸序列。
[0178]
99. 方面95至98中任一项的dna,其中所述dna整合到宿主细菌细胞的染色体中,其中所述基因可在宿主细胞中表达。
[0179]
100. 方面99的dna,其中所述细胞缺乏活性crispr/cas系统。
[0180]
101. 方面95至100中任一项的dna,其与第二dna组合,其中所述第二dna包含hpf。
[0181]
102. 方面95至100中任一项的dna,其与第二dna组合,其中所述第二dna包含噬菌体包装信号,并且任选地所述第一dna缺乏噬菌体包装信号。
[0182]
103. 方面101或102的dna,其中所述第二dna由噬菌粒或质粒(例如,穿梭载体)包含。
[0183]
在一个实例中,试剂盒、dna、第一噬菌体、辅助噬菌体或组合物由医疗容器包含,所述医疗容器例如注射器、小瓶、iv袋、吸入器、滴眼管或喷雾器。在一个实例中,试剂盒、dna、第一噬菌体、辅助噬菌体或组合物由无菌容器包含。在一个实例中,试剂盒、dna、第一噬菌体、辅助噬菌体或组合物由医学上相容的容器包含。在一个实例中,试剂盒、dna、第一
噬菌体、辅助噬菌体或组合物由发酵器皿,例如金属、玻璃或塑料器皿包含。
[0184]
在一个实例中,试剂盒、dna、第一噬菌体、辅助噬菌体或组合物由药剂包含,例如与说明书或包装标签组合,所述说明书或包装标签指示通过向人或动物受试者的经口、iv、皮下、鼻内、眼内、阴道、局部、直肠或吸入施用来施用药剂。在一个实例中,试剂盒、dna、第一噬菌体、辅助噬菌体或组合物由经口药物制剂包含。在一个实例中,试剂盒、dna、第一噬菌体、辅助噬菌体或组合物由鼻内或眼内药物制剂包含。在一个实例中,试剂盒、dna、第一噬菌体、辅助噬菌体或组合物由个人卫生组合物(例如洗发剂、肥皂或除臭剂)或化妆品制剂包含。在一个实例中,试剂盒、dna、第一噬菌体、辅助噬菌体或组合物由洗涤剂制剂包含。在一个实例中,试剂盒、dna、第一噬菌体、辅助噬菌体或组合物由例如用于清洁医疗或工业装置或仪器的清洁制剂包含。在一个实例中,试剂盒、dna、第一噬菌体、辅助噬菌体或组合物由食品、食品成分或食品加工助剂包含。在一个实例中,试剂盒、dna、第一噬菌体、辅助噬菌体或组合物由饮料、饮料成分或饮料加工助剂包含。在一个实例中,试剂盒、dna、第一噬菌体、辅助噬菌体或组合物由医用绷带、织物、膏药或拭子包含。在一个实例中,试剂盒、dna、第一噬菌体、辅助噬菌体或组合物由除草剂或农药包含。在一个实例中,试剂盒、dna、第一噬菌体、辅助噬菌体或组合物由杀虫剂包含。
[0185]
在一个实例中,第一噬菌体是覆盖噬菌体科(corticoviridae)、囊状噬菌体科(cystoviridae)、丝状噬菌体科(inoviridae)、光滑噬菌体科(leviviridae)、微小噬菌体科(microviridae)、肌尾噬菌体科(myoviridae)、短尾噬菌体科(podoviridae)、长尾噬菌体科(siphoviridae)或复层噬菌体科(tectiviridae)病毒。在一个实例中,辅助噬菌体是覆盖噬菌体科、囊状噬菌体科、丝状噬菌体科、光滑噬菌体科、微小噬菌体科、肌尾噬菌体科、短尾噬菌体科、长尾噬菌体科或复层噬菌体科病毒。在一个实例中,辅助噬菌体是丝状m13、圆环病毒科(noviridae)、有尾噬菌体(例如肌尾噬菌体科、长尾噬菌体科或短尾噬菌体科)、或无尾噬菌体(例如复层噬菌体科)。
[0186]
在一个实例中,第一噬菌体和辅助噬菌体均为覆盖噬菌体科。在一个实例中,第一噬菌体和辅助噬菌体均为囊状噬菌体科。在一个实例中,第一噬菌体和辅助噬菌体均为丝状噬菌体科。在一个实例中,第一噬菌体和辅助噬菌体均为光滑噬菌体科。在一个实例中,第一噬菌体和辅助噬菌体均为微小噬菌体科。在一个实例中,第一噬菌体和辅助噬菌体均为短尾噬菌体科。在一个实例中,第一噬菌体和辅助噬菌体均为长尾噬菌体科。在一个实例中,第一噬菌体和辅助噬菌体均为复层噬菌体科。
[0187]
在一个实例中,crispr/cas组分是i型crispr/cas系统的组分。在一个实例中,crispr/cas组分是ii型crispr/cas系统的组分。在一个实例中,crispr/cas组分是iii型crispr/cas系统的组分。在一个实例中,crispr/cas组分是iv型crispr/cas系统的组分。在一个实例中,crispr/cas组分是v型crispr/cas系统的组分。在一个实例中,crispr/cas组分包含编码cas9的核苷酸序列(例如,化脓性链球菌(s pyogenes)cas9、金黄色葡萄球菌(s aureus)cas9或嗜热链球菌cas9)。在一个实例中,crispr/cas组分包含编码cas3的核苷酸序列(例如,大肠杆菌cas3、艰难梭菌cas3或沙门氏菌属(salmonella)cas3)。在一个实例中,crispr/cas组分包含编码cpf的核苷酸序列。在一个实例中,crispr/cas组分包含编码casx的核苷酸序列。在一个实例中,crispr/cas组分包含编码casy的核苷酸序列。
[0188]
在一个实例中,第一dna、第一噬菌体或载体编码来自核苷酸序列的crispr/cas组
分或目标蛋白质,所述核苷酸序列包含可在靶细菌中工作的启动子。
[0189]
在一个实例中,宿主细菌和/或靶细菌是大肠杆菌。在一个实例中,宿主细菌和/或靶细菌是艰难梭菌(例如,载体是可在大肠杆菌中工作的穿梭载体,而宿主细菌是艰难梭菌)。在一个实例中,宿主细菌和/或靶细菌是链球菌属,例如嗜热链球菌(例如,载体是可在大肠杆菌中工作的穿梭载体,而宿主细菌是链球菌属)。在一个实例中,宿主细菌和/或靶细菌是假单胞菌属,例如铜绿假单胞菌(p aeruginosa)(例如,载体是可在大肠杆菌中工作的穿梭载体,而宿主细菌是铜绿假单胞菌)。在一个实例中,宿主细菌和/或靶细菌是克雷伯氏菌属(例如,载体是可在大肠杆菌中工作的穿梭载体,而宿主细菌是克雷伯氏菌属)。在一个实例中,宿主细菌和/或靶细菌是沙门氏菌属,例如鼠伤寒沙门氏菌(s typhimurium)(例如,载体是可在大肠杆菌中工作的穿梭载体,而宿主细菌是沙门氏菌属)。
[0190]
任选地,宿主和/或靶细菌是革兰氏阴性细菌(例如螺菌属(spirilla)或弧菌属(vibrio))。任选地,宿主和/或靶细菌是革兰氏阳性细菌。任选地,宿主和/或靶细菌是支原体属(mycoplasma)、衣原体门(chlamydiae)、螺旋体门(spirochete)或分枝杆菌属(mycobacterium)。任选地,宿主和/或靶细菌是链球菌属(例如化脓性链球菌或嗜热链球菌)。任选地,宿主和/或靶细菌是葡萄球菌属(例如金黄色葡萄球菌,例如mrsa)。任选地,宿主和/或靶细菌是大肠杆菌(例如o157:h7)宿主,例如其中cas由载体编码或内源性宿主cas核酸酶活性被去阻遏。任选地,宿主和/或靶细菌是假单胞菌属(例如铜绿假单胞菌)。任选地,宿主和/或靶细菌是弧菌属(例如霍乱弧菌(cholerae)(例如o139)或创伤弧菌(vulnificus))。任选地,宿主和/或靶细菌是奈瑟菌属(neisseria)(例如淋病奈瑟菌(gonnorrhoeae)或脑膜炎奈瑟菌(meningitidis))。任选地,宿主和/或靶细菌是博德氏菌属(bordetella)(例如百日咳博德氏菌(pertussis))。任选地,宿主和/或靶细菌是嗜血杆菌属(haemophilus)(例如流感嗜血杆菌(influenzae))。任选地,宿主和/或靶细菌是志贺氏菌属(shigella)(例如痢疾志贺氏菌(dysenteriae))。任选地,宿主和/或靶细菌是布鲁氏菌属(brucella)(例如流产布鲁氏菌(abortus))。任选地,宿主和/或靶细菌是弗朗西斯氏菌属(francisella)宿主。任选地,宿主和/或靶细菌是黄单胞菌属(xanthomonas)宿主。任选地,宿主和/或靶细菌是农杆菌属(agrobacterium)宿主。任选地,宿主和/或靶细菌是欧文氏菌属(erwinia)宿主。任选地,宿主和/或靶细菌是军团菌属(legionella)(例如嗜肺军团菌(pneumophila))。任选地,宿主和/或靶细菌是李斯特菌属(listeria)(例如单核细胞增多性李斯特菌(monocytogenes))。任选地,宿主和/或靶细菌是弯曲菌属(campylobacter)(例如空肠弯曲菌(jejuni))。任选地,宿主和/或靶细菌是耶尔森菌属(yersinia)(例如鼠疫耶尔森菌(pestis))。任选地,宿主和/或靶细菌是疏螺旋体属(borelia)(例如伯氏疏螺旋体(burgdorferi))。任选地,宿主和/或靶细菌是螺杆菌属(helicobacter)(例如幽门螺杆菌(pylori))。任选地,宿主和/或靶细菌是梭菌属(例如艰难梭菌或肉毒杆菌(botulinum))。任选地,宿主和/或靶细菌是埃立克体属(erlichia)(例如查菲埃立克体(chaffeensis))。任选地,宿主和/或靶细菌是沙门氏菌属(例如伤寒沙门氏菌(typhi)或肠道沙门氏菌(enterica),例如鼠伤寒沙门氏菌血清型,例如dt 104)。任选地,宿主和/或靶细菌是衣原体属(例如肺炎衣原体(pneumoniae))。任选地,宿主和/或靶细菌是副衣原体属(parachlamydia)宿主。任选地,宿主和/或靶细菌是棒状杆菌属(corynebacterium)(例如无枝菌酸棒状杆菌(amycolatum))。任选地,宿主和/或靶细菌是
克雷伯氏菌属(例如肺炎克雷伯氏菌)。任选地,宿主和/或靶细菌是肠球菌属(enterococcus)(例如粪肠球菌(faecalis)或屎肠球菌(faecim),例如利奈唑胺抗性)。任选地,宿主和/或靶细菌是不动杆菌属(例如鲍曼不动杆菌(baumannii),例如多药抗性)。
[0191]
使用本发明的靶细胞和在此类细胞中的抗生素抗性靶向的进一步实例如下:1. 任选地,靶细菌是例如对选自甲氧西林、万古霉素、利奈唑胺、达托霉素、奎奴普丁、达福普汀和替考拉宁的抗生素抗性的金黄色葡萄球菌细胞。
[0192]
2. 任选地,靶细菌是例如对选自头孢菌素类(例如头孢他啶)、碳青霉烯类(例如亚胺培南或美罗培南)、氟喹诺酮类、氨基糖苷类(例如庆大霉素或妥布霉素)和粘杆菌素的抗生素抗性的铜绿假单胞菌细胞。
[0193]
3. 任选地,靶细菌是例如对碳青霉烯抗性的克雷伯氏菌属(例如肺炎克雷伯氏菌)细胞。
[0194]
4. 任选地,靶细菌是例如对选自红霉素、克林霉素、β-内酰胺、大环内酯、阿莫西林、阿奇霉素和青霉素的抗生素抗性的链球菌属(例如嗜热链球菌、肺炎链球菌或化脓性链球菌)细胞。
[0195]
5. 任选地,靶细菌是例如对选自头孢曲松、阿奇霉素和环丙沙星的抗生素抗性的沙门氏菌属(例如鼠伤寒沙门氏菌血清型)。
[0196]
6. 任选地,靶细菌是例如对选自环丙沙星和阿奇霉素的抗生素抗性的志贺氏菌属细胞。
[0197]
7. 任选地,靶细菌是例如对选自异烟肼(inh)、利福平(rmp)、氟喹诺酮、阿米卡星、卡那霉素和卷曲霉素和阿奇霉素的抗生素抗性的结核分枝杆菌(mycobacteriumtuberculosis)细胞。
[0198]
8. 任选地,靶细菌是例如对万古霉素抗性的肠球菌属细胞。
[0199]
9. 任选地,靶细菌是例如对选自头孢菌素和碳青霉烯的抗生素抗性的肠杆菌科(enterobacteriaceae)细胞。
[0200]
10. 任选地,靶细菌是例如对选自甲氧苄啶、呋喃妥因、头孢氨苄和阿莫西林的抗生素抗性的大肠杆菌细胞。
[0201]
11. 任选地,靶细菌是梭菌属(例如,艰难梭菌)细胞,例如对选自氟喹诺酮抗生素和碳青霉烯的抗生素抗性。
[0202]
12. 任选地,靶细菌是例如对选自头孢克肟(例如经口头孢菌素)、头孢曲松(可注射头孢菌素)、阿奇霉素和四环素的抗生素抗性的淋病奈瑟菌细胞。
[0203]
13. 任选地,靶细菌是例如对选自β-内酰胺、美洛培南和碳青霉烯的抗生素抗性的鲍曼不动杆菌细胞。
[0204]
14. 任选地,靶细菌是例如对选自环丙沙星和阿奇霉素的抗生素抗性的弯曲菌属细胞。
[0205]
15. 任选地,靶细胞产生beta(β)-内酰胺酶。
[0206]
16. 任选地,靶细胞是对实例1至14中任一项中所述的抗生素抗性的细菌细胞。
[0207]
可移动遗传元件、基因组岛、致病岛等细菌和古细菌的遗传变异可以通过突变、重排以及水平基因转移和重组来实现。越来越多的基因组序列数据已证实,除编码管家功能(例如基本的代谢活性、信息加工、以
及细菌的结构和调节成分)的核心基因之外,还通过可移动遗传元件(mge)的水平基因转移获得了大量的辅助基因,其编码在一定的环境条件下促成适应和存活的抗微生物药抗性、毒素和酶。可移动遗传元件是分子的异质组,所述分子包括质粒、细菌噬菌体、基因组岛、染色体盒、致病岛以及整合和接合元件。基因组岛是范围为10至200 kb的相对大的dna区段,其经常整合到侧翼为16-20 bp直接重复的trna基因簇内。由于它们在gc含量(%g c)和密码子使用方面可以不同于染色体的剩余部分,因此它们被识别为通过水平基因转移获得的离散dna区段。
[0208]
致病岛(pti)是称为基因组岛的水平转移的遗传元件的子集。在金黄色葡萄球菌中存在高度可移动pti的特殊家族,其被某些常居原噬菌体诱导切除且复制。这些pti被包装成小头的噬菌体样颗粒,并且以与噬菌体的噬菌斑形成滴度相称的频率转移。这个过程被称为sapi切除复制包装(erp)周期,而高频sapi转移被称为sapi特异性转移(spst),以将其与经典普遍性转导(cgt)区分开。sapi具有高度保守的遗传组构,其与细菌噬菌体的那种相似,并且将其与所有其它水平获得的基因组岛明确区分开。sapi1编码和sapibov2编码的整合酶用于相应元件的切除和整合两者,并且假定对于其它sapi也是如此。噬菌体80α可以诱导几种不同的sapi,包括sapi1、sapi2和sapibov1,而φ11可以诱导sapibov1,但不能诱导其它两种sapi中任一。
[0209]
参考“staphylococcal pathogenicity island dna packaging system involving cos-site packaging and phage-encoded hnh endonucleases”,quiles-puchalt等人,pnas april 22,2014. 111(16)6016-6021。葡萄球菌属致病岛(sapi)是高度可移动的,并且携带且传播超抗原和其它毒力基因。据报道,sapi使用两种不相关和互补的机制,劫持了它们所侵害的噬菌体的包装机构。噬菌体包装始于在噬菌体dna中特异性序列的识别,取决于噬菌体类型,所述特异性序列称为“pac”或“cos”。sapi策略涉及在sapi基因组中携带辅助噬菌体pac或cos样序列,其确保sapi包装在完全大小的噬菌体颗粒中,取决于辅助噬菌体机构。这些策略干扰了噬菌体繁殖,其最终通过降低噬菌体颗粒的数目而成为细菌群体的关键优点。
[0210]
葡萄球菌属致病岛(sapi)是染色体上定位的可移动遗传元件的广泛家族的原型成员,其基本上促成种内和种间基因转移、宿主适应性和毒力。它们的移动性的关键特点在于通过某些辅助噬菌体诱导sapi切除和复制,并且将其有效地衣壳化为噬菌体样感染性颗粒。大多数sapi使用满头包装机制(headful packaging mechanism),并且编码小末端酶亚基(ters)同系物,其识别sapi特异性pac位点并确定sapi包装特异性。几种已知的sapi并不编码可识别的ters同系物,但仍然被辅助噬菌体有效地包装并且以高频率转移。quiles-puchalt等人报道了非ters编码的sapi之一,sapibov5,并且发现它使用两种不同的未描述的包装策略。sapibov5通过典型的pac型辅助噬菌体或cos型噬菌体包装在完全大小的噬菌体样颗粒中—即,它既具有pac又具有cos位点,并且使用两种不同的噬菌体编码的ters。这是通过cos 噬菌体的sapi包装的一个实例,并且在这点上,它类似大肠杆菌的p4质粒。金黄色葡萄球菌的cos位点包装是另外独特的,因为除大末端酶亚基之外,它还需要仅由cos 噬菌体携带的hnh核酸酶用于cos 位点切割和解链。
[0211]
几种噬菌体可诱导的sapi及其辅助噬菌体的表征已确定pac(满头)机制用于衣壳化。与这个概念一致,一些sapi编码ters的同系物,其与噬菌体编码的大末端酶亚基terl复
合,以使得能够将sapi dna包装在由噬菌体蛋白组成的感染性颗粒中。这些还含有形态发生(cpm)模块,其导致形成与小sapi基因组相称的小衣壳。在最初表征的sapi序列中,有几个不包括ters同系物或cpm同系物,并且几种随后鉴定的来自牛来源的sapi以及来自其它物种的许多噬菌体可诱导的染色体岛也是如此。对于这几个岛,假定它们或者是最初拥有这些基因的元件的缺陷型衍生物,或者存在ters和cpm 基因,但未被同源性识别。
[0212]
quiles-puchalt等人观察到
ϕ
slt/sapibov5包装的一个重要特点是对于hnh核酸酶的需求,所述hnh核酸酶紧靠
ϕ
slt末端酶模块编码。携带hnh结构域的蛋白质在自然界中是普遍的,存在于所有界的生物中。hnh基序是约30-40个aa残基的简并小核酸结合和切割模块,并且由单个二价金属离子结合。在许多不同的细胞过程中起重要作用的各种酶中已发现hnh基序,所述细胞过程包括细菌杀死;dna修复、复制和重组;以及与rna有关的过程。hnh核酸内切酶存在于革兰氏阳性和阴性细菌的许多cos位点细菌噬菌体中,始终与编码末端酶和其它形态发生蛋白的基因相邻。quiles-puchalt等人已证实由
ϕ
12编码的hnh核酸酶和紧密相关的
ϕ
slt具有非特异性核酸酶活性,并且是这些噬菌体和sapibov5的包装所需的。quiles-puchalt等人已显示,hnh和terl对于cos位点切割是共同需要的。quiles-puchalt等人还已观察到,仅革兰氏阴性细菌以及革兰氏阳性细菌的cos 噬菌体编码hnh核酸酶,与相对于pac位点切割的cos位点切割的特殊要求一致,其生成平端产物。hnh核酸酶活性对于一些cos 噬菌体需要,但对于其它cos 噬菌体不需要的证实提示,两种类型的噬菌体的terl蛋白之间存在差异—一种能够切割两条链,而另一种需要第二种蛋白质,以使得能够生成双链切割。
[0213]
在某些配置中,本发明还涉及可移动遗传元件(mge)的使用。因此,提供了下述条款。上文或本文其它地方的本发明的任何其它配置、方面、实施例或描述已作必要的修正与这些条款中的任一组合:1. 一种用于细菌的抗菌处理中的组合物,所述组合物包含改造的可移动遗传元件(mge),其能够在第一物种或菌株的第一细菌宿主细胞中动员,所述细胞包含第一噬菌体基因组,其中在所述细胞中使用由噬菌体编码的蛋白质动员mge,并且抑制第一的复制,其中所述mge编码抗菌剂或编码此类试剂的组分。
[0214]
在替代方案中,代替细菌,宿主细胞是古细菌细胞,并且代替噬菌体,存在能够感染古细菌细胞的病毒。
[0215]
在一个实例中,mge能够整合到包含第一噬菌体的基因组的宿主细胞的基因组内,例如整合到宿主细胞和/或其附加体的染色体中。
[0216]
任选地,mge抑制第一噬菌体复制。
[0217]
在一个实例中,第一噬菌体复制被完全抑制。在一个实例中,与在宿主细胞中不存在mge的复制相比,它降低了至少50、60、70、80或90%。这可以通过标准的体外噬菌斑测定来评价,以确定第一噬菌体噬菌斑形成的相对量。
[0218]
任选地,在试剂的存在下,(i)宿主细胞被抗菌剂杀死;(ii)宿主细胞的生长或增殖降低;和/或(iii)使宿主细胞对抗生素敏感,由此所述抗生素对细胞是有毒的。
[0219]
2. 条款1的组合物,其中所述试剂对与宿主细胞相同物种或菌株的细胞是有毒
的。
[0220]
3. 条款1或2的组合物,其中所述试剂对与宿主细胞的菌株或物种不同的物种或菌株的细胞是有毒的。
[0221]
4. 条款1的组合物,其中所述试剂对与宿主细胞相同物种的细胞是有毒的,并且其中所述宿主细胞已进行改造,使得所述试剂对宿主细胞是无毒的。
[0222]
5. 条款4的组合物,其中所述试剂指导核酸酶系统(任选地,crispr/cas系统),并且与宿主细胞相同物种的细胞包含被核酸酶切割的靶序列,其中所述靶序列在宿主细胞中已被去除或改变,由此所述核酸酶不能切割靶序列。
[0223]
病毒在宿主细胞中经历溶原性周期和裂解周期。如果采用溶原性周期,则噬菌体染色体可以整合到细菌染色体内,或者它可以在宿主中将自身建立为稳定的质粒,在其中它可以保持休眠长时间段。如果溶素原被诱导,则噬菌体基因组从细菌染色体中切除,并且起始裂解周期,其最终为细胞的裂解和噬菌体颗粒的释放。裂解周期导致新噬菌体颗粒的产生,其通过宿主的裂解而释放。
[0224]
6. 任何前述条款的组合物,其中所述第一噬菌体是温和噬菌体。
[0225]
7. 任何前述条款的组合物,其中所述第一细胞包含作为原噬菌体的第一噬菌体。
[0226]
8. 条款1至5中任一项的组合物,其中所述第一噬菌体是裂解性噬菌体。
[0227]
9. 任何前述条款的组合物,其中在第一噬菌体的存在下,mge的动员引起宿主细胞裂解。
[0228]
10. 任何前述条款的组合物,其中所述mge能够包装在包含第一噬菌体的一些,但并非全部结构蛋白的转导颗粒中。
[0229]“转导颗粒”可以是噬菌体或小于噬菌体,并且是能够将编码抗生素或其组分的核酸或其他dna转导到靶细菌细胞内的颗粒。
[0230]
在一些实例中,代替编码抗生素或其组分的核酸,使用编码感兴趣的蛋白质或rna的感兴趣的核酸序列(例如,本文公开的任何nsi)用于在细胞中表达,从转导颗粒的转导可以发生在所述细胞中。
[0231]
结构蛋白的实例是选自主要头蛋白和尾蛋白、门蛋白、尾丝蛋白和次要尾蛋白中的一种、多种或全部的噬菌体蛋白。
[0232] mge包含包装信号序列,其可与由第一噬菌体编码的蛋白质一起工作,以将mge(或至少其编码试剂或者其一种或多种组分的核酸)包装到转导颗粒内,所述转导颗粒能够感染与第一宿主细胞相同物种或菌株的宿主细胞。
[0233]
11. 任何前述条款的组合物,其中所述mge的动员包括将mge或者编码试剂或组分的核酸的拷贝包装到转导颗粒内,所述转导颗粒能够将所述拷贝转移到靶细菌细胞内,用于靶细胞的抗菌处理。
[0234]
12. 条款10或11的组合物,其中所述转导颗粒是能够感染所述第一物种或菌株的细胞的第二噬菌体的颗粒。
[0235]
13. 条款10至12中任一项的组合物,其中所述转导颗粒是非自我复制颗粒。
[0236]“非自我复制的转导颗粒”指这样的颗粒(例如,噬菌体或噬菌体样颗粒;或者由基因组岛(例如,sapi)或其修饰形式产生的颗粒),其能够将编码抗菌剂或组分(或任何蛋白质或rna)的核酸分子递送到细菌细胞内,但不将其自身复制的基因组包装到转导颗粒内。
在本文的替代方案中,代替噬菌体,使用或包装感染动物、人、植物或酵母细胞的病毒。例如,当细胞是人细胞时的腺病毒。
[0237]
14. 任何前述条款的组合物,其中所述mge缺乏编码噬菌体结构蛋白的基因。
[0238]
任选地,mge缺乏一种或多种噬菌体基因rina、ters和terl。
[0239]
在一个实例中,在宿主细胞中,包含小末端酶(由ters编码)和大末端酶(由terl编码)蛋白的蛋白质复合物,能够在pac位点处或附近(cos位点或由mge包含的其它包装信号序列)识别并切割mge的双链dna分子,并且这允许mge或质粒dna分子被包装到噬菌体衣壳内。当第一噬菌体在宿主细胞中作为原噬菌体被诱导时,噬菌体的裂解周期产生了噬菌体的结构蛋白和噬菌体的大末端酶蛋白。复制mge或质粒,并且表达由mge或质粒编码的小末端酶蛋白。将含有ters(以及编码抗菌剂或组分的核苷酸序列)的复制的mge或质粒dna包装到噬菌体衣壳内,导致仅携带mge或质粒dna的非自我复制的转导颗粒。
[0240]
15. 条款1至13中任一项的组合物,其中所述mge包含噬菌体结构基因和包装信号序列,并且所述第一噬菌体缺乏包装信号序列。
[0241]
16. 任何前述条款的组合物,其中所述mge是在第一物种或菌株的细菌细胞中天然发现的mge的修饰形式。
[0242]
17. 任何前述条款的组合物,其中所述mge包含修饰的基因组岛。
[0243]
任选地,基因组岛是在第一物种或菌株的细菌细胞中天然发现的岛。在一个实例中,基因组岛选自sapi、sapi1、sapi2、sapibov1和sapibov2基因组岛。
[0244]
18. 任何前述条款的组合物,其中所述mge包含修饰的致病岛。
[0245]
任选地,致病岛是在第一物种或菌株的细菌细胞中天然发现的岛,例如葡萄球菌属sapi或弧菌属ple或铜绿假单胞菌致病岛(例如papi或pagi,例如papi-1、pagi-5、pagi-6、pagi-7、pagi-8、pagi-9、pagi-10或pagi-19. 条款18的组合物,其中所述致病岛是sapi(金黄色葡萄球菌致病岛)。
[0246]
20. 条款19的组合物,其中所述第一噬菌体是
ϕ
11、80α、
ϕ
12或
ϕ
slt。
[0247]
葡萄球菌属噬菌体80α似乎动员了所有已知的sapi。因此,在一个实例中,mge包含修饰的sapi,并且第一噬菌体是80α。
[0248]
21. 条款18的组合物,其中所述致病岛是霍乱弧菌ple(噬菌体诱导性染色体岛样元件),并且任选地,所述第一噬菌体是icp1。
[0249]
22. 条款18的组合物,其中所述致病岛是大肠杆菌ple。
[0250]
23. 条款1至16中任一项的组合物,其中所述mge包含p4 dna,例如p4包装信号序列。
[0251]
24. 条款23的组合物,其中所述第一噬菌体是p2噬菌体或自我复制缺陷的修饰的p2噬菌体;任选地作为原噬菌体存在。
[0252]
25. 任何前述条款的组合物,其中所述mge包含肠杆菌科细菌噬菌体p1的paca基因。
[0253]
26. 任何前述条款的组合物,其中所述mge包含包装起始位点序列,任选地p1的包装起始位点序列。
[0254]
27. 任何前述条款的组合物,其中所述mge包含对第一物种或菌株的细胞有益的核苷酸序列,任选地编码对第一物种或菌株的细胞有益的蛋白质。
[0255]
这在以下情况下是有用的:mge的存在不仅降低宿主细胞中的第一噬菌体复制,而且mge被吸收并且可以对宿主细胞提供存活、生长或其它益处,促进mge被宿主细胞的摄取和/或保留。在一个实例中,抗菌剂在宿主细胞中的表达处于诱导型启动子或弱启动子的控制下,以允许其中由于对第一物种或菌株的细胞有益的核苷酸序列的存在,mge摄取到宿主细胞内可能是有利的时期。
[0256]
28. 任何前述条款的组合物,其中所述mge缺乏rina。
[0257]
29. 任何前述条款的组合物,其中所述mge缺乏terl。
[0258]
30. 任何前述条款的组合物,其中所述mge包含ters或其同源物,并且任选地缺乏任何其它末端酶基因。
[0259]
ters同源物是这样的序列,其如同ters,识别由mge或质粒包含的sapi特异性pac位点(或其它包装序列),并且确定用于包装mge的包装特异性。
[0260]
末端酶基因的实例是paca、pacb、tera、terb和terl。
[0261]
31. 任何前述条款的组合物,其中所述第一噬菌体是可与由mge包含的pac一起工作的pac型噬菌体(例如
ϕ
11或80α)。
[0262]
32. 条款1至30中任一项的组合物,其中所述第一噬菌体是可与由mge包含的cos一起工作的cos型噬菌体(例如
ϕ
12或
ϕ
slt)。
[0263]
任选地,噬菌体是p2。任选地,第一噬菌体是t7或t7样噬菌体,其识别由mge包含的直接重复序列用于包装。
[0264]
33. 任何前述条款的组合物,其中所述质粒或mge包含pac和/或cos序列或其同源物。
[0265]
34. 任何前述条款的组合物,其中所述质粒或mge包含ters或其同源物,并且任选地缺乏terl。
[0266]
ters同源物是这样的序列,其如同ters,识别由mge或质粒包含的sapi特异性pac位点(或其它包装序列),并且确定用于包装mge的包装特异性。
[0267]
在一个实例中,ters包含seq id no:1的序列。
[0268]
35. 条款34的组合物,其中所述ters是金黄色葡萄球菌细菌噬菌体φ80α ters或细菌噬菌体φ11 ters。
[0269]
36. 任何前述条款的组合物,其中所述mge是修饰的sapibov1或sapibov5,并且缺乏ters。
[0270]
37. 任何前述条款的组合物,其中所述第一噬菌体缺乏功能性包装信号序列,并且所述mge包含可与由第一噬菌体编码的蛋白质一起工作的包装信号序列,用于产生包装mge的拷贝或者编码试剂或组分的核酸的拷贝的转导颗粒。
[0271]
38. 任何前述条款的组合物,其中所述mge或质粒包含ppi或同源物,其能够与第一噬菌体ters复合,从而阻断ters的功能。
[0272]
39. 任何前述条款的组合物,其中所述mge包含形态发生(cpm)模块。
[0273]
40. 任何前述条款的组合物,其中所述mge包含cpma和/或cpmb。
[0274]
任选地,cpma和b来自本文公开的任何sapi。在一个实例中,任何sapi是表2中公开的sapi,并且任选地,宿主细胞或靶细胞是表中公开的任何相应的葡萄球菌。
[0275]
41. 任何前述条款的组合物,其中所述mge或第一噬菌体包含一种、多种或所有基
因cp1、cp2和cp3。
[0276]
在一个实例中,mge包含修饰的sapi,并且包含一种、多种或所有基因cp1、cp2和cp3。
[0277]
42. 任何前述条款的组合物,其中所述mge或第一噬菌体编码hnh核酸酶。
[0278]
43. 任何前述条款的组合物,其中所述mge或第一噬菌体包含整合酶基因,其编码用于切除mge且将mge整合到细菌细胞基因组内的整合酶。
[0279]
44. 任何前述条款的组合物,其中所述mge缺乏功能性整合酶基因,并且所述第一噬菌体或宿主细胞基因组(例如细菌染色体或细菌附加体)包含功能性整合酶基因。
[0280]
45. 任何前述条款的组合物,其中所述mge核酸的转录处于组成型启动子的控制下,用于在宿主细胞中转录试剂或组分的拷贝。
[0281]
任选地,当靶细胞应该被杀死时,例如在医学环境中,可以使用试剂在靶细胞中的组成性转录和产生。
[0282]
任选地,mge核酸的转录处于诱导型启动子的控制下,用于在宿主细胞中转录试剂或组分的拷贝。这可以用于例如控制如在环境(例如土壤或水)中、或者在含有靶细胞的工业培养物或发酵容器中,针对靶细菌细胞的抗菌活性的开启。例如,靶细胞可以用于工业工艺中(例如用于发酵,例如在酿造或乳品工业中),并且诱导使得能够通过使用针对靶细菌的抗菌剂来控制(例如,停止或降低)该工艺。
[0283]
46. 条款45的组合物,其中所述启动子对于宿主细胞是外源的。
[0284]
47. 条款45或46的组合物,其中所述启动子包含与宿主细胞的内源启动子序列具有至少80%同一性的核苷酸序列。
[0285]
48. 任何前述条款的组合物,其包含与mge分开的核酸,其中所述核酸包含产生第一噬菌体颗粒所需的所有基因。
[0286]
49. 条款1至47中任一项的组合物,其包含与mge分开的核酸,其中所述核酸包含少于产生第一噬菌体颗粒所需的所有基因,但包含编码用于产生转导颗粒的结构蛋白的基因,所述转导颗粒包装编码抗菌剂或者其一种或多种组分的mge核酸。
[0287]
当试剂包括多种组分时,例如,其中试剂是crispr/cas系统,或者是编码crrna的crispr阵列或编码可与宿主细胞中的cas一起工作的指导rna(例如,单个指导rna)的核酸,其中所述crrna或grna将cas引导至宿主细胞中的靶序列,以修饰靶(例如,切割靶或阻遏其转录)。
[0288]
50. 条款48或49的组合物,其中所述基因由宿主细胞染色体和/或一种或多种宿主细胞附加体包含。
[0289]
51. 条款50的组合物,其中所述基因由第一噬菌体的染色体整合的原噬菌体包含。
[0290]
52. 任何前述条款的组合物,其中所述试剂是指导核酸酶系统或其组分,其中所述试剂能够识别且切割宿主细胞dna(例如染色体dna)。
[0291]
在一个实例中,此类切割引起下述中的一种或多种:-(i)宿主细胞被抗菌剂杀死;(ii)宿主细胞的生长或增殖降低;和/或(iii)使宿主细胞对抗生素敏感,由此所述抗生素对细胞是有毒的。
[0292]
53. 条款52的组合物,其中所述指导核酸酶系统选自crispr/cas系统、talen系统、大范围核酸酶系统或锌指系统。
[0293]
54. 条款52的组合物,其中所述系统是crispr/cas系统,并且每个mge编码(a)编码crrna的crispr阵列,或(b)编码指导rna(grna,例如单个指导rna)的核酸,其中所述crrna或grna可与靶细菌细胞中的cas一起工作,其中所述crrna或grna将cas引导至宿主细胞中的靶核酸序列,以修饰靶序列(例如,切割靶或阻遏其转录)。
[0294]
任选地,cas是由宿主细胞的功能性内源核酸编码的cas。例如,靶由宿主细胞的dna或rna包含。
[0295]
55. 条款52的组合物,其中所述系统是crispr/cas系统,并且每个mge编码cas(例如,cas核酸酶),其可在靶细菌细胞中工作,以修饰由靶细胞包含的靶核酸序列。
[0296]
56. 条款53、54或55的组合物,其中所述cas是cas3、cas9、cas13、casx、casy或cpf1。
[0297]
57. 条款52至56中任一项的组合物,其中所述系统是crispr/cas系统,并且每个mge编码一种或多种级联cas(例如,cas、a、b、c、d和e)。
[0298]
58. 条款52至57中任一项的组合物,其中每个mge进一步编码cas3,其可在靶细菌细胞中与级联cas一起工作。
[0299]
59. 任何前述条款的组合物,其中所述第一物种或菌株是革兰氏阳性物种或菌株。
[0300]
60. 条款1至58中任一项的组合物,其中所述第一物种或菌株是革兰氏阴性物种或菌株。
[0301]
61. 任何前述条款的组合物,其中所述第一物种或菌株选自表1。
[0302]
在一个实例中,菌株的第一物种是葡萄球菌属(例如,金黄色葡萄球菌)物种或菌株,并且任选地,mge是修饰的sapi;并且任选地,第一噬菌体是φ80α或φ11。在一个实例中,菌株的第一物种是弧菌属(例如,霍乱弧菌)物种或菌株,并且任选地,mge是弧菌属(例如霍乱弧菌)ple。
[0303]
62. 任何前述条款的组合物,其中所述第一物种或菌株选自志贺氏菌属、大肠杆菌、沙门氏菌属、沙雷氏菌属、克雷伯氏菌属、耶尔森菌属、假单胞菌属和肠杆菌属。
[0304]
这些是p2噬菌体可以感染的物种。因此,在一个实施方案中,mge包含一种或多种p4序列(例如,p4包装序列),并且第一噬菌体是p2。因此,mge被p2结构蛋白包装,并且所得的转导颗粒可以感染广谱物种,即志贺氏菌属、大肠杆菌、沙门氏菌属、沙雷氏菌属、克雷伯氏菌属、耶尔森菌属、假单胞菌属和肠杆菌属中的两种或更多种。
[0305]
63. 一种核酸载体,其包含整合在其中的mge,其中所述mge根据任何前述条款,并且所述载体能够将mge或其拷贝转移到宿主细菌细胞内。
[0306]
合适的载体是质粒(例如,接合质粒)或病毒(例如,噬菌体或包装的噬菌粒)。
[0307]
64. 条款63的载体,其中所述载体是穿梭载体。
[0308]
穿梭载体是这样构建的载体(通常为质粒),使得它可以在两个不同的宿主物种中繁殖。因此,插入穿梭载体内的dna可以在两个不同的细胞类型中进行测试或操作。
[0309]
65. 条款63的载体,其中所述载体是质粒,其中所述质粒能够被转化到包含第一噬菌体的宿主细菌细胞内。
[0310]
66. 一种非自我复制的转导颗粒,其包含任何前述条款的所述mge或载体。
[0311]“非复制”意指mge本身不能自我复制。例如,mge缺乏编码蛋白质(例如,结构蛋白)的核苷酸序列,所述蛋白质是产生包含mge的拷贝的转导颗粒所需的。
[0312]
67. 一种包含多个转导颗粒的组合物,其中每个颗粒包含根据条款1至65中任一项的mge或载体,其中所述转导颗粒能够将mge、或者编码试剂或组分的核酸或其拷贝转移到靶细菌细胞内,其中a. 靶细胞被抗菌剂杀死;b. 靶细胞的生长或增殖降低;或c. 使靶细胞对抗生素敏感,由此所述抗生素对细胞是有毒的。
[0313]
在一个实例中,宿主细胞的生长或增殖中的降低为至少50、60、70、80、90或95%。抗生素可以是本文公开的任何抗生素。
[0314]
68. 条款67的组合物,其中所述试剂是指导核酸酶系统或其组分,其中所述试剂能够识别且切割宿主细胞dna(例如染色体dna),由此a. 靶细胞被抗菌剂杀死;b. 靶细胞的生长或增殖降低;或c. 使靶细胞对抗生素敏感,由此所述抗生素对细胞是有毒的。
[0315]
69. 一种组合物,其包含多个非自我复制的转导颗粒,其中每个颗粒包含根据条款1至65中任一项的mge或质粒,其中所述转导颗粒能够将mge、或者编码试剂或组分的核酸或其拷贝转移到靶细菌细胞内,其中所述试剂是crispr/cas系统,并且所述组分包含编码crrna或指导rna的核酸,所述核酸可与靶细菌细胞中的cas一起工作,以将cas引导至细胞的靶核酸序列以修饰序列,由此a. 靶细胞被抗菌剂杀死;b. 靶细胞的生长或增殖降低;或c. 使靶细胞对抗生素敏感,由此所述抗生素对细胞是有毒的。
[0316]
在一个实例中,宿主细胞的生长或增殖中的降低为至少50、60、70、80、90或95%。抗生素可以是本文公开的任何抗生素。
[0317]
70. 一种试剂盒,其包含条款69的组合物和所述抗生素。
[0318]
71. 条款69的组合物,其中所述组合物包含所述抗生素。
[0319]
72. 条款67至69中任一项的组合物,其中由所述组合物包含的少于10%的转导颗粒是第一噬菌体颗粒。
[0320]
73. 条款67至69中任一项的组合物,其中所述组合物中不存在第一噬菌体颗粒。
[0321]
74. 任何前述条款的mge、载体、颗粒、组合物或试剂盒,其用于人或动物患者中的医学用途。
[0322]
75. 任何前述条款的mge、载体、颗粒、组合物或试剂盒,其用于治疗或预防人或动物患者中由靶细菌细胞的感染,其中所述抗菌剂对靶细胞是有毒的。
[0323]
76. 任何前述条款的mge、载体、颗粒、组合物或试剂盒,其用于治疗或预防人或动物患者中由靶细菌细胞的感染,其中在抗菌剂的存在下a. 靶细胞被抗菌剂杀死;b. 靶细胞的生长或增殖降低;和/或
c. 使靶细胞对抗生素敏感,由此所述抗生素对细胞是有毒的。
[0324]
77. 一种产生多个转导颗粒的方法,所述方法包括将条款1至62、67至69和71至76中任一项的组合物与所述第一物种的宿主细菌细胞组合,其中所述细胞包含第一噬菌体,允许将多个所述mge引入宿主细胞内,并且在其中表达第一噬菌体编码的蛋白质,并且通过第一噬菌体蛋白包装mge拷贝的条件下,培养宿主细胞以产生多个转导颗粒,并且任选地将转导颗粒与细胞分开,并获得与细胞分开的多个转导颗粒。
[0325]
78. 条款77的方法,其包括任选地通过过滤或离心,从任何第一噬菌体中分离转导颗粒,从而在不存在第一噬菌体的情况下获得多个转导颗粒。
[0326]
79. 条款77或78的方法,其中所述颗粒编码指导核酸酶系统(任选地,crispr/cas系统)或其组分,用于切割由靶细菌细胞包含的靶核酸序列。
[0327]
80. 条款79的方法,其中所述序列由抗生素抗性基因包含,并且所述方法包括将多种颗粒与试剂盒或混合物中的所述抗生素组合。
[0328]
81. 条款77至80中任一项的方法,其中所述条件包括诱导第一噬菌体的裂解周期。
[0329]
82. 一种细菌宿主细胞,其包含第一噬菌体和如条款1至66项中任一项中所述的mge、载体或颗粒,其中所述试剂对与宿主细胞相同物种的细胞是有毒的,并且其中所述宿主细胞已进行改造,使得所述试剂对宿主细胞是无毒的。
[0330]
83. 一种细菌宿主细胞,其包含第一噬菌体,其中所述细胞由试剂盒包含,所述试剂盒进一步包含如条款1至62、67至69和71至76中任一项中所述的组合物,其中所述试剂对与宿主细胞相同物种的细胞是有毒的,并且其中所述宿主细胞已进行改造,使得所述试剂对宿主细胞是无毒的。
[0331]
84. 条款83的细胞,其中所述试剂指导核酸酶系统(任选地,crispr/cas系统),并且与宿主细胞相同物种的细胞包含被核酸酶切割的靶序列,其中所述靶序列在宿主细胞中已被去除或改变,由此所述核酸酶不能切割靶序列。
[0332]
85. 一种细菌宿主细胞,其包含第一噬菌体和如条款1至66中任一项中所述的mge、载体或颗粒,其中所述试剂对宿主细胞是无毒的,但所述试剂对与宿主细胞的物种或菌株不同的物种或菌株的第二细胞是有毒的,其中所述mge在可由宿主细胞产生的转导颗粒中是可动员的,所述转导颗粒能够将mge或其拷贝转移到所述第二细胞内,由此使所述第二细胞暴露于抗菌剂。
[0333]
86. 一种细菌宿主细胞,其包含第一噬菌体,其中所述细胞由试剂盒包含,所述试剂盒进一步包含如条款1至62、67至69和71至76中任一项中所述的组合物,其中所述试剂对宿主细胞是无毒的,但所述试剂对与宿主细胞的物种或菌株不同的物种或菌株的第二细胞是有毒的,其中所述mge在可由宿主细胞产生的转导颗粒中是可动员的,所述转导颗粒能够将mge或其拷贝转移到所述第二细胞内,由此使所述第二细胞暴露于抗菌剂。
[0334]
87. 条款86的细胞,其中所述第一噬菌体是原噬菌体。
[0335]
88. 一种细菌宿主细胞,其包含如条款1至66中任一项中所述的mge、载体或颗粒以及在一个或多个诱导型启动子的控制下的核酸,其中所述核酸编码产生转导颗粒所需的所有结构蛋白,所述转导颗粒包装mge或质粒的拷贝,其中所述试剂对宿主细胞是无毒的,但所述试剂对与宿主细胞的物种或菌株不同的物种或菌株的第二细胞是有毒的,其中所述
mge在可由宿主细胞产生的转导颗粒中是可动员的,所述转导颗粒能够将mge或其拷贝转移到所述第二细胞内,由此使所述第二细胞暴露于抗菌剂。
[0336]
89. 条款88的细胞,其中所述结构蛋白是裂解性噬菌体的结构蛋白。
[0337]
90. 条款88或89的细胞,其中所述核酸包含ters和/或terl。
[0338]
91. 条款88至90中任一项的细胞,其中所述宿主细胞和第二细胞是相同物种,并且所述宿主细胞已进行改造,使得所述抗生素对宿主细胞是无毒的。
[0339]
92. 条款88至91中任一项的细胞,其中所述核酸由质粒包含。
[0340]
93. 条款88至92中任一项的细胞,其中所述试剂是指导核酸酶系统(任选地,crispr/cas系统),并且所述第二细胞包含被所述核酸酶切割的靶序列,其中所述靶序列不存在于宿主细胞的基因组中,由此所述核酸酶不能切割宿主细胞的基因组。
[0341]
94. 任何前述条款的组合物、载体、颗粒、试剂盒或方法,其中所述细胞、宿主细胞或靶细胞选自葡萄球菌属、弧菌属、假单胞菌属、梭菌属、大肠杆菌、幽门螺杆菌、克雷伯氏菌属和沙门氏菌属细胞。
[0342]
95. 一种质粒,其包含a. 编码用于在靶细菌细胞中表达的抗菌剂或其组分的核苷酸序列;b. 用于控制试剂或组分表达的组成型启动子;c. 任选的ters核苷酸序列;d. 复制起点(ori);和e. 噬菌体包装序列(任选地pac、cos或其同源物);和f. 缺乏以下的质粒g. 编码对于产生转导颗粒(任选地噬菌体)所需的噬菌体结构蛋白的所有核苷酸序列,或质粒缺乏至少一种此类序列;和h. 任选地terl。
[0343]
96. 条款95的质粒,其中所述抗菌剂是crispr/cas系统,并且所述质粒编码crrna或指导rna(例如,单个grna),其可与靶细胞中的cas一起工作,以将cas引导至靶核苷酸序列,以修饰(例如切割)序列,由此a. 靶细胞被抗菌剂杀死;b. 靶细胞的生长或增殖降低;或c. 使靶细胞对抗生素敏感,由此所述抗生素对细胞是有毒的。
[0344]
97. 条款95或96的质粒,其中所述抗菌剂是crispr/cas系统,并且所述质粒编码cas,其可与靶细胞中的crrna或指导rna(例如,单个grna)一起工作,以将cas引导至靶核苷酸序列,以修饰(例如切割)序列,由此a. 靶细胞被抗菌剂杀死;b. 靶细胞的生长或增殖降低;或c. 使靶细胞对抗生素敏感,由此所述抗生素对细胞是有毒的。
[0345]
98. 条款97的质粒,其中所述质粒进一步编码所述crrna或grna。
[0346]
99. 一种宿主细胞,其包含条款95至98中任一项的质粒,其中所述宿主细胞不包含靶核苷酸序列。
[0347]
100. 条款99的宿主细胞,其中所述细胞能够复制质粒,并且将复制的质粒包装在
能够感染靶细菌细胞的转导颗粒中。
[0348]
101. 条款99或100的宿主细胞,其中所述宿主细胞包含在细胞染色体和/或细胞的一个或多个附加体中整合的,a.terl;b. 任选的ters;和c. 可表达的核苷酸序列,其编码产生转导颗粒所需的所有结构蛋白,所述转导颗粒包装质粒的拷贝;d. 其中所述细胞的染色体和附加体(除所述质粒外)缺乏噬菌体包装序列,其中由所述质粒包含的噬菌体包装序列在包装质粒的生产中可连同所述ters和terl的产物一起工作。
[0349]
102. 条款101的细胞,其中所述terl、任选的ters和编码结构蛋白的核苷酸序列由宿主细胞中的噬菌体(任选地原噬菌体)基因组包含。
[0350]
103. 一种细菌宿主细胞,其包含不能自我复制的辅助噬菌体的基因组,任选地其中所述基因组作为原噬菌体存在,以及根据条款95至98中任一项的质粒,其中所述辅助噬菌体可操作以在转导颗粒中包装质粒的拷贝,其中所述颗粒能够感染抗菌剂对其有毒的细菌靶细胞。
[0351]
104. 条款103的细胞,其中所述宿主细胞是第一物种或菌株的细胞,并且所述靶细胞是相同物种或菌株,并且任选地,其中所述宿主细胞是抗菌剂对其无毒的改造细胞。
[0352]
105. 条款103的细胞,其中所述宿主细胞是第一物种或菌株的细胞,而所述靶细胞是不同物种或菌株,其中所述抗菌剂对宿主细胞是无毒的。
[0353]
106. 一种制备多个转导颗粒的方法,所述方法包括培养根据条款103至105中任一项的多种宿主细胞,任选地诱导辅助噬菌体的裂解周期,并且在其中产生包含质粒的包装拷贝的转导颗粒的条件下温育细胞,并且任选地从细胞中分离颗粒,以获得多个转导颗粒。
[0354]
107. 可通过条款106的方法获得的多个转导颗粒,其用于医学中,例如用于治疗或预防人或动物受试者被靶细菌细胞感染,其中将转导颗粒施用于受试者,用于感染靶细胞并使用抗菌剂杀死细胞。
[0355]
108. 一种制备多个转导颗粒的方法,所述方法包括i. 产生宿主细胞,其基因组包含编码产生转导颗粒所需的结构蛋白的核酸,所述转导颗粒可以包装第一dna,其中所述基因组缺乏噬菌体包装信号,其中所述蛋白质的表达处于诱导型启动子的控制下;ii. 产生编码抗菌剂或其组分的第一dna(例如,如任何前述条款中定义的),其中所述dna包含噬菌体包装信号;iii. 将dna引入宿主细胞内;iv. 诱导宿主细胞中结构蛋白的产生,由此产生包装dna的转导颗粒;v. 任选地分离多个转导颗粒;和vi. 任选地将颗粒配制成药物组合物,用于施用于人或动物用于医学用途。
[0356]
109. 条款108的方法,其中所述dna包含如任何前述条款中定义的mge。
[0357]
110. 条款108或109的方法,其中所述结构蛋白是p2噬菌体蛋白,并且任选地,所
述包装信号是p4噬菌体包装信号。
[0358]
111. 条款108或109的方法,其中所述dna包含修饰的sapi或基因组岛dna。
[0359]
112. 条款108至111中任一项的方法,其中步骤(iv)中的细胞包含编码辅助噬菌体活化剂的基因,任选地,当结构蛋白是p2蛋白时,所述活化剂是p4噬菌体δ或ogr蛋白;或者当mge包含修饰的sapi时,所述活化剂是sapi rina、ptia、ptib或ptim;并且任选地,所述活化剂的表达由诱导型启动子例如t7启动子控制。
[0360]
113. 条款108至112中任一项的方法,其中所述包装信号是p4噬菌体sid和/或psu;或所述信号是sapi cpma和/或cpmb。
[0361]
这可用于将dna包装到较小的衣壳内。
[0362]
114. 条款108至113中任一项的方法,其中所述细胞基因组包含原噬菌体,其中每个原噬菌体包含编码结构蛋白的所述核酸。
[0363]
115. 条款114的方法,其中所述原噬菌体是p2原噬菌体,其缺乏cos,以及任选地选自int、cox orf78、b、orf80、orf81、orf82、orf83、a、orf91、tin、old、orf30和fun(z)的一种、多种或所有基因;并且任选地,(ii)的包装信号是cos或p4包装信号。
[0364]
116. 条款114或115的方法,其中所述原噬菌体是缺乏cos,并且包含从q到s、v到g和fi到ogr的基因的p2原噬菌体。
[0365]
117. 条款114的方法,其中所述原噬菌体是缺乏包装信号,并且包含基因29(ters)至基因53(溶素)的phi11原噬菌体;并且任选地,(ii)的包装信号是phi11包装信号。
[0366]
118. 多个转导颗粒,其可通过条款108至117中任一项的方法获得。
[0367]
119. 条款118的颗粒,其用于施用于人或动物用于医学用途。
[0368]
本发明的进一步概念如下:本发明任选地用于工业或家庭用途,或用于此类用途的方法中。例如,它用于或可用于农业、油或石油工业、食品或饮料工业、服装工业、包装工业、电子工业、计算机工业、环境工业、化学工业、航空航天工业、汽车工业、生物技术工业、医疗工业、卫生保健业、牙科行业、能源工业、消费品行业、制药工业、采矿工业、清洁行业、林业产业、渔业、休闲产业、回收行业、化妆品工业、塑料工业、纸浆或造纸工业、纺织工业、服装工业、皮革或绒面革或动物皮工业、烟草工业或钢铁工业。
[0369]
本发明任选地用于工业中或环境是工业环境,其中所述工业是选自以下的领域的工业:医疗和卫生保健;制药;人食品;动物食品;植物肥料;饮料;乳制品;肉类加工;农业;畜牧业;家禽养殖;鱼类和贝类养殖;兽医;油;天然气;石油化学;水处理;污水处理;包装;电子和计算机;个人卫生保健和日化;化妆品;牙科;非医疗牙科;眼科;非医疗眼科;矿物开采和加工;金属开采和加工;采石;航空;汽车;铁路;航运;航天;环境;土壤处理;纸浆和造纸;服装制造;染料;印刷;胶粘剂;空气处理;溶剂;生物防御;维生素补充剂;冷藏;纤维脱胶和生产;生物技术;化学;工业清洁产品;家庭清洁用品;肥皂和洗涤剂;消费产品;林业;钓鱼;休闲;回收;塑料;皮、皮革和绒面革;废物管理;丧葬和殡仪;燃料;建筑;能源;钢;以及烟草工业领域。
[0370]
在一个实例中,第一dna、第一噬菌体或载体包含靶向靶细菌的crispr阵列,其中所述阵列包含一种、或两种或更多种间隔区(例如2、3、4、5、6、7、8、9 ,10、20、30、40、50种或更多种间隔区),用于靶向细菌的基因组。
[0371]
在一个实例中,靶细菌被如下环境包含。在一个实例中,环境是人的微生物群系,例如口腔微生物群系或肠道微生物群系或血流。在一个实例中,环境不是人之中或之上的环境。在一个实例中,环境不是非人动物之中或之上的环境。在一个实施例中,环境是空气环境。在一个实施例中,环境是农业环境。在一个实施例中,环境是油或石油采收环境,例如油或石油田或井。在一个实例中,环境是用于人或非人动物消费的食品或饮料之中或之上的环境。
[0372]
在一个实例中,环境是人或动物微生物群系(例如,肠道、阴道、头皮、腋窝、皮肤或口腔微生物群系)。在一个实例中,靶细菌由人或动物微生物群系(例如,肠道、阴道、头皮、腋窝、皮肤或口腔微生物群系)包含。
[0373]
在一个实例中,将本发明的dna、噬菌体或组合物鼻内、局部或经口施用于人或非人动物,或者用于此类施用。旨在治疗人或动物的微生物群系的技术人员能够确定最佳的施用途径,这取决于目标微生物群系。例如,当微生物群系是肠道微生物群系时,施用可以是鼻内或经口的。当微生物群系是头皮时或腋窝微生物群系,施用可以是局部的。当微生物群系在口或咽喉中时,施用可以是经口的。
[0374]
在本文的任何用途或方法中,在一个实施方案中,第一噬菌体以至少0.5、1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、110、120、130、140、150、160、170、180、190、200、300、400、500、600或700的感染复数(moi)与靶细菌接触。例如,moi为20至200、20至100、50至200、50至100、75至150、100或约100、或200或约200。在一个实例中,这可以通过以下进行测定:获得含有靶细菌的微生物群系样品(例如,水路样品或受试者的肠道微生物群系样品),并且测定样品中的cfu/ml或mg数目,并且使用这点滴定以所需moi暴露于微生物群系或者施用于待处理的环境或受试者的噬菌体剂量。
[0375]
在一个实例中,环境被饮料或水(例如,水路或用于人消费的饮用水)或土壤所包含。水任选地在加热、冷却或工业系统中,或者在饮用水贮存容器中。
[0376]
在一个实例中,宿主和/或靶细菌是选自以下的厚壁菌门:anaerotruncus、醋厌氧小杆菌属(acetanaerobacterium)、聚乙酸菌属(acetitomaculum)、醋弧菌属(acetivibrio)、厌氧球菌属(anaerococcus)、厌氧细杆菌属(anaerofilum)、厌氧弯曲菌属(anaerosinus)、厌氧棒状菌属(anaerostipes)、anaerovorax、丁酸弧菌属(butyrivibrio)、梭菌属、capracoccus、脱卤素杆菌属(dehalobacter)、小类杆菌属(dialister)、多尔氏菌属(dorea)、肠球菌属、产乙醇杆菌属(ethanoligenens)、普拉梭菌属(faecalibacterium)、梭杆菌属(fusobacterium)、细杆菌属(gracilibacter)、古根海姆艾拉菌属(guggenheimella)、赫斯佩尔氏菌属(hespellia)、羊毛小杆菌属(lachnobacterium)、毛螺菌属(lachnospira)、乳杆菌属、明串球菌属(leuconostoc)、巨单胞菌属(megamonas)、moryella、光冈菌属(mitsuokella)、口小杆菌属(oribacterium)、产醋杆菌属(oxobacter)、乳头杆菌属(papillibacter)、proprionispira、假丁酸弧菌属(pseudobutyrivibrio)、假支杆菌属(pseudoramibacter)、罗斯氏菌属(roseburia)、瘤胃球菌属(ruminococcus)、八叠球菌属(sarcina)、清野氏菌属(seinonella)、shuttleworthia、孢杆菌属(sporobacter)、孢小杆菌属(sporobacterium)、链球菌属、罕见小球菌属(subdoligranulum)、互营球菌属(syntrophococcus)、热芽孢杆菌属(thermobacillus)、turibacter和魏斯氏菌属(weisella)。
[0377]
在一个实例中,试剂盒、dna、第一噬菌体、辅助噬菌体、组合物、用途或方法用于降低致病性感染或用于重新平衡肠道或口腔微生物群,例如用于治疗或预防人或动物中的肥胖或疾病。例如,第一噬菌体、辅助噬菌体、组合物、用途或方法用于击倒人或动物的肠道微生物群中的艰难梭菌或大肠杆菌细菌。
[0378]
在一个实例中,包装信号、npf和/或hpf由以下组成或包含以下:seq id no:2或者其结构或功能同源物。
[0379]
在一个实例中,包装信号、npf和/或hpf由以下组成或包含以下:seq id no:2或者与其具有至少70、75、80、85、90、91、92、93、94、95、96、97、98或99%同一性的核苷酸序列。
[0380]
在一个实例中,疾病或状况是癌症、炎性或自身免疫性疾病或状况,例如肥胖、糖尿病ibd、消化道状况或口腔状况。
[0381]
任选地,环境由以下包含或者靶细菌由以下包含:肠道微生物群、皮肤微生物群、口腔微生物群、咽喉微生物群、头发微生物群、腋窝微生物群、阴道微生物群、直肠道微生物群、肛门微生物群、眼微生物群、鼻微生物群、舌微生物群、肺微生物群、肝微生物群、肾微生物群、生殖器微生物群、阴茎微生物群、阴囊微生物群、乳腺微生物群、耳微生物群、尿道微生物群、唇部微生物群、器官微生物群或牙齿微生物群。任选地,环境由以下包含或者靶细菌由以下包含:植物(例如,烟草、农作物、水果植物、蔬菜植物或烟草,例如在植物的表面上或包含在植物中)、或环境(例如,土壤或水或水路或水性液体)。
[0382]
任选地,人或动物受试者的疾病或状况选自(a)神经退行性疾病或状况;(b)脑疾病或状况;(c)cns疾病或状况;(d)记忆丧失或损害;(e)心脏或心血管疾病或状况,例如心脏病发作、中风或心房颤动;(f)肝疾病或状况;(g)肾疾病或状况,例如慢性肾疾病(ckd);(h)胰腺疾病或状况;(i)肺疾病或状况,例如囊性纤维化或copd;(j)胃肠道疾病或状况;(k)咽喉或口腔疾病或状况;(l)眼疾病或状况;(m)生殖器疾病或状况,例如阴道、阴唇、阴茎或阴囊疾病或状况;(n)性传播疾病或状况,例如淋病、hiv感染、梅毒或衣原体属感染;(o)耳疾病或状况;(p)皮肤疾病或状况;(q)心脏疾病或状况;(r)鼻疾病或状况(s)血液疾病或状况,例如贫血,例如慢性疾病或癌症的贫血;(t)病毒感染;(u)致病性细菌感染;
(v)癌症;(w)自身免疫性疾病或状况,例如sle;(x)炎性疾病或状况,例如类风湿性关节炎、银屑病、湿疹、哮喘、溃疡性结肠炎、结肠炎、克罗恩氏病或ibd;(y)自闭症;(z)adhd;(aa)双相型障碍;(bb)als [肌萎缩侧索硬化];(cc)骨关节炎;(dd)先天性或发育缺陷或状况;(ee)流产;(ff)血液凝固状况;(gg)支气管炎;(hh)干性或湿性amd;(ii)新生血管形成(例如肿瘤或眼内);(jj)普通感冒;(kk)癫痫;(ll)纤维化,例如肝或肺纤维化;(mm)真菌疾病或状况,例如鹅口疮;(nn)代谢疾病或状况,例如肥胖、厌食、糖尿病、i型或ii型糖尿病;(oo)溃疡,例如胃溃疡或皮肤溃疡;(pp)皮肤干燥;(qq)干燥综合征(rr)细胞因子风暴;(ss)耳聋、听力损失或损害;(tt)新陈代谢缓慢或快速(即,慢于或快于受试者重量、性别和年龄的平均值);(uu)受孕障碍,例如不育或低生育力;(vv)黄疸;(ww)皮疹;(xx)川崎病;(yy)莱姆病;(zz)过敏,例如坚果、草、花粉、尘螨、猫或犬的皮毛或皮屑过敏;(aaa)疟疾、伤寒、结核病或霍乱;(bbb)抑郁症;(ccc)智力低下;(ddd)小头畸形;(eee)营养不良;(fff)结膜炎;(ggg)肺炎;
(hhh)肺栓塞;(iii)肺动脉高压;(jjj)骨病症;(kkk)败血症或败血性休克;(lll)鼻窦炎;(mmm)应激(例如职业应激);(nnn)地中海贫血、贫血、血管性血友病或血友病;(ooo)带状疱疹或唇疱疹;(ppp)月经;(qqq)精子数量少。
[0383]
用于通过本发明治疗或预防的神经退行性或cns疾病或状况在一个实例中,神经退行性或cns疾病或状况选自阿尔茨海默氏病、老年精神病、唐氏综合症、帕金森氏病、克雅氏病、糖尿病神经病变、帕金森综合症、亨廷顿氏病、马查多-约瑟夫病、肌萎缩侧索硬化、糖尿病神经病变和克雅氏病。例如,该疾病是阿尔茨海默氏病。例如,该疾病是帕金森综合症。
[0384]
在一个实例中,其中本发明的方法对人或动物受试者进行实践,用于治疗cns或神经退行性疾病或状况,该方法引起受试者中的treg细胞下调,从而促进系统性单核细胞衍生巨噬细胞和/或treg细胞跨越脉络丛进入受试者的大脑内,由此治疗、预防疾病或状况(例如阿尔茨海默氏病)或降低其进展。在一个实施方案中,该方法引起受试者的cns系统中(例如,脑和/或csf中)的ifn-γ增加。在一个实例中,该方法恢复神经纤维和/或降低神经纤维损伤的进展。在一个实例中,该方法恢复神经髓鞘和/或降低神经髓鞘损伤的进展。在一个实例中,本发明的方法治疗或预防wo2015136541中公开的疾病或状况,和/或该方法可以与wo2015136541中公开的任何方法一起使用(该文件的公开内容整体引入本文作为参考,例如,用于提供此类方法、疾病、状况和潜在治疗剂的公开内容,其可以施用于受试者用于实现cns和神经退行性疾病和状况的治疗和/或预防,例如试剂如免疫检查点抑制剂,例如抗pd-1、抗pd-l1、抗tim3或者其中公开的其它抗体)。
[0385]
用于通过该方法治疗或预防的癌症可以治疗的癌症包括未血管化或基本上未血管化的肿瘤,以及血管化非肿瘤。癌症可以包含非实体瘤(例如血液学肿瘤,例如白血病和淋巴瘤),或者可以包含实体瘤。待用本发明治疗的癌症类型包括但不限于癌、母细胞瘤和肉瘤,以及某些白血病或淋巴样恶性肿瘤、良性和恶性瘤以及恶性肿瘤,例如肉瘤、癌和黑素瘤。还包括成人肿瘤/癌症和小儿肿瘤/癌症。
[0386]
血液学癌症是血液或骨髓的癌症。血液学(或血源性)癌症的实例包括白血病,包括急性白血病(例如急性淋巴细胞性白血病、急性髓细胞性白血病、急性骨髓性白血病和成髓细胞、早幼粒细胞性、骨髓单核细胞性、单核细胞性和红白血病)、慢性白血病(例如慢性髓细胞性(粒细胞性)白血病、慢性骨髓性白血病和慢性淋巴细胞性白血病)、真性红细胞增多症、淋巴瘤、霍奇金病、非霍奇金淋巴瘤(惰性和高级别形式)、多发性骨髓瘤、华氏巨球蛋白血症、重链疾病、骨髓增生异常综合症、毛细胞白血病和骨髓增生异常。
[0387]
实体瘤是通常不含有囊肿或液体区域的异常组织块。实体瘤可以是良性或恶性
的。不同类型的实体瘤因形成其的细胞类型而命名(例如肉瘤、癌和淋巴瘤)。实体瘤(例如肉瘤和癌)的实例包括纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、骨肉瘤和其它肉瘤、滑膜瘤、间皮瘤、尤因氏肿瘤、平滑肌肉瘤、横纹肌肉瘤、结肠癌、淋巴样恶性肿瘤、胰腺癌、乳腺癌、肺癌、卵巢癌、前列腺癌、肝细胞癌、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、甲状腺髓样癌、甲状腺乳头状癌、嗜铬细胞瘤、皮脂腺癌、乳头状癌、乳头状腺癌、髓样癌、支气管源性癌、肾细胞癌、肝癌、胆管癌、绒毛膜癌、肾母细胞瘤、子宫颈癌、睾丸肿瘤、精原细胞瘤、膀胱癌、黑色素瘤和cns肿瘤(例如神经胶质瘤(例如脑干神经胶质瘤和混合性神经胶质瘤)、胶质母细胞瘤(也称为多形性胶质母细胞瘤)、星形细胞瘤、cns淋巴瘤、生殖细胞瘤、髓母细胞瘤、神经鞘瘤、颅咽管瘤、室管膜瘤、松果体瘤、血管母细胞瘤、听神经瘤、少突胶质细胞瘤、脑膜瘤、神经母细胞瘤、视网膜母细胞瘤和脑转移)。
[0388]
用于通过该方法治疗或预防的自身免疫性疾病1. 急性播散性脑脊髓炎(adem)2. 急性坏死性出血性白质脑炎3. 爱迪生氏病4. 无丙种球蛋白血症5. 斑秃6. 淀粉样变性7. 强直性脊柱炎8. 抗gbm/抗tbm肾炎9. 抗磷脂综合征(aps)10. 自身免疫性血管性水肿11. 自身免疫再生障碍性贫血12. 自身免疫性自主神经异常13. 自身免疫性肝炎14. 自身免疫性高脂血症15. 自身免疫性免疫缺陷16. 自身免疫性内耳病(aied)17. 自身免疫性心肌炎18. 自身免疫性卵巢炎19. 自身免疫性胰腺炎20. 自身免疫性视网膜病变21. 自身免疫性血小板减少性紫癜(atp)22. 自身免疫性甲状腺疾病23. 自身免疫性荨麻疹24. 轴突和神经元神经病变25. 巴洛病26. 白塞病27. 大疱性类天疱疮28. 心肌病
29. castleman病30. 乳糜泻31. 查加斯病32. 慢性疲劳综合症33. 慢性炎性脱髓鞘性多发性神经病(cidp)34. 慢性复发性多灶性骨髓炎(crmo)35. 查格-施特劳斯综合征36. 瘢痕性类天疱疮/良性粘膜类天疱疮37. 克罗恩氏病38. 科干综合症39. 冷凝集素疾病40. 先天性心脏传导阻滞41. 柯萨奇心肌炎42. crest病43. 原发性混合性冷球蛋白血症44. 脱髓鞘性神经病45. 疱疹样皮炎46. 皮肌炎47. devic’s病(视神经脊髓炎)48. 盘状狼疮49. 卓斯勒综合症50. 子宫内膜异位症51. 嗜酸性粒细胞性食管炎52. 嗜酸细胞性筋膜炎53. 结节性红斑54. 实验性变态反应性脑脊髓炎55. 伊文氏综合症56. 纤维肌痛57. 纤维化肺泡炎58. 巨细胞动脉炎(颞动脉炎)59. 巨细胞心肌炎60. 肾小球肾炎61. 古巴斯捷氏综合征62. 肉芽肿性多血管炎(gpa)(以前称为韦格纳氏肉芽肿病)63. 格雷夫斯病64. 格巴二氏综合征65. 桥本氏脑炎66. 桥本氏甲状腺炎67. 溶血性贫血
68. 过敏性紫癜69. 妊娠疱疹70. 低丙种球蛋白血症71. 特发性血小板减少性紫癜(itp)72. iga肾病73. igg4相关性硬化性疾病74. 免疫调节脂蛋白75. 包涵体肌炎76. 间质性膀胱炎77. 幼年型关节炎78. 青少年糖尿病(1型糖尿病)79. 幼年型肌炎80. 川崎综合征81. 兰伯特-伊顿综合征82. 白细胞碎裂性血管炎83. 扁平苔藓84. 硬化性苔藓85. 木样结膜炎86. 线性iga病(lad)87. 狼疮(sle)88. 慢性莱姆病89. 美尼尔病90. 显微镜下多血管炎91. 混合性结缔组织病(mctd)92. 莫伦氏溃疡93. 穆哈二氏病94. 多发性硬化95. 重症肌无力96. 肌炎97. 发作性睡病98. 视神经脊髓炎(devic's)99. 嗜中性粒细胞减少症100. 眼瘢痕性类天疱疮101. 视神经炎102. 复发性风湿病103. pandas(与链球菌有关的小儿自身免疫性神经精神障碍)104. 副肿瘤性小脑变性105. 阵发性睡眠性血红蛋白尿症(pnh)106. 帕罗二氏综合症
107. 帕森纳格-特纳综合征108. 睫状体平坦部炎(周边葡萄膜炎)109. 天疱疮110. 周围神经病变111. 静脉周脑脊髓炎112. 恶性贫血113. poems综合征114. 结节性多动脉炎115. i、ii和iii型自身免疫性多腺体综合征116. 风湿性多肌痛117. 多发性肌炎118. 心肌梗塞后综合征119. 心包切开术后综合征120. 黄体酮皮炎121. 原发性胆汁性肝硬化122. 原发性硬化性胆管炎123. 银屑病124. 银屑病关节炎125. 特发性肺纤维化126. 坏疽性脓皮病127. 单纯红细胞再生障碍128. 雷诺现象129. 反应性关节炎130. 反射性交感神经营养不良131. 赖特综合症132. 复发性多软骨炎133. 不安腿综合症134. 腹膜后纤维化135. 风湿热136. 类风湿性关节炎137. 肉瘤样病138. 施密特综合征139. 巩膜炎140. 硬皮病141. 干燥综合征142. 精子与睾丸自身免疫143. 僵人综合症144. 亚急性细菌性心内膜炎(sbe)145. susac综合征
146. 交感性眼炎147. 高安氏动脉炎148. 颞动脉炎/巨细胞动脉炎149. 血小板减少性紫癜(ttp)150. 托亨二氏综合征151. 横贯性脊髓炎152. 1型糖尿病153. 溃疡性结肠炎154. 未分化型结缔组织病(uctd)155. 葡萄膜炎156. 血管炎157. 囊泡性皮肤病158. 白癜风159. 韦格纳氏肉芽肿病(现称为肉芽肿性多血管炎(gpa)。
[0389]
用于通过该方法治疗或预防的炎性疾病1. 阿尔茨海默2. 强直性脊柱炎3. 关节炎(骨关节炎、类风湿性关节炎(ra)、银屑病关节炎)4. 哮喘5. 动脉粥样硬化6. 克罗恩氏病7. 结肠炎8. 皮炎9. 憩室炎10. 纤维肌痛11. 肝炎12. 肠易激综合症(ibs)13. 系统性红斑狼疮(sle)14. 肾炎15. 帕金森氏病16. 溃疡性结肠炎。
[0390]
段落:例如,本发明提供了下述段落(其可以任选地与上文任何公开内容组合):1. 一种抗菌组合物,其包含第一噬菌体群体,其中所述第一噬菌体需要辅助噬菌体用于第一噬菌体颗粒的复制,其中所述辅助噬菌体能够包装第一噬菌体核酸以产生第一噬菌体颗粒,其中所述第一噬菌体不同于辅助噬菌体,并且所述辅助噬菌体本身不能产生辅助噬菌体颗粒,其中所述第一噬菌体能够感染靶细菌,并且每个第一噬菌体包含用于杀死细菌的抗菌手段。
[0391]
2. 段落1的组合物,其中由所述组合物包含的至少95%的噬菌体颗粒是第一噬菌
体颗粒。
[0392]
任选地,该组合物包含辅助噬菌体。任选地,该组合物包含不多于1个辅助噬菌体颗粒/1 x 106或更多个噬菌体颗粒。任选地,该组合物包含不多于1个辅助噬菌体颗粒/1 x 108或更多个噬菌体颗粒。任选地,该组合物包含不多于1个辅助噬菌体颗粒/1 x 109或更多个噬菌体颗粒。任选地,该组合物包含不多于1个辅助噬菌体颗粒/1 x 10
10
或更多个噬菌体颗粒。
[0393]
3. 段落1或2的组合物,其中每个第一噬菌体包含crispr/cas系统的一种或多种组分,其中所述组分包含编码指导rna(任选地单个指导rna)的dna序列、或包含用于产生指导rna的crispr的dna阵列,其中所述指导rna能够靶向靶细菌的基因组。
[0394]
4. 任何前述段落的组合物,其中每个第一噬菌体基因组缺乏编码噬菌体蛋白的基因。
[0395]
5. 根据任何前述段落的组合物,其用于细菌的抗菌处理中,所述组合物包含改造的可移动遗传元件(mge),其能够在第一物种或菌株的第一细菌宿主细胞中动员,所述细胞包含辅助噬菌体基因组,其中在所述细胞中使用由辅助噬菌体编码的蛋白质动员mge,并且抑制第一辅助噬菌体的复制,其中所述mge编码抗菌剂或编码此类试剂的组分,其中所述mge包含修饰的基因组岛、修饰的致病岛、sapi(金黄色葡萄球菌致病岛)、霍乱弧菌ple(噬菌体样可诱导性染色体岛样元件)或大肠杆菌ple。
[0396]
6. 一种试剂盒,其包含(a)第一dna;和(b)一种或多种第二dna;其中(i)dna一起包含产生包装的噬菌体颗粒所需的所有噬菌体结构蛋白基因,所述包装的噬菌体颗粒包含第一dna的拷贝;(ii)第一dna不包含所述基因或包含至少一种但并非全部所述基因;并且其中一种或多种第二dna包含所述基因的剩余部分;(iii)第一dna包含用于产生包装的噬菌体颗粒的噬菌体包装信号;和(iv)第二dna缺乏将第二dna包装到噬菌体颗粒内所需的核苷酸序列;其中当共存于用于产生包含第一dna的包装噬菌体(第一噬菌体)的宿主细菌中时,所述dna是可操作的,其中所述第一噬菌体需要第二dna用于其复制,以产生进一步的第一噬菌体颗粒。
[0397]
7. 段落6的试剂盒,其中(i)的噬菌体颗粒能够感染靶细菌,所述噬菌体包含目标核苷酸序列(nsi),其能够在靶细菌中表达蛋白质或rna,其中所述nsi编码的蛋白质或rna在靶细菌中的存在介导靶细胞杀死、或者靶细胞生长或繁殖的下调。
[0398]
8. 段落6的试剂盒,其中(i)的噬菌体颗粒能够感染靶细菌,所述噬菌体包含目标核苷酸序列(nsi),其能够在靶细菌中表达蛋白质或rna,或者其中所述nsi包含可在靶细菌中工作的调节元件。
[0399]
9. 段落8的试剂盒,其中所述nsi或者其编码的蛋白质或rna在靶细菌中的存在介导靶细胞杀死、或靶细胞生长或繁殖的下调,或者介导由靶细胞基因组编码的一种或多种rna或蛋白质的表达的关闭、或其下调。
105个第一噬菌体/ml或mg。在一个实例中,本发明的任何组合物包含至少1 x 106个第一噬菌体/ml或mg。在一个实例中,本发明的任何组合物包含至少1 x 107个第一噬菌体/ml或mg。在一个实例中,本发明的任何组合物包含至少1 x 108个第一噬菌体/ml或mg。在一个实例中,本发明的任何组合物包含至少1 x 109个第一噬菌体/ml或mg。在一个实例中,本发明的任何组合物包含至少1 x 10
10
个第一噬菌体/ml或mg。在一个实例中,本发明的任何组合物包含至少1 x 10
11
个第一噬菌体/ml或mg。在一个实例中,本发明的任何组合物包含至少1 x 10
12
个第一噬菌体/ml或mg。在一个实例中,本发明的任何组合物包含至少1 x 10
13
个第一噬菌体/ml或mg。在一个实例中,本发明的任何组合物包含至少1 x 10
14
个第一噬菌体/ml或mg。
[0419]
在一个实例中,本发明的任何组合物包含至多1 x 10
14
个第一噬菌体/ml或mg,例如当该组合物由流体(例如液体)或固体所包含时。在一个实例中,本发明的任何组合物包含至多1 x 10
13
个第一噬菌体/ml或mg。在一个实例中,本发明的任何组合物包含至多1 x 10
12
个第一噬菌体/ml或mg。在一个实例中,本发明的任何组合物包含至多1 x 10
11
个第一噬菌体/ml或mg。在一个实例中,本发明的任何组合物包含至多1 x 10
10
个第一噬菌体/ml或mg。在一个实例中,本发明的任何组合物包含至多1 x 109个第一噬菌体/ml或mg。
[0420]
在一个实例中,本发明的任何组合物包含至少1 x 103至1 x 10
10
、1 x 10
11
、1 x 10
12
、1 x 10
13
或1 x 10
14
个第一噬菌体/ml或mg,例如当该组合物由流体(例如液体)或固体所包含时。在一个实例中,本发明的任何组合物包含至少1 x 104至1 x 10
10
、1 x 10
11
、1 x 10
12
、1 x 10
13
或1 x 10
14
个第一噬菌体/ml或mg。在一个实例中,本发明的任何组合物包含至少1 x 105至1 x 10
10
、1 x 10
11
、1 x 10
12
、1 x 10
13
或1 x 10
14
个第一噬菌体/ml或mg。在一个实例中,本发明的任何组合物包含至少1 x 106至1 x 10
10
、1 x 10
11
、1 x 10
12
、1 x 10
13
或1 x 10
14
个第一噬菌体/ml或mg。在一个实例中,本发明的任何组合物包含至少1 x 107至1 x 10
10
、1 x 10
11
、1 x 10
12
、1 x 10
13
或1 x 10
14
个第一噬菌体/ml或mg。在一个实例中,本发明的任何组合物包含至少1 x 108至1 x 10
10
、1 x 10
11
、1 x 10
12
、1 x 10
13
或1 x 10
14
个第一噬菌体/ml或mg。在一个实例中,本发明的任何组合物包含至少1 x 109至1 x 10
10
、1 x 10
11
、1 x 10
12
、1 x 10
13
或1 x 10
14
个第一噬菌体/ml或mg。在一个实例中,本发明的任何组合物包含至少1 x 10
10
至1 x 10
10
、1 x 10
11
、1 x 10
12
、1 x 10
13
或1 x 10
14
个第一噬菌体/ml或mg。在一个实例中,本发明的任何组合物包含至少1 x 10
11
至1 x 10
10
、1 x 10
11
、1 x 10
12
、1 x 10
13
或1 x 10
14
个第一噬菌体/ml或mg。在一个实例中,本发明的任何组合物包含至少1 x 10
12
至1 x 10
10
、1 x 10
11
、1 x 10
12
、1 x 10
13
或1 x 10
14
个第一噬菌体/ml或mg。在一个实例中,本发明的任何组合物包含至少1 x 10
13
至1 x 10
10
、1 x 10
11
、1 x 10
12
、1 x 10
13
或1 x 10
14
个第一噬菌体/ml或mg。在一个实例中,本发明的任何组合物包含至少1 x 10
14
至1 x 10
10
、1 x 10
11
、1 x 10
12
、1 x 10
13
或1 x 10
14
个第一噬菌体/ml或mg。
[0421]
在一个实例中,该组合物包含一个或多个剂量的第一噬菌体,用于施用于受试者用于医学用途,例如以治疗或预防受试者中的疾病或状况。在一个实例中,该组合物包含单个剂量。在一个实例中,该组合物包含(或至少包含)2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个剂量。在一个实例中,每个剂量是(或是至少)包含所述噬菌体的0.5、1、2、3、4、5、10、20、25、30、40、50、75、100、125、200或250mg或ml剂量(即,剂量是所述量,并且包含噬菌体和例如赋形剂、稀释剂或载体)。
[0422]
在一个实例中,该组合物包含一个或多个剂量的第一噬菌体,用于施用于受试者用于非医学用途,例如用于农业用途。在一个实例中,该组合物包含单个剂量。在一个实例中,该组合物包含(或至少包含)2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个剂量。在一个实例中,每个剂量是(或是至少)包含所述噬菌体的0.5、1、2、3、4、5、10、20、25、30、40、50、75、100、125、200、250、500、750、1000、2000、3000、4000、5000、10000、50000、100000 mg或ml剂量(即,剂量是所述量,并且包含噬菌体和例如赋形剂、稀释剂或载体)。在用于与靶细菌接触之前,剂量可以溶解或稀释于溶剂(例如,水性溶剂或水中)中。在一个实例中,1英制加仑包含一个剂量的第一噬菌体,例如用于农业用途,例如农作物喷雾,或者用于动物或牲畜用途,例如用作饮料。
[0423]
25. 段落22或23的方法或者段落24的组合物,其中所述第二dna由辅助噬菌体dna包含,并且由所述组合物包含的少于5%的总噬菌体颗粒是辅助噬菌体颗粒。
[0424]
26. 段落22至24中任一项的方法或组合物,其中所述第二dna由辅助噬菌体dna包含,并且所述组合物包含不多于1个辅助噬菌体颗粒/1 x 106或更多个噬菌体颗粒。
[0425]
这已在实施例3中得到证实,并且在实施例4中显示对于靶细菌杀死有效。在一个实施方案中,该组合物包含不多于1个辅助噬菌体颗粒/1 x 107或更多个噬菌体颗粒。在一个实施方案中,该组合物包含不多于1个辅助噬菌体颗粒/1 x 108或更多个噬菌体颗粒。在一个实施方案中,该组合物包含不多于1个辅助噬菌体颗粒/1 x 109或更多个噬菌体颗粒。在一个实施方案中,该组合物包含不多于1个辅助噬菌体颗粒/1 x 10
10
或更多个噬菌体颗粒。
[0426]
在一个实施方案中,该组合物包含不多于1个辅助噬菌体颗粒/1 x 106个噬菌体颗粒。在一个实施方案中,该组合物包含不多于1个辅助噬菌体颗粒/1 x 107个噬菌体颗粒。在一个实施方案中,该组合物包含不多于1个辅助噬菌体颗粒/1 x 108个噬菌体颗粒。在一个实施方案中,该组合物包含不多于1个辅助噬菌体颗粒/1 x 109个噬菌体颗粒。
[0427]
在一个实施方案中,该组合物包含不多于1个辅助噬菌体颗粒/1 x 106至1 x 109个噬菌体颗粒。在一个实施方案中,该组合物包含不多于1个辅助噬菌体颗粒/1 x 106至1 x 108个噬菌体颗粒。在一个实施方案中,该组合物包含不多于1个辅助噬菌体颗粒/1 x 106至1 x 107个噬菌体颗粒。在一个实施方案中,该组合物包含不多于1个辅助噬菌体颗粒/1 x 107至1 x 109个噬菌体颗粒。在一个实施方案中,该组合物包含不多于1个辅助噬菌体颗粒/1 x 107至1 x 108个噬菌体颗粒。
[0428]
在一个实例中,辅助噬菌体的比例测定为噬菌斑形成单位(pfu),例如包含所述数目标噬菌体颗粒的噬菌体组合物的pfu/ml。例如,非辅助噬菌体(即,第一噬菌体)的比例测定为靶细菌的转导单位(tfu)数目,例如噬菌体组合物的tfu/ml。pfu在易感指示菌的菌苔上进行测定,而tfu在转导测定中进行测定,其中用噬菌体组合物感染易感指示菌的培养物,确保了指示细胞的过剩(即以低感染复数(moi 《 0.01),并且通过在选择性平板上铺平板来测定转导细胞的数目。
[0429]
因此,该组合物可以包含一种或多种辅助噬菌体颗粒。然而,辅助颗粒的水平极低。这是有益的,因为该组合物是相对纯的(并且例如因此可用作药剂)。当第一噬菌体被复制的机会非常低时,它也是有用的,提供了噬菌体的给药控制、噬菌体遏制(例如在人或动物体内或者在环境中)的优点,并且噬菌体复制的缺乏降低了通过噬菌体获得不期望基因
(例如抗生素抗性基因)的机会。
[0430]
27. 段落1至5中任一项的组合物,段落22、23、25或26的方法,或者段落24、25或26的组合物,其中每个第一噬菌体颗粒包含目标核苷酸序列(nsi),其能够在靶细菌中表达蛋白质或rna,其中所述nsi编码的蛋白质或rna在靶细菌中的存在介导靶细胞杀死、或者靶细胞生长或繁殖的下调。
[0431]
28. 段落27的方法或组合物,其中所述nsi编码对靶细胞有毒的crispr/cas系统的组分。
[0432]
29. 段落28的方法或组合物,其中所述组分包含:(i)编码指导rna(例如,单个指导rna)、或包含用于产生指导rna的crispr阵列的dna序列,其中所述指导rna能够靶向靶细菌的基因组;(ii)编码cas核酸酶的dna序列;和/或(iii)编码级联的一种或多种组分的dna序列。
[0433]
30. 段落29的方法或组合物,其中所述nsi编码系统的cas核酸酶和指导rna(或者其中所述nsi编码cas核酸酶和用于产生指导rna的crispr阵列),其中所述指导rna能够靶向靶细菌的基因组,其中所述指导rna能够引导靶细胞中的cas,以介导靶细胞杀死、或者靶细胞生长或繁殖的下调。
[0434]
任选地,nsi编码cas9、tracrrna和以及用于产生指导rna的crispr阵列。
[0435]
31. 段落1至5和22至30中任一项的方法或组合物,其中所述第一噬菌体颗粒不包含噬菌体结构蛋白基因。
[0436]
32. 任何前述段落的试剂盒、dna、方法或组合物,其中所述第一dna或第一噬菌体dna由高拷贝数质粒包含。
[0437]
任选地,第一dna或第一噬菌体dna由中等拷贝数质粒包含。
[0438]
低、中和高拷贝数ori和质粒的含义是技术人员已知的,并且这些是本领域的术语。如技术人员已知的,拷贝数指示质粒拷贝/细胞的平均数。例如,低拷贝数的质粒是以1至10个拷贝/其中具有质粒的细菌细胞存在的质粒;中等拷贝数的质粒以11至50(例如11至40或20至30或40)个拷贝/细胞存在;并且高拷贝数为》50(例如,至多100、200、250、300、400、500、600或700)个拷贝/细胞。在一个实例中,包含第一dna的质粒或载体是中等拷贝数的质粒或载体。在一个实例中,包含第一dna的质粒或载体是高拷贝数的质粒或载体。常见ori和质粒的实例显示于表7中。
[0439]
33. 段落27或者当从属于段落27时的28至32中任一项的方法或组合物,其中所述nsi包含用于杀死靶细菌的改造的抗菌手段。
[0440]
34. 段落33的组合物的方法,其中所述抗菌手段包含编码指导核酸酶的核酸,所述指导核酸酶例如cas核酸酶、talen、锌指核酸酶或大范围核酸酶。
[0441]
35. 段落1至5和24至34中任一项的组合物,其用于施用于人或动物受试者用于医学用途。
[0442]
36. 段落1至5和24至34中任一项的组合物,其用于施用于人或动物受试者用于治疗靶细菌细胞的感染,其中所述第一噬菌体能够感染且杀死靶细胞,任选地其中所述感染是肠道微生物群系感染。
[0443]
任选地,靶细胞是大肠杆菌细胞,第一dna由高拷贝数质粒包含。
[0444]
在一个实例中,肠道微生物群系是上消化道微生物群系。在一个实例中,靶细胞由
受试者的上消化道包含。在一个实例中,第一噬菌体被递送至受试者的上消化道。
[0445]
在一个实例中,肠道微生物群系是胃或小肠道微生物群系。在一个实例中,靶细胞由受试者的胃或小肠包含。在一个实例中,第一噬菌体被递送至受试者的胃或小肠。
[0446]
37. 用于治疗人或动物受试者的疾病或状况的遏制方法中的段落33或34的组合物,其中所述疾病或状况由靶细菌介导,并且所述靶细菌由受试者包含(任选地由肠道微生物群系包含),所述方法包括将组合物施用于受试者,由此使所述靶细菌暴露于抗菌手段且被杀死,并且遏制第一噬菌体的繁殖。
[0447]
38. 处理离体环境的方法,所述方法包括使环境暴露于包含第一噬菌体颗粒群体的组合物,其中所述组合物可通过第22、23和25至34段中任一项的方法获得,或者所述组合物是根据段落1至5和24至34中任一项的组合物,其中所述环境包含靶细菌,并且所述第一噬菌体感染且杀死靶细菌。
[0448]
39. 段落38的方法,其中所述方法用于遏制环境中的处理。
[0449]
40. 段落1至5和24至34中任一项的组合物,其用于控制受试者中的第一噬菌体治疗的给药;或者段落38或39段的方法,其用于控制环境中的第一噬菌体处理的给药。
[0450]
41. 段落1至5和24至34中任一项的组合物,其用于降低受试者中通过第一噬菌体获得外源基因序列的风险;或者段落38或39段的方法,其用于降低环境中通过第一噬菌体获得外源基因序列的风险。
[0451]
概念:本发明提供以下概念,如实施例6所示。
[0452]
1.一种宿主细菌细胞,包括c)第一dna;和d)一种或多种第二dna;其中(v) dna一起包含产生转导颗粒所需的所有基因,该转导颗粒包含由噬菌体结构蛋白包装的第一dna的拷贝;(vi)第一dna缺乏产生所述颗粒所需的至少一个功能性必需基因(例如,编码噬菌体结构蛋白);并且其中所述一种或多种第二dna包含所述功能性必需基因;(vii)所述第一dna包含用于产生所述颗粒的噬菌体包装信号;和(viii)第二dna缺乏将第二dna包装到转导颗粒内所需的核苷酸序列;其中需要第二dna来包装第一dna以产生颗粒,其中dna在细胞中可操作以产生包含噬菌体结构蛋白的转导颗粒,所述噬菌体结构蛋白包装第一dna的拷贝。
[0453]
2.概念1的细胞,其中宿主细菌细胞包含a)所述第一dna;和b)所述一种或多种第二dna;其中(i)dna一起包含产生包装的转导颗粒所需的所有噬菌体结构蛋白,所述包装的转导颗粒包含第一dna的拷贝;(ii)第一dna不编码或编码至少一种但并非全部结构蛋白;并且其中所述一种或多种第二dna编码所述结构蛋白的剩余部分;
(iii)第一dna包含用于产生所述颗粒的噬菌体包装信号;和(iv)第二dna缺乏将第二dna包装到转导颗粒内所需的核苷酸序列;其中需要第二dna来包装第一dna以产生颗粒,其中dna在细胞中可操作以产生包含噬菌体结构蛋白的转导颗粒,所述噬菌体结构蛋白包装第一dna的拷贝。
[0454]
3.概念1的细胞,其中(i)第一dna由缺乏所述必需或结构蛋白基因的附加体(例如质粒)包含和/或第二dna由附加体(例如,质粒)或细胞的染色体包含。
[0455]
4.概念1、2或3的细胞,其中所有所述必需基因或噬菌体结构蛋白基因被第二dna包含,并且第一dna缺乏所述基因。
[0456]
5.任何前述概念的细胞,其中第一dna编码引导核酸酶或crispr/cas系统的组分(任选地,crrna或引导rna)。
[0457]
6.任何前述概念的细胞,其中第一dna包含噬菌体复制起点和/或第一dna包含噬菌体复制基因和/或噬菌体裂解基因;和/或(ii)第一dna包含噬菌体复制起点但不包含细菌复制起点。
[0458]
7.任何前述概念的细胞,其中每个转导颗粒是非自我复制的转导颗粒。
[0459]
8.任何前述概念的细胞,其中每个颗粒包含噬菌体尾纤维。
[0460]
9.任何前述概念的细胞,其中必需基因或结构蛋白基因和包装信号是有尾噬菌体例如p2、t4、t7、phi92、λ、k1-5或933w噬菌体的基因和包装信号。
[0461]
10.任何前述概念的细胞,其中第一dna被噬菌体基因组包含,其中噬菌体基因组整合在质粒中;任选地,其中每个颗粒能够感染靶细菌,第一dna包含能够在靶细菌中表达蛋白质或rna的感兴趣的核苷酸序列(nsi),其中nsi替换噬菌体的必需基因或结构蛋白基因。
[0462]
11.任何前述概念的细胞,其中每个颗粒能够感染靶细菌,第一dna包含能够在靶细菌中表达蛋白质或rna的感兴趣的核苷酸序列(nsi),其中nsi编码的蛋白质或rna在靶细菌中的存在介导靶细胞杀死,或靶细胞生长或繁殖的下调;或(ii)其中每个颗粒能够感染靶细菌,第一dna包含能够在靶细菌中表达蛋白质或rna的感兴趣的核苷酸序列(nsi),或其中nsi包含在靶细菌中可操作的调节元件。
[0463]
12.概念11的细胞,其中nsi或其编码的蛋白质或rna在靶细菌中的存在介导靶细胞杀死,或靶细胞生长或繁殖的下调,或介导通过靶细胞基因组编码的一种或多种rna或蛋白质的表达的关闭或其下调。
[0464]
13.概念11的试剂盒,其中nsi或其编码的蛋白质或rna在靶细菌中的存在介导靶细胞的生长或增殖的上调,或介导通过靶细胞基因组编码的一种或多种rna或蛋白质的表达的开启或其上调。
[0465]
14.任何前述概念的细胞,其中包装信号是pac或cos序列,或者是它们的同源物;或者是直接末端重复(dtr)。
[0466]
15.任何前述概念的细胞,其中所述包装信号包含seq id no:2或与其具有至少70、80、90、95、96、97、98或99%同一性的序列,或者是来自不同的噬菌体的同源物。
[0467]
16.一种分离的dna,包含如任何前述概念中定义的第一dna;或包含任何前述概念中定义的第二dna。
[0468]
17.概念1至15中任一项的第一dna或第二dna,其中所述dna被质粒包含。
[0469]
18.概念16或17的第二dna,其中所述dna被细胞包含,其中所述细胞不包含第一dna。
[0470]
19.包含概念18中所述的细胞的试剂盒,其中所述试剂盒包含载体(任选地,质粒),所述载体包含第一dna,其中载体不被细胞包含。
[0471]
20.概念18或19的试剂盒,其中所述细胞是细菌或古细菌细胞。
[0472]
21.一种产生转导颗粒组合物的方法,该方法包括在概念1至15中任一项的细胞中表达噬菌体结构蛋白并复制第一dna,其中产生转导颗粒,该转导颗粒包含包装的第一dna;并且任选地从细胞材料中分离一定量的转导颗粒,其中获得一定量的纯化的转导颗粒。
[0473]
22.概念21的方法,包括分离转导颗粒。
[0474]
23.包含可通过概念21或22的方法获得的转导颗粒群体的组合物。
[0475]
24.概念21或22的方法或概念23的组合物,其中所述第二dna由质粒dna包含,并且所述组合物所包含的总dna的少于5%是所述质粒的dna。
[0476]
25.概念21至24中任一项的方法或组合物,其中每个转导颗粒包含能够在靶细菌中表达蛋白质或rna的感兴趣的核苷酸序列(nsi),其中nsi编码的蛋白质或rna在靶细菌中的存在介导靶细胞杀死,或靶细胞生长或繁殖的下调。
[0477]
26.概念25的方法或组合物,其中nsi编码引导核酸酶或对靶细胞有毒的crispr/cas系统的组分。
[0478]
27.概念26的方法或组合物,其中所述组分包含(i)编码引导rna(例如单一引导rna)或包含crispr阵列用于产生引导rna的dna序列,其中引导rna能够靶向靶细菌的基因组;(ii)cas核酸酶编码dna序列;和/或(iii)编码级联的一种或多种组分的dna序列。
[0479]
28.概念26的方法或组合物,其中nsi编码cas核酸酶和系统的引导rna(或其中nsi编码cas核酸酶和用于产生引导rna的crispr阵列),其中引导rna能够靶向靶细菌的基因组,其中引导rna能够引导靶细胞中的cas介导靶细胞杀死,或靶细胞生长或增殖的下调。
[0480]
29.概念25的方法或组合物,其中nsi包括用于杀死靶细菌的工程化抗菌工具。
[0481]
30.概念29的方法或组合物,其中所述抗菌工具包括编码引导核酸酶,例如cas核酸酶、talen、锌指核酸酶或大范围核酸酶的核酸。
[0482]
31.概念1至15中任一项的细胞、概念16至18中任一项的dna或概念23至30中任一项的组合物,用于施用于人或动物受试者以用于医疗用途。
[0483]
32.概念1至15中任一项的细胞、概念16至18中任一项的dna或概念23至30中任一项的组合物,用于施用于人或动物受试者以用于治疗靶细菌细胞的感染,其中颗粒能够感染和杀死靶细胞,任选地其中感染是肠道、血液、肺或子宫道微生物组感染。
[0484]
33.概念31或32的组合物,用于治疗人或动物受试者的疾病或病症的遏制方法,其中所述疾病或病症由靶细菌介导并且所述靶细菌被受试者包含(任选地被肠道、血液、肺或子宫道微生物组包含),该方法包括将组合物施用于受试者,由此靶细菌暴露于由第一dna编码的抗菌工具并被杀死,并且遏制转导颗粒的繁殖。
[0485]
34.一种离体处理环境的方法,所述方法包括将环境暴露于包含颗粒群体的组合物,其中所述颗粒能够将第一dna转导至环境所包含的靶细胞中,所述第一dna编码对靶细胞有毒的抗菌工具从而杀死靶细胞,其中所述组合物可通过概念21、22和24至30中任一项的方法获得,或者所述组合物根据概念23至30中任一项。
[0486]
35.概念34的方法,其中该方法用于遏制环境中的处理。
[0487]
36.概念23至30中任一项的组合物,用于在人或动物受试者中控制受试者中靶细菌细胞感染的转导颗粒治疗的给药,其中所述颗粒能够将第一dna转导至靶细胞中,所述第一dna编码对靶细胞有毒的抗菌工具从而杀死靶细胞;或概念34或35的方法,用于控制环境中颗粒处理给药。
[0488]
37.概念23至30中任一项的组合物,用于降低人或动物受试者中由受试者中的颗粒获得外源基因序列的风险;或概念34或35的方法,用于降低环境中通过颗粒获得外源基因序列的风险。
[0489]
任选地,每个颗粒能够感染靶细菌,第一dna包含能够在靶细菌中表达蛋白质或rna的感兴趣的核苷酸序列(nsi)。例如,nsi编码抗菌剂。例如,nsi编码引导核酸酶(例如,cas、talen、锌指核酸酶或大范围核酸酶)。例如,nsi编码crispr/cas系统的组分。例如,核酸酶或系统在靶细胞中可操作以切割靶细胞所包含的(例如,其染色体或附加体所包含的)靶核酸(dna或rna)序列。
[0490]
在一个实施方案中,可以从第一dna中省略必需基因,由此第一dna缺乏必需基因。在另一个实施方案中,第一dna可以包含不提供必需基因功能的必需基因的突变体(即,这不是功能性必需基因)。在另一个实施方案中,第一dna可包含不可表达形式的必需基因,例如,其中基因的调控元件已被删除或突变,使得基因不起作用,例如不表达其编码的蛋白质。
[0491]
任选地,必需基因不是噬菌体终止酶基因。任选地,第一dna并非缺乏所有噬菌体终止酶基因。任选地,第一dna不缺乏噬菌体结构蛋白基因。任选地,必需基因不是噬菌体结构蛋白基因。任选地,必需基因不是噬菌体终止酶基因,也不是噬菌体结构蛋白基因。任选地,第一dna不包含在细菌宿主细胞中可操作以复制第一dna的复制起点(ori)(并且任选地,第一dna进一步包含噬菌体复制起点)。
[0492]
任选地,每个颗粒包含尾纤维(例如,包含野生型噬菌体的一个或多个尾纤维结构域的尾纤维)。
[0493]
任选地,每个颗粒包含噬菌体衣壳蛋白、包装信号(由第一dna包含)和任选的噬菌体复制基因,其中所有这些组分是相同噬菌体(例如,野生型噬菌体)的蛋白质、包装信号和基因。
[0494]
任选地,每个颗粒包含噬菌体衣壳蛋白、包装信号(由第一dna包含)和任选的噬菌体复制基因,其中包装信号和基因是相同噬菌体(例如,野生型噬菌体)的组分,且衣壳蛋白是不同噬菌体(例如,野生型噬菌体)的蛋白质。
[0495]
任选地,第一dna缺乏所有噬菌体结构蛋白基因并且第二dna包含包装第一dna以产生颗粒所需的所有噬菌体结构蛋白基因,并且例如包装信号是选自有尾噬菌体目(caudovirales)、myovirideae、podovirideae或siphovirideae噬菌体的噬菌体包装信号。任选地,第一dna缺乏所有噬菌体结构蛋白基因并且第二dna包含包装第一dna以产生颗粒所需的所有噬菌体结构蛋白基因,并且例如包装信号是选自p2、phi92、t7、λ、933w、k1-5和t4噬菌体的噬菌体的包装信号。
[0496]
任选地,第一dna缺乏所有噬菌体结构蛋白基因,且第二dna包含包装第一dna以产生颗粒所需的所有噬菌体结构蛋白基因,例如第二dna的噬菌体结构蛋白基因是选自有尾
噬菌体目、myovirideae、podovirideae或siphovirideae噬菌体的噬菌体基因。任选地,第一dna缺乏所有噬菌体结构蛋白基因,而第二dna包含包装第一dna以产生颗粒所需的所有噬菌体结构蛋白基因,例如第二dna的噬菌体结构蛋白基因是选自p2、phi92、t7、λ、933w、k1-5和t4噬菌体的噬菌体的基因。
[0497]
必需或结构蛋白基因和包装信号可以是有尾噬菌体的结构蛋白基因和包装信号。或者,必需或结构蛋白基因和包装信号可以是温和噬菌体的必需或结构蛋白基因和包装信号。或者,必需或结构蛋白基因和包装信号可以是裂解噬菌体的必需或结构蛋白基因和包装信号。
[0498]
任选地,必需或结构蛋白基因和包装信号可以是p2、t4、t7、phi92、λ、k1-5或933w噬菌体的必需或结构蛋白基因和包装信号。任选地,必需或结构蛋白基因和包装信号可以是有尾噬菌体的必需或结构蛋白基因和包装信号。任选地,必需或结构蛋白基因和包装信号可以是有尾噬菌体目噬菌体的必需或结构蛋白基因和包装信号。任选地,必需或结构蛋白基因和包装信号可以是myovirideae、podovirideae或siphovirideae噬菌体的必需或结构蛋白基因和包装信号。任选地,必需或结构蛋白基因和包装信号可以是p2噬菌体的必需或结构蛋白基因和包装信号。任选地,必需或结构蛋白基因和包装信号可以是t7噬菌体的必需或结构蛋白基因和包装信号。任选地,必需或结构蛋白基因和包装信号可以是phi92噬菌体的必需或结构蛋白基因和包装信号。任选地,必需或结构蛋白基因和包装信号可以是λ噬菌体的必需或结构蛋白基因和包装信号。任选地,必需或结构蛋白基因和包装信号可以是933w噬菌体的必需或结构蛋白基因和包装信号。任选地,必需或结构蛋白基因和包装信号可以是k1-5噬菌体的必需或结构蛋白基因和包装信号。任选地,必需或结构蛋白基因和包装信号可以是t4噬菌体的必需或结构蛋白基因和包装信号。
[0499]
任选地,本文的任何噬菌体可以是有尾噬菌体。任选地,本文中的任何噬菌体可以是有尾噬菌体目噬菌体。任选地,本文中的任何噬菌体可以是myovirideae、podovirideae或siphovirideae噬菌体。任选地,本文中的任何噬菌体可以是p2、t4、t7、phi92、λ、k1-5或933w噬菌体。任选地,本文的任何噬菌体可以是p2噬菌体。任选地,本文的任何噬菌体可以是t7噬菌体。任选地,本文的任何噬菌体可以是phi92噬菌体。任选地,本文的任何噬菌体可以是λ噬菌体。任选地,本文的任何噬菌体可以是933w噬菌体。任选地,本文的任何噬菌体可以是k1-5噬菌体。任选地,本文的任何噬菌体可以是t4噬菌体。
[0500]
根据本发明的必需基因可以是产生颗粒或噬菌体所需的任何核酸序列(不一定编码蛋白质)。
[0501]
在一个例子中,必需基因编码蛋白质。在一个例子中,必需基因不是包装信号或噬菌体复制起点。
[0502]
例如,每个必需基因选自
•
编码噬菌体结构蛋白的噬菌体基因;
•
编码基因表达激活剂(例如,rna聚合酶,例如大肠杆菌噬菌体t4、t3或k1-5的rna聚合酶)的噬菌体基因;基因q(例如,大肠杆菌噬菌体λ的基因q);基因rin(例如,葡萄球菌噬菌体nm1的rin)、基因ogr(例如,大肠杆菌噬菌体p2的ogr)或基因δ(例如,大肠杆菌卫星噬菌体p4的δ));
•
噬菌体rna代谢基因(即编码由噬菌体rna代谢系统包含的蛋白质);
•
噬菌体dna代谢基因,即编码由噬菌体的dna代谢系统包含的蛋白质);
•
噬菌体dna包装基因(即编码由噬菌体的dna包装系统包含的蛋白质);
•
编码细菌细胞裂解所必需的蛋白质的噬菌体基因。
[0503]
例如,每个必需基因选自以下p2基因(括号中给出了功能):基因b(dna复制);基因q(门蛋白);基因p和m(终止酶);基因o、l和n(衣壳);基因x、r、s、v、w、j、i、h、g、fi、fii、e、e'、t、u、d(尾和尾纤维);基因x、y、lysa、lysb、lysc(裂解盒);和ogr(晚期基因表达激活剂)。
[0504]
例如,每个必需基因选自以下t7基因(括号中给出了功能):基因1(rna聚合酶);基因1.3、2.5、3、3.5、4a、5、6(dna和rna代谢);基因6.7、7.3、8、9、10a、10b、14、15、16(衣壳和内核);基因11、12、17(尾);基因17.5、18.5、18.6、18.6(裂解);和基因18和19(终止酶)。
[0505]
噬菌体是能够感染靶细菌细胞的病毒或转导颗粒能够转导靶细菌细胞,即能够将第一dna或其部分引入靶细胞。
[0506]
在一个实施方案中,试剂盒包含包含第一和第二dna的细胞(例如,细菌细胞)。例如,细胞是细菌细胞,第一dna由缺乏所述必需或结构蛋白基因的附加体(例如,质粒)包含,第二dna由细胞的染色体包含;并且任选地,所有必需或噬菌体结构蛋白基因都被第二dna包含,并且第一dna和附加体缺乏所述基因。任选地,第一dna(或其部分)编码引导核酸酶或crispr/cas系统的组分(例如,cas、级联蛋白、crrna、引导rna或tracrrna)。任选地,第一dna(或其部分)编码crrna或引导rna。
[0507]
任选地,第一dna包含噬菌体复制起点。
[0508]
任选地,转导颗粒是非自我复制的转导颗粒。
[0509]
任选地,第一dna包含噬菌体复制基因和/或噬菌体裂解基因。
[0510]
任选地,噬菌体或颗粒包含尾纤维,例如包含结构蛋白的野生型噬菌体的尾纤维(或其结构域)。
[0511]
在细菌细胞的替代方案中,细胞是古细菌细胞并且噬菌体是能够感染古细菌的病毒或者转导颗粒能够转导古细菌。
[0512]
任选地,本文的包装信号为pac或cos序列,或者是它们的同源物;或直接末端重复(dtr)。
[0513]
应当理解,这里描述的特定实施方案是通过说明的方式示出的,而不是作为对本发明的限制。本发明的主要特征可以在不脱离本发明范围的情况下用于各种实施方案中。本领域技术人员将能够仅使用常规研究来确定本文描述的特定程序的许多等同物。这样的等同物被认为在本发明的范围内并且被权利要求所覆盖。说明书中提及的所有出版物和专
利申请表明本发明所属领域的技术人员的技术水平。美国专利申请号15/985,658、pct/ep2018/082053、所有出版物和专利申请以及所有美国等同专利申请和专利均以相同的程度通过引用并入本文,就好像每个单独的出版物或专利申请都被具体和单独地指示为通过引用并入。术语“一个”或“一种”在权利要求和/或说明书中与术语“包括”一起使用时可能表示“一个”,但也与“一个或多个”、“至少一个”和“一个或多于一个”的含义一致。在权利要求中使用的术语“或”用于表示“和/或”,除非明确指出仅指替代方案或替代方案是相互排斥的,尽管本公开支持仅指替代方案和指“和/或”的定义。在本技术中,术语“约”用于表示值包括用于确定值的设备、方法的误差的固有变异,或研究对象之间存在的变异。
[0514]
如在本说明书和权利要求中使用的,词语“包含”(以及任何形式的包含,例如“包含”和“包含”)、“具有”(以及任何形式的具有,例如“具有”和“具有”)、“包括”(以及任何形式的包括,例如“包括”和“包括”)或“含有”(以及任何形式的含有,例如“含有”和“含有”)是包容性的或开放式的,并且不排除额外的、未提及的元素或方法步骤。
[0515]
此处使用的术语“或其组合”或类似术语是指在该术语之前列出的项目的所有排列和组合。例如,“a、b、c或其组合旨在包括以下各项中的至少一项:a、b、c、ab、ac、bc或abc,并且如果顺序在特定上下文中很重要,则还有ba、ca、cb、cba、bca、acb、bac或cab。继续该示例,明确包括包含一个或多个项目或术语的重复的组合,例如bb、aaa、mb、bbc、aaabcccc、cbbaaa、cababb等等。技术人员将理解,除非从上下文中另外明显看出,否则通常对任何组合中的项目或术语的数量没有限制。
[0516]
本公开的任何部分可以与本公开的任何其他部分结合阅读,除非从上下文中另外明显说明。
[0517]
根据本公开,本文公开和要求保护的所有组合物和/或方法可以在没有过度实验的情况下完成和执行。虽然本发明的组合物和方法已经根据优选实施方案进行了描述,但对于本领域技术人员来说显而易见的是,可以对本文所述组合物和/或方法以及在方法步骤中或步骤顺序中应用变化,而不背离本发明的概念、精神和范围。所有这些对本领域技术人员来说显而易见的类似替代和修改都被认为在由所附权利要求限定的本发明的精神、范围和概念之内。
实施例
[0518]
实施例1:有效的噬菌体crispr递送媒介物生产背景我们设计了用于有效生产包含crispr/cas系统的组分的噬菌体颗粒的策略,用于杀死靶大肠杆菌nissle菌株细菌。因此,我们的噬菌体组合物由裂解产物组成,所述裂解产物主要含有包装在噬菌体颗粒中的crispr/cas系统组分,所述噬菌体颗粒缺乏噬菌体蛋白编码序列,并且不具有辅助噬菌体或具有极低比例的辅助噬菌体。另外,该策略可替代地在较不充分表征的噬菌体/细菌菌株组合中起作用。实施例3和4提供了工作范例。
[0519]
用于迄今未知的噬菌体中的crispr/cas组分包装的策略概述(a)鉴定高或中等拷贝数的克隆/穿梭载体(能够在第一大肠杆菌菌株中克隆和繁殖(克隆生产菌株),然后转移到第二目标细菌宿主菌株(靶宿主菌株)),所述载体含有用于在大肠杆菌克隆生产菌株中复制的大肠杆菌ori;
(b)分离针对靶宿主(第二)细菌的温和噬菌体;(c)为了产生克隆生产菌株,鉴定或改造宿主靶细菌(或其它细菌)的噬菌体生产菌株,其具有无效的crispr/cas系统(例如,受阻遏的cas3或其它核酸酶)和/或缺乏在第二菌株中发现的靶原间隔序列,并且可以被温和噬菌体感染且溶原;或者在生产菌株中阻遏系统或使系统失活;(d)在该生产菌株中,使用温和噬菌体(辅助噬菌体)制备溶素原,并且测试它是否可以被诱导;(e)在全基因组测序的噬菌体上,使用phageterm(https://www.ncbi.nlm.nih.gov/pmc/articles/pmc5557969/)鉴定包装序列(pac或cos);(f)缺失生产菌株细菌中的辅助噬菌体中的pac/cos包装信号序列;(g)将包装信号连同crispr阵列或单个grna编码序列(以及任选地crispr/cas系统的其它组分,例如cas9编码核苷酸序列和任选地tracrrna编码序列,或cas3和/或级联编码序列)一起掺入穿梭载体中;(h)将载体转化到生产宿主菌株内;(i)诱导(例如,uv或丝裂霉素c诱导)并收获包含crispr/cas组分的噬菌体。可替代地,使用具有反式诱导型reca的系统来模拟sos(需要活化reca)。
[0520]
使用噬菌体p2特异性针对上文大肠杆菌nissle的实施例:由于其gras(通常公认为安全的)状态,nissle是有用的,并且p2具有相对宽的宿主范围(大多数大肠杆菌、志贺氏菌属、克雷伯氏菌属、沙门氏菌属,加上将dna递送到例如假单胞菌属内;kahn等人1991,“bacteriophage p2 and p4”,methods in enzymology,第204卷,第264-280页)。
[0521]
我们使用puc19或者其它高或中等拷贝数的克隆载体。温和噬菌体p2可以溶原nissle。大多数大肠杆菌k菌株具有失活的crispr/cas系统,并且可以被p2感染,并且因此可以使用所有常规克隆宿主(此处以大肠杆菌top10为例)。
[0522]
将p2引入top10内,以产生溶素原。p2不能用丝裂霉素c或uv诱导,但我们使用来自寄生虫噬菌体p4的ε抗阻遏物,其使p2去阻遏并使其进入裂解阶段。我们从生产宿主菌株中的诱导型启动子表达这种基因。
[0523]
使用seq id no:2的325 bp包装信号序列。
[0524]
包装序列在溶原性生产top10菌株的p2原噬菌体中被缺失。
[0525]
构建编码靶向靶nissle菌株的基因组的指导rna(或可替代地包含用于产生此类指导rna的crispr阵列)的puc19穿梭载体,并且添加包装信号seq id no:2。如果靶nissle拥有其自身的内源crispr/cas系统,我们使用活化策略以通过在载体中包括cas活化基因来活化内源cas3。如果不是这样,则我们在载体中包括外源cas3编码核苷酸序列(以及任选地编码一种或多种所需级联组分的一个或多个核苷酸序列),用于在靶nissle中表达。我们将载体转化到top10生产菌株内,诱导p4抗阻遏物并且收获包含crispr/cas组分的噬菌体。
[0526]
由于诱导的(辅助)噬菌体dna不含有包装信号,我们能够分离仅包装载体dna的颗粒。因此,我们将获得包含此类噬菌体的组合物,其可以用于感染靶nissle大肠杆菌细菌,并且将crispr/cas组分引入其中,用于杀死靶细菌。
[0527]
实施例2:mge、基因组岛等
下述是可能的不同mge包装策略的概述。
[0528]
适用于不同类型的噬菌体:
•ꢀ
鉴定辅助噬菌体中的包装信号和结构基因
•ꢀ
缺失辅助噬菌体中的包装信号并且置于包含mge的质粒上
•ꢀ
将辅助物和质粒两者置于生产菌株中
•ꢀ
诱导辅助物的结构基因转录,以获得辅助噬菌体包装的mge的产生对于使用寄生性可移动元件(p4噬菌体或sapi等),通过诱导辅助噬菌体活化剂来完成辅助噬菌体结构基因的活化,所述辅助噬菌体活化剂得自p4中的寄生性元件δ,或者sapi中的ptia/b/m中的一种、多种或全部。
[0529]
如果想要较小尺寸的颗粒,则可以通过在mpi或载体中包括p4 sid以及来自sapi的psu或cpma/b,选择在寄生虫大小的衣壳中(通常为10-20 kb)中包装。
[0530]
可以使用缺陷型辅助噬菌体,其中至少包装信号已被去除,并且结构基因或者在质粒上或者作为隐藏型原噬菌体整合到生产宿主中。如果出于某种原因不能使用这种方法而需要使用功能性辅助噬菌体,则在mge或载体中包括寄生虫上的基因,其劫持噬菌体包装机构,以优先于噬菌体dna包装寄生虫dna(在我们的情况下为cgv
™
)。
[0531]
可以包括在来自p4的质粒载体上的最小基因列表。
[0532]
p4序列:参见https://www.ncbi.nlm.nih.gov/nuccore/x51522cos包装位点:seq id no:3p2和p4之间的同源序列;这可以用作mge或载体中的替代包装信号:sq id no:4对于小衣壳尺寸(包装11.4kb而不是33.5 kb),sid和/或psu可以包括在mge或载体中:sid:seq id no:5psu:seq id no:6为了活化辅助噬菌体p2,来自p4的δ可以包括在宿主细胞基因组中(在宿主细胞中分开提供,而不是在待包装的mge或载体上提供)δ:seq id no:7包括在来自p2的宿主染色体/附加体中的最小基因。
[0533]
p2序列(登录号:nc_001895)图1显示了具有加上方框的非必需基因的p2基因组的遗传图
ꢀ–
可以排除这些中的一种、多种或全部(但cos始终被缺失)。cos被缺失,且优选从int直到cos的整个区域。这个区域可以例如与抗性标记物交换,而orf30和fun(z)基因保持完整或可以被缺失。
[0534]
因此,在本发明的本文中的任何方面的实施方案中,当不同的噬菌体用作辅助噬菌体dna或第二dna的基础时,从辅助噬菌体dna或第二dna中省略int直到cos(即,包括int和cos),或者省略同源区域。
[0535]
p2基因组的各个区段的序列如下:
‑“
q”直到“s”:seq id no:8“v”直到“g”:seq id no:9“fi”直到“ogr”:seq id no:10在载体或mge上包括的来自sapi的最小基因。
[0536]
存在几种不同的sapi系统。图2显示了充分表征的sapi之一(sapibov1),其利用噬菌体phi11或phi80alpha作为辅助噬菌体。sapibov1序列(登录号:af217235.1)包装信号如果使用具有缺失的包装信号的缺陷型辅助噬菌体,则可以使用来自辅助噬菌体的信号,并且将其包括在待包装的dna中。来自金黄色葡萄球菌phi11(登录号:af424781)的实例是seq id no:11。
[0537]
对于小衣壳尺寸(包装15.8 kb而不是43.6 kb),可以在mge或载体中包括cpma和/或cpmb(seq id no:12和13)。
[0538]
为了活化辅助噬菌体phi11,可以包括ptia、b和m中的一种、多种或全部(在生产宿主细胞中分开提供,而不是在待包装的mge或载体上提供)(seq id no:14-16)。
[0539]
包括在来自phi11的宿主染色体/附加体中的最小基因。
[0540]
phi11序列(登录号:af424781)基因#29(ters)直到基因#53(溶素):seq id no:17与sapi一起发挥作用的噬菌体列表不同的sapi连接到不同的辅助噬菌体(参见下表2)可以使辅助噬菌体突变,以仅含有指导噬菌体包装在较小衣壳中的结构基因。如果仅查看负责小衣壳包装的基因(cpma和cpmb),这些在葡萄球菌中是高度保守的,指示它们作用于重新指导比下表更广泛的各种噬菌体中的包装(表2)。
[0541]
实施例3:合成转导颗粒递送平台的设计、构建和体外功效执行概述sa100是包含非自我复制的转导颗粒的合成dna递送媒介物,所述非自我复制的转导颗粒包含包装dna质粒的噬菌体外壳蛋白,所述dna质粒包含编码crispr/cas组分的核酸序列,其中所述颗粒能够感染靶大肠杆菌宿主细胞,以将dna引入其中。引入的dna然后能够在宿主细胞中使用,以产生组分。我们将此类dna称为crispr指导载体(cgvs
™
)。如本实施例中所示,我们使用缺陷型辅助噬菌体制备了此类颗粒。在合成颗粒的产生后,我们获得了缺乏编码噬菌体蛋白的任何噬菌体核酸的纯合成裂解产物。我们显示了这种裂解产物能够在体外将cgv
™
非常有效地递送到大肠杆菌中。颗粒是非自我复制的,且需要辅助噬菌体用于复制;因此有用的是,裂解产物是纯的,并且消除了含有cgv
™
的颗粒复制的可能性。这对于遏制抗菌物的作用是有用的,以允许例如对于人或动物受试者或环境的施用的更受控的(例如,预定的)给药,并且在受试者或环境中的复制消除降低了噬菌体从周围的噬菌体或细菌获得不期望的基因或性状(例如不期望的抗生素抗性基因)的机会
ꢀ–ꢀ
并且即使如此,本发明的颗粒复制的限制也提供了降低或消除此类基因或性状传播的方式。这对于机构如us fda或usda可能是感兴趣的,所述机构在批准用于环境中的药剂或抗菌物时考虑此类方面。
[0542]
研究目标目标1:设计且改造基于完全合成噬菌体的cgv递送平台sa100。
[0543]
目标2:使用sa100来证实cgv递送至大肠杆菌。
[0544]
材料和方法细菌菌株和生长条件
我们制备了用于生产合成的sae100转导颗粒的细菌生产菌株。具有噬菌体p2的大肠杆菌菌株c-2323用作原材料,用于改造我们的sa100/cgv生产菌株(来自virginia commonwealth university的gail e. christie的礼物)。用于测试sa100和感染性的其它菌株是emg-2、c-1a和c-1792(购自coli genetic stock center http://cgsc2.biology.yale.edu/)。
[0545]
所有细菌培养物都在补充有2mm mgcl2的lb培养基中生长。适当时,培养物补充有50μg/ml卡那霉素或50μg/ml壮观霉素,用于分别选择缺陷型原噬菌体和cgv。在sa100感染研究中,培养基补充有2.5 mm cacl2,以帮助sa100颗粒吸收到细菌细胞。为了诱导crispr/cas系统,使细胞暴露于0.5mm iptg和2mm茶碱。
[0546]
缺陷型辅助原噬菌体的构建将ptk-red重组质粒(p72)转化到菌株c-2323内。使用与我们想要缺失的p2的大约10 kbp区域紧上游和下游的p2原噬菌体区域具有50 bp同源性的寡核苷酸,扩增kamr卡那霉素标记物基因(参见图3)。在用kanr标记物基因成功替换所需区域后,纠正了热敏ptk-red重组质粒。
[0547]
改造cgv(p94)用于在sa100颗粒中包装使用质粒p53作为模板构建了cgv p77。质粒p53是编码crispr/cas系统的组分的质粒,该质粒包含编码tracrrna和来自化脓性链球菌的cas9蛋白(spcas)的核酸序列。获得了用于生产crrna的核酸序列,其表达由plac启动子驱动。两个片段使用gibson assembly(neb e5510s)进行组装,并且转化到大肠杆菌感受态细胞内。通过完全测序来验证组装的p77质粒。
[0548]
具有诱导型crispr/cas系统的p77用作主链,用于插入包含阿拉伯糖诱导型启动子的片段,其转录来自卫星噬菌体p4的区域sid直到cos(图3)。
[0549]
两个片段均进行pcr扩增,并且通过限制性酶克隆进行克隆。所得到的sa100可包装cgv(p94)进行序列验证。
[0550]
sa100包装的cgv的生产将cgv p94转化到先前构建的具有缺陷型原噬菌体的菌株内,从而生成了生产菌株#189。
[0551]
在卡那霉素和壮观霉素的存在下,生产菌株以指数方式生长了大约10代,确保了群体的平衡生长。在光密度(od
600
)1下,用1%阿拉伯糖诱导培养物,并且继续温育直至光密度测量很低且稳定。在旋转除去细胞碎片后,将裂解产物过滤(0.45
ꢀµ
m)并且贮存于 4c下,直至进一步使用。
[0552]
测定sa100滴度的转导方案。
[0553]
通过将sa100裂解产物与合适的细菌菌株混合来测定滴度,确保在2.5mm cacl2的存在下细菌细胞的至少100倍过剩。在30分钟温育后,将细菌稀释并在含有壮观霉素的lb上铺平板,用于计数通过转导已接受p94 cgv的细菌。为了验证sa100裂解产物的纯度,使用标准的软琼脂覆盖层,将未稀释的裂解产物点在已知支持p2增殖的细菌(c-1a)菌苔上。不存在噬菌斑形成用于验证纯度。
[0554]
dna递送测定使用了转导方案,其中在感染细菌培养物之前,将sa100裂解产物稀释,以获得范
围为0.01至100的感染复数(moi),有效地跨越sa100与细菌细胞的4 log比。
[0555]
在2.5mm cacl2的存在下的30分钟感染后,细菌在具有和不具有壮观霉素选择的lb平板上进行计数,用于p94 cgv的递送。所获得的数字用于计算在给定moi下感染的群体百分比。
[0556]
结果sa100媒介物的设计图4示意性地概述了具有cgv和缺陷型原噬菌体的sa100大肠杆菌生产菌株的总体设计。我们使用作为原噬菌体在生产菌株的染色体上整合的天然大肠杆菌噬菌体p2作为我们的原材料。在原噬菌体中,我们缺失了对于噬菌体启动并进行其自身增殖所需的基因,因此生成了缺陷型辅助噬菌体。
[0557]
然后我们将产生sa100转导颗粒所需的结构基因的表达置于诱导型启动子的控制下,允许我们开启颗粒的生产。最后,我们从噬菌体dna中缺失了通常由噬菌体用于将其dna包装到噬菌体颗粒内的包装序列,并且将其置于我们的cgv上(参见图3中所示的cos位点)。在诱导噬菌体结构基因后,我们将cgv dna包装到颗粒内,所述颗粒随后通过生产细胞的裂解进行释放。
[0558]
改造缺陷型辅助噬菌体在染色体上具有噬菌体p2的大肠杆菌菌株c-2323用作原材料,用于由缺陷型辅助噬菌体改造生产菌株。使用重组,将p2噬菌体上的区域替换为卡那霉素标记物,所述区域包含整合酶、用于启动噬菌体增殖的启动子、复制起点、dna复制基因和cos位点(当将dna包装到噬菌体颗粒内时识别的dna序列)(参见图3中所示的加上方框的p2 dna)。通过测序验证标记物的位点特异性整合和大约10kbp的噬菌体dna的缺失。
[0559]
改造cgv以允许sa100包装我们使用具有由诱导型启动子表达的cripsr/cas系统的单个载体(p77),用于改造我们的sa100可包装的cgv。
[0560]
为了能够使缺陷型p2辅助噬菌体活化和cgv包装到合成的转导颗粒内,我们将包含sid-δ-psu-cos(cos包装位点)的遗传区域从卫星噬菌体p4克隆到p77质粒内。已知能够活化p2噬菌体的克隆的p4区(seq id no:18)已经被克隆到另一个载体p93中,它在其中由阿拉伯糖诱导型启动子表达。通过完全测序验证了所得到的cgv(p94),其含有对于p2活化和sa100包装所需的所有元件。p4基因组体系结构和p94中克隆的区域显示于图3a的下部方框中,而p94基因组图显示于图3b中。
[0561]
sa100包装的cgv的生产将p94 cgv电穿孔到具有缺陷型原噬菌体的菌株内,导致生产菌株#189。
[0562]
如上所述生产sa100包装的cgv。通过将sa100包装的p94转导到3种大肠杆菌菌株内测定的,sa100包装的cgv的滴度为大约10
10 tfu/ml。如预计的,未观察到天然p2噬菌体的污染(下表3)。相应地,我们可以假定每个合成颗粒的天然噬菌体污染为1e9中少于1。
[0563]
使用sa100将cgv递送到大肠杆菌为了测定对于大肠杆菌群体的100%感染所需的噬菌体数目,我们执行了感染实验,改变了sa100颗粒与细菌细胞的比率,所谓的感染复数(moi)从0.01到100。
[0564]
我们观察到,moi为1意味着一个sa100颗粒/大肠杆菌细胞,对于细菌群体的100%
感染是足够的(图4)。
[0565]
讨论和结论设计并构建了sa100,基于完全合成的噬菌体的cgv递送媒介物。在也具有相容的cgv的生产菌株中表达后,产生了sa100包装的cgv的高滴度裂解产物,其缺乏天然噬菌体污染。最后,将获得的sa100包装的cgv有效地递送到大肠杆菌内。
[0566]
实施例4:在通过sa100合成转导颗粒递送平台递送后,cgv在体外杀死大肠杆菌执行概述我们使用sa100合成dna递送媒介物,将优化的crispr指导载体(cgv
™
)递送至两种大肠杆菌靶菌株。在系统引入后,我们可以证实靶群体的高达4 log杀死。
[0567]
前言我们先前已改造了基于噬菌体的合成dna递送媒介物sa100(实施例3),用于将cgv递送至大肠杆菌靶细胞。此处,我们优化了cgv用于通过sa100媒介物的递送,并且随后测试了在杀死大肠杆菌靶细胞方面的功效。
[0568]
研究目标目标1:优化cgv用于通过sa100递送。
[0569]
目标2:通过sa100递送的cgv杀死大肠杆菌。
[0570]
材料和方法细菌菌株和培养条件所有细菌培养物都在补充有2mm mgcl2的lb培养基中生长。适当时,培养物补充有50μg/ml卡那霉素或50μg/ml壮观霉素,用于分别选择缺陷型原噬菌体和cgv。在sa100感染研究中,培养基补充有2.5 mm cacl2,以帮助sa100颗粒吸收到细菌细胞。为了诱导crispr/cas系统,使细胞暴露于0.5mm iptg和2mm茶碱。通过将与我们cgv中的指导rna间隔区序列互补的20核苷酸序列重组到mg1655和xl1-blue的lacz基因内,从而分别生成了靶菌株mg1655_pks和xl1-blue_pks,构建了靶菌株mg1655_pks和xl1-blue_pks。
[0571]
sa100包装的cgv的生产将cgv(p94和p114)分开转化到具有缺陷型原噬菌体的相应菌株内,从而分别生成了生产菌株#189和#226。
[0572]
在卡那霉素和壮观霉素的存在下,生产菌株以指数方式生长了大约10代,确保了群体的平衡生长。在光密度(od
600
)1下,将培养物浓缩x10,并且用1%阿拉伯糖诱导培养物,并且继续温育直至光密度测量很低且稳定。在旋转除去细胞碎片后,将裂解产物过滤(0.45
ꢀµ
m),使用amicon ultra-15离心过滤器进一步浓缩大约x4,并且贮存于 4c下,直至进一步使用。
[0573]
cgv递送和杀死在2.5mm cacl2的存在下,以20的moi用sa100包装的cgv p94或p114感染大肠杆菌靶菌株的指数生长的培养物。
[0574]
在37摄氏度下温育30分钟后,将细菌培养物系列稀释,并且在含有iptg和茶碱(用于诱导crispr/cas组分的表达)的lb平板上铺平板,以研究cgv介导的杀死,或在lb 壮观霉素上铺平板,以研究对靶群体的cgv递送。
[0575]
结果
通过增加拷贝数优化cgvdna先前显示cgvp94有效地递送至大肠杆菌(实施例3)。根据stuitje等人1981,“identificationofmutationsaffectingreplicationcontrolofplasmidclodf13”,nature,第290卷,第264-267页,这种cgv含有clodf13复制起点,其中单个snp将拷贝数从7增加到80。通过将snp掺入用于pcr扩增整个cgv的寡核苷酸内,我们产生了含有突变的clodf13ori的p114(seqidno:23)。进行序列验证。
[0576]
通过sa100的cgv递送我们先前显示了使用在sa100中包装的p94有效cgv递送(实施例3)。此处,我们比较了cgvp94和p114对mg1655_pks的递送(图6a,以及另外地p114对xl1-blue_pks的递送(图6b。使用感染复数(moi)20,我们证实了对靶群体的100%递送。
[0577]
sa100递送的cgv的杀死功效使用与上文相同的实验设置(靶菌株,sa100包装的cgv和20的moi),我们研究了在crispr/cas系统表达诱导后,所递送的cgv杀死靶细胞的能力。
[0578]
靶向mg1655_pks中的pksdna序列的p94cgv能够将靶菌株减少大约2log,而靶向相同序列的p114将靶群体减少大约4log(图7)。当p114靶向xl1-blue_pks靶群体中的pks时,观察到相同量级的杀死(图7)。
[0579]
讨论和结论在sa100将cgv递送到靶细胞后,我们能够将靶群体的杀死从使用p94的大约2log增加到使用p114的4log,这可能是由于cgv的高拷贝数。
[0580]
实施例5:在微生物群系背景下,使用非自我复制颗粒和靶细胞杀死,对肠道微生物群系的体内抗菌药递送执行概述大肠杆菌amg1655-pk用于定殖鼠肠道。我们通过sa100递送媒介物(合成的非自我复制的噬菌体颗粒,参见实施例3和4),显示了统计学上显著的cgv
™
psnp114递送到mg1655-pks内。我们观察到靶向大肠杆菌mg1655-pks的cgv
™
活化后的存活降低。
[0581]
前言我们先前已显示,大肠杆菌atcc43888定殖nmri小鼠模型的小鼠肠道(数据未显示),并且在小鼠肠道中的大肠杆菌atcc43888中的crispr阵列活化降低了存活,其中使用该阵列产生的指导rna靶向大肠杆菌基因组用于cas切割(数据未显示)。在该实施例中,我们着手评价通过合成syntheticnanoboiotic
™
,即sa100递送到mg1655-pks内的基于crispr/cas的抗菌药(cgv
™
)的存活。
[0582]
研究目标:通过用syntheticnanoboiotic
™
sa100递送cgv
™
psnp114,确定鼠肠道微生物群系中的大肠杆菌mg1655-pks的存活降低。
[0583]
材料和方法大肠杆菌是插入有pks片段的大肠杆菌mg1655,具有链球菌抗性标记物,phylo组a。
[0584]
使细胞在补充有50μg/ml壮观霉素的lb培养基中生长过夜。第二天测量od,并且将培养物稀释至108cfu/ml。媒介物、诱导和未诱导的组显示于表4中。
[0585]
•ꢀ
15只雌性nmri小鼠,26-30克(taconic)
•ꢀ
含有茶碱和l-阿拉伯糖的诱导剂溶液实验动物设施和小鼠住房温度为21℃ /
‑ꢀ
2℃,并且可以通过加热和冷却进行调节,并且明/暗周期为6 a.m.
‑ꢀ
6 p.m./6 p.m
ꢀ–ꢀ
6 a.m的12小时间隔。小鼠具有对食品和家庭质量的饮用水的自由接近,直到研究前3天。将小鼠6-7只小鼠/笼饲养在标准设施中,具有来自tapvei的aspen wood的寝具,以及来自sizzle-nest的纸带作为筑巢材料,直到研究前1天,然后移动到gmo设施内,每笼一只小鼠。从第0天起,木制寝具已更改为纸寝具,以方便从笼中收集粪便。
[0586]
链霉素饮用水的制备通过溶解6.94 g硫酸链霉素/l无菌水来制备6升5g/l链霉素。从第-3天开始以及在研究自始至终,给小鼠给予链霉素水。
[0587]
小鼠的接种在接种之前将接种物配制为现成的悬浮液。在第0天上午8点,通过管饲法用0.25 ml接种小鼠。使用大约10
11 tfu/ml的滴度。
[0588]
小鼠的处理在第1天的上午7点和下午1点以及再次在第2天的上午7点,通过经口管饲法用诱导剂和10
11 tfu/ml sa100向小鼠给药。诱导剂紧在处理前的每个处理时间点之前立即混合,并且用抗酸剂对小鼠进行管饲。
[0589]
从笼中收集粪便样品紧在接种前,将0.5 ml粪便样品从笼中收集到三个15 ml nunc管内。在接种后第1天和第2天,在上午7点处理之前,收集0.5 ml粪便样品,并且将小鼠移至新的笼。在接种后第2天,在处理后4小时也收集粪便样品。
[0590]
cfu测定通过在1-4小时过程中涡旋多次,将0.5 ml粪便物质溶解在5 ml无菌盐水内。通过将粪便样品在无菌的0.9% nacl中的10倍系列稀释来测定菌落计数,并且将20 μl斑点应用于琼脂平板。粪便样品的检测下限为50 cfu/ml。所有琼脂平板都在环境空气中在35℃下温育18-22小时。
[0591]
通过在lb 链霉素 壮观霉素平板上铺平板,来计数cgv的递送。通过在仅具有链霉素的lb平板上铺平板,来计数靶菌株的丰度。
[0592]
小鼠的临床监测在研究至始至终监测小鼠的体重,并且基于其行为和临床体征将小鼠评分为0-6(表5)。如果达到3分或20%的体重减轻,对小鼠实施安乐死。
[0593]
结果在接种前小鼠的微生物群系分析接种前收集的3个样品中的2个中未检测到细菌。合并的样品之一具有6.54 log10 cfu/ml的小白色菌落。maldi分析指示,异味类芽孢杆菌(paenibacillus odorife)具有1.71的得分值,并且作为第二种最可能的木糖葡萄球菌(staphylococcus xylosus)具有1.43的得分值,两者均具有低等级质量。在温育48小时后,在2个其它合并样品中也出现3-4 log10 cfu/ml的小白色菌落。
[0594]
在接种后24小时,如在lb strep琼脂平板上测定的,粪便样品中的cfu水平范围为6.1
ꢀ‑ꢀ
8.6 log10 cfu/样品。在接种后第2天观察到相似的水平。在2个接种组各自中,没有观察到显著差异。
[0595]
在lb strep spec琼脂平板上,在任何组中在第1天都没有观察到菌落。第2天在诱导剂处理的组中观察到范围为1至5 log10 cfu/样品的cfu计数,但在媒介物处理的组中未观察到。
[0596]
动物研究的布局在每个鼠干预研究中使用了二十四只小鼠。
[0597]
临床小鼠得分在整个研究期过程中,小鼠并未显示任何感染或不适的临床体征。
[0598]
mg1655-pks的诱导杀死粪便物质提取物在含有链霉素的平板上铺平板,以测定大肠杆菌mg1655-pks菌株的cfu(图8)。链霉素cfu计数显示各个处理组之间无差异。
[0599]
当粪便样品在壮观霉素和链霉素上铺平板以测定cgv psnp114的递送(因为这种cgv携带壮观霉素抗性标记物)时,我们观察到48小时后cfu和因此cgv递送的显著增加(图9)。当crispr系统被诱导时,我们观察到平均cfu计数的显著减少。
[0600]
讨论和结论我们成功地证实了使用合成synthetic nanobiotic
™
平台sa100,将指导核酸酶抗菌物(cgv
™
)递送到鼠肠道模型中的大肠杆菌mg1655-pks内。因此,建立了使用非自我复制颗粒将抗菌物体内递送至微生物群系。使用cgv
™
上的活化crispr系统,观察到cfu计数的统计学显著降低。
[0601]
实施例6:通过反式的必需功能产生转导颗粒天然噬菌体经过改造,将它们转化为我们的crispr-guided vectors
™
(cgv)的dna载体媒介(转导颗粒)。颗粒可以转导靶细菌以引入载体,从中表达crispr/cas系统或其一种或多种组分。我们利用裂解繁殖,其中必需辅助功能仅由宿主细胞(sa800和sa900)提供。
[0602]
sa800和sa900sa800和sa900颗粒的生产基于生产宿主细菌菌株的裂解繁殖。我们通过灭活必需的噬菌体功能(例如通过删除结构基因)并添加编码crispr-cas系统的核苷酸序列来改造天然(野生型)噬菌体。
[0603]
通过在单独的辅助质粒上提供必需基因,我们可以使cgv噬菌体杂合体在生产菌株上繁殖。然而,由于缺乏辅助质粒,cgv无法在任何其他细菌菌株上繁殖。
[0604]
我们参考图10。为了构建包含cgv的非自我复制颗粒,所述cgv包含编码crispr-cas系统组分的核苷酸序列,我们改造了天然噬菌体以包含噬菌体dna复制所需的噬菌体包装信号和基因。cgv可以包含多个噬菌体基因,只要删除或突变一个或多个必需基因以使cgv-噬菌体杂合体在不表达必需功能的菌株上不自我复制。在生产菌株中,该功能以从质粒或细菌细胞染色体的反式表达提供。
[0605]
在一个实例中,生产细胞将包含带有编码结构噬菌体蛋白的基因的质粒,该蛋白在cgv繁殖和包装过程中表达。构建包含天然噬菌体基因组的载体,其中该基因发生突变,
并且向其中插入编码crispr-cas系统组分的核苷酸序列,形成cgv-噬菌体杂合体。因此,在没有反式提供的辅助功能的情况下,cgv-噬菌体杂合体没有将cgv dna包装在转导颗粒中的功能。
[0606]
在最小版本中,所有必需功能(即对于包装必需)由生产宿主细胞携带(例如在染色体或一种或多种质粒上),除了噬菌体包装信号和噬菌体dna复制机制(包括噬菌体复制起点),不同的是,它们在cgv上携带。重要的是,dna复制机制可能不需要与辅助质粒或染色体上的必需基因来自相同噬菌体。例如,来自噬菌体λ的dna复制机制可以包含在携带噬菌体p2包装信号的cgv上(并用于复制它)并包装到p2噬菌体衣壳中(例如,其中衣壳蛋白由生产菌株细胞的辅助质粒或染色体编码)。
[0607]
cgv能够在携带辅助功能的合适生产宿主菌株上作为裂解噬菌体进行复制(即通过感染-裂解-再感染循环进行繁殖)。然而,在非生产细胞例如临床靶细菌中,噬菌体不能通过裂解循环繁殖,而只能作为dna递送媒介起作用,从而递送编码一种或多种编码crispr/cas组分(或可选地另一种抗菌剂或其他感兴趣的蛋白质或rna)的组分的序列。
[0608]
表2:sapi
元件葡萄球菌基因组baba*lindsay和holden
ǂ
大小(kb)诱导噬菌体sapi4金黄色葡萄球菌菌株mrsa252nasapi415.1内源性原噬菌体sapi1028金黄色葡萄球菌菌株ny940nana15.6内源性原噬菌体
sapibov1金黄色葡萄球菌菌株rf122vsa2na15.8φ11和80αsapibov2金黄色葡萄球菌菌株v329nana2780αsapim4金黄色葡萄球菌菌株mu50vsa3i型na14.4内源性原噬菌体sapimw2金黄色葡萄球菌菌株mw2vsa3ii型sapi314.4内源性原噬菌体sepi1金黄色葡萄球菌菌株frl909nana9.9未知shpi2溶血葡萄球菌vsh2na16.6未知sapi1金黄色葡萄球菌菌株rn4282vsa1na15.280α和φ13sapi3金黄色葡萄球菌菌株colvsa1sapi115.6未知sapi5金黄色葡萄球菌菌株usa300nana14.0未知sapin1和sapim1分别为金黄色葡萄球菌菌株n315和金黄色葡萄球菌菌株mu50。vsa4i型sap121580αsapi2金黄色葡萄球菌菌株rn3984nana14.780和80αsarlfusb金黄色葡萄球菌欧洲耐梭链孢菌的脓疱疮克隆cs6nana20.7未知sapi122金黄色葡萄球菌菌株rf122nana17.9内源性原噬菌体sapi6
∆
金黄色葡萄球菌菌株8325.col、usa300、mssa476.newman和mw2vsa4il型na3.14未知sspl15305腐生葡萄球菌菌株15305vss15305na16.7未知
[n/a,不适用;*命名法由baba等人提议;
ǂ
命名法由lindsey & holden等人提议]。
[0609]
表3:在生产后sa100包装的cgv的滴度。
[0610]
表4:组(实施例5)。
[0611]
表5:临床得分得分0
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
健康得分1
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
轻微的临床感染迹象(运动缓慢,皮肤的轻度立毛)得分2
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
中等感染迹象(动作缓慢、轻微挤眼、缺乏好奇心或活动改变)得分3
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
严重感染迹象(动作减少、挤眼、身体姿势改变)得分4
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
严重感染迹象(动作僵硬、强制通气、挤眼)被处死得分5
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
小鼠不动,冰冷,侧躺。被处死得分6
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
小鼠死亡
。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
