1.本发明总体上涉及用于在样品中检测配体的测定、方法和测试试剂盒。具体地,本发明提供了用于针对配体的存在对测试样品进行筛选的测定、方法和测试试剂盒,所述配体的特征在于能够与类固醇激素受体形成复合物并且引发类固醇激素特异性基因组应答。
背景技术:
2.对能够引发类固醇激素基因组应答的配体的检测在生物化学、分子生物学和医学的许多领域中很重要。此类配体包含内源性类固醇、外源性类固醇、非类固醇分子和合成分子。例如,确定血清或血浆中的总激素生物活性对于监测人类健康相关病状很重要,所述人类健康相关病状包含衰老、围绝经期、更年期、雄激素缺乏症、雄激素过多症、激素替代疗法、包含乳腺癌和前列腺癌的内分泌癌、如骨质疏松症和肝毒性等其它激素相关病状、月经不调、多囊卵巢综合征、性发育障碍和不孕症。用于雄激素/雌激素和抗雄激素/抗雌激素分子的常规检测方法未提供关于激素生物活性的信息。激素生物活性是用于了解驱动健康病状的潜在机制以便可以实施适当的治疗/干预的重要度量。
3.检测样品中的激素生物活性对于监测非法的人和动物性能增强、伤害掩盖、补充剂和食品掺假、乳制品行业的生长促进剂以及环境污染剂也很重要。测量激素生物活性提供了关于可能调节身体内的内分泌途径,由此影响人类健康的污染物和/或掺杂物的信息。
4.引发类固醇激素基因组应答的配体首先通过在真核细胞的细胞质或核中与类固醇激素受体蛋白形成复合物来或激活类固醇激素受体蛋白以形成经激活的受体蛋白。配体取代受体蛋白上的辅因子,然后使dna结合基序暴露。经激活的受体蛋白与第二经激活的受体蛋白二聚化,并且如果需要通过与被称为应答元件的特定核苷酸序列结合而与dna相互作用,则移位到核。在正常的生物学功能中,与应答元件结合的经配体激活的类固醇激素受体蛋白的集聚通过增强或抑制对rna聚合酶ii介导的转录的启动来调节基因表达。rna聚合酶ii是通过使核苷酸三磷酸抵靠dna模板聚合来组装以催化rna转录的多亚基全酶。
5.类固醇激素基因组应答由与类固醇激素受体蛋白和受体特异性应答元件,例如雄激素受体(ar)和雄激素应答元件(are)、雌激素受体-α(er-α)、雌激素受体-β(er-β)和雌激素应答元件(ere)、糖皮质激素受体(gr)和糖皮质激素应答元件(gre)、盐皮质激素受体(mr)和盐皮质激素应答元件(mre)、孕酮受体-a(pr-a)、孕酮受体-b(pr-b)和孕酮应答元件(pre)结合的配体诱导。
6.然而,并非与类固醇激素受体蛋白结合的所有配体都会引发类固醇激素基因组应答。一些配体引发特征在于第二信使信号传导的非基因组应答,如g蛋白激活。此非基因组应答发生在配体结合的几秒到几分钟内,并且不是典型的类固醇激素应答。
7.用于检测样品中配体的存在的常用方法是直接在所述样品中测量配体。然而,样品通常是分子的复杂混合物,并且通常需要复杂的制备过程以进行分析。检测样品中配体的存在通常依赖于如液相或气相色谱等工艺将分子物种从复杂混合物中分离为相对纯的组分的级分,并且然后利用结构敏感型方法,如质谱对每种级分进行分析。可以使用此方法
对任何一个样品中的多于100个配体进行测试。自动纯化系统、气相或液相色谱和质谱仪是必须由经过培训的技术人员不断校准和操作以产生可靠的结果的昂贵且技术复杂的实验室仪器。另一个缺点是可以通过与如性激素结合球蛋白或血清白蛋白等蛋白质相互作用而使一些配体为生物上非活性的,并且此方法不在配体的生物上活性的级分与生物上非活性的级分之间进行区分。此外,电离的过程可能导致某些类固醇分子崩解,从而无法使用此类方法对其进行测量。另外,此方法在以下情况下不提供关于样品的由多个配体产生的总生物活性的信息:无法鉴定所有已知配体;或者可以鉴定配体,不知道活性是加性的、协同的,还是甚至是竞争性的。此外,由于配体的生物代谢,需要预先了解配体和其相关代谢物的分子结构,以实现对样品中配体的存在的可靠鉴定。
8.用于检测样品中类固醇激素配体的存在的另一个常用方法是使用基于免疫学技术的生物测定,如放射免疫测定和酶联免疫吸附测定。免疫学技术的局限性是需要抗体分子直接检测配体或检测与性激素结合球蛋白直接结合的配体。免疫学测定由于测定的通过不同制造产生的抗体分子的高度可变性而缺乏再现性。
9.为了克服对在样品中检测配体的局限性,已经开发了基于细胞的类固醇激素测定,其中配体与类固醇激素受体蛋白结合并且引发类固醇激素基因组应答。在这些测定中,样品中配体的存在是在类固醇激素受体被激活并且增加然后转化成蛋白质的报告基因的rna聚合酶ii转录之后进行检测的。最常见地,报告基因对荧光蛋白(如gfp)或酶进行编码,所述gfp或酶将在特定底物存在的情况下诱导光或比色反应。
10.然而,存在与这些基于细胞的测定相关联的局限性,因为所述测定需要专门的装备和专业知识来维持活细胞培养。这增加了基于细胞的测试的成本并且减少了这些方法的高通量应用。另外,活细胞的高度分子复杂性使测试变得困难,并且降低了特异性和再现性两者。
11.为了克服对使用基于细胞的测定在样品中检测配体的局限性,开发了在样品中检测配体的无细胞系统,其中所述配体能够引发类固醇激素基因组应答。
12.然而,无细胞测定的局限性在于需要使用多亚基全酶聚合酶,如rna聚合酶ii。重组产生rna聚合酶ii极度难以以可变的再现性实现,并且因此,通常通过使用所有组分都存在并在启动子序列处聚集在一起的核提取物来使全酶可用。然而,由真核细胞制备核提取物在制造上费用高昂,因为需要费用高昂的细胞生长培养基和富集核材料所需的技术专业知识。
13.具体地,本发明提供了涉及单多肽聚合酶的测试试剂盒、测定和方法,所述聚合酶的活性通过与类固醇激素受体蛋白结合的配体而降低或受到所述配体的抑制而不是被所述配体激活。
技术实现要素:
14.本文描述和要求保护的发明具有许多属性和实例,包含但不限于在本发明内容中阐述或描述或引用的那些。其不旨在是包罗万象的,并且本文描述和要求保护的发明不限于本发明内容中鉴定的特征或实例,包含这些特征或实例仅出于说明而非限制的目的。
15.在本发明的一方面,提供了一种用于针对能够引发类固醇激素基因组应答的配体的存在对样品进行筛选的测试试剂盒,所述测试试剂盒包括:
16.(i)类固醇激素受体,所述类固醇激素受体能够与来自所述样品的配体形成受体-配体复合物;以及
17.(ii)核酸分子,所述核酸分子包括:
18.(a)聚合酶启动子序列;
19.(b)应答元件,所述应答元件能够被所述受体-配体复合物结合;以及
20.(c)报告构建体,
21.其中所述应答元件(b)位于所述启动子序列(a)与所述报告构建体(c)之间,并且(a)、(b)和(c)可操作地连接;以及
22.(iii)聚合酶,
23.其中所述样品中配体的存在是通过测量当所述样品与所述测试试剂盒组合时由所述配体-受体复合物与所述应答元件的结合引起的所述报告构建体的转录减少或抑制来检测的。
24.在本发明的另外的方面,提供了一种用于针对能够引发类固醇激素基因组应答的配体的存在对样品进行筛选的测试试剂盒,所述测试试剂盒包括:
25.(i)类固醇激素受体,所述类固醇激素受体能够与来自所述样品的配体形成受体-配体复合物;以及
26.(ii)核酸分子,所述核酸分子包括:
27.(a)聚合酶启动子序列;
28.(b)应答元件,所述应答元件能够被所述受体-配体复合物结合;以及
29.(c)报告构建体,
30.其中所述应答元件(b)位于所述启动子序列(a)与所述报告构建体(c)之间,并且(a)、(b)和(c)可操作地连接;以及
31.(iii)单多肽聚合酶,
32.其中所述样品中配体的存在是通过测量当所述样品与所述测试试剂盒组合时由所述配体-受体复合物与所述应答元件的结合引起的所述报告构建体的转录减少或抑制来检测的。
33.在本发明的另外的方面,提供了一种用于针对能够引发类固醇激素基因组应答的配体的存在对样品进行筛选的测试试剂盒,所述测试试剂盒包括:
34.(i)类固醇激素受体,所述类固醇激素受体能够与来自所述样品的配体形成受体-配体复合物;以及
35.(ii)核酸分子,所述核酸分子包括:
36.(a)聚合酶启动子序列;
37.(b)应答元件,所述应答元件能够被所述受体-配体复合物结合;以及
38.(c)报告构建体,
39.其中所述应答元件(b)位于所述启动子序列(a)与所述报告构建体(c)之间,并且(a)、(b)和(c)可操作地连接;以及
40.(iii)单多肽rna聚合酶,
41.其中所述样品中配体的存在是通过测量当所述样品与所述测试试剂盒组合时由所述配体-受体复合物与所述应答元件的结合引起的所述报告构建体的转录减少或抑制来
配体复合物;
63.(ii)类固醇激素受体辅因子,所述类固醇激素受体辅因子选自:热休克蛋白90(hsp90);hsp90和热休克蛋白70(hsp70)的复合物;hsp90、hsp70和热休克蛋白40(hsp40)的复合物;hsp90、hsp70、hsp40和p23的复合物;hsp90、hsp70、hsp40、p23和热休克蛋白组织蛋白(hop)的复合物;hsp90、hsp70、hsp40、p23、hop和48kd hip蛋白(hip)的复合物;hsp90、hsp70、hsp40、p23、hop、hip和p60的复合物;以及hsp90、hsp70、hsp40、p23、hop、hip、p60和fkbp52的复合物;
64.(iii)核酸分子,所述核酸分子包括:
65.(a)t7 rna聚合酶启动子序列,所述t7 rna聚合酶启动子序列由seq id no:1定义;
66.(b)应答元件,所述应答元件能够被所述受体-配体复合物结合;以及
67.(c)报告构建体,所述报告构建体包括rna适配体,所述rna适配体能够与荧光团结合,
68.其中所述应答元件(b)位于所述启动子序列(a)与所述报告构建体(c)之间,并且(a)、(b)和(c)可操作地连接;以及
69.(iv)t7 rna聚合酶,
70.其中所述样品中配体的存在是通过测量当所述样品与所述测试试剂盒组合时由所述配体-受体复合物与所述应答元件的结合引起的所述报告构建体的荧光减少或抑制来检测的。
71.在本发明的又另外的方面,提供了一种用于针对能够引发类固醇激素基因组应答的配体的存在对样品进行筛选的测试试剂盒,所述测试试剂盒包括:
72.(i)类固醇激素受体,所述类固醇激素受体能够与来自所述样品的配体形成受体-配体复合物;
73.(ii)类固醇激素受体辅因子,所述类固醇激素受体辅因子选自:热休克蛋白90(hsp90);hsp90和热休克蛋白70(hsp70)的复合物;hsp90、hsp70和热休克蛋白40(hsp40)的复合物;hsp90、hsp70、hsp40和p23的复合物;hsp90、hsp70、hsp40、p23和热休克蛋白组织蛋白(hop)的复合物;hsp90、hsp70、hsp40、p23、hop和48kd hip蛋白(hip)的复合物;hsp90、hsp70、hsp40、p23、hop、hip和p60的复合物;以及hsp90、hsp70、hsp40、p23、hop、hip、p60和fkbp52的复合物;
74.(iii)核酸分子,所述核酸分子包括:
75.(a)t7 rna聚合酶启动子序列,所述t7 rna聚合酶启动子序列由seq id no:1定义;
76.(b)应答元件,所述应答元件能够被所述受体-配体复合物结合;以及
77.(c)报告构建体,所述报告构建体包括rna适配体,所述rna适配体能够与荧光团结合,
78.其中所述应答元件(b)位于所述启动子序列(a)与所述报告构建体(c)之间,并且(a)、(b)和(c)可操作地连接;
79.(iv)荧光团,所述荧光团能够与所述rna适配体结合;以及
80.(v)t7 rna聚合酶,
81.其中所述样品中配体的存在是通过测量当所述样品与所述测试试剂盒组合时由所述配体-受体复合物与所述应答元件的结合引起的所述报告构建体的荧光减少或抑制来检测的。
82.在本发明的又另外的方面,提供了一种用于针对能够引发类固醇激素基因组应答的配体的存在对样品进行筛选的测试试剂盒,所述测试试剂盒包括:
83.(i)类固醇激素受体,所述类固醇激素受体能够与来自所述样品的配体形成受体-配体复合物;
84.(ii)类固醇激素受体辅因子,所述类固醇激素受体辅因子选自:热休克蛋白90(hsp90);hsp90和热休克蛋白70(hsp70)的复合物;hsp90、hsp70和热休克蛋白40(hsp40)的复合物;hsp90、hsp70、hsp40和p23的复合物;hsp90、hsp70、hsp40、p23和热休克蛋白组织蛋白(hop)的复合物;hsp90、hsp70、hsp40、p23、hop和48kd hip蛋白(hip)的复合物;hsp90、hsp70、hsp40、p23、hop、hip和p60的复合物;以及hsp90、hsp70、hsp40、p23、hop、hip、p60和fkbp52的复合物;
85.(iii)核酸分子,所述核酸分子包括:
86.(a)t7 rna聚合酶启动子序列,所述t7 rna聚合酶启动子序列由seq id no:1定义;
87.(b)应答元件,所述应答元件能够被所述受体-配体复合物结合;以及
88.(c)报告构建体,所述报告构建体包括mango适配体,所述mango适配体能够与噻唑橙结合,
89.其中所述应答元件(b)位于所述启动子序列(a)与所述报告构建体(c)之间,并且(a)、(b)和(c)可操作地连接;
90.(iv)噻唑橙;以及
91.(v)t7 rna聚合酶,
92.其中所述样品中配体的存在是通过测量当所述样品与所述测试试剂盒组合时由所述配体-受体复合物与所述应答元件的结合引起的所述报告构建体的荧光减少或抑制来检测的。
93.在本发明的又另一方面,提供了一种用于在样品中检测配体的测定方法,所述配体能够引发类固醇激素基因组应答,所述测定方法包括以下步骤:
94.(i)使样品与以下接触:
95.(a)类固醇激素受体,所述类固醇激素受体与来自所述样品的配体形成配体-受体复合物;以及
96.(b)核酸分子,所述核酸分子包括:
97.(1)聚合酶启动子序列;
98.(2)应答元件,所述应答元件被所述配体-受体复合物结合;以及
99.(3)报告构建体,
100.其中所述应答元件(b)位于所述启动子序列(a)与所述报告构建体(c)之间,并且(a)、(b)和(c)可操作地连接;
101.(c)单多肽聚合酶;以及
102.(d)核苷三磷酸;以及
103.(ii)测量由所述配体-受体复合物与所述应答元件的结合引起的所述报告构建体的转录减少或抑制,
104.其中所述报告构建体的所测得的转录减少或抑制反映在所述样品中检测到配体。
105.在本发明的又另一方面,提供了一种用于在样品中检测配体的测定方法,所述配体能够引发类固醇激素基因组应答,所述测定方法包括以下步骤:
106.(i)使样品与以下接触:
107.(a)类固醇激素受体,所述类固醇激素受体与来自所述样品的配体形成配体-受体复合物;以及
108.(b)类固醇激素受体辅因子,所述类固醇激素受体辅因子选自:热休克蛋白90(hsp90);hsp90和热休克蛋白70(hsp70)的复合物;hsp90、hsp70和热休克蛋白40(hsp40)的复合物;hsp90、hsp70、hsp40和p23的复合物;hsp90、hsp70、hsp40、p23和热休克蛋白组织蛋白(hop)的复合物;hsp90、hsp70、hsp40、p23、hop和48kd hip蛋白(hip)的复合物;hsp90、hsp70、hsp40、p23、hop、hip和p60的复合物;以及hsp90、hsp70、hsp40、p23、hop、hip、p60和fkbp52的复合物;
109.(c)核酸分子,所述核酸分子包括:
110.(1)聚合酶启动子序列;
111.(2)应答元件,所述应答元件被所述配体-受体复合物结合;以及
112.(3)报告构建体,
113.其中所述应答元件(b)位于所述启动子序列(a)与所述报告构建体(c)之间,并且(a)、(b)和(c)可操作地连接;
114.(d)单多肽聚合酶;以及
115.(e)核苷三磷酸;以及
116.(ii)测量由所述配体-受体复合物与所述应答元件的结合引起的所述报告构建体的转录减少或抑制,
117.其中所述报告构建体的所测得的转录减少或抑制反映在所述样品中检测到配体。
118.在本发明的又另一方面,提供了一种用于在样品中检测配体的测定方法,所述配体能够引发类固醇激素基因组应答,所述方法包括以下步骤:
119.(i)使样品与如本文所述的测试试剂盒接触;以及
120.(ii)测量由所述配体-受体复合物与所述应答元件的结合引起的所述报告构建体的转录减少或抑制,
121.其中所述报告构建体的所测得的转录减少或抑制反映在所述样品中检测到配体。
122.在本发明的又另一方面,提供了一种用于在样品中检测配体的测定方法,所述配体能够引发类固醇激素基因组应答,所述测定方法包括以下步骤:
123.(i)使样品与以下接触:
124.(a)类固醇激素受体,所述类固醇激素受体与来自所述样品的配体形成配体-受体复合物;以及
125.(b)核酸分子,所述核酸分子包括:
126.(1)聚合酶启动子序列;
127.(2)应答元件,所述应答元件被所述配体-受体复合物结合;以及
128.(3)基于荧光的报告构建体,
129.其中所述应答元件(b)位于所述启动子序列(a)与所述报告构建体(c)之间,并且(a)、(b)和(c)可操作地连接;
130.(c)单多肽聚合酶;以及
131.(d)核苷三磷酸;以及
132.(ii)测量由所述配体-受体复合物与所述应答元件的结合引起的所述报告构建体的荧光减少或抑制,
133.其中所述报告构建体的所测得的荧光减少或抑制反映了在所述样品中检测到配体。
134.在本发明的又另一方面,提供了一种用于在样品中检测配体的测定方法,所述配体能够引发类固醇激素基因组应答,所述测定方法包括以下步骤:
135.(i)使样品与以下接触:
136.(a)类固醇激素受体,所述类固醇激素受体与来自所述样品的配体形成配体-受体复合物;以及
137.(b)类固醇激素受体辅因子,所述类固醇激素受体辅因子选自:热休克蛋白90(hsp90);hsp90和热休克蛋白70(hsp70)的复合物;hsp90、hsp70和热休克蛋白40(hsp40)的复合物;hsp90、hsp70、hsp40和p23的复合物;hsp90、hsp70、hsp40、p23和热休克蛋白组织蛋白(hop)的复合物;hsp90、hsp70、hsp40、p23、hop和48kd hip蛋白(hip)的复合物;hsp90、hsp70、hsp40、p23、hop、hip和p60的复合物;以及hsp90、hsp70、hsp40、p23、hop、hip、p60和fkbp52的复合物;
138.(c)核酸分子,所述核酸分子包括:
139.(1)聚合酶启动子序列;
140.(2)应答元件,所述应答元件被所述配体-受体复合物结合;以及
141.(3)基于荧光的报告构建体,
142.其中所述应答元件(b)位于所述启动子序列(a)与所述报告构建体(c)之间,并且(a)、(b)和(c)可操作地连接;
143.(d)单多肽聚合酶;以及
144.(e)核苷三磷酸;以及
145.(ii)测量由所述配体-受体复合物与所述应答元件的结合引起的所述报告构建体的荧光减少或抑制,
146.其中所述报告构建体的所测得的荧光减少或抑制反映了在所述样品中检测到配体。
147.在本发明的又另一方面,提供了一种用于在样品中检测配体的测定方法,所述配体能够引发类固醇激素基因组应答,所述方法包括以下步骤:
148.(i)使样品与如本文所述的测试试剂盒接触,所述测试试剂盒包括基于荧光的报告构建体;以及
149.(ii)测量由所述配体-受体复合物与所述应答元件的结合引起的所述报告构建体的荧光减少或抑制,
150.其中所述报告构建体的所测得的荧光减少或抑制反映了在所述样品中检测到配
体。
151.在本发明的另外的方面,提供了一种用于确定样品的类固醇激素生物活性的方法,所述方法包括将样品与如本文所述的测试试剂盒组合以确定所述样品是否包括足以激活类固醇激素受体并且引起所述报告构建体的物理性质变化的配体,其中所述报告构建体的物理性质变化提供了关于所述样品的类固醇激素生物活性的信息。
152.在本发明的另外的方面,提供了一种用于确定生物样品的类固醇激素生物活性的方法,所述方法包括将生物样品与如本文所述的测试试剂盒组合以确定所述样品是否包括足以激活类固醇激素受体并且引起所述报告构建体的物理性质变化的配体,其中所述报告构建体的物理性质变化提供了关于所述生物样品的类固醇激素生物活性的信息。
153.在本发明的另外的方面,提供了一种用于确定临床样本的类固醇激素生物活性的方法,所述方法包括将从所述临床样本获得的样品与如本文所述的测试试剂盒组合以确定所述样品是否包括足以激活类固醇激素受体并且引起所述报告构建体的物理性质变化的配体,其中所述报告构建体的物理性质变化提供了关于所述临床样本的类固醇激素生物活性的信息。
154.在本发明的另外的方面,提供了一种用于确定食品或营养补充剂的类固醇激素生物活性的方法,所述方法包括将所述食品或营养补充剂或所述食品或营养补充剂的提取物与如本文所述的测试试剂盒组合以确定所述样品是否包括足以激活类固醇激素受体并且引起所述报告构建体的物理性质变化的配体,其中所述报告构建体的物理性质变化提供了关于所述食品或营养补充剂的类固醇激素生物活性的信息。
155.在本发明的另外的方面,提供了一种用于确定源自环境来源的样品的类固醇激素生物活性的方法,所述方法包括将从环境来源获得的样品与如本文所述的测试试剂盒组合以确定所述样品是否包括足以激活类固醇激素受体并且引起所述报告构建体的物理性质变化的配体,其中所述报告构建体的物理性质变化提供了关于所述环境样品的类固醇激素生物活性的信息。
156.在本发明的另外的方面,提供了一种用于确定运动员的兴奋剂状态的方法,所述方法包括将从运动员获得的样品与如本文所述的测试试剂盒组合以确定所述样品是否包括足以激活类固醇激素受体并且引起所述报告构建体的物理性质变化的配体,其中所述报告构建体的物理性质变化提供了关于所述运动员的所述兴奋剂状态的信息。
157.在本发明的另外的方面,提供了一种用于确定样品的类固醇激素生物活性的方法,所述方法包括对样品执行如本文所述的测定方法以确定所述样品是否包括足以激活类固醇激素受体并且引起所述报告构建体的物理性质变化的配体,其中所述报告构建体的物理性质变化提供了关于所述样品的类固醇激素生物活性的信息。
158.在本发明的另外的方面,提供了一种用于确定生物样品的类固醇激素生物活性的方法,所述方法包括对样品执行如本文所述的测定方法以确定所述样品是否包括足以激活类固醇激素受体并且引起所述报告构建体的物理性质变化的配体,其中所述报告构建体的物理性质变化提供了关于所述生物样品的类固醇激素生物活性的信息。
159.在本发明的另外的方面,提供了一种用于确定食品或营养补充剂的类固醇激素生物活性的方法,所述方法包括对所述食品或营养补充剂或来自所述食品或营养补充剂的提取物执行如本文所述的测定方法以确定所述食品或营养补充剂是否包括足以激活类固醇
激素受体并且引起所述报告构建体的物理性质变化的配体,其中所述报告构建体的物理性质变化提供了关于所述食品或营养补充剂的类固醇激素生物活性的信息。
160.在本发明的另外的方面,提供了一种用于确定临床样本的类固醇激素生物活性的方法,所述方法包括对临床样本执行如本文所述的测定方法以确定所述样品是否包括足以激活类固醇激素受体并且引起所述报告构建体的物理性质变化的配体,其中所述报告构建体的物理性质变化提供了关于所述临床样本的类固醇激素生物活性的信息。
161.在本发明的另外的方面,提供了一种用于确定源自环境来源的样品的类固醇激素生物活性的方法,所述方法包括对所述环境样品执行如本文所述的测定方法以确定所述样品是否包括足以激活类固醇激素受体并且引起所述报告构建体的物理性质变化的配体,其中所述报告构建体的物理性质变化提供了关于类固醇激素生物活性的信息。
162.在本发明的另外的方面,提供了一种用于确定运动员的兴奋剂状态的方法,所述方法包括对从所述运动员获得的样品执行如本文所述的测定方法以确定所述样品是否包括足以激活类固醇激素受体并且引起所述报告构建体的物理性质变化的配体,其中所述报告构建体的物理性质变化提供了关于所述运动员的所述兴奋剂状态的信息。
163.在本发明的另外的方面,提供了一种用于针对配体的存在对样品进行筛选的制品,所述配体能够引发类固醇激素基因组应答,所述制品包括如本文所述的测试试剂盒以及针对如何检测所述样品中配体的存在的说明书。
164.在本发明的另外的方面,提供了一种用于针对配体的存在对生物样品进行筛选的制品,所述配体能够引发类固醇激素基因组应答,所述制品包括如本文所述的测试试剂盒以及针对如何检测所述生物样品中配体的存在的说明书。
165.在本发明的另外的方面,提供了一种用于针对配体的存在对食品或营养补充剂进行筛选的制品,所述配体能够引发类固醇激素基因组应答,所述制品包括如本文所述的测试试剂盒以及对于如何检测所述食品或营养补充剂中配体的存在的说明书。
166.在本发明的又另外的方面,提供了一种用于确定样品的类固醇激素生物活性的制品,所述制品包括如本文所述的测试试剂盒以及用于检测样品中的类固醇激素生物活性的说明书,其中所述样品中生物活性配体的存在表明所述样品的类固醇激素生物活性。
167.在本发明的又另外的方面,提供了一种用于确定临床样本的类固醇激素生物活性的制品,所述制品包括如本文所述的测试试剂盒以及用于检测临床样本中的类固醇激素生物活性的说明书,其中所述临床样本中存在生物活性配体表明所述临床样本的类固醇激素生物活性。
168.在本发明的又另外的方面,提供了一种用于确定环境样品的类固醇激素生物活性的制品,所述制品包括如本文所述的测试试剂盒以及用于检测环境样品中的类固醇激素生物活性的说明书,其中所述环境样品中生物活性配体的存在表明所述环境样品的类固醇激素生物活性。
169.在本发明的又另外的方面,提供了一种用于确定运动员的兴奋剂的制品,所述制品包括如本文所述的测试试剂盒以及用于检测源自所述运动员的样品中配体的存在的说明书,其中所述样品中存在所述配体表明所述样运动员有兴奋剂。
附图说明
170.图1示出了在t7启动子的控制下对包括mango ii适配体序列的报告构建体的t7 rna聚合酶介导的转录进行的雄激素应答元件(are)介导的抑制的示意表示。
171.图2示出了ar减少了rnamango ii适配体的t7介导的转录。使用t7启动子-are-rna mango ii适配体dna模板组装体外转录反应。在0.5ml eppendorf管中组装反应,并且通过添加11.5ng/ml睾酮引发反应。2小时培养之后,利用添加to1-生物素(to1-b)测量rna mango ii适配体,并且使用标准荧光计检测增加的荧光。黑色柱-未添加ar的对照反应,灰色柱-以100ng/反应或400ng/反应添加ar的反应。
172.图3示出了ar减少了rnamango ii适配体的t7介导的转录。使用t7启动子-are-rna mango ii适配体dna模板组装体外转录反应。在0.5ml eppendorf管中组装反应。2小时培养之后,利用添加to1-b测量rnamango ii适配体,并且使用标准荧光计检测增加的荧光。黑色柱-未添加ar的对照反应,灰色柱-以100ng/反应添加ar的反应。深灰色柱
–
以100ng/反应添加并且用11.5ng/ml睾酮激活的ar的反应。
173.图4示出了hsp90阻断了t7介导的rnamango ii适配体表达的ar抑制。使用t7启动子-are-rnamango ii适配体dna模板组装了体外转录反应。在0.5ml eppendorf管中组装反应。两小时培养之后,利用添加to1-b测量rnamango ii适配体,并且使用标准荧光计检测增加的荧光。黑色柱-未添加ar的对照反应,灰色柱-以100ng/反应添加ar的反应。深灰色柱
–
以100ng/反应添加并且用11.5ng/ml睾酮激活的ar的反应。深灰色柱-以100ng/反应添加ar并且以200ng/反应添加hsp90的反应。最深灰色的柱-以100ng/反应添加ar并且以200ng/反应添加hsp90并且以11.5ng/ml添加睾酮的反应。
174.图5示出了经睾酮激活的ar剂量依赖性地降低rna适配体mango ii的t7介导的表达。如文中所述组装所述反应。对于这些反应,通过乙醇对照证明了t7产生的rnamango ii。将乙醇对照包含在内,因为乙醇对照是类固醇、睾酮(t)和二氢睾酮(dht)的稀释剂。针对乙醇对照产生的荧光输出被任意指定为100%,并且将其用作经配体激活的反应的参考。添加浓度不断降低(跨2.5mm到25μm的范围)的睾酮以激活ar,或者可替代地以250μm添加dht。t和dht两者均是内源性雄激素和ar的有效激活剂。****p《0.001(相对于乙醇)利用dunnett的多重比较测试进行的单向anova。
175.图6示出了ar的滴定直接影响δmango ii。如文中所述组装反应(例如参见表7)。对于这些反应,通过乙醇对照证明了t7产生的rnamango ii(灰色柱)。将乙醇对照包含在内,因为乙醇对照是睾酮(t)的稀释剂。针对乙醇对照产生的荧光输出被任意指定为100%,并且将其用作经250μm睾酮激活的反应的参考(黑色柱)。将ar的浓度从50ng降低到25ng到14.2ng维持了显著水平的ar阻断(n=5),然而t7抑制的效应大小相对于50ng降低。将ar浓度增加到100ng(n=2)对t7抑制无进一步影响。****p《0.001,***p=0.002(相对于乙醇),利用dunnett的多重比较测试进行的单向anova。
176.图7示出了hsp90:ar比率影响δmango ii。如文中所述组装反应(参见表8)。对于这些反应,通过乙醇对照证明了t7产生的rna mango ii(灰色柱)。针对乙醇对照产生的荧光输出被任意指定为100%,并且将其用作经250μm睾酮激活的反应的参考(黑色柱)。结果示出仅当ar浓度增加时1:1比率才有效,当ar浓度为100ng时记录的δmango ii最大。如果ar浓度为50ng或100ng则2:1比率有效,而4:1比率允许ar甚至在较低ar浓度的情况下操作,
而8:1比率示出对δmango ii的效应大小降低。
177.图8示出了单个are位点强到足以降低t7转录。除了dna模板不同外,如文中所述组装反应。对于一组反应,使用仅对单个are进行编码的dna模板,而对于第二组反应,使用原始3xare dna模板(序列示出在表2中)。对于这些反应,通过乙醇对照证明了t7产生的rna mango ii(灰色柱)。针对乙醇对照产生的荧光输出被任意指定为100%并且将其用作经250μm睾酮激活的反应的参考(黑色柱)。结果示出单个are与3xare一样有效(****p《0.0001,***p=0.002)。
178.图9示出了dna模板浓度的降低使δmango ii降低。如文中所述组装所述反应。对于这些反应,通过乙醇对照证明了t7产生的rnamango ii(灰色柱)。针对乙醇对照产生的荧光输出被任意指定为100%并且将其用作经250μm睾酮激活的反应的参考(黑色柱)。结果示出随着dna模板浓度下降到每反应25ng以下,检测δmango ii的能力丧失(****p《0.0001,***p=0.003)。
179.图10示出了将t7单位从50u滴定到10u将荧光降低到变化检测阈值以下。对t7 rna聚合酶进行滴定,使得添加了每反应50u到10u的酶。所述反应仅由t7 rna聚合酶、dna模板和反应缓冲液组成。值得注意的是,在50u下,由反应产生的mango ii产生了约340000的荧光读数。当添加40u的酶时,所述荧光读数很好地减少到约200000。任何进一步稀释都未产生可测量到的荧光变化,这表明约200000的荧光单位是此反应的阈值。
180.图11示出了δmango ii检测的阈值。利用50u或100u的t7 rna聚合酶、dna模板、反应缓冲液、50ng ar、100ng hsp90和250μm睾酮(或乙醇作为对照)建立了反应。数据显示当添加50u t7酶时,能够检测到δmango ii,然而,效应大小相对较小,但很显著(n=5,*p=0.0155利用sidaks事后测试的单向anova)。当添加100u的t7酶时,容易地检测到效应大小更大的δmango ii(n=5,****p《0.0001)。δmango ii检测的阈值为约200000。如果输出下降到此值以下,将难以解释测试结果。
181.图12示出了单个ere位点强到足以使经雌二醇激活的erα降低t7转录。如文中所述组装所述反应。对于这些反应,通过乙醇对照证明t7产生的rna mango ii。将乙醇对照包含在内,因为乙醇对照是类固醇激素、雌二醇(e2)的稀释剂。针对乙醇对照产生的荧光输出被任意指定为100%,并且将其用作经雌二醇激活的反应的参考。添加了5um的雌二醇以激活erα。n=3,****p《0.001(相对于乙醇),利用dunnett的多重比较测试进行的单向anova。
182.图13示出了ar/hsp90-are测定能够检测aas和sarm的范围。使用了睾酮(250μm)作为阳性参考,而使用了乙醇作为阴性参考并且将活性设置为100%(绿色虚线)。相对于乙醇对照对所有数据进行归一化。文中描述的雄激素分子的类别(表10)。
183.图14示出了rna聚合酶活性未受血清影响。用dna模板(100ng)、缓冲液、无核酸酶的水并且针对ar反应,ar(50ng)、hsp90(100ng)组装反应。在反应开始之前在添加100u(或等效的)t7 rna聚合酶的情况下添加马血清或fcs(10μl)。将反应保持在37℃下持续150分钟,之后用to1-生物素(100nm)检测到mango ii rna适配体。数据显示马血清或fcs的存在对mango ii的t7产生无影响。
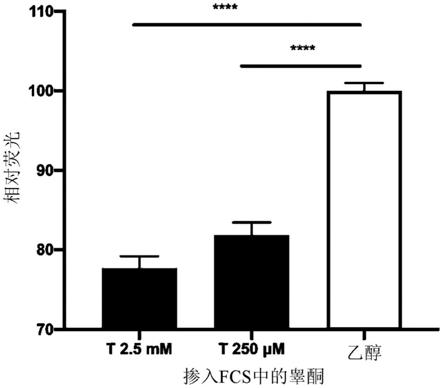
184.图15示出了在血清样品中检测睾酮。除了添加了掺入有睾酮的13μl fcs之外,按文中所述组装反应。掺入乙醇的fcs用作非激活ar对照,并且t7活性被任意设置为100%。睾酮显示出对t7产生的mango ii的剂量依赖性抑制,其中对于更高的睾酮浓度,δmango ii
更大。p《0.0001,相对于乙醇,利用sidak的事后比较进行的单向anova。
185.图16示出了在尿液样品中检测雄激素活性。如文中所述组装反应。将乙醇用作用于ar激活的阴性(媒剂)对照,而将睾酮(250μm)用作阳性对照。小马#1和小马#2表示从两个不同的年轻雄性赛马获得的尿液样品。阉马#1和阉马#2表示从两个不同的雄性阉割马获得的尿液样品。掺入的群勃龙表示在解偶联和提取步骤之前已掺入有群勃龙的阉马尿液样品。针对乙醇对照测量的t7活性被任意设置为100%。睾酮示出在小马尿液样品和掺入的群勃龙尿液样品的情况下看到对t7产生的mango ii的抑制,然而对阉马样品测量到对t7活性的抑制很小。阉马的睾丸已被去除,并且由于这些器官是雄性的睾酮产生的主要来源,因此预期内源性雄激素水平会很低。
186.图17示出了使用shr/sre测定的激素原检测。用s9肝脏部分对雄烯二酮进行预培养,然后提取肝脏s9部分反应以获取类固醇。然后针对雄激素活性对提取的样品进行测试。数据显示甲醇对照表示完全的t7活性,当在不存在雄激素的情况下添加ar/hsp90时所述活性不受影响。当对雄烯二酮/s9提取的样品进行测试时,与雄烯二酮(n=2,独立地无nad s9部分/提取反应)相比,荧光读数(n=2,独立地类固醇代谢/提取反应)显著降低。
187.一般定义
188.除非另外特别定义,否则本文所使用的所有技术和科学术语应被视为具有与本领域(例如,在免疫学、免疫组织化学、蛋白质化学、分子遗传学、合成生物学和生物化学)的普通技术人员通常所理解的含义相同的含义。
189.旨在提及本文公开的数字的范围(例如,1到10)也并入了对于在所述范围内的所有相关数字(例如,1、1.1、2、3、3.9、4、5、6、6.5、7、8、9和10)以及还在所述范围内的有理数的任何范围(例如,2到8、1.5到5.5以及3.1到4.7)的提及,并且因此,明确公开了本文明确公开的所有范围的所有子范围。这些仅是特定意图的实例,且在所列举的最低值与最高值之间的数值的所有可能组合被视为以类似方式在本技术中明确地陈述。
190.术语“和/或”,例如“x和/或y”应被理解为“x和y”或“x或y”,并且应被视为对这两个含义或任一含义提供明确支持。
191.术语“一个(a)”或“一种(an)”是指指定的实体中的一个或多于一个实体;例如,“受体”或“核酸分子”可以指一个或多个受体或核酸分子,或至少一个受体或核酸分子。因此,术语“一个(a)”或“一种(an)”、“一个或多个”和“至少一个”在本文中可以互换使用。
192.贯穿本说明书,词语“包括(comprise)”或如“包括(comprises)”或“包括(comprising)”等变体应当被理解为暗示包含所陈述要素、整数或步骤或要素组、整数组或步骤组,但不排除任何其它要素、整数或步骤或要素组、整数组或步骤组。
193.贯穿本说明书,除非另有特别说明或上下文另有要求,否则对单个步骤、物质组成、步骤组或物质组成组的引用应被视为涵盖这些步骤中的一个和多个(a plurality of)(即一个或多个(more))步骤、物质组成、步骤组或物质组成组。
194.所选定义
195.出于本发明的目的,以下术语应具有以下含义。
196.如本文所用,术语“测试试剂盒”是指包括各个组分以执行根据本文所述的发明的测定和方法的制品。
197.如本文所用,术语“类固醇激素受体”或“shr”是指蛋白质或多肽,包含选择性地与
配体结合的重组多肽,所述配体能够激活类固醇激素受体,并且包含但不限于雄激素受体、雌激素受体、孕酮受体、盐皮质激素受体和糖皮质激素受体。典型地,类固醇激素受体包括配体结合结构域、激活结构域和脱氧核糖核酸结合结构域。根据此定义,“类固醇激素受体”可以任选地包含帮助将类固醇激素受体保持在折叠和激素应答状态以被配体激活的其它辅因子,包含(例如)热休克蛋白等。
198.如本文所用,术语“类固醇激素受体辅因子”是指在被配体置换之前将类固醇激素受体保持在非活性状态的一个或多个辅因子,在被配体取代时类固醇激素受体变为激活的。根据本发明的类固醇激素受体辅因子的实例包含但不限于:热休克蛋白90(hsp90);hsp90和热休克蛋白70(hsp70)的复合物;hsp90、hsp70和热休克蛋白40(hsp40)的复合物;hsp90、hsp70、hsp40和p23的复合物;hsp90、hsp70、hsp40、p23和热休克蛋白组织蛋白(hop)的复合物;hsp90、hsp70、hsp40、p23、hop和48kd hip蛋白(hip)的复合物;hsp90、hsp70、hsp40、p23、hop、hip和p60的复合物;以及hsp90、hsp70、hsp40、p23、hop、hip、p60和fkbp52的复合物。
199.术语“配体”总体上是指与受体结合的任何分子,并且包含但不限于类固醇、多肽、蛋白质、维生素、碳水化合物、糖蛋白、治疗剂、药物、糖胺聚糖或其任何组合。如本文所用,“配体”包含但不限于类固醇激素,如包含但不限于雌激素、孕酮、雄激素等性激素,以及所述类固醇激素的天然和合成的衍生物和类似物以及代谢物、设计者类固醇激素、合成代谢雄激素类固醇以及选择性雄激素、孕酮和雌激素受体调节剂、目前已知的那些以及预期将在生物样品中开发或天然存在的那些。
200.如在本文中可互换使用的术语“受体-配体复合物”和“经激活的类固醇激素受体”是指配体结合的类固醇激素受体,其中所述类固醇激素受体在与配体结合时经历结构转变并且然后被称为处于激活形式。如本文所述的受体-配体复合物包含但不限于配体结合的激素受体的二聚体(即(hr-l)2)。
201.如本文所用,术语“基因组应答”是指经激活的类固醇激素受体(或受体-配体复合物)选择性地与其对应的核酸应答元件结合并且激活或抑制下游基因的转录的能力。在细胞环境中,配体结合的受体与核酸应答元件结合并且响应于外部刺激(即配体的存在)接通或断开基因。已经开发了根据本发明的测试试剂盒、测定和方法以通过提供模拟基于细胞的系统的各方面的基于报告子的框架来鉴定在细胞环境中将引发类固醇激素基因组应答的配体。
202.如本文所用,术语“类固醇代谢机制”是指任何酶,并且包含足以将配体从生理非活性形式转化为生理活性形式,或从生理活性形式转化为更具生理活性的形式,或从生理活性形式转化为较低生理活性的形式,或从生理活性形式转化为生理非活性形式的酶的组合。
203.如本文所用,术语“检测装置”是指被适配成检测经激活的类固醇激素受体与核酸应答元件之间的结合相互作用的任何设备、装备或构型。检测装置的实例包含但不限于光学方法、光谱学、可见光谱学、拉曼光谱学、uv光谱学、表面等离子体共振、电化学方法、阻抗、电阻、电容、通过质量变化、机械共振变化进行的机械感测、电泳、凝胶电泳、凝胶阻滞、成像、荧光以及荧光共振能量转移、聚合酶链反应等。
204.如本文所用,术语“核酸序列”是指脱氧核糖核酸(dna)序列、核糖核酸序列(rna)、
信使核糖核酸(mrna)和互补dna(cdna),并且包含两个或多个核苷酸,也被称为多核苷酸或寡核苷酸的连续的序列。核酸序列可以是单链或双链的。
205.如本文所用,术语“报告构建体”是指对报告分子进行编码的核酸序列,所述报告分子对可以测定其表达的rna进行编码;此rna包含但不限于荧光团结合适配体,或合成rna或mrna。另外,报告基因可以涵盖可以通过rna分析检测其表达产物的任何所关注的基因的基因。
206.如本文所用,术语“启动子”是在可操作地连接的经转录的序列的5'端部处位于转录的起点附近的核酸序列。启动子可以含有在调节可操作地连接的基因的转录中相互作用的一个或多个调节元件。根据本发明的启动子的实例包含但不限于t7、t3和sp6噬菌体启动子或起始序列。术语“启动子”、“启动子序列”、“起始子序列”或“起始序列”贯穿本说明书可互换使用以表示相同的事物。
207.如本文所用,术语“可操作地连接”描述了两个大分子元件,所述两个大分子元件被布置成使得调节第一元件的活性诱导对第二元件的作用。以此方式,启动子元件的活性的调节可以用于改变和/或调节可操作地连接的报告构建体的表达。例如,与启动子元件可操作地连接的报告基因构建体的转录由“激活”启动子的活性的因子诱导;与启动子元件可操作地连接的报告基因构建体的转录由“阻断”启动子的活性的因子抑制。因此,如果此报告构建体的转录受到启动子的活性影响,则启动子区域与报告构建体可操作地连接。
208.如本文所用,术语“表达”是指在基因内进行编码的信息所表达的过程。如果基因对蛋白质进行编码,则表达包括将dna转录为mrna,即将mrna(如果需要)处理为成熟的mrna产物,以及将成熟的mrna翻译为蛋白质两者。如果如脱氧核糖核酸(dna)或基因等核酸分子含有多肽的编码序列和在适当的宿主环境中提供将容纳在dna中的遗传信息转录、处理和翻译为蛋白质产物的能力的表达控制序列,并且如果此类表达控制序列与对多肽进行编码的核苷酸序列可操作地连接,则所述分子被称为“能够表达”多肽(或蛋白质)。
209.如本文所用,术语“样品”是指期望针对配体的存在进行测试的任何样品。术语“样品”和“测试样品”在本说明书中可互换使用。
210.如本文所用,术语“相对效力”或“rp”是指测试化合物相对于参考化合物展现出的生物活性的乘数,其中生物活性由化合物与(例如)如使用本文所述的测定和测试试剂盒测量的类固醇激素受体结并激活类固醇激素受体的能力定义。当相对效力》1时,与参考化合物相比,测试化合物在其生物活性方面更具效力;在相对效力《1的情况下,与参考化合物相比,测试化合物在其生物活性方面效力更低;并且在相对效力=1的情况下,测试化合物和参考化合物在其生物活性方面效力相等。
211.如本文所用,术语“激活因子”或“af”涉及测试化合物(例如)从生理非活性状态到生理活性状态或从较低生理活性的状态到更具生理活性的状态的代谢转化的量度。激活因子》1意味着,测试化合物经历了在测定中在代谢机制存在的情况下到更具生理活性的状态的代谢转化。
212.术语“参考阈值”或“参考标准”可互换使用以表示(例如)在测试样品不存在或测试样品和类固醇激素受体不存在的情况下测量的测定活性的水平。在根据本文描述的发明的某些实例中,参考阈值或参考标准是使用乙醇代替测试样品确定的。参考阈值的目的是在不存在目标配体的情况下建立测定的任何基线活性或信号。
具体实施方式
213.本发明提供了用于针对能够激活类固醇激素受体并且引发类固醇激素基因组应答的配体的存在对样品进行筛选的测试试剂盒、测定和方法。
214.在根据本发明的某些实例中,本文所述的测试试剂盒、测定和方法可用于例如,通过测量从受试者获得的样品的雄激素和/或雌激素活性来确定受试者的激素状态。然后可以使用此信息来确定,例如,受试者是否患有癌症或有患癌症的风险,或者可以用于研究与衰老,例如更年期相关的内分泌问题或可以用于评估激素替代疗法或激素抑制疗法的功效。
215.在根据本发明的其它实例中,本文所述的测试试剂盒、测定和方法可用于针对禁用的添加剂或针对可能对健康有害的天然激活剂,包含但不限于可以促进激素敏感型癌症的植物雌激素对食品和保健食品补充剂进行筛选。
216.酶介导的活性测定和测试试剂盒
217.本文所述的测试试剂盒和方法所基于的根据本发明的测定基本上是基于活性的测定,所述测定依据通过源自待测样品的配体的结合而进行的类固醇激素受体激活的原理工作。类固醇激素受体的激活发生在配体与受体结合并诱导蛋白质的三级结构的构象变化时,这意味着之后受体-配体复合物(在本文中也被称为“经激活的类固醇激素受体”)能够与核酸应答元件结合并且影响rna聚合酶并且引发所谓的“基因组应答”。换言之,能够上调或下调来自细胞的基因组的基因的表达,这然后可能引起生理作用。通过本文所述的测试试剂盒、测定和方法测量的正是经激活的类固醇激素受体与核酸应答元件之间的此结合相互作用,作为用于检测所研究的样品中具有类固醇或类固醇样活性的配体的存在的代理。
218.重要的是,这意味着根据本发明的测试试剂盒和测定能够检测由未知结构的配体,如(例如)“设计药物”引发的类固醇激素生物活性/活性。从历史上看,这是不可能的,因为常规实验室测试装备,如气相/液相色谱和质谱需要事先了解所研究分子的结构。
219.针对类固醇激素生物活性/活性的检测的先前方法涉及酵母和哺乳动物细胞报告测定(例如,参考cooper等人(2013)《传感器(sensors)》13:2148-2163)。此类测定具有公认的局限性,如需要(例如)专业装备和专业知识来维持活细胞培养。在很大程度上模拟基于细胞的系统的分子框架上建模的无细胞测定的开发已经产生了与其基于细胞的报告对应物相比具有增强的功能和提高的测定灵敏度的体外侧测定。然而,无细胞测定的局限性在于需要使用多亚基全酶聚合酶,如rna聚合酶ii。重组产生rna聚合酶ii极度难以以可变的再现性实现,并且因此,通常通过使用所有组分都存在并在启动子序列处聚集在一起的核提取物来使全酶可用。然而,由真核细胞制备核提取物在制造上费用高昂,因为需要费用高昂的细胞生长培养基和富集核材料所需的技术专业知识。
220.为了解决此局限性,申请人现在开发了基于体外转录反应的无细胞测定,所述反应涉及更容易获得的单多肽聚合酶。
221.在开发这些下一代测定时,申请人鉴定源自(例如)噬菌体感染的原核细胞的单多肽dna依赖性rna聚合酶能够表达报告构建体读数。请参阅实例1-2,结合图1-16阅读。
222.重要的是,使用重组的市售噬菌体聚合酶替代了对制造费用高昂的核提取物的需要。
223.因此,在本发明的一个方面,提供了一种用于针对能够引发类固醇激素基因组应
答的配体的存在对样品进行筛选的测试试剂盒,所述测试试剂盒包括:
224.(i)类固醇激素受体,所述类固醇激素受体能够与来自所述样品的配体形成配体-受体复合物;以及
225.(ii)核酸分子,所述核酸分子包括:
226.(a)聚合酶启动子序列;
227.(b)应答元件,所述应答元件能够被所述配体受体复合物结合;以及
228.(c)报告构建体,
229.其中所述应答元件(b)位于所述启动子序列(a)与所述报告构建体(c)之间,并且(a)、(b)和(c)可操作地连接;以及
230.(iii)单多肽聚合酶,
231.其中所述样品中配体的存在是通过测量当所述样品与所述测试试剂盒组合时由所述配体-受体复合物与所述应答元件的结合引起的所述报告构建体的转录减少或抑制来检测的。
232.在本发明的一个实例中,所述测试试剂盒进一步包括核苷酸三磷酸(ntp)。
233.在本发明的又另一方面,提供了一种用于在样品中检测配体的测定方法,所述配体能够引发类固醇激素基因组应答,所述测定方法包括以下步骤:
234.(i)使样品与以下接触:
235.(a)类固醇激素受体,所述类固醇激素受体与来自所述样品的配体形成配体-受体复合物;以及
236.(b)核酸分子,所述核酸分子包括:
237.(1)聚合酶启动子序列;
238.(2)应答元件,所述应答元件被所述配体-受体复合物结合;以及
239.(3)报告构建体,
240.其中所述应答元件(b)位于所述启动子序列(a)与所述报告构建体(c)之间,并且(a)、(b)和(c)可操作地连接;
241.(c)单多肽聚合酶;以及
242.(d)核苷三磷酸;以及
243.(ii)测量由所述配体-受体复合物与所述应答元件的结合引起的所述报告构建体的转录减少或抑制,
244.其中所述报告构建体的所测得的转录减少或抑制反映在所述样品中检测到配体。
245.本文所述的测试试剂盒和测定方法赋予的重要优势是显著降低了在酵母和哺乳动物细胞报告测定的细胞环境中另外存在的分子复杂性,或通过使用核提取物进行无细胞测定,如wo2018/088852中描述的需要rna聚合酶ii来执行的那些而产生的分子复杂性。降低的分子复杂性通过限制在目标配体不存在的情况下类固醇激素受体对激素应答元件的非特异性激活使测定特异性显著增强。应当理解,激素应答元件(例如雄激素应答元件)对其互补受体(例如雄激素受体)不是高度选择性的,并且事实上可以被可以存在于细胞或核提取物内的其它类固醇激素受体激活。例如,在雄激素应答元件的情况下,ii组激素受体类别中的其它非雄激素受体,如孕酮受体a、孕酮受体b、糖皮质激素受体和/或盐皮质激素受体潜在地可以激活are。这进而降低了测定特异性。
246.事实上,不存在由细胞环境或核提取物产生的分子复杂性意味着本文所述的测试试剂盒和测定方法对于其目标配体的检测是高度选择性的。进一步地,容易地切换(例如)类固醇激素受体和/或激素应答元件的能力在本文所述的用于检测所关注的其它目标配体的测试试剂盒和测定方法中产生多功能性。
247.本文所述的测试试剂盒和测定方法赋予的另一个重要的优势是化学计量地定义生物反应的独特能力。例如,通过精确控制必要测定组分与非必要测定组件两者之间的分子关系,可以显著增强对于目标配体的检测的测定灵敏度。换言之,本文所述的测试试剂盒和测定方法可以被配置成测量经激活的配体-激素受体复合物与存在于报告构建体中的激素应答元件之间的结合相互作用的最优数量。相比之下,即使不是不可能,也难以复制对被配置成检测配体的存在的基于细胞的报告测定的相同程度的控制,因为无法准确预测或控制对(例如)克隆到细胞中的重组受体和/或核酸应答元件进行编码的基因或核酸序列的总拷贝数。对于基于核提取物的无细胞报告测定也很难进行控制,其中难以确定存在的rna聚合酶ii亚基、辅因子和其它非必要蛋白的确切数量。
248.这些和其它考虑由以下实施例记录。作为说明,当结合图6-9阅读时参考实例2。具体地,在涉及检测雄激素配体(例如睾酮)的原型测定中(“雄激素测定原型2”),申请人展示了经激活的雄激素受体(ar)在与其互补激素应答元件(are;位于如本文所定义的核酸序列内)结合并且当以下时阻断受体构建体的t7介导的表达时最有效:(i)ar:核酸比率为≥7.2,并且(ii)反应混合物中核酸的浓度为≥0.789nm。
249.因此,在根据本文所述的测试试剂盒、测定和方法的另外的实例中,类固醇激素受体与核酸的比率介于约7:1与约10:1之间,并且包含但不限于7.0:1、7.1:1、7.2:1、7.3:1、7.4:1、7.5:1、7.6:1、7.7:1、7.8:1、7.9:1、8.0:1、8.1:1、8.2:1、8.3:1、8.4:1、8.5:1、8.6:1、8.7:1、8.8:1、8.9:1、9.0:1、9.1:1、9.2:1、9.3:1、9.4:1、9.5:1、9.6:1、9.7:1、9.8:1、9.9:1和10.0:1。
250.技术人员将进一步理解,类固醇激素受体与包括激素受体应答元件的核酸之间的分子化学计量可以根据测试试剂盒/测定的组分部分以及待测样品的性质而变化。例如,可以将测试试剂盒/测定配置成检测与不同类固醇激素受体结合的配体,所述类固醇激素受体包含但不限于雄激素受体、雌激素受体α、雌激素受体β、孕酮受体a、孕酮受体b、盐皮质激素受体和糖皮质激素受体,其中类固醇激素受体与其互补核酸/应答元件之间的比率可以介于(例如)约1:1与约20:1之间。
251.因此,在根据本文所述的测试试剂盒和测定方法的又另一实例中:
252.(i)测试试剂盒包括雄激素受体,并且雄激素受体与包括雄激素应答元件的核酸的比率介于约1:1与约20:1之间,包含但不限于1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、11:1、12:1、13:1、14:1、15:1、16:1、17:1、18:1、19:1或20:1;
253.(ii)测试试剂盒包括雌激素受体,并且雌激素受体与包括雌激素应答元件的核酸的比率介于约1:1与约20:1之间,包含但不限于1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、11:1、12:1、13:1、14:1、15:1、16:1、17:1、18:1、19:1或20:1;
254.(iii)测试试剂盒包括孕酮受体,并且孕酮受体与包括孕酮应答元件的核酸的比率介于约1:1与约20:1之间,包含但不限于1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、11:1、12:1、13:1、14:1、15:1、16:1、17:1、18:1、19:1或20:1;
255.(iv)测试试剂盒包括盐皮质激素受体,并且盐皮质激素受体与包括盐皮质激素应答元件的核酸的比率介于约1:1与约20:1之间,包含但不限于1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、11:1、12:1、13:1、14:1、15:1、16:1、17:1、18:1、19:1或20:1;并且
256.(v)测试试剂盒包括糖皮质激素受体,并且糖皮质激素受体与包括糖皮质激素应答元件的核酸的比率介于约1:1与约20:1之间,包含但不限于1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、11:1、12:1、13:1、14:1、15:1、16:1、17:1、18:1、19:1或20:1。
257.尽管有上述考虑,但必须注意不要用过多的受体使测定饱和,因为这本身可以产生阻止配体-受体复合物与其互补应答元件的最优结合的热动力学或动力学障碍。根据本文提供的公开,技术人员可以进行常规实验以对类固醇激素受体的经优化的浓度/范围进行滴定以执行本文所述的测试试剂盒和测定方法(例如,参考下面的实例2.3)。
258.如先前提到的,申请人进一步确定,类固醇激素受体在不存在对其类固醇激素受体具有特异性的配体的情况下保留了某些与其对应核酸应答元件结合并激活所述对应核酸应答元件的能力。此现象有时被称为核酸应答元件的自体激活。尽管由于分子复杂性降低,在本文所述的测试试剂盒和测定中自体激活的水平显著降低,但可能期望确定在不存在配体的情况下的参考阈值(即作为应答元件的自体激活的结果的基线信号)以帮助确定在含有目标配体的样品存在的情况下的绝对测定信号/读数。
259.因此,在根据本文所述的测试试剂盒和测定方法的另一实例中,报告构建体的转录减少或抑制是相对于参考阈值测量的。
260.在根据本文所述的测试试剂盒和测定方法的又另一实例中,报告构建体的转录减少或抑制是相对于如通过测量报告构建体在测试样品不存在的情况下的转录所确定的参考阈值测量的。
261.在根据本文所述的测试试剂盒和测定方法的又另外的实例中,报告构建体的转录减少或抑制是相对于如通过测量报告构建体在测试样品不存在的情况下和在受体不存在的情况下的转录所确定的参考阈值测量的。
262.在用于增强测定特异性和执行的并行方法中,可以修改本文所述的测试试剂盒和测定方法以包含至少一个类固醇激素受体辅因子。辅因子的主要目的是将类固醇激素受体保持在非活性构象中,从而防止在目标配体不存在的情况下类固醇激素受体与激素应答元件结合并激活激素应答元件。
263.当测试试剂盒与测试样品接触(或组合)时,配体的存在引起对辅因子的取代,并且然后配体结合的受体自由地与第二配体结合的受体和激素应答元件形成复合物。
264.因此,在根据本文所述的测试试剂盒和测定方法的另一实例中,测试试剂盒或测定方法进一步包括至少一个类固醇激素受体辅因子。
265.在相关实例中,类固醇激素受体辅因子包含但不限于选自以下的类固醇激素受体辅因子:热休克蛋白90(hsp90);hsp90和热休克蛋白70(hsp70)的复合物;hsp90、hsp70和热休克蛋白40(hsp40)的复合物;hsp90、hsp70、hsp40和p23的复合物;hsp90、hsp70、hsp40、p23和热休克蛋白组织蛋白(hop)的复合物;hsp90、hsp70、hsp40、p23、hop和48kd hip蛋白(hip)的复合物;hsp90、hsp70、hsp40、p23、hop、hip和p60的复合物;以及hsp90、hsp70、hsp40、p23、hop、hip、p60和fkbp52的复合物。
266.在根据本文所述的测试试剂盒和测定方法的另外相关的实例中,测试试剂盒或测
定方法进一步包括热休克蛋白90。
267.然而,本领域的技术人员将理解,类固醇激素受体辅因子的存在不是本文所述的测试试剂盒、测定和方法的必要特征。这是因为在不存在辅因子的情况下仍然可以实现测定结果。例如,实例1/图4中呈现的数据展示了,在不存在热休克蛋白90的情况下,配体测定结果与非配体测定结果(即ar/t对ar)之间的信号仍存在可测量的差异。
268.事实上,还存在例如通过改变测定方法所执行的温度最小化通过由非配体结合的受体对激素应答元件的自体激活产生的信号的量的另外的方法。
269.申请人已经观察到配体结合的类固醇激素受体与非配体结合的类固醇激素受体之间对其核酸应答元件的结合亲和力/动力学的差异。因此,可以在优先测量由配体结合的受体而不是非配体结合的受体对激素应答元件的激活的温度下或温度范围内执行本文所述的测试试剂盒、测定和方法,由此最小化由非配体结合的受体产生的任何背景信号。
270.因此,在根据本发明的此方面的又另一实例中,测试试剂盒或测定方法的执行在约25℃到约42℃以及优选地约35℃到约37℃的温度范围下执行。
271.术语“约25℃到约42℃的温度范围”旨在包含25℃到42℃的任何温度,并且非限制性地包含25℃、26℃、27℃,28℃、29℃、30℃、31℃、32℃、33℃、34℃、35℃、36℃、37℃、38℃、39℃、40℃、41℃和42℃。本领域技术人员将认识到也可以使用小数点范围内的温度。为了进一步说明这一点,“在约35℃到约37℃的温度范围内”包含但不限于35.0℃、35.1℃、35.2℃、35.3℃、35.4℃、35.5℃、35.6℃、35.7℃、35.8℃、35.9℃、36.0℃、36.1℃、36.2℃、36.3℃、36.4℃、36.5℃、36.6℃、36.7℃、36.8℃、36.9℃和37.0℃。
272.申请人进一步发现,可以操纵辅因子与类固醇激素受体之间的化学计量关系以进一步增强测定灵敏度。例如,根据实例2中描述的雄激素测定原型2,申请人确定当hsp90:ar比率介于约1.22与4.88之间时,ar在被ar特异性配体激活和与are结合方面最有效。
273.因此,在根据本文所述的测试试剂盒和测定方法的另外的实例中,hsp90与类固醇激素受体的比率被限定为介于约1:1到约5:1之间。这包含但不限于被限定为以下的hsp90与类固醇激素受体的比率:1.0:1、1.1:1、1.2:1、1.3:1、1.4:1、1.5;1、1.6:1、1.7:1、1.8:1、1.9:1、2.0:1、2.1:1、2.2:1、2.3:1、2.4:1、2.5;1、2.6:1、2.7:1、2.8:1、2.9:1、3.0:1、3.1:1、3.2:1、3.3:1、3.4:1、3.5;1、3.6:1、3.7:1、3.8:1、3.9:1、4.0:1、4.1:1、4.2:1、4.3:1、4.4:1、4.5;1、4.6:1、4.7:1、4.8:1、4.9:1或5.0:1。
274.然而,技术人员将理解,类固醇激素受体辅因子与类固醇激素受体之间的分子化学计量可以根据测试试剂盒/测定的组成而变化。例如,可以将测试试剂盒/测定配置成检测与雌激素受体结合的配体,所述雌激素受体包含雌激素受体α或雌激素受体β,并且雌激素受体辅因子与雌激素受体之间的比率可以(例如)介于约1:1与约20:1之间。
275.因此,在根据本文所述的测试试剂盒和测定方法的又另一实例中:
276.(i)测试试剂盒包括雄激素受体,并且雄激素受体辅因子与雄激素受体的比率介于约1:1与约20:1之间,包含但不限于1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、11:1、12:1、13:1、14:1、15:1、16:1、17:1、18:1、19:1或20:1;
277.(ii)测试试剂盒包括雌激素受体,并且雌激素受体辅因子与雌激素受体的比率介于约1:1与约20:1之间,包含但不限于1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、11:1、12:1、13:1、14:1、15:1、16:1、17:1、18:1、19:1或20:1;
278.(iii)测试试剂盒包括孕酮受体,并且孕酮受体辅因子与孕酮受体的比率介于约1:1与约20:1之间,包含但不限于1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、11:1、12:1、13:1、14:1、15:1、16:1、17:1、18:1、19:1或20:1;
279.(iv)测试试剂盒包括盐皮质激素受体,并且盐皮质激素受体辅因子与盐皮质激素受体的比率介于约1:1与约20:1之间,包含但不限于1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、11:1、12:1、13:1、14:1、15:1、16:1、17:1、18:1、19:1或20:1;并且
280.(v)测试试剂盒包括糖皮质激素受体,并且糖皮质激素受体辅因子与糖皮质激素受体的比率介于约1:1与约20:1之间,包含但不限于1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、11:1、12:1、13:1、14:1、15:1、16:1、17:1、18:1、19:1或20:1。
281.实例4的表9中的信息总结了在考虑本文所述的测试试剂盒和测定方法的组成时与分子化学计量论点相关的关键考虑因素,这特别地受到实例1-3附带的数据的支持。
282.根据本发明的测定反应混合物通常将含有10ul到50ul总体积。根据表9中总结的信息,这意味着:
283.(i)类固醇激素受体的浓度应保持在由约10nm到约60nm定义的范围内,包含但不限于类固醇激素受体的10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59或60nm;
284.(ii)包括激素应答元件的核酸分子的浓度应保持在由约0.70nm到约3.5nm定义的范围内,包含但不限于核酸分子的0.70、0.80、0.90、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2或3.3nm;并且
285.(iii)在存在的情况下,热冲击蛋白90的浓度应保持在由约40nm到约60nm限定的范围内,包含但不限于热休克蛋白90的40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59或60nm。
286.进一步考虑了酶的浓度/量,其中当在反应混合物中采用约50-100个酶单位(u)时,假设绝对基线阈值活性为约200,000u,可以实现最优测定结果。参见图10和11。
287.在根据本文所述的测试试剂盒和测定方法的又另一实例中,转录减少或抑制是由选自噬菌体rna聚合酶、病毒rna聚合酶、细菌rna聚合酶和真核病毒rna聚合酶的单多肽聚合酶介导的转录减少或抑制。
288.在相关实例中,聚合酶是噬菌体rna聚合酶。在另外的相关实例中,启动子序列是噬菌体rna聚合酶起始序列。
289.在根据本文所述的测试试剂盒和测定方法的又另一实例中,聚合酶是选自由包含t7 rna聚合酶、t3 rna聚合酶和sp6 rna聚合酶的dna依赖性rna聚合酶组成的组的噬菌体聚合酶。
290.在根据本文所述的测试试剂盒和测定方法的另一实例中,噬菌体聚合酶是t7 rna聚合酶。
291.在根据本文所述的测试试剂盒和测定方法的另一实例中,启动子序列是t7 rna聚合酶起始序列。
292.在相关实例中,t7 rna聚合酶起始序列包括由5'-taatacgactcactatag-3'(seq id no:1)定义的序列。
qpcr)等已建立的技术或使用如基于嵌入染料的检测或荧光核苷酸的直接添加的荧光等其它技术进行半量化/量化。例如,使用与rna适配体结合的荧光团以形成rna-荧光团复合物,如本文所述。这些和其它技术对于本领域的技术人员来说将是已知的。
307.本文所述的测试试剂盒和测定方法被配置成用于检测将与类固醇激素受体结合的已知结构和未知结构两者的各个配体,所述类固醇激素受体包含雄激素受体(ar)、雌激素受体α(er-α)、雌激素受体β(er-β)、孕酮受体a(pra)、孕酮受体b(prb)、盐皮质激素受体(mr)和糖皮质激素受体(gr)。
308.已知与雄激素受体结合的配体的实例包含但不限于:睾酮、二氢睾酮;雄激素合成代谢类固醇(aas),所述aas包含但不限于trena、17α-群勃龙、17β-群勃龙、群迪酮、去甲睾酮、宝丹酮、四烯雌酮;选择性雄激素受体调节剂(sarm),所述sarm包含但不限于93746、bms-546929、lgd4033、acp105、yk-11、安达林(andarine)、利甘德罗、奥斯达林(ostarine)。
309.已知与雌激素受体α结合的配体的实例包含但不限于:雌二醇、雌酮、雌三醇;选择性雌激素受体调节剂,所述选择性雌激素受体调节剂包含雷洛昔芬(raloxifene)、他莫昔芬(tamoxifen)、托瑞米芬(toremifene)、奥培米芬(ospemifene)、拉索昔芬(lasofoxifene)、环芬尼(cyclofenil)、氯米芬(clomifene)、溴帕雌酚(broparestrol,)、基多昔芬(basedoxifene)、双炔失碳酯(anordrin);植物雌激素,所述植物雌激素包含但不限于膳食雌激素,如多酚(白藜芦醇)、黄烷酮(圣草酚、橙皮素、高圣草酚、柚皮素)、黄酮(芹菜素、木犀草素、橘皮素)、黄酮醇(漆黄素、山柰酚、杨梅素、霍香黄酮醇、槲皮素、鼠李秦素)、儿茶素(原花青素)、异黄酮(异黄酮鹰嘴豆芽素a、大豆素苷元(clycitein)、大豆苷元(daidzein)、刺芒柄花素(formononetin)、木黄酮(genistein))、异黄烷(雌马酚)、香豆素(香豆雌酚);雌激素样内分泌破坏性化学品(eedc),所述eedc包含但不限于二氯二苯三氯乙烷(ddt)、二恶英、多氯联苯(pcb)、双酚a(bpa)、多溴联苯(pbb)、邻苯二甲酸酯、硫丹(endosulfan)、莠去津(atrazine)、玉米赤霉醇;设计师化合物,如酰肼衍生物。
310.已知与雌激素受体β结合的配体的实例包含但不限于与雌激素受体α结合的所有配体,以及二芳基丙腈(dpn)和惠氏(wyeth)来源的苯并恶唑,如way-659、way-818和way-200070。
311.已知与孕酮受体a和孕酮受体b结合的配体的实例包含但不限于:孕酮、炔诺酮、左炔诺孕酮、醋酸甲羟孕酮、醋酸甲地孕酮、地屈孕酮、屈螺酮;选择性孕酮受体调节剂,包含醋酸乌利司他、醋酸特拉司酮、维拉立生(vilaprisan)、阿索立尼(asoprisnil)、阿索立尼酯(asoprisnil ecamate);抗孕酮,包含米非司酮(mifepristone)、奥那普利司酮(onapristone)、利洛普酮(lilopritone)和群勃龙(gestrinone)。
312.已知与盐皮质激素受体结合的配体的实例包含但不限于:醛固酮;合成盐皮质激素,如氟氢可的松(fludrocortisone);抗盐皮质激素,如螺内酯(spironolactone)和依普利酮(eplerenone);糖皮质激素受体配体,如下所述的那些。
313.已知与糖皮质激素受体结合的配体的实例包含但不限于地塞米松(dexamethasone)、氢化可的松(hydrocortisone)、可的松(cortisone)、泼尼松龙(prednisolone)、甲基泼尼松龙(methylprednisolone,)、泼尼松(prednisone)、安西奈德(amcinonide)、布地奈德(budesonide)、地奈德(desonide)、氟轻松(fluocinonide)、哈西奈德(halcinonide)、倍氯米松(beclometasone)、倍他米松(betamethasone)、氟可龙
(fluocortolone)、卤米松(halometasone)、莫米松(mometasone)或如拮抗剂米非司酮和、酮康唑。
314.示例性测定组分和构建体
315.由样品中存在的配体激活的类固醇激素受体将二聚化(即形成如所定义的受体-配体复合物)并且与其互补激素应答元件结合。在本文所述的测试试剂盒和测定中,激素应答元件与报告构建体连接,并且可以使用报告构建体的物理性质变化来反映所研究的样品中配体的存在。根据本发明的示例性激素应答元件包含:雄激素应答元件(are)、雌激素应答元件(ere)、孕酮应答元件(pre)、盐皮质激素应答元件(mre)和糖皮质激素应答元件(gre)。
316.如先前所述,各个激素应答元件并入了被配置成选择性地与经激活的配体-受体复合物结合的结合基序。例如,雄激素应答元件、雌激素应答元件、孕酮应答元件、盐皮质激素应答元件和糖皮质激素应答元件中的每个应答元件包括在其二级结构朝向上促进二聚化的配体受体复合物(即(hr-l)2)通过锌指结合基序结合的不完善二六聚体回文序列。
317.在根据本文所述的测试试剂盒和测定方法的实例中,雄激素应答元件包括与经激活的雄激素受体结合的dna结合基序。在相关实例中,dna结合基序与配体结合的雄激素受体的二聚体(即(ar-l)2;其中“ar”是雄激素受体,并且“l”是配体)结合。在相关实例中,dna结合基序包括在经激活的雄激素受体与雄激素应答元件之间产生结合特异性的不完善二六聚体回文序列。在另外的相关实例中,包括dna结合基序的雄激素应答元件是双链脱氧核糖核酸。
318.在根据本文所述的测试试剂盒和测定方法的实例中,雌激素应答元件包括与经激活的雌激素受体结合的dna结合基序。在相关实例中,dna结合基序与配体结合的雌激素受体的二聚体(即(er-l)2;其中“er”是选自er-α或er-β的雌激素受体)结合。在另外的相关实例中,dna结合基序包括在经激活的雌激素受体与雌激素应答元件之间产生结合特异性的不完善二六聚体回文序列。在另外的相关实例中,包括dna结合基序的雌激素应答元件是双链脱氧核糖核酸。
319.在根据本文所述的测试试剂盒和测定方法的实例中,孕酮应答元件包括与经激活的孕酮受体结合的dna结合基序。在相关实例中,dna结合基序与配体结合的孕酮受体的二聚体(即(pr-l)2;其中“pr”是选自pra或prb的孕酮受体)结合。在另外的相关实例中,dna结合基序包括在经激活的孕酮受体与孕酮应答元件之间产生结合特异性的不完善二六聚体回文序列。在另外的相关实例中,包括dna结合基序的孕酮应答元件是双链脱氧核糖核酸。
320.在根据本文所述的测试试剂盒和测定方法的实例中,盐皮质激素应答元件包括选择性地与经激活的盐皮质激素受体结合的dna结合基序。在相关实例中,dna结合基序与配体结合的盐皮质激素受体的二聚体(即(mr-l)2;其中“mr”是盐皮质激素受体)结合。在另外的相关实例中,dna结合基序包括在经激活的盐皮质激素受体与盐皮质激素应答元件之间产生结合特异性的不完善二六聚体回文序列。在另外的相关实例中,包括dna结合基序的盐皮质激素应答元件是双链脱氧核糖核酸。
321.在根据本文所述的测试试剂盒和测定方法的实例中,糖皮质激素应答元件包括选择性地与经激活的糖皮质激素受体结合的dna结合基序。在相关实例中,dna结合基序与配体结合的糖皮质激素受体的二聚体(即(gr-l)2;其中“gr”是糖皮质激素受体)结合。在另外
的相关实例中,dna结合基序包括在经激活的糖皮质激素受体与糖皮质激素应答元件之间产生结合特异性的不完善二六聚体回文序列。在另外的相关实例中,包括dna结合基序的糖皮质激素应答元件是双链脱氧核糖核酸。
322.检测与雄激素受体,如睾酮、二氢睾酮、合成类固醇激素(例如aas)和选择性雄激素受体调节剂(即sarm)和植物雄激素或异种雄激素结合并且激活雄激素受体的配体需要包括雄激素受体连同能够与经激活的雄激素-受体复合物结合的雄激素应答元件的测试试剂盒/测定。
323.在根据本文所述的测试试剂盒和测定方法的实例中,雄激素应答元件包括或在于序列5'-agaacannntgttct-3'(seq id no:4),其中n是选自g、c、t或a的任何核酸碱基。其互补反义序列被定义为5'-agaacannntgttct-3'(seq id no:5),其中n表示基于seq id no:4与5之间的序列比对与seq id no:4互补的碱基(即a=t;t=a;g=c;c=g)。
324.在根据本文所述的测试试剂盒和测定方法的另一实例中,雄激素应答元件包括或在于序列5'-ggtacannntgttct-3'(seq id no:6),其中n是选自g、c、t或a的任何核酸碱基。其互补反义序列被定义为5'-agaacannntgtacc-3'(seq id no:7),其中n表示基于seq id no:6与7之间的序列比对与seq id no:6互补的碱基(即a=t;t=a;g=c;c=g)。
325.检测与雌激素受体,如雌二醇、雌酮、包含植物雌激素和外源性雌激素的其它雌激素样类固醇激素以及选择性雌激素受体调节剂(serm)结合并且激活雌激素受体的配体需要包括雌激素受体α(er-α)或雌激素受体β(er-β)连同能够与经激活的雌激素-受体复合物结合的雌激素应答元件的测试试剂盒/测定。
326.在根据本文所述的测试试剂盒和测定方法的实例中,雌激素应答元件包括或在于序列5'-aggtcannntgacct-3'(seq id no:8),其中n是选自g、c、t或a的任何核酸碱基。其互补反义序列被定义为5'-aggtcannntgacct-3'(seq id no:9),其中n表示基于seq id no:8与9之间的序列比对与seq id no:8互补的碱基(即a=t;t=a;g=c;c=g)。
327.检测与孕酮受体,如孕酮、炔诺酮、左炔诺孕酮、其它孕酮样类固醇激素和选择性孕酮受体调节剂(sprm)结合并且激活孕酮受体的配体需要包括孕酮受体a(pra)或孕酮受体b(prb)连同能够与经激活的孕酮-受体复合物结合的孕酮应答元件的测试试剂盒/测定。
328.在根据本文所述的测试试剂盒和测定方法的实例中,孕酮应答元件包括或在于序列5'-ggtacaaactgttct-3'(seq id no:10)。其互补反义序列被定义为5'-agaacagtttgtacc-3'(seq id no:11)。
329.检测与盐皮质激素受体,如醛固酮、如氟氢可的松等合成盐皮质激素以及如螺内酯和依普利酮等抗盐皮质激素结合并且激活盐皮质激素受体的配体需要包括盐皮质激素受体连同能够与经激活的盐皮质激素受体复合物结合的盐皮质激素应答元件的测试试剂盒/测定。
330.在根据本文所述的测试试剂盒和测定方法的实例中,盐皮质激素应答元件包括或在于序列5'-agaacanaatgttct-3'(seq id no:12),其中n是选自g、c、t或a的任何核酸碱基。其互补反义序列被定义为5'-agaacattntgttct-3'(seq id no:13),其中n表示基于seq id no:12与13之间的序列比对与seq id no:12互补的碱基(即a =t;t=a;g=c;c=g)。
331.检测与糖皮质激素受体,如皮质醇、地塞米松和11-二氢皮质酮结合并且激活糖皮质激素受体的配体需要包括糖皮质激素受体连同能够与经激活的糖皮质激素-受体复合物
结合的糖皮质激素应答元件的测试试剂盒/测定。
332.在根据本文所述的测试试剂盒和测定方法的实例中,糖皮质激素应答元件包括或在于序列5'-agaacanaatgttct-3'(seq id no:12),其中n是选自g、c、t或a的任何核酸碱基。其互补反义序列被定义为5'-agaacattntgttct-3'(seq id no:13),其中n表示基于seq id no:12与13之间的序列比对与seq id no:12互补的碱基(即a=t;t=a;g=c;c=g)。
333.根据本文所述的测试试剂盒和测定方法的示例性核酸序列包含但不限于:
334.t7i-are(n)-mangoii:其中n=1、2、3、4;
335.t7i-ere(n)-mangoii:其中n=1、2、3、4;
336.t7i-pre(n)-mangoii:其中n=1、2、3、4;
337.t7i-mre(n)-mangoii:其中n=1、2、3、4;
338.t7i-gre(n)-mangoii:其中n=1、2、3、4;
339.t7i-are(n)-f30-mangoii:其中n=1、2、3、4;
340.t7i-ere(n)-f30-mangoii:其中n=1、2、3、4;
341.t7i-pre(n)-f30-mangoii:其中n=1、2、3、4;
342.t7i-mre(n)-f30-mangoii:其中n=1、2、3、4;
343.t7i-gre(n)-f30-mangoii:其中n=1、2、3、4;
344.t7i-are(n)-ispinach:其中n=1、2、3、4;
345.t7i-ere(n)-ispinach:其中n=1、2、3、4;
346.t7i-pre(n)-ispinach:其中n=1、2、3、4;
347.t7i-mre(n)-ispinach:其中n=1、2、3、4;
348.t7i-gre(n)-ispinach:其中n=1、2、3、4;
349.t7i-are(n)-f30-ispinach:其中n=1、2、3、4;
350.t7i-ere(n)-f30-ispinach:其中n=1、2、3、4;
351.t7i-pre(n)-f30-ispinach:其中n=1、2、3、4;
352.t7i-mre(n)-f30-ispinach:其中n=1、2、3、4;
353.t7i-gre(n)-f30-ispinach:其中n=1、2、3、4;
354.其中t7i表示t7 rna聚合酶的启动子/起始序列。
355.在相关实例中,t7i启动子/起始序列由5'-taatacgactcactatag-3'(seq id no:1)定义。
356.根据本文所述的测试试剂盒和测定方法的替代示例性核酸序列包含但不限于:
357.t3i-are(n)-mangoii:其中n=1、2、3、4;
358.t3i-ere(n)-mangoii:其中n=1、2、3、4;
359.t3i-pre(n)-mangoii:其中n=1、2、3、4;
360.t3i-mre(n)-mangoii:其中n=1、2、3、4;
361.t3i-gre(n)-mangoii:其中n=1、2、3、4;
362.t3i-are(n)-f30-mangoii:其中n=1、2、3、4;
363.t3i-ere(n)-f30-mangoii:其中n=1、2、3、4;
364.t3i-pre(n)-f30-mangoii:其中n=1、2、3、4;
365.t3i-mre(n)-f30-mangoii:其中n=1、2、3、4;
366.t3i-gre(n)-f30-mangoii:其中n=1、2、3、4;
367.t3i-are(n)-ispinach:其中n=1、2、3、4;
368.t3i-ere(n)-ispinach:其中n=1、2、3、4;
369.t3i-pre(n)-ispinach:其中n=1、2、3、4;
370.t3i-mre(n)-ispinach:其中n=1、2、3、4;
371.t3i-gre(n)-ispinach:其中n=1、2、3、4;
372.t3i-are(n)-ispinachx3:其中n=1、2、3、4;
373.t3i-ere(n)-ispinachx3:其中n=1、2、3、4;
374.t3i-pre(n)-ispinachx3:其中n=1、2、3、4;
375.t3i-mre(n)-ispinachx3:其中n=1、2、3、4;
376.t3i-gre(n)-ispinachx3:其中n=1、2、3、4;
377.其中t3i表示t3 rna聚合酶的启动子或起始序列。
378.在相关实例中,t3i启动子/起始序列由5'-aattaaccctcactaaag-3'(seq id no:2)定义。
379.根据本文所述的测试试剂盒和测定方法的替代示例性核酸序列包含但不限于:
380.sp6i-are(n)-mangoii:其中n=1、2、3、4;
381.sp6i-ere(n)-mangoii:其中n=1、2、3、4;
382.sp6i-pre(n)-mangoii:其中n=1、2、3、4;
383.sp6i-mre(n)-mangoii:其中n=1、2、3、4;
384.sp6i-gre(n)-mangoii:其中n=1、2、3、4;
385.sp6i-are(n)-f30-mangoii:其中n=1、2、3、4;
386.sp6i-ere(n)-f30-mangoii:其中n=1、2、3、4;
387.sp6i-pre(n)-f30-mangoii:其中n=1、2、3、4;
388.sp6i-mre(n)-f30-mangoii:其中n=1、2、3、4;
389.sp6i-gre(n)-f30-mangoii:其中n=1、2、3、4;
390.sp6i-are(n)-ispinach:其中n=1、2、3、4;
391.sp6i-ere(n)-ispinach:其中n=1、2、3、4;
392.sp6i-pre(n)-ispinach:其中n=1、2、3、4;
393.sp6i-mre(n)-ispinach:其中n=1、2、3、4;
394.sp6i-gre(n)-ispinach:其中n=1、2、3、4;
395.sp6i-are(n)-ispinachx3:其中n=1、2、3、4;
396.sp6i-ere(n)-ispinachx3:其中n=1、2、3、4;
397.sp6i-pre(n)-ispinachx3:其中n=1、2、3、4;
398.sp6i-mre(n)-ispinachx3:其中n=1、2、3、4;
399.sp6i-gre(n)-ispinachx3:其中n=1、2、3、4;
400.其中sp6i表示sp6 rna聚合酶的启动子或起始序列。
401.在相关实例中,sp6i启动子/起始序列由5'-atttaggtgacactatag-3'(seq id no:3)定义。
402.在根据本发明的另一实例中,测试试剂盒和/或测定方法被配置成检测与雄激素
受体结合的配体,并且包含t7rna聚合酶起始序列、雄激素应答元件和对f30支架和mango ii rna适配体进行编码的报告构建体的核酸序列包括如下seq id no:14中所示的序列:
403.[seq id no:14]
[0404]
5'taatacgactcactatagactctggaggaatggagaacagcctgttctccattgccatgtgtatgtgggtacgaaggagaggagaggaagaggagagtacccacatactctgatgatccttcgggatcattcatggcaatctagga3'
[0405]
在根据本发明的又另一实例中,测试试剂盒和/或测定方法被配置成检测与雌激素受体α或雌激素受体β结合的配体,并且包含t7rna聚合酶起始序列、雌激素应答元件和对f30支架和mango ii rna适配体进行编码的报告构建体的核酸序列包括如下seq id no:15中示出的序列:
[0406]
[seq id no:15]
[0407]
5'taatacgactcactatagactctggaggaacaggtcagcatgacctgttgccatgtgtatgtgggtacgaaggagaggagaggaagaggagagtacccacatactctgatgatccttcgggatcattcatggcaatctagga3'
[0408]
在根据本发明的又另外的另一实例中,测试试剂盒和/或测定方法被配置成检测与孕酮受体a或孕酮受体b结合的配体,并且包含t7rna聚合酶起始序列、孕酮应答元件和对f30支架和mango ii rna适配体进行编码的报告构建体的核酸序列包括如下seq id no:16中示出的序列:
[0409]
[seq id no:16]
[0410]
5'taatacgactcactatagactctggaggaaggtacaaactgttctttgccatgtgtatgtgggtacgaaggagaggagaggaagaggagagtacccacatactctgatgatccttcgggatcattcatggcaatctagga3'
[0411]
在根据本发明的另一实例中,测试试剂盒和/或测定方法被配置成检测与盐皮质激素受体结合的配体,并且包含t7rna聚合酶起始序列、盐皮质激素应答元件和对f30支架和mango ii rna适配体进行编码的报告构建体的核酸序列包括如下seq id no:17中所示的序列:
[0412]
[seq id no:17]
[0413]
5'taatacgactcactatagactctggaggaatgtacaggatgttctttgccatgtgtatgtgggtacgaaggagaggagaggaagaggagagtacccacatactctgatgatccttcgggatcattcatggcaatctagga3'
[0414]
在根据本发明的另一实例中,测试试剂盒和/或测定方法被配置成检测与糖皮质激素受体结合的配体,并且包含t7rna聚合酶起始序列、糖皮质激素应答元件和对f30支架和mangoii rna适配体进行编码的报告构建体的核酸序列包括如下seq id no:18中所示的序列:
[0415]
[seq id no:18]
[0416]
5'taatacgactcactatagactctggaggaatgtacaggatgttctttgccatgtgtatgtgggtacgaaggagaggagaggaagaggagagtacccacatactctgatgatccttcgggatcattcatggcaatctagga3'
[0417]
以下表1中总结了用于根据本发明的测试试剂盒和测定方法的其它核酸/构建体。
[0418]
表1:示例性构建体序列信息
[0419]
[0420]
[0421]
[0422]
[0423]
[0424][0425]
多路复用测定系统
[0426]
本发明进一步设想了被配置成检测来自同一测试样品的两个或更多个类固醇激素基因组应答的多路复用测定。
[0427]
为了进一步说明多路复用系统的相关性,在某些情况下,对于临床医师有用的将是研究例如受试者的激素状态以了解受试者的雄激素和雌激素水平/活性。
[0428]
从同一测试样品中并排检测雄激素配体和雌激素配体是可能的,因为与雄激素受体结合的配体不会与存在于同一测定中的雌激素受体结合并激活所述雌激素受体;相反,与雌激素受体结合的不与也存在于同一测定中的雄激素受体结合并激活所述雄激素受体的配体。这是因为雄激素受体和雌激素受体属于不同的类固醇激素受体类别,并且因此在受体激活方面不存在“交叉对话”。而且因此,已经开发出了多路复用测定来检测同一样品中的雄激素配体和雌激素配体两者。
[0429]
因此,在本发明的另一方面,提供了一种用于针对雄激素配体和/或雌激素配体的并排检测对样品进行筛选的测试试剂盒,所述测试试剂盒包括:
[0430]
(i)雄激素受体,其中所述雄激素受体能够与来自所述样品的互补配体形成雄激素受体-配体复合物;以及
[0431]
(ii)第一核酸分子,所述第一核酸分子包括:
[0432]
(a)聚合酶启动子序列;
[0433]
(b)雄激素应答元件,所述雄激素应答元件能够被所述雄激素受体-配体复合物结合;以及
[0434]
(c)第一报告构建体,
[0435]
其中所述应答元件(b)位于所述启动子序列(a)与所述报告构建体(c)之间,并且(a)、(b)和(c)可操作地连接;以及
[0436]
(iii)雌激素受体,其中所述雌激素受体能够与来自所述样品的互补配体形成雌激素受体-配体复合物;以及
[0437]
(iv)第二核酸分子,所述第二核酸分子包括:
[0438]
(d)聚合酶启动子序列;
[0439]
(e)雌激素应答元件,所述雌激素应答元件能够被所述雌激素受体-配体复合物结合;以及
[0440]
(f)第二报告构建体;以及
[0441]
(iv)单多肽聚合酶,
[0442]
其中所述第一报告构建体和所述第二报告构建体不同,
[0443]
并且其中所述样品中雄激素配体的存在是通过测量当所述样品与所述测试试剂盒组合时由所述雄激素受体-配体复合物与应答元件的结合引起的所述第一报告构建体的转录降低或抑制来检测的,
[0444]
并且其中所述样品中雌激素配体的存在是通过测量当所述样品与所述测试试剂盒组合时由所述雌激素受体-配体复合物与应答元件的结合引起的所述第二报告构建体的转录降低或抑制来检测的。
[0445]
在根据本发明的此方面的一个实例中,所述测试试剂盒进一步包括:热休克蛋白90(hsp90);hsp90和热休克蛋白70(hsp70)的复合物;hsp90、hsp70和热休克蛋白40(hsp40)的复合物;hsp90、hsp70、hsp40和p23的复合物;hsp90、hsp70、hsp40、p23和热休克蛋白组织蛋白(hop)的复合物;hsp90、hsp70、hsp40、p23、hop和48kd hip蛋白(hip)的复合物;hsp90、hsp70、hsp40、p23、hop、hip和p60的复合物;以及hsp90、hsp70、hsp40、p23、hop、hip、p60和fkbp52的复合物。
[0446]
在根据本发明的此方面的一个实例中,第一核酸分子和第二核酸分子是离散分子。
[0447]
在根据本发明的此方面的另一实例中,第一核酸分子和第二核酸分子可操作地连接。
[0448]
在根据本发明的此方面的另一实例中,第一核酸分子包括由seq id no:14定义的序列。
[0449]
在根据本发明的此方面的另外的实例中,第二核酸分子包括由seq id no:15定义的序列。
[0450]
在根据本发明的此方面的又另外的实例中,第一核酸分子和第二核酸分子可操作地连接并且包括由seq id no:80定义的序列。
[0451]
5'-taatacgactcactatagactctggaggaatggagaacagcctgttctccattgccatgtgtatgtgggtacgaaggagaggagaggaagaggagagtacccacatactctgatgatccttcgggatcattcatggcaatc
taggaaaccccgcggggcctttcgggggtctcgcggggttttttgctctaatacgactcactatagactctggaggaacaggtcagcatgacctgttgccatgtgtatgtgggtacgaaggagaggagaggaagaggagagtacccacatactctgatgatccttcgggatcattcatggcaatctagga-3'
[0452]
有利地,本文所述的测定和测试试剂盒特别适合于多路复用系统中的构型,因为(i)所述测定和测试试剂盒的执行在另外含有干扰测定信号的天然存在的配体和/或类固醇激素受体的细胞提取物不存在的情况下是可能的(例如配体和受体的“交叉对话”导致响应元件自动激活),并且(ii)本文所述的测定系统的简单性意味着可以常规地对现有测定或测试试剂盒进行修改以包含第二或后续的受体/报告构建体组合,所述第二或后续的受体/报告构建体组合特定于第二配体的检测;通过利用同一体内转录机制(例如噬菌体聚合酶 核苷三磷酸),可以方便地检测通过每个报告产生的离散信号。为了进一步说明这一点,根据本发明的多路复用测定系统可以包括例如雄激素特异性报告构建体,所述雄激素特异性报告构建体在雄激素或雄激素样配体存在的情况下将产生报告读数,所述报告读数可以独立于由特定于同一样品中雌二醇的检测的报告构建体产生的读数测量。
[0453]
本领域的技术人员将理解由于缺乏与本发明的多路复用系统相关联的分子复杂性所赋予的优点,并且将认识到,从同一测试样品检测多个离散的类固醇激素基因组应答(例如,两个、三个、四个或更多个)是可能的。
[0454]
因此,根据本发明的测试试剂盒包括至少一个类固醇激素受体和包括至少一个报告构建体的至少一个核酸分子。
[0455]
因此,根据本文所述的测试试剂盒和方法,术语“类固醇激素受体”旨在表示“至少一个类固醇激素受体”,在某种意义上为可以存在的两个或更多个不同类型的类固醇激素受体(例如并且仅通过说明,与睾酮结合的类固醇激素受体和与雌二醇结合的类固醇激素受体)。
[0456]
类似地,术语“核酸分子[包括应答元件]”旨在表示“至少一个核酸”,在某种意义上为可以存在的两个或更多个离散的核酸分子,每个核酸分子包括不同的应答元件以及任选地不同的报告分子。
[0457]
在根据本发明的此方面的实例中,测试试剂盒包括(i)雌激素受体和包括雌激素应答元件的核酸分子,以及(ii)雄激素受体和包括雄激素应答元件的核酸分子。
[0458]
在相关实例中,包括雌激素应答元件的核酸分子进一步包括能够与第一荧光团结合的第一rna适配体。
[0459]
在另一相关实例中,包括雄激素应答元件的核酸分子进一步包括能够与第二荧光团结合的第二rna适配体。
[0460]
在相关实例中,第一和第二rna适配体包含但不限于mango i、mango ii、mango iii和mango iv、spinach、ispinach、baby spinach、broccoli和孔雀石绿,条件是第一rna适配体与第二rna适配体不相同。
[0461]
在另外的相关实例中,第一rna适配体是mango ii,并且第二rna适配体是孔雀石绿。
[0462]
在另外的相关实例中,第一rna适配体是mango ii,并且第二rna适配体是ispinach。
[0463]
测试试剂盒和测定的功用
[0464]
有利地,本发明提供了基本上依据类固醇激素受体激活的原理工作的基于活性的测试试剂盒、测定和方法。通过检测由待测样品内存在的目标配体进行的类固醇激素受体激活(与随后的与其激素应答元件的结合),本发明提供了不依赖于询问的对配体的结构了解,可以容易地在生物活性配体与生物非活性配体的存在之间进行区分,并且提供不需要复杂的实验室装备或特定专业知识来执行的经济高效的可靠且可再现的系统的无细胞测试试剂盒、测定和方法。
[0465]
因此,在本发明的另一方面,提供了一种用于确定运动员的兴奋剂状态的方法,所述方法包括将从运动员获得的样品与如本文所述的测试试剂盒组合并且确定运动员的兴奋剂状态。
[0466]
在根据本发明的此方面的一个实例中,从运动员获得的样品是血清样品、血浆样品或尿液样品。
[0467]
在另一实例中,运动员是人类运动员或选自马、骆驼或狗的非人运动员。
[0468]
在本发明的另外的方面,提供了一种用于针对配体的存在对测试样品进行筛选的制品,所述配体能够激活类固醇激素受体并且引发细胞中的基因组应答,所述制品包括如本文所述的测试试剂盒以及针对如何检测所述样品中配体的存在的说明书。
[0469]
在本发明的又另外的方面,提供了一种用于确定运动员的兴奋剂的制品,所述制品包括如本文所述的测试试剂盒以及用于检测源自所述运动员的样品中配体的存在的说明书,其中所述样品中存在所述配体表明所述样运动员有兴奋剂。
[0470]
本文所述的各个测试试剂盒和测定各自提供了(i)类固醇激素受体,所述类固醇激素受体包含用于与可能存在于待测样品中的配体结合的配体结合结构域,以及(ii)核酸应答元件,所述核酸应答元件包括被经激活的类固醇激素受体(或配体-受体复合物;hr-l)结合的蛋白质结合结构域。术语“经激活的类固醇激素受体”是指受体-配体复合物,并且可以包含hr-l结构的各种排列(例如单体、二聚体、三聚体等)。重要的是,激素应答元件含有对受体-配体复合物有特异性的结合基序。因此,通过将本发明的测试试剂盒和测定与所关注的样品组合,检测具有与类固醇激素受体结合并且引发类固醇激素基因组应答的潜力的配体是可能的。
[0471]
术语“受体结合结构域”、“经激活的受体结合结构域”、“激素受体结合结构域”、“经激活的激素受体结合结构域”、“受体-配体结合结构域”和“激素受体-配体结合结构域”可互换使用以指代被如本文所定义的经激活的激素受体或配体-受体复合物结合的激素应答元件的蛋白质结合结构域。
[0472]
在其它实施例中,本文所述的发明可用于检测用于人类以及非人运动员,包含赛马和狗的性能增强前药/药物(例如合成代谢类固醇)。在其它实例中,本文所述的发明可用于针对添加剂对食品和健康食品补充剂进行筛选,所述添加剂可以与类固醇激素受体结合并且在细胞中引发基因组应答或在代谢过程之后引起基因组应答(即在所谓的“前药”的情况下)。
[0473]
本发明进一步设想了从测试样品中检测一种或多种生理非活性配体,所述配体在转化为生理活性形式时最终能够激活类固醇激素受体。如此,如本文所述的测试试剂盒、测定和方法进一步包括能够以其将激活其对应类固醇激素受体的方式对配体进行处理的类固醇代谢机制。以此方式,可以从如营养补充剂等样品中检测生理非活性配体(例如激素
原)。
[0474]
如此,本文所述的测试试剂盒、测定和方法可以进一步包括类固醇代谢机制,所述类固醇代谢机制足以将配体从生理非活性形式转化为生理活性形式,或从生理活性形式转化为更具生理活性的形式,或从生理活性形式转化为较低生理活性的形式,或从生理活性形式转化为生理非活性形式。仅当配体处于生理活性形式时,其才能够激活类固醇激素受体并且引发基因组应答。因此,在根据本发明的测试试剂盒、测定和方法中包含类固醇代谢机制帮助促进从所关注的测试样品中检测生理非活性配体,(例如)检测哪些配体以前药(例如前激素)形式存在并且可以另外使用既定方法逃避检测。此外,在根据本发明的测试试剂盒、测定和方法中包含类固醇代谢机制帮助确定显示作用所必需的配体的生物活性/效力。
[0475]
图17中呈现的数据进一步说明了这一点。用s9肝脏部分对雄烯二酮(即雄激素激素原)进行预培养,然后提取反应混合物以获取类固醇(即以移除任何潜在非特异性配体)。然后针对雄激素活性对各个测试和对照样品进行分析。结果表明,与未处理对照(即雄烯二酮-s9肝脏)相比,用于雄烯二酮 s9肝脏处理的报告构建体的荧光在统计学上显著降低,其中未处理对照的雄激素活性水平接近于媒剂对照(即甲醇 t7;甲醇 ar/hsp90)。
[0476]
本文所述的测试试剂盒、测定和方法还可以进一步包括用于检测受体-配体复合物与容纳在核酸内的应答元件之间的结合的检测装置,如所定义的。
[0477]
根据本发明的测试试剂盒和测定是无细胞的。这特别重要,因为测定系统的分子复杂性显著降低。例如,不存在(i)有可能为类固醇激素分子产生热动力学槽的细胞膜结构以及(ii)利用基于细胞的系统观察到的内源性类固醇激素代谢提供了灵敏度增强的测定系统。进一步地并且有利地,根据本文所述的测试试剂盒、测定和方法,可以精确地控制必要结构元件(例如类固醇激素受体和核酸应答元件,包含一个或多个经激活的受体结合结构域)的相对量以提供增强的检测功能和增加的灵敏度。
[0478]
根据本文所述的方法,可将测试结果与参考阈值进行比较以确定由测试样品中存在的配体产生的信号的绝对水平。事实上,申请人观察到通过非配体结合受体对应答元件的非特异性结合和/或激活。因此,在期望对任何给定测试样品执行半定量分析的情况下,可以在测试样品不存在的情况下执行本文所述的测定和方法,以首先建立参考阈值(例如,在充当阴性对照的乙醇存在的情况下)。然后可以将从测试样品获得的测定结果与参考阈值进行比较,以使用简单的减法方法确定可归因于样品中存在的配体的绝对活性。
[0479]
本发明进一步设想了使用本文所述的测定和测试试剂盒来确定测试化合物相对于参考化合物的效力。根据本发明,术语“相对效力”被定义为测试化合物相对于参考化合物的生物活性的乘数,如通过相对于参考化合物对测试化合物的生物活性进行归一化而确定的。
[0480]
可以使用ec
50
或由所述特定化合物的剂量应答曲线给出半最大应答的化合物的浓度来确定测试化合物和参考化合物的生物活性。剂量应答曲线是通过连续稀释化合物并且测量其类固醇激素受体结合/激活曲线而产生的。然后绘制所测得的活性(例如通过荧光测量的)对化合物的浓度(即化合物的连续稀释产生最好以对数标度呈现的浓度范围)的图。
[0481]
本领域的技术人员将认识到测试化合物的相对效力的量度是相对于所使用的参考化合物。换言之,测试化合物的相对效力可能会根据相对于其对测试化合物的生物活性
进行归一化的参考化合物而有所不同。
[0482]
当相对效力》1时,与参考化合物相比,测试化合物在测定中引起更高的所测得的生物活性。当相对效力《1时,与参考化合物相比,测试化合物在测定中引起较低的所测得的生物活性。当相对效力=1时,测试化合物和参考化合物在测定中引起相等的生物活性。
[0483]
相对效力也可以用于确定所讨论的测试化合物的激活因子。如本文所用,激活因子将在酵母细胞中或使用无酵母细胞的提取物(即不含有代谢机制)确定的测试化合物的相对效力与在哺乳动物细胞中或使用无哺乳动物细胞的提取物(即包含代谢机制)确定的同一测试化合物的相对效力相关联,作为测试化合物两种状态之间的相对激活的量度。激活因子》1意味着,测试化合物经历了在测定中在代谢机制存在的情况下到更具生理活性的状态的代谢转化。
[0484]
由根据本发明的测试试剂盒和测定赋予的又另一优点是执行相对容易。换言之,本文所述的测试试剂盒、测定和方法的执行不需要复杂的细胞培养技术、有经验的实验室技术人员或复杂的实验室测试装备和分析。这是特别有利的,因为根据本发明的测试试剂盒、本领域未经训练的人员可以按照相对简单的测试程序实践测定和方法。进一步地,测试试剂盒、测定和方法的执行可以提供实时信息(例如),当对在紧接着比赛之前或之后从运动员提取的样品中的性能增强物质时进行测试时。
[0485]
在本发明的其它方面,提供了一种用于针对配体的存在对样品进行筛选的测试试剂盒,所述配体能够与类固醇激素受体形成复合物并且当在细胞中时引发基因组应答,所述测试试剂盒包括:
[0486]
(i)雄激素受体,所述雄激素受体能够与来自测试样品的配体形成配体-受体复合物;或
[0487]
(ii)雌激素受体,所述雌激素受体能够与来自所述测试样品的配体形成配体-受体复合物,其中所述雌激素受体是雌激素受体α或雌激素受体β;或
[0488]
(iii)孕酮受体,所述孕酮受体能够与来自所述测试样品的配体形成配体-受体复合物,其中所述孕酮受体是孕酮受体a或孕酮受体b;或
[0489]
(iv)盐皮质激素受体,所述盐皮质激素受体能够与来自所述测试样品的配体形成配体-受体复合物;或
[0490]
(v)糖皮质激素受体,所述糖皮质激素受体能够与来自所述测试样品的配体形成配体-受体复合物;以及
[0491]
(vi)核酸分子,所述核酸分子包括:
[0492]
(a)聚合酶启动子序列;
[0493]
(b)应答元件,所述应答元件能够被所述受体-配体复合物结合;以及
[0494]
(c)报告构建体,
[0495]
其中所述应答元件(b)位于所述启动子序列(a)与所述报告构建体(c)之间,并且(a)、(b)和(c)可操作地连接;以及
[0496]
(iii)单多肽聚合酶,
[0497]
其中所述样品中配体的存在是通过测量当所述样品与所述测试试剂盒组合时由所述配体-受体复合物与所述应答元件的结合引起的所述报告构建体的转录减少或抑制来检测的。
[0498]
在本发明的其它方面,提供了一种用于针对配体的存在对样品进行筛选的测试试剂盒,所述配体能够与类固醇激素受体形成复合物并且当在细胞中时引发基因组应答,所述测试试剂盒包括:
[0499]
(i)雄激素受体,所述雄激素受体能够与来自测试样品的配体形成配体-受体复合物;或
[0500]
(ii)雌激素受体,所述雌激素受体能够与来自所述测试样品的配体形成配体-受体复合物,其中所述雌激素受体是雌激素受体α或雌激素受体β;或
[0501]
(iii)孕酮受体,所述孕酮受体能够与来自所述测试样品的配体形成配体-受体复合物,其中所述孕酮受体是孕酮受体a或孕酮受体b;或
[0502]
(iv)盐皮质激素受体,所述盐皮质激素受体能够与来自所述测试样品的配体形成配体-受体复合物;或
[0503]
(v)糖皮质激素受体,所述糖皮质激素受体能够与来自所述测试样品的配体形成配体-受体复合物;以及
[0504]
(vi)类固醇激素受体辅因子,所述类固醇激素受体辅因子选自:热休克蛋白90(hsp90);hsp90和热休克蛋白70(hsp70)的复合物;hsp90、hsp70和热休克蛋白40(hsp40)的复合物;hsp90、hsp70、hsp40和p23的复合物;hsp90、hsp70、hsp40、p23和热休克蛋白组织蛋白(hop)的复合物;hsp90、hsp70、hsp40、p23、hop和48kd hip蛋白(hip)的复合物;hsp90、hsp70、hsp40、p23、hop、hip和p60的复合物;以及hsp90、hsp70、hsp40、p23、hop、hip、p60和fkbp52的复合物;以及
[0505]
(vii)核酸分子,所述核酸分子包括:
[0506]
(a)聚合酶启动子序列;
[0507]
(b)应答元件,所述应答元件能够被所述受体-配体复合物结合;以及
[0508]
(c)报告构建体,
[0509]
其中所述应答元件(b)位于所述启动子序列(a)与所述报告构建体(c)之间,并且(a)、(b)和(c)可操作地连接;以及
[0510]
(iii)单多肽聚合酶,
[0511]
其中所述样品中配体的存在是通过测量当所述样品与所述测试试剂盒组合时由所述配体-受体复合物与所述应答元件的结合引起的所述报告构建体的转录减少或抑制来检测的。
[0512]
在本发明的又另外的方面,提供了一种用于针对能够引发类固醇激素基因组应答的配体的存在对测试样品进行筛选的测试试剂盒,所述测试试剂盒包括:
[0513]
(i)雄激素受体,所述雄激素受体能够与来自所述测试样品的配体形成配体-受体复合物;或
[0514]
(ii)雌激素受体,所述雌激素受体能够与来自所述测试样品的配体形成配体-受体复合物,其中所述雌激素受体是雌激素受体α或雌激素受体β;或
[0515]
(iii)孕酮受体,所述孕酮受体能够与来自所述测试样品的配体形成配体-受体复合物,其中所述孕酮受体是孕酮受体a或孕酮受体b;或
[0516]
(iv)盐皮质激素受体,所述盐皮质激素受体能够与来自所述测试样品的配体形成配体-受体复合物;或
[0517]
(v)糖皮质激素受体,所述糖皮质激素受体能够与来自所述测试样品的配体形成配体-受体复合物;以及
[0518]
(vi)核酸分子,所述核酸分子包括:
[0519]
(a)聚合酶启动子序列;
[0520]
(b)应答元件,所述应答元件能够被如以上(i)到(v)中任一个定义的所述受体-配体复合物结合;以及
[0521]
(c)受体构建体,
[0522]
其中所述应答元件(b)位于所述启动子序列(a)与所述报告构建体(c)之间,并且(a)、(b)和(c)可操作地连接;以及
[0523]
(vii)单多肽聚合酶;以及
[0524]
(viii)核苷三磷酸;
[0525]
其中所述样品中配体的存在是通过测量当所述样品与所述测试试剂盒组合时由所述配体-受体复合物与所述应答元件的结合引起的所述报告构建体的转录减少或抑制来检测的。
[0526]
在本发明的又另外的方面,提供了一种用于针对能够引发类固醇激素基因组应答的配体的存在对测试样品进行筛选的测试试剂盒,所述测试试剂盒包括:
[0527]
(i)雄激素受体,所述雄激素受体能够与来自所述测试样品的配体形成配体-受体复合物;或
[0528]
(ii)雌激素受体,所述雌激素受体能够与来自所述测试样品的配体形成配体-受体复合物,其中所述雌激素受体是雌激素受体α或雌激素受体β;或
[0529]
(iii)孕酮受体,所述孕酮受体能够与来自所述测试样品的配体形成配体-受体复合物,其中所述孕酮受体是孕酮受体a或孕酮受体b;或
[0530]
(iv)盐皮质激素受体,所述盐皮质激素受体能够与来自所述测试样品的配体形成配体-受体复合物;或
[0531]
(v)糖皮质激素受体,所述糖皮质激素受体能够与来自所述测试样品的配体形成配体-受体复合物;以及
[0532]
(vi)类固醇激素受体辅因子,所述类固醇激素受体辅因子选自:热休克蛋白90(hsp90);hsp90和热休克蛋白70(hsp70)的复合物;hsp90、hsp70和热休克蛋白40(hsp40)的复合物;hsp90、hsp70、hsp40和p23的复合物;hsp90、hsp70、hsp40、p23和热休克蛋白组织蛋白(hop)的复合物;hsp90、hsp70、hsp40、p23、hop和48kd hip蛋白(hip)的复合物;hsp90、hsp70、hsp40、p23、hop、hip和p60的复合物;以及hsp90、hsp70、hsp40、p23、hop、hip、p60和fkbp52的复合物;以及
[0533]
(vii)核酸分子,所述核酸分子包括:
[0534]
(a)聚合酶启动子序列;
[0535]
(b)应答元件,所述应答元件能够被如以上(i)到(v)中任一个定义的所述受体-配体复合物结合;以及
[0536]
(c)受体构建体,
[0537]
其中所述应答元件(b)位于所述启动子序列(a)与所述报告构建体(c)之间,并且(a)、(b)和(c)可操作地连接;以及
[0538]
(viii)单多肽聚合酶;以及
[0539]
(ix)核苷三磷酸;
[0540]
其中所述样品中配体的存在是通过测量当所述样品与所述测试试剂盒组合时由所述配体-受体复合物与所述应答元件的结合引起的所述报告构建体的转录减少或抑制来检测的。
[0541]
在根据本发明的测定、方法和测试试剂盒的某些实例中,所述核酸分子包含核酸的各个组分的一个或多个拷贝,包含所述响应元件或所述报告构建体。例如,报告构建体或核酸分子可以包含核酸响应元件的单个拷贝或多个拷贝,包含但不限于双份拷贝、三份拷贝、四份拷贝等。
[0542]
在本发明的另一实例中,从细胞中对类固醇激素受体进行纯化,或者通过重组克隆、表达和纯化从基于细胞的激素受体得到类固醇激素受体。在另外的实例中,类固醇激素受体是合成的,并且其序列在本领域已知的内源性类固醇激素受体序列上建模或由内源性类固醇激素受体序列进化而来。
[0543]
本领域的技术人员还将认识到,可以在本发明的测试试剂盒、测定和方法中采用任何类固醇激素受体,条件是所述类固醇激素受体保留了其与所关注的配体结合并且被所关注的配体激活以进行检测的能力。这包含基于内源性细胞形式以及重组或合成形式的类固醇激素受体。
[0544]
因此,根据本发明的测试试剂盒、测定和方法可以被配置成对引发类固醇激素基因组应答的任何配体进行筛选/检测。然而,本领域技术人员将认识到,根据本文所述的各种测定概念,不同激素类别(即配体)的检测需要对测试试剂盒、测定和方法的格式进行正确配置和优化。例如,与如睾酮以及其它睾酮样激素等雄激素受体结合并且激活雄激素受体的配体的检测需要包括雄激素受体以及能够与经激活的雄激素-受体复合物等结合的雄激素应答元件的测试试剂盒/测定。
[0545]
设计师类固醇和非类固醇合成代谢药物对反兴奋剂实验室构成了重大且日益增长的挑战。在21世纪初,随着检测到四氢孕三酮和脫氧甲基睾酮首次鉴定出,设计师合成代谢药物构成的威胁迅速增加以包含许多潜在药剂。这些合成衍生的合成代谢药物被设计成逃避相对于制造和供应两者的检测或合法控制,并且许多可在互联网上广泛获得,所述药物在互联网上以所谓的“补充剂”出售。
[0546]
质谱仍然是用于鉴定生物样品和/或补充剂中的已知非法类固醇激素和非类固醇合成代谢药物的主要技术。尽管其具有灵敏度和特异性,但质谱仍然受到需要事先了解类固醇和非类固醇合成代谢药物的化学结构以进行检测的限制。此外,质谱未能提供关于检测到的合成代谢药物的生物活性的信息,并且无法在生物活性分子与非活性分子之间进行区分。这是对运动员、教练员、训练者、经理和制造商提起法律诉讼所需的信息。
[0547]
近年来,已使用了基于酵母和哺乳动物细胞的体外雄激素生物测定来检测补充剂中新型合成雄激素的存在、孕酮以及雄激素、前雄激素、设计师雄激素和设计师非类固醇合成代谢药物的雄激素的可能性。然而,这些测定受到与分子复杂性相关联的局限性,如本文别处所述,并且需要在性质上为分子和细胞两者的耗时、劳动密集且费用高昂的技术技能。因此,考虑将目前形式的测定包含在常规筛选中是不可行的。换言之,基于酵母和哺乳动物细胞的测定受到显著的局限性,因为其不是高通量的或经济高效的。
[0548]
有利地,本发明提供了基本上依据类固醇激素受体激活的原理工作的基于活性的测试试剂盒、测定和方法。通过检测由待测样品内存在的配体进行的类固醇激素受体激活,本发明提供了不依赖于询问的对配体的结构了解,可以容易地在生物活性配体与生物非活性配体的存在之间进行区分,并且提供不需要复杂的实验室装备或特定专业知识来执行的经济高效的可靠且可再现的系统的无细胞测试试剂盒、测定和方法。
[0549]
因此在根据本文所述的测试试剂盒、测定和方法的实例中,配体是性能增强设计师药物和/或类固醇。
[0550]
在根据本文所述的测试试剂盒、测定和方法的另一实例中,配体具有未知的化学结构。
[0551]
在根据本文所述的测试试剂盒、测定和方法的另外的实例中,配体具有先前未知的化学结构。
[0552]
本发明进一步设想了如本文所述的测试试剂盒、测定和方法用于通过以下来检测目标配体的拮抗剂的用途:针对将阻止配体与其类固醇激素受体结合使得其不再激活受体并引发基因组应答的化合物对所关注的样品进行筛选。
[0553]
这在需要对阻断类固醇激素受体激活的拮抗剂(例如)进行筛选作为用于治疗内分泌和非内分泌癌症的潜在疗法时尤其有用。例如,可以使用包括根据本发明的一种或多种雌激素受体的基于活性的测试试剂盒、方法和测定来针对拮抗剂的存在对化合物文库进行筛选或监测进行癌症疗法的患者的乳腺癌组织或血液中雌激素受体激活的丧失。
[0554]
在根据本文所述的测试试剂盒、测定和方法的所有方面的又另外的实例中,生物样品源自选自由以下组成的组的动物:马、犬、骆驼、牛、猪、绵羊、公山羊、禽、猿、鼠、野兔、鹿、鱼、鲑鱼、灵长类动物和人。
[0555]
在根据本文所述的测试试剂盒、测定和方法的所有方面的又另外的实例中,测试样品源自选自由以下组成的组的生物材料:尿液、唾液、粪便、毛发、组织,包含但不限于血液(血浆和血清)、肌肉、肿瘤、精液等。
[0556]
在根据本文所述的测试试剂盒、测定和方法的所有方面的又另外的实例中,测试样品源自选自由以下组成的组的食品:蔬菜、肉类、包含但不限于运动饮料和牛奶的饮料、包含但不限于食品补充剂和运动补充剂、营养补充剂、草药提取物等的补充剂。
[0557]
在根据本文所述的测试试剂盒、测定和方法的所有方面的又另外的实例中,测试样品源自选自由以下组成的组的药品:药物、补药、糖浆、片剂、锭剂、霜剂、喷雾剂和凝胶。
[0558]
在根据本文所述的测试试剂盒、测定和方法的所有方面的又另外的实例中,样品源自选自由以下组成的组的环境:液体、水、土壤、包含但不限于塑料和矿物的纺织品。
[0559]
实例6中呈现的结合图14-16阅读的信息表明,测试试剂盒和测定方法用于检测来自如源自小牛和马的血清(图14)等生物基质的睾酮(作为示例性类固醇激素配体)以及从小马获得的尿液(图15和16)。这些数据加强了根据本发明的测试试剂盒和测定方法在本领域的效用,例如,在确定轨道旁的人类和马科运动员的兴奋剂状态,或对食品补充剂执行分析作为输出/输入质量控制的一部分方面的效用。
[0560]
因此,在另一实例中,样品是生物样品。在相关实例中,生物样品是体液样品,包含但不限于血液、血浆、血清、唾液、间质液、精液和尿液。
[0561]
在另一实例中,样品源自植物,包含但不限于叶、花、茎、树皮、根、芽、豆荚、花粉和
种子。
[0562]
在另一实例中,样品源自包含但不限于以下的动物:马科动物、犬科动物、单峰骆驼科动物、牛科动物、猪科动物、绵羊科动物、公山羊科动物、禽科动物、猿科动物、鼠科动物、野兔科动物、鹿科动物、鱼科动物、鲑鱼科动物、灵长类动物和人类动物。
[0563]
在另一实例中,测试样品是非生物样品。在相关实例中,非生物样品包含但不限于包含水的液体样品、土壤样品、包含但不限于塑料的纺织品样品、矿物样品、食品样品和药品。
[0564]
食品样品的实例包含但不限于蔬菜、肉类、饮料、补充剂和草药提取物。
[0565]
药品的实例包含但不限于药物、补药、糖浆、片剂、锭剂、霜剂、喷雾剂和凝胶。
[0566]
***
[0567]
参考以下实例进一步描述了本发明。将理解,所要求保护的本发明并不旨在以任何方式受限于这些实例。
[0568]
实例
[0569]
下面的信息和数据展示了关于对与包含(例如)睾酮和二氢睾酮的雄激素受体结合并且激活雄激素受体的配体,或与包含(例如)雌二醇的雌激素受体结合并且激活雌激素受体的配体的检测的各种原型测定。这些实施例用于说明本文所述和要求保护的活性测定平台,其中通过对与雄激素受体结合的配体或与雌激素受体(即er-α和er-β)结合的配体的检测例示的测定概念和原理将同样适用于检测所关注的其它受体配体,所关注的其它受体配体包含但不限于与包含但不限于孕酮的孕酮受体结合的配体、与包含但不限于醛固酮的盐皮质激素受体结合的配体以及与包含但不限于皮质醇的糖皮质激素受体结合的配体。
[0570]
实例1
[0571]
雄激素测定原型1:测定架构和结果
[0572]
1.1体外转录平台
[0573]
申请人最初开发了一种体外转录平台包含对位于mango ii的rna适配体序列上游的3x雄激素应答元件(are)的串联阵列上游的t7 rna共有启动子序列进行编码的dna构建体,其与重组雄激素受体(ar)、重组热休克蛋白90(hsp90)、t7 rna聚合酶、核苷三磷酸和转录缓冲液组合。t7启动子将驱动高水平的rna适配体表达,所述表达将通过与荧光团、噻唑橙1
–
生物素(to1)的结合来进行检测。当are被经配体激活的ar结合时,会抑制t7驱动的适配体表达。
[0574]
雄激素应答元件(are)
[0575]
●
这些实验中测试的雄激素应答元件是3
×
are的串联阵列。
[0576]
雄激素受体(ar)
[0577]
●
已从西格玛奥德里奇公司(sigma-aldrich)对商业重组ar进行了测试。
[0578]
t7 rna聚合酶
[0579]
●
在这些研究中使用了来自赛默飞世尔公司(thermofisher)的megascript试剂盒作为t7 rna聚合酶以及必要的缓冲液和核苷酸三磷酸的来源。
[0580]
1.2对are介导的转录/翻译的说明
[0581]
从雄激素分子扩散到细胞中开始天然雄激素信号传导,其中所述雄激素分子与在细胞质中保持处于非活性状态的与热休克蛋白90(hsp90)结合的ar结合。在与雄激素分子
(或配体)结合时,ar经历释放hsp90的构象变化,并且使核定位和二聚化位点暴露。配体-ar复合物的目标是易位到核,在所述核中ar与dna中的are位点结合,并且rna聚合酶ii全酶组装并启动ar调节的基因的转录。rna聚合酶ii对基因的转录会产生mrna转录物,所述mrna转录物进而充当用于核糖体机制制造蛋白质的模板。
[0582]
利用此天然生物学,现在描述的实验表明,经睾酮(天然雄激素)激活的ar降低了t7介导的转录,因为已将are放置在t7启动子(和转录起始位点)的下游,因此当睾酮配体结合的ar与are结合时,存在t7介导的转录减少/抑制。
[0583]
图1展示了对t7 rna聚合酶介导的转录的are介导的阻断的示意图。
[0584]
在如天然雄激素、睾酮等配体存在的情况下,ar与are结合并且抑制由t7聚合酶进行的转录。在此状态下,形成了较少的rna mango ii适配体。
[0585]
在不存在配体的情况下,未使ar激活以与are结合,并且因此dna无阻塞性蛋白质。t7沿dna构建体行进以产生rna mango ii适配体,随后通过to1-b结合和荧光检测所述适配体。
[0586]
参考图2和3中呈现的结果,研究了对转录的ar阻断进行的睾酮激活。ar未示出完整的t7介导的转录和rna mango ii适配体表达。所述激活在ar存在的情况下会减少,并且当通过11.5ng/ml睾酮激活ar时会进一步减少。
[0587]
参考图4,接下来研究了hsp90是否可以抑制ar的基线激活。ar是借助通过睾酮使区域激活因子-1(af-1)激活或通过区域激活因子-2(af-2)的自体激活而发生构象变化激活的。对于ar,af-2非常活跃,并且可以表示至多50%的ar活性。为了抑制af-2自体激活,添加了hsp90以使ar保持处于非激活状态,在所述非激活状态在配体不存在的情况下ar不会与are结合。然而,在配体存在的情况下,hsp90应与ar竞争性地解离,并且配体结合的ar应与are结合。
[0588]
实例2:
[0589]
雄激素测定原型2:测定架构和结果
[0590]
雄激素测定原型2的概念是如t7 rna聚合酶等单个蛋白质rna聚合酶与其在dna模板上的启动子序列结合。dna模板对启动子下游的rna适配体mango ii序列进行编码。激素应答元件(hre)位于t7启动子与mango ii序列之间。当向t7体外转录(ivt)添加类固醇激素受体(shr)并且通过受体特异性配体激活shr时,shr会与dna模板上的hre结合,并在此结合位置中物理地抑制t7 rna聚合酶将dna转录为rna,并且因此未形成mango ii适配体。通过向与mango ii适配体结合的反应混合物中添加如to1-生物素等特定荧光团检测mango ii的形成。在与mango ii适配体结合时,to1在被510nm波长激发时发射535nm波长的激发波长。使用标准荧光计测量荧光。
[0591]
2.1用于开发雄激素测定原型2的dna序列
[0592]
以下实验使用ar或erα作为示例shr并且使用are和ere作为示例hre。
[0593]
巩固t7介导的体外转录的关键步骤是识别其在dna模板中的启动子序列。然后为了测量t7转录已经发生,dna序列可以对报告酶(蛋白质)或报告rna(例如适配体)进行编码。在以下实施例中,dna序列对报告rna(mango ii)进行编码。
[0594]
使用了商业dna片段合成来产生对以下进行编码的一系列dna模板:(1)t7起始子序列,(2)are,(3)具有f30支架的mango ii rna适配体。将这些dna片段克隆到质粒中,并且
使用经转换的大肠杆菌(e.coli)进行扩增。随后的质粒提取、纯化和线性化为原型测定提供了最终的dna模板。转录因子阻断t7活性的其它实例示出,t7起始子序列与转录因子位点之间约15bp对于阻断t7进程是最优的。因此,在dna片段中包含了15bp的填充序列。
[0595]
表2:原型2中使用的用于检测雄激素配体的序列
[0596][0597]
*单下划线区域为mango ii
[0598]
2.2经睾酮激活的ar能够抑制rna适配体mango ii的t7介导的表达
[0599]
用于检测shr配体的shr-hre-rna适配体反应取决于与激素应答元件结合的shr对t7转录的阻断。在以下实例中,使用了ar和are来表示shr和hre。
[0600]
表3:ar/hsp90-are反应所需的反应组分,以t7产生的mango ii作为读数
[0601]
组分每反应浓度/活性*t7 rna聚合酶0.5μlt7 are mango ii dna模板100ngt7反应缓冲剂**2.5μlar50nghsp90100ng类固醇激素250μmmango ii特异性荧光团100nm
[0602]
*初始实验的浓度基于先前的工作(例如ar/hsp90的fret测定或发明人的实验室建立的其它无细胞测定)或制造商的协议(dna模板浓度、酶和荧光团)。
[0603]
**t7反应缓冲液(例如来自hiscribe试剂盒[赛默飞世尔科技公司]的ntp缓冲液或提供有t7酶的10
×
缓冲液或自制缓冲液)
[0604]
在添加t7 rna聚合酶的情况下组装和启动反应,并且在37℃下培养150分钟。在此期间,产生了rnamango ii适配体。mango ii的检测是通过添加荧光团、噻唑橙(to1)并且用荧光计,激发510nm和发射535nm测量输出进行的。图5示出了经睾酮激活的ar能够以剂量依赖性方式减少t7产生的rna适配体mango ii的量。睾酮表示身体内最丰富的内源性循环雄激素。睾酮可以在外周组织(例如性腺)中转化为二氢睾酮(dht)。还发现dht激活在mango ii的t7产生中ar调节的减少。
[0605]
2.3类固醇激素受体的滴定
[0606]
如上所述,在以下实验中使用了ar作为示例类固醇激素受体。
[0607]
在以上实验中,并且如表3中所示,初始ar浓度基于在发明人的实验室中建立的先
前的无细胞测定。t7介导的mango ii产生的减少取决于存在足够的ar来阻断当前与dna模板接合并且在dna模板上有活性的所有t7酶分子。这意味着ar与t7的比率和ar与dna模板的比率两者都很重要。然而,在t7和/或dna模板的最优水平的上下文中需要考虑ar的水平,所述最优水平支持检测荧光变化所需的足够mango ii产生。
[0608]
在接下来的一系列实验中,改变了每反应ar的浓度以显示对δ[mango ii]的作用。
[0609]
表4:ar的滴定
[0610][0611]
使用50ng ar反应作为“标准”反应,ar的分子的数量为2.737e
11
(454.55fmol或22.72nm)相比3.798e
10
(63.06fmol或3.15nm)的dna分子的数量产生7.2:1的ar:dna过量比率。将ar浓度加倍到100ng使比率加倍到14.4:1。将ar浓度减半到25ng使比率减半到3.6:1,并且进一步地再次使14.2ng ar减半到1.8:1。
[0612]
图6中的数据表明7.2:1或更大的ar:dna比率会产生更大的δmango ii。较低的比率仍示出δmango ii但效应大小降低。值得注意的是,比率从7.2跃升到14.4示出了对δmango ii的效应大小未提高,这表明在7.2:1时,ar与dna的过量足以阻断t7活性并且具有进一步过量会产生冗余。
[0613]
当考虑通过类固醇激素进行shr激活时,还需要检查hsp90与shr的比率,因为过量的hsp90会阻断shr的激活,这在低配体浓度下尤其如此,而不足的hsp90将允许shr自体激活。再次,在下一组实验中使用ar作为代表性shr,改变hsp90与ar的比率以详查睾酮对mango ii的t7产生的影响。
[0614]
表5:hsp90:ar比率的滴定
[0615][0616]
图7示出50ng ar和100ng hsp90的标准反应,其中2.44:1的hsp90:ar的比率是最优的,然而其它比率可以达到相同的水平的δmango ii。例如,对应于6.69e
11
个分子(1.11pmol或55.5nm)的100ng hsp90和对应于5.47e
11
个分子(909.09fmol或45.5nm)的100ng ar或1.22:1的比率也示出对mango ii的t7介导的产生的良好抑制。同等地,分别表
示1.37e
11
个分子(227.27fmol或11.4nm)和6.69e
11
个分子(1.11pmol或55.5nm)的ar(25ng)和hsp90(100ng)或4.88:1的比率示出与2.44:1的比率无区别的δmangoii。然而,9.76:1的比率示出δmangoii减少,ar浓度《100ng的1.22:1比率也是如此。
[0617]
重要的是,来自图6和7数据突出了化学计量地定义生物反应的独特能力。
[0618]
当ar:dna比率为≥7.2:1时ar在与are结合并阻断t7进展方面最有效。当hsp90:ar比率介于1.22:1与4.88:1之间时,ar在被配体激活并与are结合方面最有效。
[0619]
2.4操纵hre
[0620]
迄今为止数据使用了基于细胞的ar生物测定中通常使用的3
×
are序列(参见表2)。然而,已鉴定出的主要are序列为agaacagcctgttct。考虑到此测定的功能,即ar物理地阻断了t7酶,3
×
are序列的存在可能不是必需的。在接下来的测试中,将单个但主要在序列方面的are克隆到t7 dna模板中。图8清楚地示出,单个are与具有经激活的ar阻断t7 rna聚合酶的3
×
are序列一样有效。
[0621]
2.5滴定dna模板
[0622]
dna模板是测定的关键组成部分并且需要处于支持t7转录的浓度下,同时还不能过量,以便存在的ar分子的数量可以在空间上阻碍t7酶对报告构建体的转录。
[0623]
在接下来的一系列实验中,对dna模板进行滴定以保持ar和t7恒定。这提供了对支持转录和维持ar阻断所需的dna分子的数量的见解。图9的数据表明,当ar的浓度为50ng(2.737e
11
个分子,454.55fmol或22.72nm)并且dna浓度为100ng(3.798e
10
,63.06fmol或3.15nm)时,存在对δmango ii的良好检测,从而表示7.2:1的ar:dna比率。通过将dna浓度降低到14.4:1、17.28:1和28.8:1的测试比率来增加过量的ar与dna的量对改善δmango ii无影响。因此,7.2:1的过量比率可实现最大作用。注意,将dna模板减少到6.46e9或3.398e9确实会影响δmango ii,因为t7介导的荧光输出显著降低(数据未示出)。因此,双链dna的9.495e9个分子是成功反应所需的最小水平,而过量的ar:dna必须维持在7.2:1以上。在添加更多ar的情况下超过7.2会产生冗余,而减少dna以增加比率风险t7介导的转录本身。
[0624]
来自图9的数据继续定义了生物有效但合成实现的shr反应。通过对单个组分的化学计量分析,实验证实了当ar:dna比率为≥7.2:1时ar在与are结合并阻断t7进展方面最有效。然而,当组成此比率时,需要将dna模板浓度锁定在双链dna的至少9.495e9个分子,否则转录的基础水平会受损害。
[0625]
2.5滴定t7聚合酶
[0626]
需要考虑以进行可以模拟类固醇激素受体生物学的完全定义的化学计量反应的雄激素测定原型2的最终组分是t7酶本身。在此反应中使用了t7 rna聚合酶来产生报告子,所述报告子在这些实例中为rna适配体mango ii。
[0627]
t7酶的量对于将荧光读数维持在将实现最优动态范围的光谱内至关重要。t7是酶,因此不仅浓度是重要因素,而且活性也是。接下来的一系列实验示出了改变t7活性对δmango ii的影响。
[0628]
在图10中,数据表明随着量t7单位从50u滴定到10u,t7产生的mangoii:to1b的荧光水平。应注意的是,在40-10u的酶范围内,在所有度量接近200000的情况下测量的荧光无明显差异,这表明检测基线清晰,此时灵敏度不够高,无法测量输出变化。这表明为了测量δmangoii,荧光度量必须大于200000。
[0629]
为了进一步证明最小荧光水平的影响,在用睾酮诱导的ar阻断的反应中使用了t7(50u)或t7(100u)来产生mango ii rna适配体或使用其作为对照乙醇。图11中的数据表明,如果使用了50u,则荧光为约250000-300000,睾酮激活示出在δmango ii中为约9%,然而如果荧光在》600000的范围内,则相同的反应示出约16%δmango ii。因此,数据突出了t7活性必须在产生》300000的mangoii-to1b荧光的范围内。确切的活性或单位将取决于重组t7 rna聚合酶的比活性的批次与批次和/或供应商与供应商的差异。
[0630]
实例3:
[0631]
雌激素测定原型3:测定架构和结果
[0632]
在以上实例中,使用了ar/are作为示例shr/hre。以下系列的实验使用了为ar/are建立的所定义反应化学计量来显示测试对其它shr,在此情况下erα的适用性。下面呈现的结果表明,经雌二醇激活的erα能够抑制rna适配体mango ii的t7介导的表达。
[0633]
表6:原型3中使用的用于检测雌激素配体的序列
[0634][0635]
*单下划线区域为mango ii
[0636]
使用了被证明是睾酮的成功检测测试的标准ar/are条件,然而用erα替代了ar并且对单个ere进行编码的dna模板替代了are dna模板(表6)。图12示出了用erα(50ng)与hsp90(100ng)的组合替代ar并且用5μm雌二醇(e2)进行激活导致mangoii:to1输出减少。δmango ii为约60%。在考虑比率时,68kda的erα小于ar(110kda),并且因此为了重量而添加的分子的数量为4.428e11(735.20fmol或36.8nm)。因此hsp90:erα的比率为6.69e
11
:4.428e
11
或1.51:1,并且erα:dna为4.428e
11
:3.798e
10
或11.66:1。这两者都在发现为用于利用shr/hre测试的ar版本检测雄激素的成功比率的范围内。
[0637]
表7:erα/ere反应
[0638]
组分每反应浓度t7 rna聚合酶0.5μl或100ut7 ere mango ii dna模板100ngt7反应缓冲液2.5μlerα50nghsp90100ngmango ii特异性荧光团100nm
[0639]
erα:ere反应对雌激素的检测的重要性为两倍。首先,这说明了从ar/are dna模板到er/ere dna模板的基本测试组分切换的简单性。其次,这说明了为ar/are建立的通过配体与雄激素受体结合,由hsp90替代,并且与are结合模仿雄激素生物学的所定义化学计量反应可转化为第二类固醇激素受体/类固醇应答元件组合。
[0640]
数据表明,所述测试能够以无细胞方式重现类固醇激素生物学,并且以此方式可以定义每个组件-真正的原位测试。这与体外使用基于细胞的生物测定或基于核提取物的无细胞生物测定提供全酶rna聚合酶ii的情况不同。在基于细胞的生物测定的情况下,shr、hsp90、dna模板和rna聚合酶ii的水平根本无法定义,因为其受到细胞的表达模式影响。基于核提取物的无细胞生物测定可以通过描述shr、hsp90和hre水平来部分定义反应的化学计量,然而无法定义rna聚合酶水平。rna聚合酶ii是全酶,由几个亚基或蛋白质组成,并且因此可以仅以核提取物的形式提供。在存在哪些其它蛋白质方面未对核提取物进行定义。在此单多肽rna聚合酶形式的测定中,可以完全定义反应的化学计量,并且数据显示此类反应可以通过合成操纵来模拟类固醇激素受体的自然生物学。
[0641]
实例4
[0642]
针对原型测定的配体-shr/hre化学计量反应
[0643]
实例2和3中呈现的数据揭示了通过配体与特定受体结合,由此受体从hsp90移出并且与类固醇应答元件结合(经典类固醇激素基因组应答)来模拟类固醇激素受体生物学的所定义化学计量。在自然界中,shr会激活或抑制靶基因的表达。在本文所述的原型测定中,配体结合的shr的结合抑制报告分子的表达。
[0644]
表8:提供原型测定的经优化的输出的分子的比率
[0645][0646]
表9:显示shr/hsp90/hre反应的示例化学计量的模板
[0647][0648]
*x由产生》600000单位的mango ii:to1b荧光所需的t7 rna聚合酶的体积/单位(取决于供应商的)定义。绝对基线阈值为活性》200000的荧光。
[0649]
实例5
[0650]
雄激素测定原型2检测雄激素分子
[0651]
雄激素分子主要是类固醇激素。睾酮和二氢睾酮是最丰富的内源性雄激素。基于其结构,已设计和销售了合成雄激素合成代谢类固醇(aas)。aas是运动员、人类和动物等中最常见滥用的性能增强药物。合成衍生的另一类别的雄激素分子是选择性雄激素受体调节剂或sarm。与aas一样,sarm也被运动员滥用。aas和sarm两者在其结构方面不同,具有多种不同的侧基和主链。接下来的一系列实验测试了ar/hsp90-are原型测定是否能够检测不同的aas和sarm。
[0652]
表10:利用雄激素测定原型2测试的aas和sarm
[0653]
雄激素化合物化合物的性质睾酮内源性二氢睾酮内源性17α-群勃龙aas17β-群勃龙aastrenaaas-设计师类固醇-网络来源的四烯雌酮孕酮,新描述的雄激素群迪酮aas去甲睾酮aas宝丹酮aas93746sarmbmssarmldgsarmacp105sarmyk-11sarm安达林sarm利甘德罗sarm奥斯达林sarm
[0654]
图13示出了所述测定能够检测多种aas和sarm。
[0655]
实例6
[0656]
雄激素测定原型2检测生物基质中的雄激素分子
[0657]
接下来针对雄激素测定原型2检测存在于如血清或血浆等生物基质中的睾酮的能力对其进行测试。首先,需要证明t7 rna聚合酶在血清存在的情况下继续运行,即血清本身不会抑制t7在产生mango ii适配体方面的功效。图14示出了在马血清或胎牛血清(fcs)存在的情况在下t7 rna聚合酶继续产生mango ii。
[0658]
无证据表明血清无意地抑制了t7活性。接下来,测试了在血清存在的情况下,ar是否仍然对作为示例配体的睾酮做出应答。如以上所描述的建立反应,不同之处在于这次用已掺入有睾酮(或乙醇作为媒剂)的血清替换水组分。图15示出了,如果血清存在作为反应组分,则反应不会受到损害。此结果非常重要,因为这说明了所述测定能够检测用于例如临床或运动兴奋剂应用的生物学相关样品中的雄激素水平。
[0659]
在下一阶段的测试中,针对雄激素测定原型2检测与马尿液样品脱缀合并且从马尿液样品中提取的内源性雄激素的能力对其进行测试。在比赛日收集赛马尿液样品,并且使用常规程序对类固醇进行脱缀合并且提取类固醇。将所提取的类固醇重悬于乙醇中并进行测定。
[0660]
图16示出了雄激素测定原型2能够检测到来自小马(雄性马)的尿液样品中的高水平的雄激素,而无法检测到来自阉马(阉割的雄性马)的高水平的雄激素。使用阉马尿液中的睾酮和掺入的群勃龙(aas)作为对照。
[0661]
来自图15和图16的数据表明,所述测定能够检测出包含血清和尿液的生物基质中
的雄激素分子。
[0662]
尽管已经通过举例描述了本发明,但是应当了解,在不脱离如权利要求书中所界定的本发明范围的情况下可以作出改变和修改。此外,在存在具体特点的已知同等特点的情况下,并入所述同等特点,如同在本说明书中具体提及一样。
[0663]
***
[0664]
本文参考或提及的所有专利、出版物、科学论文、网站以及其它文献和材料表示本发明所涉及领域的技术人员的技术水平,并且每个此类参考文献和材料由此通过引用并入本文,其程度如同其已通过引用单独地整体并入或以其整体在本文中阐述。申请人保留将来自任何此类专利、出版物、科学论文、网站、电子可用信息以及其它参考材料或文献的任何和所有材料和信息实际并入本说明书的权利。
[0665]
已采用的术语和表达被用作描述性而非限制性的术语,并且不打算在使用此类术语和表达来排除所示出和所描述的特征的任何等同物或其部分,但是应认识到,在所要求保护的本发明的范围内的各种修改是可能的。因此,将理解,尽管已经通过优选实施例和任选特征明确地公开了本发明,但是本领域的技术人员可以对本文公开的概念进行修改和变更,并且此类修改和变更被视为是在如本文所述并且所附权利要求书限定的本发明的范围之内。
[0666]
在本文中宽泛地且概括性地描述了本发明。落入一般性公开内容内的较窄种类和亚属分组中的每一个也形成本发明的一部分。这包含本发明的一般性描述,其条件或否定限制为从属中除去任何主题,不管删去的材料是否在此具体详述。
[0667]
其它实施例处于以下权利要求内。另外,在根据马库什(markush)基团描述本发明的特征或方面的情况下,本领域的技术人员将认识到本发明也根据马库什基团的任何单个成员或成员子组进行描述。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。