1.本发明属于药物分析领域,涉及中药质量控制,具体涉及快速检查清热解毒口服液中掺伪山银花的方法。
背景技术:
2.目前,2020年版《中国药典》诸多含金银花药材的制剂针对山银花中有效成分灰毡毛忍冬皂苷乙进行了检查,标准中规定不可检出山银花的主要成分灰毡毛忍冬皂苷乙。清热解毒口服液标准未涉及对山银花的检查,对生产中投入了掺杂山银花的行为未能起到有效的监督。
3.为解决上述问题,特提出本发明。
技术实现要素:
4.本发明旨在克服现有技术不足,提供一种快速检查清热解毒口服液中掺伪山银花的方法。
5.本发明上述目的通过如下技术方案实现:
6.一种快速检查清热解毒口服液中掺伪山银花的方法,通过高效液相色谱法或高效液相色谱-质谱法检测待检测清热解毒口服液中是否存在灰毡毛忍冬皂苷乙,若检测到灰毡毛忍冬皂苷乙则说明掺伪山银花,若未检测到灰毡毛忍冬皂苷乙则说明未掺伪山银花。
7.优选地,所述高效液相色谱法包括参数:以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相a,以0.4%醋酸溶液为流动相b,按如下梯度进行梯度洗脱,流速为每分钟1ml;采用蒸发光散射检测器检测,不分流进样,柱温:30℃;理论塔板数按灰毡毛忍冬皂苷乙计算应不低于5000;
[0008][0009]
优选地,所述高效液相色谱-质谱法包括参数:以十八烷基硅烷键合硅胶为填充剂,规格为内径2.1mm、粒径1.8μm;以乙腈为流动相a,以0.1%甲酸溶液为流动相b,按如下梯度进行梯度洗脱;采用串联四级杆质谱检测器,电喷雾正离子模式,多反应离子监测,选择m/z 1421.65
→
1097.60和m/z 1421.65
→
347.10作为灰毡毛忍冬皂苷乙检测离子对,进样1μl;
[0010][0011]
[0012]
有益效果:
[0013]
本发明提供的方法可以有效检查出清热解毒口服液中掺伪山银花的违规问题,对于生产中掺伪山银花的行为能起到有效监督,可以有效提高清热解毒口服液的质量控制水平。
附图说明
[0014]
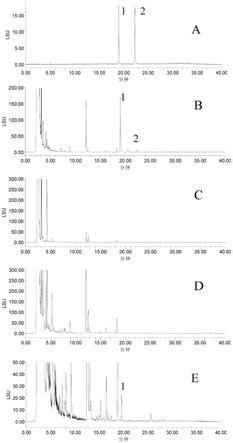
图1为hplc-elsd法检查山银花色谱图;其中:a为灰毡毛忍冬皂苷乙和川续断皂苷乙混合对照品溶液,b为阳性样品溶液,c为缺金银花阴性制剂对照溶液,d为全方制剂对照溶液,e为掺10%山银花阳性制剂对照溶液;1为灰毡毛忍冬皂苷乙峰;2为川续断皂苷乙峰;图2为液质联用法检查山银花提取离子色谱图;其中:a为灰毡毛忍冬皂苷乙和川续断皂苷乙混合对照品溶液,b为阳性样品溶液,c为缺金银花阴性制剂对照溶液,d为全方制剂对照溶液,e为掺山银花阳性制剂对照溶液。
具体实施方式
[0015]
下面结合实施例具体介绍本发明实质性内容,但并不以此限定本发明的保护范围。
[0016]
实施例1:清热解毒口服液中山银花的检查方法
[0017]
【检查】山银花照高效液相色谱法(《中国药典》2020年版通则0512)测定。
[0018]
色谱条件与系统适应性试验以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相a,以0.4%醋酸溶液为流动相b,按下表中的规定进行梯度洗脱,流速为每分钟1ml;采用蒸发光散射检测器检测,不分流进样,柱温:30℃。理论塔板数按灰毡毛忍冬皂苷乙计算应不低于5000。
[0019][0020]
对照品溶液的制备取灰毡毛忍冬皂苷乙对照品适量,精密称定,加50%甲醇制成每1ml含0.2mg的对照品溶液,即得。
[0021]
供试品溶液的制备精密量取本品5ml,置50ml量瓶中,加50%甲醇适量,振摇,用50%甲醇稀释至刻度,摇匀,放置,滤过,取续滤液,即得。
[0022]
测定法分别精密吸取对照品溶液与供试品溶液各20μl,注入液相色谱仪,测定,即得。
[0023]
供试品色谱中不得呈现与对照品色谱峰保留时间相对应的色谱峰。
[0024]
备注:必要时,采用高效液相色谱-质谱法验证。
[0025]
照高效液相色谱-质谱法(《中国药典》2020年版通则0512和通则0431)测定。
[0026]
色谱、质谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂(内径2.1mm,粒径1.8μm);以乙腈为流动相a,以0.1%甲酸溶液为流动相b,按下表进行梯度洗脱;
采用串联四级杆质谱检测器,电喷雾正离子模式(esi ),多反应离子监测(mrm),选择m/z 1421.65
→
1097.60和m/z 1421.65
→
347.10作为灰毡毛忍冬皂苷乙检测离子对,进样1μl。
[0027][0028]
对照品溶液的制备取灰毡毛忍冬皂苷乙对照品适量,精密称定,加50%甲醇制成每1ml含0.2μg的对照品溶液,即得。
[0029]
供试品溶液的制备取(1)项下供试品溶液,即得。
[0030]
测定法分别精密吸取对照品溶液和供试品溶液各1μl,注入液相色谱质谱联用仪,测定,即得。
[0031]
实施例2:检查方法的构建
[0032]
1、标准工艺制法
[0033]
按照2020年版《中国药典》一部收载的“清热解毒口服液”质量标准中制法项下操作。
[0034]
处方:石膏670g、金银花134g、玄参107g、地黄80g、连翘67g、栀子67g、甜地丁67g、黄芩67g、龙胆67g、板蓝根67g、知母54g、麦冬54g。
[0035]
制法:以上十二味,除金银花、黄芩外,其余石膏等十味先加水温浸l小时,煎煮(待煮沸后,再加入金银花和黄芩)二次,第一次1小时,第二次40分钟,滤过,合并滤液,滤液浓缩至相对密度约为1.17(80℃),加入乙醇使含醇量达65%~70%,冷藏48小时,滤过,滤液回收乙醇,浓缩至适量,即得。
[0036]
2、仪器与试药
[0037]
2.1仪器:waters e2695液相色谱仪,2424蒸发光散射检测器;shimadzu lc-20液相色谱仪,配alltech蒸发光散射检测器;梅特勒xs205du电子天平;shimadzu lcms-8050三重四级杆液质联用仪。
[0038]
2.2试药:甲醇、乙腈、乙酸为色谱纯;水为去离子水;其余试剂为分析纯。
[0039]
2.3对照品:灰毡毛忍冬皂苷乙、川续断皂苷乙,采购自中国食品药品检定研究院,批号分别为111814-202005和111813-201804,纯度分别为97.2%和96.8%。
[0040]
2.4样品:山银花饮片3批,见表1;制剂样品由2021国家药品评价性抽验所得。标准制剂分为清热解毒全方标准制剂、缺金银花阴性制剂以及掺杂山银花阳性制剂,均为苏州药检中心按照清热解毒口服液的工艺模拟制备。制备标准制剂的投料饮片均符合2020年版《中国药典》一部品种标准项下有关的各项规定。
[0041]
表1山银花药材饮片信息表
[0042][0043]
3、方法与结果
[0044]
3.1色谱条件
[0045]
色谱柱:waters xbridge c18(5μm,4.6
×
250mm),thermo bds hypersil c18(5μm,4.6
×
250mm),boston green ods(5μm,4.6
×
250mm),柱温:30℃;流速:1.0ml/min。
[0046]
流动相:参考2020年版《中国药典》一部项下包含山银花检查的中成药,均选择乙腈-0.4%乙酸水溶液作为流动相,故本试验选择该流动相系统。流动相梯度洗脱程序见下表2。
[0047]
表2梯度洗脱程序
[0048][0049]
3.2溶液制备
[0050]
3.2.1对照品溶液制备
[0051]
取灰毡毛忍冬皂苷乙、川续断皂苷乙对照品适量,精密称定,加50%甲醇制成每1ml各含0.2mg的混合溶液,即得。
[0052]
3.2.2供试品溶液制备
[0053]
精密量取本品5ml,置50ml量瓶中,加50%甲醇适量,振摇,用50%甲醇稀释至刻度,摇匀,放置,滤过,取续滤液,即得。
[0054]
3.2.3阴性及阳性制剂对照溶液制备
[0055]
取金银花等药材按清热解毒口服液处方工艺制备方法制备全方制剂;取处方中除金银花外的全部药味,按本品口服液制法制备缺金银花阴性制剂;按处方中金银花量的10%添加山银花,其余药味按处方取用,制备掺10%山银花阳性制剂。按照供试品溶液制备方法制备相应的全方制剂对照溶液,缺金银花阴性制剂对照溶液,掺10%山银花阳性制剂对照溶液。
[0056]
3.2.4供试品溶液制备讨论
[0057]
参考2020年版《中国药典》一部项下包含山银花检查的中成药,均选择50%甲醇溶液作为提取溶剂,本试验选择30%甲醇、50%甲醇、70%甲醇作为考察溶剂。结果表明各组分在50%甲醇条件下达到最大提取率。考察料液比,结果口服液1:10时目标含量最佳。
[0058]
3.3专属性试验
[0059]
取灰毡毛忍冬皂苷乙和川续断皂苷乙混合对照品溶液及全方制剂对照溶液、缺金银花阴性制剂对照溶液、掺10%山银花阳性制剂对照溶液注入液相色谱仪进行测定,结果
表明:专属性良好,详见图1,专属性图谱。
[0060]
3.4耐用性试验
[0061]
考察三种不同色谱柱及两台液相色谱仪下样品(sz2021yp0056)的含量比较,结果如下表3,灰毡毛忍冬皂苷乙方法耐用性可行,而川续断皂苷乙因含量较低,接近定量限,故相对标准偏差较大。
[0062]
表3耐用性试验结果
[0063][0064]
3.5线性关系及检测限考察
[0065]
分别精密称取灰毡毛忍冬皂苷乙与川续断皂苷乙9.87mg和10.37mg,加50%甲醇分别制成对照品储备溶液。取两对照品储备溶液,用50%甲醇配置成浓度级别为20、50、100、200、500ug/ml的系列标准溶液,按上述色谱条件,分别进样,记录各组分峰面积。以峰面积对数值lgy为纵坐标,进样质量lgx为横坐标,绘制标准曲线,结果见表4。取阴性样品(样品编号sz2021yp0020)添加适当浓度的混合对照品溶液,按供试品制备方法制备阴性样品加标溶液,进样测定,以信噪比3:1设为检测限,结果见表4,此处单位表示加标供试品溶液的终浓度。
[0066]
表4山银花成分线性关系及检测限
[0067][0068]
3.6精密度考察
[0069]
取混合对照品溶液浓度水平为200ug/ml的溶液,连续进样6次,检测灰毡毛忍冬皂苷乙和川续断皂苷乙的峰面积,计算得峰面积rsd分别为1.23%和1.30%,仪器精密度良好。
[0070]
3.7稳定性考察
[0071]
取样品编号sz2021yp0056样品,按上述供试品溶液制备方法制备供试品溶液,于0、1、2、4、8、16、24h内分时间段测试灰毡毛忍冬皂苷乙和川续断皂苷乙峰面积,结果其峰面积rsd分别为1.17%和3.11%,样品在24h内稳定性良好。
[0072]
3.8重复性考察
[0073]
取样品取样品编号sz2021yp0056样品,按上述供试品溶液制备方法制备6份供试品溶液,测定灰毡毛忍冬皂苷乙和川续断皂苷乙峰面积,计算其rsd值分别为2.18%和2.16%,重复性良好。
[0074]
3.9准确度试验
[0075]
采用加标回收法,取口服液阴性样品(样品编号sz2021yp0020)9份,分三组,按低
中高浓度添加灰毡毛忍冬皂苷乙和川续断皂苷乙对照品溶液,按拟定供试品溶液制备方法制备,依法测定,计算回收率,结果见表5。
[0076]
表5回收率结果
[0077][0078]
3.10限度制定
[0079]
《中国药典》2020年版一部中收载的山银花品种有四个来源-灰毡毛忍冬、红腺忍冬、华南忍冬或黄褐毛忍冬,市场上以灰毡毛忍冬最为常见,因此本检验方法以灰毡毛忍冬为山银花研究对象。对三批灰毡毛忍冬皂苷乙进行检测,测定灰毡毛忍冬皂苷乙含量分别为58.3mg/g、72.9mg/g、57.5mg/g,川续断皂苷乙含量分别为0.043mg/g、0.067mg/g、0.028mg/g。
[0080]
考虑到市面上存在一定程度的金银花掺杂山银花现象,非生产厂家主观故意为之,本项目研究拟定金银花掺杂10%山银花为掺杂限度,取三批山银花按清热解毒口服液标准制备方法制备掺10%山银花阳性制剂三批,液相测定并计算得三批样品中灰毡毛忍冬皂苷乙含量分别为0.49mg/ml、0.68mg/ml、0.54mg/ml,灰毡毛忍冬皂苷乙平均含量为0.61mg/ml,川续断皂苷乙未检出。
[0081]
参考《中国药典》2020年版中将山银花检查纳入质量标准的含金银花中成药制剂,均将灰毡毛忍冬皂苷乙作为唯一检查指标,结合实际样品检测结果中检出的川续断皂苷乙峰面积较小,含量均较低,因此本项目研究将灰毡毛忍冬皂苷乙作为山银花检查指标成分,限度按金银花掺杂10%山银花计,口服液每1ml含灰毡毛忍冬皂苷乙不得超过0.61mg。
[0082]
3.11样品测定
[0083]
依照上述方法对200批口服液样品进行测定,样品检出情况见下表6,未列入表的
为未检出样品。共有9个生产企业24批次口服液检出灰毡毛忍冬皂苷乙,其中有5个生产企业15批次样品不合格。
[0084]
表6山银花检查阳性样品检测结果
[0085][0086][0087]
4、液相色谱-质谱法验证
[0088]
4.1检测条件
[0089]
色谱柱为waters acquity hss c18(100mm
×
2.1mm,1.8um);以乙腈-0.1%甲酸溶液为流动相,梯度洗脱,洗脱程序表见表7;采用串联四级杆质谱检测器,电喷雾离子化(esi)正离子模式,多反应离子监测(mrm),选择m/z 1421.65
→
1097.60和m/z 1421.65
→
347.10(灰毡毛忍冬皂苷乙,碰撞能量分别为34,25)作为检测离子对,按上述离子对测定的mrm色谱峰信噪比均应大于3:1。
[0090]
表7山银花检查质谱验证梯度程序
[0091][0092]
4.2溶液制备
[0093]
取hplc项下供试品溶液,即得。
[0094]
4.3专属性考察
[0095]
取灰毡毛忍冬皂苷乙对照品溶液及全方制剂对照溶液、缺金银花阴性制剂对照溶液、掺10%山银花阳性制剂对照溶液注入液相色谱仪进行测定,结果表明:目标化合物专属性良好,详见图2专属性图谱。
[0096]
4.4耐用性考察
[0097]
使用不同品牌色谱柱,结果不同品牌色谱柱测定结果基本一致;小范围调整流动相比例,结果一定范围内的波动对本检验方法无影响。
[0098]
4.5检测限
[0099]
取阴性样品(样品编号sz2021yp0020)添加适当浓度的混合对照品溶液,按供试品制备方法制备阴性样品加标溶液,进样测定,以信噪比3:1设为检测限,结果灰毡毛忍冬皂苷乙的检测限为0.02μg/ml。
[0100]
4.6样品测定
[0101]
对液相色谱检出阳性的样品进行质谱检测,结果均与液相检测一致。
[0102]
上述实施例的作用在于具体介绍本发明的实质性内容,但本领域技术人员应当知道,不应将本发明的保护范围局限于该具体实施例。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。