人源化bcma抗体和bcma-car-t细胞
技术领域
1.本发明涉及人源化bcma抗体和特异性减少多发性骨髓瘤生长,在过继免疫基因治疗肿瘤领域中有用的人源化bcma-car-t细胞(pmc309含共刺激结构域cd28,pmc750含共刺激结构域4-1bb)。
背景技术:
2.免疫疗法正在成为一种非常有前途的癌症治疗方法。t细胞或t淋巴细胞是我们免疫系统的武装力量,不断寻找外来抗原并将异常(癌症或经感染细胞)和正常细胞区分开来。利用car(嵌合抗原受体)构建体对t细胞进行基因修饰已成为设计肿瘤特异性t细胞最常见的方法。将靶向肿瘤相关抗原(taa)的car-t细胞输入患者体内(称为过继细胞转移或act)是一种有效的免疫治疗方法[1,2]。与化疗或抗体相比,car-t技术的优点在于经重新编程的工程化t细胞能在患者体内实现增殖和持续存在(“一种活的药物”)[1,2]。
[0003]
car通常由在n-末端部分的单克隆抗体来源的单链可变片段(scfv)、铰链、跨膜结构域和若干胞内共刺激结构域:(i)cd28,(ii)cd137(4-1bb)、cd127或其它共刺激结构域,与cd3-ζ结构域串联组成(图1)[2;3]。car的演变经历了从第一代(无共刺激结构域)到第二代(有一个共刺激结构域)再到第三代car(有若干个共刺激结构域)。具有多个共刺激结构域的car(所谓的第三代car)增强了细胞毒性car-t细胞活性,显著改善car-t细胞的持久性,从而增强其抗肿瘤活性。
[0004]
图1示出了car的结构。左侧:第一代(无共刺激结构域)结构,中间:第二代(一个共刺激结构域cd28或4-1bb),右侧:第三代car(两个或若干个共刺激结构域)。该图来自golubovskaya,wu,cancers,2016[3]。
[0005]
bcma
[0006]
b细胞成熟抗原(bcma)是一种细胞表面受体,又称cd269和肿瘤坏死因子受体超家族成员17(tnfrsf17),由tnfrsf17基因编码。该受体主要在成熟的b淋巴细胞中表达,并在大多数多发性骨髓瘤(mm)中过表达[4]。现有用于治疗多发性骨髓瘤的靶向bcma的疗法包括单克隆抗体、双特异性抗体和t细胞免疫疗法、car-t疗法[4][5]。
[0007]
bcma结构和信号传导
[0008]
人bcma蛋白由184个氨基酸组成:1-54-胞外结构域;55-77-跨膜结构域;78-184-胞浆结构域。bcma的氨基酸序列如图2所示。bcma缺乏信号肽,并与其他受体诸如baff受体以及跨膜激活物和亲环素配体相互作用物和钙调节物(taci)类似[5]。这些受体在b细胞成熟和分化为浆细胞中发挥重要作用。它们的配体包括在mm患者中表达增高的baff和april[5]。单克隆抗体靶向受体-配体相互作用,同时car-t细胞疗法结合bcma以杀伤mm细胞。bcma还与traf1、2、3、5和6相互作用。
技术实现要素:
[0009]
为了给多发性骨髓瘤的提供新的治疗方法,本发明提供了一种人源化bcma的单链
可变片段(scfv),其包括具有seq id no:5所示氨基酸的vh和具有seq id no:6所示氨基酸的vl。
[0010]
在一些实施方式中,本发明的scfv进一步包括vh和vl之间的接头。
[0011]
在具体实施方式中,本发明的scfv具有seq id no:8所示的氨基酸序列。
[0012]
另一方面,本发明提供了一种嵌合抗原受体(car)融合蛋白,其自n-末端到c-末端包括:
[0013]
(i)本发明的scfv,
[0014]
(ii)跨膜结构域,
[0015]
(iii)至少一个共刺激结构域,和
[0016]
(iv)激活结构域。
[0017]
在具体的实施方式中,所述共刺激结构域是cd28或4-1bb。
[0018]
在具体的实施方式中,所述激活结构域是cd3ζ。
[0019]
在一个具体的实施方式中,本发明的car有seq id no:9所示的氨基酸序列。
[0020]
在另一个具体的实施方式中,本发明的car具有seq id no:10所示的氨基酸序列。
[0021]
再一方面,提供了编码本发明的car的核酸。
[0022]
又一方面,提供了一种经修饰以表达本发明的car的t细胞或自然杀伤细胞。car-t细胞由于它们对肿瘤或病毒抗原的细胞毒活性,对靶标癌细胞具有特异性杀伤活性。
[0023]
本发明基于靶向骨髓瘤bcma的人源化bcma-car-t细胞。人源化bcma-car-t细胞的优势在于其拥有人源化bcma scfv,由于scfv具有人序列,相比鼠scfv对人的免疫原性要低,在许多临床应用中极具潜力和优势。
附图说明
[0024]
图1.示出了car的结构。
[0025]
图2.示出了bcma蛋白的氨基酸序列;胞外结构域标有下划线。
[0026]
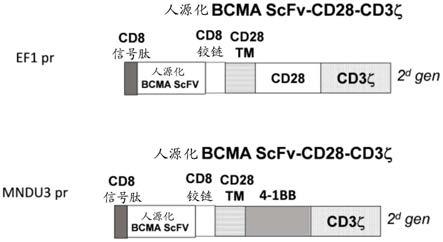
图3.示出了人源化bcma car的结构。
[0027]
图4.示出了人源化bcma-car-t细胞杀伤cho-bcma细胞但不杀伤cho细胞。利用xcelligence实时细胞毒性分析检测人源化bcma-car-t细胞的细胞毒性。y轴表示归一化的细胞指数,x轴表示时间。上侧表示cho-bcma靶细胞,下侧表示cho靶细胞。右边从上到下是靶细胞、t细胞、模拟car-t细胞和人源化bcma car-t细胞作为效应细胞。图5.示出了相比t细胞和模拟car-t细胞,人源化bcma-car-t细胞针对cho-bcma-阳性细胞分泌高水平的ifn-γ,p《0.05。
[0028]
图6.示出了基于抗小鼠f(ab)2m fab和荧光标记的bcma蛋白,利用facs对9天的扩增期间的hbcma-car-t细胞(pmc750)进行检测,表明有高百分比的car-阳性细胞。
[0029]
图7.示出了利用rtca实时细胞毒性分析,证明pmc750 car-t细胞有效且特异性地杀伤cho-bcma细胞。上侧:cho-bcma靶细胞;下侧:cho-cs1靶细胞。
[0030]
图8.示出了人源化bcma-car-t细胞显著减少rpmi8226异种移植瘤生长。*p《0.001,bcma-car-t细胞(pmc750)和模拟(pbs-对照)比较。
[0031]
图9.示出了bcma-car-t细胞显著抑制prmi8226异种移植肿瘤的生长。
具体实施方式
[0032]
定义
[0033]
如本文所使用的,“嵌合抗原受体(car)”是指一种经过改造后可以赋予t细胞新的能力靶向一种特定蛋白的受体蛋白。该受体是嵌合的,因为它们将抗原结合功能和t细胞激活功能结合成单一的受体。car是一种融合蛋白,其包括能够与抗原结合的胞外结构域、跨膜结构域和至少一个胞内结构域。“嵌合抗原受体(car)”有时也称为“嵌合受体”、“t小体”,或“嵌合免疫受体(cir)”。“能与抗原结合的胞外结构域”指的是能与某一抗原结合的任何寡肽或多肽。“胞内结构域”指的是任何已知作为结构域起作用的寡肽或多肽,该结构域传递信号以激活或抑制细胞内的生物过程。
[0034]
如本文所使用的,“结构域”指的是多肽中的一个区域,该区域独立于其他区域折叠成特定结构。
[0035]
如本文所使用的,“人源化抗体”指的是来源于非人类物种的抗体,其蛋白质序列已被修饰以增加其与人类天然产生的抗体变体的相似性。
[0036]
如本文所使用的,“单链可变片段(scfv)”指的是来源于保留与抗原结合能力的抗体的单链多肽。scfv的一个示例包括通过重组dna技术形成的抗体多肽,并且其中免疫球蛋白重链(h链)和轻链(l链)片段的fv区域通过间隔序列连接。本领域技术人员已知用于工程化scfv的各种方法。
[0037]
如本文所使用的,“肿瘤抗原”指的是具有抗原性的生物分子,其表达导致癌症。
[0038]
本发明人已基于特异性靶向bcma的人源化bcma scfv序列生成car-t细胞。本发明人已产生了人源化bcma-car-t细胞以靶向过表达bcma肿瘤抗原的癌细胞。本发明的人源化bcma-car-t细胞针对多发性骨髓瘤细胞分泌高水平的细胞因子,并杀伤cho-bcma阳性靶细胞而不杀伤对照cho细胞。
[0039]
本发明人以小鼠单克隆抗体,克隆4c8a(wo2019/195017)的重链和轻链可变区为起始工程化制备人源化bcma scfv。小鼠4c8a抗体对人bcma展现出很强且选择性的结合。人源化bcma同样对人bcma展现出很强且选择性的结合,但对人体的免疫原性较低。
[0040]
本发明涉及一种人源化单克隆抗人bcma抗体(pmc309),其分别包括具有seq id no:5所示氨基酸的人源化vh和具有seq id no:6所示氨基酸的人源化vl。在一个实施方案中,人源化抗人bcma抗体是单链可变片段(scfv)。该scfv可以是vh-接头-vl或vl-接头-vh。
[0041]
本发明还涉及一种嵌合抗原受体融合蛋白,其从n-末端到c-末端包括:(i)抗bcma的单链可变片段(scfv)(本发明),(ii)跨膜结构域,(iii)至少一个共刺激结构域,和(iv)激活结构域。
[0042]
图3示出了人源化bcma car结构的构建体。第二代bcma-car拥有在ef1启动子下的cd28共刺激结构域(上侧,例如:car-pmc309),或者拥有在mndu3启动子下的4-1bb共刺激结构域(下侧,例如:car-pmc750)。
[0043]
本发明人已生成了人源化bcma-scfv-cd28/41-bb-cd3ζ-car-t(bcma-car-t)细胞并用于对抗多发性骨髓瘤细胞(mm)。bcma-car-t细胞分泌高水平的细胞因子,并且对乳酸脱氢酶(ldh)细胞毒性试验和对使用cho-bcma细胞的细胞毒性试验呈阳性,但对cho细胞的细胞毒性试验呈阴性,这表明car-t细胞由于它们对肿瘤或病毒抗原的细胞毒活性,对靶标癌细胞具有特异性杀伤活性。
[0044]
本发明的人源化bcma-scfv的优势包括该人源化bcma-scfv对人体的免疫原性更低。因此,本发明的bcma抗体作为治疗剂在许多临床应用中极具潜力和优势。
[0045]
本发明中的人源化bcma scfv可应用于免疫疗法:毒素/药物-偶联抗体、单克隆治疗抗体、人源化bcma抗体和car-t细胞免疫疗法。
[0046]
使用本发明中人源化bcma scfv的人源化bcma-car-t细胞可以有效地靶向bcma阳性癌细胞系中的bcma抗原。
[0047]
人源化bcma-car-t细胞可以与不同的化学疗法,诸如检查点抑制剂、靶向疗法、小分子抑制剂,和抗体等结合使用。
[0048]
人源化bcma-car-t细胞可以在临床上用于bcma阳性癌细胞。
[0049]
共激活结构域的修饰:cd28、4-1bb等能用于提高bcma-car的疗效。标签偶联的人源化bcma scfv可以用于car的生成。
[0050]
人源化bcma-car-t细胞可以与不同的安全开关联合使用,例如t-egfr,rqr(利妥昔单抗-cd34-利妥昔单抗)等。
[0051]
第三代car-t或其他共激活信号结构域所组成的car结构中都能使用该人源化bcma-scfv。
[0052]
人源化bcma-car能与靶向其他肿瘤抗原或肿瘤微环境例如vegfr-1-3、pdl-1、靶向bcma和cd3或其他抗原的双特异性抗体的car,相结合以用于治疗。
[0053]
人源化bcma-car-t细胞能用于对抗对化疗有抵抗力并形成侵袭性肿瘤的癌症干细胞。
[0054]
以下实施例进一步阐明了本发明。这些实施例仅用于阐明本发明,并且不应被解释为限制性的。
[0055]
实施例
[0056]
本发明人生成了克隆到慢病毒载体的在慢病毒在内ef1启动子下的人源化bcma-scfv-car构建体(car-pmc309)。慢病毒car构建体包含人源化bcma scfv-cd28-cd3ζ,插入在xba i和eco ri克隆位点间。本发明人还用car生成了在mndu3启动子下的bcma-scfv-41bb-cd3构建体(car-pmc750),以实现人源化bcma-car的更高表达(图3)。
[0057]
这些慢病毒生成于293t细胞中,且通过rt-pcr确定了滴度。随后等剂量的慢病毒被用于转导t细胞。
[0058]
实施例1:人源化bcma vh和vl以及scfv序列
[0059]
通过对bcma阳性的杂交瘤克隆进行测序获得bcma的scfv。人源化bcma(pmc309)scfv的结构为:vh-接头-vl。接头是g4s
×
3。
[0060]
人源化bcma(pmc309)scfv蛋白的核苷酸序列如seq id no:4所示。其中粗体突出显示人源化bcma pmc309 scfv克隆的vh的核苷酸序列(seq id no:1);下划线突出显示vl的核苷酸序列(seq id no:2);在中间(斜体)的是编码3xg4s接头3x(ggggs)的核苷酸序列(seq id no:3)。
[0061][0062]
人源化bcma(pmc309)scfv蛋白的氨基酸序列:(seq id no:8)
[0063]
在蛋白中,粗体突出显示vh的氨基酸序列(seq id no:5);下划线突出显示vl的氨基酸序列(seq id no:6);在中间(斜体)的是3
×
g4s接头序列的氨基酸序列(seq id no:7)。
[0064][0065]
实施例2a:人源化bcma-car序列(car-pmc309)
[0066]
人源化(pmc309)bcma-car构建体方案如图3所示,这在整个申请中称为人源化bcma。携带ef1启动子的慢病毒载体用于克隆人源化scfv car序列。
[0067]
以下核苷酸序列示出了cd8信号肽-人源化bcma scfv-cd8铰链-tm28-cd28-cd3ζ。car构建体包括人cd8信号肽、人源化bcma scfv(vh-接头3
×
(g4s)-vl)、cd8铰链、cd28跨膜、共刺激结构域cd28、激活结构域cd3ζ(图3,上侧)。
[0068]
cd8信号肽序列-bcma scfv(vh-接头-vl)-cd8铰链-cd28 tm-cd28-cd3-ζ:
[0069]
《cd8信号肽》
[0070]
atggccttaccagtgaccgccttgctcctgccgctggccttgctgctccacgccgccaggccggctagc
[0071]
《人源化bcma(pmc309)scfv》
[0072]
caggtgcagctggtgcagagcggcgcggaagtgaaaaaaccgggcagcagcgtgaaagtgagctgcaaagcgagcggctatacctttaccagctatgtgatgcattgggtgcgccaggcgccgggccagggcctggaatggatgggctatattattccgtataacgatgcgaccaaatataacgaaaaatttaaaggccgcgtgaccattaccgcggataaaagcaccagcaccgcgtatatggaactgagcagcctgcgcagcgaagataccgcggtgtattattgcgcgcgctataactatgatggctattttgatgtgtggggccagggcaccctggtgaccgtgagcagcggcggcggcggcagcggcggcggcggcagcggcggcggcggcagcgatgtggtgatgacccagagcccggcgtttctgagcgtgaccccgggcgaaaaagtgaccattacctgccgcgcgagccagagcattagcgattatctgcattggtatcagcagaaaccggatcaggcgccgaaactgctgattaaatatgcgagccagagcattagcggcgtgccgagccgctttagcggcagcggcagcggcaccgattttacctttaccattagcagcctggaagcggaagatgcggcgacctattattgccagaacggccatagctttccgccgacctttggcggcggcaccaaagtggaaattaaa
[0073]
qvqlvqsgaevkkpgssvkvsckasgytftsyvmhwvrqapgqglewmgyiipyndatkynekfkgrvtitadkststaymelsslrsedtavyycarynydgyfdvwgqgtlvtvssggggsggggsggggsdvvmtqspaflsvtpgekvtitcrasqsisdylhwyqqkpdqapkllikyasqsisgvpsrfsgsgsgtdftftissleaedaatyycqnghsfpptfgggtkveik
[0074]
《xhoi限制性酶切位点》
[0075]
核苷酸ctcgag
[0076]
氨基酸le
[0077]
《cd8铰链》
[0078]
aagcccaccacgacgccagcgccgcgaccaccaacaccggcgcccaccatcgcgtcgcagcccctgtccctgcgcccagaggcgagccggccagcggcggggggcgcagtgcacacgagggggctggacttcgccagtgataagccc
[0079]
kptttpaprpptpaptiasqplslrpeasrpaaggavhtrgldfasdkp
[0080]
《cd28 tm/共刺激》
[0081]
ttttgggtgctggtggtggttggtggagtcctggcttgctatagcttgctagtaacagtggcctttattattttctgggtgaggagtaagaggagcaggctcctgcacagtgactacatgaacatgactccccgccgccccgggcccacccgcaagcattaccagccctatgccccaccacgcgacttcgcagcctatcgctcc
[0082]
fwvlvvvggvlacysllvtvafiifwvrskrsrllhsdymnmtprrpgptrkhyqpyapprdfaayrs
[0083]
《cd3ζ》
[0084]
agagtgaagttcagcaggagcgcagacgcccccgcgtaccagcagggccagaaccagctctataacgagctcaatctaggacgaagagaggagtacgatgttttggacaagagacgtggccgggaccctgagatggggggaaagccgcagagaaggaagaaccctcaggaaggcctgtacaatgaactgcagaaagataagatggcggaggcctacagtgagattgggatgaaaggcgagcgccggaggggcaaggggcacgatggcctttaccagggtctcagtacagccaccaaggacacctacgacgcccttcacatgcaggccctgccccctcgctaatag
[0085]
rvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkpqrrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr
[0086]
《ecori限制性酶切位点》
[0087]
gaattc
[0088]
人源化bcma-car蛋白的核苷酸和氨基酸序列(car-pmc309构建结构见图3)
[0089]
核苷酸
[0090]
atggccttaccagtgaccgccttgctcctgccgctggccttgctgctccacgccgccaggccggctagccaggtgcagctggtgcagagcggcgcggaagtgaaaaaaccgggcagcagcgtgaaagtgagctgcaaagcgagcggctatacctttaccagctatgtgatgcattgggtgcgccaggcgccgggccagggcctggaatggatgggctatattattccgtataacgatgcgaccaaatataacgaaaaatttaaaggccgcgtgaccattaccgcggataaaagcaccagcaccgcgtatatggaactgagcagcctgcgcagcgaagataccgcggtgtattattgcgcgcgctataactatgatggctattttgatgtgtggggccagggcaccctggtgaccgtgagcagcggcggcggcggcagcggcggcggcggcagcggcggcggcggcagcgatgtggtgatgacccagagcccggcgtttctgagcgtgaccccgggcgaaaaagtgaccattacctgccgcgcgagccagagcattagcgattatctgcattggtatcagcagaaaccggatcaggcgccgaaactgctgattaaatatgcgagccagagcattagcggcgtgccgagccgctttagcggcagcggcagcggcaccgattttacctttaccattagcagcctggaagcggaagatgcggcgacctattattgccagaacggccatagctttccgccgacctttggcggcggcaccaaagtggaaattaaactcgagaagcccaccacgacgccagcgccgcgaccaccaacaccggcgcccaccatcgcgtcgcagcccctgtccctgcgcccagaggcgagccggccagcggcggggggcgcagtgcacacgagggggctggacttcgccagtgataagcccttttgggtgctggtggtggttggtggagtcctggcttgctatagcttgctagtaacagtggcctttattattttctgggtgaggagtaagaggagcaggctcctgcacagtgac
tacatgaacatgactccccgccgccccgggcccacccgcaagcattaccagccctatgccccaccacgcgacttcgcagcctatcgctccagagtgaagttcagcaggagcgcagacgcccccgcgtaccagcagggccagaaccagctctataacgagctcaatctaggacgaagagaggagtacgatgttttggacaagagacgtggccgggaccctgagatggggggaaagccgcagagaaggaagaaccctcaggaaggcctgtacaatgaactgcagaaagataagatggcggaggcctacagtgagattgggatgaaaggcgagcgccggaggggcaaggggcacgatggcctttaccagggtctcagtacagccaccaaggacacctacgacgcccttcacatgcaggccctgccccctcgctaa
[0091]
氨基酸:(seq id no:9)
[0092]
malpvtalllplalllhaarpasqvqlvqsgaevkkpgssvkvsckasgytftsyvmhwvrqapgqglewmgyiipyndatkynekfkgrvtitadkststaymelsslrsedtavyycarynydgyfdvwgqgtlvtvssggggsggggsggggsdvvmtqspafl
[0093]
svtpgekvtitcrasqsisdylhwyqqkpdqapkllikyasqsisgvpsrfsgsgsgtdftftissleaedaatyycqnghsfpptfgggtkveiklekptttpaprpptpaptiasqplslrpeasrpaaggavhtrgldfasdkpfwvlvvvggvlacysllvtvafiifwvrskrsrllhsdymnmtprrpgptrkhyqpyapprdfaayrsrvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkpqrrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr
[0094]
实施例2b:人源化bcma-car序列(car-pmc750)
[0095]
类似实施例2a的方式制备另一种car,除了携带kan抗性基因并以4-1bb结构域作为慢病毒载体的刺激结构域外,包含同样的scfv(图3,下侧,car-pmc750)。
[0096]
hbcma-41bb-cd3 car(car-pmc750)的氨基酸序列如下所示:seq id no:10
[0097]
qvqlvqsgaevkkpgssvkvsckasgytftsyvmhwvrqapgqglewmgyiipyndatkynekfkgrvtitadkststaymelsslrsedtavyycarynydgyfdvwgqgtlvtvssggggsggggsggggsdvvmtqspaflsvtpgekvtitcrasqsisdylhwyqqkpdqapkllikyasqsisgvpsrfsgsgsgtdftftissleaedaatyycqnghsfpptfgggtkveiklekptttpaprpptpaptiasqplslrpeasrpaaggavhtrgldfasdkpfwvlvvvggvlacysllvtvafiifwvkrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkpqrrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr
[0098]
实施例3:人源化bcma-car-t细胞杀伤cho-bcma细胞但不杀伤cho细胞
[0099]
如[6]中所描述,用293s细胞制备慢病毒。我们用人源化bcma-car慢病毒转导t细胞,扩增car-t细胞并表达bcma,利用bcma重组蛋白检测bcma scfv表达(如[6]中所述)。然后,我们将人源化bcma-car-t细胞与cho-bcma靶细胞并且与cho(bcma-阴性)对照细胞分别孵育。人源化bcma-car-t细胞特异性杀伤cho-bcma细胞(图4,上侧),而不杀伤cho细胞(图4,下侧)。这表明人源化bcma-car-t细胞高特异性地靶向bcma抗原并杀伤bcma阳性细胞。
[0100]
图4示出了人源化bcma-car-t细胞杀伤cho-bcma细胞但不杀伤cho细胞。利用xcelligence实时细胞毒性分析检测人源化bcma-car-t细胞的细胞毒性。y轴显示归一化的细胞指数,而x轴显示时间。上侧:cho-bcma靶细胞。下侧:cho靶细胞。右边从上到下是靶细胞、t细胞、模拟car-t细胞和人源化bcma car-t细胞作为效应细胞。
[0101]
实施例4:人源化car-t细胞针对靶cho-bcma细胞分泌显著水平的ifn-γ
[0102]
收集人源化bcma-car-t细胞和靶cho-bcma细胞共培养后的上清液并进行进行ifn-γ分析。bcma-car-t细胞与cho-bcma细胞共培养分泌高水平的ifn-γ(图5),与对照
cho细胞共培养分泌低水平的ifn-γ(图5)。这证实了人源化bcma-car-t细胞的特异性和杀伤细胞毒性分析结果。与针对bcma-阴性k562细胞相比,人源化bcma car-t细胞针对rpmi8226细胞分泌更高水平的ifn-γ(未显示)。
[0103]
图5.人源化bcma-car-t细胞与cho-bcma-阳性细胞分泌高水平的ifn-γ。p《0.05,在cho-bcma细胞与t细胞和模拟car-t细胞相比较ifn-γ的分泌。
[0104]
实施例5.人源化bcma-41bb-cd3 car-t细胞(pmc750)表达高百分比car-阳性细胞,杀伤bcma-阳性靶细胞并分泌高水平的ifn-γ。
[0105]
重新克隆了人源化bcma与4-1bb共刺激结构域和mndu3启动子以提高car-t细胞的持久性。转导后,car-t细胞的bcma scfv阳性细胞百分比高(图6)。我们利用抗小鼠f(ab)2和重组荧光标记bcma蛋白,在扩增后第9天检测到了大于70%的car阳性细胞(图6)。
[0106]
图6.基于抗小鼠f(ab)2mfab和荧光标记bcma蛋白,采用facs分析扩增9天期间的hbcma-car-t(pmc750),显示出高百分比的car阳性细胞。
[0107]
本发明利用pmc750 hbcma-car-t细胞作为效应细胞,cho-bcma细胞作为靶细胞进行细胞毒性分析。hbcma-41bb-cd3 car-t细胞有效地杀伤cho-bcma细胞(图7,上侧),但不杀伤bcma阴性对照cho-cs1细胞(图7,下侧)。
[0108]
图7.rtca(实时细胞毒性分析)证实了pmc750 car-t细胞对cho-bcma细胞的有效且特异性的杀伤作用。上侧:cho-bcma靶细胞;下侧:cho-cs1靶细胞。
[0109]
检测出pmc750 hbcma-car-t对cho和hela的bcma阳性细胞分泌高水平ifn-γ,且高于小鼠bcma-car-t细胞的ifn-γ分泌水平(图8)。
[0110]
图8.人源化bcma pmc750和小鼠bcma pmc447 car-t细胞对cho-bcma和hela-bcma细胞的ifn-γ的分泌水平。
[0111]
实施例6.人源化bcma-car-t细胞显著抑制小鼠体内模型中rpme8226异种移植肿瘤的生长。
[0112]
将多发性骨髓瘤rpmi8226-荧光素酶阳性细胞皮下注射到nsg小鼠(2
×
106细胞/小鼠),在第二天静脉注射人源化bcma-car-t细胞(pmc750)(1
×
107car-t细胞/小鼠)。利用荧光素成像法检测肿瘤的生长(图9,上侧)。人源化bcma-car-t细胞显著抑制小鼠中rpme8226肿瘤的生长,p《0.001(图9,下侧)。研究过程中未发现任何行为或视觉变化。
[0113]
图9.人源化bcma-car-t细胞显著抑制prmi8226异种移植肿瘤的生长。*p《0.001,bcma-car-t细胞(pmc750)与模拟(pbs-对照)比较。
[0114]
参考文献
[0115]
[1]m.v.maus,a.r.haas,g.l.beatty,s.m.albelda,b.l.levine,x.liu,y.zhao,m.kalos,and c.h.june,t cells expressing chimeric antigenreceptors can cause anaphylaxis in humans.cancer immunol res 1(2013)26-31.
[0116]
[2]m.v.maus,s.a.grupp,d.l.porter,and c.h.june,antibody-modified t cells:cars take the front seat for hematologic malignancies.blood 123(2014)2625-35.
[0117]
[3]v.golubovskaya,and l.wu,different subsets of t cells,memory,effector functions,and car-t immunotherapy.cancers(basel)8(2016).
[0118]
[4]s.a.ali,v.shi,i.maric,m.wang,d.f.stroncek,j.j.rose,j.n.brudno,
m.stetler-stevenson,s.a.feldman,b.g.hansen,v.s.fellowes,f.t.hakim,r.e.gress,and j.n.kochenderfer,t cells expressing an anti-b-cell maturation antigen chimeric antigen receptor cause remissions of multiple myeloma.blood 128(2016)1688-700.
[0119]
[5]y.t.tai,and k.c.anderson,targeting b-cell maturation antigen in multiple myeloma.immunotherapy(2015).
[0120]
[6]r.berahovich,h.zhou,s.xu,y.wei,j.guan,j.guan,h.harto,s.fu,k.yang,s.zhu,l.li,l.wu,and v.golubovskaya,car-t cells based on novel bcma monoclonal antibody block multiple myeloma cell growth.cancers(basel)10(2018).
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。