一株具有广谱抗菌活性的放线菌f8及其应用
技术领域
1.本发明涉及微生物领域,特别是一种具有广谱抗菌活性的放线菌f8及其应用。
背景技术:
2.放线菌是一类具有重要应用价值的功能性微生物资源,因其菌落边缘菌丝常呈放线状而得名,放线菌具有合成丰富的生物活性物质能力,可以产生多种类型的抗生素、抑菌剂、抗肿瘤物质等。世界上已发现的天然活性产物中,40%以上是在放线菌中发现的,目前临床和农业上普遍应用的各类抗生素约三分之二是由放线菌生产,其中70%以上由链霉菌产生。
3.湿地兼有水体和陆地的双重特征,是地球上生物多样性最丰富、生产力最高、生态服务价值最大的生态系统,具有稳定环境、保护物种基因等功能,享有“地球之肾”、“生物基因库”的美誉。由于处于陆地和河流交接地带,湿地明显受到河流和陆地环境双重影响,湿地土壤中可能拥有独特的、既不同于陆地也不同于水体环境的放线菌资源,其生境的独特性决定了其中放线菌的多样性及资源的珍稀性。放线菌种类多样性必然导致其产生代谢产物多样性,从而具备合成新颖活性化合物的能力。这些结构新颖、功能多样和具有特殊生理活性的湿地放线菌次级代谢产物的发现和其蕴含的应用价值潜力,为湿地微生物来源的天然产物的开发奠定基础,为湿地微生物资源的高效利用提供科学依据。
技术实现要素:
4.针对上述情况,为解决现有技术之缺陷,本发明之目的就是提供一种具有广谱抗菌活性的放线菌f8及其应用,可有效解决湿地微生物的利用问题。
5.本发明解决的技术方案是,放线菌f8其分类命名为棒状链霉菌(streptomyces amritsarensis),已保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:cgmcc no.22041,保藏日期为2021年3月19日,保藏地址为北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,该菌株的16s rdna基因序列如seq id no1所示。
6.本发明放线菌f8无菌发酵液的制备方法为:按1%的接种量将种子液接种于100ml基础发酵培养基或优化发酵培养基中,35℃,180rpm振荡培养7d得到发酵液,在需要无菌发酵液上清的时候,12000
×
g,25℃离心去除菌体,上清用孔径为0.22μm的滤膜过去去除残余的菌体,即得到含有菌体分泌的活性物质的无菌发酵液上清。
7.所述的基础发酵培养基为:可溶性淀粉20g,kno
3 1g,k2hpo
4 0.5g,mgso4·
7h2o 0.5g,nacl 0.5g,feso4·
7h2o 0.01g,ph7.0,蒸馏水定容至1000ml。
8.所述的优化发酵培养基为:可溶性淀粉20g,花生饼粉50g,nano
3 0.5g,k2hpo
4 0.5g,mgso4·
7h2o 0.5g,nacl 1g,feso4·
7h2o 0.01g,ph7.0,蒸馏水定容至1000ml。
9.所述的具有广谱抗菌活性的放线菌f8在制备感染革兰氏阳性菌金黄色葡萄球菌(staphylococcus aureus)、枯草芽孢杆菌(bacillus subtilis)、解淀粉芽孢杆菌(bacillus amyloliquefaciens)、革兰氏阴性细菌大肠杆菌(escherich coli)以及丝状真
菌灰葡萄孢霉(botrytis cinerea)疾病的药物中的应用。
10.所述的具有广谱抗菌活性的放线菌f8无菌发酵液在制备感染革兰氏阳性菌金黄色葡萄球菌(staphylococcus aureus)、枯草芽孢杆菌(bacillus subtilis)、解淀粉芽孢杆菌(bacillus amyloliquefaciens)、革兰氏阴性细菌大肠杆菌(escherich coli)以及丝状真菌灰葡萄孢霉(botrytis cinerea)疾病的药物中的应用。
11.本发明放线菌f8可用于治疗感染革兰氏阳性菌金黄色葡萄球菌(staphylococcus aureus)、枯草芽孢杆菌(bacillus subtilis)、解淀粉芽孢杆菌(bacillus amyloliquefaciens)、革兰氏阴性细菌大肠杆菌(escherich coli)以及丝状真菌灰葡萄孢霉(botrytis cinerea)类疾病,是棒状链霉菌上的创新。
附图说明
12.图1为本发明f8菌株在高氏一号固体培养基上的菌落形态图。
13.图2为本发明基于16s rdna序列构建的f8菌株的系统进化树图。
14.图3为本发明f8菌株在不同温度下的生长情况图。
15.图4为本发明f8菌株在不同ph值下的生长情况图。
16.图5为本发明f8菌株在不同盐度的生长情况图。
17.图6为本发明f8菌株发酵液对指示菌抑制效果图;图中所示指示菌分别为:a,枯草芽孢杆菌;b,解淀粉芽孢杆菌;c,金黄色葡萄球菌;d,大肠杆菌;e,灰葡萄孢霉。
18.图7为本发明f8菌株发酵液热稳定性实验效果图。
19.图8溶菌酶与蛋白酶k处理后f8菌株发酵液抑菌效果图。
20.图9f8菌株发酵液抑菌效果与菌体生长关系图
21.图10不同浓度葡萄糖对f8菌株发酵液抑菌效果影响图。
22.图11不同浓度淀粉对f8菌株发酵液抑菌效果影响图。
23.图12不同浓度nano3对f8菌株发酵液抑菌效果影响图。
24.图13不同浓度花生饼粉对f8菌株发酵液抑菌效果影响图。
25.图14不同萃取剂对f8菌株发酵液活性产物的萃取效果图。
26.图15乙酸乙酯作为萃取剂不同萃取时间的萃取效果图。
27.图16萃取剂不同用量萃取效果图。
具体实施方式
28.以下结合附图和具体情况对本发明的具体实施方式作进一步详细说明。
29.本发明放线菌f8的来源是从郑州黄河国家湿地公园湿地土壤样品中分离纯化得到的。相关实验资料如下:
30.一、菌株的分离与筛选
31.1)样品的采集与预处理
32.湿地土壤样品采集于郑州黄河国家湿地公园,并及时记录取样的时间、地点及周边环境。将样品于通风避光处阴干21天,然后将其研磨成粉末状,110℃干热处理1-2h;
33.2)湿地土壤放线菌的分离
34.称取干热处理的土壤样品1.0g,加入到9.0ml含1.5%苯酚的无菌生理盐水中,37
℃,150r/min震荡1h后,静置20min取上清液,梯度稀释后取100μl均勾的涂布于含萘啶酮酸(25mg/l)、放线菌酮(50mg/l)与重铬酸钾(25mg/l)的高氏一号固体培养基上,每个梯度设3个重复;放入30℃的培养箱中倒置培养14d~21d;挑取不同形态的菌落到高氏一号固体培养基平板上进行培养,然后将分离的菌落在平板上反复划线纯化,直至得到菌落形态单一的培养物;
35.3)广谱抗菌活性放线菌的筛选
36.采用牛津杯法筛选具有广谱抗菌活性的放线菌,具体步骤如下:以无菌操作在固体培养基(细菌为lb培养基,真菌为pda培养基)表面均匀涂布指示菌金黄色葡萄球菌(staphylococcus aureus)、枯草芽孢杆菌(bacillus subtilis)、解淀粉芽孢杆菌(bacillus amyloliquefaciens)、大肠杆菌(escherich coli)以及丝状真菌灰葡萄孢霉(botrytis cinerea),然后垂直放上3支牛津杯,轻轻加压,使其与培养基接触无空隙,在牛津杯中加入无菌发酵液200μl,勿使其外溢。加满后置37℃(细菌)或28℃(真菌)培养2~3d,观察结果,用游标卡尺测量抑菌圈直径。
37.二、菌株培养
38.高氏一号固体培养基:可溶性淀粉20g,kno
3 1g,k2hpo4 0.5g,mgso4·
7h2o 0.5g,nacl 0.5g,feso4·
7h2o 0.01g,琼脂15g,ph7.2~7.4,蒸馏水定容至1000ml。121℃,高压蒸汽灭菌备用。
39.种子培养基:可溶性淀粉20g,kno
3 1g,k2hpo
4 0.5g,mgso4·
7h2o 0.5g,nacl 0.5g,feso4·
7h2o 0.01g,ph7.2~7.4,蒸馏水定容至1000ml。
40.基础发酵培养基:可溶性淀粉20g,kno
3 1g,k2hpo
4 0.5g,mgso4·
7h2o 0.5g,nacl 0.5g,feso4·
7h2o 0.01g,ph7.0,蒸馏水定容至1000ml。
41.优化发酵培养基:可溶性淀粉20g,花生饼粉50g,nano
3 0.5g,k2hpo
4 0.5g,mgso4·
7h2o0.5g,nacl 1g,feso4·
7h2o 0.01g,ph7.0,蒸馏水定容至1000ml。
42.lb培养基:nac1 10g,蛋白胨10g,酵母提取物5g,琼脂粉15g,ph调至7.0,蒸馏水定容至1000ml。
43.马铃薯葡萄糖琼脂培养基(pda培养基):马铃薯(去皮)切块200g,加水煮烂(煮沸20-30分钟),用八层纱布过滤,葡萄糖20g,琼脂20g,ph值自然,自来水定容至1000ml。
44.以上培养基121℃,高压蒸汽灭菌20min备用。
45.固体平板培养:将菌株划线接种到高氏一号固体培养基上,30℃培养7天至长出孢子。
46.种子液培养:重悬在高氏一号固体培养基上长出的菌株孢子,接种于100ml种子培养基中,30℃,180rpm振荡培养36h得到种子液。
47.菌株发酵培养:按1%的接种量将种子液接种于100ml基础发酵培养基或优化发酵培养基中,35℃,180rpm振荡培养7d得到发酵液,在需要无菌发酵液上清的时候,12000
×
g,25℃离心去除菌体,上清用孔径为0.22μm的滤膜过去去除残余的菌体,即得到含有菌体分泌的活性物质的无菌发酵液上清。
48.三、菌株的鉴定
49.1)形态学特征观察
50.菌株f8在高氏一号固体培养基上3-5天长出白色菌落,产白色的气生菌丝,灰粉色
的孢子丝,培养时间7d后,菌落老化呈黄色,显微镜观察孢子为直链节杆状。
51.2)16s rdna序列测定和系统进化树构建
52.提取菌株f8基因组dna,采用细菌通用引物27f与1492r扩增16srdna并纯化测序,测序结果通过ncbi的blastn程序进行同源性比较,采用mega7.0软件,用nj法建立系统发育树。通过序列分析,发现f8与streptomyces amritsarensis 2a同源性高达99%。结合其形态特征和生理生化特征,初步判定为streptomyces amritsarensis,见图2所示。
53.四、菌株生长条件优化
54.1)f8菌株最适生长温度的优化
55.取100μl种子液涂布高氏一号固体培养基,于4℃、16℃、25℃、30℃、37℃、40℃培养48后,菌落生长状况如图3。
56.由图3可以看出f8菌株在25℃-40℃都可以生长,低于25℃生长缓慢,菌落较少,40℃菌体生长减缓,菌落减少,37℃为最适生长温度。
57.2)f8菌株最适生长ph的优化
58.取1ml种子液接种基础发酵培养基,培养3d后,采用测量菌体干重的方法研究其在ph3-12条件下生长的生长状况(图4)
59.由图4可以看出f8菌株在ph值3.0-12.0都可以生长,6.0-8.0生长状态较好,最适生长ph值为7.0。
60.3)f8菌株最适生长盐度的优化
61.取1ml种子液接种基础发酵培养基,培养3d后,采用测量菌体干重的方法研究其在一系列浓度的nacl溶液的生长状况,如图5所示。
62.结果显示f8菌株在nacl浓度0-2.5%均可生长,但浓度大于2.0%时生长受到明显抑制,最适盐度为nacl浓度1%。
63.五、f8菌株发酵液抑菌效果
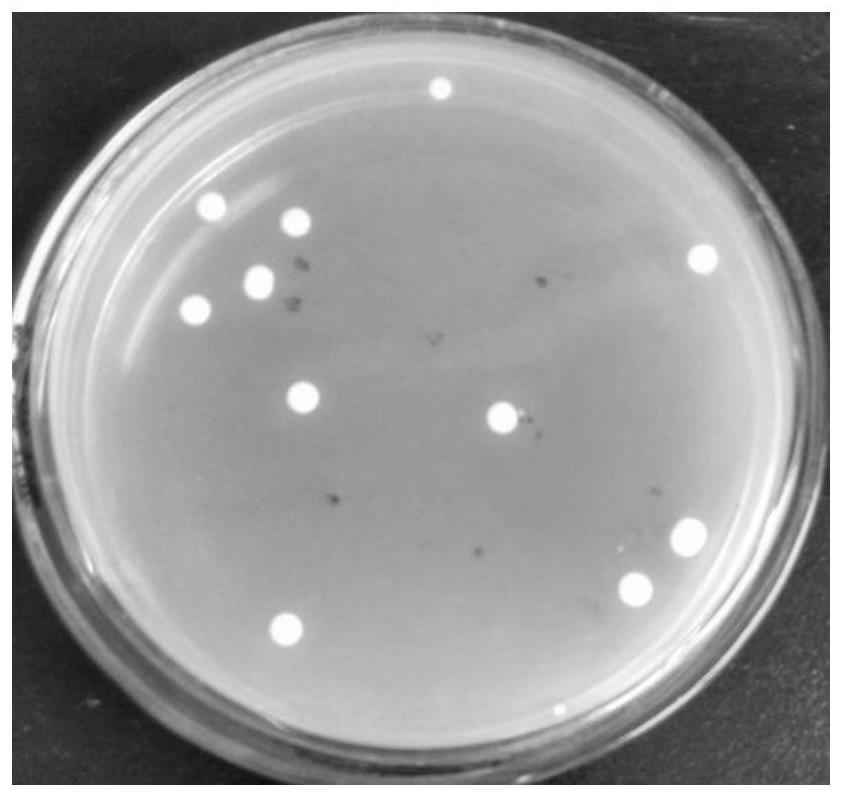
64.采用牛津杯法检测f8发酵液抑菌效果,具体步骤如下:以无菌操作在固体培养基(细菌为lb培养基,真菌为pda培养基)表面均匀涂布指示菌金黄色葡萄球菌(staphylococcus aureus)、枯草芽孢杆菌(bacillus subtilis)、解淀粉芽孢杆菌(bacillus amyloliquefaciens)、大肠杆菌(escherich coli)以及丝状真菌灰葡萄孢霉(botrytis cinerea),然后垂直放上3支牛津杯,轻轻加压,使其与培养基接触无空隙,在牛津杯中加入f8菌株无菌发酵液200μl,勿使其外溢。加满后置37℃(细菌)或28℃(真菌)培养2~3d,观察结果,用游标卡尺抑菌圈直径。可见在牛津杯周围出现了明显的抑菌圈,而且f8的生长量并不大(图6),可见f8在发酵过程中合成了拮抗指示菌的活性物质。
65.六、f8菌株发酵液中活性物质的稳定性
66.1)热稳定性试验:将培养7d后的发酵液分别置于40℃,50℃,60℃,70℃,80℃,90℃下30min,然后以菌枯草芽孢杆菌(bacillus subtilis)为指示菌,利用牛津杯测定抑菌圈的方法测定f8菌株发酵液的抑菌效果,利用spss19.0进行方差分析。测得各个温度下发酵液的抑菌效果差异是不显著的。f8菌株发酵液活性具有很好的温度稳定性,可耐受90℃的高温,如图7所示。
67.2)f8菌株发酵液对溶菌酶及蛋白酶k的稳定性实验
68.将培养7d后的发酵液取2ml分别加入200ug溶菌酶与200ug蛋白酶k,37℃恒温水浴
中保温30min,然后以枯草芽孢杆菌(bacillus subtilis)为指示菌,利用牛津杯测定抑菌圈的方法测定f8菌株发酵液的抑菌效果,利用spss19.0进行方差分析。f8菌株发酵液经溶菌酶及蛋白酶k处理后,抑菌效果变化不显著,说明发酵液活性对溶菌酶以及蛋白酶k稳定,如图8所示。
69.七、f8菌株发酵条件优化
70.1)f8菌株发酵温度优化
71.按1%的接种量接种种子液到基础发酵培养基,比较了30℃,35℃与37℃下发酵液的抑菌效果,35℃培养,发酵液对枯草芽孢杆菌(bacillus subtilis)、解淀粉芽孢杆菌(bacillus amyloliquefaciens)、金黄色葡萄球(staphylococcus aureus)、大肠杆菌(escherich coli)及灰葡萄孢霉(botrytis cinerea)表现出较好的抑制效果,最适发酵温度为35℃(表1)。
72.表1不同发酵温度对f8菌株抑菌效果影响
[0073][0074]
2)f8菌株发酵时间优化
[0075]
按1%的接种量接种种子液到基础发酵培养基,35℃,180r/min振荡培养,分别于0h,3h,6h,9h
……
每隔3h取一次样,采用称重法测定菌体干重,以枯草芽孢杆菌(bacillus subtilis)作为指示菌,利用牛津杯测定抑菌圈的方法测定不同发酵时期f8菌株的抑菌效果,f8菌株发酵液抑菌效果与菌体生长关系如图9所示:抑菌效果在菌体生长的迟缓期及指数期(60h前)的增长比较缓慢,菌体进入稳定期后(70h后),发酵液抑制指示菌的效果逐渐增加,菌体160h后进入衰退期,发酵液抑菌活性的增加液逐渐变缓,因此为了获得较好的抑菌效果,发酵液的收集时间要大于160h,本试验发酵液的收集时间为第七天,也就是发酵168h。
[0076]
3)f8菌株发酵培养基碳源优化
[0077]
实验了蔗糖、葡萄糖、麦芽糖、果糖、乳糖、半乳糖、海藻糖、淀粉作为唯一碳源f8菌株发酵液对指示菌枯草芽孢杆菌(bacillus subtilis)的抑制效果。实验结果显示f8菌株在蔗糖、麦芽糖、果糖、乳糖、半乳糖及海藻糖培养基中既不能很好的生长也不能产生抑菌效果(如图10所示)。葡萄糖及淀粉作为唯一碳源具有一定的抑菌效果,6%淀粉作为唯一碳源效果最好(如图11所示)。
[0078]
4)发酵培养基无机氮源优化
[0079]
研究了nh4no3、nano3、kno3、(nh4)2so4、作为唯一氮源f8菌株发酵液对指示菌枯草芽孢杆菌(bacillus subtilis)的抑制效果。实验结果显示f8菌株在nh4no3、(nh4)2so4培养
基中既不能很好的生长也不能产生抑菌效果。nano3与kno3作为唯一氮源具有一定的抑菌效果,1.5g/l nano3作为唯一氮源效果最好(如图12所示)。
[0080]
5)f8菌株发酵培养基复合氮源优化
[0081]
研究了花生饼粉、玉米粉、麸皮、黄豆粉作为有机氮源f8菌株发酵液对指示菌枯草芽孢杆菌(bacillus subtilis)的抑制效果。实验结果显示f8菌株在麸皮、黄豆粉培养基中既不能很好的生长也不能产生抑菌效果。花生饼粉与玉米粉作为氮源具有一定的抑菌效果,6%的花生饼粉作为氮源效果最好(如图13所示)。
[0082]
6)可溶性淀粉、nano3、花生饼粉复合发酵培养基优化
[0083]
以枯草芽孢杆菌(bacillus subtilis)为指示菌,分别以可溶性淀粉、nano3、花生饼粉作为碳源、无机氮源与复合氮源,利用正交试验进行培养基优化。35℃,180rpm培养7d后采用牛津杯法测量发酵液抑菌效果。
[0084]
表2复合发酵培养基优化结果
[0085][0086]
由表2可以看出,优化培养基中可溶性淀粉、nano3、花生饼粉分别为5%,4%与0.5g/l发酵液抑菌效果最好,抑菌圈直径达到了22.01cm,比基础培养基17.74cm提高了24.%。
[0087]
7)优化发酵培养基发酵液对指示菌抑制效果
[0088]
按1%的接种量将种子液分别接种于100ml的基础发酵培养基与优化发酵培养基,35℃,180rpm振荡培养7d。以无菌操作在固体培养基(细菌为lb,真菌为pda)表面均匀涂布指示菌金枯草芽孢杆菌(bacillus subtilis)、解淀粉芽孢杆菌(bacillus amyloliquefaciens)、金黄色葡萄球(staphylococcus aureus)、大肠杆菌(escherich coli)及灰葡萄孢霉(botrytis cinerea),利用牛津杯法测定发酵液的抑菌效果,结果见表3,与基础发酵培养基相比,优化发酵培养基发酵液对枯草芽孢杆菌(bacillus subtilis)、解淀粉芽孢杆菌(bacillus amyloliquefaciens)、金黄色葡萄球(staphylococcus aureus)、大肠杆菌(escherich coli)及灰葡萄孢霉(botrytis cinerea)的抑菌活性分别提升了28%、24%、18%、30%与19%。
[0089]
表3优化培养基发酵液对指示菌株的抑菌效果
[0090][0091]
八、f8菌株发酵液萃取条件优化
[0092]
1)f8菌株发酵液萃取剂的选择
[0093]
以枯草芽孢杆菌为指示菌,实验了乙酸乙酯,四氯化碳,石油醚,乙醇,正丁醇以及丙酮对发酵液的萃取效果,实验结果如图14所示。结果显示乙酸乙酯,四氯化碳对活性物质的萃取效果较好,石油醚,乙醇,正丁醇以及丙酮萃取活性损失较大,确定最佳萃取试剂为乙酸乙酯。
[0094]
2)乙酸乙酯作为萃取剂萃取时间的选择
[0095]
以枯草芽孢杆菌(bacillus subtilis)为指示菌,实验了10min、20min、30min、40min、50min及60min乙酸乙酯作为萃取剂的萃取效果,结果如图15所示。不同萃取时间萃取效果如图16所示,结果显示萃取30min以上萃取效果差异不显著,因此确定30min为最佳萃取时间。
[0096]
3)萃取剂乙酸乙酯用量的确定
[0097]
以枯草芽孢杆菌(bacillus subtilis)为指示菌,研究了发酵液与萃取剂乙酸乙酯不同比例(1:1、1:2、1:3、1:4、1:5)的萃取效果。结果显示发酵液与萃取剂乙酸乙酯比例为1:3效果最好,萃取剂继续增加差异不显著。
[0098]
本发明放线菌f8分离自郑州黄河国家湿地公园表层土壤,利用风干 干热 苯酚的组合方式进行预处理,萘啶酮酸 放线菌酮 重铬酸钾作为分离抑制剂。其菌落为白色,产白色的气生菌丝,灰粉色的孢子丝,最适生长温度是37℃,最适ph7.0,最适盐度为1%的nacl。通过对放线菌f8进行形态学特征观察、16s rdna序列测定和系统进化分析等多相分类学鉴定,初步鉴定放线菌f8为streptomyces amritsarensis。保藏在中国微生物菌种保藏管理委员会普通微生物中心,cgmmcc号:22041。采用牛津杯法对放线菌f8的抑菌活性进行检测,结果表明其对革兰氏阳性菌金黄色葡萄球菌(staphylococcus aureus)、枯草芽孢杆菌(bacillus subtilis)、解淀粉芽孢杆菌(bacillus amyloliquefaciens)、革兰氏阴性细菌大肠杆菌大肠杆菌(escherich coli)以及丝状真菌灰葡萄孢霉(botrytis cinerea)均具有良好的抑菌效果。其发酵液抑菌效果自发酵70h明显增加,其发酵液对温度、溶菌酶以及蛋白酶具有较好的稳定性。通过发酵条件优化,确定其最适发酵温度为35℃,最适ph为7.0。最适发酵培养基成分为可溶性淀粉20g/l,花生饼粉50g/l,nano
3 0.5g/l,k2hpo
4 0.5g/l,mgso4·
7h2o 0.5g/l,nacl1g/l,feso4·
7h2o 0.01g/l。发酵液最适萃取剂为乙酸乙酯,萃取时间30min,最佳酵液与萃取剂比例为1:3,本发明菌株的发现具有实际的生产意义,适合大范围的推广和应用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。