一种boc-人胰岛素融合蛋白包涵体的高效复性液及其复性方法
技术领域
1.本发明属于生物医药领域,具体涉及一种boc-人胰岛素融合蛋白包涵体的高效复性液及其复性方法。
背景技术:
2.胰岛素是一种两条氨基酸链共有51个氨基酸组成,分别是21个氨基酸的a链和30个氨基酸的b链,由a7-b7和a20-b19之间的两对二硫键连接,另外在a链内还有一个a6-a11的链内二硫键。
3.人胰岛素是一种由51个氨基酸组成的蛋白质类激素,由胰脏内的胰岛细胞分泌。胰岛素参与人体内的糖代谢,从而控制人体内的血糖平衡。1978年,美国的genetech公司首次利用生物重组的方法在大肠杆菌内表达胰岛素。在“胰岛素原”的酶切复性过程中,胰蛋白酶识别胰岛素b29位的赖氨酸,产生大量的b30位苏氨酸消去的胰岛素副产物(desb30-胰岛素)。由于desb30-胰岛素和胰岛素之间只相差一个苏氨酸,他们之间的分离非常的困难,因此,将n-(叔丁氧碳基)-赖氨酸(bock)定点的引入到重组人胰岛素的b29位上产生boc-人胰岛素融合蛋白。
4.目前重组人胰岛素及其类似物的生产采用了两套系统,其一是酵母系统,酵母系统采用了分泌人胰岛素原类似物的方式,分泌出来的人胰岛素前体已经具有天然的二硫键及正确的n-端,但是酵母发酵生产周期长且表达水平很低。其二是采用大肠杆菌系统,但是大肠杆菌表达形成包涵体,链间和链内的二硫键错配导致蛋白无活性,需要进行包涵体的复性过程,形成正确配对的二硫键。
5.现有技术中有关于胰岛素的复性方法,例如在f-j
·
鲁伯洛德c07k14/62,中国专利cn1132845c中公开了获得具有正确键合的胱氨酸键的胰岛素前体的改进的方法,即在半胱氨酸或半胱氨酸盐酸盐和离液助剂存在下,获得到30%~50%的正确复性产物。王骊丽c07k14/62,中国专利cn103172727a中公开了一种高效体积排阻色谱复性同时纯化重组人胰岛素原的方法,尝试该方法在boc-人胰岛素融合蛋白进行复性中,结果显示回收率低。
6.因此,本领域需要开发一种提高复性效率的boc-人胰岛素融合蛋白的复性方法。
技术实现要素:
7.本发明的目在于提供一种提高复性效率的boc-人胰岛素融合蛋白的复性方法。
8.本发明第一方面,提供一种boc-人胰岛素融合蛋白的复性方法,所述的方法包括步骤:
9.(1)将含有boc-人胰岛素融合蛋白的包涵体进行裂解,得到裂解混合液,向所述的裂解混合液中加入变性溶液,得到boc-人胰岛素融合蛋白变性溶液;
10.(2)将所述boc-人胰岛素融合蛋白变性溶液与复性液混合后进行反应,得到复性的boc-人胰岛素融合蛋白。
11.在另一优选例中,所述的包涵体包括表达boc-人胰岛素融合蛋白的重组菌的包涵体。
12.在另一优选例中,所述的重组菌为大肠杆菌。
13.在另一优选例中,所述的包涵体通过以下方法制备,所述方法包括步骤:
14.(i)提供表达boc-人胰岛素融合蛋白的重组菌;
15.(ii)从所述重组菌中分离得到含有boc-人胰岛素融合蛋白的包涵体。
16.在另一优选例中,所述的boc-人胰岛素融合蛋白的氨基酸序列如seq id no.:1所示,且第83位赖氨酸为nε-(叔丁氧羰基)-赖氨酸。
17.在另一优选例中,所述步骤(1)中,所述的裂解是通过加入裂解液进行。
18.在另一优选例中,所述的裂解液包括脲。
19.在另一优选例中,所述的裂解液包括6-10mol/l脲。
20.在另一优选例中,所述的裂解液的的ph为8.0-10.0,较佳地8.5-9.5。
21.在另一优选例中,所述包涵体与所述的裂解液的重量体积比(g/ml)为5-40:200-800,较佳地10-30:300-600,更佳地5-25:350-500。
22.在另一优选例中,所述步骤(1)中,所述裂解的时间为0.5-3h。
23.在另一优选例中,所述步骤(1)中,所述裂解的温度为室温。
24.在另一优选例中,所述步骤(1)中,所述的裂解混合液中,总蛋白浓度为10-30g/l,较佳地15-25g/l。
25.在另一优选例中,所述步骤(1)中,所述的变性溶液包括变性剂。
26.在另一优选例中,所述的变性剂选自下组:二硫苏糖醇、β-巯基乙醇,或其组合。
27.在另一优选例中,所述的β-巯基乙醇的浓度为5-50mmol/l,较佳地20-30mmol/l,更佳地25-35mmol/l。
28.在另一优选例中,所述步骤(1)中,向所述的裂解混合液中加入变性溶液后,调节ph为8.0-11.0,较佳地9-11,更佳地9.5-10.5。
29.在另一优选例中,所述的复性液与所述的boc-人胰岛素融合蛋白变性溶液的体积比为1-10:1,较佳地2-8:1,更佳地3-7:1。
30.在另一优选例中,所述的复性液包括tris、na2co3、甘氨酸、nacl、edta和胱氨酸。
31.在另一优选例中,所述的复性液的溶剂为水。
32.在另一优选例中,所述的胱氨酸为l-胱氨酸或d-胱氨酸。
33.在另一优选例中,所述的tris的浓度为20-80mmol/l,较佳地30-70mmol/l,更佳地40-60mmol/l,最佳地45-55mmol/l。
34.在另一优选例中,所述的na2co3的浓度为1-25mmol/l,较佳地3-20mmol/l,更佳地5-15mmol/l,最佳地8-12mmol/l。
35.在另一优选例中,所述的甘氨酸的浓度为20-80mmol/l,较佳地30-70mmol/l,更佳地40-60mmol/l,最佳地45-55mmol/l。
36.在另一优选例中,所述的nacl的浓度为20-250mmol/l,较佳地50-150mmol/l,较佳地80-120mmol/l,更佳地90-110mmol/l,最佳地95-105mmol/l。
37.在另一优选例中,所述edta的浓度为0.1-5mmol/l,较佳地0.1-2mmol/l,更佳地0.1-1mmol/l,最佳地0.3-0.7mmol/l。
38.在另一优选例中,所述胱氨酸的浓度为0.1-5mmol/l,较佳地0.1-2mmol/l,更佳地0.1-1.5mmol/l,更佳地0.1-1mmol/l,最佳地0.3-0.7mmol/l。
39.在另一优选例中,所述复性液的ph为9.0-12,较佳地10-11,更佳地10.2-10.8,最佳地10.3-10.7。
40.在另一优选例中,用酸或碱调节复性液的ph。
41.在另一优选例中,所述步骤(2)中,所述反应的时间为10-30h,较佳地10-25h,更佳地12-18h。
42.在另一优选例中,所述步骤(2)中,所述反应的温度为0-20℃,较佳地3-15℃,更佳地2-6℃。
43.在另一优选例中,所述步骤(2)中,在反应过程中,以2-100cm3/h,较佳地5-50cm3/h,更佳地10-40cm3/h,更佳地10-30cm3/h,最佳地15-25cm3/h的速率向反应体系中通入气体(如空气)。
44.本发明第二方面,提供一种复性液,所述的复性液包括tris、na2co3、甘氨酸、nacl、edta和胱氨酸。
45.在另一优选例中,所述的复性液如本发明第一方面所述。
46.本发明第三方面,提供一种boc-人胰岛素融合蛋白,所述的boc-人胰岛素融合蛋白具有如seq id no.:1所示的氨基酸序列且第83位赖氨酸为nε-(叔丁氧羰基)-赖氨酸。
47.本发明第四方面,提供一种分离的多核苷酸,其特征在于,所述多核苷酸编码如本发明第三方面所示的boc-人胰岛素融合蛋白。
48.应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
49.图1显示了boc-修饰的人胰岛素融合蛋白表达质粒图谱。
50.图2为复性后的样品hplc图谱图。
51.图3为复性后的样品hplc图谱图。
52.图4显示了复性后的复性液样品的电泳图;泳道1:标准蛋白,从上到下条带分子量依次为100、30、25、20、15、10、5、3.4kd;泳道2:boc-人胰岛素融合蛋白包涵体变性溶解液;泳道3:boc-人胰岛素融合蛋白复性液还原性检测;泳道4:boc-人胰岛素融合蛋白复性液非还原性检测;
53.图5为复性后的样品hplc图谱图。
54.图6为复性后的样品hplc图谱图。
具体实施方式
55.本发明人经过广泛而深入的研究,首次获得了一种新的适用于表达的boc-人胰岛素融合蛋白。本发明的融合蛋白具有折叠正确度、表达率和产率高优势,且本发明的融合蛋白能在商业意义的高浓度下折叠,无需先对重组人胰岛素融合蛋白进行蛋白纯化,直接进行蛋白复性,最终获得具有生物活性的重组人胰岛素融合蛋白。本发明还提供一种boc-人
胰岛素融合蛋白的复性方法和复性液,本发明所述的复性方法和复性液对重组人胰岛素包涵体变性液进行复性后,能够得到高收率的正确折叠的boc-人胰岛素融合蛋白。在此基础上,发明人完成了本发明。
56.术语
57.除非另有定义,否则本文中所用的所有技术和科学术语的含义与本发明所属领域普通技术人员普遍理解的含义相同。
58.如本文所用,术语“包括”、“包含”与“含有”可互换使用,不仅包括开放式定义,还包括半封闭式、和封闭式定义。换言之,所述术语包括了“由
……
构成”、“基本上由
……
构成”。
59.如本文所用,在提到具体列举的数值中使用时,术语“约”意指该值可以从列举的值变动不多于1%。例如,如本文所用,表述“约100”包括99和101和之间的全部值(例如,99.1、99.2、99.3、99.4等)。
60.如本文所用,术语“tris”与“三(羟甲基)氨基甲烷”可互换使用。
61.如本文所用,术语“edta”与“乙二胺四乙酸”可互换使用。
62.除非另有说明,否则本发明的种boc-人胰岛素融合蛋白的氨基酸序列从n端到c端进行编号。
63.如本文所用,术语“boc-赖氨酸”与“叔丁氧羰基-赖氨酸”可互换使用。
64.融合蛋白
65.如本文所用,“本发明融合蛋白”、“重组融合蛋白”、“融合蛋白”、“boc-人胰岛素融合蛋白”、“boc修饰胰岛素融合蛋白”或“胰岛素融合蛋白”均指boc-人胰岛素融合蛋白,所述的boc-人胰岛素融合蛋白具有如seq id no.:1所示的氨基酸序列且第83位赖氨酸为nε-(叔丁氧羰基)-赖氨酸。
66.seq id no.:1所示的氨基酸序列如下:
67.mvskgeelftgvkltlkficttyvqertisfkdtyktraevkfegdenlyfqgrfvnqhlcgshlvealylvcgergffytpktrgiveqcctsicslyqlenycn(seq id no.:1)。
68.本发明所述的boc-人胰岛素融合蛋白经酶切后能够得到具有生物活性的boc-人胰岛素。
69.如本文所用,术语“融合蛋白”还包括具有上述活性的变异形式。这些变异形式包括(但并不限于):1-3个(通常为1-2个,更佳地1个)氨基酸的缺失、插入和/或取代,以及在c末端和/或n末端添加或缺失一个或数个(通常为3个以内,较佳地为2个以内,更佳地为1个以内)氨基酸。例如,在本领域中,用性能相近或相似的氨基酸进行取代时,通常不会改变蛋白质的功能。又比如,在c末端和/或n末端添加或缺失一个或数个氨基酸通常也不会改变蛋白质的结构和功能。此外,所述术语还包括单体和多聚体形式的本发明多肽。该术语还包括线性以及非线性的多肽(如环肽)。
70.本发明还包括上述融合蛋白的活性片段、衍生物和类似物。如本文所用,术语“片段”、“衍生物”和“类似物”是指基本上保持本发明融合蛋白的功能或活性的多肽。本发明的多肽片段、衍生物或类似物可以是(i)有一个或几个保守或非保守性氨基酸残基(优选保守性氨基酸残基)被取代的多肽,或(ii)在一个或多个氨基酸残基中具有取代基团的多肽,或(iii)多肽与另一个化合物(比如延长多肽半衰期的化合物,例如聚乙二醇)融合所形成的
多肽,或(iv)附加的氨基酸序列融合于此多肽序列而形成的多肽(与前导序列、分泌序列或6his等标签序列融合而形成的融合蛋白)。根据本文的教导,这些片段、衍生物和类似物属于本领域熟练技术人员公知的范围。
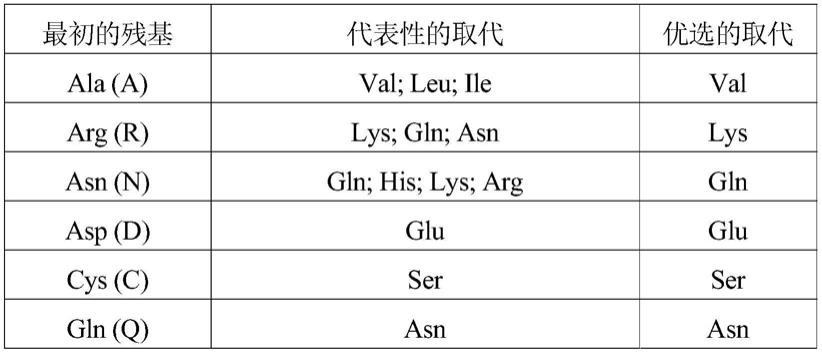
71.一类优选的活性衍生物指与本发明的氨基酸序列相比,有至多3个,较佳地至多2个,更佳地至多1个氨基酸被性质相似或相近的氨基酸所替换而形成多肽。这些保守性变异多肽最好根据表a进行氨基酸替换而产生。
72.表a
[0073][0074][0075]
本发明还提供本发明融合蛋白的类似物。这些类似物与本发明的多肽的差别可以是氨基酸序列上的差异,也可以是不影响序列的修饰形式上的差异,或者兼而有之。类似物还包括具有不同于天然l-氨基酸的残基(如d-氨基酸)的类似物,以及具有非天然存在的或
合成的氨基酸(如β、γ-氨基酸)的类似物。应理解,本发明的多肽并不限于上述例举的代表性的多肽。
[0076]
此外,还可以对本发明融合蛋白进行修饰。修饰(通常不改变一级结构)形式包括:体内或体外的多肽的化学衍生形式如乙酰化或羧基化。修饰还包括糖基化,如那些在多肽的合成和加工中或进一步加工步骤中进行糖基化修饰而产生的多肽。这种修饰可以通过将多肽暴露于进行糖基化的酶(如哺乳动物的糖基化酶或去糖基化酶)而完成。修饰形式还包括具有磷酸化氨基酸残基(如磷酸酪氨酸,磷酸丝氨酸,磷酸苏氨酸)的序列。还包括被修饰从而提高了其抗蛋白水解性能或优化了溶解性能的多肽。
[0077]
术语“编码本发明融合蛋白的多核苷酸”可以是包括编码本发明融合蛋白的多核苷酸,也可以是还包括附加编码和/或非编码序列的多核苷酸。
[0078]
本发明还涉及上述多核苷酸的变异体,其编码与本发明有相同的氨基酸序列的多肽或融合蛋白的片段、类似物和衍生物。这些核苷酸变异体包括取代变异体、缺失变异体和插入变异体。如本领域所知的,等位变异体是一个多核苷酸的替换形式,它可能是一个或多个核苷酸的取代、缺失或插入,但不会从实质上改变其编码的融合蛋白的功能。
[0079]
复性液
[0080]
本发明提供一种复性液,用于对含有boc-人胰岛素融合蛋白的包涵体裂解和变性后的boc-人胰岛素融合蛋白变性溶液进行复性,得到高收率的正确折叠的boc-人胰岛素融合蛋白。在此基础上,发明人完成了本发明。
[0081]
在本发明的一个优选例中,所述的复性液包括(但不限于)tris、na2co3、甘氨酸、nacl、edta和胱氨酸。
[0082]
具体地,所述的复性液如上述本发明第一方面所述。
[0083]
复性方法
[0084]
本发明所述的复性液用于对本发明所述的boc-人胰岛素融合蛋白进行复性处理。
[0085]
典型地,本发明提供一种boc-人胰岛素融合蛋白的复性方法,所述的方法包括步骤:
[0086]
(1)将含有boc-人胰岛素融合蛋白的包涵体进行裂解,得到裂解混合液,向所述的裂解混合液中加入变性溶液,得到boc-人胰岛素融合蛋白变性溶液;
[0087]
(2)将所述boc-人胰岛素融合蛋白变性溶液与复性液混合后进行反应,得到复性的boc-人胰岛素融合蛋白。
[0088]
在本发明的一个优选例中,所述的包涵体包括表达boc-人胰岛素融合蛋白的重组菌的包涵体。
[0089]
在另一优选例中,所述的重组菌为大肠杆菌。
[0090]
在另一优选例中,所述的包涵体通过以下方法制备,所述方法包括步骤:
[0091]
(i)提供表达boc-人胰岛素融合蛋白的重组菌;
[0092]
(ii)从所述重组菌中分离得到含有boc-人胰岛素融合蛋白的包涵体。
[0093]
本发明的主要优点包括
[0094]
1、本发明意外开发了一种能够显著提高复性效率的boc-人胰岛素融合蛋白的复性液和复性方法。
[0095]
2、本发明无需先对重组人胰岛素融合蛋白进行蛋白纯化,直接进行蛋白复性,最
终获得具有生物活性的重组人胰岛素融合蛋白。
[0096]
3、本发明通过对重组人胰岛素包涵体复性工艺的优化,大大提高了复性率至80%-90%,并且易于放大,适合工业化生产。
[0097]
4、本发明蛋白表达促进元件可提高融合蛋白的溶解性并降低融合蛋白的分子间相互作用,从而使融合蛋白能够在具有商业意义的高浓度下折叠。
[0098]
5、制备目的肽过程中无需溴化氰裂解、氧化亚硫酸盐解以及相关纯化步骤。
[0099]
6、制备目的肽过程中无需使用高浓度的硫醇或疏水性吸附树脂。
[0100]
7、使目的肽免受微生物宿主的胞内降解。
[0101]
8、本发明融合蛋白可促进目的肽的表达,目的肽的表达水平和产率显著提高。
[0102]
9、本发明融合蛋白非常适合表达带有非天然氨基酸目的肽,可明显促进带有非天然氨基酸目的肽的折叠。
[0103]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
[0104]
实施例1
[0105]
1.构建重组人胰岛素表达载体,构建方法参照本领域的现有技术,具体地可以参照专利申请号201910210102.9中实施例的记载。将融合蛋白fp-tev-r-miniins的dna片段,克隆至表达载体质粒pbad/his a(购自ntcc公司,卡那霉素抗性)的arabad启动子下游ncoi-xhoi位点,得到质粒pbad-fp-tev-r-miniins。质粒图谱如图1所示。
[0106]
再将pylrs的dna序列,克隆至表达载体质粒pevol-pbpf(购自ntcc公司,氯霉素抗性)的arabad启动子下游spei-sali位点,同时在prok启动子下游,以pcr方法插入赖氨酰-trna合成酶的trna(pyltcua)的dna序列。该质粒命名为pevol-pylrs-pylt。
[0107]
将质粒pbad-fp-tev-r-miniins和质粒pevol-pylrs-pylt转化大肠杆菌菌株,筛选获得表达boc-人胰岛素融合蛋白的重组大肠杆菌菌株。其中,boc-人胰岛素融合蛋白的氨基酸序列如seq id no.:1所示:
[0108]
mvskgeelftgvkltlkficttyvqertisfkdtyktraevkfegdenlyfqgrfvnqhlcgshlvealylvcgergffytpktrgiveqcctsicslyqlenycn(seq id no.:1)。其中第83位赖氨酸为nε-(叔丁氧羰基)-赖氨酸。
[0109]
2.配制种子液培养基,接种,经过两级培养制得二级种子液,培养20h,od600达到180左右,发酵结束,得到约3l发酵液,离心得到约130g/l的湿菌体。发酵液离心后,加入破碎缓冲液,利用高压均质机破菌两次,离心后加入一定浓度吐温80和edta-2na等洗涤,接着水洗一次,离心收集沉淀得到包涵体。每升发酵液最终可获得约43g湿重包涵体。
[0110]
3.为了使融合蛋白重折叠,将包涵体溶解于ph 9.0-11.0并含有10~30mmol/l巯基乙醇的8mol/l脲溶液中,使溶解后总蛋白的浓度为10~30mg/ml。将样品稀释5~10倍,在4~8℃,ph为10.5~11.8的条件下进行常规折叠16~30小时。室温下,维持ph为8.0~9.5,用胰蛋白酶和羧肽酶b酶切融合蛋白10~20小时。反相hplc分析结果表明,复性及酶解步骤的总收率高于75%。胰蛋白酶与羧肽酶b酶解后获得的胰岛素类似物被命名为boc-人胰岛素。通过膜过滤澄清样品,阴离子交换层析初纯化boc-人胰岛素,sds-聚丙烯酰胺凝胶电泳纯度达90%。每1升发酵液最终得到的boc-人胰岛素的产量约为2.1g。并且对获得的boc-人
胰岛素进行maldi-tof质谱分析,结果检测出其分子量与理论分子量5907.7da相符合。经离子交换层析洗脱收集样品,加入盐酸进行boc-人胰岛素脱保护反应,加入氢氧化钠溶液控制ph为2.0~3.2以终止反应,再经两步高压反相层析,纯化后重组人胰岛素的收率高于75%,最终每1升发酵液最终得到的重组人胰岛素的产量约为1100mg。
[0111]
实施例2
[0112]
本实施例考察不同的复性方法对实施例1的boc修饰的重组人胰岛素融合蛋白包涵体进行复性,所述的方法如下:
[0113]
室温下,将20克boc-人胰岛素融合蛋白包涵体溶解于500ml含有8mol/l脲、ph 9.0的包涵体溶解溶液中,室温搅拌0.5-3h,使总蛋白浓度约为10g/l;再加入终浓度为20mmol/lβ-巯基乙醇,调节ph值为9.0,获得boc-人胰岛素融合蛋白变性溶液。
[0114]
将boc-人胰岛素融合蛋白变性溶液加入至5000ml的复性液中,复性液中含有终浓度为50mmol/l tris、10mmol/l na2co3,50mmol/l甘氨酸,100mmol/l nacl,0.5mmol/l乙二胺四乙酸(edta),0.5mmol/l l-胱氨酸,调节ph 10.0。以20cm3/h的速率向复性液中持续通入空气,4℃搅拌反应16小时后停止该反应。
[0115]
取复性液经hplc分析检测,复性后的样品hplc图谱见图2,正确折叠复性的boc-人胰岛素融合蛋白hplc图谱的保留时间为5.733min,根据boc-人胰岛素融合蛋白的峰面积归一化法计算复性后实际得到正确折叠复性的boc-人胰岛素融合蛋白的量为2.43g,boc-人胰岛素融合蛋白复性的收率经计算约为81%。
[0116]
实施例3
[0117]
本实施例考察不同的复性方法对实施例1的boc修饰的重组人胰岛素融合蛋白包涵体进行复性,所述的方法如下:
[0118]
室温下,将20克boc-人胰岛素融合蛋白包涵体溶解于350ml含有8mol/l脲、ph 9.0的包涵体溶解溶液中,室温搅拌0.5-3h,使总蛋白浓度约为20g/l;再加入终浓度为30mmol/lβ-巯基乙醇,调节ph值为10.0,获得boc-人胰岛素融合蛋白变性溶液。
[0119]
将boc-人胰岛素融合蛋白变性溶液加入至1750ml的复性液中,复性液中含有终浓度为50mmol/l tris、10mmol/l na2co3,50mmol/l甘氨酸,100mmol/l nacl,0.5mmol/l edta,0.5mmol/l l-胱氨酸,调节ph 10.5。以20cm3/h的速率向复性液中持续通入空气,4℃搅拌反应16小时后停止该反应。
[0120]
取复性液经hplc分析检测,复性后的复性液样品hplc图谱见图3,sds-page电泳图如图4所示。从图3-4中可以看出,正确折叠复性的boc-人胰岛素融合蛋白hplc图谱的保留时间为5.749min,根据boc-人胰岛素融合蛋白的峰面积归一化法计算复性后实际得到正确折叠复性的boc-人胰岛素融合蛋白的量为2.55g,boc-人胰岛素融合蛋白复性的收率经计算约为85%。
[0121]
对保留时间为5.749min出峰时间的胰岛素融合蛋白经过羧肽酶和胰蛋白酶的酶切,可获得boc-人胰岛素,并且对获得的boc-人胰岛素进行maldi-tof质谱分析,结果检测出其分子量与理论分子量5907.7da相符合。
[0122]
实施例4
[0123]
本实施例考察不同的复性方法对实施例1的boc修饰的重组人胰岛素融合蛋白包涵体进行复性,所述的方法如下:
[0124]
室温下,将20克boc-人胰岛素融合蛋白包涵体溶解于350ml含有8mol/l脲、ph 9.0的包涵体溶解溶液中,室温搅拌0.5-3h,使总蛋白浓度约为10g/l;再加入终浓度为20mmol/lβ-巯基乙醇,调节ph值为10.0,获得boc-人胰岛素融合蛋白变性溶液。
[0125]
将boc-人胰岛素融合蛋白变性溶液加入至5000ml的复性液中,复性液中含有终浓度为50mmol/l tris、10mmol/l na2co3,50mmol/l甘氨酸,100mmol/l nacl,0.5mmol/l edta,2.0mmol/l l-胱氨酸,调节ph 10.5。以20cm3/h的速率向复性液中持续通入空气,4℃搅拌反应16小时后停止该反应。
[0126]
取复性液经hplc分析检测,复性后的样品hplc图谱见图5,正确折叠复性的boc-人胰岛素融合蛋白hplc图谱的保留时间为5.802min,根据boc-人胰岛素融合蛋白的峰面积归一化法计算复性后实际得到正确折叠复性的boc-人胰岛素融合蛋白的量为2.34g,boc-人胰岛素融合蛋白复性的收率经计算约为78%。
[0127]
实施例5
[0128]
本实施例考察不同的复性方法对实施例1的boc修饰的重组人胰岛素融合蛋白包涵体进行复性,所述的方法如下:
[0129]
室温下,将20克boc-人胰岛素融合蛋白包涵体溶解于500ml含有8mol/l脲、ph 9.0的包涵体溶解溶液中,室温搅拌0.5-3h,使总蛋白浓度约为10g/l;再加入终浓度为20mmol/lβ-巯基乙醇,调节ph值为10.0,获得boc-人胰岛素融合蛋白变性溶液。
[0130]
将boc-人胰岛素融合蛋白变性溶液加入至5000ml的复性液中,复性液中含有终浓度为50mmol/l tris、10mmol/l na2co3,50mmol/l甘氨酸,100mmol/l nacl,0.5mmol/l edta,0.5mmol/l l-胱氨酸,调节ph 10.0。不通空气,4℃搅拌反应16小时后停止该反应。
[0131]
取复性液经hplc分析检测,复性后的样品hplc图谱见图6,正确折叠复性的boc-人胰岛素融合蛋白hplc图谱的保留时间为5.810min,根据boc-人胰岛素融合蛋白的峰面积归一化法计算复性后实际得到正确折叠复性的boc-人胰岛素融合蛋白的量为2.16g,boc-人胰岛素融合蛋白复性的收率经计算约为72%。
[0132]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。