一种抗病毒特异性t细胞的制备方法
技术领域
1.本发明属于细胞培养技术领域,具体涉及一种抗病毒特异性t细胞的培养方法。
背景技术:
2.病毒是一种个体微小,结构简单,只含一种核酸(dna或rna),必须在活细胞内寄生并以复制方式增殖的非细胞型生物。病毒感染人类会引起多种健康问题,病毒感染一般症状主要有发热、头痛、咳嗽等全身中毒症状及病毒寄主和侵袭组织器官导致炎症损伤而引起的局部症状(腹泻、皮疹、肝脏功能损伤等)。根据病毒的不同产生症状不同,有些病毒还会使心肌受到损伤,引起病毒性心肌炎。
3.抗病毒免疫就是机体针对病毒的免疫。包含细胞免疫、体液免疫等机体免疫模式。能够有效的对抗、遏制、消除病毒对机体的感染和破坏。是机体适应自然环境的重要保证。抗病毒特异性t细胞通过细胞免疫完成对病毒的清除作用。
4.抗病毒特异性t淋巴细胞是t细胞的一个亚群,经抗原刺激和细胞因子的辅助下增殖分化,活化成为具有特异杀伤活性的t细胞。目前的抗病毒治疗中,可以通过向病毒感染患者转输具有抗病毒活性的免疫细胞,直接清除病毒或激发机体免疫反应来清除病毒,达到治疗目的。而实现该种疗法的前提是体外培养获得大量抗病毒特异性t细胞。
5.特异性t细胞的培养基成分对培养效果的影响目前还有待深入研究。
6.中国专利201810955224.6中公开了一种免疫细胞培养基及其应用,对无水氯化钙等多种无机盐、l-亮氨酸等多种氨基酸、白介素2、白介素4等组分对免疫细胞培养的影响进行了探索。但该发明提供的培养基成分种类复杂多变,成分浓度范围较大,无法确定最佳培养效果的培养基的具体成分浓度,在培养的选择中带来了较大难度。
7.一般特异性t细胞或免疫细胞培养基中的氯化钾常规浓度较低(中国专利201810955224.6:310.5mg/l~311.3mg/l;中国专利201711319524.7:10-1000mg/l;中国专利201711321217.2:10-1000mg/l;中国专利201710797665.3:250-500mg/l),本领域常规使用的最高氯化钾浓度为1g/l,本发明通过优化培养基中氯化钾的浓度提高了细胞培养终产物中抗病毒特异性t细胞的比例。
技术实现要素:
8.本发明提供了一种用于培养抗病毒特异性t细胞的培养基和培养方法。常规抗病毒特异性t细胞的培养基中氯化钾含量最高为1g/l,本发明意外发现了含高浓度氯化钾的培养基所培养的细胞产物中,抗病毒特异性细胞比例更高。
9.一方面,本发明提供了一种用于抗病毒特异性t细胞培养的培养基。
10.所述的抗病毒特异性t细胞培养基中包括氯化钾的浓度为》1g/l并≦4g/l。
11.优选地,所述的抗病毒特异性t细胞培养基中包括浓度为2g/l的氯化钾。
12.所述的抗病毒特异性t细胞培养基的类型包括但不限于无血清培养基;所述的培养基包括但不限于kbm581培养基、gt-t551培养基、x-vivo培养基、gt-t505培养基、
stemxvivo培养基、texmacs gmp培养基、ex-cell培养基、immunocult培养基或alys505n-0培养基。
13.所述的培养基的成分包括但不限于:无水氯化钙、硫辛酸、丙酮酸钠、氯化镁、维生素、乙醇胺、氯化钠、烟酰胺、氨基酸、抗生素。
14.在一些实施例中,所述的培养基为添加有2g/l的氯化钾的x-vivo培养基。
15.在一些实施例中,所述的培养基为添加有2g/l的氯化钾的gt-t551培养基。
16.在一些实施例中,所述的培养基为添加有2g/l的氯化钾的alys505n-0培养基。
17.所述的培养基可以培养包括但不限于抗巨细胞病毒特异性t细胞、抗肝炎病毒特异性t细胞、抗麻风病毒特异性t细胞、抗eb病毒特异性t细胞、抗多瘤病毒特异性t细胞,抗人乳头瘤病毒特异性t细胞、抗疱疹病毒特异性t细胞。
18.优选地,所述的培养基中还包括人il-2;所述的人il-2的终浓度为0.1
×
10
6-7
×
106u/l,优选为1
×
106u/l。
19.另一方面,本发明提供了一种抗病毒特异性t细胞的培养方法。
20.所述的抗病毒特异性t细胞的培养方法包括以下步骤:
21.(1)取血:取病毒检测阳性患者外周血;
22.(2)分离:将步骤(1)外周血采用ficoll密度梯度法得到单个核细胞;
23.(3)培养液重悬:添加有1-4g/l的氯化钾无血清培养液重悬步骤(2)得到的单个核细胞;
24.(4)培养:重悬后的单个核细胞种入纤连蛋白和抗人cd3抗体共同处理后的预包被培养瓶进行扩增,得到抗病毒特异性t细胞的产品。
25.所述的步骤(1)中的病毒检测阳性患者可以是巨细胞病毒、肝炎病毒、麻风病毒、eb病毒检测阳性的患者。
26.所述的步骤(2)还包括细胞分选步骤,所述的细胞分选步骤如下:
27.将得到的单个核细胞先与igg4亚型的抗人pd-1抗体共孵育,然后与生物素化的抗人igg4抗体共孵育,再加入抗生物素抗体包被的磁珠共孵育,磁力分离得到pd-1阳性的单个核细胞。
28.优选地,所述的细胞分选步骤如下:
29.将得到的单个核细胞先与抗人pd-1抗体(igg4亚型)在4℃下共孵育10min,然后与生物素化的抗人igg4抗体在25℃下共孵育15min,再加入抗生物素抗体包被的磁珠在4℃下共孵育10min,磁力分离得到pd-1阳性的单个核细胞。
30.所述的步骤(3)中无血清培养基中氯化钾的浓度优选为2g/l。
31.优选地,所述的步骤(3)的无血培养基中添加人il-2;所述的人il-2终浓度为0.1
×
10
6-7
×
106u/l,优选为1
×
106u/l。
32.优选地,所述的步骤(4)中预包被培养瓶中纤连蛋白为0.5-10μg/ml,抗人cd3抗体为0.1-4μg/ml。
33.进一步优选地,所述的步骤(4)中预包被培养瓶中纤连蛋白为6μg/ml,抗人cd3抗体为1.5μg/ml。
34.优选地,所述的步骤(4)培养过程中隔天进行半量换液,4天后更换新的培养瓶。
35.优选地,所述的步骤(4)的培养时间为10天。
36.在一些实施例中,所述的培养方法还包括检测步骤,以确定终培养物中抗病毒特异性t细胞的比例。
37.再一方面,本发明还提供了一种包含抗病毒特异性t细胞的产品。
38.所述的产品中包含前述培养方法得到的抗病毒特异性t细胞终产物。
39.所述的产品类型包括但不限于药物和疫苗。
40.相对于目前已公开的特异性t细胞的培养方法,本发明提供的培养方法,操作简单,成本低,且最终的细胞产品含有的抗病毒特异性细胞比例更高,具有很好的工业应用前景。
附图说明
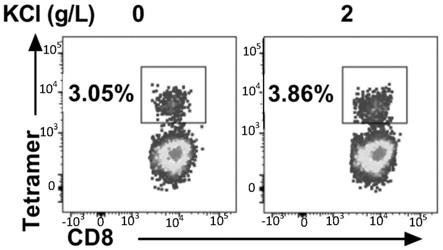
41.图1为含不同浓度氯化钾的培养基培养条件下,最终培养物中抗巨细胞病毒特异性t细胞含量流式检测结果。根据该图,可以判断各实验组组特异性t细胞含量(百分数)。
42.图2为含不同浓度氯化钾的培养基培养条件下,pd-1阳性t细胞亚群中抗巨细胞病毒特异性t细胞比例的流式检测结果。根据该图,可以判断各实验组组特异性t细胞含量(百分数)。
具体实施方式
43.下面结合具体实施例,对本发明作进一步详细的阐述,下述实施例不用于限制本发明,仅用于说明本发明。以下实施例中所使用的实验方法如无特殊说明,实施例中未注明具体条件的实验方法,通常按照常规条件,下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。
44.实施例1高浓度氯化钾对抗巨细胞病毒特异性t细胞比例的影响
45.(1)取hla-a*02:01基因筛查结果为阳性且巨细胞病毒阳性患者外周血,本实施例中共涉及1个患者,患者为造血干细胞移植后巨细胞病毒阳性患者,选自河南省肿瘤医院,本次实验已获得患者许可。
46.(2)将步骤(1)外周血采用ficoll密度梯度法得到单个核细胞。
47.(3)将步骤(2)分离得到的单个核细胞分为五组,五组细胞分别用以下培养液重悬:
48.①
不添加氯化钾无血清培养液(0g/l),添加人il-2(终浓度为106u/l);
49.②
添加有1g/l的氯化钾无血清培养液,添加人il-2(终浓度为106u/l);
50.③
添加有2g/l的氯化钾无血清培养液,添加人il-2(终浓度为106u/l);
51.④
添加有3g/l的氯化钾无血清培养液,添加人il-2(终浓度为106u/l);
52.⑤
添加有4g/l的氯化钾无血清培养液,添加人il-2(终浓度为106u/l)。
53.其中无血清培养液购自lonza公司。
54.重悬后的单个核细胞分别种入6μg/ml纤连蛋白和1.5μg/ml抗人cd3抗体处理后的预包被培养瓶进行扩增,所有细胞隔天进行半量换液,4天后更换新的培养瓶,10天后得到包含抗巨细胞病毒特异性t细胞的产品。
55.(4)将步骤(3)得到的细胞利用流式细胞仪检测其中所含抗巨细胞病毒特异性t细胞比例。具体方法为:分别从各组细胞中取106细胞,经磷酸盐缓冲液洗2遍后,添加10μl的
荧光四聚体(hla-a*02:01pp65(nlvpmvatv)购自mbl公司)室温孵育30分钟。之后添加抗人cd8荧光抗体和抗人cd3荧光抗体的混合物5μl并继续孵育20分钟。孵育结束后用磷酸盐缓冲液洗1遍后,用含有0.5%多聚甲醛的磷酸盐缓冲液重悬,4℃孵育1个小时后流式细胞仪检测。
56.结果如图1所示,结果表明添加高浓度(1-3g/l)的氯化钾的培养基培养的细胞中针对人巨细胞病毒抗原pp65(nlvpmvatv)的特异性t细胞含量较不添加高浓度氯化钾的培养组高。然而,添加更高浓度的氯化钾(4g/l)会导致上述特异性t细胞比例降低。
57.实施例2高浓度氯化钾对pd-1阳性t细胞亚群中抗病毒特异性t细胞比例的影响
58.(1)取hla-a*02:01基因筛查结果阳性且巨细胞病毒阳性患者外周血,本实施例中共涉及1个患者,患者为造血干细胞移植后巨细胞病毒阳性患者,选自河南省肿瘤医院,本次实验已获得患者许可。
59.(2)将步骤(1)外周血采用ficoll密度梯度法得到单个核细胞。
60.(3)将步骤(2)得到的单个核细胞先与抗人pd-1抗体(igg4亚型)在4℃下共孵育10min,然后与生物素化的抗人igg4抗体在25℃下共孵育15min,再加入抗生物素抗体包被的磁珠在4℃下共孵育10min,磁力分离得到pd-1阳性的单个核细胞。
61.(4)将步骤(2)得到的pd-1阳性单个核细胞为两组,分别用以下培养液重悬:
62.①
不添加氯化钾无血清培养液(0g/l),添加人il-2(终浓度为106u/l);
63.②
添加有2g/l的氯化钾无血清培养液,添加人il-2(终浓度为106u/l)其中无血清培养液购自lonza公司。
64.重悬后的单个核细胞分别种入6μg/ml纤连蛋白和1.5μg/ml抗人cd3抗体处理后的预包被培养瓶进行扩增,所有细胞隔天进行半量换液,4天后更换新的培养瓶,10天后得到包含抗巨细胞病毒特异性t细胞的产品。
65.(5)按实施例1中的步骤(4)检测抗巨细胞病毒特异性t细胞的比例。
66.相关实验结果如图2所示,表明添加高浓度(2g/l)的氯化钾的培养基培养的细胞中针对人巨细胞病毒抗原pp65(nlvpmvatv)的特异性t细胞含量较不添加高浓度氯化钾的培养组高。
67.实施例3高浓度氯化钾对抗eb病毒特异性t细胞比例的影响
68.(1)取hla-a*02:01基因筛查结果阳性且eb病毒阳性患者外周血,本实施例中共涉及5个患者,选自河南省肿瘤医院,本次实验已获得患者许可。
69.(2)将步骤(1)外周血采用ficoll密度梯度法得到单个核细胞。
70.(3)将步骤(2)分离得到的单个核细胞分为五组,五组细胞分别用以下培养液重悬:
71.①
不添加氯化钾无血清培养液(0g/l),添加人il-2(终浓度为106u/l);
72.②
添加有1g/l的氯化钾无血清培养液,添加人il-2(终浓度为106u/l);
73.③
添加有2g/l的氯化钾无血清培养液,添加人il-2(终浓度为106u/l);
74.④
添加有3g/l的氯化钾无血清培养液,添加人il-2(终浓度为106u/l);
75.⑤
添加有4g/l的氯化钾无血清培养液,添加人il-2(终浓度为106u/l)。
76.其中无血清培养液购自lonza公司。
77.重悬后的单个核细胞分别种入6μg/ml纤连蛋白和1.5μg/ml抗人cd3抗体处理后的
预包被培养瓶进行扩增,所有细胞隔天进行半量换液,4天后更换新的培养瓶,10天后得到包含抗eb病毒特异性t细胞的产品。
78.(4)将步骤(3)得到的细胞利用流式细胞仪检测其中所含抗eb特异性t细胞比例。
79.结果表明添加高浓度(1-3g/l)的氯化钾的培养基培养的细胞中针对eb病毒抗原特异性t细胞含量较不添加高浓度氯化钾的培养组高。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。