1.本发明涉及中药制剂制备领域,具体涉及一种开心散缓释片及其制备方法。
背景技术:
2.开心散最早出现于唐代孙思邈的《备急千金要方》而后记载于《世医得效方》中,由菖蒲、远志、茯苓、人参、辰砂几味药材组成;主治“主心气不定,五脏不足,甚者忧愁悲伤不乐,忽忽喜忘,朝瘥暮剧,狂眩方”,是治疗中医情志病的经典药方,并且也是中医临床治疗抑郁的基础方之一。现如今主要用于治疗神志不宁,心气不足、健忘失眠、心怯怔忡等病症,即西医范畴的抑郁、焦虑症状、学习记忆障碍等,可见开心散主要用于精神性疾病的治疗。
3.缓控释剂,可以在预订时间内进行药物释放,使得使血药浓度长期恒定在有效浓度范围;相较于普通制剂相比,缓控释剂在体内保持较长时间的有效治疗浓度,大大减少了给药次数,方便了患者服药,且缓控释剂的相对生物利用度一般处于80%~120%,减少了血药浓度的峰谷效应,降低了药物的毒副作用,提高疗效。口服中药缓控释剂给药系统可分为膜控型、骨架型、胃滞留型、渗透泵型等,其中以膜控型和骨架型最为常见,由于中药不同于结构清楚、成分单一、作用靶点明确的化学药品,加之中药缓控试剂的理论研究起步相对较晚,未形成一套完整的理论体系,以至于化学药缓控试剂理论技术并不能完全适用于中药。
4.对于中药本身,由于药材中所含成分过多,副作用也再所难免;中药中常见的剂型除散剂外,其他剂型也在快速发展,针对慢性病治疗的药物缓控释剂具有良好的发展前景,然而,由于中药及其复方联合用药具有成分多、药物靶点多、使用途径、作用多的特点,中药缓控释剂的研究起步相对较晚,就目前为止研究未成体系。
技术实现要素:
5.为解决上述问题,本发明提供了一种开心散缓释片及其制备方法。
6.为实现上述目的,本发明采取的技术方案为:一种开心散缓释片,由以下组分制备所得:人参皂苷提取物30mg;远志提取物30mg;菖蒲提取物30mg;茯苓提取物60mg;致孔剂peg4000142.5mg;填充剂乳糖142.5mg;硬脂酸镁2.5mg;润湿剂水12.5ml;润滑剂2.5mg。
7.本发明还提供了一种开心散缓释片的制备方法,包括如下步骤:取人参皂苷提取物30mg、远志提取物30mg、菖蒲提取物30mg、茯苓提取物60mg、致孔剂peg4000142.5mg、填充剂乳糖142.5mg、硬脂酸镁2.5mg、润湿剂水12.5ml制软材,至“手握成团,轻压即散”的效果,过20目筛后,置于60℃恒温烘干箱中烘干2h,取出,整粒后,与2.5mg的润滑剂混合均匀,过50目筛后,用10mm的浅凹冲模压片机中压片,即得。
8.本发明实现了开心散缓释片的成功制备,所得的开心散缓释片符合《中国药典》(2020版)的标准,在可以减少给药次数从而减少副作用的同时,增加药效时长达到长期治疗目的。
附图说明
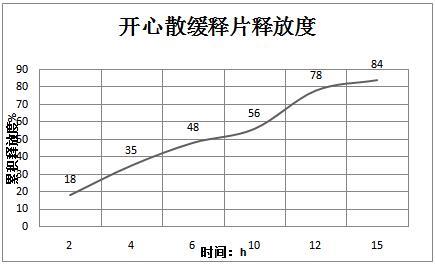
9.图1为四种辅料的在不同处方的用量均值分布图;图2为本发明实施例的开心散缓释制剂的释放度。
具体实施方式
10.为了使本发明的目的及优点更加清楚明白,以下结合实施例对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
11.原料的处理:人参皂苷提取及分离:将人参500g,用粉碎机粉成粗粉,过60目,索氏提取器,加10倍量乙醚回流脱脂至无色,残渣加甲醇加热回流提取只三氯化锑氯仿饱和溶液反应呈阴性,减压回收甲醇,得浸膏,用10倍量蒸馏水溶解,用水饱和度正丁醇萃取6次,合并,减压回收正丁醇,蒸干。用大孔数值柱色谱法分离皂苷,用水溶解皂苷粗品,加样于处理好的d101型大孔树脂上,吸附1小时,用三倍柱提及蒸馏水洗脱除杂质,继用60%已缓存洗脱只三氯化锑氯仿饱和溶液反应呈阴性,减压回收溶剂,减压60℃下真空干燥,得精致皂苷。
12.远志-石菖蒲皂苷提取:将石菖蒲、远志各500g,杂质去除,分别粉碎过50 目筛,取过筛后的远志、石菖蒲粉末,用无水乙醇,16∶1 的液料比,超声提取时间为 60 min,提取温度为50 ℃ ,烘干。
13.茯苓多糖提取:取茯苓500g,用粉碎机粉成粗粉,过60目,水提醇沉法提取,料液比为 1 ∶10,提取时间为 100min,提取 1 次;提取液浓缩至原体积的 1 /12,醇沉浓度为 80% ,醇沉时间为 12 h。
14.开心散缓释片处方设计1.3单因素考察开心散缓释片的辅料将上述提取制备好的中药提取物按照:人参:远志:菖蒲:茯苓=1:1:1:2的比例混合均匀。
15.开心散缓释片的制备称取60片(每片500mg重的上述比例的中药提取物,缓释骨架材料和致孔剂,加适量的润湿剂制软材,即“手握成团,轻压即散”效果后,过20目筛,将过筛后的颗粒放入60℃恒温烘干箱中烘干2h,取出烘干好的颗粒剂整粒后称取60片重的润滑剂混合均匀,过50目筛。将总混后的颗粒剂用10mm的浅凹冲模压片机中压片。
16.缓释骨架种类的选择取6个托盘,编号1、2、3、4、5、6分别加入比例为12%,25%,43%的hpmck100m和ec,制
软材使粉末手握成团,轻压即散,过20目筛,在恒温干燥箱60℃下干燥2h整粒,加入0.5%润滑剂混合均匀过50目筛整粒压片。以开心散缓释片的外观,硬度,脆碎度,可压性,溶出度作为评价指标。
17.致孔剂种类的选择取2个托盘,编号1、2,分别加入比例为12%的ec和28.5%的peg600,12%的ec和peg4000制软材使粉末手握成团,轻压即散,过20目筛,在恒温干燥箱60℃下干燥2h整粒,加入0.5%润滑剂混合均匀过50目筛整粒压片。以开心散缓释片的外观,硬度,脆碎度,可压性,溶出度作为评价指标。
18.填充剂种类的选择取2个托盘,编号1、2,分别加入比例为28.5%的乳糖和28.5%淀粉制软材,使粉末手握成团,轻压即散,过20目筛,在恒温干燥箱60℃下干燥2h整粒,加入0.5%的润滑剂混合均匀过50目筛整粒,以开心散缓释片颗粒的外观和结块程度作为评价指标。
19.润湿剂种类的选择取2个托盘,编号1、2,分别加入比例为12%的ec制软材,再向其中加入适量的水和90%的乙醇,作为润湿剂,使粉末手握成团,过20目筛,在恒温干燥箱60℃下干燥2h整粒,加入0.5%的润滑剂混合均匀过50目筛整粒,轻压即散。以开心散缓释片颗粒的外观和结块程度作为评价指标。
20.正交实验优选开心散缓释片的辅料用量经过单因素考察后,筛选出了制备开心散缓释片的最佳辅料种类,在此基础上采用的正交设计方案,明确各辅料的用量,其中表1主药与辅料用量的克数比例,根据各项指标对所制备的开心散缓释片进行评分。
21.表1因素水平表1.5评分标准正交试验的评分标准如下表2。四项各项总分10分,参考《中国药典》缓控释片检查中四项评价指标对制成颗粒剂剂的影响程度,设计权重系数分别为:外观0.2,硬度0.3,脆碎度0.3,重量差异0.2。
22.表2评分标准
1.6验证实验预测缓释片处方最佳工艺为:每片hpmck15m用量51 mg,mcc用量92 mg,即每片辅料用量约为143 mg。精密称取pns提取物粉末100 g,加入hpmck15m用量51 g和mcc用量92 g,混匀,喷95 %乙醇制软材,制粒,干燥后整粒,加0.8%颗粒重量的硬脂酸镁,压制成1000片,测定缓释片药物累积释放度综合评分为97.74,与理论预测值98.96基本吻合,表明模型拟合良好,有较好的预测性1.7质量检查外观:完整光洁,色泽均匀,没有麻点硬度:取样品10片,用片剂硬度测定仪测定硬度,硬度合格标准为40-60n。
23.重量:取样品10片,用分析天平称重量,结果以十片片剂平均重量表示。
24.脆碎度:取样品10片,片剂的抗磨损和抗振动能力,小于1%合格。
25.重量差异:取样品10片,平均(标示)片重<0.50g,片剂重量差异限度(%)为
±
7.5%;平均(标示)片重≥0.5g,片剂重量差异限度(%)为
±
5%。
26.溶出度:符合下述条件之一者,可判为符合规定:(1)6片(粒)中,每片(粒)在每个时间点测得的溶出量按标示量计算,均未超出规定范围;(2)6片(粒)中,在每个时间点测得的溶出量,如有1~2片(粒)超出规定范围,但未超出规定范围的10%,且在每个时间点测得的平均溶出量未超出规定范围;(3)6片(粒)中,在每个时间点测得的溶出量,如有1~2片(粒)超出规定范围,其中仅有1片(粒)超出规定范围的10%,但未超出规定范围的20%,且其平均溶出量未超出规定范围,应另取6片(粒)复试;初、复试的12片(粒)中,在每个时间点测得的溶出量,如有1~3片(粒)超出规定范围,其中仅有1片(粒)超出规定范围的10%,但未超出规定范围的20%,且其平均溶出量未超出规定范围。以上结果判断中所示超出规定范围的10%、20%是指相对于标示量的百分率(%),其中超出规定范围10%是指:每个时间点测得的溶出量不低于低限的-10%,或不超过高限的+10%;每个时间点测得的溶出量应包括最终时间测得的溶出量。
27.体外释放度建立:参考2020年版 《中国药典》四部通则0931溶出度与释放度测定法中的第一法和第二法(缓释制剂和控释制剂)。取缓释片6片,置于转篮中,以500ml水为溶出介质,在(37
±
0.5) ℃、100 r/min 下于2h,3h,4h,6h,12h各取样5ml用紫外可见分光光度法测定吸光度,并及时补充等体积等温度的释放介质。然后,参考2020年版 《中国药典》四部通则9013缓释、迟释制剂指导原则。以水为溶出介质,采用综合评分法,以第2、4、6、10、
12、15小时的累积释放度为评价指标。
28.结果2.1单因素筛选开心散缓释片辅料结果2.1.1缓释骨架材料筛选根据1.32操作方法进行开心散缓释片的缓释骨架材料的筛选,结果见表3。
29.表3开心散缓释片的缓释骨架材料筛选由表3可知,hpmck100m成型率较低,且具有结块现象,hpmck100m缓释片由于粘度较低在可压性实验中需要的压力更大且不易压制成片,在溶出度实验中的溶出表现不好,外观也不如ec所制成的缓释片色泽均匀,表面光滑,不符合要求,所以ec是本处方的最优缓释骨架材料,故本实验将ec作为开心散缓释片的缓释骨架材料。
30.致孔剂的筛选 根据1.33的操作方法进行开心散缓释片的致孔剂的筛选,结果见表4。
31.表4开心散缓释片的致孔剂筛选由表4可知,peg600由于本身粘稠且易吸潮,制成的颗粒黏性较大,颗粒不容易成型,压成缓释片较黏片剂表面完整光感较好且peg600溶解性较大,缓释片的制孔效果较差,药物释放速度过慢且不均匀,不符合要求。peg4000为鳞片状固体,研细后制成的颗粒形状较好,黏度适中,由于peg4000分子量大溶解性较差在压制成缓释片剂后,制孔效果好,在缓释片表面形成孔洞,缓释片表面完整光感良好。所以peg4000是本处方的最优致孔剂,故本实验将peg4000作为开心散缓释片的致孔剂。
32.填充剂的筛选根据1.34的操作方法进行开心散缓释片的填充剂的筛选,结果见表5。
33.表5开心散缓释片的填充剂筛选由表5可知,玉米淀粉由于易吸潮,不宜溶于冷水,颗粒不容易成型且容易结块,压成缓释片所需要压力较大,不符合要求。乳糖为白色结晶颗粒,颗粒形状较好,不宜结块,且有甜味还可用于矫味所以乳糖是本处方的最优填充剂,故本实验将乳糖作为开心散缓释片的填充剂。
34.润湿剂的筛选
根据1.35的操作方法进行开心散缓释片的润湿剂的筛选,结果见表6。
35.表6开心散缓释片的润湿剂筛选由表6可知,90%乙醇作为润湿剂时,成型率较低,且具有结块现象,外观也不如水所制成的颗粒剂色泽均匀,表面光滑,不符合要求,所以水是本处方的最优润湿剂,故本实验将水作为开心散缓释片的润湿剂。
36.分析从上述可知,我们已知的中药多糖提取物较强的黏性和吸湿性,对于制粒造成一定的困扰。为了降低中药提取物的吸湿性,所选用的辅料须具有一定的吸湿性。实验证明,将一定的中药提取物,ec,peg4000,乳糖混合均匀可降低吸湿性,成型率高,味道适宜,价格适中,理化性能较好。
37.正交试验结果2.3.1 处方筛选结果表7评分结果表8直观分布图
由表7和表8可分析出,ec用量、peg4000用量对最终得分造成影响,导致对所制备的缓释片剂有显著性影响。各因素影响制剂质量的程度由大及小为a>b>c。故各辅料用量的最佳组合为a2b2c1d4。所以确定处方为:主药人参、远志、菖蒲、茯苓,提取物30mg、30mg、30mg、60mg,致孔剂peg4000142.5mg,填充剂乳糖142.5mg,润湿剂水12.5ml。
38.分析比较k1,k2,k3,k4,由于k
2 》 k1》 k3》k4,从而得到a2水平最优;从表8可以看出数值最大的是b2,所以选取b2作为b因素的最优水平;c因素对开心散缓释片影响不大,因此c因素的最优水平相比较之下选择c1;所以开心散缓释片的最优处方为水作为润湿剂,乳糖作为处方中的填充剂时,所制得的缓释片剂外观好,可压率高,硬度、脆碎度适中,故本实验的处方为主药人参、远志、菖蒲、茯苓,提取物30mg、30mg、30mg、60mg,致孔剂peg4000142.5mg,填充剂乳糖142.5mg,润湿剂水12.5ml。
39.缓释片剂的制备选择ec,peg4000,乳糖常用辅料,以中药提取物浸膏粉,缓释骨架材料,致孔剂以一定的比例混合制成开心散缓释片剂。所以通过辅料筛选后开心散缓释片剂最优处方设计如表9所示。
40.表9 开心散缓释片处方
主药人参、远志、菖蒲、茯苓,提取物30mg、30mg、30mg、60mg,致孔剂peg4000142.5mg,填充剂乳糖142.5mg,硬脂酸镁2.5mg,润湿剂水12.5ml,过20目筛,将过筛后的颗粒放入60℃恒温烘干箱中烘干2h,取出烘干好的颗粒剂整粒后称取2.5mg润滑剂混合均匀,过50目筛。将总混后的颗粒剂用10mm的浅凹冲模压片机中压片,最终制成500mg缓释片。
41.质量检查结果按照药典中对缓释片剂的要求,分别从外观、硬度、脆碎度、重量差异4个方面对开心散缓释片进行考察。
42.外观实验制得的开心散缓释片剂干燥触摸光滑无不平整、大小一致、色泽均为褐色片剂。
43.硬度实验制得的开心散缓释片硬度检查,取样品10片,用片剂硬度测定仪测定硬度,10片缓释片硬度平均为60n结论:马莲根颗粒剂的粒度均符合40-60n区间,符合规定。
44.脆碎度实验制得的开心散缓释片剂脆碎度检查,取压制好的缓释片10片,10片缓释片剂在60min100转下无破损,裂片等情况。
45.结论:片剂的抗磨损和抗振动能力小于1%合格。
46.重量差异实验制得的开心散缓释片剂重量差异检查,取压制好的缓释片10片,10片缓释片剂的重量均在500mg-520mg左右结论:平均(标示)片重<0.50g,片剂重量差异限度(%)为
±
7.5%;平均(标示)片重≥0.5g,片剂重量差异限度(%)为
±
5%,符合规定的要求。
47.溶出度参考2020年版《中国药典》四部通则0931溶出度与释放度测定法中的第一法和第二法(缓释制剂和控释制剂)。取缓释片适量,置于转篮中,以500ml水为溶出介质,在(370.5)
°ꢀ
c、100 r/min 下于2h,3h,4h,6h,12h各取样5ml用紫外可见分光光度法测定吸光度,并及时补充等体积等温度的释放介质。然后,参考2020年版 《中国药典》四部通则9013缓释、迟释制剂指导原则。以水为溶出介质,采用综合评分法,以第2、4、12小时的累积释放度为评价指标,计算溶出度。
48.溶出度结果:
2.5.6释放度本发明的开心散缓释制剂的释放度如图2所示,与普通制剂相比具有很多优点,可以有效减缓药物释放速率,从而减少药物用量及给药次数,并有效节约成本。本实验所研究制作的开心散缓释片,是国内首次将缓释片应用到开心散药物的制作过程中,可以有效开心散在临床用药中用药次数多的缺点,使得开心散在抗抑郁治疗中得到广泛的应用。
49.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以作出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。