1.本发明属于枯草芽孢杆菌基因工程技术领域,具体涉及crispr-cas9技术通过启动子替换、脂肪酸前体途径强化改善丰原素合成。选择内源性强启动子p
ylb
替换丰原素天然合成酶基因簇启动子p
pps
,在此基础上对3-羟基辅酶a水合酶基因fadb进行敲除,对长链脂肪酸辅酶a连接酶基因yhfl以及编码生物素羧化酶基因yngh、异源硫酯酶tesa基因进行过表达。所构建菌株以阿拉伯糖为碳源进行发酵,提出一种利用阿拉伯糖转化丰原素枯草芽孢杆菌人工菌株的构建方法。
背景技术:
2.丰原素(fengycin),又名芬芥素、芬荠素,是由芽孢杆菌产生的低分子量两亲性环脂肽家族成员之一,由一个c14-c18的β羟基脂肪酸链和氨基酸(l-glu-d-orn-d-tyr-d-allo-thr-l-glu-d-ala/val-l-pro-l-gln-l-tyr-l-ile)组成的环肽,包括丰原素a、b、c、s和plipastatin等多种变体。具有抗菌、抗肿瘤、抗生物黏附、抗凝聚等多种生物活性,作为生物防治剂、抗肿瘤药物、纳米药物载体、材料涂层、乳化剂等应用潜力极大。
3.目前对丰原素合成的底盘细胞的研究主要集中在b.amyloliquefaciens fmbj-60、b.velezensis fzb42、bacillus subtilis atcc21332、bacillus subtilis f29-3以及bacillus subtilis 168等。bacillus subtilis 168作为一种gras模式微生物底盘,安全性良好,工业上作为生产菌株安全性可以得到保障;同时不存在密码子的偏好性,胞外蛋白分泌能力强;遗传背景清晰,便于进行菌种改造;拥有较为成熟的发酵技术,具有广阔的工业生产潜力。但是在以往的报道中bacillus subtilis 168的发酵水平尚处于较低的阶段,且对其研究多体现在丰原素合成酶基因簇的启动子替换,对启动子的选择性与重要前体——脂肪酸的研究较少,因此寻求可替换的启动子、强化脂肪酸代谢流对于丰原素的生产具有重要意义。
4.近年来,科研工作者对丰原素的研究主要集中在启动子替换、发酵方式的优化。例如hussein等以p
repu
替换bcaillus subtilis 168中丰原素天然启动子,优化体积氧传质系数(kla)和体积平均功耗(pvl),丰原素产量达到507mg/l(w.hussein,s.fahim.plipastatin over-production in bacillus subtilis using site direct mutation[j].research journal of pharmaceutical biological and chemical sciences,2017,8(3):1013-1020)。yaseen等将外源高产菌株bbg21的p
fen
启动子替换其内源性启动子,丰原素产量增加了10倍(y.yaseen,f.gancel,m.bechet,d.drider,p.jacques.study of the correlation between fengycin promoter expression and its production by bacillus subtilis under different culture conditions and the impact on surfactin production[j].archives of microbiology,2017,199(10):1371-1382)。此外还有一些组成型的强启动子、诱导型启动子也逐渐被应用于脂肽的合成中。但这些启动子存在表达强度过高造成菌体负担、诱导剂价格昂贵、发酵中添加易污染等问题,因此,寻找时期特异性启动子以在细胞生长特定时期启动基因的高表达,使得生长与
生产彼此协调在工业化中更有意义。p
ylb
作为芽孢杆菌中新发掘的时期特异性启动子(j.t.xu,x.q.liu,x.x.yu,x.y.chu,j.tian,n.f.wu.identification and characterization of sequence signatures in the bacillus subtilis promoter p-ylb for tuning promoter strength[j].biotechnology letters,2020,42(1):115-124),其可实现稳定期基因高表达,对稳定期次级代谢物的生产如丰原素等的潜力具大。
[0005]
丰原素由亲水的寡肽与疏水的脂肪酸链组成的低分子量环脂肽,其中β-羟基脂肪酸作为其重要前体,由合成酶基因簇c结构域对其进行选择活化,因此脂肪酸的含量在一定程度上决定了丰原素起始合成速率。脂肪酸已被报道影响surfactin的合成,例如过表达生物素羧化酶亚基基因yngh的工程菌株ts1726在摇瓶中surfactin的产量增加到13.37g/l,且相比于一般的乙酰辅酶a羧化酶亚基accbc、ad具有更高催化乙酰辅酶a合成脂肪酸的活性(m.m.wang,h.m.yu,z.y.shen.antisense rna-based strategy for enhancing surfactin production in bacillus subtilis ts1726 via overexpression of the unconventional biotin carboxylase ii to enhance accase activity[j].acs synthetic biology,2019,8(2):251-256),暗示了yngh可能作为胞内脂肪酸代谢调控的又一靶点。但在之前的研究中脂肪酸影响丰原素合成的报道较少,tan等(cn113278644-a)通过过表达脂肪酸合成的限速途径丙二酰辅酶a合成途径的相关基因(acs、bira和accacd),将丰原素产量提升为24.73mg/l。
[0006]
木质纤维素是地球上最丰富的可再生资源,植物生物质中的木质素、纤维素和半纤维素都可以转化成十分宝贵的能源和化工原料,或者经过水解成为单糖用于生物炼制行业,通过微生物发酵生产生物基化学品(如琥珀酸、乳酸等)和生物燃料(如乙醇、丁醇等),并逐渐代替传统的石油化学工业生产工艺。阿拉伯糖(arabinose)作为木质纤维素水解后的第二大五碳糖,在胞内存在天然的nadph途径,而诸多研究表明脂肪酸与氨基酸的合成与胞内nadph关系极为密切。因此,以阿拉伯糖作为碳源,一方面可以开发其转化丰原素的潜力,另一方面也能解决木质纤维素利用率低的问题。利用这种可再生原料结合合成生物学技术,真正实现绿色生物制造,开发更符合可持续发展理念的生物基产品。
[0007]
本发明以bacillus subtilis 168为研究对象,利用crispr-cas9技术以稳定期高表达启动子p
ylb
替换天然丰原素操纵子启动子,再阻断脂肪酸β氧化分解代谢基因fadb、强化脂肪酸酰基辅酶a基因yhfl表达、构建生物素羧化酶yngh、硫酯酶tesa(escherichia coli mg1655来源)过表达菌株,实现了菌体生长与生产相协调,开发出一种构建阿拉伯糖转化丰原素的枯草芽孢杆菌人工菌株构建方法。
[0008]
本发明的一种阿拉伯糖转化丰原素的人工细胞构建方法,包括步骤如下:
[0009]
1)利用核苷酸序列seq id no:1、seq id no:2、seq id no:3,分别设计oligo引物对应获得sgp
pps
基因、sgfadb基因、sgamye基因;
[0010]
2)将1)中的sgp
pps
基因、sgfadb基因、sgamye基因分别连入pjoe8999载体接构建质粒pjoe8999-sgp
pps
、pjoe8999-sg-sgfadb、pjoe8999-sgamye;
[0011]
3)利用核苷酸序列seq id no:4、seq id no:5,seq id no:6、seq id no:7,seq id no:8、seq id no:9,设计pcr引物,以bacillus subtilis 168基因组为模板,对应扩增敲除靶点上下游同源臂基因sgp
pps-up、sgp
pps-down,sgfadb-up、sgfadb-down及sgamye-up、sgamye-down;
[0012]
4)利用核苷酸序列seq id no:10,设计pcr引物,以bacillus subtilis 168基因组为模板,获得p
ylb
启动子;
[0013]
5)利用核苷酸序列seq id no:11,设计pcr引物,以bacillus subtilis 168基因组为模板,扩增脂肪酸辅酶a连接酶基因yhfl;
[0014]
6)利用核苷酸序列seq id no:12、seq id no:13,设计pcr引物,以bacillus subtilis 168基因组为模板,分别扩增p43启动子、生物素羧化酶基因yngh;利用核苷酸序列seq id no:14,设计pcr引物,以escherichia coli k-12mg1655基因组为模板,扩增硫酯酶基因tesa;
[0015]
7)将6)中p43启动子、yngh基因、tesa基因通过重叠延伸pcr获得融合基因片段pyt,其中字母p表示p43启动子,字母y表示yngh基因,字母t表示tesa基因。
[0016]
8)将3)中sgp
pps-up、sgp
pps-down基因、4)中p
ylb
启动子连入1)中的pjoe8999-sgp
pps
载体中,构建重组质粒pjoe8999-sgp
pps-p
ylb
。
[0017]
9)将3)中sgfadb-up、sgfadb-down连入1)中的pjoe8999-sgfadb载体中,构建重组质粒pjoe8999-sgfadb-1。
[0018]
10)将3)中sgamye-up、sgamye-down基因、4)中p
ylb
启动子、5)yhfl基因连入1)中pjoe8999-sgamye载体,构建重组质粒pjoe8999-sgamye-p
ylb-yhfl。
[0019]
11)将7)中的pyt基因片段连入php13载体连接,构建重组质粒php13-pyt。
[0020]
12)将8)中构好的载体通过spizizen方法转化入出发菌株bsj00中构建启动子p
ylb
替换菌株,命名为bsj02。
[0021]
13)将9)中构好的载体通过spizizen方法转化入bsj02构建3-羟基辅酶a水合酶基因fadb敲除菌株,命名为bsj021。
[0022]
14)将10)中构好的载体通过spizizen方法转化入bsj021构建长链脂肪酸辅酶a连接酶基因yhfl过表达菌株,命名为bsj022。
[0023]
15)将11)中构好的载体通过spizizen方法转化入bsj022构建生物素羧化酶基因yngh、硫酯酶基因tesa过表达菌株,命名为bsj023。
[0024]
16)将出发菌株bsj00与本发明构建的基因工程菌株bsj023在阿拉伯糖为碳源的条件下发酵生产丰原素。
[0025]
所述步骤1)中设计oligo引物如下:
[0026]
sgppps-f:tacgcctcttattatgagaactgg
[0027]
sgppps-r:aaacccagttctcataataagagg
[0028]
sgfadb-f:tacgggcctgtcacatcagaatcg
[0029]
sgfadb-r:aaaccgattctgatgtgacaggcc
[0030]
sgamye-f:tacgtgaagatcaggctatcactg
[0031]
sgamye-r:aaaccagtgatagcctgatcttca
[0032]
所述步骤3)中设计pcr引物如下:
[0033]
p
pps-uf:ttaatacgactcactatagggtcgactatgccttagatttatttaagcagtcac
[0034]
p
pps-ur:ataagaaaatgtagaaaaaagcagaaaaatg
[0035]
p
pps-df:ttgagcgaacatacttattctttaacc
[0036]
p
pps-dr:agatgaagattatttcttaatctagaattcatttacaagcaaattataaggaaacc
[0037]
fadb-uf:ttaatacgactcactatagggtcgacaatatttacccgcgtgagg
[0038]
fadb-ur:aggacagaactcctttacttattg
[0039]
fadb-df:aagtaaaggagttctgtcctaaggggatatgatcatgaatct
[0040]
fadb-dr:agatgaagattatttcttaatctagatttatctgctccgtaatgaataagc
[0041]
amye-uf:acgactcactatagggtcgaactgccgttattcgctgg
[0042]
amye-ur:catgcgactctacccatgtcac
[0043]
amye-df:gcctgatggcaggtatgaca
[0044]
amye-dr:aagattatttcttaatctagcccgctccgattaaagctac
[0045]
所述步骤4)中设计pcr引物如下:
[0046]
p
ylb-f:ttttttctacattttcttatttcttgccgcctcgtcacaa
[0047]
p
ylb-r:gaataagtatgttcgctcaaacaaatctccccctttgttgt
[0048]
所述步骤5)中设计pcr引物如下:
[0049]
yhfl-f:atgtacacatggtcgacccaaggagggtatagctatgaatcttgtttcaaaattggaag
[0050]
yhfl-r:tgccagcacaacgccatgtgtctagattattggggcaaaatatctctcag
[0051]
所述步骤6)中设计pcr引物如下:
[0052]
p43-f:cgcggatccgcggcttccttgtagag
[0053]
p43-r:tcagtacttttgtaaacatagctataccctccttggcatgtgtacattcctctcttacc
[0054]
yngh-f:gagaggaatgtacacatgccaaggagggtatagctatgtttacaaaagtactgatcgc
[0055]
yngh-r:gttgaagttcatcatagctataccctccttggttataggtgctgtttcaaaaagtca
[0056]
tesa-f:tgaaacagcacctataaccaaggagggtatagctatgatgaacttcaacaatgttttcc
[0057]
tesa-r:ccggaattcttatgagtcatgatttactaaaggc。
[0058]
利用本发明提出的方法构建一种能利用阿拉伯糖高效合成丰原素的枯草芽孢杆菌人工菌株,通过进行丰原素合成酶基因簇启动子替换、强化脂肪酸代谢途径前体供应最终将基因工程菌中的bsj023产量提高至212.36mg/l,较出发菌株bsj00提高了1.67倍。同时,阿拉伯糖的利用缓解了资源紧张问题,为可再生生物质资源——木质纤维的利用奠定了基础。
附图说明
[0059]
图1:pjoe8999-sgp
pps-p
ylb
质粒构建过程;
[0060]
图2:p
ylb
启动子替换菌株bsj02电泳验证结果;
[0061]
图3:pjoe8999-sgfadb-1质粒构建过程;
[0062]
图4:3-羟基辅酶a水合酶基因fadb敲除菌株bsj021电泳验证结果;
[0063]
图5:pjoe8999-sgamye-p
ylb-yhfl质粒构建过程;
[0064]
图6:长链脂肪酸辅酶a连接酶基因yhfl过表达菌株bsj022电泳验证结果;
[0065]
图7:php13-pyt质粒构建过程;
[0066]
图8:生物素羧化酶基因yngh、硫酯酶基因tesa过表达菌株bsj023电泳验证结果。
[0067]
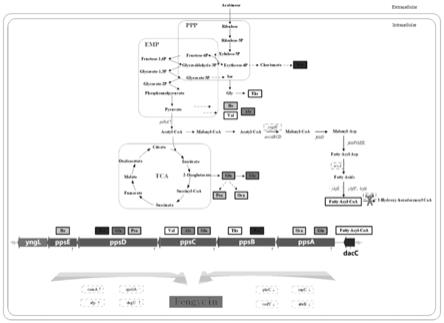
图9:丰原素的生物合成途径。
具体实施方式
[0068]
为了使本发明的目的、技术方案及效果更加清晰,下面结合附图和具体的实施例对本发明进行详细说明,下述实施例是说明性的,不是限定性的,本领域的专业人员按照本发明的精神可以对其进行改进和变化,所述的这些改进和变化都应当视为在本发明的范围内,本发明的范围和实质由权利要求来限定。
[0069]
实施例一
[0070]
1.重组质粒pjoe8999-sgp
pps
、pjoe8999-sgfadb、pjoe8999-sgamye的构建过程。
[0071]
(1)敲除整合靶点sgp
pps
、sgfadb、sgamye的设计及合成。参考sgrna的设计网站http://crispor.tefor.net/获得敲除整合靶点核苷酸序列seq id no:1、seq id no:2、seq id no:3,设计oligo引物进行退火获得sgamye、sgfadb、sgamye基因。退火体系为:上游引物9μl,下游引物9μl,缓冲液2μl;退火程序为:95℃5min,94℃15s,94℃缓慢降到室温。引物交由北京擎科生物科技有限公司合成。
[0072]
所述步骤(1)中设计oligo引物如下:
[0073]
sgppps-f:tacgcctcttattatgagaactgg
[0074]
sgppps-r:aaacccagttctcataataagagg
[0075]
sgfadb-f:tacgggcctgtcacatcagaatcg
[0076]
sgfadb-r:aaaccgattctgatgtgacaggcc
[0077]
sgamye-f:tacgtgaagatcaggctatcactg
[0078]
sgamye-r:aaaccagtgatagcctgatcttca
[0079]
(2)重组质粒pjoe8999-sgp
pps
、pjoe8999-sgfadb、pjoe8999-sgamye的构建。将pjoe8999载体用bsai于37℃酶切反应1h,酶切产物分别与sgp
pps
、sgfadb、sgamye基因片段用t4 dna连接酶在25℃金属浴中连接2h,分别将连接产物转化至escherichia coli dh5α感受态细胞中,涂布在50μg/ml卡那霉素抗性平板上,待长出单菌落后筛选正确的转化子提质粒并测序,所构重组质粒命名为pjoe8999-sgp
pps
、pjoe8999-sgfadb、pjoe8999-sgamye。
[0080]
2.重组质粒pjoe8999-sgp
pps-p
ylb
、pjoe8999-sgfadb-1、pjoe8999-sgamye-p
ylb-yhfl、php13-pyt的构建过程。
[0081]
(1)bacillus subtilis 168及escherichia coli mg1655基因组的提取。将在lb液体培养基中220rpm,37℃过夜培养,获得新鲜的菌液用于基因组的提取,收集培养的细菌菌液大约1-5ml,12000r/min离心并弃掉上清收集菌体;加1ml无菌水充分吹吸悬浮菌体,12000r/min离心30s,目的是为了防止培养基成分残留,该步骤重复2-3次;向上一步得到的菌体中加入100ul破菌缓冲液吹吸重悬,并漩涡震荡3min;加入称量好的0.2g的石英砂,加入200ul的苯酚:氯仿:异丙醇=25:24:1的基因组提取液,再次漩涡震荡3min;吸取10ul的10
×
te缓冲液加入混匀,并漩涡震荡3min;12000r/min离心5min,小心吸取上清液到干净无菌的1.5ml离心管中;向得到的上清液添加20ul 3m的醋酸钠溶液和900ul的无水乙醇,轻轻上下颠倒混匀后,室温静置30min;12000r/min离心弃上清,并用70%的乙醇重悬洗涤沉淀3-4次;12000r/min离心10min,收集沉淀,尽量倒净离心管内的液体,室温晾干至完全无酒精残留,加入20-50ul的ddh2o溶解沉淀,在-20℃条件下保存。
[0082]
(2)敲除整合靶点上下游同源臂的扩增及回收。利用核苷酸序列seq id no:4、seq id no:5,seq id no:6、seq id no:7,seq id no:8、seq id no:9,设计pcr引物,以
bacillus subtilis 168基因组为模板,对应扩增敲除靶点上下游同源臂基因sgp
pps-up、sgp
pps-down,sgfadb-up、sgfadb-down及sgamye-up、sgamye-down,并利用琼脂糖凝胶试剂盒进行纯化回收。
[0083]
所述步骤(2)中设计pcr引物如下:
[0084]
ppps-uf:ttaatacgactcactatagggtcgactatgccttagatttatttaagcagtcac
[0085]
ppps-ur:ataagaaaatgtagaaaaaagcagaaaaatg
[0086]
ppps-df:ttgagcgaacatacttattctttaacc
[0087]
ppps-dr:agatgaagattatttcttaatctagaattcatttacaagcaaattataaggaaacc
[0088]
fadb-uf:ttaatacgactcactatagggtcgacaatatttacccgcgtgagg
[0089]
fadb-ur:aggacagaactcctttacttattg
[0090]
fadb-df:aagtaaaggagttctgtcctaaggggatatgatcatgaatct
[0091]
fadb-dr:agatgaagattatttcttaatctagatttatctgctccgtaatgaataagc
[0092]
amye-uf:acgactcactatagggtcgaactgccgttattcgctgg
[0093]
amye-ur:catgcgactctacccatgtcac
[0094]
amye-df:gcctgatggcaggtatgaca
[0095]
amye-dr:aagattatttcttaatctagcccgctccgattaaagctac
[0096]
(3)p
ylb
启动子的扩增及回收。利用核苷酸序列seq id no:10,设计pcr引物,以bacillus subtilis 168基因组为模板,获得p
ylb
启动子,并利用琼脂糖凝胶试剂盒进行纯化回收。
[0097]
所述步骤(3)中设计pcr引物如下:
[0098]
pylb-f:ttttttctacattttcttatttcttgccgcctcgtcacaa
[0099]
pylb-r:gaataagtatgttcgctcaaacaaatctccccctttgttgt
[0100]
(4)长链脂肪酸辅酶a连接酶基因yhfl的扩增及回收。利用核苷酸序列seq id no:11,设计pcr引物,以bacillus subtilis 168基因组为模板,扩增长链脂肪酸辅酶a连接酶基因yhfl,并利用琼脂糖凝胶试剂盒进行纯化回收。
[0101]
所述步骤(4)中设计pcr引物如下:
[0102]
yhfl-f:atgtacacatggtcgacccaaggagggtatagctatgaatcttgtttcaaaattggaag
[0103]
yhfl-r:tgccagcacaacgccatgtgtctagattattggggcaaaatatctctcag
[0104]
(5)p43启动子、生物素羧化酶基因yngh及硫酯酶基因tesa的扩增及回收。利用核苷酸序列seq id no:12、seq id no:13,设计pcr引物,以bacillus subtilis 168基因组为模板,分别扩增p43启动子、生物素羧化酶基因yngh,并利用琼脂糖凝胶试剂盒进行纯化回收;利用核苷酸序列seq id no:14,设计pcr引物,以escherichia coli k-12mg1655基因组为模板,扩增硫酯酶基因tesa,并利用琼脂糖凝胶试剂盒进行纯化回收。
[0105]
所述步骤(5)中设计pcr引物如下:
[0106]
p43-f:cgcggatccgcggcttccttgtagag
[0107]
p43-r:tcagtacttttgtaaacatagctataccctccttggcatgtgtacattcctctcttacc
[0108]
yngh-f:gagaggaatgtacacatgccaaggagggtatagctatgtttacaaaagtactgatcgc
[0109]
yngh-r:gttgaagttcatcatagctataccctccttggttataggtgctgtttcaaaaagtca
[0110]
tesa-f:tgaaacagcacctataaccaaggagggtatagctatgatgaacttcaacaatgttttcc
[0111]
tesa-r:ccggaattcttatgagtcatgatttactaaaggc。
[0112]
(6)pyt基因片段的扩增及回收。通过p43-f,tesa-r引物overlap pcr获得p43启动子、yngh、tesa基因的融合片段,并利用琼脂糖凝胶试剂盒进行纯化回收。
[0113]
(7)pcr反应体系为:总体积50μl,无菌水17μl,2
×
phanta max buffer 25μl,dntp mix 1μl,上游引物2μl,下游引物2μl,phanta max super fidelity dna polymerase 1μl,模板2μl;pcr反应程序为:95℃3min,95℃15s,72℃60s/kb,72℃5min,4℃保温,循环数:30。
[0114]
(8)重组质粒pjoe8999-sgp
pps-p
ylb
的构建。将重组质粒pjoe8999-sgppps用sali、xbai在37℃条件下进行酶切反应1h,酶切产物与p
ylb
启动子基因片段(seq id no:10)、敲除整合位点的上下游同源臂基因片段sgp
pps-up、sgp
pps-down(seq id no:4,seq id no:5)在50℃进行重组反应30min,重组产物转化至escherichia coli dh5α感受态细胞中,涂布在50μg/ml卡那霉素抗性平板上,待长出单菌落后筛选正确的转化子提质粒并测序,所构重组质粒命名为pjoe8999-sgp
pps-p
ylb
(图1)。
[0115]
(9)重组质粒pjoe8999-sgfadb-1的构建。将重组质粒pjoe8999-sgfadb用sali、xbai在37℃条件下进行酶切反应,酶切产物与敲除位点的上下游同源臂基因片段sgfadb-up、sgfadb-down(seq id no:6,seq id no:7)在50℃进行重组反应30min,重组产物转化至escherichia coli dh5α感受态细胞中,涂布在50μg/ml卡那霉素抗性平板上,待长出单菌落后筛选正确的转化子提质粒并测序,所构重组质粒命名为pjoe8999-sgfadb-1(图3)。
[0116]
(10)重组质粒pjoe8999-sgamye-p
ylb-yhfl的构建。将重组质粒pjoe8999-sgamye用sali、xbai在37℃条件下进行酶切反应,酶切产物与p
ylb
启动子、yhfl基因、敲除位点的上下游同源臂基因片段sgamye-up、sgamye-down(seq id no:10,seq id no:11,seq id no:8,seq id no:9)在50℃进行重组反应30min,重组产物转化至escherichia coli dh5α感受态细胞中,涂布在50μg/ml卡那霉素抗性平板上,待长出单菌落后筛选正确的转化子提质粒并测序,所构重组质粒命名为pjoe8999-sgamye-p
ylb-yhfl(图5)。
[0117]
(11)重组质粒php13-pyt的构建。将pyt基因片段用bamh、ecori在37℃条件下进行酶切反应1h,酶切产物与同样酶切过的php13质粒在25℃条件下连接2h,连接产物转化至escherichia coli dh5α感受态细胞中,涂布在20μg/ml氯霉素抗性平板上,待长出单菌落后筛选正确的转化子提质粒并测序,所构重组质粒命名为php13-pyt(图7)。
[0118]
3.工程菌株bsj02、bsj021、bsj022、bsj023的构建过程。
[0119]
(1)工程菌株bsj02的构建及验证。将pjoe8999-sgp
pps-p
ylb
通过spizizen方法转化入出发菌株bsj00中,涂布在0.2%甘露糖、25μg/ml卡那霉素抗性平板上于30℃诱导培养,待长出单菌落后用基因组引物jyz-f1:tgttgaggtcaccccaaatcaaaaagaag,jyz-r1:ttcgtttaatatcctcaagagaaaacaagg筛选转化子,所得琼脂糖凝胶电泳条带大小为3235bp,与理论一致,表明p
ylb
启动子成功替换。将正确的转化子在无抗性的平板划线于50℃培养丢失质粒,成功构建菌株电泳图如附图说明中的图2所示。
[0120]
(2)工程菌株bsj021的构建及验证。将pjoe8999-sgfadb-1通过spizizen方法转化入菌株bsj02中,涂布在0.2%甘露糖、25μg/ml卡那霉素抗性平板上于30℃诱导培养,待长出单菌落后用基因组引物jyz-f2:acgctgcgatctattctgaagagacgggtg,jyz-r2:gtaaatcggccgtgtgaacacaacattccc筛选转化子,所得琼脂糖凝胶电泳条带大小为2461bp,与理论一致,表明3-羟基辅酶a水合酶基因fadb成功敲除。将正确的转化子在无抗性的平板
划线于50℃培养丢失质粒,成功构建菌株bsj021电泳图如附图说明中的图4所示。
[0121]
(3)工程菌株bsj022的构建及验证。将pjoe8999-sgamye-p
ylb-yhfl通过spizizen方法转化入菌株bsj021中,涂布在0.2%甘露糖、25μg/ml卡那霉素抗性平板上于30℃诱导培养,待长出单菌落后用基因组引物jyz-f3:aaggaggaagcggaagaatgaagtaag,jyz-r3:ttccttggttaattaacgcaaatgcataac筛选转化子,所得琼脂糖凝胶电泳条带大小为3788bp,与理论一致,表明长链脂肪酸辅酶a连接酶基因yhfl成功整合。将正确的转化子在无抗性的平板划线于50℃培养丢失质粒,成功构建菌株bsj022电泳图如附图说明中的图6所示。
[0122]
(4)工程菌株bsj023的构建及验证。将php13-pyt通过spizizen方法转化入bsj022中,涂布在5μg/ml氯霉素抗性平板上,待长出单菌落后用质粒通用引物php13-f:cgtatgttgtgtggaattgtgagcg,php13-r:gatgtgctgcaaggcgattaagttg筛选正确的转化子,成功连入载体片段大小应为2907bp,与理论一致,表明php13-pyt成功导入。成功构建菌株电泳图如附图说明中的图8所示。
[0123]
所述步骤(1)、(2)、(3)、(4)中spizizen转化培养基及方法如下:
[0124]
i.10
×
spizizen盐:(nh4)2so
4 2g/l,k2hpo
4 18.3g/l,kh2po
4 6g/l,c6h5o7na3·
2h2o 1.2g/l,ddh2o配制,ph 7.2
[0125]
ii.gm1(μl/5ml):10
×
spizizen 500,2%acid hydrolysate casein 100,5%yeast extract 100,40%glucose 100,20%mgso4·
7h2o 5,0.5%l-tryptophan 50,ddh2o 3145.
[0126]
iii.gm2(μl/5ml):10
×
spizizen 500,2%acid hydrolysate casein 50,40%glucose 100,20%mgso4·
7h2o 35,0.5%l-tryptophan 5,ddh2o 3310.
[0127]
iv.1)将冻存于-80℃的枯草芽孢杆菌菌种在固体lb平板上划线,37℃活化18h。
[0128]
2)挑取单菌落于5ml gm1培养基的试管中培养,37℃,200rpm培养18h。
[0129]
3)取500μlgm1培养物转接入装有5mlgm1培养基的试管中,继续培养4.5h,使其生长达到对数末期。
[0130]
4)取750μlgm1培养物转接到装有5mlgm2培养基的试管中(37℃预热),37℃,200rpm培养1.5h,制得感受态细胞。
[0131]
5)将待转化的质粒dna与制得的1ml感受态细胞混匀后,37℃静置1h。
[0132]
6)将转化后的感受态细胞于37℃,200rpm条件下震荡培养1h,取适量的菌液涂布于选择性lb培养基平板中,37℃培养24h后,挑选转化子。
[0133]
实施例二
[0134]
1培养基成分:
[0135]
种子培养基:葡萄糖20g/l,蛋白胨10g/l,酵母粉3g/l,牛肉膏3g/l,牛肉膏3g/l,nacl 5g/l,ph 7.0;
[0136]
发酵培养基:阿拉伯糖20g/l,黄豆饼粉20g/l,硫酸镁0.5g/l,磷酸氢二钠1.54g/l,磷酸氢二钠二水6g/l,硫酸亚铁七水6mg/l,硫酸锰6mg/l,硫酸铜五水6mg/l,ph 7.0。
[0137]
2.发酵方法
[0138]
将出发菌株bsj00与本发明构建的菌株bsj023在固体培养基中37℃培养活化20h,挑取单菌落于装有100ml种子培养基的250ml的摇瓶中,37℃,220rpm过夜培养,按5%的接种量取发酵种子液到发酵培养基中,30℃,200rpm的条件培养48h,发酵结束。其中枯草芽孢
杆菌菌株中丰原素的合成途径如附图9所示,阿拉伯糖进入细胞后,进入磷酸戊糖代谢途径(ppp)经糖酵解(emp)部分途径与三羧酸循环(tca)产生氨基酸与脂肪酸,由非核糖体肽合成酶(ppsa-ppse)对应选择底物进行活化和装载,最终合成丰原素。
[0139]
3.丰原素的提取和测定
[0140]
取发酵液30ml于50ml的离心管中,在8000rpm,4℃离心30min,弃去菌体沉淀,在上清中加入6m的盐酸调节ph至2.0,沉淀发酵液中游离的丰原素,4℃静置过夜,8000rpm,4℃离心30min,收集酸沉淀,然后用3ml纯甲醇溶剂萃取,萃取结束后用0.2m的naoh调节ph至7,离心收集上清液,即为含丰原素的粗提液。将发酵液处理所得的粗提液过0.22μm的滤膜,采用色谱柱4.6
×
150mm xdb c18进行hplc(agilent1200,usa)分析,流动相为乙腈/水/三氟乙酸(50:50:0.5,v/v/v),柱温30℃,流速0.8ml/min,紫外检测波长为210nm,进样量为20μl。
[0141]
发酵产量的检测结果显示利用本发明提出的方法能够改善丰原素合成,将bsj023发酵产量提升到212.36mg/l,较出发菌株bsj00提高了1.67倍。本发明提出的方法能够改善出发菌株利用阿拉伯糖合成丰原素的能力,为丰原素的工业化生产奠定基础。
[0142]
本发明公开和提出的技术方案,本领域技术人员可通过借鉴本文内容,适当改变条件路线等环节实现,尽管本发明的方法和制备技术已通过较佳实施例子进行了描述,相关技术人员明显能在不脱离本
技术实现要素:
、精神和范围内对本文所述的方法和技术路线进行改动或重新组合,来实现最终的制备技术。特别需要指出的是,所有相类似的替换和改动对本领域技术人员来说是显而易见的,他们都被视为包括在本发明精神、范围和内容中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。