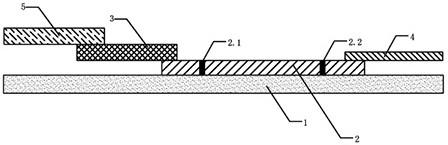
1.本技术属于体外诊断领域,具体的涉及一种检测孕妇胎盘生长因子的免疫层析试剂条及其制备方法。
背景技术:
2.plgf为分泌型二聚体糖蛋白,属于血管内皮生长因子(vascular endothelial growth factor,vegf)家族成员。plgf主要在胎盘表达,特别是在绒毛膜细胞滋养细胞和合体滋养细胞表达丰富;在人脐静脉内皮细胞、微静脉内皮细胞、有核红细胞、正常人骨髓等细胞中也有一定程度的表达。plgf的生物活性主要表现为:促性滋养细胞的增值与分化,诱导内皮细胞增值、迁移、激活,抗内皮细胞凋亡,增加血管通透性等。对于绒毛外滋养细胞的增值浸润、胎盘血管的形成、血流向高排低阻型的转变及胎盘血管由分支型向非分支型的转变等起重要作用。
3.正常非孕妇女的血清plgf水平极低,基本检测不出。正常妊娠时血清plgf分泌水平呈峰形,早孕及中孕期血清plgf水平逐渐上升,29
‑
32周时达到高峰,随后下降。这与胎盘供养变化及plgf生理功能有关。孕早期胚胎生长发育时,母体血对绒毛供给极少,处于相对缺氧状态,此时plgf水平较低;随着妊娠进展,胎儿胎盘单位内逐渐建立血流,氧分压上升,plgf水平随之上升;妊娠中期时,血供丰富、供氧充足,plgf水平达到峰值,此时胎盘血管生成主要由分支结构向非分支结构转变,而plgf主要促性非分支血管的生成;继续妊娠近足月分娩时,不断加强的子宫肌痉挛引起相应的供血减少,逐渐缺氧,从而下调plgf的分泌,引起plgf水平逐渐下降。
4.据报道,子痫前期患者外周血plgf水平显著低于同龄正常妊娠者,子痫前期患者外周血中plgf水平的下降,表明胎盘plgf合成与分泌受限,影响滋养细胞的分化与增值,限制了滋养细胞的浸润能力,造成胎盘浅着床,胎盘绒毛缺血缺氧,而缺氧可下调plgf表达;当plgf下降后,其对滋养层细胞凋亡的保护作用也减弱,胎盘组织内滋养层细胞凋亡增加,同时缺氧也可引起滋养层细胞凋亡增加,进一步影响滋养细胞功能。plgf的减少还影响内皮细胞的生产分化,致使胎盘血管的生成减少,子宫血管重铸障碍。
[0005] cn201810672538.5公开了一种胎盘生长因子检测用免疫荧光法试剂盒,该试剂盒是用于检测人血清中胎盘生长因子,但是对于重度子痫前期患者,如果采用血清作为样品进行胎盘生长因子检测需要血液采样,是一种有创采样,不容易被患者接受,特别是孕晚期重度子痫前期患者,血液采样更是不方便。
技术实现要素:
[0006]
本技术针对现有技术的上述不足,提供一种能采用尿液进行检测,更方便、无创、容易被患者接受,而且还具有敏感性高、重复性好、特异性强等优点的检测孕妇尿液胎盘生长因子的免疫层析试剂条。
[0007]
为了解决上述技术问题,本技术采用的技术方案为:一种检测孕妇尿液胎盘生长
因子的免疫层析试剂条,该试剂条包括底板,所述的底板上设置有包被垫(包被分析模),所述的包被垫上设置有检测线和质控线,所述的包被垫的一端搭接有标记物垫(偶合物垫)、另一端搭接有吸水垫;所述的标记物垫上搭接有样品垫;所述的检测线包被有特异抗体为抗胎盘生长因子单克隆抗体,所述的质控线包被有特异抗体为兔igg抗体,所述的标记物垫上包被有铕荧光纳米微球标记的胎盘生长因子单克隆抗体偶合物。
[0008]
本技术所述免疫层析试纸条采用免疫荧光(夹心法)定量检测人尿液中胎盘生长因子蛋白的含量。当样品滴加到检测卡加样孔后,样品中的plgf蛋白和偶合物垫片中的荧光物质标记的plgf蛋白抗体结合,形成plgf
‑
抗体
‑
荧光复合物,并通过毛细作用沿着硝酸纤维素膜流动,在流经检测区时,检测带(t带)上固定的plgf抗体与样品中plgf
‑
抗体
‑
荧光复合物结合,检测带(t带)上结合的荧光物质标记抗体的量与样品中plgf的量成正比,通过荧光免疫分析仪定量检测样品中plgf的含量。
[0009]
采用上述结构的试剂条,通过设定特定的抗体和偶合物,可以对通过重度子痫前期患者孕晚期尿液进行plgf的检测,而对于重度子痫前期患者的孕晚期尿液plgf水平显著下降,通过将尿液与血清中plgf水平进行平行相关性研究,结果显示血清与尿液两种样本中plgf水平相关性较好;因此本技术针对尿液作为样本进行检测的试剂条,与血液检测相比,尿液检测更方便、无创,容易被患者接受,实现了通过尿液plgf水平检测代替血清plgf水平研究plgf与子痫前期发病关系,并为子痫前期的临床监测及诊治提供更便捷的方法。
[0010]
进一步的,本技术所述的铕荧光纳米微球的直径为250
‑
350nm;本技术上述采用的250
‑
350nm粒径的微球有助于提高试纸条的灵敏度,使本技术的试纸条可以更容易检测到尿液样本中的plgf蛋白。
[0011]
进一步的,本技术所述的包被垫为硝酸纤维素膜、醋酸纤维素膜、尼龙膜或聚四氟乙烯膜中的一种。
[0012]
进一步的,本技术所述的标记物垫为玻璃纤维膜或聚酯膜中的一种。
[0013]
进一步的,本技术所述的样品垫为玻璃纤维膜或聚酯膜中的一种。
[0014]
进一步的,本技术所述的吸水垫为纤维素、玻璃纤维素或纤维素玻璃纤维素混合体中的一种。
[0015]
本技术还提供一种上述检测孕妇胎盘生长因子的免疫层析试剂条的制备方法,制备步骤包括:包被垫的制备:将一株鼠抗人plgf单克隆抗体和兔igg抗体分别包被到包被垫上,含有一株鼠抗人plgf单克隆抗体的作为检测线,含有兔igg抗体的作为质控线,干燥备用;(2)标记物垫的制备:将另一株鼠抗人plgf单克隆抗体标记的表面活化的荧光乳胶微球喷涂在标记物垫上,干燥备用;(3)组装试剂条:在底板上粘接上包被垫,然后在靠近该包被垫上的质控线的一端搭接吸水垫,在靠近该包被垫上的检测线的一端搭接标记物垫、标记物垫的另一端搭接上样品垫,然后将其切成所需宽度的试剂条,之后将该试剂条放入卡壳内。
[0016]
优选的,本技术所述的plgf单克隆抗体标记的表面活化的荧光乳胶微球的标记方法为:将荧光微球(铕荧光纳米微球)置于10mg/ml edc(1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐)中活化15 min,离心清洗,然后加入0.1 mg/ml plgf抗体摇床反应2h,加入封闭液0.1% bsa反应2h,得到plgf单克隆抗体标记的表面活化的荧光乳胶微球。
[0017]
优选的,本技术所述的荧光微球标记方法,荧光微球抗体中的缓冲液为50 mm ph=7.0 硼酸缓冲液(由于尿液中相对于血液中plgf的含量低,本技术通过设定硼酸缓冲液来提高试纸条的灵敏度,使其可以满足检测要求),微球储存液包含10 mg/ml bsa,10 mg/ml海藻糖(微球储存液的配方以及各配方的浓度可以提高微球标记后的稳定性)。
[0018]
优选的,本技术所述的喷涂在标记物垫上的鼠抗人plgf单克隆抗体标记的表面活化的荧光乳胶微球具体的为:将用鼠抗人plgf单克隆抗体标记的荧光微球配置成0.2mg/ml的浓度,按照5ul/cm的速度喷涂在玻璃纤维素膜上,然后放置在37℃下干燥2h制成标记物垫。
[0019]
本技术的优点和有益效果:1.本技术所提供的快速检测孕妇胎盘生长因子的免疫层析试剂条,其可用于尿液中plgf的检测,以用于预测子痫前期相关疾病的诊断。
[0020]
2.本技术所提供的快速检测孕妇胎盘生长因子的试剂条,与血液检测相比,尿液检测更方便、无创,容易被患者接受。
[0021]
3.本技术所提供的快速检测孕妇胎盘生长因子的试剂条,其灵敏度高、稳定性强、线性范围宽,具有优异的准确性和精密度。
[0022]
4.本技术的试剂条是一种适应于尿液中plgf检测的试剂条,由于尿液中plgf相对分子量较少,当还无肾小球疾病引起的蛋白尿时,plgf就很容易通过肾小球滤过到尿,此外,肾脏自身不分泌plgf,且尿中的plgf量不受孕期补钙的影响,从而实现了尿液中plgf水平与子痫前期的关系,重度子痫前期组尿液中plgf水平显著低于正常妊娠组;正常血压组尿plgf在早中孕时升高,29
‑
32周达到高峰,随后下降;且病例组发病前,在25
‑
28周尿plgf即开始明显下降,出现临床症状后尿plgf浓度为32pg/ml,而在相同胎龄的对照组为234pg/ml;本技术就是基于发现重度子痫前期患者孕晚期尿液plgf水平显著下降,将尿液与血清中plgf水平进行平行相关性研究,结果显示血清与尿液二种样本中plgf水平相关性较好,本技术的尿液检测用的试剂条与血液检测相比,尿液检测更方便、无创,容易被患者接受。实现了用尿液plgf水平检测代替血清plgf水平研究plgf与子痫前期发病关系,并为子痫前期的临床监测及诊治提供更便捷的方法。
[0023]
5.本技术通过合理的配置各个成分和浓度以及粒径的大小,获得一种适应于尿液中plgf检测的试剂条;本技术的试纸条针对的检测样本为尿液,相对于血液样本是一种无创的取样过程,更能为患者接受,且方便;本技术针对尿液样本中的plgf含量检测,优化了特定组成和配比的试纸条和加工工艺,使其可以满足尿液中plgf检测要求。
附图说明
[0024]
图1为本技术试剂条的结构示意图。
[0025]
图2为本技术实施案例中孕妇胎盘生长因子的校准曲线。
[0026]
如图所示:1.底板,2.包被垫,2.1.检测线,2.2.质控线,3.标记物垫(偶合物垫),4.吸水垫,5.样品垫。
具体实施方式
[0027]
为了进一步理解本技术,下面结合实施例对本技术优选实施方案进行描述,但是
应当理解,这些描述只是为进一步说明本技术的特征和优点,而不是对本技术权利要求的限制。
[0028]
如附图1所示,本技术的试剂条具体的结构如下:一种检测孕妇胎盘生长因子的免疫层析试剂条,该试剂条包括底板1,所述的底板上设置有包被垫2(包被分析模),所述的包被垫2上设置有检测线2.1和质控线2.2,所述的包被垫2的一端搭接有标记物垫(偶合物垫)3、另一端搭接有吸水垫4;所述的标记物垫3上搭接有样品垫5;所述的检测线2.1包被有特异抗体为抗胎盘生长因子单克隆抗体(即该检测线上具有抗胎盘生长因子单克隆抗体,具体的可以采用鼠抗人plgf单克隆抗体),所述的质控线2.2包被有特异抗体为兔igg抗体(即该质控线上具有兔igg抗体),所述的标记物垫3上包被有铕荧光纳米微球标记的胎盘生长因子单克隆抗体偶合物。
[0029]
本技术所述的铕荧光纳米微球的直径为250
‑
350nm,所述的包被垫2为硝酸纤维素膜、醋酸纤维素膜、尼龙膜或聚四氟乙烯膜中的一种,所述的标记物垫3为玻璃纤维膜或聚酯膜中的一种,所述的样品垫5为玻璃纤维膜或聚酯膜中的一种,所述的吸水垫4为纤维素、玻璃纤维素或纤维素玻璃纤维素混合体中的一种。
实施例
[0030]
1.plgf免疫层析检测卡的制备1)荧光微球标记plgf抗体(铕荧光纳米微球标记的胎盘生长因子单克隆抗体偶合物):将荧光微球(直径为250
‑
350nm的铕荧光纳米微球)置于10mg/ml edc(1
‑
乙基
‑
(3
‑
二甲基氨基丙基)碳酰二亚胺盐酸盐)中活化15 min,离心清洗,然后加入0.3 mg/ml plgf抗体摇床反应2h,加入封闭液0.1% bsa反应2h,离心清洗,微球储存液收集;2)包被垫的制备:将一株鼠抗人plgf单克隆抗体和兔igg单克隆抗体分别用0.05m的磷酸盐缓冲液(ph=8.5)稀释成2mg/ml,用划膜喷金仪在硝酸纤维素膜(此处包被垫采用nc膜)上进行划膜。含有一株鼠抗人plgf单克隆抗体的作为检测线(t线),含有兔igg抗体的作为质控线(c线),然后在37℃,湿度<30%的环境下干燥24h制成包被垫;3)标记物垫的制备:配置玻璃纤维素膜(标记物垫采用玻璃纤维素膜或者称为玻璃纤维膜)浸泡液:2mm 硼酸,0.1%peg20000,5%海藻糖,0.5%酪蛋白;混匀溶解后定容,调节ph9.0;将玻璃纤维素膜在上述浸泡液中浸泡3min,然后在37℃下干燥6h,备用;将封闭干燥的cp垫切割为9
×
305mm规格,备用;将用鼠抗人plgf单克隆抗体标记的荧光微球配置成0.2mg/ml的浓度,按照5ul/cm的速度喷涂在玻璃纤维素膜上,然后放置在37℃下干燥2h制成标记物垫;4)样本垫的制备配置样本垫(玻璃纤维膜或者称为玻璃纤维素膜)浸泡液:50mm tris
‑
base,5%海藻糖,0.1%bsa,0.8%tween20,混匀定容,调节ph8.5;将样本垫在上述浸泡液中浸泡3min,然后在37℃下干燥6h,备用。
[0031]
将封闭干燥的cp垫切割为15
×
305mm规格置于干燥柜中保存备用。
[0032]
5)吸水垫的制备将吸水垫(玻璃纤维素膜)裁切为23mm
×
300mm规格,备用。
[0033]
6)免疫层析检测卡的组装首先在底板1上粘接包被垫2,然后在靠近包被垫2上的质控线的一端搭接吸水垫4,在靠近包被垫2的检测线的一端搭接标记物垫3及其连接的样品垫5,上述各个垫层未搭接的一端与相应的接触的垫层接触(如标记物垫3一端搭接在包被垫上,其他部分则自然下垂与其下方的包被垫2接触形成支撑);用切条机切成4mm
±
0.1mm的试剂条,将试剂条放入卡壳中制备成孕妇胎盘生长因子免疫层析检测卡;卡壳的具体结构为常规的试剂条封装结构,上面设置加样孔和检测窗,用于加样和检测,卡壳为可拆式结构,分为上下壳体,上下壳体相互扣合,为硬质材料方便在检测仪器中检测。
[0034]
2.检测取70μl的待测样本(尿液)滴加到步骤1(上述制备工艺)制备的plgf免疫层析检测卡的加样孔中待测样本,孵育12min,然后将plgf免疫层析检测卡插入到荧光免疫分析仪进行检测,即时可获得检测结果。
[0035]
3.试剂条的性能检测1)配置不同浓度的plgf标准品(0、12、100、1000、3000pg/ml),用本步骤1制备的plgf免疫层析检测卡按照步骤2的检测过程依次进行测定,空白检测线不高于12pg/ml,检测范围为12~3000pg/ml。检测结果如表1所示,以样本浓度为横坐标,检测线与质控线的比值(t/c)为纵坐标,用直线回归进行曲线拟合,拟合度r 2分别为0.9964,n=5,制备的plgf校准曲线如图2所示,t/c值与校准品在浓度为12
‑
3000pg/ml的范围内具有良好的相关性。
[0036]
表1检测数据标准浓度pg/ml01210010003000t/c0.00130.01020.1281.0293.7329直线回归:=============================================================方程: y = a b*x
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
a
ꢀꢀꢀꢀ
=
ꢀꢀꢀꢀꢀꢀꢀ‑
0.03831b
ꢀꢀꢀꢀ
=
ꢀꢀꢀꢀꢀꢀꢀꢀ
0.00124r^2
ꢀꢀ
=
ꢀꢀꢀꢀꢀꢀꢀꢀ
0.99638==========================================================================================================================
ꢀꢀꢀꢀꢀꢀꢀ
x
ꢀꢀꢀꢀ
y
‑
反应值
ꢀꢀꢀꢀ
y
‑
平均值 cv(%)
ꢀꢀꢀꢀ
y
‑
计算值
ꢀꢀꢀꢀꢀꢀ
y
‑
残差
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑ꢀꢀꢀ
0.0000
ꢀꢀꢀꢀꢀ
0.0013
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ‑
0.0383
ꢀꢀ‑
0.0396
ꢀꢀꢀ
12.0000
ꢀꢀꢀꢀꢀ
0.0102
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ‑
0.0234
ꢀꢀ‑
0.0336
ꢀꢀ
100.0000
ꢀꢀꢀꢀꢀ
0.1280
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
0.0855
ꢀꢀ‑
0.0425
ꢀꢀ
1000.0000
ꢀꢀꢀꢀꢀ
1.0290
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1.2002
ꢀꢀ
0.1712
ꢀꢀ
3000.0000
ꢀꢀꢀꢀꢀ
3.7329
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
3.6774
ꢀꢀꢀ‑
0.0555=============================================================数据个数 5,残差平方和 0.03691。
[0037]
2)定量限定量限(limit of quantitation,loq),参照clsi发布的ep17
‑
a2文件。
[0038]
依据临床要求和室间质量评价的允许误差,设定本试剂plgf的总误差目标为30%。在不考虑分析偏差的情况下,允许总误差(tea)=2cv,即cv=1/2tea。plgf浓度在12.00pg/ml时检测的cv为12.97%,小于15%,符合质量目标要求,因此loq=12.00pg/ml,表明plgf荧光微球免疫层析检测卡的具有较高的灵敏度。
[0039]
3)精密度抽取三个批次的plgf检测试剂条,分别检测浓度为20、200、2000pg/ml的样本进行检测,每个浓度点平行测定10次,计算三个批号检测试剂条的批内变异系数和批间变异系数,从表2中可以看出批间和批内变异系数均小于15%,说明plgf荧光免疫层析检测卡的精密度较高。
[0040]
表2检测数据从表2中可以看出批间和批内变异系数均小于15%,表明本技术制备的plgf免疫层析检测卡的稳定性良好。
[0041]
所以,通过上述实施例可知,本技术的试剂条能适应于尿液中plgf的检测,样品采用量小,并且还具有敏感性高、重复性好、特异性强等优点。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。