用于鉴定能够治疗阿尔茨海默病的药物的方法
发明领域
1.本技术涉及医学领域。具体地,本技术提供了用于鉴定能够治疗神经变性疾病的药物的方法以及相关试剂盒。
2.发明背景
3.学习和记忆依赖于脑中的活性依赖性的突触可塑性。在这一关键过程中的功能障碍与若干种脑疾病有关。例如这种与突触功能障碍相关的疾病包括阿尔茨海默病(alzheimer’s disease(ad))和帕金森病(parkinson’s disease(pd))。
4.阿尔茨海默病(ad)是一种退行性和高度衰弱的脑病,是全世界老年人死亡的主要原因。该疾病的特征在于脑中β
‑
淀粉样蛋白(aβ)斑块和tau蛋白的神经原纤维缠结的累积。ad的症状包括记忆丧失、推理和判断受损以及运动能力降低。ad目前是不能治愈的,并且其临床管理受到对复杂的多因素病理生理学的不完全理解的严重限制。然而,突触功能障碍被认为是ad致病机理的早期征象,并且与认知衰退密切相关。目前对于ad没有疾病改善的临床干预,并且五种可用的药物仅减轻疾病症状。ad也难以诊断,特别是在其早期阶段。目前的诊断是基于可观察到的症状和病史,其可以通过脑成像和脑脊液分析来补充。根据国际阿尔茨海默病协会的数据,目前全世界估计有约4700万人患有该疾病,并且由于人口老龄化,预计到2050年病例数显著增加至约13200万人。
5.帕金森病(pd)是ad后世界上第二大流行的神经变性疾病。该疾病的主要病理标志是α
‑
突触核蛋白在神经元中被称为路易体(lewy body)的包涵体中累积,以及黑质(中脑区域)中的产生多巴胺的神经元的大规模死亡。患有pd的患者经历与运动有关的症状。随着疾病的发展,认知受到影响,痴呆通常发生在晚期pd中。在世界范围内,估计目前约7百万人患有pd。60岁以后pd的发展风险急剧上升。由于人口老龄化,估计到2040年可能有1300万人患有pd。
6.与alarmin信号传导失调相关的疾病包括神经血管疾病、中风、心血管疾病等。alarmins是由免疫细胞主动分泌或在感染或损伤时从受损或患病细胞被动释放的分子。它们作为危险信号来诱导免疫应答。由于它们在组织的修复和重塑中起关键作用,因此具有有益的功能。然而,过量释放某些白蛋白会触发或加剧导致失调的过程和疾病的炎症过程。高迁移率族蛋白1(hmgb1)是alarmin的一个实例,其血浆水平与心血管疾病如中风和心脏病以及病症如脓毒病,急性胰腺炎,哮喘和慢性阻塞性肺病密切相关。在脓毒病中,hmgb1负责触发巨大的先天免疫应答,其引起导致60%患者死亡的多器官衰竭。在中风中,大量hmgb1由小神经胶质细胞主动分泌或由坏死神经元被动释放。这引起加重全身和脑炎症的延迟过程,这使得身体容易经历二次感染,例如呼吸和泌尿感染,并降低存活。此外,hmcb1的释放通过触发特定的促炎途径来加剧血管炎症以驱动动脉粥样硬化和心肌损伤的进展。提示脑卒中后hmgb1功能障碍可改善脑卒中患者的预后,降低继发心血管事件的风险。
7.与血管生成失调相关的疾病是年龄相关性黄斑变性(amd),一种以黄斑,视网膜中心区视力丧失为特征的病症,由于有害蛋白和脂质的积累。amd影响视觉功能,这导致难以进行日常活动。amd目前是不可逆的,但是现有的治疗旨在减缓退化的速率。在早期和中期,
通过改善饮食和降低危险因素如吸烟和动脉粥样硬化来控制疾病。与cnv相关的晚期amd用fda批准的血管内皮生长因子抑制剂,例如雷尼珠单抗,阿柏西普(aflibercept)和brolucizumab来控制。然而,没有cnv的amd目前是不可治疗的。
8.与髓鞘形成失调有关的疾病包括脱髓鞘疾病(例如ms,als)。髓鞘保护中枢神经系统(cns)的脑和脊髓中的神经细胞。在多发性硬化症(ms)(一种炎性退行性自身免疫性疾病)中,髓鞘受到身体自身免疫系统的攻击并受损,从而阻止cns内的神经细胞通信。对于ms还没有已知的治愈方法,但是临床干预可以改善发作后的功能并防止新的发作。通常基于体征和症状来诊断患者,但是即使当与支持医学成像和实验室测试相结合时,诊断也可能是有挑战性的。肌萎缩性侧索硬化症(als)是成人中最常见的运动神经元疾病,也是第三种最常见的神经变性疾病。als的诊断是基于症状的呈现和对排除种其它疾病的一系列测试。als是不能治愈的,并且目前的治疗集中在控制症状和提供支持性护理。
9.因此,需要研究和开发更有效地治疗或诊断用于神经系统相关疾病,例如神经变性疾病(例如ad)的药物或治疗剂。
10.发明概述
11.第一方面,本技术提供了用于鉴定能够治疗神经变性疾病的治疗剂的方法,所述方法包括:
12.(1)将表达选自表2和表3中所列基因的任一种或多种基因的细胞与候选物接触;和
13.(2)确定所述基因的表达水平或所述基因产物在细胞中的活性水平,其中与不存在所述候选物时所述基因的对照表达水平或所述基因产物在细胞中的对照活性水平相比,所述基因的表达水平或所述基因产物的活性水平升高或降低指示所述候选物可以作为治疗神经变性疾病的治疗剂。所述测定是在相同条件下进行的,除了存在和不存在候选物的差异。
14.第二方面,本技术提供了用于鉴定能够治疗神经变性疾病的治疗剂的试剂盒,其包含用于检测选自表2和表3中所列基因的任一种或多种基因的表达水平或所述基因产物在细胞中的活性水平的试剂。
15.第三方面,本技术提供了用于诊断或鉴定个体中神经变性疾病的试剂盒,其包含用于检测从所述个体获得的样本中选自表2和表3中所列基因的任一种或多种基因的表达水平或所述基因产物在细胞中的活性水平的试剂。
16.第四方面,本技术提供了用于检测来自个体的样本中选自表2和表3中所列基因的任一种或多种基因的表达水平或所述基因产物在细胞中的活性水平的试剂在制备用于诊断或鉴定所述个体中神经变性疾病的试剂盒或药物中的用途。
17.在一些实施方案中,上述方面所述的神经变性疾病为阿尔茨海默氏病(ad)。
18.在一些实施方案中,上述方面所述的基因选自表1中所列的基因。
19.在一些实施方案中,上述方面所述的基因是hmgb1,agt,grm3,grm7,tnik,etnppl或wif1,并且其中所述细胞是星形胶质细胞。在优选的实施方案中,所述基因是hmgb1,并且与不存在所述候选化合物时所述基因的对照表达水平或所述基因产物在细胞中的对照活性水平相比,所述基因的表达水平或所述基因产物的活性水平降低指示所述化合物可以作为治疗神经变性疾病的治疗剂。在另一优选的实施方案中,所述基因是agt,grm3,grm7,
tnik,etnppl或wif1,并且与不存在所述候选物时所述基因的对照表达水平或所述基因产物在细胞中的对照活性水平相比,所述基因的表达水平或所述基因产物的活性水平升高指示所述候选物可以用于治疗神经变性疾病例如ad、或者与alarmin信号传导失调相关的疾病。
20.在一些实施方案中,上述方面所述的基因是neat1,pde1a,ctnna2,marcksl1,mobp或opalin,并且其中所述细胞是少突胶质细胞。在优选的实施方案中,所述基因是neat1或pde1a,并且与不存在所述候选物时所述基因的对照表达水平或所述基因产物在细胞中的对照活性水平相比,所述基因的表达水平或所述基因产物的活性水平降低指示所述候选物可以作为治疗神经变性疾病例如ad的治疗剂。在另一优选的实施方案中,所述基因是ctnna2,marcksl1,mobp或opalin,并且与不存在所述候选物时所述基因的对照表达水平或所述基因产物在细胞中的对照活性水平相比,所述基因的表达水平或所述基因产物的活性水平升高指示所述候选物可以用于治疗神经变性疾病例如ad、或者与髓鞘形成失调有关的疾病。
21.在一些实施方案中,上述方面所述的基因是acvr1,efna1,eng,ephb4,robo4,tek或vwf,并且其中所述细胞是内皮细胞。在优选的实施方案中,与不存在所述候选物时上述基因的对照表达水平或上述基因产物在细胞中的对照活性水平相比,所述基因的表达水平或所述基因产物的活性水平降低指示所述候选物可以用于治疗神经变性疾病例如ad、或者与血管生成失调相关的疾病。
22.在一些实施方案中,上述方面所述的基因的表达水平可以是mrna水平或蛋白质水平。
23.附图简要说明
24.图1显示了ad患者前额皮质层的单细胞核转录组分析,其中图a显示了单细胞核转录组分析流程,图b显示了以均匀流形逼近和投影图(umap plot)表示的前额皮质层中6种主要的细胞类型,图c显示了在169,496个样本细胞核中各细胞类型的所占比例,图d以热度图(heatmap)表示的每种细胞类型的5个最富集表达的基因,图e显示了以均匀流形逼近和投影图(umap plot)表示的6种主要细胞类型的相关基因表达。所有数据均以平均值加减标准误差表示。astro:星形胶质细胞,endo:内皮细胞,excit:兴奋性神经元,inhibit:抑制性神经元,mic:小胶质细胞,以及oligo:少突胶质细胞。
25.图2显示了在各细胞类型中与ad有关联的分子信号通路异常。umap图(a)与柱形图(b)表示6种主要细胞类型在ad患者以及正常人群的前额皮质层中的所占比例。图c显示了在ad患者与正常人群样本中每种细胞类型具有的差异表达基因的数量(校正p值小于0.1,以2为对数底的倍数变化≥0.1或≤
‑
0.1)。down:下调基因;up:上调基因。图d显示了以韦恩图(venn diagram)表示的在6种细胞类型中的11种共调控差异表达基因以及每种细胞类型特有的差异表达基因数量。图e显示了以热度图(heatmap)表示的6种细胞类型的差异表达基因在ad患者中的表达情况,具体的基因富集信号通路(go terms)被标注在右侧。astro:星形胶质细胞,endo:内皮细胞,excit:兴奋性神经元,inhibit:抑制性神经元,mic:小胶质细胞,以及oligo:少突胶质细胞。所有数据均以平均值加减标准误差表示。
26.图3显示了调控神经稳态的星形胶质细胞与少突胶质细胞在ad患者中的比例降低。图a显示了以umap图表示的各星形胶质细胞亚群(a1
‑
a9)在ad患者与正常人群的前额皮
质层中的分布。图b显示了以umap图表示的与ad相关的各星形胶质细胞亚群分布。图c显示了以热度图(heatmap)表示的在ad患者中下调的星形胶质细胞亚群中的富集基因(校正p值小于0.1,以2为对数底的倍数变化≥0.1)。down subpop.:下调的星形胶质细胞亚群;up subpop.:上调的星形胶质细胞亚群。图d显示了基于ad患者中下调的星形胶质细胞亚群转录组的信号通路富集分析。图e显示了以umap图表示的各少突胶质细胞亚群(o1
‑
o9)在ad患者与正常人群的前额皮质层中的分布。图f显示了以umap图表示的与ad相关的各少突胶质细胞亚群分布。图g显示了以热度图(heatmap)表示的在ad患者中下调的少突胶质细胞亚群中的富集基因(校正p值小于0.1,以2为对数底的倍数变化≥0.1)。down subpop.:下调的少突胶质细胞亚群;up subpop.:上调的少突胶质细胞亚群。图h显示了基于ad患者中下调的少突胶质细胞亚群转录组的信号通路富集分析。
27.图4显示了与血管生成以及抗原呈递相关的内皮细胞亚群在ad患者中增加。图a
‑
c表明ad患者中出现了具有独特转录组的内皮细胞亚群,其中图a显示了以umap图表示的各内皮细胞亚群(e1
‑
e7)在ad患者与正常人群的前额皮质层中的分布;图b显示了与ad相关的各内皮细胞亚群分布,红色代表在ad患者中上调的细胞亚群(即e1、e3以及e4);以及图c显示了单细胞层面上各富集基因在ad患者中上调的内皮细胞亚群中的表达情况(校正p值小于0.1,以2为对数底的倍数变化≥0.1),up subpop.代表上调的内皮细胞亚群。图d和e表明在ad患者中激活的内皮细胞与血管生成以及抗原呈递有关,其中图d显示了ad患者中上调的内皮细胞亚群转录组的上调基因信号通路富集分析,图e显示了蛋白互作网络分析。
28.发明详述
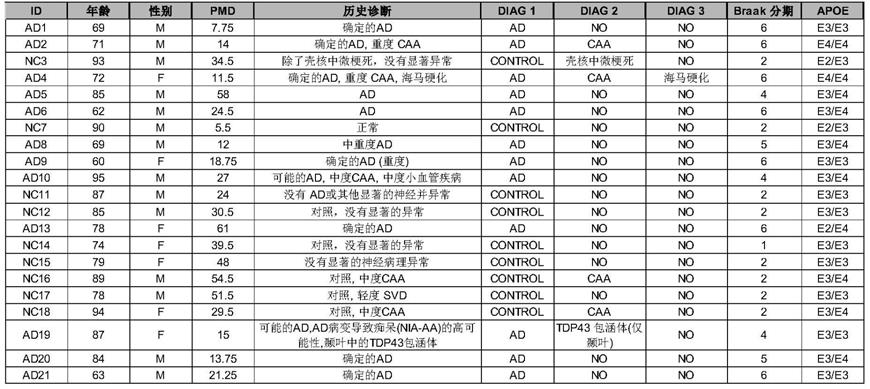
29.阿尔茨海默病(ad)是最常见的痴呆形式(1),其病理学特征包括淀粉样β肽的沉积和神经原纤维缠结以及神经炎症(2)。然而,目前没有有效的治疗ad的手段,这部分是由于没有充分理解ad致病期间细胞类型特异性应答的分子基础(3
‑
11)。随着ad的进展,特定细胞类型的分子通路的破坏可能导致功能障碍。最近的研究已经利用单核转录组分析来研究ad脑中的转录组变化,并且已经揭示了使用容易获得的冷冻脑组织在单细胞水平上的分子变化。特别地,这些研究已经鉴定了ad中最主要的神经细胞类型,例如神经元和少突胶质细胞中的失调通路。尽管来自这些研究的数据对于研究者来说是有价值的资源,但是一些问题仍未解决。首先,其它细胞类型,特别是内皮细胞中的失调通路仍然是未知的。其次,由于细胞异质性,并不清楚ad中细胞亚群的变化是否以及如何引起所观察到的失调。因此,有必要研究ad中细胞异质性的变化,以鉴定精确的细胞靶标用于发ad治疗剂的开发。
30.本技术发明人对ad中不同细胞类型中的失调的分子通路进行了全面的研究,并确定了促成所观察到的变化的细胞靶标。通过无偏转录组分析,本技术发明人发现内皮细胞、星形胶质细胞和少突胶质细胞中的ad相关的细胞类型特异性转录组变化与它们各自的功能(即血管生成、突触信号传导和髓鞘形成)的失调有关。因此,ad患者脑组织的这种全面的转录组图谱使得能够鉴定ad中的分子靶标以用于ad的预后评估以及开发内皮或神经胶质特异性途径的治疗剂。
31.本技术提供了涉及与神经变性疾病例如阿尔茨海默病(ad)相关的新生物标志物的发现。在此基础上,本技术提供了用于鉴定或筛查有效治疗神经变性疾病如ad的潜在治疗剂或药物的方法以及相关试剂盒。因此,本技术还提供了用于鉴定用于治疗受试者的神经变性疾病如ad的潜在有效的治疗化合物的筛查方法。
32.在一些实施方案中,检测了神经变性疾病如ad患者中细胞类型特异性转录子的变化。
33.在一些实施方案中,检测的细胞类型包括星形胶质细胞、少突胶质细胞、内皮细胞等细胞。
34.在一些实施方案中,发明人通过检测ad患者中细胞类型特异性转录子的变化,鉴定了ad相关的新的生物标志物。
35.在一些具体的实施方案中,本技术鉴定的生物标志物包括下表2和表3中所列出的那些基因中的一种或多种。在更具体的实施方案中,本技术鉴定的生物标志物包括下表1所列出的那些基因中的一种或多种。
36.在一些实施方案中,本文所鉴定的生物标志物包括表达于星形胶质细胞的hmgb1,agt,grm3,grm7,tnik,etnppl或wif1。
37.在另一些实施方案中,本文所鉴定的生物标志物包括表达于少突胶质细胞的neat1,pde1a,ctnna2,marcksl1,mobp或opalin。
38.在其他实施方案中,本文所鉴定的生物标志物包括表达于内皮细胞的acvr1,efna1,eng,ephb4,robo4,tek或vwf。
39.在一些实施方案中,通过将本文所鉴定的生物标志物在用候选化合物处理前后的表达水平变化情况来评价候选化合物治疗ad的有效性。在一些实施方案中,本文所述的基因表达水平包括mrna水平和蛋白质水平。在具体的实施方案中,检测生物标志物的mrna水平的方法包括但不限于核糖核酸测序(rna sequencing),即时聚合酶链式反应(real
‑
time polymerase chain reaction)以及微阵列检测(microarray)。在具体的实施方案中,检测生物标志物的蛋白质水平的方法包括但不限于酶联免疫吸附试验(elisa)以及western免疫印迹分析(western blot)。
40.在另一些实施方案中,通过将本文所鉴定的生物标志物在用候选化合物处理前后的基因产物的活性水平变化情况来评价候选化合物治疗ad的有效性。在具体的实施方案中,检测基因产物的活性水平的方法包括但不限于磷酸化检测(phosphorylation immunoassay)以及蛋白质相互作用检测(protein
‑
protein interaction assay)。
41.因此,本技术提供了待测试的候选化合物可用于治疗神经变性疾病如ad的初步证据。可以对如此鉴定的化合物进行额外的测试,例如在实验室动物或临床试验中进行体内测试,以进一步证实其抗ad的治疗功效。
42.在本说明书和权利要求书中,词语“包括”、“包含”和“含有”意指“包括但不限于”,且并非意图排除其他部分、添加物、组分、或步骤。
43.应该理解,在本技术的特定方面、实施方案或实施例中描述的特征、特性、组分或步骤,可适用于本文所描述的任何其他的方面、实施方案或实施例,除非与之矛盾。
44.上述公开内容总体上描述了本发明,通过下面的实施例进一步示例本发明。描述这些实施例仅为说明本发明,而不是限制本发明的范围。尽管本文中使用了特殊的术语和值,这些术语和值同样被理解为示例性的,并不限定本发明的范围。除非特别指明,本说明书中的实验方法和技术为本领域技术人员所公知的方法和技术。
实施例
45.试验相关方法
46.从ad患者采集脑组织的选择标准
47.我们从西南痴呆症脑库(the south west dementia brain bank,swdbb)获得患有阿尔茨海默病(ad)的患者和正常对照(nc)受试者死后前额皮质的组织样品(来自ba6,ba8和ba9区域)。ad的临床诊断基于ad的dsm
‑
5标准。对于来自swdbb的初始样品选择,我们排除患有其它神经变性疾病、血管疾病、中毒状态、感染、朊病毒、炎性疾病、结构性脑病症、代谢/营养疾病、创伤、谵妄、遗传病症(例如,唐氏综合症)或其它全身性疾病的受试者。我们根据braak分期将样品分类(即,ad:≥4和nc:≤2)。对于单核rna测序(snrna
‑
seq)文库制备,我们随后根据年龄和死亡后廷搁时间(postmortem delay,pmd)选择受试者并确保平衡的性别比率。因此,我们的研究包括21名受试者(平均年龄:ad,74.6岁;nc,85.4岁),包括8名男性ad患者和4名女性ad患者以及6名男性正常对照受试者和3名女性正常对照受试者(参见表a)。在snrna
‑
seq文库制备之前,我们没有根据apoe基因型有意地包括/排除样品,而是按照制造商的说明书通过taqman pcr用来自thermo scientific的探针(测定id:c_3084793_20和c_904973_10)证实了apoe基因型。
48.表a
[0049][0050]
释义:
[0051]
caa
‑
淀粉样血管病(cerebral amyloid augiopathy)
[0052]
pmd
‑
死亡后廷搁时间(postmortem delay)
[0053]
no
‑
无其他病症
[0054]
control
‑
正常对照
[0055]
ad患者脑组织中核的分离
[0056]
我们在先前所述方法(15)的基础上进行微小的调整从冷冻的前额叶皮质样品中分离核。简言之,我们将冷冻的皮质组织直接置于具有冰冷的均化缓冲液(0.25m蔗糖、25mm kcl、5mm mgcl2、20mm三羟甲基甘氨酸
‑
koh[ph 7.8]、1mm dtt、0.15mm精胺、0.5mm亚精胺、蛋白酶抑制剂、5μg/ml放线菌素、0.32%np40和0.04%bsa)的预冷的dounce均化器中。在用松散的研杵进行25次冲程之后,我们将匀浆物以1:1混合在optiprep中,并且在4℃下以10,000
×
g离心溶液20分钟。我们随后收集分离的核,将其在离心管的底部沉淀,洗涤它们一次
以去除optiprep,随后将它们重新悬浮在补充有10%fbs的dmem/f12中。我们将核稀释至每ml 40,000个核,通过用血细胞计数器计数确保该稀释度。我们还通过流式细胞术评价了单核悬浮液的纯度;该方案通常产生高纯度的单核悬浮液(即,在所有样品中>95%dapi
核)。用于细胞核提取的所有缓冲液和梯度溶液含有60u/ml rnasin(promega)。
[0057]
snrna
‑
seq文库的制备
[0058]
我们使用chromium
tm
单细胞3’文库试剂盒v3(1000078;10
×
genomics)按照制造商的说明制备snrna
‑
seq文库。为了构建snrna
‑
seq文库,我们使用与反转录试剂混合物混合的40
‑
μl稀释的核悬浮液(每μl400个核),并将样品加载到芯片中用于单细胞包封。然后,我们立即在热循环仪上孵育被包封的核,以使rna能够逆转录并产生条形码cdna。根据制造商的说明,我们将该cdna用于文库构建。通过qubit(赛默飞世尔科技公司)测定最终文库的浓度,通过fragment分析仪(advanced analytical technologies)测定片段长度。我们在novaseq 6000系统上根据制造商的说明(novogene)对文库进行配对末端测序,并且每个文库获得至少200gb的原始数据。
[0059]
snrna
‑
seq分析
[0060]
预处理和质量控制
[0061]
因为snrna
‑
序列文库捕获来自未剪接的前mrna和成熟mrna的读数,我们首先根据10x genomics公司提供的说明产生前mrna参考基因组。我们随后使用cell ranger(3.0.1版)将来自novogene的demultiplexed fastq文件与grch38前mrna参考基因组进行比对,默认设置。在比对完成之后,我们使用cell ranger中的默认质量控制设置作为初始质量控制步骤。该初始质量控制过程仅保留在所有条形码中的独特分子标识符值的第99百分点的前10%内具有独特分子标识符计数的条形码,并将其分类为细胞相关矩阵;将剩余的条形码作为背景条形码处理并排除。我们随后在seurat(3.0版)中使用这些细胞相关矩阵作为第二轮质量控制和下游分析的输入。
[0062]
对于第二轮的质量控制,我们控制了seurat中每个样品的基因数目、独特分子标识符计数的数目和线粒体基因的百分比的分布。为了从数据集中排除潜在的死亡细胞和细胞碎片,我们过滤掉具有≤200个基因、≥20,000个独特的分子标识符、或≥20%线粒体基因的核,如先前几个snrna
‑
seq研究(12,13,18,19)中所述。最终的过滤基质含有169,496个核和29,171个基因。在样品制备过程中,我们针对每个样品约16,000个核,发现尽管通过质量控制的核的数目在样品之间变化,但变化与年龄、性别、死亡后廷搁和病理无关,并且没有批次效应。尽管样品之间的死亡后廷搁是不同的,但我们还发现基因和检测到的转录本的数目与死亡后廷搁的变化无关。表b显示了来自21例受试者的样品的核数目以及每核的转录子和基因数目。
[0063]
表b
[0064][0065]
通过降维鉴定细胞类型
[0066]
对于整合分析,我们遵循seurat指导分析中描述的工作流程。我们首先对过滤矩阵进行对数归一化,并使用具有参数selection.method=vst,以及nfeatures=1000的findvariablefeatures函数识别每个样品高度可变的特征。为了对所有21个样本进行整合,我们使用具有参数dims=1:20的findintegrationanchors函数来识别用于锚定样本的特征,并且使用所识别的锚定器来使用具有参数dims=1:20的integratedata函数来对数据集进行整合。我们随后对积分矩阵进行缩放,并使用参数npcs=50的runpca函数来进行线性降维。我们使用jackstrawplot函数可视化每个主成分的p值分布,并选择使用前20个主成分进行基于图的聚类。
[0067]
我们使用具有参数分辨率=1的findclusters函数执行k
‑
最近邻聚类,并且使用具有参数dims=1:20的runumap函数执行统一流形逼近与投影(umap)聚类,这最初产生43个细胞簇。通过wilcoxon秩和检验,使用logfc.threshold=0.25和test.use=wilcox的findallmarkers函数,我们鉴定了每个细胞簇中的差异表达的基因(deg)。然后根据已知细胞类型标志物的表达将细胞类型鉴定分配给每个细胞簇,并通过wilcoxon秩和检验,使用参数logfc.threshold=0.25和test.use=wilcox的findallmarkers函数,鉴定另外的细胞类型特异性标志物基因。对于细胞类型标记物,将统计学显著性水平设定为调整的p值<0.1。为了进一步证实这些标记物的细胞类型特异性,我们将我们的数据与等人的数据(18)进行了比较。在本研究中证实了这些标志物在不同细胞类型中的表达模式。
[0068]
细胞类型特异性转录组变化的检测
[0069]
为了检测ad中细胞类型特异性转录变化,我们根据对ad和nc样品的初始分类(基于braak分期)将样品分层,并通过使用findmarkers函数的wilcoxon秩和检验比较ad和nc样品之间的单个细胞类型的转录组谱,参数logfc.threshold=0和test.use=wilcox。细胞类型特异性转录组变化的统计学显著性水平设定为经调整的p<0.1且log2倍数变化≥0.1或≤
‑
0.1。图1a显示了单细胞核转录组分析流程。
[0070]
试验结果
[0071]
图1显示了ad患者前额皮质层的单细胞核转录组分析结果,其中图b
‑
d显示了人脑
前额皮质层中细胞类型异质性的无差别鉴定。本研究鉴定出了与ad相关的基因标志物,表1显示了代表性基因在ad患者与正常对照受试者之间的变化、细胞类型和指示治疗潜力的变化。通过表1可以看出,如果一种候选化合物能够上调ad患者中星形胶质细胞的agt,grm3,grm7,tnik,etnppl或wif1agt,或者下调星形胶质细胞中的hmgb1,则表明该化合物能够可以作为有效治疗ad的药物。如果一种候选化合物能够上调ad患者中少突胶质细胞的ctnna2,marcksl1,mobp或opalin,或者下调少突胶质细胞的neat1或pde1a,则表明该化合物能够有效治疗ad。如果一种候选化合物能够下调ad患者中内皮细胞的acvr1,efna1,eng,ephb4,robo4,tek或vwf,则表明该化合物能够有效治疗ad。
[0072]
表2汇总了所鉴定出的细胞类型特异性标志物。表3汇总了与ad相关的星形胶质细胞、内皮细胞、小胶质细胞和少突胶质细胞亚群的基因标签,显示了目标基因表达情况,即在两个细胞亚群之中的一个细胞亚群的富集程度。
[0073]
根据细胞类型特异性的转录组变化,鉴定出了与ad相关的失调的分子信号通路。如图2所示,与ad相关联的转录组变化具有高度细胞类型特异性的特点(图c和d),ad患者中细胞特异性转录组变化与不同分子信号通路具有相关性(图e)。
[0074]
调控神经稳态的星形胶质细胞与少突胶质细胞在ad患者中的比例降低。如图3所示,与维持突触功能相关的星形胶质细胞亚群在ad患者中减少(图b
‑
d),与髓鞘形成相关的少突胶质细胞亚群在ad患者中也是减少的(图f
‑
h)。
[0075]
与星形胶质细胞和少突胶质细胞相反,参与血管生成以及抗原呈递的内皮细胞亚群在ad患者中是增加的(图4)。基于ad患者中上调的内皮细胞亚群转录组的上调基因信号通路富集分析(图4d)以及蛋白互作网络分析(图4e)表明,激活的内皮细胞的标记基因形成了一个蛋白间互作网络,并与6种不同的信号通路有关。
[0076]
表1
[0077]
[0078][0079]
表2 细胞类型特异性标志物
[0080]
[0081]
[0082]
[0083]
[0084]
[0085]
[0086]
[0087]
[0088]
[0089]
[0090]
[0091]
[0092]
[0093]
[0094]
[0095]
[0096]
[0097]
[0098]
[0099]
[0100]
[0101]
[0102]
[0103][0104]
表3 ad相关的星形胶质细胞、内皮细胞、小胶质细胞和少突胶质细胞亚群的基因标签
[0105]
[0106]
[0107]
[0108]
[0109]
[0110]
[0111]
[0112]
[0113]
[0114]
[0115]
[0116]
[0117]
[0118]
[0119]
[0120]
[0121]
[0122]
[0123]
[0124]
[0125]
[0126]
[0127]
[0128]
[0129]
[0130]
[0131]
[0132]
[0133]
[0134]
[0135]
[0136]
[0137]
[0138][0139]
在不偏离本技术公开的实质和范围的情况下,可对本技术公开的各实施方案进行多种改变和等同替换。除非上下文中另有说明,否则本公开的实施方案的任何特征、步骤或实施方案都可以与任何其他特征或实施方案组合使用。
[0140]
参考文献
[0141]
1.c.reitz,c.brayne,r.mayeux,epidemiology of alzheimer disease.nat.rev.neurol.7,137
–
152(2011).
[0142]
2.w.y.fu,x.wang,n.y.ip,targeting neuroinflammation as a therapeutic strategy for alzheimer’s disease:mechanisms,drug candidates,and new opportunities.acs chem.neurosci.(2018)https:/doi.org/10.1021/acschemneuro.8b00402.
[0143]
3.e.m.snyder,et al.,regulation of nmda receptor trafficking by amyloid
‑
β.nat.neurosci.8,1051
–
1058(2005).
[0144]
4.y.chen,a.k.y.fu,n.y.ip,synaptic dysfunction in alzheimer’s disease:mechanisms and therapeutic strategies.pharmacol.ther.195,186
–
198(2019).
[0145]
5.s.w.scheff,d.a.price,f.a.schmitt,e.j.mufson,hippocampal synaptic loss in early alzheimer’s disease and mild cognitive impairment.neurobiol.aging 27,1372
–
1384(2006).
[0146]
6.m.r.hynd,h.l.scott,p.r.dodd,glutamate
‑
mediated excitotoxicity and neurodegeneration in alzheimer’s disease.neurochem.int.45,583
–
595(2004).
[0147]
7.c.n.parkhurst,et al.,microglia promote learning
‑
dependent synapse formation through brain
‑
derived neurotrophic factor.cell 155,1596
–
1609(2013).
[0148]
8.k.s.christopherson,et al.,thrombospondins are astrocyte
‑
secreted proteins that promote cns synaptogenesis.cell 120,421
–
433(2005).
[0149]
9.s.a.liddelow,et al.,neurotoxic reactive astrocytes are induced by activated microglia.nature 541,481
–
487(2017).
[0150]
10.b.v.zlokovic,neurovascular pathways to neurodegeneration in alzheimer’s disease and other disorders.nat.rev.neurosci.12(2011).
[0151]
11.z.zhao,a.r.nelson,c.betsholtz,b.v.zlokovic,establishment and dysfunction of the blood
‑
brain barrier.cell 163,1064
–
1078(2015).
[0152]
12.h.mathys,et al.,single
‑
cell transcriptomic analysis of alzheimer’s disease.nature 570,332
–
337(2019).
[0153]
13.a.grubman,et al.,a single
‑
cell atlas of entorhinal cortex from individuals with alzheimer’s disease reveals cell
‑
type
‑
specific gene expression regulation.nat.neurosci.22,2087
–
2097(2019).
[0154]
14.x.wang,et al.,deciphering cellular transcriptional alterations in alzheimer’s disease brains.mol.neurodegener.15(2020).
[0155]
15.w.renthal,et al.,characterization of human mosaic rett syndrome brain tissue by single
‑
nucleus rna sequencing.nat.neurosci.21,1670
–
1679(2018).
[0156]
16.g.x.y.zheng,et al.,massively parallel digital transcriptional profiling of single cells.nat.commun.8(2017).
[0157]
17.a.butler,p.hoffman,p.smibert,e.papalexi,r.satija,integrating single
‑
cell transcriptomic data across different conditions,technologies,and species.nat.biotechnol.36,411
–
420(2018).
[0158]
18.s.et al.,altered human oligodendrocyte heterogeneity in multiple sclerosis.nature 566,543
–
547(2019).
[0159]
19.y.zhou,et al.,human and mouse single
‑
nucleus transcriptomics reveal trem2
‑
dependent and trem2
‑
independent cellular responses in alzheimer’s disease.nat.med.26,131
–
142(2020).
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。