1.本发明涉及纳米材料和生物医学领域,具体涉及一种碳纳米复合生物制剂及制备方法和应用。
技术背景
2.碳纳米粒子(carbon nano particles,以下简称cnps)是三个维度的尺寸均小于100nm的类球状、扁柱状、或其它不规则形状的碳基纳米粒子。cnps具有良好荧光特性,无毒性,生物相容性好,容易被生物体吸收和排放等诸多特点。cnps作为纳米材料在生物医学领域有巨大的应用前景。
3.纯的碳纳米粒子在水性溶剂中容易聚集成团,因而在生物体内应用时存在潜在风险,限制了其作为药物载体、影像试剂、肿瘤免疫激活等生物医药领域中的应用。
技术实现要素:
4.本发明的目的在于克服现有技术中的碳纳米粒子在水性溶剂中容易团聚,无法得到稳定的碳纳米复合生物材料以及在生物医药领域的应用受到限制等技术问题,提供了一种碳纳米复合生物制剂。
5.本发明的另一个目的在于提供一种碳纳米复合生物制剂的制备方法。
6.本发明的另一个目的在于提供一种碳纳米复合生物制剂的应用。
7.本发明的目的通过以下技术方案予以实现:
8.一种碳纳米复合生物制剂,包括碳纳米粒子,所述碳纳米粒子表面包含有多个官能团,所述官能团为羟基、羧基、巯基或氨基中的一种或多种;通过热复合作用,所述碳纳米粒子表面缠绕复合生物材料,所述碳纳米粒子表面的官能团为碳纳米粒子与生物材料的结合位点;所述生物材料包括生物大分子、细胞或细胞碎片、细菌或细菌碎片、病毒或病毒碎片中的一种或多种。
9.将碳纳米粒子与生物材料混合,在外加能量的作用下,通过热过程使碳纳米粒子表面的羟基、巯基、羧基和氨基的一种或多种基团与生物材料相互作用,使生物材料缠绕到碳纳米粒子表面。生物材料主要包括生物大分子、细胞或者细胞碎片、细菌或细菌碎片、病毒或病毒碎片。生物大分子与碳纳米粒子表面的官能团相互作用,在热过程下,使得生物大分子缠绕在碳纳米粒子的表面。细胞、细菌、病毒表面含有丰富的蛋白等物质,因此细胞、细菌、病毒及其碎片也可以通过表面的蛋白等生物大分子与碳纳米粒子复合。生物材料复合到碳纳米表面有助于提高碳纳米粒子在水溶液中的分散性,阻止碳纳米粒子在水中的团聚,形成稳定的碳纳米复合生物材料,提高碳纳米粒子表面所包覆的生物材料的免疫源性,进而具有更佳的免疫激活特性,提高碳纳米复合生物材料在肿瘤免疫激活、药物载体以及生物影像剂等领域的应用的有效性。
10.优选地,所述生物大分子包括蛋白、多肽、核酸、多核苷酸、碳水化合物、葡聚糖、多糖或脂类中的一种或多种。
11.优选地,所述细胞或细胞碎片为癌细胞或癌细胞碎片。
12.一种所述碳纳米复合生物制剂的制备方法,包括以下步骤:
13.s1.制备碳纳米粒子;
14.s2.将步骤s1得到的碳纳米粒子和生物材料按照质量比为1:(0.1~10000)混合,在25~100℃条件下反应2~30min,纯化后即得。
15.步骤s1中碳纳米粒子的制备具体为:将柠檬酸和尿素混合溶于二甲基亚砜或二甲基甲酰胺中,放入高压反应釜中,在110~220℃条件下,加热反应2~10h,然后用甲醇或者乙醇对得到的碳纳米粒子进行离心清洗,离心转速优选为6000~10000rpm。
16.或者碳纳米粒子的制备具体为:将柠檬酸和分散蓝-1混合在去离子水或者超纯水中,放入高压反应釜中,在110~220℃条件下,加热反应2~10h,然后用甲醇或者乙醇对得到的碳纳米粒子进行离心清洗,离心转速优选为6000~10000rpm。
17.当然本发明中的纳米粒子不限于上述方法制备。
18.步骤s2中采用的加热方法包括热传导、热辐射,光热,磁热或微波加热中的一种。
19.所述碳纳米复合生物制剂作为生物影像剂的应用。
20.所述碳纳米复合生物制剂作为药物载体的应用。
21.所述碳纳米复合生物制剂作为肿瘤免疫药物的应用。
22.与现有技术相比,本发明具有以下技术效果:
23.本发明提供的一种碳纳米粒子生物复合制剂,所述的生物材料与碳纳米粒子表面的活性基团(羟基、巯基、羧基、氨基中的一种或多种)发生作用,在外加能量产生的热的作用下缠绕到碳纳米粒子表面,形成碳纳米粒子与生物材料的生物复合制剂。生物材料在碳纳米粒子表面的包覆,将有效地提高碳纳米粒子在水溶液里面的分散性,防止碳纳米粒子在水中的团聚。其效果表现为大幅度提高碳纳米粒子的发光强度及发光稳定性,提高碳纳米粒子表面所包覆的生物材料的免疫源性,进而具有更佳的免疫激活特性,提高碳纳米复合生物材料在肿瘤免疫激活、药物载体以及生物影像剂等领域的应用。
附图说明
24.图1碳纳米粒子及其与牛血清蛋白复合制剂的荧光光谱;
25.图2碳纳米粒子及其与生物复合制剂透析前后的吸收光谱;
26.图3不同反应温度下碳纳米粒子及其与牛血清蛋白复合制剂的荧光光谱;
27.图4不同反应温度下碳纳米粒子及其与牛血清蛋白复合制剂透析后的吸收光谱;
28.图5碳纳米粒子及其与牛血清蛋白复合制剂常温存放1个月后,吸收光谱的变化;
29.图6碳纳米粒子及其与牛血清蛋白复合制剂常温存放1个月后,荧光光谱的变化;
30.图7碳纳米粒子及其与细胞复合制剂的荧光光谱;
31.图8碳纳米粒子及其与细胞复合制剂的吸收光谱;
32.图9不同反应温度下,碳纳米粒子及其与细胞复合制剂透析前后的吸收光谱;
33.图10注射肿瘤免疫激活剂治疗的小鼠以及对照组小鼠的肿瘤生长曲线;
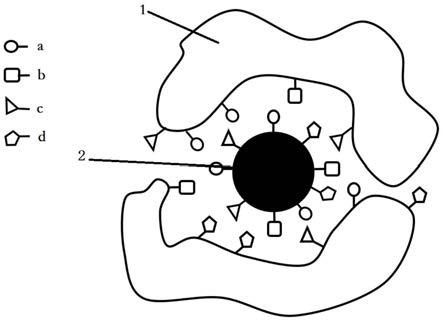
34.图11本发明碳纳米粒子与生物材料相互作用的结构示意图(a-羟基、b-羧基、c-巯基、d-氨基;1-生物材料,2-碳纳米粒子)。
具体实施方式
35.为使本发明的目的、技术方案和优点更加清楚,下面结合具体实施例和对比例将对本发明的技术方案进行详细的描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施方式,都属于本发明所保护的范围。
36.除特殊说明,本实施例中所用的设备均为常规实验设备,所用的材料、试剂若无特殊说明均为市售得到,无特殊说明的实验方法也为常规实验方法。
37.实施例1
38.将柠檬酸和尿素按质量比1:3溶解于dmso溶剂中,得到透明溶液置于50ml聚四氟乙烯高压反应釜中,160℃下反应4h,反应后的溶液加入大量乙醇洗涤,得到黑色固体,将固体水洗,离心(8000rpm,5min),干燥后得到深蓝色粉末。测定获得的碳纳米粒子的直径为3~10nm。碳纳米粒子的c、n、o、s元素质量比分别为50.1%,29.3%,19.1%和1.5%。
39.将得到的碳纳米粒子溶于去离子水中,配置浓度为(0.1~1.5)mg/ml溶液,将碳纳米粒子和牛血清蛋白的质量比是1:10混合,采用光照加热、热板加热、水浴(油浴)加热、烘箱加热或超声加热等加热方式升温至25~100℃,反应2~30min,并同时以40~250rpm转速搅拌。即得到碳纳米粒子的牛血清蛋白(cqd-bsa)复合制剂。
40.实施例2
41.将柠檬酸和分散蓝-1按质量比1:3溶解于水(或超纯水、pbs缓冲液等)中,得到透明溶液置于50ml聚四氟乙烯高压反应釜中,200℃下反应3h。反应后的溶液加入大量乙醇,得到黑色固体,固体水洗,离心(8000rpm,5min),干燥后得到深蓝色粉末。
42.将上述碳纳米粒子溶于去离子水中,配置浓度为(0.1~1.2)mg/ml,在上述溶液中每毫升中加入1x104~1x10
10
个4t1乳腺癌细胞。采用光照加热、热板加热、水浴(油浴)加热、烘箱加热或超声加热等加热方式升温至25~100℃,反应2~30min,并同时以40~500rpm转速搅拌。即得碳纳米粒子的乳腺癌细胞(cqd-cell)复合制剂。
43.实施例3
44.碳纳米粒子的制备同实施例1。
45.将得到的碳纳米粒子溶于去离子水中,配置浓度为(0.1~1.5)mg/ml溶液,将碳纳米粒子和乳杆菌的质量比是1.0:10混合,采用光照加热、热板加热、水浴(油浴)加热、烘箱加热或超声加热等加热方式升温至25~100℃,反应2~30min,并同时以40~250rpm转速搅拌。即得到碳纳米粒子的乳酸杆菌复合制剂。
46.实施例4
47.碳纳米粒子的制备同实施例1。
48.将得到的碳纳米粒子溶于去离子水中,配置浓度为(0.1~1.5)mg/ml溶液,将碳纳米粒子和非洲猪瘟病毒(asfv)的质量比是1.0:10混合,采用光照加热、热板加热、水浴(油浴)加热、烘箱加热或超声加热等加热方式升温至25~100℃,反应2~30min,并同时以40~250rpm转速搅拌。即得到碳纳米粒子的非洲猪瘟病毒(cqd-asfv)复合制剂。
49.实验例1
50.测定实施例获得的碳纳米粒子(cqd)以及得到的碳纳米粒子的牛血清蛋白(cqd-bsa)复合制剂的荧光,结果如图1所示。经过复合后得到的cqd-bsa,增加了碳纳米粒子的分
散性,具体表现为pl发射强度显著增强。
51.实验例2
52.将实施例1得到的碳纳米粒子(cqd)和碳纳米粒子的牛血清蛋白(cqd-bsa)复合制剂,分别放入透析袋中进行透析,透析时间为2天。通过测定碳纳米透析之前(cqd)和透析之后(cqd dialys);以及碳纳米粒子的牛血清蛋白复合制剂透析前(cad-bsa)和之后(cqd-bsa dialys)的吸收光谱。如图2所示,透析后的纯碳纳米粒子溶液的吸收接近0,几乎全部透出。而复合制剂的吸收谱线基本不变,说明碳纳米粒子和牛血清蛋白发生了有效复合。
53.实验例3
54.将实施例1获得的碳纳米粒子和牛血清蛋白按照质量比为1:10溶解在去离子水中,搅拌加热10min,反应温度分别设为25℃、40℃、60℃、80℃、90℃。对不同反应温度获得的cqd-bsa进行荧光测试,结果如图3所示,随着复合温度的增加复合制剂的荧光强度显著增强。再对不同温度条件下获得的cqd-bsa透析2天,再测定透析前后的吸收光谱,结果如图4所示,随着复合温度的增加,透析出去的碳量子粒子逐渐减少。
55.实验例4
56.将实施例1获得碳纳米粒子(cqd)和碳纳米粒子的牛血清蛋白(cqd-bsa)复合制剂分散在水溶液中,配置成1mg/ml的溶液。将溶液在常温下保存,放置30天。测定放置前后cqd和cqd-bsa的吸收光谱,结果如图5所示,经过放置,碳纳米点的红色波段600nm附近的吸收峰消失,只保留350nm附近的紫外吸收峰,而复合制剂的吸收谱线基本保持不变,说明纯碳纳米粒子放置30天后结构发生了变化,而复合制剂受影响甚微。测定放置前后cqd和cqd-bsa的荧光光谱,结果如图6所示,经过长期放置,纯碳纳米点发生聚集,pl的峰值降低。而复合制剂非常稳定,光谱基本不变。
57.实验例5
58.通过荧光光谱观察碳纳米粒子和实施例2得到的碳纳米粒子的乳腺癌(cqd-cell)复合制剂的荧光特性,结果如图7所述。经过复合后,增加了碳纳米粒子的分散性,表现为发射峰强度增强,伴随发射峰位置蓝移。通过cqd和cqd-cell的吸收光谱,如图8所示,可以发现经过复合前后碳纳米粒子的吸收光谱没有发生实质性的变化。
59.实验例6
60.将实施例2获得的碳纳米粒子和4t1乳腺癌细胞复合,将1ml质量浓度为0.2mg/ml的碳纳米粒子和数量为1
×
106的4t1细胞,搅拌10min,反应温度分别设置为,25℃,40℃,70℃,90℃。复合制剂通过透析前后的吸收光谱的变化证明碳纳米粒子和4t1细胞在外加能量下的复合稳定性,结果如图9所示。由图9发现,随着复合温度的增加,透析出去的碳纳米粒子逐渐减少,吸收强度逐渐增强,吸收光谱曲线形状基本保持不变。
61.实验例7
62.将一定计量实验例6经80℃复合获得的cqd-cell制剂注射到带4t1乳腺癌肿瘤的小鼠体内。优选注射计量为200ul,注入方法为静脉注入、皮下注入和腹水注入的一种,优选皮下注入。
63.测量小鼠的肿瘤生长曲线,结果如图10所示。图10发现,实验组a肿瘤生长显著受到抑制进而治愈,而对照组b肿瘤逐渐增大。说明cqd-cell制剂有效地激活了小鼠的肿瘤免疫功能,抑制并灭杀了小鼠体内的肿瘤。
64.最后应当说明的是,以上实施例仅用以说明本发明的技术方案,而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细地说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。