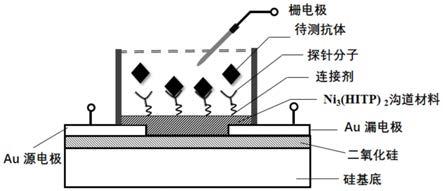
(hitp)2场效应晶体管生物传感器能够通过所述溶液液槽容纳待测液体,并利用该ni3(hitp)2场效应晶体管生物传感器的电学性能变化,判断所述待测液体中是否含有新型冠状病毒抗体分子,从而实现对新型冠状病毒抗体分子检测。
7.作为本发明的进一步优选,所述ni3(hitp)2场效应晶体管生物传感器能够通过施加固定栅压与源漏电压,测量源漏端电流信号变化,从而实现对新型冠状病毒抗体分子检测。
8.作为本发明的进一步优选,所述将戊二醛交联剂修饰至沟道区域ni3(hitp)2材料的表面,再将新冠病毒抗原蛋白探针分子通过戊二醛交联剂固定至沟道区域ni3(hitp)2材料的表面,具体是:
9.取戊二醛溶液滴加至所述溶液液槽内进行培育,培育温度为25℃,培育时间1~2h;培育完成后,将戊二醛溶液吸走,然后将新冠抗原分子溶液滴加至所述溶液液槽内进行培育,培育温度为0~4℃,培育时间8~12h。
10.作为本发明的进一步优选,所述戊二醛溶液中戊二醛的质量百分浓度为0.10~0.50%;所述新冠抗原分子溶液中新冠抗原分子的浓度为100~200μg/ml。
11.作为本发明的进一步优选,所述溶液液槽具体为pdms溶液液槽;优选的,该pdms溶液液槽是使用聚二甲基硅氧烷(pdms)在20~25℃固化形成;
12.所述pdms溶液液槽为圆柱体,其横截面内径为3~4mm,圆柱体的高度为1~1.5mm。
13.作为本发明的进一步优选,所述溶液液槽能够容纳的液体体积为20~30μl;
14.所述戊二醛溶液的体积为15~25μl;所述新冠抗原分子溶液的体积为15~25μl。
15.按照本发明的另一方面,本发明提供了利用上述制备方法制备得到的ni3(hitp)2场效应晶体管生物传感器。
16.通过本发明所构思的以上技术方案,与现有技术相比,能够取得以下有益效果:
17.1.mof材料多种多样,但导电mof材料却较为少见。本发明着眼于导电mof材料,利用ni3(hitp)2这种导电性较好的mof材料形成的导电mof基场效应晶体管,进一步得到了mof
‑
fet生物传感器,尤其可应用于新冠检测。本发明是在ni3(hitp)2导电mof基场效应晶体管沟道区域,先制备用于容纳液体的溶液液槽(例如,可使用聚二甲基硅氧烷(pdms)制备用于存储待测分析液的液槽),然后在液槽内沟道材料(即,ni3(hitp)2材料)表面依次修饰戊二醛连接分子及抗原蛋白探针分子(抗原蛋白探针分子通过与戊二醛化学键合固定在沟道材料表面),利用蛋白抗原与蛋白抗体之间的特异性结合引起的沟道mof材料电导率的变化,从而实现对新型冠状病毒(sars
‑
cov
‑
2)抗体分子的特异性灵敏检测。与已经报道的检测材料相比,ni3(hitp)2薄膜导电性好,能原位生长在沟道处,与基底接触良好、薄膜均匀,薄膜多孔、活性位点多,容易吸附待检测病毒分子,这样在很大程度上提高了病毒分子的检测灵敏度、缩短了检测时间。
18.不同于使用石墨烯或硅纳米线等作为沟道敏感材料的场效应晶体管,本发明首次使用金属有机框架材料作为传感器敏感材料用于形成能够检测新型冠状病毒抗体分子的生物传感器。本发明通过先制备源漏金电极,再水热法原位生长mof材料(即,使用简单的原位生长法即可制备均匀的mof薄膜,制备mof场效应晶体管),然后使用pdms制造液槽,随后直接戊二醛化学修饰引入醛基,通过醛基与探针抗原的氨基化学连接,即可制备得传感器,步骤简单稳定。
19.2.本发明利用ni3(hitp)2导电mof薄膜场效应晶体管,制备器件pdms液槽,获得mof基场效应晶体管生物传感器。该传感器具有良好稳定性,体积小便于携带转移。
20.3.利用本发明中的生物传感器进行新冠病毒抗体分子时,由于在mof材料表面功能化修饰抗原探针分子,通过待测分子与探针分子的特异性结合,改变传感器的电学信号,即可实现传感器对新冠抗体分子的检测,尤其是低浓度特异性新冠抗体分子的检测,检测限低至10pg/ml。本发明中的生物传感器可配合现有半导体参数分析仪直接检测,新冠病毒的待测溶液加入后,直接在液槽区域测量电流值的变化实现检测,具有快速检测和高灵敏度。
21.综上,本发明为新型冠状病毒抗体分子检测提供了一种新途径,具有检测速度快、灵敏度高、操作简便、易携带、可实时检测等巨大优势;基于本发明中的生物传感器能够实现对新型冠状病毒抗体分子的低浓度灵敏测试,检测限低至10pg/ml。本发明可应用于新冠病毒抗体分子免疫学快速灵敏检测,应用前景广阔。
附图说明
22.图1为本发明所述的ni3(hitp)2场效应晶体管生物传感器的结构示意图。
23.图2为本发明实施例1中制备的ni3(hitp)2场效应晶体管生物传感器的转移特性曲线图。
24.图3为本发明实施例1中制备的ni3(hitp)2场效应晶体管生物传感器的输出特性曲线图。
25.图4为本发明实施例1中制备的ni3(hitp)2场效应晶体管生物传感器对10pg/ml~1μg/ml新冠病毒抗体分子检测结果图。
具体实施方式
26.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。此外,下面所描述的本发明各个实施方式中所涉及到的技术特征只要彼此之间未构成冲突就可以相互组合。
27.下面各个实施例所基于的ni3(hitp)2场效应晶体管,其制备方法包括以下步骤:
28.步骤1、在si/sio2晶圆基底表面旋涂正性光刻胶,转速5000rpm,时间60s;将涂好光刻胶的基底在100℃加热台上前烘3min;在固定掩模版下对器件紫外曝光10s;曝光后基底泡入显影液中显影,时间15s;显影结束后将基底取出后氮气枪吹干,在110℃加热台上后烘3min;光刻完成后对器件进行磁控溅射镀金工艺,其中溅射真空度26mtorr,溅射电流38ma,溅射时间100s;溅射完成后使用丙酮超声剥离从而实现图案化源漏电极的制备,超声时间15s。
29.步骤2、源漏电极制备完成后在电极表面低温水热反应原位生长ni3(hitp)2材料。首先称量6.6mg 2,3,6,7,10,11
‑
六氨基三苯六盐酸盐(hatp)充分搅拌溶解于5ml去离子水中;称量10mg六水合氯化镍(nicl2·
6h2o)充分搅拌溶解于5ml去离子水中;取0.3ml氨水(nh3·
6h2o)加入六水合氯化镍溶液中;随后将氨水与氯化镍混合溶液逐滴加入至hatp溶液中,并搅拌1min;将步骤1制备的含有源漏电极的器件倒置于反应混合溶液表面,采用水浴
加热反应混合液,使得mof材料原位生长于源漏电极间,反应时间1h,反应温度65℃;反应结束后取出器件,对器件真空干燥,干燥温度100℃,干燥时间2h,干燥完成后成功制备ni3(hitp)2场效应晶体管。
30.利用上述ni3(hitp)2场效应晶体管进一步形成生物传感器以检测新型冠状病毒,可以包括如下步骤:在ni3(hitp)2场效应晶体管沟道区域制备pdms溶液液槽(溶液液槽的截面面积区域可以大于沟道区域的表面积,例如,沟道区域可以完全在溶液液槽之内),通过培育将戊二醛交联剂修饰至沟道mof材料表面,然后再通过培育将抗原蛋白探针分子通过戊二醛连接固定至mof材料表面,由此得到mof基场效应晶体管生物传感器。通过施加固定栅压与源漏电压,测量源漏端电信号变化从而实现对新型冠状病毒抗体分子检测。
31.其中,将戊二醛连接分子修饰至沟道mof材料表面,然后将抗原蛋白探针分子通过戊二醛连接修饰至mof材料表面,具体是,取戊二醛溶液滴加至器件液槽内培育,培育温度为25℃,培育时间1~2h,将戊二醛溶液吸走,然后将新冠抗原分子溶液滴加至器件液槽内培育,培育温度为0~4℃,培育时间8~12h。
32.在进行检测时,例如可以按以下步骤进行:
33.(s1)将培育完成的mof基场效应晶体管生物传感器从低温环境取出,吸走液槽内的抗原探针分子溶液,加入15~20μl的pbs溶液清洗液槽内残留探针分子并静置5~10min使器件恢复稳定状态。
34.(s2)将ph为7.4的pbs溶液与抗体分子混合配置成不同浓度溶液,其浓度为10pg/ml~1μg/ml;使用酪蛋白溶液作为封闭液滴加至传感器液槽内室温培育。
35.(s3)将keysight b1500a半导体测试系统源漏端探针分别与传感器源漏端电极压针接触,将栅端探针伸入传感器液槽液栅pbs溶液内,不接触液槽内沟道mof材料。
36.(s4)固定栅压为
‑
0.1v,固定源漏电压
‑
0.1v,测试pbs溶液作液栅时传感器源漏电流数值,即基底电流信号i
pbs
;向传感器液槽内依次滴加小浓度至大浓度的病毒抗体溶液,随后分别依次测试10pg/ml,100pg/ml,1ng/ml,10ng/ml,100ng/ml,1μg/ml抗体溶液加至传感器液槽后器件源漏端电信号的变化情况,通过识别电信号的变化从而实现对新型冠状病毒抗体分子的快速灵敏检测。
37.其中,封闭液培育是将液槽内的pbs溶液吸出,加入15~20μl封闭液即5%酪蛋白的pbs溶液,室温25℃培育时间1~2h。
38.基底电流信号测试,是将封闭液从液槽内吸走,随后加入5~10μl的pbs溶液清洗传感器液槽里的残留酪蛋白分子,再次加入15~20μl的pbs溶液并使用测试系统测试源漏端电流信号随时间变化情况,测试时间180s,得到i
pbs
基底电流信号。
39.新冠病毒抗体溶液的检测过程是吸走液槽里的溶液,加入5~10μl的pbs溶液清洗传感器液槽,随后加入15~20μl的新冠病毒抗体溶液,培育5~10min后测试源漏端电流信号随时间变化情况得到该抗体浓度下的电流信号。
40.检测新冠病毒抗体溶液时,源漏电压与栅极电压都固定为
‑
0.1v。
41.另外,可重复上述步骤(s4),依次测试10pg/ml,100pg/ml,1ng/ml,10ng/ml,100ng/ml,1μg/ml浓度下抗体溶液产生的电信号变化,通过识别不同浓度下的不同电流信号从而实现对新冠病毒抗体分子的灵敏检测。
42.以下为具体实施例:
43.实施例1:
44.一种ni3(hitp)2场效应晶体管生物传感器及其制备方法,其包括以下步骤:
45.步骤1、基于ni3(hitp)2场效应晶体管,使用聚二甲基硅氧烷(pdms)在沟道区域制备圆柱体液槽,其横截面内径为3mm,高度1mm;在25℃固化后形成用于存储待测溶液检测的pdms液槽。
46.步骤2、取15μl质量浓度为0.1%的戊二醛溶液滴加至器件液槽内培育,培育温度为25℃,培育时间1h;培育结束后将戊二醛溶液吸走,取15μl浓度为100μg/ml的新冠抗原分子溶液(sras
‑
cov
‑
2n蛋白,0588
‑
v07e,sino biological inc.)滴加至器件液槽内培育,培育温度约0℃,培育时间8h;培育完成后即可得ni3(hitp)2场效应晶体管生物传感器,其器件结构如图1所示。
47.步骤3、将制备完成的场效应晶体管生物传感器从低温环境取出,吸走液槽内的抗原探针分子溶液,加入20μl的pbs溶液清洗液槽内残留探针分子并静置10min使器件恢复稳定状态。
48.步骤4、采用keysight b1500a半导体测试系统,对ni3(hitp)2场效应晶体管生物传感器的电性能测试。将测试系统源漏端探针分别与传感器源漏端电极压针接触,将栅端探针伸入传感器液槽液栅pbs溶液内,不接触液槽内沟道mof材料。设置参数对器件的转移输出特性进行测试:设置固定源漏电压
‑
0.1v,测试在扫描栅压
‑
1.5~1v下的源漏电流变化,得到器件转移特性曲线如图2所示;设置间隔栅电压
‑
0.1v、
‑
0.05v、0v、0.05v、0.1v,测试在扫描源漏电压0~
‑
0.2v下的源漏电流变化,得到器件输出特性曲线如图3所示;由结果可知,转移曲线表明器件的p型空穴多子导电的特性,输出特性曲线表征器件在
‑
0.1v~0.1v的栅电压下良好的调制效应。
49.步骤5、将ph为7.4磷酸盐缓冲液(pbs溶液)与抗体分子(sras
‑
cov
‑
2n蛋白抗体,40588
‑
r00004,sino biological inc.)混合配置成不同浓度溶液,其浓度为10pg/ml~1μg/ml;取20μl的5%酪蛋白溶液作为封闭液滴加至传感器液槽内室温培育1h。
50.步骤6、将封闭液从液槽内吸走,随后加入5μl的pbs溶液清洗传感器液槽里的残留酪蛋白分子,重新加入20μl的pbs溶液,静置培育10min;设定测试系统栅压为
‑
0.1v,固定源漏电压
‑
0.1v,测试传感器在pbs溶液中的源漏电流数值,即基底电流信号i
pbs
;加入20μl浓度为10pg/ml的新冠病毒抗体溶液,培育10min后测试源漏端电流信号随时间变化情况得到10pg/ml浓度下的电流信号。该浓度测试结束后,加入5μl的pbs溶液清洗传感器液槽,重复上述测试步骤,从低浓度至高浓度依次加入20μl的100pg/ml、1ng/ml、10ng/ml、100ng/ml、1μg/ml抗体溶液并测试器件源漏端电信号的变化情况,通过识别电信号的变化从而实现对新型冠状病毒抗体分子的快速灵敏检测,抗体浓度测试结果如图4所示。结果表明传感器能够对新冠病毒抗体分子实现快速灵敏检测,检测限低至10pg/ml。
51.实施例2:
52.一种ni3(hitp)2场效应晶体管生物传感器及其制备方法,其包括以下步骤:
53.步骤1、基于ni3(hitp)2场效应晶体管,使用聚二甲基硅氧烷(pdms)在沟道区域制备圆柱体液槽,其横截面内径4mm,高度1.5mm;25℃固化后形成用于存储待测溶液检测的pdms液槽。
54.步骤2、取25μl质量浓度为0.5%的戊二醛溶液滴加至器件液槽内培育,培育温度
为25℃,培育时间2h;培育结束后将戊二醛溶液吸走,取25μl浓度为200μg/ml的新冠抗原分子溶液滴加至器件液槽内培育,培育温度约0℃,培育时间12h;培育完成后即可得ni3(hitp)2场效应晶体管生物传感器。
55.步骤3、将制备完成的场效应晶体管生物传感器从低温环境取出,吸走液槽内的抗原探针分子溶液,加入20μl的pbs溶液清洗液槽内残留探针分子并静置10min使器件恢复稳定状态。
56.步骤4、采用keysight b1500a半导体测试系统,用ni3(hitp)2场效应晶体管生物传感器对新冠病毒抗体分子浓度检测。将测试系统源漏端探针分别与传感器源漏端电极压针接触,将栅端探针伸入传感器液槽液栅pbs溶液内,不接触液槽内沟道mof材料。
57.步骤5、将pbs溶液与抗体分子混合配置成不同浓度溶液,其浓度为10pg/ml~1μg/ml;取15μl的5%酪蛋白溶液作为封闭液滴加至传感器液槽内室温培育1h。
58.步骤6、将封闭液从液槽内吸走,随后加入5μl的pbs溶液清洗传感器液槽里的残留酪蛋白分子,重新加入15μl的pbs溶液,静置培育10min;设定测试系统栅压为
‑
0.1v,固定源漏电压
‑
0.1v,测试传感器在pbs溶液中的源漏电流数值,即基底电流信号i
pbs
;加入15μl浓度为10pg/ml的新冠病毒抗体溶液,培育10min后测试源漏端电流信号随时间变化情况得到10pg/ml浓度下的电流信号。该浓度测试结束后,加入5μl的pbs溶液清洗传感器液槽,重复上述测试步骤,从低浓度至高浓度依次加入15μl的100pg/ml、1ng/ml、10ng/ml、100ng/ml、1μg/ml抗体溶液并测试器件源漏端电信号的变化情况,通过识别电信号的变化从而实现对新型冠状病毒抗体分子的快速灵敏检测。
59.由于本发明是在基于现有ni3(hitp)2导电mof薄膜场效应晶体管的基础上,通过制备pdms溶液液槽,通过戊二醛交联剂修饰固定探针分子,获得了ni3(hitp)2场效应晶体管生物传感器;然后,通过待测分子与探针分子的特异性结合,改变传感器的电学信号,从而实现传感器对新型冠状病毒抗体分子的快速灵敏检测;关于基于ni3(hitp)2导电mof薄膜场效应晶体管,其他未详细说明的地方,均可参照现有技术(cn110429032a)。
60.本领域的技术人员容易理解,以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。