技术特征:
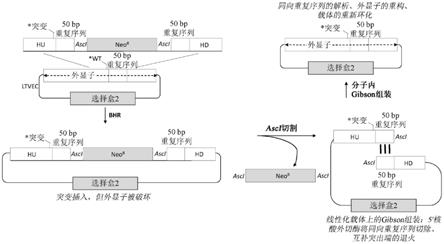
1.一种用于在预先存在的靶向性载体中引入无瘢痕靶向基因修饰的方法,所述方法包括:(a)在细菌细胞群中进行所述预先存在的靶向性载体与修饰盒之间的细菌同源重组,其中所述修饰盒包括所述靶向基因修饰并且包括插入核酸,所述插入核酸侧接有与所述预先存在的靶向性载体中的5'靶序列相对应的5'同源臂和与所述预先存在的载体中的3'靶序列相对应的3'同源臂,其中所述插入核酸从5'到3'包括:(i)第一重复序列;(ii)用于第一核酸酶试剂的第一靶位点;(iii)选择盒;(iv)用于第二核酸酶试剂的第二靶位点;以及(v)与所述第一重复序列相同的第二重复序列;(b)选择包括包含所述选择盒的经修饰靶向性载体的细菌细胞;(c)用所述第一核酸酶试剂切割所述经修饰靶向性载体中的所述第一靶位点并用所述第二核酸酶试剂切割所述经修饰靶向性载体中的所述第二靶位点以去除所述选择盒并暴露所述经修饰靶向性载体中的所述第一重复序列和所述第二重复序列;以及(d)在分子内体外组装反应中将所暴露的第一重复序列与所暴露的第二重复序列组装以产生包括所述无瘢痕靶向基因修饰的所述靶向性载体,其中包括所述无瘢痕靶向基因修饰的所述靶向性载体中既不存在用于所述第一核酸酶试剂的所述第一靶位点,也不存在用于所述第二核酸酶试剂的所述第二靶位点,而是仅存在所述重复序列的单个拷贝。2.根据权利要求1所述的方法,其中所述重复序列与所述预先存在的靶向性载体中的序列相同。3.根据权利要求1所述的方法,其中所述靶向基因修饰包括插入,并且所述重复序列与所述插入的5'端或3'端相同。4.根据任一前述权利要求所述的方法,其中所述重复序列的长度为至少约20个核苷酸。5.根据权利要求4所述的方法,其中所述重复序列的长度介于约20个核苷酸与约100个核苷酸之间。6.根据任一前述权利要求所述的方法,其中所述修饰盒是线性双链核酸。7.根据任一前述权利要求所述的方法,其中所述修饰盒的长度为约1kb到约15kb。8.根据任一前述权利要求所述的方法,其中所述5'同源臂和所述3'同源臂各自的长度为至少约35个核苷酸。9.根据权利要求8所述的方法,其中所述5'同源臂和所述3'同源臂各自的长度介于约35个核苷酸与约500个核苷酸之间。10.根据任一前述权利要求所述的方法,其中所述第一核酸酶试剂和/或所述第二核酸酶试剂是稀有切割核酸酶试剂。11.根据任一前述权利要求所述的方法,其中所述预先存在的靶向性载体中不存在所述第一靶位点和/或所述第二靶位点。12.根据任一前述权利要求所述的方法,其中所述第一靶位点与所述第二靶位点相同,
并且所述第一核酸酶试剂与所述第二核酸酶试剂相同。13.根据任一前述权利要求所述的方法,其中所述第一核酸酶试剂和/或所述第二核酸酶试剂包括稀有切割限制酶。14.根据权利要求13所述的方法,其中所述稀有切割限制酶是noti、xmaiii、sstii、sall、nrui、nhei、nb.bbvci、bbvci、asci、asisi、fsei、paci、pmei、sbfi、sgrai、swai、bspqi、sapi、sfii、cspci、absi、ccini、fspai、maubi、mrei、mssi、palai、rgai、rigi、sdai、sfaai、sgfi、sgrdi、sgsi、smii、srfi、sse2321、sse83871、lgui、pcisi、aari、ajui、aloi、bari、ppii或psri。15.根据权利要求1到12中任一项所述的方法,其中所述第一核酸酶试剂和/或所述第二核酸酶试剂是成簇的规律间隔的短回文重复序列(clustered regularly interspaced short palindromic repeats,crispr)相关(cas)蛋白和向导rna(grna)、锌指核酸酶(zfn)、转录激活子样效应子核酸酶(transcription activator
‑
like effector nuclease,talen)或经工程化的大范围核酸酶。16.根据权利要求15所述的方法,其中所述第一核酸酶试剂和/或所述第二核酸酶试剂所述cas蛋白和所述grna,其中所述cas蛋白是cas9,并且其中所述grna包括靶向的crispr rna(crrna)和反式激活cripsr rna(tracrrna)。17.根据任一前述权利要求所述的方法,其中所述靶向基因修饰包括所述5'同源臂或所述3'同源臂中的修饰。18.根据权利要求1到16中任一项所述的方法,其中所述靶向基因修饰包括所述插入核酸中的修饰。19.根据任一前述权利要求所述的方法,其中所述靶向基因修饰包括点突变、缺失、插入、置换或其组合。20.根据任一前述权利要求所述的方法,其中所述选择盒赋予对抗生素的抗性。21.根据权利要求20所述的方法,其中所述选择盒赋予对氨苄青霉素、氯霉素、四环素、卡那霉素、大观霉素、链霉素、羧苄青霉素、博来霉素、红霉素或多粘菌素b的抗性。22.根据任一前述权利要求所述的方法,其中所述预先存在的靶向性载体是长度为至少约10kb的大靶向性载体。23.根据权利要求22所述的方法,其中所述预先存在的靶向性载体的长度为至少约100kb。24.根据任一前述权利要求所述的方法,其中所述预先存在的靶向性载体包括第二选择盒。25.根据权利要求24所述的方法,其中所述第二选择盒赋予对抗生素的抗性。26.根据权利要求25所述的方法,其中所述修饰盒中的所述选择盒和所述预先存在的靶向性载体中的所述第二选择盒各自赋予对不同抗生素的抗性。27.根据权利要求24到26中任一项所述的方法,其中所述第二选择盒允许在细菌细胞和哺乳动物细胞两者中进行选择。28.根据任一前述权利要求所述的方法,其中步骤(c)在体外发生。29.根据任一前述权利要求所述的方法,其中步骤(d)包括:(i)使所述经修饰靶向性载体与核酸外切酶接触以暴露所述第一重复序列与所述第二
重复序列之间的互补序列;(ii)对所暴露的互补序列进行退火;(iii)延长经退火的互补序列的3'端;以及(iv)连接所述经退火的互补序列。30.根据权利要求29所述的方法,其中步骤(d)包括将所述经修饰靶向性载体与核酸外切酶、dna聚合酶和dna连接酶一起温育。31.根据任一前述权利要求所述的方法,其进一步包括:(e)在步骤(d)中的所述体外组装之后,用所述第一核酸酶试剂和所述第二核酸酶试剂处理所述靶向性载体,以验证既不存在用于所述第一核酸酶试剂的所述第一靶位点,也不存在用于所述第二核酸酶试剂的所述第二靶位点。32.一种用于在预先存在的靶向性载体中引入无瘢痕靶向基因修饰的方法,所述方法包括:(a)在细菌细胞群中进行所述预先存在的靶向性载体与缺失盒之间的细菌同源重组,其中所述缺失盒包括插入核酸,所述插入核酸侧接有与所述预先存在的靶向性载体中的5'靶序列相对应的5'同源臂和与所述预先存在的载体中的3'靶序列相对应的3'同源臂,其中所述5'靶序列和所述3'靶序列侧接所述预先存在的靶向性载体的要引入所述靶向基因修饰的区域,并且其中所述插入核酸从5'到3'包括:(i)用于第一核酸酶试剂的第一靶位点;(ii)选择盒;以及(iii)用于第二核酸酶试剂的第二靶位点;(b)选择包括包含所述选择盒的经修饰靶向性载体的细菌细胞;(c)用所述第一核酸酶试剂切割所述经修饰靶向性载体中的所述第一靶位点并用所述第二核酸酶试剂切割所述经修饰靶向性载体中的所述第二靶位点以去除所述选择盒并暴露所述经修饰靶向性载体中的上游末端序列和下游末端序列;以及(d)在体外组装反应中将经切割靶向性载体与包括所述靶向基因修饰的修饰盒组装以产生包括所述无瘢痕靶向基因修饰的所述靶向性载体,所述靶向基因修饰侧接有与所述经修饰靶向性载体中的所述上游末端序列重叠的上游末端序列和与所述经修饰靶向性载体中的所述下游末端序列重叠的下游末端序列,其中包括所述无瘢痕靶向基因修饰的所述靶向性载体中既不存在用于所述第一核酸酶试剂的所述第一靶位点,也不存在用于所述第二核酸酶试剂的所述第二靶位点。33.根据权利要求32所述的方法,其中所述缺失盒的长度为约1kb到约15kb。34.根据权利要求32或33所述的方法,其中所述5'同源臂和所述3'同源臂各自的长度为至少约35个核苷酸。35.根据权利要求34所述的方法,其中所述5'同源臂和所述3'同源臂各自的长度介于约35个核苷酸与约500个核苷酸之间。36.根据权利要求32到35中任一项所述的方法,其中所述缺失盒是线性双链核酸。37.根据权利要求32到36中任一项所述的方法,其中所述第一核酸酶试剂和/或所述第二核酸酶试剂是稀有切割核酸酶试剂。38.根据权利要求32到37中任一项所述的方法,其中所述预先存在的靶向性载体中不
存在所述第一靶位点和/或所述第二靶位点。39.根据权利要求32到38中任一项所述的方法,其中所述第一靶位点与所述第二靶位点相同,并且所述第一核酸酶试剂与所述第二核酸酶试剂相同。40.根据权利要求32到39中任一项所述的方法,其中所述第一核酸酶试剂和/或所述第二核酸酶试剂包括稀有切割限制酶。41.根据权利要求40所述的方法,其中所述稀有切割限制酶是noti、xmaiii、sstii、sall、nrui、nhei、nb.bbvci、bbvci、asci、asisi、fsei、paci、pmei、sbfi、sgrai、swai、bspqi、sapi、sfii、cspci、absi、ccini、fspai、maubi、mrei、mssi、palai、rgai、rigi、sdai、sfaai、sgfi、sgrdi、sgsi、smii、srfi、sse2321、sse83871、lgui、pcisi、aari、ajui、aloi、bari、ppii或psri。42.根据权利要求32到39中任一项所述的方法,其中所述第一核酸酶试剂和/或所述第二核酸酶试剂是成簇的规律间隔的短回文重复序列(crispr)相关(cas)蛋白和向导rna(grna)、锌指核酸酶(zfn)、转录激活子样效应子核酸酶(talen)或经工程化的大范围核酸酶。43.根据权利要求42所述的方法,其中所述第一核酸酶试剂和/或所述第二核酸酶试剂所述cas蛋白和所述grna,其中所述cas蛋白是cas9,并且其中所述grna包括靶向的crispr rna(crrna)和反式激活cripsr rna(tracrrna)。44.根据权利要求32到43中任一项所述的方法,其中所述选择盒赋予对抗生素的抗性。45.根据权利要求44所述的方法,其中所述选择盒赋予对氨苄青霉素、氯霉素、四环素、卡那霉素、大观霉素、链霉素、羧苄青霉素、博来霉素、红霉素或多粘菌素b的抗性。46.根据权利要求32到45中任一项所述的方法,其中所述预先存在的靶向性载体是长度为至少10kb的大靶向性载体。47.根据权利要求46所述的方法,其中所述预先存在的靶向性载体的长度为至少100kb。48.根据权利要求32到47中任一项所述的方法,其中所述预先存在的靶向性载体包括第二选择盒。49.根据权利要求48所述的方法,其中所述第二选择盒赋予对抗生素的抗性。50.根据权利要求49所述的方法,其中所述缺失盒中的所述选择盒和所述预先存在的靶向性载体中的所述第二选择盒各自赋予对不同抗生素的抗性。51.根据权利要求48到50中任一项所述的方法,其中所述第二选择盒允许在细菌细胞和哺乳动物细胞两者中进行选择。52.根据权利要求32到51中任一项所述的方法,其中所述修饰盒中的所述上游末端序列与所述经修饰靶向性载体中的所述上游末端序列之间的重叠长度和/或所述修饰盒中的所述下游末端序列与所述经修饰靶向性载体中的所述下游末端序列之间的重叠长度的长度为至少约20个核苷酸。53.根据权利要求32到52中任一项所述的方法,其中所述修饰盒中的所述上游末端序列与所述经修饰靶向性载体中的所述上游末端序列之间的重叠长度和/或所述修饰盒中的所述下游末端序列与所述经修饰靶向性载体中的所述下游末端序列之间的重叠长度的长度介于约20个核苷酸与约100个核苷酸之间。
54.根据权利要求32到53中任一项所述的方法,其中步骤(c)在体外发生。55.根据权利要求32到54中任一项所述的方法,其中步骤(d)包括:(i)使所述经切割靶向性载体和所述修饰盒与核酸外切酶接触,以暴露所述经修饰靶向性载体中的所述末端序列与所述修饰盒中的所述末端序列之间的互补序列;(ii)对所暴露的互补序列进行退火;(iii)延长经退火的互补序列的3'端;以及(iv)连接所述经退火的互补序列。56.根据权利要求55所述的方法,其中步骤(d)包括将所述经切割靶向性载体和所述修饰盒与核酸外切酶、dna聚合酶和dna连接酶一起温育。57.根据权利要求32到56中任一项所述的方法,其中所述修饰盒是线性双链核酸。58.根据权利要求32到57中任一项所述的方法,其中所述修饰盒的长度为至少约200个核苷酸。59.根据权利要求32到58中任一项所述的方法,其中所述修饰盒修饰盒为无法直接合成或通过聚合酶链式反应产生的大小。60.根据权利要求32到59中任一项所述的方法,其中所述修饰盒的长度为至少约10kb。61.根据权利要求32到60中任一项所述的方法,其中所述靶向基因修饰包括点突变、缺失、插入、置换或其组合。62.根据权利要求32到61中任一项所述的方法,其进一步包括:(e)在步骤(d)中的所述体外组装之后,用所述第一核酸酶试剂和所述第二核酸酶试剂处理所述靶向性载体,以验证既不存在用于所述第一核酸酶试剂的所述第一靶位点,也不存在用于所述第二核酸酶试剂的所述第二靶位点。
技术总结
提供了用于在预先存在的靶向性载体中引入无瘢痕靶向基因修饰的方法。所述方法可以使用细菌同源重组(BHR)和体外组装的组合,以无瘢痕方式将此类靶向基因修饰引入到预先存在的靶向性载体中。的靶向性载体中。的靶向性载体中。
技术研发人员:苏珊娜
受保护的技术使用者:瑞泽恩制药公司
技术研发日:2020.04.02
技术公布日:2021/12/14
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。