1.本发明属于功能食品加工技术领域,具体涉及一种无添加自稳定的亚麻籽鲜食植物乳的制备方法及应用。
背景技术:
2.随着食品生产技术不断升级、更新,消费者的健康意识与环保意识不断增强,新型食品不断涌现,植物性食品正在蓬勃发展,低饱和脂肪、低胆固醇和高蛋白的食品受到越来越多的关注,植物蛋白饮料就是在这一趋势下开发的新产品。作为新型饮料,其克服了动物蛋白饮料高饱和脂肪酸、高胆固醇的弊端,以健康天然的成分和独具特色的风味深受消费者喜爱和追捧,并逐渐在市场上崭露头角。目前食品加工行业中,植物代乳产品不仅被用作饮料,也逐渐被用作食品原料。
3.亚麻籽富含植物源n
‑
3系列唯一的必需多不饱和脂肪酸α
‑
亚麻酸(α
‑
linolenic acid,ala,约55%),在促进机体生长发育、维持机体免疫力、视力和神经功能正常等方面具有重要作用;其所富含的独特的天然植物胶
‑
亚麻籽胶(11.5g/100g),被证实具有降低糖尿病和心脏病相关的风险、促进肠道健康等多重生物活性;除此之外亚麻籽还富含蛋白质(18.6g/100g)、膳食纤维、亚麻木酚素(1g/100g)、甾醇、矿物质、维生素等营养成分和微量营养素,极具营养价值。综上所述,使用亚麻籽全籽制备植物蛋白饮料不仅可满足人们对健康生活的需要,还可在一定程度上缓解优质奶源紧张的趋势。
4.然而目前现有的亚麻籽植物蛋白饮料生产工艺一般需要脱壳、碾磨、高温蒸煮等过程,同时添加大量合成乳化剂、稳定剂、螯合剂、增稠剂,如单、双甘油脂肪酸酯、蔗糖脂肪酸酯、黄原胶等,不仅能耗颇高,还容易促使亚麻籽营养成分损失,进而无法充分体现亚麻籽饮料自身的营养价值;并且在加工过程中容易引起氧化劣变、引入外源有害物,不仅削弱营养价值,还可能引发食品安全问题。
5.因此,如何提供一种无需添加外源性添加剂、稳定性好、营养、美味的亚麻籽鲜食植物乳的制备方法是本领域亟待解决的问题。
技术实现要素:
6.本发明公开了一种无添加自稳定的亚麻籽鲜食植物乳的制备方法,其工艺简单,无需添加外源性添加剂即可维持产品稳定性,制备的亚麻籽鲜食植物乳安全、营养、美味,适于推广应用。
7.为了实现上述目的,本发明采用如下技术方案:
8.一种无添加自稳定的亚麻籽鲜食植物乳的制备方法,包括如下步骤:
9.(1)对亚麻籽原籽进行微波熟制预处理,得到熟制亚麻籽;
10.(2)对熟制亚麻籽进行浸泡、淋洗,脱除副产物亚麻籽胶;
11.(3)向经过脱胶处理的亚麻籽中加水,破碎提浆,得到亚麻籽植物乳;
12.(4)对亚麻籽植物乳进行过滤;
13.(5)对过滤后的亚麻籽植物乳进行超高压灭菌。
14.本发明在制备亚麻籽鲜食植物乳时,先对亚麻籽原籽进行微波处理,一方面可除去生亚麻籽含有的生氰糖苷等毒性物质和抗营养因子,保证产品的安全性和营养品质;另一方面与后续浸泡、淋洗、提浆工艺耦合,可在不额外添加乳化剂或稳定剂等外源性添加剂的基础上,通过亚麻籽自身内源多糖、蛋白质等胶体大分子实现植物乳的自稳定效果。
15.亚麻籽的种皮坚韧,外表覆盖胶质、纤维细胞等坚固致密保护层,会限制内源蛋白质、脂肪等营养素的溶出,熟制及浸泡处理相互配合,可影响胶质及纤维细胞的致密性,进而有利于后续提浆过程中营养素快速溶出,保证植物乳的自稳定性。
16.淋洗处理可将部分亚麻籽胶脱除,利于后续提浆过程中营养素快速溶出,利于维持植物乳稳定性,并且获得的副产物亚麻籽胶也具有良好的经济价值。
17.经过脱胶处理的亚麻籽加水,破碎提浆,使亚麻籽中的营养素高效溶出,一方面可保证亚麻籽植物乳自稳定体系的建立,另一方面有利于饮用者对营养素的充分吸收。
18.亚麻籽植物乳过滤后进行超高压灭菌,非热灭菌工艺降低了植物乳中热敏性营养素的损失,避免温度过高影响植物乳的风味口感,并且能够避免温度过高对植物乳自稳定体系的破坏。
19.综上,本发明省去脱壳、亚麻籽油精炼、微囊化等工序,在节能、环保的同时,保留大部分的α
‑
亚麻酸、蛋白、亚麻木酚素以及膳食纤维(如亚麻籽胶)等具有重要生物活性与保健功能的营养成分,各步骤相互配合,无需添加外源添加剂,依靠使亚麻籽胶等内源性稳定剂即可自稳定30天以上,可满足鲜食食品货架期,能为儿童、青少年、白领、老年人等具有特殊营养需求的人群提供较高营养价值与感官愉悦。
20.优选地,步骤(1)中,
21.微波熟制预处理的微波功率为700
‑
800w,微波时间为1
‑
8min。
22.相较于炒制、煮制等熟制处理方式,微波处理对于亚麻籽中蛋白质等能够维持植物乳自稳定性的物质破坏程度更小,在保证对生氰糖苷、抗vb6因子等毒性物质和抗营养因子的去除效果的同时,能够提高产品的储藏稳定性。
23.优选地,步骤(2)中,
24.使用水对熟制亚麻籽进行浸泡,浸泡时固液质量比为1:(3
‑
7),浸泡时间2
‑
24h。
25.熟制亚麻籽经过浸泡,细胞结构软化、组织疏松,能够降低提浆能耗和设备磨损,提高胶体的分散程度和悬浮性。
26.优选地,步骤(2)中,
27.淋洗时间5
‑
60s,淋洗流速为100
‑
200ml/s。
28.进一步优选地,淋洗时间为15
‑
60s。
29.提浆获得的亚麻籽植物乳中成分较为复杂,分散在水相中的油滴、固体颗粒、蛋白质和碳水化合物颗粒的沉降、沉淀、团聚、絮凝、上浮均会影响体系的稳定性;而淋洗步骤对于后续提浆获得的亚麻籽植物乳中成分组成及体系的稳定性具有重要影响;淋洗强度过大,亚麻籽胶等多糖大分子过度脱除,后续提浆步骤中易产生“桥接絮凝”,即较少的多糖链引起蛋白、油脂体等“串联”,从而破坏体系稳定性;若不进行淋洗处理,亚麻籽胶等多糖大分子保留量过多,后续提浆步骤中多糖溶解相与乳液其他相容易发生“排除絮凝”,进而影响体系稳定性;通过淋洗条件的控制,可以更好地维持亚麻籽植物乳的自稳定状态。
30.进一步优选地,淋洗时亚麻籽堆放厚度不超过2cm,便于定量脱胶。
31.优选地,步骤(3)中,
32.经过脱胶处理的亚麻籽与水的固液质量比为1:(1
‑
5);
33.破碎提浆为剪切破碎,剪切破碎功率为125
‑
1000w,时间为1
‑
3min。
34.适当的剪切破碎处理在保证营养素高效溶出的同时可提高体系稳定性;剪切破碎力度过大,油脂体结构破碎,会引起亚麻籽植物乳体系失稳;剪切破碎力度过小,营养素低效溶出,大量营养素保留在亚麻籽渣内,随过滤处理弃除,造成营养损失;通过剪切破碎条件的控制,可更好地维持亚麻籽植物乳的自稳定状态,保证亚麻籽营养素的充分利用。
35.优选地,可以采用胶体磨等其他方式进行破碎提浆处理。
36.优选地,步骤(4)中,
37.过滤目数为100
‑
200目。
38.过滤去除浆液中大颗粒物质,可使所得植物乳口感更加细腻。
39.优选地,步骤(5)中,
40.超高压灭菌前,对过滤后的亚麻籽植物乳进行分装。
41.优选地,所述分装包括罐装;
42.罐装容器包括玻璃瓶、塑料瓶、铝罐或马口铁罐。
43.优选地,步骤(5)中,
44.超高压灭菌压力为300
‑
600mpa,时间为10
‑
20min。
45.进一步优选地,亚麻籽微波处理条件为720w、6min;亚麻籽浸泡处理固液质量比为1:7,浸泡2h;淋洗时间为36s,淋洗流速为170ml/s;提浆处理亚麻籽与水的添加质量比为1:3,剪切破碎功率1000w,时间1
‑
3min;过滤过100/200目筛;超高压灭菌条件为400mpa,10
‑
20min。
46.上述无添加自稳定的亚麻籽鲜食植物乳的制备方法可应用于食品加工。
47.综上所述,本发明熟制、浸泡、淋洗、破碎提浆、过滤、超高压灭菌步骤环环相扣,协同促进亚麻籽植物乳的自稳定性,并保证亚麻籽植物乳的安全性、营养价值及口感;制得的无添加自稳定鲜食亚麻籽植物乳粒径均匀,外观稳定,具有坚果香气,在无任何外源添加剂帮助下可稳定于4℃储藏超过30天,物理、化学稳定性均良好。
附图说明
48.图1所示为微波、炒制处理的亚麻籽植物乳及生亚麻籽植物乳粒径分布。
49.图2所示为煮制处理的亚麻籽植物乳粒径分布。
50.图3所示为微波、炒制处理的亚麻籽植物乳及生亚麻籽植物乳初始外观图。
51.图4所示为微波、炒制处理的亚麻籽植物乳及生亚麻籽植物乳储藏一周外观图。
52.图5所示为煮制处理的亚麻籽植物乳储藏一周外观图;
53.z1.5、z3分别剪切破碎1.5、3min。
54.图6所示为各组亚麻籽植物乳tem图;
55.其中,(a)为微波处理的亚麻籽组;(b)为炒制亚麻籽组;(c)为生亚麻籽(亚麻籽原籽)组。
56.图7所示为各组亚麻籽植物乳风味物质图;
57.其中,(a)为微波处理的亚麻籽组;(b)为炒制亚麻籽组;(c)为生亚麻籽(亚麻籽原籽)组。
58.图8所示为不同脱胶工艺对各组亚麻籽植物乳的外观影响;
59.其中,(a)为轻度脱胶组;左图为初始外观,右图为储藏4天后外观;
60.(b)为适度脱胶组;左图为初始外观,右图为储藏4天后外观;
61.(c)完全脱胶组;左图为初始外观,中图为储藏4天后外观;右图为中图局部放大图。
62.图9所示为不同脱胶工艺对各组亚麻籽植物乳粒径分布影响。
63.图10所示为不同淋洗时间对脱胶效果的影响。
64.图11所示为不同淋洗时间对亚麻籽植物乳粒径分布的影响。
65.图12所示为不同淋洗时间对亚麻籽植物乳ζ电位的影响。
66.图13所示为不同淋洗时间对亚麻籽植物乳tsi的影响。
67.图14所示为不同提浆工艺对各组亚麻籽植物乳外观的影响;
68.其中,左图为初始外观,图中由左至右依次为剪切破碎1.5、3、4.5、6min组;
69.左图为储藏15天后外观,图中由左至右依次为剪切破碎1.5、3、4.5、6min组。
70.图15所示为不同提浆工艺对各组亚麻籽植物乳粒径分布的影响。
71.图16所示为不同提浆时间对各组亚麻籽植物乳外观、粒径分布及tsi指数的影响;
72.其中,(a)为初始外观;
73.(b)为储藏21天外观;
74.(c)为100目过滤储藏前后粒径变化;
75.(d)为200目过滤储藏前后粒径变化。
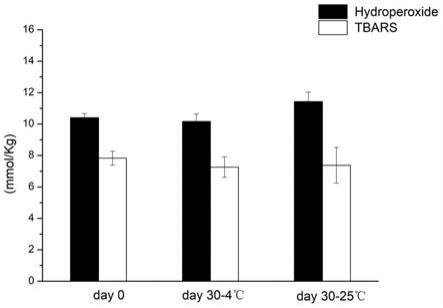
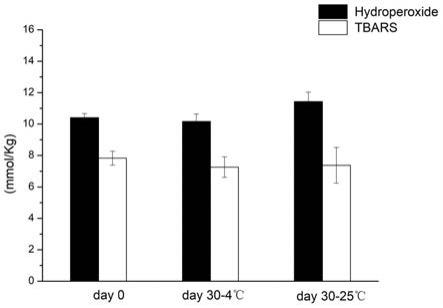
76.图17所示为亚麻籽植物乳储藏前后初次级氧化产物含量变化。
77.图18所示为不同灭菌处理对亚麻籽植物乳外观的影响;
78.其中,(a)为高温高压灭菌后亚麻籽植物乳外观;
79.(b)为巴氏灭菌后亚麻籽植物乳外观;
80.(c)左图为亚麻籽植物乳灭菌前外观,右图为超高压灭菌后亚麻籽植物乳外观。
81.图19所示为超高压灭菌前后亚麻籽植物乳粒径分布。
82.图20所示为超高压灭菌前后亚麻籽植物tsi指数变化。
具体实施方式
83.下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
84.实施例1亚麻籽熟制预处理工艺研究
85.亚麻籽的微波熟制预处理工艺对亚麻籽植物乳稳定性至关重要,不可缺少;缺失微波熟制工艺,则无法符合亚麻籽熟制脱氰的安全加工要求,本发明微波处理工艺在除去氰化物、保证安全性的同时,与后续浸泡、淋洗、剪切破碎工艺耦合,可实现自稳定效果;并且若将其替换为炒制、煮制等熟制工艺,对亚麻籽中蛋白质等物质破坏严重,即使耦合后续
浸泡、淋洗、剪切破碎工艺,也无法实现自稳定亚麻籽植物乳的制备。
86.1.材料与试剂
87.亚麻籽
‑‑
甘肃张掖张亚2号;其他试剂购自国药集团化学试剂有限公司。
88.2.主要仪器与设备
89.密闭式微波快速萃取系统
‑‑
美国cem公司;马尔文3000激光粒度分析仪
‑‑
英国马尔文仪器公司;马尔文纳米粒径分析仪
‑‑
英国马尔文仪器公司;气相色谱仪与质谱仪联用agilent7890a
‑
5975c
‑‑
美国安捷伦公司。
90.3.实验方法及结果
91.(1)亚麻籽的熟制
92.选择新鲜、干燥、无腐烂变质的亚麻籽,进行如下熟制处理:
93.微波熟制使用密闭式微波消解仪(密闭式微波快速萃取系统),在720w功率下微波6min,获得微波熟制亚麻籽;
94.炒制工艺使用炒籽机于180℃炒制45min,获得炒制亚麻籽;
95.煮制工艺为100℃,时间为8min,获得煮制亚麻籽;
96.并设置不进行熟制处理的生亚麻籽对照组。
97.(2)浸泡洗胶
98.将各组熟制亚麻籽以及生亚麻籽分别按照1:7的固液质量比使用纯水室温浸泡2h,并对亚麻籽进行30s淋洗。
99.(3)提浆
100.将各组浸泡洗胶处理后的亚麻籽与纯水按1:3质量比混合,进行剪切破碎,功率为1000w,分别处理1.5、3min,所得浆液用200目筛过滤,得到亚麻籽植物乳。
101.(4)微波熟制亚麻籽营养素与生氰糖苷检测
102.传统熟制方式如炒制、煮制等已被前期研究者证实可实现亚麻籽脱毒,因此本实验参照gb 5009.6
‑
2016、gb 5009.5
‑
2016、gb 5009.88
‑
20142.2等对步骤(1)制得的微波熟制亚麻籽中营养素及生氰糖苷进行检测,结果如表1所示,微波亚麻籽营养成分丰富,富含蛋白质、油脂、矿质元素等,同时其氰化物已低于检出定量限。
103.表1.亚麻籽微波后营养素与氰化物含量
104.微波亚麻籽含量(/100g)蛋白质(g)23.8
±
0.02脂肪(g)25.2
±
0.07水分(g)3.83
±
0.06灰分(g)3.9
±
0.01钙(mg)1.92*102±
4.55锌(mg)3.39
±
0.30硒(μg)9.01
±
0.02钠(mg)72.80
±
1.44锰(mg)3.28
±
0.16氰化物(hcn)nd
105.(5)亚麻籽植物乳的粒径分布
106.利用激光粒度分析仪通过激光衍射技术确定各组亚麻籽植物乳的粒径分布情况。测定参数:使用湿分散法分析,样品折射率为1.480,水的折光率为1.330,搅拌速率为2000rpm/min,测试温度为25℃。
107.结果如图1、2所示,煮制、炒制处理的亚麻籽植物乳(剪切破碎3min)的粒径分布出现典型的宽峰分布,表明内部液滴出现絮凝现象;相比之下,微波熟制处理的亚麻籽植物乳的粒径分布表现出微波工艺对植物乳自稳定体系的优越性。
108.(6)亚麻籽植物乳的外观检测
109.使用高分辨率相机对各组植物乳制备后及储藏1周后的外观进行拍摄记录。
110.如图3
‑
5所示,亚麻籽熟制工艺对亚麻籽植物乳的稳定性影响较大;其中,炒制处理的亚麻籽植物乳仅储藏1周就出现典型的油
‑
水分离现象,且有黑褐色沉淀生成;煮制处理的亚麻籽植物乳储藏1周也出现了絮凝现象;而微波处理的亚麻籽植物乳储藏1周后外观与初始外观无差异。
111.(7)亚麻籽植物乳的电镜检测
112.对各组亚麻籽植物乳进行电镜检测,结果如图6所示,与生亚麻籽对比,微波与炒制工艺均对亚麻籽植物细胞内部结构产生影响,细胞内单层囊泡膜部分或全部消失,从tem图中发现,微波比炒制工艺对亚麻籽植物细胞结构破坏更严重。
113.(8)亚麻籽植物乳香气成分分析
114.采用顶空固相微萃取法从植物乳上方顶空提取挥发性化合物。采用气相色谱
‑
质谱联用技术(agilent 7890a
‑
5975c),hp
‑
5ms柱(60m
×
0.25mm
×
0.25μm,agilent technologies,目录号122
‑
5532)测定挥发物的种类和浓度。入口温度设置为250℃,离子源温度设置为230℃,界面温度设置为280℃。载气流量为1.5ml/min。过程中使用的温度斜坡为:保持在40℃2min;加热至200℃,4℃/min;保持在200℃2min;然后加热到280℃,8℃/min。注射体积设为1μl。质谱仪在150℃和70ev电压的冲击模式下工作。质谱仪扫描范围40
‑
400amu,溶剂延迟7min。单个化合物通过ms
‑
library搜索(wiley138k,john wiley and sons,hewlett packard,usa)进行鉴定和量化。
115.通过顶空固相微萃取
‑
气相色谱
‑
质谱联用技术分析植物乳中挥发性风味化合物,结果如图7、表2所示,炒制亚麻籽植物乳具有“化学制品、霉味”,而微波亚麻籽植物乳具有“果味、甜味”等适合作为饮料风味的香甜风味分子,更适合作为亚麻籽植物乳的熟制工艺。煮制亚麻籽植物乳风味和稳定性不佳,未做香气成分分析。
116.表2.熟制工艺对亚麻籽饮料植物乳香气成分影响
[0117][0118][0119]
实施例2亚麻籽淋洗脱胶工艺研究
[0120]
亚麻籽种皮中富含丰富的亚麻籽胶等膳食纤维,为天然的乳化稳定剂,但是胶体大分子的浓度本身对植物乳体系的稳定性会产生较大影响,如:亚麻籽胶大分子浓度过低,易产生“桥接絮凝”,较少的多糖链可能引起蛋白、油脂体等“串联”,从而破坏体系稳定性;
当亚麻籽胶过多时,多糖溶解相与乳液其他相发生“排除絮凝”。因此,为获得良好的亚麻籽自稳定体系,其淋洗脱胶工艺十分重要。淋洗条件不当,可因为亚麻籽胶等多糖大分子浓度过低引起“桥接絮凝”,或由于亚麻籽胶等多糖大分子浓度过高而引起“排除絮凝”,无法实现自稳定体系的构建;淋洗工艺也与前一步骤微波及后续步骤产生协同工艺效果,如果改用其他淋洗脱胶工艺,无法实现亚麻籽植物乳自稳定效果。
[0121]
1.材料与试剂
[0122]
亚麻籽
‑‑
甘肃张掖张亚2号;其他试剂购自国药集团化学试剂有限公司。
[0123]
2.主要仪器与设备
[0124]
密闭式微波快速萃取系统
‑‑
美国cem公司;马尔文3000激光粒度分析仪
‑‑
英国马尔文仪器公司;马尔文纳米粒径分析仪
‑‑
英国马尔文仪器公司。
[0125]
3.实验方法及结果
[0126]
(1)亚麻籽植物乳制备
[0127]
亚麻籽的熟制:选择新鲜、干燥、无腐烂变质的亚麻籽,使用密闭式微波消解仪,在720w功率下微波6min,获得微波熟制亚麻籽;
[0128]
并设置不进行熟制处理的生亚麻籽对照组;
[0129]
浸泡淋洗:将熟制亚麻籽按照1:7的固液质量比使用纯水室温浸泡2h后捞出,进行脱胶处理(轻度脱胶组:淋洗时间2s;重度脱胶组:脱壳亚麻籽仁,完全脱去附着于壳上的亚麻籽胶;适度脱胶组:淋洗时间36s),淋洗流速为160ml/s,淋洗时堆放厚度不超过1cm;
[0130]
提浆:淋洗脱胶后的亚麻籽按固液质量比1:3加纯水,剪切破碎,剪切破碎功率为1000w,时间分别为3min;
[0131]
过滤:所得浆液用100或200目筛过滤,得到亚麻籽植物乳。
[0132]
(2)亚麻籽植物乳外观及粒径分布
[0133]
使用高分辨率相机对各组植物乳制备后及储藏4天后的外观进行拍摄记录。
[0134]
各组亚麻籽植物乳外观稳定性结果如图8所示,在储藏仅4天就可体现出稳定性差异,图(a)中轻度脱胶亚麻籽植物乳在储藏4天出现明显分层现象,图(b)显示适度脱胶亚麻籽植物乳储藏4天前后对比不明显,植物乳仍保持较稳定状态,图(c)显示完全脱胶亚麻籽植物乳在储藏4天后出现明显沉淀。
[0135]
利用激光粒度分析仪通过激光衍射技术确定亚麻籽植物乳的粒径分布情况。测定参数:使用湿分散法分析,样品折射率为1.480,水的折光率为1.330,搅拌速率为2000rpm/min,测试温度为25℃。
[0136]
三种植物乳的粒径分布分析如图9所示,脱胶不充分的植物乳粒径分布峰型较宽,而适度脱胶植物乳粒径分布较均匀。
[0137]
(3)亚麻籽脱胶量化与植物乳微观分析实验
[0138]
称取亚麻籽干籽50g,以1:7加入去离子水,浸泡2h后捞出,分别淋洗0s,5s,15s,30s,60s,120s,淋洗流速为160ml/s,堆放高度不超过1cm。
[0139]
1)称取亚麻籽(湿重5g)按固液比1:15加入去离子水,于75℃恒温水浴搅拌提取2h,离心(4200r/min,15min),在上清液中加入3倍体积的无水乙醇,沉淀3h后离心(4200r/min,15min)过夜,所得沉淀在105℃烘干恒重。结果如图10所示,淋洗时间延长可以有效降低亚麻籽中亚麻籽胶含量。
[0140]
2)将不同淋洗时间所得亚麻籽按固液质量比1:3加纯水,剪切破碎,剪切破碎功率为1000w,时间为3min;所得浆液用200目筛过滤,得到亚麻籽植物乳。
[0141]
利用激光粒度分析仪通过激光衍射技术确定亚麻籽植物乳的粒径分布情况。测定参数:使用湿分散法分析,样品折射率为1.480,水的折光率为1.330,搅拌速率为2000rpm/min,测试温度为25℃。结果如图11所示,淋洗时间延长,亚麻籽植物乳的粒径略有下降。
[0142]
将乳液以1:250的比例使用去离子水进行稀释,使用马尔文纳米粒径分析仪测定在不同复配比条件下乳液的ζ电位。图12显示淋洗时间延长降低了亚麻籽植物乳的电位绝对值;
[0143]
用激光衍射扫描测定植物乳的相分离稳定性,该设备由一个装有近红外光源(880nm)的探测头组成,该探测头扫描样品的高度,每40μm采集一次传输和后向散射数据。光源从上到下每隔30秒扫描样品,并测量在25℃下15分钟内光背散射或透射的百分比。使用turbisoft 2.1软件计算的tsi(turbiscan stability index)参数评估植物乳的稳定性。结果如图13所示,亚麻籽淋洗0s、5s和120s所制备的亚麻籽植物乳tsi值略高于剩余四组,显示其稳定性相比较而言有所降低,由此可以得到初步得到结论:亚麻籽冲洗时间在15
‑
60s之间比较合适。
[0144]
实施例3亚麻籽提浆工艺研究
[0145]
亚麻籽种皮坚韧,覆盖胶质、纤维细胞等致密的保护层,为了提高亚麻籽内的蛋白质、脂肪等营养素溶出,同时不破坏其自稳定体系,应对提浆工艺即亚麻籽剪切破碎程度进行严格把控。提浆工艺控制不当,有可能因为营养素的低效溶出引起亚麻籽植物乳营养价值下降,或由于提浆工艺能量过于密集,引起油脂体结构的破碎,从而破坏亚麻籽植物乳自稳定体系,因此适度剪切提浆工艺也处在整条加工工艺链条中不可缺少或替换的位置,过度加工易导致植物乳絮凝沉淀失稳,加工不足易导致亚麻籽中营养素溶出不足。
[0146]
1.材料与试剂
[0147]
亚麻籽
‑‑
甘肃张掖张亚2号;其他试剂购自国药集团化学试剂有限公司。
[0148]
2.主要仪器与设备
[0149]
密闭式微波快速萃取系统
‑‑
美国cem公司;马尔文3000激光粒度分析仪
‑‑
英国马尔文仪器公司;马尔文纳米粒径分析仪
‑‑
英国马尔文仪器公司;turbiscan ma2000
‑‑
formulaction公司。
[0150]
3.实验方法及结果
[0151]
(1)亚麻籽植物乳制备
[0152]
亚麻籽的熟制:选择新鲜、干燥、无腐烂变质的亚麻籽,使用密闭式微波消解仪,在720w功率下微波6min,获得微波熟制亚麻籽;
[0153]
浸泡淋洗:将熟制亚麻籽按照1:7的固液质量比使用纯水室温浸泡2h,淋洗36s,淋洗流速为167ml/s;
[0154]
提浆:淋洗脱胶后的亚麻籽按固液质量比1:3加纯水,剪切破碎,剪切破碎功率为1000w,时间为1
‑
6min;
[0155]
过滤:所得浆液用100或200目筛过滤,得到亚麻籽植物乳。
[0156]
(2)亚麻籽植物乳的外观、粒径分布及重力分离分析
[0157]
使用高分辨率相机对各组植物乳制备后及储藏15天后的外观进行拍摄记录。
[0158]
利用激光粒度分析仪通过激光衍射技术确定各组亚麻籽植物乳的粒径分布情况。测定参数:使用湿分散法分析,样品折射率为1.480,水的折光率为1.330,搅拌速率为2000rpm/min,测试温度为25℃。
[0159]
如图14、15所示,当1000w功率提浆时间>3min时,储藏2周即出现明显絮凝。当提浆工艺能量不足,会引起亚麻籽中含有的营养素如蛋白质、油脂、碳水化合物等无法充分溶出于水环境中;而当提浆工艺能量过剩,可引起亚麻籽植物乳中漂浮的油脂体等亚细胞结构单元发生破坏,降低体系稳定性,同时根据斯托克斯定律可知,当油水两相密度差过大时,更易引起植物乳两相分离,发生漂浮或沉淀现象。
[0160]
因此,为获得良好的亚麻籽自稳定体系,将其剪切破碎提浆时间保持在1
‑
3min后继续研究,用激光衍射扫描测定植物乳的相分离稳定性,该设备由一个装有近红外光源(880nm)的探测头组成,该探测头扫描样品的高度,每40μm采集一次传输和后向散射数据。光源从上到下每隔30秒扫描样品,并测量在25℃下15分钟内光背散射或透射的百分比。使用turbisoft 2.1软件计算的tsi(turbiscan stability index)参数评估植物乳的稳定性。
[0161]
结果如表3和图16所示,使用1000w功率1,2,3min制备的亚麻籽植物乳均比较稳定,在储藏21天后,亚麻籽植物乳的粒径分布改变不大,未出现明显分层现象,tsi值显示植物乳仍保持较稳定状态。
[0162]
表3.剪切破碎时间对亚麻籽植物乳粒径的影响
[0163][0164]
(3)氧化稳定性测试
[0165]
将1000w、3min剪切破碎200目过滤所得植物乳分别在4℃和室温约25℃储藏30天,并按照下述方法分别测定植物乳的初次级氧化产物。
[0166]
氢过氧化物:采用紫外分光光度计法对乳液体系中氢过氧化物含量进行测定(kiralan,et al.,2014)。具体方法如下:0.3ml乳液与1.5ml破乳剂(异辛烷:异丙醇=3:1)混合,涡旋振荡10s,重复3次,每次间隔20s进行乳液破乳,5000rpm离心10min获得油相。取200μm上层有机相于10ml离心管中,并加入2.8ml甲醇/丁醇(2:1)混合液,紧接着加入30μlfe
2
和3.14m硫氰酸铵(1:1)混合液,振荡均匀,暗反应20min后在510nm波长下使用紫外分光光度计测定吸光度。使用过氧化氢异丙苯制备标准溶液绘制标准曲线,单位为mmol/kg
油。
[0167]
fe
2
:使用0.132m bacl2(0.4m hcl配制)和0.144m feso41:1混合,5000rpm下离心5min获得。
[0168]
tbars:采用紫外分光光度计对乳液体系中的丙二醛含量进行测定。具体方法如下:在耐高温螺盖玻璃皂化管中加入1ml乳液并与2ml tba试剂混合,振荡均匀,沸水浴15min,冷却至室温,5000rpm离心15min,在532nm波长下使用紫外分光光度计测定吸光度。使用1,1,3,3
‑
四乙氧基丙烷配置标准溶液绘制标准曲线,单位为mmol tep/kg油。
[0169]
结果如图17所示,亚麻籽植物乳初始氢过氧化氢值10.40
±
0.26mmol/kg oil,tbars值7.83
±
0.44mmol/kg oil;4℃储藏1个月后氢过氧化氢值10.16
±
0.48mmol/kg oil,tbars值7.27
±
0.65mmol/kg oil;25℃储藏1个月后氢过氧化氢值11.43
±
0.60mmol/kg oil,tbars值7.38
±
1.13mmol/kg oil,亚麻籽植物乳初次级氧化产物储藏前后无显著性差异。
[0170]
(4)营养素含量检测
[0171]
对1000w,1、3min剪切破碎200目过滤所得植物乳营养素含量进行测定,结果如表4所示,当亚麻籽提浆时间较低时,自稳定性较高,但不利于其中营养素的溶出,随着亚麻籽植物乳剪切破碎时间的延长,其固形物含量、蛋白质等指标显著提高,该结果表明在1000w、3min这一工艺下所得亚麻籽植物乳既保持自稳定性,又兼具较好营养性。
[0172]
表4.不同剪切破碎时间对亚麻籽植物乳营养素含量的影响
[0173][0174]
实施例4
[0175]
亚麻籽植物乳富含蛋白质、ala、酚酸等营养成分,如果不进行灭菌,将很容易滋生有害菌,破坏产品质量;但传统高温灭菌方法容易破坏乳化特性中蛋白质的性质,使其失去稳定性,进而影响亚麻籽植物乳稳定性;本发明在熟制、浸泡、淋洗、剪切破碎、过滤处理后耦合超高压灭菌工艺,一方面可满足植物乳微生物安全标准,同时避免使用常规热灭菌技术,由于过热处理引起植物乳自稳定体系彻底破坏的问题;上述超高压非热灭菌工艺同样不可缺少且不可替换,当前序工艺全部一致,使用其他热灭菌方式并无法维持甚至进一步提高其亚麻籽植物乳的自稳定性。
[0176]
1.材料与试剂
[0177]
亚麻籽
‑‑
甘肃张掖张亚2号;其他试剂购自国药集团化学试剂有限公司。
[0178]
2.主要仪器与设备
[0179]
密闭式微波快速萃取系统
‑‑
美国cem公司;马尔文3000激光粒度分析仪
‑‑
英国马尔文仪器公司;马尔文纳米粒径分析仪
‑‑
英国马尔文仪器公司;turbiscan ma2000
‑‑
formulaction公司;高温高压灭菌锅,超高压仪,恒温水浴锅,菌落计数器,培养箱,显微镜等微生物检测常用仪器。
[0180]
3.实验方法及结果
[0181]
(1)亚麻籽植物乳制备
[0182]
亚麻籽的熟制:选择新鲜、干燥、无腐烂变质的亚麻籽,使用密闭式微波消解仪,在720w功率下微波6min,获得微波熟制亚麻籽;
[0183]
浸泡淋洗:将熟制亚麻籽按照1:7的固液质量比使用纯水室温浸泡2h,堆放厚度约1cm,淋洗36s,淋洗流速为167ml/s;
[0184]
提浆:淋洗脱胶后的亚麻籽按固液质量比1:3加纯水,剪切破碎,剪切破碎功率为1000w,时间为1
‑
6min;
[0185]
过滤:所得浆液用100或200目筛过滤,得到亚麻籽植物乳。
[0186]
按固液比1:3将适度亚麻籽与进行剪切破碎提浆,功率为1000w,时间为3min,过滤目数为200目。
[0187]
灭菌:对亚麻籽植物乳分别进行净水超高压灭菌(400mpa,10
‑
20min)、高温高压灭菌(121℃,30min)、低温长时巴氏灭菌(65℃,30min)。
[0188]
(2)亚麻籽植物乳的外观
[0189]
使用高分辨率相机对各组植物乳外观进行拍摄记录。
[0190]
结果如图18所示,高温高压、巴氏灭菌明显破坏了亚麻籽植物乳的自稳定体系,而亚麻籽植物乳经过超高压灭菌后并未出现破乳、沉淀、絮凝等现象。
[0191]
(3)亚麻籽植物乳的粒径分布
[0192]
利用激光粒度分析仪通过激光衍射技术确定超高压灭菌亚麻籽植物乳的粒径分布情况。测定参数:使用湿分散法分析,样品折射率为1.480,水的折光率为1.330,搅拌速率为2000rpm/min,测试温度为25℃。
[0193]
结果如图19所示,超高压灭菌可有效地保持,甚至改善了亚麻籽植物乳的自稳定体系。
[0194]
(4)亚麻籽植物乳的重力分离分析
[0195]
用激光衍射扫描测定了植物乳的相分离稳定性。该设备由一个装有近红外光源(880nm)的探测头组成,该探测头扫描样品的高度,每40μm采集一次传输和后向散射数据。光源从上到下每隔30秒扫描样品,并测量在25℃下15分钟内光背散射或透射的百分比。使用turbisoft2.1软件计算的tsi(turbiscan stability index)参数评估植物乳的稳定性。
[0196]
结果如图20所示,tsi数据显示超高压灭菌可有效地保持,甚至改善了亚麻籽植物乳的自稳定体系。
[0197]
(5)亚麻籽的灭菌实验
[0198]
按照国标方法对各组菌落总数gb 4789.2—2016、大肠菌群gb 4789.3—2016、霉菌和酵母gb 4789.15—2016进行检测。
[0199]
如表5所示,植物乳中菌落总数、大肠菌群、霉菌和酵母等需达到安全限量范围,超高压工艺对亚麻籽植物乳的微生物杀灭情况初步达到了鲜食饮料的安全标准,因此本发明中所用超高压灭菌工艺耦合上述亚麻籽熟制处理工艺、适度脱胶工艺、高效提浆工艺,各步骤环环相扣,共同产生了显著的工艺优越性,即形成一种无需任何外源添加稳定剂即可形成自稳定的亚麻籽植物乳。
[0200]
表5.灭菌工艺对亚麻籽饮料植物乳微生物指标影响
[0201][0202]
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。
[0203]
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对上述实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。