1.本发明涉及药材提取技术领域,具体地,本发明涉及珠芽蓼根茎、茎叶、果实提取物 及其制备方法和应用。
背景技术:
2.酶抑制剂是指能对酶的某些基团起作用,降低酶的活性或使酶完全失活,从而获得某 种疗效的物质。α
‑
葡萄糖苷酶抑制剂可以抑制小肠上皮细胞中α
‑
葡萄糖苷酶的活性,减缓 食物中低聚糖水解为葡萄糖的速度,减少小肠上皮细胞对葡萄糖的吸收,达到降血糖、治 疗糖尿病的目的。酪氨酸酶抑制剂可以抑制黑色素细胞中酪氨酸酶的活性,减少多巴色素 合成,使肌肤黑色素沉积减少,从而达到美白的效果。
3.随着空气污染日益严重,环境中的自由基不断增加。当人体中自由基达到一定数量时 会失去控制,对人体细胞、关键酶造成损害,导致机体老化。因此自由基清除剂可以通过 清除体内多余的自由基达到抗衰老的目的。
4.珠芽蓼属于蓼科(polygonaceae)蓼属(polygonum l.),是传统藏药。目前有关珠芽蓼用途 研究的文献鲜少,以临床治疗腹泻的案例居多,还有几篇抗氧化作用的研究报道。因此, 开发珠芽蓼提取物的提取制备和分析鉴定方法,并挖掘其新用途,填补用途研究的空白, 是本领域亟需解决的问题。
技术实现要素:
5.本发明旨在至少在一定程度上解决相关技术中的技术问题之一。为此,本发明提供一 种珠芽蓼提取物的制备方法,利用该方法制备出的珠芽蓼根茎、茎叶、果实提取物具有抑 制α
‑
葡萄糖苷酶、酪氨酸酶活性以及清除abts自由基的作用,在降糖、抑制黑色素合成 和抗氧化方面具有广阔的开发潜力。
6.为此,本发明第一方面提供一种珠芽蓼提取物的制备方法。根据本发明的实施例,所 述制备方法包括:
7.(1)对珠芽蓼药材进行粉碎处理,以便获得待萃取药材粉末;
8.(2)利用基质固相分散萃取(mspd)所述待萃取药材粉末,其中,以ods为填料, 采用甲醇溶液对所述待萃取药材粉末进行多次萃取处理,每次萃取处理所采用的甲醇溶液 中甲醇的体积百分比均高于前一次萃取处理所采用的甲醇溶液中甲醇的体积百分比;
9.(3)分别收集采用不同甲醇体积百分比的甲醇溶液进行洗脱得到的洗脱液。
10.本发明提供一种珠芽蓼提取物的制备方法,在特定的条件下,对上样后的基质固相萃 取柱依次使用不同体积百分比梯度的甲醇水溶液进行洗脱,获得不同体积百分比梯度甲醇 的洗脱液,以便制备珠芽蓼提取物,利用该方法制备出的珠芽蓼提取物具有抑制α
‑
葡萄糖 苷酶、酪氨酸酶活性以及清除abts自由基的作用。
11.根据本发明的实施例,所述珠芽蓼提取物的制备方法还包括以下附加技术特征的至少 之一:
12.根据本发明的实施例,所述甲醇溶液为甲醇水溶液或纯甲醇。
13.根据本发明的实施例,所述甲醇溶液中甲醇的体积百分比为15%~100%。
14.采用15%~100%甲醇溶液对所述待萃取药材粉末进行萃取处理,获得的含有特定组分 和组分含量的珠芽蓼提取物具有抑制α
‑
葡萄糖苷酶、酪氨酸酶活性以及清除abts自由基 的作用。
15.根据本发明的实施例,所述珠芽蓼药材包括珠芽蓼根茎、珠芽蓼茎叶、珠芽蓼果实。
16.根据本发明的实施例,在步骤(2)中,所述基质固相分散萃取中采用的填料为经活化 的ods(ods表示十八烷基硅烷键合硅胶)。
17.根据本发明的实施例,在步骤(2)中,所述经活化的ods与所述珠芽蓼药材的质量 比为(1.0
‑
5.0):(0.5
‑
3.0)。
18.根据本发明的实施例,所述步骤(2)进一步包括:依次采用15%甲醇溶液、60%甲醇 溶液、100%甲醇对所述待萃取药材粉末进行萃取处理。
19.分别采用15%甲醇溶液、60%甲醇溶液、100%甲醇对所述待萃取药材粉末进行萃取处 理,获得含有特定组分和组分含量的珠芽蓼提取物,其中的有效组分活性也较高,珠芽蓼 提取物具有较好的抑制α
‑
葡萄糖苷酶、酪氨酸酶活性以及清除abts自由基的作用。
20.根据本发明的实施例,进行所述萃取时,所述甲醇溶液的流速为36~50bv/h。
21.根据本发明的实施例,所述甲醇溶液洗脱体积至少为5bv。
22.甲醇溶液洗脱体积在5bv以上,能够将待萃取药材粉末中的有效成分充分萃取出来, 获得的含有特定组分和组分含量的珠芽蓼提取物具有抑制α
‑
葡萄糖苷酶、酪氨酸酶活性以 及清除abts自由基的作用。
23.根据本发明的实施例,所述步骤(3)进一步包括:
24.对所述洗脱液进行浓缩、冻干处理,以便获得不同体积百分比的甲醇溶液洗脱干物质。
25.根据本发明的实施例,所述不同体积百分比的甲醇溶液洗脱干物质选自珠芽蓼根茎的 15%甲醇溶液洗脱干物质、珠芽蓼根茎的60%甲醇溶液洗脱干物质、珠芽蓼根茎的100%甲 醇溶液洗脱干物质、珠芽蓼茎叶的15%甲醇溶液洗脱干物质、珠芽蓼茎叶的60%甲醇溶液 洗脱干物质、珠芽蓼茎叶的100%甲醇溶液洗脱干物质、珠芽蓼果实的15%甲醇溶液洗脱干 物质、珠芽蓼果实的60%甲醇溶液洗脱干物质、珠芽蓼果实的100%甲醇溶液洗脱干物质中 的至少之一。
26.按以下方式处理各洗脱液:
27.将采用15%甲醇溶液对珠芽蓼根茎的粉末进行洗脱得到的洗脱液进行浓缩并冻干,得 珠芽蓼根茎的15%甲醇溶液洗脱干物质。将采用60%甲醇溶液对珠芽蓼根茎的粉末进行洗 脱得到的洗脱液进行浓缩并冻干,得珠芽蓼根茎的0%甲醇溶液洗脱干物质。将采用100% 甲醇溶液对珠芽蓼根茎的粉末进行洗脱得到的洗脱液进行浓缩并冻干,得珠芽蓼根茎的100% 甲醇洗脱干物质。
28.将采用15%甲醇溶液对珠芽蓼茎叶的粉末进行洗脱得到的洗脱液进行浓缩并冻干,得 珠芽蓼茎叶的15%甲醇溶液洗脱干物质。将采用60%甲醇溶液对珠芽蓼茎叶的粉末进行洗 脱得到的洗脱液进行浓缩并冻干,得珠芽蓼茎叶的60%甲醇溶液洗脱干物质。将采
用100% 甲醇溶液对珠芽蓼茎叶的粉末进行洗脱得到的洗脱液进行浓缩并冻干,得珠芽蓼茎叶的100% 甲醇溶液洗脱干物质。
29.将采用15%甲醇溶液对珠芽蓼果实的粉末进行洗脱得到的洗脱液进行浓缩并冻干,得 珠芽蓼果实的15%甲醇溶液洗脱干物质。将采用60%甲醇溶液对珠芽蓼果实的粉末进行洗 脱得到的洗脱液进行浓缩并冻干,得珠芽蓼果实的60%甲醇溶液洗脱干物质。将采用100% 甲醇溶液对珠芽蓼果实的粉末进行洗脱得到的洗脱液进行浓缩并冻干,得珠芽蓼果实的100% 甲醇溶液洗脱干物质。
30.本发明第二方面提供一种珠芽蓼根茎提取物。根据本发明的实施例,所述珠芽蓼根茎 提取物由第一方面所述的制备方法制备获得。
31.根据本发明的实施例,所述珠芽蓼根茎提取物包括珠芽蓼根茎的60%甲醇溶液洗脱干 物质。
32.根据本发明的实施例,所述珠芽蓼根茎的60%甲醇溶液洗脱干物质包括儿茶素、阿魏 酸、3
‑
阿拉伯糖葡糖基槲皮素(peltatoside)、芦丁、芦丁同分异构体、金丝桃苷、槲皮素
‑3‑
o
‑ꢀ
葡萄糖苷酸中的一种或多种。
33.本发明第三方面提供一种珠芽蓼茎叶提取物。根据本发明的实施例,所述珠芽蓼茎叶 提取物由第一方面所述的制备方法制备获得。
34.本发明第四方面提供一种珠芽蓼果实提取物。根据本发明的实施例,所述珠芽蓼果实 提取物由第一方面所述的制备方法制备获得。
35.根据本发明的实施例,所述珠芽蓼果实的60%甲醇溶液洗脱干物质包括花旗松素、阿 魏酸、3
‑
阿拉伯糖葡糖基槲皮素(peltatoside)、3
‑
阿拉伯糖葡糖基槲皮素同分异构体、芦 丁、芦丁同分异构体、槲皮素
‑4‑
o
‑
葡糖苷、异槲皮苷、槲皮素
‑3‑
o
‑
葡萄糖苷酸、扁蓄苷中 的一种或多种。
36.通过分析鉴定,所得前述花旗松素、3
‑
阿拉伯糖葡糖基槲皮素、3
‑
阿拉伯糖葡糖基槲皮 素同分异构体和槲皮素
‑4‑
o
‑
葡糖苷,均首次在珠芽蓼药材中分离鉴定。
37.本发明第五方面提供一种药物组合物。根据本发明的实施例,所述药物组合物中含有 第一方面所述的制备方法制备获得的珠芽蓼提取物、第二方面所述的珠芽蓼根茎提取物、 第三方面所述的珠芽蓼茎叶提取物、第四方面所述的珠芽蓼果实提取物中的至少之一。
38.本发明第六方面提供第一方面所述的制备方法制备获得的珠芽蓼提取物在制备α
‑
葡 萄糖苷酶抑制剂中的用途。根据本发明的实施例,所述珠芽蓼提取物选自珠芽蓼根茎的15% 甲醇溶液洗脱干物质、珠芽蓼根茎的60%甲醇溶液洗脱干物质、珠芽蓼根茎的100%甲醇溶 液洗脱干物质、珠芽蓼茎叶的60%甲醇溶液洗脱干物质、珠芽蓼果实的15%甲醇溶液洗脱 干物质、珠芽蓼果实的60%甲醇溶液洗脱干物质中的至少之一。
39.根据本发明优选的实施例,所述珠芽蓼提取物选自珠芽蓼根茎的60%甲醇溶液洗脱干 物质、珠芽蓼茎叶60%的甲醇溶液洗脱干物质、珠芽蓼果实的60%甲醇溶液洗脱干物质中 的至少之一。
40.其中,珠芽蓼根茎的15%甲醇溶液洗脱干物质、珠芽蓼根茎的60%甲醇溶液洗脱干物 质、珠芽蓼根茎的100%甲醇溶液洗脱干物质、珠芽蓼茎叶的60%甲醇溶液洗脱干物质、珠 芽蓼果实的15%甲醇溶液洗脱干物质、珠芽蓼果实的60%甲醇溶液洗脱干物质对α
‑
葡萄糖 苷酶抑制效果均优于阳性对照阿卡波糖。尤其是珠芽蓼根茎的60%甲醇溶液洗脱干物质、 珠芽蓼果实的60%甲醇溶液洗脱干物质的抑制效果最佳,其抑制效果均为阳性对照阿卡波 糖的405倍;其次为珠芽蓼茎叶的60%甲醇溶液洗脱干物质,其抑制效果为阳性对照阿卡 波糖的10倍。
41.本发明第七方面提供第一方面所述的制备方法制备获得的珠芽蓼提取物在制备酪氨酸 酶抑制剂中的用途。根据本发明优选的实施例,所述珠芽蓼提取物选自珠芽蓼根茎的60% 甲醇溶液洗脱干物质、珠芽蓼根茎的100%甲醇溶液洗脱干物质、珠芽蓼茎叶的100%甲醇 溶液洗脱干物质、珠芽蓼果实的60%甲醇溶液洗脱干物质中的至少之一。
42.根据本发明优选的实施例,所述珠芽蓼提取物选自珠芽蓼根茎的60%甲醇溶液洗脱干 物质、珠芽蓼果实的60%甲醇溶液洗脱干物质中的至少之一。
43.其中,珠芽蓼根茎的60%甲醇溶液洗脱干物质、珠芽蓼根茎的100%甲醇溶液洗脱干物 质、珠芽蓼茎叶的100%甲醇溶液洗脱干物质、珠芽蓼果实的60%甲醇溶液洗脱干物质对酪 氨酸酶均具有不同程度的抑制效果,其中珠芽蓼根茎的60%甲醇溶液洗脱干物质、珠芽蓼 果实的60%甲醇溶液洗脱干物质的抑制效果更明显,为阳性对照熊果苷的5~8倍。
44.本发明第八方面提供第一方面所述的制备方法制备获得的珠芽蓼提取物在制备清除 abts自由基的药物中的用途。根据本发明的实施例,所述珠芽蓼提取物选自珠芽蓼根茎 的60%甲醇溶液洗脱干物质、珠芽蓼果实的60%甲醇溶液洗脱干物质中的至少之一。
45.其中,珠芽蓼根茎的60%甲醇溶液洗脱干物质、珠芽蓼果实的60%甲醇溶液洗脱干物 质对abts的清除效果为阳性对照维生素c的1.4~2倍。
46.有益效果
47.相比现有技术,本发明包括以下至少一种有益效果:
48.(1)使用本发明的方法制备出的珠芽蓼提取物具有抑制α
‑
葡萄糖苷酶、酪氨酸酶活性 以及清除abts自由基作用。该提取物包括阿魏酸、儿茶素、芦丁同分异构体、芦丁、金 丝桃苷、槲皮素
‑3‑
o
‑
葡萄糖苷酸、花旗松素、3
‑
阿拉伯糖葡糖基槲皮素、3
‑
阿拉伯糖葡糖 基槲皮素同分异构体、槲皮素
‑4‑
o
‑
葡糖苷、异槲皮苷、扁蓄苷中的一种或几种。其中,花 旗松素、3
‑
阿拉伯糖葡糖基槲皮素、3
‑
阿拉伯糖葡糖基槲皮素同分异构体和槲皮素
‑4‑
o
‑
葡 糖苷4种成分均首次在珠芽蓼药材中分离鉴定。
49.(2)使用本发明方法制备的珠芽蓼根茎的15%甲醇溶液洗脱干物质对α
‑
葡萄糖苷酶的 ic
50
为11.8μg/ml,阳性对照阿卡波糖的ic
50
为121.7μg/ml,其对α
‑
葡萄糖苷酶的抑制效 果明显优于阳性对照。
50.(3)使用本发明方法制备的珠芽蓼果实的15%甲醇溶液洗脱干物质对α
‑
葡萄糖苷酶的 ic
50
分别为38.4μg/ml,阳性对照阿卡波糖ic
50
分别为121.7μg/ml,其对α
‑
葡萄糖苷酶的 抑制效果明显优于阳性对照。
51.(4)使用本发明方法制备的珠芽蓼根茎的60%甲醇溶液洗脱干物质对α
‑
葡萄糖苷酶、 酪氨酸酶、abts的ic
50
分别为0.3、86.6、21.5μg/ml,阳性对照阿卡波糖、熊果苷、维 生素c的ic
50
分别为121.7、698.7、41.96μg/ml,其对α
‑
葡萄糖苷酶、酪氨酸酶的抑制效 果及abts的清除效果明显优于各阳性对照。
52.(5)使用本发明方法制备的珠芽蓼茎叶的60%甲醇溶液洗脱干物质对α
‑
葡萄糖苷酶的ic
50
为12.2μg/ml,阳性对照阿卡波糖的ic
50
分别为121.7μg/ml,其对α
‑
葡萄糖苷酶的
抑 制效果优于阳性对照。
53.(6)使用本发明方法制备的珠芽蓼果实的60%甲醇溶液洗脱干物质对α
‑
葡萄糖苷酶、 酪氨酸酶、abts的ic
50
分别为0.3、132.9、29.9μg/ml,阳性对照阿卡波糖、熊果苷、维 生素c的ic
50
分别为121.7、698.7、41.96μg/ml,其对α
‑
葡萄糖苷酶、酪氨酸酶的抑制效 果及abts的清除效果优于各阳性对照。
54.(7)使用本发明方法制备的珠芽蓼根茎的100%甲醇溶液洗脱干物质对α
‑
葡萄糖苷酶、 酪氨酸酶的ic
50
分别为59.1、582.0μg/ml,阳性对照阿卡波糖、熊果苷的ic
50
分别为121.7、 698.7μg/ml,其对α
‑
葡萄糖苷酶、酪氨酸酶的抑制效果均优于各阳性对照。
55.(8)使用本发明方法制备的珠芽蓼茎叶的100%甲醇溶液洗脱干物质对酪氨酸酶的ic
50
为436.6μg/ml,阳性对照熊果苷的ic
50
为698.7μg/ml,其对酪氨酸酶的抑制效果优于阳 性对照。
56.(9)使用本发明方法制备的珠芽蓼果实的100%甲醇溶液洗脱干物质对α
‑
葡萄糖苷酶、 酪氨酸酶的ic
50
分别为197.1、860.9μg/ml,阳性对照阿卡波糖、熊果苷的ic
50
分别为121.7、 698.7μg/ml,其对α
‑
葡萄糖苷酶、酪氨酸酶的抑制效果与阳性对照阿卡波糖、熊果苷接近。
57.(10)使用本发明方法制备的珠芽蓼根茎、珠芽蓼果实提取物具有抑制酪氨酸酶、清 除abts自由基的活性,其中的珠芽蓼根茎的60%甲醇溶液洗脱干物质、珠芽蓼果实的60% 甲醇溶液洗脱干物质对酪氨酸酶的抑制效果及abts自由基清除效果优于阳性对照熊果苷、 维生素c。因此,该珠芽蓼根茎提取物、珠芽蓼果实提取物具有美白、抗衰老的开发潜力。
58.(11)本发明所制备的多个提取物同时具有良好的抑制α
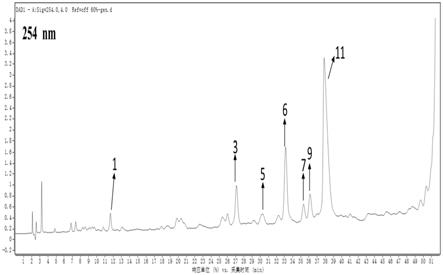
‑
葡萄糖苷酶和清除abts自 由基的效果,且其抑制活性均强于阳性对照,可用于治疗或辅助治疗糖尿病的同时减轻自 由基对胰岛β细胞攻击导致的胰岛素分泌大量减少的症状。
59.(12)本发明在前期研究的基础上,开发了珠芽蓼根茎、茎叶、果实不同极性段提取 物独立的制备和鉴定方法,并比较其生物酶抑制活性和抗氧化作用,结果发现珠芽蓼根茎、 茎叶、果实的不同提取物都有不同程度的活性抑制作用,未来在美白、抗衰老、抗糖尿病 及其相关并发症等领域具有较好的研发应用潜力。这对填补珠芽蓼生物活性研究的空白具 有重要的参考和指导作用,也为完善珠芽蓼整体质量评价体系及其未来研发应用提供了技 术支撑。
60.本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明 显,或通过本发明的实践了解到。
附图说明
61.本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显 和容易理解,其中:
62.图1显示了实施例5中珠芽蓼根茎的60%甲醇提取物的高效液相色谱图;
63.图2显示了实施例5中珠芽蓼果实的60%甲醇提取物的高效液相色谱图。
64.图1、2中的标号1
‑
12与表8中化合物的序号对应。
具体实施方式
65.术语说明
66.本发明中,“15%甲醇溶液”或“15%(v/v)甲醇溶液”表示含甲醇体积百分比为15% 的甲醇水溶液,其他比例的甲醇溶液以此类推。
67.本发明的目的是提供一种具有降糖、清除自由基及抑制黑色素合成效果的,可用于治 疗或辅助治疗糖尿病、抗衰老及美白肌肤的珠芽蓼根茎、茎叶、果实提取物及其制备方法, 即利用ods
‑
基质固相萃取分离纯化制备珠芽蓼根茎、茎叶、果实提取物。
68.根据本发明的具体实施例,本发明提供一种珠芽蓼根茎、茎叶、果实提取物的制备方 法如下:
69.将干燥后的珠芽蓼根茎药材粉碎,称取样品粉末1
‑
6g备用。称取适量ods填料(2
‑
10 g),用纯甲醇浸泡过夜进行活化,装于底部塞有脱脂棉的50ml注射器中(内直径28.5mm, 柱高110mm),沉降、敲实,并使填料面水平平整,在填料上方加入柱横切面大小滤纸片, 用约50ml起始洗脱溶液(15%甲醇溶液)对ods柱进行洗脱置换,将洗脱液放至填料面, 向其中小心倒入备好的样品粉末,使样品粉末水平平整。依次采用15%(v/v)甲醇水溶 液、60%(v/v)甲醇水溶液和100%(v/v)甲醇分别洗脱5bv(1bv=15ml),分别收 集不同体积百分比的甲醇溶液的洗脱液,分别使用旋转蒸发仪在50℃下将各洗脱液浓缩至 无醇味,使用冻干机冷冻干燥,即得珠芽蓼根茎的15%(v/v)甲醇溶液洗脱干物质、珠 芽蓼根茎的60%(v/v)甲醇溶液洗脱干物质、珠芽蓼根茎的100%(v/v)甲醇溶液洗脱 干物质。
70.将干燥后的珠芽蓼茎叶药材粉碎,称取样品粉末1
‑
6g备用。称取适量ods填料(2
‑
10 g),用纯甲醇浸泡过夜进行活化,装于底部塞有脱脂棉的50ml注射器中(内直径28.5mm, 柱高110mm),沉降、敲实,并使填料面水平平整,在填料上方加入柱横切面大小滤纸片, 用约50ml起始洗脱溶液(15%甲醇溶液)对ods柱进行洗脱置换,将洗脱液放至填料面, 向其中小心倒入备好的样品粉末,使样品粉末水平平整。依次采用15%(v/v)甲醇水溶 液、60%(v/v)甲醇水溶液和100%(v/v)甲醇分别洗脱5bv(1bv=15ml),分别收 集不同体积百分比的甲醇溶液的洗脱液,分别使用旋转蒸发仪在50℃下将各洗脱液浓缩至 无醇味,使用冻干机冷冻干燥,即得珠芽蓼茎叶的15%(v/v)甲醇溶液洗脱干物质、珠 芽蓼茎叶的60%(v/v)甲醇溶液洗脱干物质、珠芽蓼茎叶的100%(v/v)甲醇溶液洗脱 干物质。
71.将干燥后的珠芽蓼果实药材粉碎,称取样品粉末1
‑
6g备用。称取适量ods填料(2
‑
10 g),用纯甲醇浸泡过夜进行活化,装于底部塞有脱脂棉的50ml注射器中(内直径28.5mm, 柱高110mm),沉降、敲实,并使填料面水平平整,在填料上方加入柱横切面大小滤纸片, 用约50ml起始洗脱溶液(15%甲醇溶液)对ods柱进行洗脱置换,将洗脱液放至填料面, 向其中小心倒入备好的样品粉末,使样品粉末水平平整。依次采用15%(v/v)甲醇水溶 液、60%(v/v)甲醇水溶液和100%(v/v)甲醇分别洗脱5bv(1bv=15ml),分别收 集不同体积百分比的甲醇溶液的洗脱液,分别使用旋转蒸发仪在50℃下将各洗脱液浓缩至 无醇味,使用冻干机冷冻干燥,即得珠芽蓼果实的15%(v/v)甲醇水溶液洗脱干物质、 珠芽蓼果实的60%(v/v)甲醇水溶液洗脱干物质、珠芽蓼果实的100%(v/v)甲醇溶液 洗脱干物质。
72.下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明, 而不能理解为对本发明的限制。实施例中未注明具体技术或条件的,按照本领域内的文献 所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,
均为 可以通过市购获得的常规产品。
73.为描述本发明,以下列出了实施例。但需要理解,本发明不限于这些实施例,只是提 供实践本发明的方法。
74.本发明中各简称的含义
[0075][0076][0077]
实施例1:珠芽蓼提取物制备
[0078]
1、实验试剂:无水甲醇(成都科隆,ar,2020072302);ods(日本ymc公司,aqg12s50)。
[0079]
2、药材来源:珠芽蓼根茎来自云南,果实来自四川,茎叶来自西藏。
[0080]
3、实验仪器:超纯水为实验室自制(美国密理博公司milli
‑
q超纯水仪);十万分之一 电子天平xs205型(瑞士梅特勒-托利多仪器有限公司)。
[0081]
4、制备方法:
[0082]
1)分别将干燥后的珠芽蓼根茎、茎叶、果实药材粉碎,称取各样品粉末0.5g,分别加 入10ml 50%甲醇(v/v)超声提取20min,旋蒸蒸干后得珠芽蓼根茎总提物(tre)、茎 叶总提物(tle)、果实总提物(tfe)。
[0083]
2)另称取各样品粉末2g,分别倒入3个自制固相萃取小柱(内直径28.5mm,柱高 110mm,含5g ods,填料上下各铺一层滤纸)进行分离制备。首先用50ml起始洗脱溶 液(15%甲醇溶液,v/v)平衡固相萃取小柱,依次采用15%(v/v)甲醇水溶液、60%(v/v) 甲醇水溶
液和100%(v/v)甲醇分别洗脱5bv(1bv=15ml),分别收集不同体积百分比 的甲醇溶液的洗脱液,50℃下旋蒸浓缩至无醇味,最后冷冻干燥,即得9个不同梯度洗脱 的珠芽蓼提取物,包括3个根茎提取物(r
‑
15%meoh、r
‑
60%meoh、r
‑
100%meoh)、3 个茎叶提取物(l
‑
15%meoh、l
‑
60%meoh、l
‑
100%meoh)和3个果实提取物(f
‑
15%meoh、 f
‑
60%meoh、f
‑
100%meoh)。
[0084]
实施例2:α
‑
葡萄糖苷酶抑制活性测定
[0085]
1、实验仪器:多功能酶标仪(biotek)。
[0086]
2、实验试剂:α
‑
葡萄糖苷酶(sigma,750un,slcc4854);磷酸二氢钾(广东光华,hplc,20190427);氢氧化钠(西陇科学,ar,191115);pnpg(源叶生物,99.8%, k17a10b82914);碳酸钠(西陇科学,ar,180408);阿卡波糖(阿拉丁,100%,a1823131)。
[0087]
3、实验溶液:磷酸盐缓冲液(ph=6.8);α
‑
葡萄糖苷酶溶液(0.15u/ml);pnpg(对 硝基苯基
‑
α
‑
d
‑
吡喃葡萄糖苷)溶液(0.5mg/ml);碳酸钠溶液(1mol/l);阿卡波糖阳性 对照(2.00、1.00、0.50、0.25mg/ml)。
[0088]
4、实验样品:tre、tle、tfe、r
‑
15%meoh、r
‑
60%meoh、r
‑
100%meoh、l
‑
15%meoh、 l
‑
60%meoh、l
‑
100%meoh、f
‑
15%meoh、f
‑
60%meoh和f
‑
100%meoh。
[0089]
5、实验方法:
[0090]
1)供试品溶液制备
[0091]
取各提取物干品适量,分别用3%甲醇溶液(v/v)溶解并稀释成一系列浓度,具体如 下:
[0092]
tre:0.03125、0.01563、0.00781、0.00391mg/ml;
[0093]
tle:0.12500、0.06250、0.03125、0.01563mg/ml;
[0094]
tfe:0.06250、0.03125、0.01563、0.00781mg/ml;
[0095]
r
‑
15%meoh:0.20000、0.10000、0.05000、0.02500mg/ml;
[0096]
l
‑
15%meoh:1.00000、0.50000、0.25000、0.12500mg/ml;
[0097]
f
‑
15%meoh:0.30800、0.15400、0.07700、0.03800mg/ml;
[0098]
r
‑
60%meoh:0.00625、0.00313、0.00156、0.00078mg/ml;
[0099]
l
‑
60%meoh:0.19800、0.09900、0.04950、0.02475mg/ml;
[0100]
f
‑
60%meoh:0.00619、0.00309、0.00155、0.00077mg/ml;
[0101]
r
‑
100%meoh:0.40000、0.20000、0.10000、0.05000mg/ml;
[0102]
l
‑
100%meoh:0.40000、0.20000、0.10000、0.05000mg/ml;
[0103]
f
‑
100%meoh:1.01444、0.50722、0.25361、0.12681mg/ml。
[0104]
2)珠芽蓼根茎各提取物对α
‑
葡萄糖苷酶抑制活性测定
[0105]
按表1于96孔板中依次加入缓冲液、供试品、α
‑
葡萄糖苷酶溶液、pnpg溶液并混合 均匀,使用酶标仪于37℃孵育30min。然后加入40μl碳酸钠溶液终止反应,使用酶标仪 振板5min后于405nm波长下检测吸光值,计算抑制率并换算为ic
50
值,结果见表2。
[0106]
表1反应溶液信息表
[0107][0108][0109]
抑制率计算公式:
[0110][0111]
a供试品——供试品反应液吸光值
[0112]
a供试品空白——供试品空白反应溶液吸光值
[0113]
a对照——对照反应液吸光值
[0114]
a对照空白——对照空白反应液吸光值
[0115]
表2珠芽蓼各提取物对α
‑
葡萄糖苷酶抑制活性
[0116][0117]
结果表明,本发明方法制备所得的珠芽蓼提取物中,r
‑
60%meoh和f
‑
60%meoh对α
‑ꢀ
葡萄糖苷酶抑制效果最佳,为阳性对照阿卡波糖的405倍,提示其是极具开发潜力的降糖 组分,可用于开发治疗或辅助治疗糖尿病的产品;其次是tre和tfe,抑制效果分别为阳 性对照阿卡波糖的135倍和71倍,同样显示其具有治疗糖尿病的潜力;tle、r
‑
15%meoh 和l
‑
60%meoh抑制效果相对较弱,为阳性对照阿卡波糖的10~38倍。
[0118]
实施例3:酪氨酸酶抑制活性测定
[0119]
1、实验仪器:多功能酶标仪(biotek);恒温水浴锅(上海一恒)。
[0120]
2、实验试剂:磷酸二氢钾(广东光华,ar,1807061);氢氧化钠(西陇科学,ar, 20180103);酪氨酸(sigma,slbv3552);酪氨酸酶(sigma,25ku,slbz0022),熊 果苷(广州觉
然,201712002a)。
[0121]
3、实验溶液:配制酪氨酸溶液(5.0μmol/ml);酪氨酸酶溶液(200u/ml);磷酸盐 缓冲液(ph=6.50);熊果苷阳性对照溶液(4.03600、2.01800、1.00900、0.50450mg/ml)。
[0122]
4、实验样品:tre、tle、tfe、r
‑
15%meoh、r
‑
60%meoh、r
‑
100%meoh、l
‑
15%meoh、 l
‑
60%meoh、l
‑
100%meoh、f
‑
15%meoh、f
‑
60%meoh和f
‑
100%meoh。
[0123]
5、实验方法:
[0124]
1)供试品溶液制备
[0125]
取各提取物干品适量,分别用3%甲醇溶液(v/v)溶解并稀释成一系列浓度,具体如 下:
[0126]
tre:1.00、0.60、0.40、0.20mg/ml;
[0127]
tle:1.00、0.60、0.40、0.20mg/ml;
[0128]
tfe:1.00、0.60、0.40、0.20mg/ml;
[0129]
r
‑
15%meoh:4.00、2.00、1.00、0.50mg/ml;
[0130]
l
‑
15%meoh:4.00、2.00、1.00、0.50mg/ml;
[0131]
f
‑
15%meoh:4.00、2.00、1.00、0.50mg/ml;
[0132]
r
‑
60%meoh:1.00、0.33、0.11、0.04mg/ml;
[0133]
l
‑
60%meoh:1.98、0.99、0.50、0.25mg/ml;
[0134]
f
‑
60%meoh:0.99、0.33、0.11、0.04mg/ml;
[0135]
r
‑
100%meoh:0.50、0.25、0.13、0.06mg/ml;
[0136]
l
‑
100%meoh:0.50、0.25、0.13、0.06mg/ml;
[0137]
f
‑
100%meoh:1.01、0.51、0.25、0.13mg/ml。
[0138]
2)珠芽蓼根茎各提取物对酪氨酸酶抑制活性的测定:
[0139]
按表3依次加入酪氨酸溶液、磷酸盐缓冲液、供试品溶液、酪氨酸酶溶液,混合均匀, 置于25℃水浴反应50min。移取反应溶液于475nm下检测吸光值,计算抑制率并换算为 ic
50
值,结果见表4。
[0140]
表3反应溶液信息表
[0141][0142][0143]
抑制率计算公式:
[0144][0145]
a供试品——供试品反应液吸光值
[0146]
a供试品空白——供试品空白反应溶液吸光值
[0147]
a对照——对照反应液吸光值
[0148]
a对照空白——对照空白反应液吸光值
[0149]
表4珠芽蓼各提取物对酪氨酸酶抑制活性
[0150][0151]
结果表明,本发明技术制备所得的珠芽蓼提取物中,r
‑
60%meoh对酪氨酸酶的抑制 效果最明显,为阳性对照熊果苷的8倍;其次为f
‑
60%meoh,抑制效果为阳性对照熊果 苷的5倍;r
‑
100%meoh和l
‑
100%meoh抑制效果相对较弱,为阳性对照熊果苷的1.2~1.6 倍。结果表明所述珠芽蓼提取物具有抑制黑色素合成的功效,可用于开发美白淡斑产品。
[0152]
实施例4:abts自由基清除活性测定
[0153]
1、实验仪器:多功能酶标仪(biotek)
[0154]
2、实验试剂:abts(阿拉丁,98%,c2017065);过硫酸钾(阿拉丁,99.99%,l1912060); 维生素c(阿拉丁,99.99%,j1812078)。
[0155]
3、实验溶液:abts工作液、维生素c(vit c)对照溶液(0.250、0.175、0.100、0.075、 0.050、0.030、0.010、0.005mg/ml)
[0156]
4、实验样品:tre、tle、tfe、r
‑
15%meoh、r
‑
60%meoh、r
‑
100%meoh、l
‑
15%meoh、 l
‑
60%meoh、l
‑
100%meoh、f
‑
15%meoh、f
‑
60%meoh和f
‑
100%meoh。
[0157]
5、实验方法:
[0158]
1)供试品溶液制备
[0159]
取各提取物干品适量,分别用50%甲醇溶液(v/v)溶解并稀释成一系列浓度,具体 如下:
[0160]
tre:0.1500、0.1250、0.0625、0.0300、0.0150、0.0075、0.0038mg/ml;
[0161]
tle:0.2500、0.1500、0.1250、0.0625、0.0300、0.0150、0.0075mg/ml;
[0162]
tfe:0.2500、0.1500、0.1250、0.0625、0.0300、0.0150、0.0075mg/ml;
[0163]
r
‑
15%meoh:1.0000、0.5000、0.1875、0.1250、0.0625、0.0160、0.0075mg/ml;
[0164]
l
‑
15%meoh:2.0000、1.5000、1.0000、0.5000、0.2500、0.0830、0.0277mg/ml;
[0165]
f
‑
15%meoh:1.5000、1.0000、0.7500、0.5000、0.2500、0.1250、0.0150mg/ml;
[0166]
r
‑
60%meoh:0.25000、0.12500、0.04165、0.03200、0.02080、0.00694、0.00071mg/ml;
[0167]
l
‑
60%meoh:0.5000、0.2500、0.1250、0.0835、0.0420、0.0140、0.0047mg/ml;
[0168]
f
‑
60%meoh:0.5000、0.2812、0.0625、0.0320、0.0150、0.0050、0.0016mg/ml;
[0169]
r
‑
100%meoh:4.5000、3.0000、2.0000、1.0000、0.5000、0.2500、0.0625mg/ml;
[0170]
l
‑
100%meoh:5.0000、4.5000、2.5000、0.8330、0.2770、0.0920、0.0306mg/ml;
[0171]
f
‑
100%meoh:10.1400、8.0000、6.0000、3.0000、2.0000、0.6670、0.0740mg/ml;
[0172]
2)珠芽蓼根茎各提取物对abts自由基清除活性的测定:
[0173]
按表5取20μl供试品溶液与稀释后的abts工作液(在734nm下吸光值为0.7
±
0.02) 混合避光反应30min,于734nm下检测吸光值,计算抑制率并换算为ic
50
值,结果见表6。
[0174]
表5反应溶液信息表
[0175][0176]
抑制率计算公式:
[0177][0178]
a供试品——供试品反应液吸光值
[0179]
a供试品空白——供试品空白反应溶液吸光值
[0180]
a对照——对照反应液吸光值
[0181]
a对照空白——对照空白反应液吸光值
[0182]
表6珠芽蓼各提取物对abts自由基清除活性
[0183]
[0184]
结果表明,本发明技术制备所得的珠芽蓼提取物中,tre、r
‑
60%meoh和f
‑
60%meoh 对abts的清除效果与阳性对照vit c最为接近,清除效果是阳性对照vit c的1.4~2.0倍
[0185]
众所周知,vitc通过抑制酪氨酸酶的形成达到美白淡斑的功效,但其结构特殊性导致 其见光易变质失效。本发明技术制备所得的珠芽蓼提取物r
‑
60%meoh和l
‑
60%meoh, 均具有比vit c强的抗氧化作用,同时还具有明显的抑制α
‑
葡萄糖苷酶和酪氨酸酶活性的 效果,尤其对α
‑
葡萄糖苷酶具有极显著抑制作用(是阳性对照的405倍,详见表2、4、6、 7),说明其有望成为辅助治疗糖尿病的新选择,同时在美白淡斑和/或抗衰老产品方面具有 广阔的开发前景。
[0186]
表7珠芽蓼各提取物的生物活性强度
[0187][0188]
鉴于r
‑
60%meoh和f
‑
60%meoh具有明显的生物活性,接下来对mspd
‑
60%甲醇制 备得的珠芽蓼提取物进行成分分析和鉴定,进一步阐述其发挥活性作用的潜在机制。
[0189]
实施例5:珠芽蓼提取物成分鉴定
[0190]
1、实验试剂:乙腈(merck,ja095830);乙酸(阿拉丁,hplc,b1808001)。
[0191]
2、实验仪器:飞行时间质谱联用仪(agilent 1260
‑
qtof 6530lc
‑
ms)(美国安捷伦科 技有限公司)。
[0192]
3、分析样品:r
‑
60%meoh和f
‑
60%meoh提取物溶液。
[0193]
4、色谱分析:选用agilent proshell 120sb
‑
aq(150mm
×
3.0mm,2.7μm),以0.2%乙 酸(a;v/v)
‑
乙腈(b)为流动相进行梯度梯度(0~45min,11%b~16%b;45~47min, 16%b~25%b;47~49min,25%b~100%b;49~51min,100%b;51~52min,100%b~11% b),流速0.4ml/min,柱温25℃,检测波长254nm,进样5μl。
[0194]
5、质谱鉴定:干燥气温度350℃,干燥气流速10l/min,雾化气压力35psi,毛细管电 压4000v(
‑
),片段电压120v,参比离子m/z 121.050873、992.009798。各提取物的色谱 图结果如图1
‑
2所示,各成分质谱鉴定数据如表8所示。根据准分子离子信息鉴定各提取 物主要成分(质谱数据详见表8)。
[0195]
表8各提取物化学成分质谱数据
[0196][0197]
结果表明,由本发明方法制备所得的、可用于治疗或辅助治疗糖尿病并具有美白淡斑 和/或抗衰老的珠芽蓼根茎和果实60%提取物,其活性成分包括上述有机酸和黄酮成分中的 一种或多种,其中,花旗松素、3
‑
阿拉伯糖葡糖基槲皮素同分异构体、3
‑
阿拉伯糖葡糖基槲 皮素和槲皮素
‑3‑
o
‑
葡萄糖苷酸均首次在珠芽蓼药材中分离鉴定,为提升珠芽蓼的质量评价 体系提供了科学依据。
[0198]
中药具有多成分、多途径、多靶点协同调控的特点,其作用机制复杂多样,使得中药 药效物质基础不明确、中药及其相关产品的质量难以控制,最终缺乏科学合理的药效安全 评价体系。因此,阐明中药药效、活性的作用机制,需先研究其所包含化学成分的结构及 其作用特征,这样可以为药效物质基础研究奠定良好的基础。本发明提供了一种具有治疗 糖尿病、美白淡斑和/或抗衰老作用前景的珠芽蓼提取物及其制备方法,并通过高分辨质谱 确定其发挥活性作用的具体成分,为珠芽蓼及其产品的开发应用提供了技术支撑。
[0199]
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、 或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包 含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须 针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一 个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技 术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合 和组合。
[0200]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的, 不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例 进行变化、修改、替换和变型。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。