1.本发明涉及一种肿瘤增强型肿瘤浸润淋巴细胞的制备方法,属于肿瘤浸润淋巴细胞制备技术领域。
背景技术:
2.肿瘤目前是对人类威胁最大的疾病之一,早期发现通过手术、化疗等常规治疗多数只能延缓病情,发展到晚期则缺乏较好的治疗手段。近年来免疫治疗技术发展迅速,不论car
‑
t还是pd1/pd
‑
l1免疫卡控点抗体药物陆续上市,为肿瘤治疗带来希望。针对肿瘤的免疫细胞研究如火如荼,并取得一些进展,包括目前全球上市的dc疫苗、car
‑
t,然而目前大部分免疫细胞技术都是针对肿瘤单靶点或少数几个靶点,面对异质性较强的肿瘤疗效有限。
3.tils作为常规过继免疫细胞疗法已经有40多年的临床应用,相较于外周血培养的lak、cik等免疫细胞而言,tils中因相对较多的肿瘤特异性杀伤t细胞,因此在包括黑色素、卵巢癌、乳腺癌等众多肿瘤中均取得一定的治疗效果,而越来越多的临床试验加速tils作为一种特殊的免疫细胞治疗技术或药物上市,为众多肿瘤的治疗提供一种选择。
4.然而临床试验也发现tils的众多不足之处:
①
首当其冲是异质性较强,虽然tils含有的肿瘤特异性杀伤t细胞,但是大部分免疫细胞不具备肿瘤杀伤功能,而且不同患者tils含有的肿瘤特异性杀伤t细胞数量不一,而制备中是无选择性的扩增,最终导致不同患者制备的tils质量不一,因此也导致后续临床效果大不相同;
②
传统技术制备的tils面临来自肿瘤微环境中pd1信号通路的抑制,因此无法最大程度发生肿瘤杀伤作用;
③
传统技术制备的tils活力差,体内存活时间短,综上述原因导致传统的tils临床疗效不一,需要通过技术升级突破治疗瓶颈。
技术实现要素:
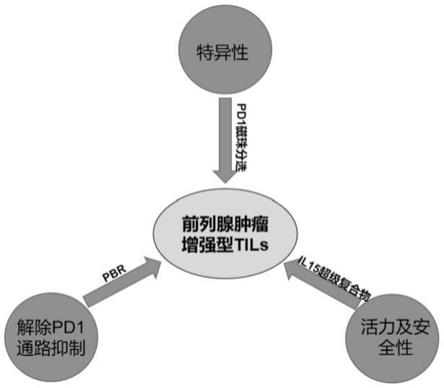
5.发明目的:针对上述技术问题,本发明提供了种肿瘤增强型肿瘤浸润淋巴细胞的制备方法。
6.技术方案:为达到上述发明目的,本发明采用以下技术方案:
7.一种肿瘤增强型肿瘤浸润淋巴细胞的制备方法,包括以下步骤:
8.(1)从肿瘤组织中提取肿瘤淋巴细胞tils;
9.(2)分选富集tils中pd1阳性t细胞;
10.(3)一次性将pbr转化融合蛋白和il
‑
15超级复合物整合到pd1阳性t细胞中;所述pbr转化融合蛋白包括:pd1的胞外区、41bb的胞内区和
△
il2rb(yrhq)的截段,并按顺序连接;所述il
‑
15超级复合物包括:信号肽、“自杀基因”r结构、linker1、白细胞介素
‑
15突变体il
‑
15
‑
m
‑
n72d、linker2、白细胞介素
‑
15受体α的sushi结构域、cd
‑
4跨膜区,并按顺序连接;
11.(4)通过扩增培养,获得肿瘤增强型tils。
12.优选的,步骤(1)中,经病理组织学确认的肿瘤组织,经组织块破碎法处理后,浸润于培养液中,后从组织中游离出来所述tils;所述肿瘤组织选自前列腺癌组织、肺癌组织或
胃癌组织等。
13.优选的,步骤(2)中,通过抗体磁珠分选富集tils中pd1阳性t细胞。
14.进一步优选的,所述通过抗体磁珠分选富集,是指按顺序使用下列试剂先分选出pd1阳性的tils细胞:
15.cd279(pd1)antibody、anti
‑
apc microbeads、support kit、cd20 cytoplasmic antibody、anti
‑
pe microbeads ultrapure和support kit。
16.优选的,步骤(3)中,利用pb转座子系统以电转的方式一次性将pbr转化融合蛋白和il
‑
15超级复合物整合到pd1阳性t细胞中。
17.优选的,步骤(3)中,所述pd1的胞外区、41bb的胞内区和
△
il2rb(yrhq)的截段的氨基酸序列分别如seq id no:1、seq id no:2和seq id no:3所示;编码所述pd1、41bb和
△
il2rb(yrhq)的dna序列分别如seq id no:4、seq id no:5和seq id no:6所示。
18.优选的,步骤(3)中,所述信号肽、“自杀基因”r结构、linker1、白细胞介素
‑
15突变体il
‑
15
‑
m
‑
n72d、linker2、白细胞介素
‑
15受体α的sushi结构域和cd
‑
4跨膜区的氨基酸序列分别如seq id no:7、seq id no:8、seq id no:9、seq id no:10、seq id no:11、seq id no:12和seq id no:13所示;编码所述信号肽、“自杀基因”r结构、linker1、白细胞介素
‑
15突变体il
‑
15
‑
m
‑
n72d、linker2、白细胞介素
‑
15受体α的sushi结构域和cd
‑
4跨膜区的dna序列分别如seq id no:14、seq id no:15、seq id no:16、seq id no:17、seq id no:18、seq id no:19和seq id no:20所示。
19.优选的,步骤(3)中,所述一次性将pbr转化融合蛋白和il
‑
15超级复合物整合到pd1阳性t细胞中前,先将所述il
‑
15超级复合物与pbr连接,两者连接所用的2a连接肽为p2a或f2a;所述p2a的氨基酸序列如seq id no:21所示,编码所述p2a的dna序列如seq id no:22所示。
20.优选的,步骤(4)中,所述扩增培养使用的培养基为无血清的悬浮细胞培养基,进一步优选aim
‑
v(gibco,usa)培养基。
21.一种肿瘤增强型肿瘤浸润淋巴细胞,由上述制备方法制得。
22.优选的,所述增强型tils的制备方法包括如下步骤:
23.采用细胞培养液培养肿瘤浸润淋巴细胞。
24.1、通过手术获得患者的肿瘤组织样本并经病理确认;
25.2、将患者肿瘤组织样本用pbs进行浸泡、清洗,尽量去除组织中的结缔组织和坏死组织;
26.3、将清洗干净的肿瘤组织移入干净的培养皿中,用手术剪进行剪碎,大小约1
‑
8mm3。放入24孔培养板中,每孔2ml x
‑
vivo15培养基,il
‑
7(10ng/ml)、il
‑
15(20ng/ml)、il
‑
21(20ng/ml)、1%双抗、5%人血白蛋白、β
‑
巯基乙醇(55um)和hepes(10mm)。
27.4、每隔一天进行观察,不论是否观察到有tils生长,第4
‑
5天去组织块并半量换液。
28.5、根据tils的生长状况,每隔1
‑
3天进行一次半量换液。
29.6、若孔板内长满了tils,并且所有的贴壁细胞已经去除,将各个长满孔的tils收集起来。
30.7、将步骤6中收集的tils通过抗体磁珠分选富集pd1阳性细胞;利用pb转座子系统
以电转的方式一次性将pbr、il
‑
15超级复合物等基因整合到pd1阳性的t细胞中,得到增强型tils。
31.8、所述的pb转座子电转具体的为每2
×
106个细胞使用2ug的转座子和1ug的转座酶以电压860v,时间20ms的条件电转。
32.9、扩增的第0天,取5-10
×
106个分选电转后的增强型tils重悬浮于75cm2培养瓶中并补加培养基至10ml,加入200ng/ml的cd3/cd28抗体、il
‑
7(10ng/ml)、il
‑
21(20ng/ml)。
33.10、所述的培养基为含aim
‑
v(gibco,usa):5%人血白蛋白,1%双抗,β
‑
巯基乙醇(55um) hepes(10mm)的x
‑
vivo15完全培养基1:1。
34.11、细胞培养到第2天,添加新的10ml完全培养液aim
‑
v(gibco,usa),并且保持il
‑
7(10ng/ml)、il
‑
21(20ng/ml),5%人血白蛋白。
35.12、培养到第5天,添加新的30ml完全培养液aim
‑
v(gibco,usa),并且保持il
‑
7(10ng/ml)、il
‑
21(20ng/ml),5%人血白蛋白。
36.13、培养到第7天,将2个75cm2培养瓶细胞收集,用cd20 microbeads,human的磁珠,将表达“自杀基因”r结构的阳性细胞筛选出来并解离后,转移到1.8l培养袋中添加新的200ml完全培养液aim
‑
v(gibco,usa),并且保持il
‑
7(10ng/ml)、il
‑
21(20ng/ml),5%人血白蛋白。
37.14、从转入培养袋中培养那天起,每隔一天进行一次台盼蓝染色计数,通过调节完全培养基的体积控制袋子内的细胞密度为0.5
‑2×
106/ml,并且始终保持il
‑
7(10ng/ml)、il
‑
21(20ng/ml)、5%人血白蛋白。
38.15、扩增后14天收集细胞,计数,并且对扩增后的增强型tils进行细胞表型检测(通过14天扩增大约可获得40
‑
100亿的细胞量);
39.tils中pd1阳性的t细胞更具有肿瘤识别杀伤能力,因此本发明首先将肿瘤组织来源tils中分选出pd1阳性的t细胞进行富集扩增,以提升肿瘤特异性t细胞的比例;而pd1通路的激活会抑制t细胞的活力,降低其对肿瘤细胞的杀伤,为了解除肿瘤微环境中来自pd1通路的抑制,本发明设计研发出新型pd1的胞外区:41bb的胞内区:
△
il2rb(yrhq)的截段(pbr)转化融合蛋白,将pbr过表达于t细胞,可以通过其与内源性pd1竞争结合pd
‑
l1,解除pd1/pd
‑
l1抑制信号,通过41bb,
△
il2rb(yrhq)刺激信号,促进了它们的增殖,阻止了体外末端分化,并且延长了体内的存续时间。常规tils的扩增培养选用高浓度il2,虽然可以短时间提高tils的产量,然而会降低其活力。研究发现il15可以通过与il
‑
15α受体(il
‑
15rα)结合通过信号级联反应最终促进t细胞向tscm(记忆性干细胞样t细胞)和tcm(中央记忆型t细胞)分化,同时促进t细胞增殖和细胞因子释放,增强免疫细胞肿瘤杀伤功能,为了维持其回输后的体内活力,本发明研发了膜锭il
‑
15超级复合物激动剂,通过基因工程使其稳定表达于分选的t细胞中,不仅可以提高t细胞的肿瘤杀伤活力,还可以刺激体内的内源性nk、t细胞等其他免疫细胞,加速对体内肿瘤细胞的清除;加装的“自杀基因”r结构解决了t细胞基因改造后,后续临床的安全性,当回输的t细胞面临异常扩增或者出现严重副反应时可以通过利妥昔单克隆抗体进行清除。
40.有益效果:相对于现有技术,本发明制备方法有以下特点
①
通过分选pd1阳性的t细胞提升肿瘤特异性t细胞的比例;
②
设计的pbr融合蛋白能够解除肿瘤微环境中来自pd1通路的抑制,提高tils对肿瘤细胞的杀伤能力;
③
il
‑
15超级复合物不仅可以提高t细胞的
肿瘤杀伤活力,还可以刺激体内的内源性nk、t细胞等其他免疫细胞,加速对体内肿瘤细胞的清除;
④
加装的“自杀基因”r结构解决了t细胞基因改造后,后续临床的安全性。
附图说明
41.图1为具体实验设计。
42.图2为pbr和il
‑
15超级复合物结构及质粒构建示意图,其中:
43.a、pbr融合蛋白构建示意图(pd1的胞外区、41bb的胞内区和
△
il2rb(yrhq)的截段);
44.b、il
‑
15超级复合物融合蛋白结构示意图(信号肽、“自杀基因”r结构、linker1、白细胞介素
‑
15突变体il
‑
15
‑
m
‑
n72d、linker2、白细胞介素
‑
15受体α的sushi结构域、cd
‑
4跨膜区);
45.c、pbr、il
‑
15超级复合物质粒构建示意图(il
‑
15超级复合物与pbr连接所用的2a连接肽为p2a)。
46.图3为验证增强型tils对前列腺原代肿瘤靶细胞杀伤功能,其中:
47.a、增强型tils及对照组细胞表型鉴定(常规tils为未经分选培养,增强型tils为分选电转后培养);
48.b、c、利用elisa实验验证增强型tils及常规tils分别对前列腺正常上皮细胞(左)和前列腺原代肿瘤靶细胞的杀伤作用(右)(增强型tils对前列腺原代肿瘤靶细胞杀伤功能更强);
49.图4为验证增强型tils解除了pd1/pd
‑
l1通路抑制,其中:
50.a、增强型tils及对照组细胞表型鉴定(常规tils为未经分选培养,pd1
tils为分选后常规培养,增强型tils为分选电转后培养);
51.b、利用elisa实验验证增强型tils及常规tils分别对前列腺原代肿瘤靶细胞(pct1)和过表达pd
‑
l1肿瘤靶细胞(pct1
‑
pd
‑
l1)的杀伤作用(右)(增强型tils的杀伤能力更强);
52.c、利用流式检测ifnγ间接验证增强型tils及常规tils分别对pct1和pct1
‑
pd
‑
l1的杀伤作用(增强型tils的ifnγ量更高)。
53.图5为验证il
‑
15超级复合物提供增强型tils的活力,其中:
54.a、增强型tils及对照组细胞表型鉴定(增强型tils高表达anti il
‑
15,活力更强);
55.b、利用cd45ro和cd45ra抗体流式分析增强型tils及常规tils的细胞比例(增强型tils向tscm和tcm分化);
56.c、在没有外源性细胞因子的培养条件下,长时间监测增强型tils的倍增效率(增强型tils的增殖能力更强)。
57.图6为验证增强型tils的“自杀”功能,其中:
58.a、增强型tils及对照组细胞表型鉴定(anti cd20检测增强型tils“自杀基因”r结构的表达);
59.b、体外模拟cdc反应,将增强型tils及常规tils分别同baby rabbitcomplement以及不同浓度的利妥昔单抗培养,后经流式细胞术分析不同组t细胞的凋亡;
60.c、体外模拟adcc反应,在利妥昔单抗处理下,将增强型tils及常规tils按照不同比例分别同同一自体来源的nk细胞共培养,后经流式细胞术分析不同组tils细胞的凋亡。
具体实施方式
61.下面通过具体实施例对本发明所述的技术方案给予进一步详细的说明。
62.本发明的具体实验设计如图1所示,包括:
63.1、通过抗体磁珠分选富集tils中pd1阳性t细胞;
64.2、利用pb转座子系统以电转的方式一次性将pbr、il
‑
15超级复合物等基因整合到pd1阳性的t细胞中;
65.3、培养7天,收集细胞,用磁珠分选表达“自杀基因”r结构的阳性细胞,后通过扩增培养获得增强型tils。
66.所述的磁珠分选是指按顺序使用下列试剂分选出pd1阳性的tils细胞:
67.①
美天旎货号:130
‑
119
‑
921,名称:cd279(pd1)antibody,anti
‑
human,ap c,,realease结合细胞;
68.②
美天旎货号:130
‑
090
‑
855,名称:anti
‑
apc microbeads对细胞进行间标,将pd1阳性的tils分选出来;
69.③
美天旎货号:130
‑
120
‑
675,名称:support kit对细胞进行解离,解离掉抗体和磁珠;
70.④
美天旎货号:130
‑
123
‑
084,名称:cd20 cytoplasmic antibody,anti
‑
human,pe,readye_leasedata sheet结合细胞;
71.⑤
美天旎货号:130
‑
105
‑
639,名称:anti
‑
pe microbeads ultrapure对细胞进行间标,将表达“自杀基因”r结构的阳性细胞筛选出来;
72.⑥
美天旎货号:130
‑
120
‑
675,名称:support kit对细胞进行解离,解离掉抗体和磁珠;
73.实施例1
74.患者,男,66岁,前列腺肿瘤组织用生理盐水充分清洗,去除前列腺癌标本周围的正常组织和坏死区域。将前列腺癌标本放在无菌培养皿中,加入少量生理盐水,用灭菌的手术剪从标本四周的不同区域剪下大小约为1
‑
8mm3的小组织块,数目一般不少于8块。取剪下的1小块前列腺癌组织置于24孔板的一个孔内,每孔含有2ml x
‑
vivo15培养基,il
‑
7(10ng/ml)、il
‑
15(20ng/ml)、il
‑
21(20ng/ml)、1%双抗、5%人血白蛋白、β
‑
巯基乙醇(55um)和hepes(10mm),其他孔用相同方法操作。将24孔板放于37℃,5%co2细胞培养箱中培养。每隔一天通过显微镜观察各个孔中组织块周围淋巴细胞的增殖情况。不论是否观察到有tils生长,培养起始后的第4
‑
5天给所有孔进行半量换液并去组织块,即先小心吸掉孔内1ml上层液体,尽量避免吸走细胞,之后加入1ml x
‑
vivo15培养基,il
‑
7(10ng/ml)、il
‑
15(20ng/ml)、il
‑
21(20ng/ml)、1%双抗、5%人血白蛋白、β
‑
巯基乙醇(55um)和hepes(10mm)。第一次换液后,根据tils生长情况,每隔1
‑
2天进行一次半量换液,方法如前。在这种培养条件下,tils通常会先裂解孔内的贴壁细胞,然后开始增殖和生长。培养约1
‑
2周后,通常会观察到组织块周围会有致密的毯状淋巴细胞层形成。一旦孔内tils长满(所有贴壁细胞已除去),就将各个细胞长满孔收集起来。可以等份冻存(冻存液为90%fbs 10%dmso),最好将密度
控制在1
×
106‑1×
107/ml之间,也可以调整细胞密度至0.7
‑
1.5
×
106/ml在完全培养基含il
‑
7(10ng/ml)、il
‑
15(20ng/ml)、il
‑
21(20ng/ml)中继续培养,直至达到实验或治疗所需的细胞数。扩增起始的当天(第0天),收集的tils通过抗体磁珠分选富集pd1阳性细胞;利用pb转座子系统以电转的方式一次性将pbr、il
‑
15超级复合物等基因(2
×
106个细胞使用2ug的转座子和1ug的转座酶以电压860v,时间20ms的条件)整合到pd1阳性细胞中,取1
×
107个电转后的tils重悬于两个75cm2培养瓶中并补加完全培养基(aim
‑
v(gibco,usa):5%人血白蛋白,1%双抗,β
‑
巯基乙醇(55um)和hepes(10mm)的x
‑
vivo15完全培养基1:1)至10ml,加入200ng/ml的cd3/cd28抗体、il
‑
7(10ng/ml)、il
‑
21(20ng/ml)。细胞培养到第2天,添加新的10ml完全培养液aim
‑
v(gibco,usa),并且保持il
‑
7(10ng/ml)、il
‑
21(20ng/ml),5%人血白蛋白。培养到第5天,添加新的30ml完全培养液aim
‑
v(gibco,usa),并且保持il
‑
7(10ng/ml)、il
‑
21(20ng/ml),5%人血白蛋白。培养到第7天,将2个75cm2培养瓶细胞收集,用cd20 microbeads,human的磁珠,将表达“自杀基因”r结构的阳性细胞筛选并解离出来后,转移到1.8l培养袋中,加200ml的完全培养基aim
‑
v(gibco,usa)和il
‑
7(10ng/ml)、il
‑
21(20ng/ml),5%人血白蛋白。从转入培养袋中培养那天起,每隔一天进行一次台盼蓝染色计数,通过调节完全培养基的体积控制袋子内的细胞密度为0.5
×
106‑2×
106/ml,并且始终保持il
‑
7(10ng/ml)、il
‑
21(20ng/ml)。在扩增的第14天,将细胞收集起来,用于实验,也可检测后用于患者输注。(收获细胞53
×
108个)
75.实施例2
76.患者,男,58岁,增强型tils培养方法与上述方法一致(收获细胞78
×
108个)。
77.实施例3
78.患者,男,74岁,增强型tils培养方法与上述方法一致(收获细胞46
×
108个)。
79.如图2所示,委托通用生物系统(安徽)有限公司构建pbr、il
‑
15超级复合物,按照pd1的胞外区(seq id no:1)、41bb的胞内区(seq id no:2)、
△
il2rb(yrhq)的截段(seq id no:3)、p2a连接肽(seq id no:21)、信号肽(seq id no:7)、“自杀基因”r结构(seq id no:8)、linker1(seq id no:9)、白细胞介素
‑
15突变体il
‑
15
‑
m
‑
n72d(seq id no:10)、linker2(seq id no:11)、白细胞介素
‑
15受体α的sushi结构域(seq id no:12)、cd
‑
4跨膜区(seq id no:13)的顺序将序列进行组装。优化后常规合成基因,并克隆至载体质粒载体上。
80.所述的pd1 dna序列atcccaatgcagcaggcgccctggccagtcgtctgggcggtgctacaactgggctggcggccaggatggttcttagactccccagacaggccctggaacccccccaccttctccccagccctgctcgtggtgaccgaaggggacaacgccaccttcacctgcagcttctccaacacatcggagagcttcgtgctaaactggtaccgcatgagccccagcaaccagacggacaagctggccgccttccccgaggaccgcagccagcccggccaggactgccgcttccgtgtcacacaactgcccaacgggcgtgacttccacatgagcgtggtcagggcccggcgcaatgacagcggcacctacctctgtggggccatctccctggcccccaaggcgcagatcaaagagagcctgcgggcagagctcagggtgacagagagaagggcagaagtgcccacagcccac。
81.所述的pd1氨基酸序列ipmqqapwpvvwavlqlgwrpgwfldspdrpwnpptfspallvvtegdnatftcsfsntsesfvlnwyrmspsnqtdklaafpedrsqpgqdcrfrvtqlpngrdfhmsvvrarrndsgtylcgaislapkaqikeslraelrvterraevptah。
82.所述的41bb dna序列ccagccccatctgacctctctccgggagcatcctctgtgaccccgcctgcccctgcgagagagccaggacactctccgcagatcatctccttctttcttgcgctgacgtcgactgcgttgctcttc
ctgctgttcttcctcacgctccgtttctctgttgttaaacggggcagaaagaaactcctgtatatattcaaacaaccatttatgagaccagtacaaactactcaagaggaagatggctgtagctgccgatttccagaagaagaagaaggaggatgtgaactg。
83.所述的41bb氨基酸序列papsdlspgassvtppaparepghspqiisfflaltstallfllffltlrfsvvkrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcel。
84.所述的
△
il2rb(yxxq)dna序列tgccgcagcaacaacaccggcccctggctgaagaaggtgctgaagtgcaacacccccgaccccagcaagttcttcagccagctgagcagcgagcacggcggcgacgtgcagaagtggctgagcagccccttccccagcagcagcttcagccccggcggcctggcccccgagatcagccccctggaggtgctggagcgcgacaaggtgacccagctgctgcccctgaacaccgacgcctacctgagcctgcaggagctgcagggccaggaccccacccacctggtgtaccgccaccag。
85.所述的
△
il2rb(yxxq)氨基酸序列crsnntgpwlkkvlkcntpdpskffsqlssehggdvqkwlsspfpsssfspgglapeisplevlerdkvtqllplntdaylslqelqgqdpthlvyrhq。
86.所述的信号肽dna序列gacatgtggacctggatcctcttcttggtggcagcagccacgcgagtccactcc。
87.所述的信号肽氨基酸序列dmwtwilflvaaatrvhs。
88.所述的“自杀基因”r结构dna序列tgcgcccccaacagcaaccccagcctgtgc。
89.所述的“自杀基因”r结构氨基酸序列capnsnpslc。
90.所述的linker1dna序列ggcagcggcggcagcggcggcggcggcagcggcggcggcggcagcggcggcggcggcagcggcggcggcagcctgcag。
91.所述的linker1氨基酸序列gsggsggggsggggsggggsgggslq。
92.所述的白细胞介素
‑
15突变体il
‑
15
‑
m
‑
n72d dna序列gtgaacaactgggtgatcagcgacctgaagaagatcgaggacctgatccagagcatgcacatcgacgccaccctgtacaccgccagcgacgtgcaccccagctgcaaggtgaccgccatgaagtgcttcctgctggagctgcaggtgatcagcctggagagcggcgacgccagcatccacgacgacgtggagaacctgatcatcctggccaacgacagcctgagcagcaacggcaacgtgaccgagagcggctgcgccgagtgcgaggagctggaggagaagaacatcaaggagttcctgtggagcttcgtgcacatcgtgcagatgttcatcaacaccagc。
93.所述的白细胞介素
‑
15突变体il
‑
15
‑
m
‑
n72d氨基酸序列vnnwvisdlkkiedliqsmhidatlytasdvhpsckvtamkcfllelqvislesgdasihddvenliilandslssngnvtesgcaeceeleeknikeflwsfvhivqmfints。
94.所述的linker2 dna序列gacggcggcggcagc。
95.所述的linker2氨基酸序列dgggs。
96.所述的白细胞介素
‑
15受体α的sushi结构域dna序列tgcatcacccccccccccatgagcgtggagcacgccgacatctgggccaagagctacagcctgtacagccgcgagcgctacatctgcaacagcgccttcaagcgcaaggccggcaccagcagcctgaccgagtgcgtgaccaacaaggccaccaacgtggcccactggaccacccccagcctgaagtgcatccgcgac。
97.所述的白细胞介素
‑
15受体α的sushi结构域氨基酸序citpppmsvehadiwaksyslysreryicnsafkrkagtssltecvtnkatnvahwttpslkcird。
98.所述的cd
‑
4跨膜区dna序列gtggtggtgaacatgcgcgccaccaagaacacctgcgtgtggggcaccagcaagatgagcaagaacaaggccaaggtgagcaagcgcaaggccgtgtgggtgaacgccggcatgtggtgca
gcgacagcggcgtgagcaacatcaaggtgacctggagcaccgtgatggccatcgtgggcggcgtggccggcatcggcggcatc。
99.所述的cd
‑
4跨膜区氨基酸序列vvvnmratkntcvwgtskmsknkakvskrkavwvnagmwcsdsgvsnikvtwstvmaivggvagiggi。
100.所述的2a连接肽为p2a dna序列agcggcggcgccaccaacttcagcctgctgaagcaggccggcgacgtggaggagaaccccggcccc。
101.所述的2a连接肽为p2a氨基酸序列sggatnfsllkqagdveenpgp。
102.所述序列具有80%
‑
95%同源性。
103.如图3所示,为验证增强型tils对前列腺原代肿瘤靶细胞杀伤功能:取培养14天的常规tils和增强型tils流式检测并分别于同一样本来源的前列腺正常上皮细胞和前列腺原代肿瘤靶细胞共孵育24h后,利用elisa实验得出在不同效靶比下(10:1,5:1,1:1)常规tils和增强型tils对前列腺正常上皮细胞和前列腺原代肿瘤靶细胞杀伤率;a图增强型tils中pd1阳性细胞比率为94.38%略高于常规tils,但增强型tils的荧光信号强度更强;b图常规tils和增强型tils对前列腺正常上皮细胞基本不杀伤,常规tils和增强型tils对前列腺原代肿瘤靶细胞的杀伤能力更强,在10:1的效靶比下增强型tils对前列腺原代肿瘤靶细胞的杀伤率约为40%是常规tils杀伤能力两倍。
104.如图4所示,为验证增强型tils解除pd1/pd
‑
l1通路抑制:取培养14天的常规tils、分选pd1阳性的tils和增强型tils流式检测并分别于前列腺原代肿瘤靶细胞(pct1)和过表达pd
‑
l1肿瘤靶细胞(pct1
‑
pd
‑
l1)共孵育24h后,利用elisa实验得出在10:1效靶比下常规tils、分选pd1阳性的tils和增强型tils对前列腺原代肿瘤靶细胞(pct1)和过表达pd
‑
l1肿瘤靶细胞(pct1
‑
pd
‑
l1)的杀伤率;a图增强型tils中pd1阳性细胞比率为94.38%略高于常规tils和分选pd1阳性的tils,但增强型tils的荧光信号强度更强;b图增强型tils对前列腺原代肿瘤靶细胞(pct1)和过表达pd
‑
l1肿瘤靶细胞(pct1
‑
pd
‑
l1)的杀伤率约为60%优于常规tils和分选pd1阳性的tils对前列腺原代肿瘤靶细胞(pct1)和过表达pd
‑
l1肿瘤靶细胞(pct1
‑
pd
‑
l1)的杀伤率;c图利用流式检测tils培养上清液中ifnγ的含量,在前列腺原代肿瘤靶细胞(pct1)和过表达pd
‑
l1肿瘤靶细胞(pct1
‑
pd
‑
l1)共培养上清液中,增强型tils高于常规tils和分选pd1阳性的tils,间接验证增强型tils比常规tils和分选pd1阳性的tils分别对(pct1)和pct1
‑
pd
‑
l1的杀伤作用更强。
105.如图5所示,为验证il
‑
15超级复合物提供增强型tils的活力:取培养14天的常规tils和增强型tils进行流式检测,a图为检测il
‑
15的表达,增强型tils il
‑
15的表达为94.27%,常规tils不表达;b图利用cd45ro和cd45ra抗体流式分析增强型tils及常规tils的细胞比例,增强型tilscd45ra比率为82.74%,常规tils不表达,增强型tils向tscm和tcm分化;c图在没有外源性细胞因子的培养条件下,长时间监测增强型tils的倍增效率,增强型tils的扩增能力和活力优于常规tils。
106.如图6所示,为验证增强型tils的“自杀”功能:a图为取培养14天的常规tils和增强型tils进行流式检测,增强型tils cd20表达为96.86%,常规tils不表达;b图将增强型tils及常规tils同baby rabbit complement以及不同浓度(0ug/ml,50ug/ml,100ug/ml和200ug/ml)的利妥昔单抗培养,后经annexin v/pi染色经流式细胞术分析不同组tils细胞的凋亡情况;c图将强型tils及常规tils按分别照一定比例(2:1,10:1和20:1)同来自同一
供体的nk细胞进行培养,后经annexin v/pi染色经流式细胞术分析不同组tils细胞的凋亡情况,通过b和c图可以看出增强型tils可以通过cdc和adcc途径实现“自杀”而常规tils不可以。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。