1.本发明属于生物信息学分析领域,具体涉及一种肝癌患者免疫治疗超进展风险的预测模型、构建方法及其应用。
背景技术:
2.原发性肝癌(primary liver cancer,plc)是全世界范围内常见的消化系统恶性肿瘤。全球肝癌的年新发病例数居于恶性肿瘤第7位,死亡人数居于恶性肿瘤的第3位。70%~80%的肝癌病人确诊时已为进展期,失去根治性手术治疗机会,仅能接受系统治疗等姑息性治疗方式,预后极差。这些患者的治疗选择有限。自2017年,仑伐替尼一线治疗肝癌,瑞戈非尼、卡博替尼和雷莫芦单克隆抗体二线治疗肝癌获批临床应用,标志着肝癌靶向治疗进入新时代。虽然中晚期肝癌病人客观缓解率获得显著提高,但其总体生存时间未能获得有效延长。近年来,免疫检查点抑制剂(immune checkpoint inhibi
‑
tors,icis)为代表的免疫疗法使许多类型肿瘤患者的预后得到了前所未有的改善。随着icis在临床的广泛应用,越来越多的证据表明,部分患者在接受icis后短时间内肿瘤负荷反而迅速增大,导致生存期显著缩短,该现象被称为超进展性疾病(hpd)。
3.有多篇研究使用不同方法对免疫治疗的肿瘤患者出现的超进展现象进行评估及预测。其中kim等人的研究中,通过肿瘤生长动力学通过tgk(tumour growth kinetics)和tgr(tumour growth rate)数据共同评估,tgk是基于recist测量肿瘤靶病灶最长径每月的直径变化,tgr是基于recist测量靶病灶体积总和每月变化的log值[]。基于连续的ct或者mri扫描来评估肿瘤反应即肿瘤生长动力学。评估时间与基线测量的时间间隔为12周。基线的定义为即将治疗前的影像学,试验周期的定义为接受治疗到治疗完成为12周。用tgk和tgr的倍数变化及tgr绝对值(δtgr)来表达hpd。他们对超进展的定义为:tgk及tgr增长超过4倍,且δtgr超过40%。并且高nlr可以预测,nlr的cutoff值为4.125。
[0004]
目前用于评估超进展的方法有很多,没有统一的标准。在实际临床工作中,评估肝癌患者的超进展有诸多限制。目前使用比较广泛的方法是肿瘤生长率(tgr)来定义它,这些方法有一些重要的临床局限性,例如需要事先进行计算机断层扫描(ct),但在真实世界中往往缺少必须的治疗前的影像学;且tgr的定义中不包括对新病灶和不可测量疾病的评估。
技术实现要素:
[0005]
本发明的目的在于提供一种可以准确评估肝癌患者免疫治疗超进展风险的预测模型、构建方法及其应用。
[0006]
本发明所采取的技术方案是:
[0007]
本发明的第一方面,提供一种肝癌患者免疫治疗超进展风险评估模型的构建方法,包含以下步骤:
[0008]
s1:获取hpd患者及非hpd患者的临床资料;
[0009]
s2:使用差异分析检测hpd患者及非hpd患者中的变量;
[0010]
s3:使用单变量和多变量逻辑回归分析确定与hpd相关的临床变量,建立风险模型;
[0011]
所述临床变量包含淋巴结转移、肺转移、nlr(中性粒细胞与淋巴细胞的比率)、白蛋白和ps(体力活动状态)评分。
[0012]
在本发明的一些实施方式中,所述差异分析包含独立样本t检验、卡方检验或mann
‑
whitney u检验。
[0013]
在本发明的一些实施方式中,所述构建方法还包含步骤s4评估所述模型的效能。
[0014]
在本发明的一些实施方式中,所述步骤s4为使用roc分析验证该风险模型在评估肝癌患者免疫治疗超进展风险的准确性。
[0015]
在本发明的一些实施方式中,所述风险模型的计算公式为logit(p)=
‑
3.208 1.450
×
淋巴结转移 1.043
×
肺转移 0.610
×
nlr
‑
0.848
×
白蛋白 0.323
×
ps评分;
[0016]
在本发明的一些实施方式中,所述模型公式中对纳入模型的变量赋值为:患有所述淋巴结转移,则其变量赋值为1,否则为0;患有所述肺转移,则其变量赋值为1,否则为0;若所述nlr≥3,则其变量赋值为1,否则为0;若所述白蛋白≥35g/l,则其变量赋值为1,否则为0;若ps评分≥2,则其变量赋值为0,否则为1;
[0017]
其中,若logit(p)≥
‑
2.60,预测为hpd高风险患者;若logit(p)<
‑
2.60,预测为hpd低风险患者。
[0018]
在本发明的一些实施方式中,所述hpd定义为:
[0019]
(1)治疗开始后大约2个月内的pdx,可测量的病灶增加≥10mm;和
[0020]
(2)靶病灶总直径较基线增加≥40%和/或靶病灶总直径较基线≥20%的同时两个不同器官出现新病灶。
[0021]
在本发明的一些实施方式中,所述超进展也可以通过tgk和tgr的倍数变化及tgr绝对值(δtgr)来表达hpd。
[0022]
本发明的第二方面,提供一种肝癌患者免疫治疗超进展风险评估模型,所述模型包含淋巴结转移、肺转移、nlr、白蛋白、ps评分,所述模型的计算公式为logit(p)=
‑
3.208 1.450
×
淋巴结转移 1.043
×
肺转移 0.610
×
nlr
‑
0.848
×
白蛋白 0.323
×
ps评分;
[0023]
在本发明的一些实施方式中,所述模型公式中对纳入模型的变量赋值为:患有所述淋巴结转移,则其变量赋值为1,否则为0;患有所述肺转移,则其变量赋值为1,否则为0;若所述nlr≥3,则其变量赋值为1,否则为0;若所述白蛋白≥35g/l,则其变量赋值为1,否则为0;若ps评分≥2,则其变量赋值为0,否则为1;
[0024]
若logit(p)≥
‑
2.60,预测为hpd高风险患者;若logit(p)<
‑
2.60,预测为hpd低风险患者。
[0025]
本发明的第三方面,提供一种肝癌患者免疫治疗超进展风险评估系统,其包括:
[0026]
输入单元,至少用于输入待评估数据;
[0027]
分析单元:由本发明第一方面所述方法构建得到的基于logistic算法的风险评估模型,至少用于对该待评估数据进行分析;
[0028]
评估单元:至少用于显示模型评分;
[0029]
所述评分≥
‑
2.60,预测为hpd高风险患者;
[0030]
所述评分<
‑
2.60,预测为hpd低风险患者。
[0031]
本发明的第四方面,提供一种电子设备,包括存储器、处理器及存储在存储器上并可在处理器上运行的计算机程序,所述处理器执行所述计算机程序时实现本发明第一方面所述的模型构建方法。
[0032]
本发明的第五方面,提供一种存储介质,其中存储有处理器可执行的指令,其特征在于,所述处理器可执行的指令在由处理器执行时用于执行本发明第一方面所述的模型构建方法。
[0033]
本发明的第六方面,提供检测本发明第一方面所述临床变量的物质在制备肝癌患者免疫治疗超进展风险评估产品中的应用。
[0034]
在本发明的一些实施方式中,通过logistic回归分析建立模型进行风险评估,其中模型公式为logit(p)=
‑
3.208 1.450
×
淋巴结转移 1.043
×
肺转移 0.610
×
nlr
‑
0.848
×
白蛋白 0.323
×
ps评分。
[0035]
在本发明的一些实施方式中,所述模型公式中对纳入模型的变量赋值为:患有所述淋巴结转移,则其变量赋值为1,否则为0;患有所述肺转移,则其变量赋值为1,否则为0;若所述nlr≥3,则其变量赋值为1,否则为0;若所述白蛋白≥35g/l,则其变量赋值为1,否则为0;若ps评分≥2,则其变量赋值为0,否则为1;
[0036]
若logit(p)≥
‑
2.60,预测为hpd高风险患者;若logit(p)<
‑
2.60,预测为hpd低风险患者。
[0037]
在本发明的一些实施方式中,所述物质为试剂或仪器。
[0038]
本发明的第七方面,提供一种产品,其特征在于,包含本发明第六方面所述物质。
[0039]
本发明的第八方面,提供本发明第一方面所述方法或本发明第二方面所述模型或本发明第三方面所述系统或本发明第四方面所述电子设备或本发明第五方面所述存储介质或本发明第七方面所述产品在制评估肝癌患者免疫治疗超进展风险中的应用。
[0040]
本发明的有益效果是:
[0041]
本发明使用一种经研究证实的有效的超进展评估方法:在免疫治疗2月内,与基线相比可测量的病灶增加≥10mm的基础上靶病灶增大40%,或者靶病灶增加20%同时至少在2个不同器官上出现新的病灶。此方法克服了之前方法存在的影像学的限制及新病灶和不可测量疾病的评估的限制,且更加直观和便于使用。并且使用此方法评价使用ici的原发性肝癌患者中的发病率及预测hpd的因素,并建立预测模型对模型进行评价。
[0042]
本发明发现通过淋巴结转移、肺转移、nlr、白蛋白和ps评分建立预测模型logit(p)=
‑
3.208 1.450
×
淋巴结转移 1.043
×
肺转移 0.610
×
nlr
‑
0.848
×
白蛋白 0.323
×
ps评分。该模型可以准确预测肝癌患者免疫治疗超进展风险,auc达到0.801,具有诊断学意义,在临床工作中有一定的指导意义。
附图说明
[0043]
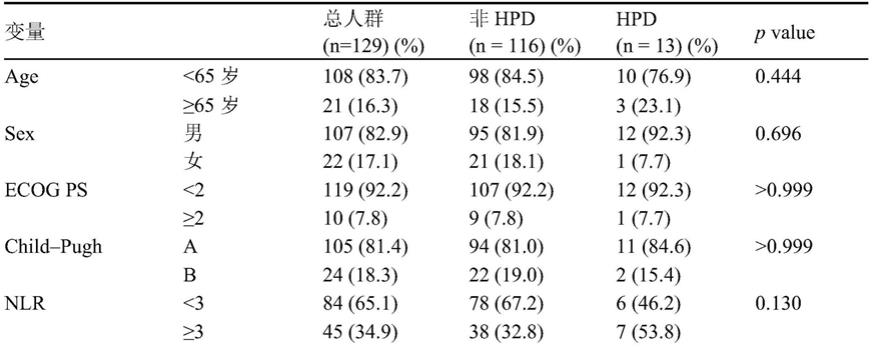
图1为纳入研究的患者流程图。
[0044]
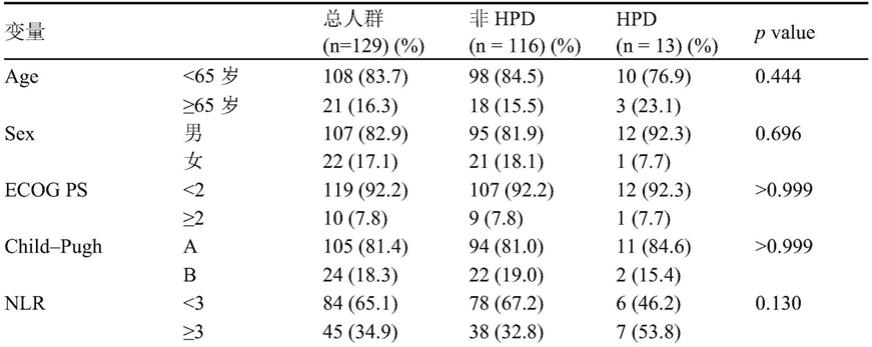
图2为pd
‑
1抑制剂治疗原发性肝癌患者hpd风险模型的受试者工作特征曲线。
具体实施方式
[0045]
以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
[0046]
hpd,超进展性疾病;
[0047]
ici,免疫检查点抑制剂;
[0048]
pd
‑
1,程序性死亡受体
‑
1;
[0049]
pd
‑
l1,程序性死亡配体
‑
1;
[0050]
pd,进展;
[0051]
pfs,无进展生存期;
[0052]
pr,部分反应;
[0053]
ps,体力活动状态;
[0054]
sd,病情稳定。
[0055]
材料与方法
[0056]
本研究为2018年8月至2020年10月在南方医院经组织学或临床诊断为原发性肝癌后接受pd
‑
1抑制剂治疗的患者的回顾性研究,纳入标准如下:
[0057]
(1)pd
‑
1抑制剂输注记录在电子病历和医嘱中;
[0058]
(2)东部肿瘤协作组表现状态(ecog ps)≤2分;
[0059]
(3)child
‑
pugh评分a/b阶段。
[0060]
排除标准如下:
[0061]
(1)基线数据缺失;
[0062]
(2)没有可测量的靶病灶;
[0063]
(3)治疗前后缺乏必要的影像学检查;
[0064]
(4)除原发性肝癌外,存在其他肿瘤。
[0065]
患者选择流程图如图1所示。
[0066]
申请人回顾性收集了以下数据:年龄、性别、饮酒、吸烟史、丙型肝炎病毒(hbv)感染、丙型肝炎病毒(hcv)感染、ecog ps、child
‑
pugh评分、血常规(中性粒细胞和淋巴细胞计数)和血液生化(丙氨酸氨基转移酶、天冬氨酸氨基转移酶、总胆红素和白蛋白)。pd
‑
1抑制剂治疗前发生转移的器官、发生转移的器官数量、门静脉癌栓(pvtt)、pvtt类型、pd
‑
1抑制剂治疗前的治疗类型。
[0067]
正如之前的研究中提到的,pvtt分为四种类型。所有患者在免疫治疗前后均接受增强型计算机断层扫描(ct)或磁共振成像,所有靶病变均接受基线和免疫治疗后影像学检查以进行评估。基线前扫描在治疗前3个月和基线之间进行。第一次评估扫描在初始免疫治疗后大约2个月进行。ct扫描用于评估基于实体瘤反应评估标准(recist)1.1的治疗反应。主要终点是hpd的发生,根据recist1.1,hpd被定义为从第一次pd
‑
1抑制剂治疗之日到第一次影像学评估的hpd。次要终点是无进展生存期(pfs)。pfs被定义为第一次免疫抑制治疗和进展之间的时间。recist 1.1用于评估患者在首次影像学评估时的疗效,并计算部分缓解/疾病稳定(pr/sd)、无hpd的进展性疾病(pd)和首次影像学评估时的hpd率。
[0068]
hpd的定义:根据申请人的前期研究,申请人根据recist 1.1将hpd定义为:
[0069]
(1)治疗开始后2个月内的pdx,可测量的病灶增加≥10mm;和
[0070]
(2)靶病灶总直径较基线增加≥40%和/或靶病灶总直径较基线≥20%的同时至少两个不同器官出现新病灶。
[0071]
申请人根据治疗反应将患者分为非hpd(pr、sd和无hpd的pd)和hpd(有hpd的pd)组。独立样本t检验、卡方检验或mann
‑
whitney u检验用于评估hpd与分类变量或连续变量之间的相关性(视情况而定)。recist 1.1用于评估治疗效果。
[0072]
申请人使用单变量和多变量逻辑回归分析来确定与hpd相关的临床变量。基于对hpd具有预测意义的临床变量,使用logistic回归建立风险模型。
[0073]
申请人计算了曲线下面积(auc)来评估模型的预测能力。所有测试都是双侧的,并且p值<0.05被认为具有统计学意义。所有统计分析均使用spss 26.0版软件(ibm corp.,armonk,ny,usa)进行。
[0074]
统计分析
[0075]
1、患者特征
[0076]
共有129名接受pd
‑
1抑制剂治疗的患者被纳入分析。两组在免疫治疗前器官转移数、肺转移数、淋巴结转移数、肝切除数上有显着差异(p<0.05);大多数患者年龄低于65岁(n=108,83.7%),男性(n=107,82.9%),child
‑
pugh a级(n=105,81.4%),巴塞罗那临床肝癌(bclc))c期(n=96,74.4%),ecog ps良好(0或1:n=119,92.2%),hbv感染(n=114,88.4%)。49名患者有肝外转移。肺转移35例,淋巴结转移54例。58名患者有pvtt。申请人相关数据见表1。
[0077]
申请人使用recist 1.1来评估129名患者。根据recist 1.1,84名(65.1%)患者患有pr/sd,32名(24.8%)患有无hpd的pd,13名(10.1%)患有hpd。
[0078]
表1.hpd及非hpd患者基线临床特征.
[0079]
[0080][0081][0082]
2、hpd的评估
[0083]
申请人根据recist 1.1评估了hpd。申请人首先评估了接受pd
‑
1抑制剂治疗的患者的肿瘤生长百分比。根据首次使用pd
‑
1前3个月内的影像评估每位患者的基线肿瘤直径,并根据患者首次免疫治疗后约2个月的影像评估肿瘤生长百分比。所有患者的平均肿瘤生
长率为4.98%。17名患者(13.1%)的肿瘤生长百分比≥20%,6名患者(4.7%)的肿瘤生长≥40%。其次,申请人在免疫治疗开始后大约2个月内评估了新转移的状态。31人(24.0%)有两个或多个不同器官的新转移,50名患者没有新转移。关于转移,48人有1例新转移。
[0084]
最后,根据recist 1.1,申请人确定了13名(13/129,10.1%)患有hpd的患者。其中,5例(38.5%)肿瘤生长百分比≥40%,8例(61.5%)肿瘤生长百分比≥20%,在两个以上不同器官有新转移。根据recist 1.1,84例pr/sd患者占总人群的65.1%,32例pd无hpd患者占总人群的24.8%。
[0085]
3、临床变量筛选以及模型构建
[0086]
单变量和多变量分析用于研究与hpd相关的临床变量。单变量分析结果见表2,多变量分析结果见表3。
[0087]
表2单变量分析结果
[0088][0089][0090]
表3多变量分析结果
[0091][0092]
单变量分析显示肺转移、淋巴结转移和肝切除有显着差异。p<0.2的变量(包括肺转移、淋巴结转移、肝切除、中性粒细胞
‑
淋巴细胞比[nlr]、总胆红素、pvtt和肝外转移器官数)和ecog ps、白蛋白和bclc纳入进行多变量分析。
[0093]
其中,发现淋巴结转移和肺转移与hpd显着相关。
[0094]
淋巴结转移的判断标准:从患者mri或ct结果中判定有淋巴结转移。
[0095]
肺转移的判断标准:从患者mri或ct结果中判定有肺转移。
[0096]
ps评分标准:如果肿瘤患者能够正常活动,评0分;如果肿瘤患者症状比较轻,生活能够自理,能够从事轻体力活动的话,评1分;如果肿瘤患者具有明显的症状,但生活还能自理,白天卧床时间不超过50%,评2分;如果肿瘤患者具有明显的症状,白天卧床时间超过了50%,但还是能够起床站立,生活能够部分自理,评3分;如果肿瘤患者症状比较重,卧床不起,评4分;如果肿瘤患者死亡,评5分。
[0097]
在多变量分析中,发现淋巴结转移及肺转移仍有显著性。因nlr、白蛋白及ps评分为评估患者预后的重要临床变量。申请人将淋巴结转移、肺转移、nlr、白蛋白和ps纳入logistic逻辑回归分析建立风险模型评估hpd风险,模型公式为logit(p)=
‑
3.208 1.450
×
淋巴结转移 1.043
×
肺转移 0.610
×
nlr
‑
0.848
×
白蛋白 0.323
×
ps评分。
[0098]
变量赋值为:淋巴结转移0=无,1=有;肺转移0=无,1=有;nlr0=<3,1=≥3;白蛋白0=<35g/l,1=≥35g/l;ps评分0=<2,1=≥2。
[0099]
当p=0.06897,累计分数达到logit(p)=
‑
2.60时,约登指数最大为0.55。当logit(p)≥
‑
2.60预测为hpd高危患者,logit(p)<
‑
2.60即预测为hpd低危患者。
[0100]
4.模型准确性评估
[0101]
接下来申请人使用roc分析验证该风险模型在评估肝癌患者免疫治疗超进展风险的准确性。
[0102]
roc分析见图2,auc为0.801(p<0.001),可以看出本实施例的预测模型具有较高准确性以及可以很好的用于肝癌患者免疫治疗超进展风险的预测中。
[0103]
综上所述,可以看出,本发明的hpd风险模型可用于预测ici治疗的原发性肝癌患者hpd的风险。
[0104]
上述具体实施方式对本发明作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。