1.本发明涉及微芯片及细胞分析技术领域,更具体的说是涉及具有高时间分辨率的单液滴更替捕获微芯片系统及其应用。
背景技术:
2.目前可用于研究单细胞水平信号转导的方法主要包括质谱分析、流式分析、facs分析技术等;上述方法虽具有单细胞分析、高灵敏度和多参数分析的优点,却仍存在两大局限性:
3.一是需要大量的分散的细胞悬浮液;对于贴壁细胞或组织而言,分散的细胞悬浮液在一定程度上破坏了其固有的细胞与细胞间、细胞与组织间的通讯联系,从而会导致细胞信号通路的不确定性扰动;
4.二是现有方法中细胞培养和样品处理等步骤主要依赖于人工操作,使得其时间分辨率一般在数分钟量级,不能够满足快速信号转导分析所要求的时间分辨率;例如细胞受激产生磷酸化响应的过程一般是在数秒至数分的时间范围内,因此研究蛋白质磷酸化反应的快速动力学所需的瞬态分辨率应该在秒量级。
5.实现高时间分辨率的关键在于激励试剂的快速更替,目前用于以高时间分辨率分析细胞信号转导的研究方法主要包括基于连续流体的微流控技术和基于独立液滴的数字微流控技术。其中,基于连续流体的微流控技术为了实现化学激励的快速转换(用于获得高时间分辨率),需要较高的液体流速,从而在微流通道内产生较大的剪切力,这会导致产生额外的与连续流体相关的干扰信号;此外,基于连续流体的微流控系统往往需要集成通道内微阀结构用来避免细胞间的串扰;但相关结构不仅制备繁琐,对其操作也有较高的要求。对于基于独立液滴的数字微流控技术,已有研究人员提出了借助于电润湿现象实现独立液滴发生和输送,完成细胞信号通路检测的方法;其能够在低剪切力作用下完成激励试剂的快速替换,实现快速信号转导分析。然而该方法需要借助电场作用进行液滴操作,芯片涉及电路设计和集成,芯片制备和操作均较为复杂;且该方法分析通量有限,扩展较难。
6.因此,亟待提供一种低剪切作用且能够实现高时间分辨分析的微芯片系统。
技术实现要素:
7.鉴于此,本发明提供了一种基于表面能作用的单液滴捕获微芯片系统,通过对单液滴的捕获控制,可实现高时间分辨率下的反应过程分析。
8.为了实现上述目的,本发明采用如下技术方案:
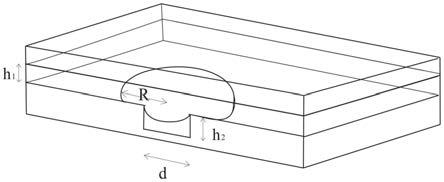
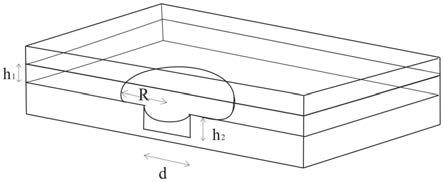
9.具有高时间分辨率的单液滴更替捕获微芯片系统,芯片系统内设置有通道,通道高度小于单液滴直径;通道内设置有凹陷的势阱,势阱内径小于单液滴直径,势阱用于捕获单液滴。
10.由于通道高度小于自然状态下的单液滴直径,因此单液滴在通道内受到挤压呈扁平状。当单液滴通过势阱时,由于通道内凹陷结构使单液滴的表面能得以降低,单液滴的小
部分进入势阱内进而整个单液滴被捕获;后续使其它单液滴以合适的流速流经势阱,即可实现单液滴的更替。
11.上述单液滴捕获微芯片系统应用于捕获单液滴。
12.进一步地,势阱可设置于通道的顶部或底部。
13.利用上述具有高时间分辨率的单液滴更替捕获微芯片系统进行单液滴更替捕获的控制方法之一:
14.在油相作用下,将单液滴以速度q
o
输送至势阱,存在如下三种情况:
15.(1)无捕获模式:当单液滴运动速度q
o
≥单液滴被捕获的临界速度q
c
时,单液滴直接通过势阱,不被捕获;
16.(2)更替模式:当单液滴运动速度大于单液滴更替的临界速度q1,即q1<q
o
<q
c
时,单液滴被捕获于势阱处,并且后一单液滴完全取代前一单液滴,捕获于势阱处,实现单液滴的更替;
17.(3)停驻模式:当单液滴运动速度低于单液滴更替的临界速度q1时,q
o
≤q1时,单液滴被捕获并停驻于势阱中,后续单液滴无法替代被捕获单液滴,继而绕行通过;
18.通过改变q
o
实现单液滴捕获控制。
19.上述具有高时间分辨率的单液滴更替捕获微芯片系统或单液滴更替捕获控制方法可应用于高时间分辨率分析体系,上述分析体系既可以是基于细胞的分析体系,也可以是非细胞反应分析体系。
20.优选地,利用上述具有高时间分辨率的单液滴更替捕获微芯片系统或单液滴更替捕获控制方法进行高时间分辨率下的细胞分析,包括如下操作步骤:
21.(1)将含有细胞的溶液制成单液滴,捕获于势阱处;
22.(2)对捕获于势阱处的细胞进行培养,使细胞沉降并贴壁生长;
23.(3)将激励试剂制成单液滴,通入通道,在更替模式下更替原有液滴,进而原位激励贴壁生长的细胞;
24.(4)将终止激励的试剂制成单液滴,通入微通道,在更替模式下更替原有液滴,进而终止激励细胞;
25.(5)对激励中或激励后的细胞进行原位实时的观察、检测。
26.基于表面能差作用的芯片系统,可实现高时间分辨率下激励试剂的快速且完全更替,进而能够用于细胞快速信号转导的研究。
27.进一步优选地,通过调节含有细胞的溶液中细胞密度,实现单细胞水平分析。
28.进一步优选地,细胞沉降时,芯片系统采用势阱位于通道顶部的结构。
29.优选地,具有高时间分辨率的单液滴更替捕获微芯片系统,包括微通道,第一入口,第二入口,第三入口和出口;
30.微通道包括依次连通的单液滴发生区,输送区和捕获区;
31.单液滴发生区分别通过通道连通外接水相的第一入口和外接油相的第二入口;连通第二入口的通道在连通第一入口的通道两侧与其交汇,交汇处水相稳定形成液滴;液滴发生后继而经过下游通道传至输送区;输送区与外接油相的第三入口连通;液滴在输送区被油相输送至捕获区,捕获区设置有凹陷的势阱,通过控制第三入口油相的注入速度即可实现液滴在捕获区的不同模式的调节;捕获区连通出口。
32.此外,产生单液滴的结构(单液滴发生区)和单液滴流动控制结构(输送区)可替换为其他能够实现相同功能的结构。
33.上述具有高时间分辨率的单液滴更替捕获微芯片系统在捕获单液滴中的应用。
34.利用上述具有高时间分辨率的单液滴更替捕获微芯片系统进行单液滴捕获控制的方法:
35.由第三入口注入油相,在油相作用下,单液滴以速度q
o
输送至势阱,存在如下三种情况:
36.(1)无捕获模式:q
o
≥单液滴被捕获的临界速度q
c
时,单液滴直接通过势阱,不被捕获;
37.(2)更替模式:单液滴更替的临界速度q1<q
o
<q
c
时,单液滴捕获于势阱中,并且后一单液滴完全取代前一单液滴,捕获于势阱中,实现单液滴的更替;
38.(3)停驻模式:q
o
≤q1时,单液滴捕获并停驻于势阱中,后续单液滴无法替代被捕获单液滴,绕行通过;
39.通过改变q
o
实现单液滴捕获控制。
40.本发明具有高时间分辨率的单液滴更替捕获微芯片系统操作简单,通过改变第三入口注入的油相流速即可实现单液滴的捕获、更替,在单液滴替换速度和替换效率的精密调控方面具有突出的优势及应用潜力。
41.进一步优选地,利用上述具有高时间分辨率的单液滴更替捕获微芯片系统或单液滴更替捕获控制方法进行高时间分辨率下的细胞分析,包括如下步骤:
42.由第一入口注入含有细胞的细胞培养液,形成单液滴,捕获于势阱处;
43.对捕获于势阱处的细胞进行培养,使细胞沉降并贴壁;
44.由第一入口注入激励试剂,使激励试剂形成单液滴,更替势阱处的细胞培养液;
45.由第一入口注入激励终止试剂,使终止试剂形成单液滴,更替势阱处的激励液滴;
46.对激励后的细胞进行观察、检测。
47.进一步地,本发明芯片可基于光刻工艺制备模板,然后利用pdms将图形进行翻模,最后经过等离子体键合工艺获得微芯片系统。
48.综上所述,本发明具有高时间分辨率的单液滴更替捕获微芯片系统结构简单,操作方便;可实现单液滴捕获以及单液滴更替控制,适于高时间分辨率下解析细胞快速信号转导的响应机制与动力学过程,也可用于其他非细胞反应的高分辨率分析。
49.具体具备以下特点:
50.(1)可以实现亚秒级时间分辨率下的快速反应过程的分析;
51.(2)可以实现单液滴的完全更替,替换效率理论上可达100%;
52.(3)液滴之间的快速且完全的替换过程,不会产生高水平的剪切力作用;
53.(4)可以实现高时间分辨率下定量原位分析单细胞信号转导通路的研究;且细胞检测分析可在贴壁细胞上原位完成;
54.(5)微芯片系统结构简单,操作简便。
附图说明
55.图1所示为具有高时间分辨率的单液滴更替捕获微芯片系统结构示意图;
56.图中,1.第一入口,2.第二入口,3.第三入口,4.出口;
57.a.通道宽度100μm,b.通道宽度200μm,c.通道宽度400μm,e.通道长度1mm,f.通道长度2mm。
58.图2所示为图1中捕获区局部放大图;
59.图3所示为单液滴捕获、更替模式示意图;
60.图4所示为光刻工艺制备模板流程图;
61.图5所示为单液滴更替过程在高速显微镜拍摄的视频图像;
62.图6所示为细胞贴壁方式示意图;
63.图7所示为势阱内细胞贴壁生长的成像图;
64.图8所示为势阱处细胞的活力测定染色图。
具体实施方式
65.下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
66.实施例1
67.如图1所示,具有高时间分辨率的单液滴更替捕获微芯片系统,包括微通道,第一入口1,第二入口2,第三入口3和出口4。
68.微通道包括依次连通的单液滴发生区,输送区和捕获区。
69.单液滴发生区通过通道连通第一入口1(外接水相)和第二入口2(外接油相);连通第二入口的通道在连通第一入口的通道两侧与其交汇成t形。
70.输送区通过通道与单液滴发生区t形结构处连通;并且输送区通过设置于两侧的通道与第三入口3连通。
71.捕获区与输送区连通;捕获区内设置有势阱式微孔;并且势阱微孔与单液滴发生区的t形结构以及捕获区输送区连通通道在同一延长线上;捕获区上流体所流向的方向(远离输送区的一侧)通过通道与出口4连通。
72.实施例2
73.实施例1具有高时间分辨率的单液滴更替捕获微芯片系统的制备:
74.1.模板设计
75.微通道高度(h1)50μm;捕获区微孔(势阱)直径(d)75μm,深度(h2)50μm(图2),其余尺寸如图1所示。
76.2.制备模板
77.(ⅰ)标准步骤清洗硅片,并用氧等离子体处理约3min;
78.(ⅱ)多层匀胶(负胶,可选用etertec hq
‑
6100),100℃层压在干净硅片上(图4
‑
a和4
‑
b),直至所需厚度;
79.(ⅲ)利用铬掩模板,7mw/cm2的紫外下曝光40s(图4
‑
c);
80.(ⅳ)在质量浓度为1%的碳酸钾水溶液中浸泡显影(图4
‑
d);
81.(
ⅴ
)再次匀胶(图4
‑
e)后,再次于7mw/cm2的紫外下曝光40s进行二次固化;采用二
次曝光步骤而避免了后烘步骤,可大大降低加工时间;
82.(
ⅵ
)曝光后进行显影(图4
‑
f)、后烘坚膜和刻蚀、去胶(4
‑
g)步骤,即可获得多层微结构。
83.3.pdms翻模
84.(ⅰ)采用道康宁pdms(dow corning sylgard 184),将基本组分和固化剂按照10:1重量比完全混合;倒入真空干燥箱内,排除气泡;
85.(ⅱ)轻轻倒入模板,避免混入气泡,静置待其平摊;
86.(ⅲ)干燥箱内85℃,20min固化;
87.(ⅳ)揭膜,分割和打孔;
88.(
ⅴ
)根据实验要求选择等离子体法键合或蘸取液态pdms固化键合;
89.(
ⅵ
)最后对第一入口、第二入口、第三入口和出口进行插管并连接外部注射器或注射泵,从而获得完整的微芯片系统。
90.实施例3
91.使用实施例2制备的具有高时间分辨率的单液滴更替捕获微芯片系统进行单液滴捕获:
92.由第一入口连通水相注射器,由第二入口连通油相注射器,在特定速度下于单液滴发生区形成水相液滴,进一步在微通道内流向下游。
93.由第三入口注入油相,在油相作用下,单液滴a向势阱方向输送,由于捕获区高度远小于自然状态下的单液滴a球形直径,单液滴a呈现挤压状态,储存表面能;使单液滴a小于单液滴被捕获的临界速度q
c
,单液滴a输送至势阱,表面能释放,被势阱捕获,继续输送单液滴b,单液滴b到达势阱处时,存在如下三种情况(图3):
94.(1)无捕获模式:单液滴b速度(即捕获区内油相流速)q
o
≥单液滴被捕获的临界速度q
c
时,单液滴a从势阱中脱出,并且单液滴b及后续单液滴均直接通过势阱,不被捕获;
95.(2)更替模式:单液滴更替的临界速度q1<q
o
<q
c
时,基于hele
‑
shaw cell理论模型,单液滴b完全取代单液滴a,被捕获于势阱中;
96.(3)停驻模式:q
o
≤q1时,单液滴a捕获并停驻于势阱中,单液滴b无法替代单液滴a,绕行通过。
97.可见,通过改变q
o
可以实现单液滴捕获控制。
98.进一步地,利用不同荧光液滴评估试剂更替效率,使用可编程的高精度注射泵向第一入口注入荧光液,微通道内的图像由安装在倒置显微镜的高速摄像机拍摄;如图5所示,在更替模式下,依次使红色、蓝色单液滴进入捕获区,蓝色液滴将红色的液滴从势阱中推出,且在此过程中没有颜色的变化,红色的微液滴被完全地从势阱中推出,因此可认为替换效率在理论上可达100%。
99.进一步地,统计完成一次液滴替换的摄像帧数,即可计算出完成一次液滴完全更替所需的时间。实验结果显示单个替换平均用时为0.4s,完全能够满足快速信号转导动力学分析所要求的秒级时间分辨率。
100.实施例4
101.按照实施例3方法利用实施例2制备的具有高时间分辨率的单液滴更替捕获微芯片系统进行单液滴捕获:
102.第一入口注入细胞悬浮液(细胞悬浮于培养基中),于单液滴发生区产生细胞悬液单液滴,单液滴体积约10nl,将单液滴输送到中间的势阱区域,由于表面能的降低,导致细胞悬液单液滴被势阱捕获,之后停止油相的流动,将微芯片系统放入细胞培养箱中,使被包封的细胞沉降到底部;实验表明,经过2
‑
3h停置,即可实现细胞沉降并贴壁;如图6所示,贴壁时选择势阱位于通道顶部的方式放置。进一步地,可对势阱处的细胞进行原位检测:
103.将微芯片系统放置在配有温度、co2和湿度控制器的显微镜培养箱中培养,对芯片中势阱处的细胞明场成像,如图7所示。
104.进一步地,对势阱区细胞进行培养时可于第一入口注入培养基,通过调节第三入口连通的油相速度,使其达到更替模式,进而将细胞所需要的物质输送到势阱区,而将原来在势阱处的液滴替换掉,从而达到在势阱中培养细胞的目的。可使用hoechst和fda染色试剂评估细胞活力,如图8所示,芯片系统内势阱处贴壁生长的mcf7细胞活性正常。表明本系统及方法对细胞活性无损伤。
105.进一步地,对势阱区细胞进行培养时可于第一入口注入激励试剂或染色试剂,在更替模式下使其经过势阱区细胞,通过荧光显微镜系统监测细胞内荧光变化。
106.本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。