1.本发明属于药物分析技术领域,具体涉及一种月季花特征图谱的构建方法。
背景技术:
2.月季花为蔷薇科植物月季的干燥花,为我国传统常用中药;本品味甘、性温,归肝经,主要功能有活血调经,疏肝解郁,主要用于气滞血瘀、月经不调,痛经,闭经,胸胁胀痛。该药材的质量标准收载于《中国药典》2015年版一部。然而,关于月季花配方颗粒却缺乏相应的质量标准。
3.15版药典规定月季花中含量指示性成分为金丝桃苷和异槲皮苷的总量,无特征图谱或指纹图谱的相关标准,月季花配方颗粒为经水提取、浓缩、干燥、制粒所得的颗粒,已经不具备饮片性状鉴别的特征,相较于饮片而言,月季花配方颗粒的定性检测方法的准确性要求更高。
4.《高效液相色谱法测定月季花中金丝桃苷含量》文献中公开了一种测定月季花中金丝桃苷含量的方法,但是该方法只能通过测定金丝桃苷发现不同批次月季花药材的质量,又由于月季花配方颗粒不具备药材饮片的性状鉴别特征,该方法不能对月季花配方颗粒的质量进行准备判断,快速准确的定性判定配方颗粒是否为月季花品种仍是一个空白。因此,如何全面地控制月季花配方颗粒的成品质量是本发明需要解决的技术问题。
技术实现要素:
5.因此,本发明要解决的技术问题在于克服现有技术中没有月季花配方颗粒的定性检测标准等缺陷,从而提供一种月季花特征图谱的构建方法。
6.为此,本发明提供了以下技术方案。
7.本发明提供了一种月季花特征图谱的构建方法,包括,照高效液相色谱法测定,采用梯度洗脱程序,得到月季花的特征图谱;
8.所述特征图谱的特征峰至少包括异槲皮苷峰和/或鞣花酸峰、金丝桃苷峰。
9.所述特征图谱的特征峰包括6个特征峰,分别是1号峰为鞣花酸,2号峰为金丝桃苷,3号峰为异槲皮苷,4号共有特征峰,5号共有特征峰,6号共有特征峰。
10.所述特征峰的相对保留时间的规定值为:1号峰的相对保留时间rrt为0.90;3号峰的相对保留时间rrt为1.12;4号峰的相对保留时间rrt为1.61;5号峰的相对保留时间rrt为1.81;6号峰的相对保留时间rrt为2.44;其中,2号峰是参照峰;其它特征峰的相对保留时间在规定值的
±
15%内;或,
11.所述特征峰的相对保留时间的规定值为:1号峰的相对保留时间rrt为0.81;2号峰的相对保留时间rrt为0.90;4号峰的相对保留时间rrt为1.43;5号峰的相对保留时间rrt为1.62;6号峰的相对保留时间rrt为2.30;其中,3号峰是参照峰,其它特征峰的相对保留时间在规定值的
±
10%内。
12.所述的构建方法,包括以下步骤,
13.对照品溶液的制备:取异槲皮苷和/或鞣花酸、金丝桃苷,分别加入有机溶剂后得到对照品溶液;
14.供试品溶液的制备:取月季花待测样品制成供试品溶液;
15.色谱条件:照高效液相色谱法测定,以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相a,以乙酸为流动相b,梯度洗脱;检测波长为350-355nm;柱温为33-38℃;
16.测定:吸取对照品溶液与供试品溶液,注入液相色谱仪,测定,即得。
17.所述梯度洗脱的程序包括:0-2min,流动相a:流动相b的体积比为10-12%:90-88%;2-17min,流动相a:流动相b的体积比为12-13%:88-87%;17-30min,流动相a:流动相b的体积比为13-26%:87-74%;30-31min,流动相a:流动相b的体积比为26-100%:74-0%。
18.所述色谱条件:照高效液相色谱法测定,以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相a,以体积分数0.5%乙酸为流动相b,梯度洗脱;检测波长为354nm;柱温为35℃;流速为0.3ml/min。
19.所述供试品溶液的制备具体步骤包括,
20.取月季花配方颗粒,称定重量,加入醇溶剂,经提取后,用所述醇溶剂补足减失的重量,摇匀,滤过,取滤液,即得;
21.所述供试品溶液的浓度为6-50mg/ml。
22.所述提取的方法为超声提取法、振摇提取法或回流提取法。
23.金丝桃苷对照品溶液的浓度为15-25μg/ml;
24.异槲皮苷对照品溶液的浓度为15-25μg/ml;
25.鞣花酸对照品溶液的浓度为25-34μg/ml。
26.本发明技术方案,具有如下优点:
27.1.本发明提供的月季花特征图谱的构建方法,该方法得到的特征图谱可以作为月季花配方颗粒的专属性鉴别方法,用于月季花的定性检测,专属性强,定性检测结果准确度高,该方法构建的特征图谱中包含月季花中的关键成分金丝桃苷、异槲皮苷和鞣花酸的特征峰,可以对特征图谱进行整体质量控制,得到的图谱的准确度高,特征峰的峰形好、分离度高。
28.2.本发明提供的月季花特征图谱的构建方法,金丝桃苷、异槲皮苷均是月季花的有效成分,且保留时间适中,位于图谱中间位置,峰面积占总峰面积比例适宜,比较稳定,有助于色谱峰的确认,以金丝桃苷和异槲皮苷作为特征图谱的特征峰有助于提高特征图谱的稳定性、准确性和重现性。
29.以金丝桃苷、异槲皮苷和鞣花酸为对照品,可以对特征图谱中的特征峰进行指认,能够明确特征图谱中的成分,进一步从整体上加强了特征图谱的专属性,从而更好地控制产品质量。
30.本发明提供的特征图谱的特征峰峰形和重复性好,适用于从整体性、全面性物质基础方面对月季花质量进行精准控制。
31.采用本发明提供的梯度洗脱程序,有助于月季花中的各个成分能够尽可能出峰并互相分离,且分析时间适中,有助于提高特征峰的分离度以及有助于月季花配方颗粒中关键成分的检测,同时还能保证特征峰具有较好的峰形。
附图说明
32.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
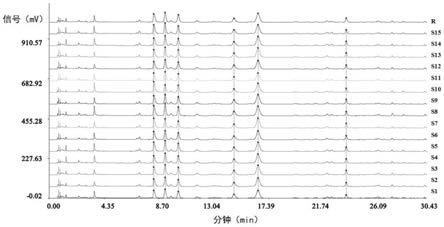
33.图1是本发明实施例1中15批月季花配方颗粒样品的液相色谱图;
34.图2是本发明实施例1中月季花配方颗粒的特征图谱;
35.图3是本发明实验例1中供试品溶液的3d全扫描图;
36.图4是本发明实验例2中对照组1的特征图谱;
37.图5是本发明实验例2中对照组2的特征图谱;
38.图6是本发明实验例2中对照组3和4的特征图谱;
39.图7是本发明实验例3中对照组1的特征图谱;
40.图8是本发明实验例3中对照组2的特征图谱;
41.图9是本发明实验例3中对照组3的特征图谱;
42.图10是本发明实验例3中对照组4的特征图谱;
43.图11是本发明实验例4中正交试验得到的特征图谱;
44.图12是本发明实施例2色谱柱耐用考察部分内容中对照组1的特征图谱;
45.图13是本发明实施例2色谱柱耐用考察部分内容中对照组2的特征图谱。
具体实施方式
46.提供下述实施例是为了更好地进一步理解本发明,并不局限于所述最佳实施方式,不对本发明的内容和保护范围构成限制,任何人在本发明的启示下或是将本发明与其他现有技术的特征进行组合而得出的任何与本发明相同或相近似的产品,均落在本发明的保护范围之内。
47.实施例中未注明具体实验步骤或条件者,按照本领域内的文献所描述的常规实验步骤的操作或条件即可进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规试剂产品。
48.本发明试药及仪器:
49.试药:
50.月季花配方颗粒(共15个批次,批号分别为:kl190725-274200-01、kl190725-250400-02、kl190801-250400-03、kl190916-274000-04、kl190916-250400-05、kl190916-250400-06、kl190916-450000-07、kl190916-250400-08、kl190916-654000-09、kl190916-464000-10、kl190916-250000-11、kl190916-250000-12、kl190916-450000-13、kl190916-654000-14、kl190916-250000-15);
51.本发明中用到的月季花配方颗粒的制备方法的步骤包括:取月季花饮片4400g,加水煎煮,滤过,滤液浓缩成清膏,加辅料适量,干燥,再加入辅料适量,混匀,制粒,制成1000g,分装,即得。
52.金丝桃苷对照品(批号:111521-201708,纯度:95.1%,中国食品药品检定研究院);
53.异槲皮苷对照品(批号:111809-201403,纯度:92.9%,中国食品药品检定研究院);
54.鞣花酸对照品(批号:111959-20190,中国食品药品检定研究院)。
55.试剂:
56.乙腈(默克股份两合公司,ja078530),分析纯;
57.醋酸(fisher scientific,171289),色谱纯;
58.水为蒸馏水(屈臣氏)。
59.仪器:
60.waters acquityh-class超高效液相色谱仪,pda detector检测器,tuv detector检测器,empower 3色谱工作站;
61.xp26电子天平(梅特勒-托利多)和bsa124s电子天平(赛多利斯科技仪器(北京)有限公司);
62.kq-500db超声波清洗器(昆山市超声仪器有限公司)。
63.实施例1
64.本实施例提供了一种月季花配方颗粒特征图谱的构建方法,包括如下步骤:
65.对照品溶液的制备:称取0.2mg金丝桃苷,加入100ml甲醇,制成20μg/ml的金丝桃苷对照品溶液;
66.称取0.2mg异槲皮苷,加入100ml甲醇,制成20μg/ml的异槲皮苷对照品溶液;
67.称取0.3mg鞣花酸,加入100ml甲醇,制成30μg/ml的鞣花酸对照品溶液;
68.供试品溶液的制备:月季花配方颗粒研细,取0.3g,精密称定,置具塞锥形瓶中,加入25ml体积分数30%甲醇水溶液,密塞,称定重量,超声处理30min,放冷,再称定重量,用体积分数30%甲醇水溶液补足减失的重量,摇匀,滤过,取滤液,即得,供试品溶液的浓度为12mg/ml。
69.色谱条件:以十八烷基硅烷键合硅胶为填充剂,色谱柱为cortecs uplc t3,2.1
×
100mm,粒径1.6μm,柱温为35℃;以乙腈为流动相a,以体积分数0.5%乙酸为流动相b,梯度洗脱,洗脱程序见表1,流速为0.3ml/min;检测波长354nm;
70.表1 洗脱梯度程序
71.时间(min)流动相a(%)流动相b(%)0-210-1290-882-1712-1388-8717-3013-2687-7430-3126-10074-031-33100033-34100-100-9034-401090
72.测定:分别取1μl对照品溶液与供试品溶液,注入液相色谱仪,测定。
73.特征峰的确定
74.采用上述方法对15批月季花配方颗粒样品进行超高效液相色谱测定,结果见表2和图1,使用《中药色谱指纹图谱相似度评价系统》(2012.1版本)生成月季花配方颗粒对照
特征图谱,图1中的r为对照特征图谱,根据相对保留时间稳定、各批次样品均能检出以及峰的高度相对较高的原则,选择了6个重复性较好的峰作为特征峰,特征图谱如图2所示。其中,3个峰与对照品的峰的保留时间相同,分别是1号峰对应鞣花酸参照物;2号峰对应金丝桃苷参照物;3号峰对应异槲皮苷参照物,以2号峰作为参照峰(s峰),计算其它特征峰与s峰的相对保留时间,相对保留时间的规定值为:1号峰的相对保留时间rrt为0.90;2号峰的相对保留时间rrt为1.00;3号峰的相对保留时间rrt为1.12;4号峰的相对保留时间rrt为1.61;5号峰的相对保留时间rrt为1.81;6号峰的相对保留时间rrt为2.44;相对保留时间在规定值的
±
15%之内。
75.以3号峰作为参照峰(s峰),计算其它特征峰与s峰的相对保留时间,相对保留时间的规定值为:1号峰的相对保留时间rrt为0.81;2号峰的相对保留时间rrt为0.90;4号峰的相对保留时间rrt为1.43;5号峰的相对保留时间rrt为1.62;6号峰的相对保留时间rrt为2.30;相对保留时间在规定值的
±
10%之内。
76.表2 15批月季花配方颗粒特征峰的相对保留时间
[0077][0078]
实验例1检测波长的考察
[0079]
按照实施例1中的方法制备供试品溶液,进行3d全扫描,扫描结果见图3,结果显示检测波长为354nm时,黄酮类成分有较大吸收,因此,检测波长为354nm。
[0080]
实验例2流动相的考察
[0081]
取同一批次的供试品溶液(kl190725-274200-01),精密称取4份,分别按照实施例1“供试品溶液的制备”项的方法制得供试品溶液,然后分别按照如下色谱条件进样测定,色谱条件:(1)实验组1:以十八烷基硅烷键合硅胶为填充剂,色谱柱cortecs uplc t3,2.1
×
100mm,粒径1.6μm,柱温为35℃,流速为0.3ml/min;检测波长354nm;以乙腈为流动相a,以体积分数0.5%乙酸为流动相b进行梯度洗脱,梯度洗脱程序如表1所示,进样量为1μl。
[0082]
(2)对照组1与实验组1的区别仅在于流动相不同,对照组1中选用以甲醇为流动相a,以水为流动相b,所得谱图见图4;
[0083]
(3)对照组2与实验组1的区别仅在于流动相不同,对照组2中选用以乙腈为流动相a,以水为流动相b,所得谱图见图5;
[0084]
(4)对照组3与实验组1的区别仅在于流动相不同,对照组3中选用以乙腈为流动相a,以体积分数0.1%乙酸为流动相b,所得谱图见图6;
[0085]
(5)对照组4与实验组1的区别仅在于流动相不同,对照组4中选用以乙腈为流动相a,以体积分数1.0%乙酸为流动相b,所得谱图见图6。
[0086]
实验结果表明,以乙腈为流动相a,以体积分数0.5%乙酸为流动相b得到的色谱峰的峰形的对称性最好,且色谱峰分离度较好。
[0087]
实验例3洗脱梯度的考察
[0088]
取同一批次的供试品溶液(kl190725-274200-01),分别称取5份,分别按照实施例1供试品溶液的制备”项的方法制得供试品溶液,实验组1按照实施例1“色谱条件”的方法测定特征图谱,进样量为1μl。
[0089]
(1)对照组1:以十八烷基硅烷键合硅胶为填充剂,色谱柱cortecs uplc t3,2.1
×
100mm,粒径1.6μm,柱温为30℃;以乙腈为流动相a,以体积分数0.1%甲酸为流动相b,梯度洗脱,洗脱程序见表3;流速为0.3ml/min;检测波长354nm;得到谱图,见图7。
[0090]
表3 梯度洗脱程序
[0091]
时间(分钟)流动相a(%)流动相b(%)0-310-1290-883-18128818-1912-1588-8519-2515-1885-8225-4018-2382-77
[0092]
(2)对照组2:以十八烷基硅烷键合硅胶为填充剂,色谱柱cortecs uplc t3,2.1
×
100mm,粒径1.6μm,柱温为30℃;以乙腈为流动相a,以体积分数0.1%甲酸为流动相b,梯度洗脱,洗脱程序见表4;流速为0.3ml/min;检测波长354nm;得到谱图,见图8。
[0093]
表4 梯度洗脱程序
[0094]
时间(分钟)流动相a(%)流动相b(%)0-410-1290-884-1512-1388-8715-3013-2687-74
[0095]
(3)对照组3:以十八烷基硅烷键合硅胶为填充剂,色谱柱cortecs uplc t3,2.1
×
100mm,粒径1.6μm,柱温为30℃;以乙腈为流动相a,以体积分数0.1%甲酸为流动相b,梯度洗脱,洗脱程序见表5;流速为0.2ml/min;检测波长354nm;得到谱图,见图9。
[0096]
表5 梯度洗脱程序
[0097]
时间(分钟)流动相a(%)流动相b(%)0-211892-1211-1289-8812-3512-3688-64
[0098]
(4)对照组4:以十八烷基硅烷键合硅胶为填充剂,色谱柱cortecs uplc t3,2.1
×
100mm,粒径1.6μm,柱温为30℃;以乙腈-0.05%磷酸为流动相,等度洗脱,;流速为0.2ml/min;检测波长354nm;得到谱图,见图10。
[0099]
结果表明,对照组1-4的洗脱梯度程序得到的特征图谱的特征峰的分离度和峰形欠佳。
[0100]
实验例4供试品溶液制备方法的考察
[0101]
方法一:取0.3g月季花配方颗粒,精密称定,置具塞锥形瓶中,分别按照实验安排精密加入30%甲醇,密塞,称定重量,超声提取,再称定重量,用30%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
[0102]
方法二:取0.3g月季花配方颗粒,精密称定,置具塞锥形瓶中,分别按照实验安排精密加入30%甲醇,密塞,称定重量,振摇提取,再称定重量,用30%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
[0103]
方法三:取0.3g月季花配方颗粒,精密称定,置具塞锥形瓶中,分别按照实验安排精密加入30%甲醇,密塞,称定重量,回流提取,再称定重量,用30%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
[0104]
对提取方法、提取时间和溶剂用量这三个因素进行考察,设计正交试验,正交试验因素水平表和正交试验表见表6和表7。
[0105]
正交试验按照方法一、二、三制备供试品溶液,按照实施例1中的色谱条件测定,图谱见图11,得到各组正交试验的相对峰面积,计算结果见表8。
[0106]
表6 正交实验因素水平表
[0107][0108]
表7 正交实验因素水平表
[0109][0110]
表8 正交试验的相对峰面积计算结果
[0111][0112]
表8,说明提取方法、提取时间和溶剂用量对特征峰没有影响。综合考虑操作简单难易程度以及生产,本发明优先考虑超声提取法。
[0113]
实施例2方法学考察
[0114]
(1)精密度考察实验
[0115]
重复性
[0116]
取月季花配方颗粒(批号:kl190725-274200-01)按照实施例1中的方法配制成供试品溶液,共6份,记为实验组1-6;按照实施例1中的色谱条件进行测试,得到特征图谱,分别以2号峰和3号峰为参照峰,计算其相对峰面积、相对保留时间和rsd,见表9和表10。结果各个特征峰的相对保留时间及相对峰面积的rsd均小于2.0%,表明该方法重复性好,结果如表9和10所示。
[0117]
表9 特征峰保留时间及相对保留时间
[0118][0119]
表10 特征图谱重复性考察峰面积及相对峰面积
[0120]
[0121][0122]
表9和表10表明,以2号峰为参照峰和以3号峰为参照峰得到的其他特征峰的相对保留时间及相对峰面积的rsd均小于2.0%,表明该方法重复性好。
[0123]
中间精密度实验
[0124]
采用waters uplc h-class,tuv检测器,取同一批次的月季花配方颗粒(批号:kl190725-274200-01)制成供试品溶液,共6份,均按实施例1中的色谱条件测定,得到特征图谱,分别以2号峰和3号峰为参照峰,计算其相对峰面积、相对保留时间和rsd,结果见表11和12。
[0125]
表11 特征峰的保留时间及相对保留时间
[0126]
[0127][0128]
表12 特征峰的峰面积及相对峰面积
[0129]
[0130][0131]
从表11和12的结果中可以看出,以2号峰和3号峰为参照峰,得到的其他特征峰的相对保留时间rsd在0-0.2%,相对峰面积的rsd在0-1.0%范围内。不同仪器间相对保留时间rsd范围是0-2.0%,相对峰面积rsd%范围是0-6.5%,表明不同仪器分析对特征图谱有一定的影响。
[0132]
(2)溶液稳定性考察
[0133]
按照实施例1中的方法制备得供试品溶液,室温放置,分别于0、2、4、6、8、10、12、24h按照实施例1中的色谱条件测定,对特征峰进行分析,分别以2号峰为参照峰,3号峰为参照峰,分别得到相对保留时间和相对峰面积,结果见表13和表14。
[0134]
表13 供试品溶液放置不同时间后的特征峰的相对保留时间
[0135]
[0136][0137]
表14 供试品溶液放置不同时间后的相对峰面积
[0138]
[0139][0140]
表13和14中,不同放置时间后的供试品溶液得到的特征图谱中的特征峰相对保留时间均小于2.0%,相对峰面积的rsd均小于2.2%,结果表明供试品溶液在24h内稳定。
[0141]
(3)耐用性实验
[0142]
色谱柱耐用性
[0143]
取同一批次的月季花配方颗粒(批号:kl190725-274200-01),按照实施例1中的方法配制成供试品溶液,共3份;实验组1按照实施例1中的色谱条件进行测试,得到特征图谱,进样量为1μl。
[0144]
对照组1与实验组1的区别仅在于色谱柱不同,对照组1采用waters cortecs uplc c18(1.6μm,2.1
×
100mm)色谱柱,得到的特征图谱见图12。
[0145]
对照组2与实验组1的区别仅在于色谱柱不同,对照组2采用waters acquity uplc beh shield rp18(1.7μm,2.1
×
100mm)色谱柱,得到的特征图谱见图13。
[0146]
结果显示,部分特征峰的相对保留时间超出规定范围,结果表明本方法对不同品牌及长度色谱柱的耐用性较差,因此本发明采用waters corrtec t3(2.1
×
100mm,1.6um)色谱柱。
[0147]
不同柱温的考察
[0148]
取同一批次的供试品溶液(kl190725-274200-01),精密称取3份,按照实施例1制备得供试品溶液,然后分别在33℃、35℃和37℃按照实施例1中的色谱条件进测定,得到特征图谱,进样量为1μl,分别以2号峰为参照峰,3号峰为参照峰,计算保留时间和相对保留时间,见表15。
[0149]
表15 不同柱温下特征峰的相对保留时间
[0150][0151]
表15中,以35℃得到的特征图谱的相对保留时间为参照,其它两个温度得到的特征图谱的6个特征峰的相对保留时间与35℃得到的特征图谱的相对保留时间在
±
10%之内,表明本发明提供的构建方法对不同柱温的耐用性良好。
[0152]
不同酸浓度考察
[0153]
考察流动相ph值的微小变化对构建方法的影响,取同一批次的月季花配方颗粒(kl190725-274200-01),按照实施例1中的方法制备得到供试品溶液,共3份,然后分别按照如下色谱条件进样,色谱条件:(1)对照组1:以十八烷基硅烷键合硅胶为填充剂,色谱柱cortecs uplc t3,2.1
×
100mm,粒径1.6μm,柱温为30℃;以乙腈为流动相a,0.45%醋酸为流动相b,梯度洗脱,洗脱程序同表3;流速为0.3ml/min;检测波长354nm,得到特征图谱。
[0154]
(2)对照组2,与对照组1的区别仅在于流动相b不同,对照组2的流动相b为0.50%醋酸。
[0155]
(3)对照组3,与对照组1的区别仅在于流动相b不同,对照组3的流动相b为0.55%醋酸。
[0156]
然后计算对照组1-3特征图谱中特征峰的相对保留时间,分别以2号峰为参照峰,3号峰为参照峰,计算相对保留时间,结果见表16。
[0157]
表16 不同酸浓度下特征峰的相对保留时间
[0158][0159][0160]
表16可以看出,6个特征峰的相对保留时间在规定值的
±
10%内,不同酸浓度下各色谱峰的分离度较好,说明本发明提供的构建方法对于流动相不同ph值的耐用性良好。
[0161]
本发明提供的月季花配方颗粒特征图谱的构建方法得到的特征图谱的准确度高、特征峰的峰形好、分离度好。
[0162]
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。