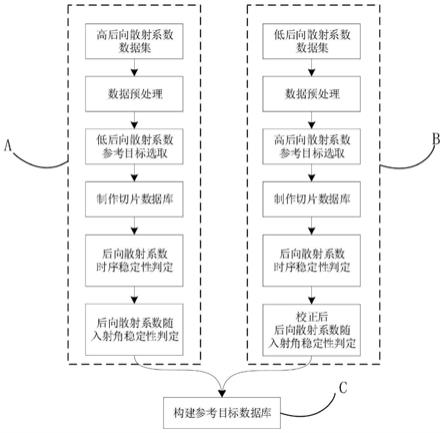
1.本发明属于药物检测技术领域,具体涉及一种槟榔或焦槟榔特征图谱的构建方法及应用。
背景技术:
2.槟榔为棕榈科植物槟榔areca catechu l.的干燥成熟种子,主产于海南,广西等地也有种植。根据炮制方法不同分为槟榔和焦槟榔,槟榔具有杀虫,消积,行气,利水,截疟的功效;焦槟榔具有消食导滞的功效。临床证明,槟榔炮制加工之后可缓和药性及长于消食导滞,其性质变化的根本是所含成分含量的改变,炒焦使槟榔中各类成分的含量均有所下降。
3.由于中药炮制后,性状和成分均会发生变化,对于饮片因为其外观有所变化还可以凭借传统经验实现鉴别,但对于中药配方颗粒其经过水提取已经失去外观性状特点,其难以仅靠外观等传统经验实现鉴别。何晓燕等人发表的《槟榔炒制过程中不同炮制品的特征图谱分析》中记载了,槟榔经过炒焦后其化学成分的含量发生变化,多是槟榔碱等指标成分含量的变化。又由于配方颗粒由单味中药饮片经水提、浓缩、干燥、制粒而成,由于中药配方颗粒经一系列现代制备工艺加工制成后,其化学成分含量及传递亦发生改变。现有技术中缺少一种简便、直观鉴别槟榔和焦槟榔配方颗粒的方法。
技术实现要素:
4.因此,本发明要解决的技术问题在于克服现有技术中没有关于槟榔和焦槟榔的鉴别方法的缺陷,从而提供了一种槟榔或焦槟榔特征图谱的构建方法及应用。
5.为此,本发明提供了以下技术方案。
6.本发明提供了一种槟榔或焦槟榔特征图谱的构建方法,包括获得槟榔或焦槟榔的特征图谱,所述特征图谱的特征峰包括4个共有特征峰,分别是1号峰,2号峰,3号峰和4号峰,其中,2号峰为氢溴酸槟榔碱峰,4号峰为儿茶素峰;
7.以2号峰为参照峰,1号峰的相对保留时间为0.83;以4号峰为参照峰,3号峰的相对保留时间为0.80;
8.其中,共有特征峰的相对保留时间在规定值的
±
10%。
9.所述槟榔或焦槟榔特征图谱的构建方法,包括以下步骤,
10.参照物溶液的制备:分别取氢溴酸槟榔碱和儿茶素对照品制备氢溴酸槟榔碱对照品参照物溶液和儿茶素对照品参照物溶液;
11.取槟榔对照药材制备对照药材参照物溶液;
12.供试品溶液的制备:取待测样品制备得到供试品溶液;
13.色谱条件:照高效液相色谱法测定,以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相a,磷酸为流动相b,梯度洗脱;检测波长200-250nm;流速为0.5-1.5ml/min;
14.测定:分别吸取参照物溶液和供试品溶液,注入高效液相色谱仪,测定,即得;
15.其中,所述梯度洗脱的程序包括:0-5min,流动相a:流动相b的体积比为3%:97%;5-6min,流动相a:流动相b的体积比为3-8%:97-92%;6-45min,流动相a:流动相b的体积比为8%:92%。
16.所述色谱条件:照高效液相色谱法测定,以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相a,以体积分数0.1%磷酸为流动相b,梯度洗脱;检测波长215nm;流速为1.0ml/min;理论塔板数按槟榔碱峰计算应不低于3000。
17.所述对照品参照物溶液的制备步骤包括:分别取氢溴酸槟榔碱和儿茶素对照品,加入体积分数40-60%的醇溶液,即得;
18.所述对照药材参照物溶液的制备步骤包括:取槟榔对照药材,加入体积分数40-60%的醇溶液,提取20-30min,滤过,取续滤液,即得;
19.所述供试品溶液的制备步骤包括,取待测样品,精密称定,加入醇溶液,提取20-40min,补足减失的溶剂,滤过,取续滤液,即得。
20.所述氢溴酸槟榔碱对照品参照物溶液的浓度为20-70μg/ml;所述儿茶素对照品参照物溶液的浓度为50-135μg/ml;
21.所述对照药材参照物溶液的浓度为15-30mg/ml;
22.所述供试品溶液的浓度为3-30mg/ml;
23.所述待测样品为标准汤剂冻干粉待测样品、配方颗粒待测样品、药材待测样品或饮片待测样品。
24.所述待测样品为药材或饮片时,供试品溶液的浓度为15-25mg/ml;所述待测样品为标准汤剂冻干粉或配方颗粒时,供试品溶液的浓度为3-15mg/ml。
25.本发明还提供了一种检测槟榔和焦槟榔的方法,按照上述构建方法同法操作得到待测样品的特征图谱,以待测样品特征图谱中1号峰与2号峰的峰面积比值、4号峰与2号峰的峰面积比值进行检测。
26.所述待测样品为标准汤剂冻干粉待测样品或配方颗粒待测样品时,1号峰的峰高高于2号峰时,所述待测样品为槟榔,2号峰的峰高高于1号峰时,所述待测样品为焦槟榔。
27.进一步地,当待测样品为标准汤剂冻干粉待测样品时,采用式ⅰ和式ⅱ进行检测,当β1>2.2,β2>3.6时,待测样品为槟榔标准汤剂冻干粉;
28.当β1≤2.2,β2≤3.6时,待测样品为焦槟榔标准汤剂冻干粉;
[0029][0030]
其中,s1为1号峰的峰面积,s2为2号峰的峰面积,s4为4号峰的峰面积。
[0031]
进一步地,当待测样品为配方颗粒待测样品时,采用式ⅰ和式ⅱ进行检测,当β1>2.2,β2>3.6时,待测样品为槟榔配方颗粒,反之为焦槟榔配方颗粒;
[0032][0033]
其中,s1为1号峰的峰面积,s2为2号峰的峰面积,s4为4号峰的峰面积。
[0034]
进一步地,当待测样品为饮片或药材时,采用式ⅱ进行检测,当β2>1.8时,待测样品为槟榔,当β2≤1.8时,待测样品为焦槟榔;
[0035][0036]
其中,s2为2号峰的峰面积,s4为4号峰的峰面积。
[0037]
本发明技术方案,具有如下优点:
[0038]
1.本发明提供的槟榔或焦槟榔特征图谱的构建方法,该方法得到的特征图谱的重复性和准确性较好,通过控制洗脱梯度程序,可以保证特征图谱的重复性和稳定性,以及得到的特征峰的峰形好、分离度高。
[0039]
该方法得到的特征图谱的准确度高,可以用于评价槟榔和焦槟榔的质量,同时还可以作为评价基准,用于控制生产槟榔或焦槟榔中各个工艺环节;且特征图谱可以精准的表达不同性状下槟榔和焦槟榔的药效物质的一致性。
[0040]
本发明提供的构建方法得到的特征图谱可以用于鉴别槟榔和焦槟榔。
[0041]
2.本发明提供的检测槟榔或焦槟榔的方法,本发明提供了一种简便快速鉴别样品为槟榔或焦槟榔的方法,通过对特征图谱中1号峰与2号峰的峰面积比值、4号峰与2号峰的峰面积比值进行检测,可以准确鉴别槟榔和焦槟榔,尤其是对槟榔配方颗粒和焦槟榔配方颗粒进行鉴别区分,方法数字化、简单、快速、对操作人员的要求较低。
[0042]
本发明提供的检测槟榔和焦槟榔的方法,该方法可以用来鉴别槟榔和焦槟榔的药材、饮片、标准汤剂冻干粉或配方颗粒,实现了对槟榔和焦槟榔的质量控制。
附图说明
[0043]
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0044]
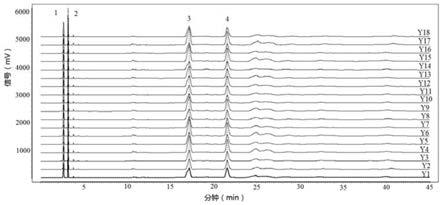
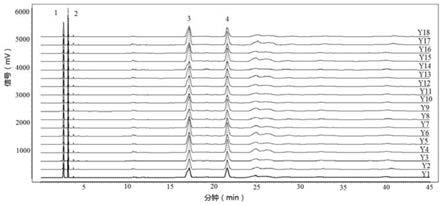
图1是本发明实施例1中18批槟榔饮片的特征图谱;
[0045]
图2是本发明实施例1中18批焦槟榔饮片的特征图谱;
[0046]
图3是本发明实施例1中18批槟榔标准汤剂冻干粉的特征图谱;
[0047]
图4是本发明实施例1中18批焦槟榔标准汤剂冻干粉的特征图谱;
[0048]
图5是本发明实施例1中参照物溶液的特征图谱;
[0049]
图6是本发明实施例1中槟榔配方颗粒的特征图谱;
[0050]
图7是本发明实施例1中焦槟榔配方颗粒的特征图谱;
[0051]
图8是本发明实验例1中实验组1得到的特征图谱;
[0052]
图9是本发明实验例1中对照组1得到的特征图谱;
[0053]
图10是本发明实验例1中对照组2得到的特征图谱;
[0054]
图11是本发明实验例2中对照组1得到的特征图谱;
[0055]
图12是本发明实验例3中对照组得到的特征图谱。
具体实施方式
[0056]
提供下述实施例是为了更好地进一步理解本发明,并不局限于所述最佳实施方式,不对本发明的内容和保护范围构成限制,任何人在本发明的启示下或是将本发明与其
570100-03,记为klj1-klj3。
[0067]
本发明提供的18批不同的饮片的产地分别为,
[0068]
y190617-537000-01产地:广西壮族自治区玉林市玉州区;
[0069]
y190617-570100-02产地:海南省海口市龙华区;
[0070]
y190617-570100-03产地:海南省海口市龙华区;
[0071]
y190617-571500-04产地:海南省万宁市;
[0072]
y190617-571600-05产地:海南省屯昌县;
[0073]
y190617-571200-06产地:海南省定安县;
[0074]
y190617-571400-07产地:海南省琼海市;
[0075]
y190617-571300-08产地:海南省文昌市;
[0076]
y190617-571500-09产地:海南省万宁市;
[0077]
y190617-571500-10产地:海南省万宁市;
[0078]
y190617-571600-11产地:海南省屯昌县;
[0079]
y190617-571600-12产地:海南省屯昌县;
[0080]
y190617-571600-13产地:海南省屯昌县;
[0081]
y190617-570100-14产地:海南省海口市龙华区;
[0082]
y190617-571200-15产地:海南省定安县;
[0083]
y190617-571400-16产地:海南省琼海市;
[0084]
y190617-571400-17产地:海南省琼海市;
[0085]
y190617-571300-18产地:海南省文昌市;
[0086]
上述槟榔饮片批号分别简写y1-y18;
[0087]
焦槟榔饮片是由槟榔饮片炮制得到,炮制方法为滚筒炒药机温度升高至240℃,投入槟榔饮片,转速为20r/min,炒制30min后得到焦槟榔饮片,得到的焦槟榔饮片的批号分别与y1-y18对应,记为jy1-jy18。
[0088]
乙腈为色谱纯,fisher;
[0089]
乙醇为分析纯,国药集团化学试剂有限公司;
[0090]
磷酸为分析纯,fisher;
[0091]
水为屈臣氏纯化水。
[0092]
仪器:
[0093]
waters e2695 hplc高效液相色谱仪,2489uv/vis detector紫外检测器,empower 3色谱工作站;
[0094]
me104e电子天平(梅特勒
·
托利多),jy20002电子天平(梅特勒
·
托利多);
[0095]
kq-300db超声波清洗器(昆山市超声仪器有限公司);
[0096]
电子恒温水浴锅dzkw-4(北京中兴伟业仪器有限公司)。
[0097]
实施例1
[0098]
本实施例提供了一种槟榔或焦槟榔特征图谱的构建方法,包括以下步骤,
[0099]
参照物溶液的制备:取氢溴酸槟榔碱对照品,精密称定,加入体积分数50%乙醇,制成60μg/ml的氢溴酸槟榔碱对照品参照物溶液;
[0100]
取儿茶素对照品,精密称定,加入体积分数50%乙醇,制成120μg/ml的儿茶素对照
品参照物溶液。
[0101]
对照药材参照物溶液的制备:取槟榔标准药材0.5g,置锥形瓶中,加入体积分数50%乙醇25ml,密塞,超声处理30min,超声的功率为300w、频率为40khz,取出,冷却,摇匀,滤过,取续滤液,得到槟榔对照药材参照物溶液,浓度为20mg/ml。
[0102]
颗粒或冻干粉供试品溶液的制备:待测样品研细,取0.1g,精密称定,置锥形瓶中,精密加入体积分数50%乙醇25ml,称定重量,超声处理30min,超声的功率为300w、频率为40khz,放冷,再次称定重量,用体积分数50%乙醇补足减失的重量,摇匀,滤过,取续滤液,即得,供试品溶液的浓度为4mg/ml;
[0103]
饮片供试品溶液的制备:待测样品(饮片)研细,取0.5g,精密称定,置锥形瓶中,精密加入体积分数50%乙醇25ml,称定重量,超声处理30min,超声的功率为300w、频率为40khz,放冷,再次称定重量,用体积分数50%乙醇补足减失的重量,摇匀,滤过,取续滤液,即得,供试品溶液的浓度为20mg/ml。
[0104]
色谱条件:照高效液相色谱法测定,色谱柱采用agilent zorbax eclipse xdb-c18(柱长为250mm,内径为4.6mm,粒径为5μm),以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相a,以体积分数0.1%磷酸为流动相b,梯度洗脱;检测波长215nm;流速为1.0ml/min;柱温为30℃;理论塔板数按槟榔碱峰计算应不低于3000。
[0105]
其中,梯度洗脱程序为,0-5min,流动相a:流动相b的体积比为3%:97%;5-6min,流动相a:流动相b的体积比为3-8%:97-92%;6-45min,流动相a:流动相b的体积比为8%:92%。
[0106]
测定:分别吸取10μl对照品参照物溶液、对照药材参照物溶液和供试品溶液注入高效液相色谱仪中,测定,即得。
[0107]
特征峰的指认:取18批槟榔饮片和18批焦槟榔饮片,按照上述方法制成供试品溶液,然后按照“色谱条件”和“测定”项下,测定得到特征图谱,槟榔饮片和焦槟榔饮片的特征图谱如图1、2所示。取18批槟榔标准汤剂冻干粉和18批焦槟榔标准汤剂冻干粉,按照上述方法制成得到供试品溶液,然后按照“色谱条件”和“测定”项下,测定得到特征图谱,槟榔标准汤剂冻干粉和焦槟榔标准汤剂冻干粉的特征图谱如图3、4所示。选择4个重复性较好的峰作为槟榔或焦槟榔的共有特征峰,分别是1号共有特征峰、2号共有特征峰、3号共有特征峰和4号共有特征峰,槟榔和焦槟榔的特征图谱上的特征峰的相对保留时间一致,区别只在于特征峰的峰面积不同。槟榔或焦槟榔的特征图谱中,应呈现4个特征峰,并与对照药材参照物特征图谱中的4个特征峰相对应,其中,2号峰和4号峰分别与氢溴酸槟榔碱、儿茶素相对应。以2号峰作为参照物峰,其它特征峰的相对保留时间在规定值的
±
10%,1号峰的相对保留时间为0.83,2号峰的相对保留时间为1.00;以4号峰为参照物峰,其它特征峰的相对保留时间在规定值的
±
10%,3号峰的相对保留时间为0.80;4号峰的相对保留时间为1.00。氢溴酸槟榔碱对照品参照物溶液的特征图谱和儿茶素对照品参照物溶液的特征图谱见图5,槟榔或焦槟榔的特征图谱与对照品参照物溶液的图谱比照,可知,2号峰为氢溴酸槟榔碱峰,4号峰为儿茶素峰。
[0108]
取3批槟榔配方颗粒和3批焦槟榔配方颗粒,按照上述方法制备得到供试品溶液,然后按照“色谱条件”和“测定”项下,测定得到特征图谱,如图6和7所示,同时计算槟榔配方颗粒、焦槟榔配方颗粒、槟榔标准汤剂冻干粉和焦槟榔标准汤剂冻干粉、槟榔饮片和焦槟榔
饮片的保留时间和相对保留时间,见表1和表2。从表1和表2的结果中可知,槟榔饮片、焦槟榔饮片、槟榔标准汤剂冻干粉、焦槟榔标准汤剂冻干粉、槟榔配方颗粒和焦槟榔配方颗粒符合本发明构建方法得到的特征图谱,该方法可以实现对槟榔和焦槟榔的质量控制。
[0109]
表1槟榔饮片、标准汤剂和配方颗粒的特征峰的相对保留时间
[0110]
[0111]
[0112][0113]
表2焦槟榔饮片、标准汤剂和配方颗粒的特征峰的相对保留时间
[0114]
[0115][0116]
实施例2
[0117]
本实施例提供了一种检测槟榔配方颗粒和焦槟榔配方颗粒的方法,采用实施例1中的方法构建待测样品的特征图谱,得到待测样品的特征图谱;然后,以待测样品特征图谱中1号峰与2号峰的峰面积比值、4号峰与2号峰的峰面积比值进行检测;具体如下:
[0118]
待测样品溶液的制备方法:配方颗粒待测样品研细,取0.1g,精密称定,置锥形瓶中,精密加入体积分数50%乙醇25ml,称定重量,超声处理30min,超声的功率为300w、频率为40khz,放冷,再次称定重量,用体积分数50%乙醇补足减失的重量,摇匀,滤过,取续滤液,即得,供试品溶液的浓度为4mg/ml。
[0119]
按照实施例1中的“色谱条件”测定,进样量为取10μl,得到特征图谱。
[0120]
按照式ⅰ和式ⅱ,计算配方颗粒待测样品特征图谱中1号峰与2号峰的峰面积比值、4号峰与2号峰的峰面积比值,当β1>2.2,β2>3.6时,配方颗粒待测样品为槟榔配方颗粒;当β1≤2.2,β2≤3.6时,配方颗粒待测样品为焦槟榔配方颗粒;
[0121][0122]
其中,s1为1号峰的峰面积,s2为2号峰的峰面积,s4为4号峰的峰面积。
[0123]
实施例3
[0124]
本实施例提供了一种检测槟榔饮片和焦槟榔饮片的方法,采用实施例1中的方法构建待测样品的特征图谱,得到待测样品的特征图谱;然后,以待测样品特征图谱中1号峰与2号峰的峰面积比值、4号峰与2号峰的峰面积比值进行检测;具体如下:
[0125]
待测样品溶液的制备方法:饮片待测样品,取0.5g,精密称定,置锥形瓶中,精密加入体积分数50%乙醇25ml,称定重量,超声处理30min,超声的功率为300w、频率为40khz,放冷,再次称定重量,用体积分数50%乙醇补足减失的重量,摇匀,滤过,取续滤液,即得,供试品溶液的浓度为20mg/ml。
[0126]
按照实施例1中的“色谱条件”测定,进样量为取10μl,得到饮片的特征图谱。
[0127]
按照式ⅱ,计算饮片待测样品特征图谱中4号峰与2号峰的峰面积比值,当β2>1.8时,饮片待测样品为槟榔,当β2≤1.8时,饮片待测样品为焦槟榔;
[0128][0129]
其中,s2为2号峰的峰面积,s4为4号峰的峰面积。
[0130]
实施例4
[0131]
本实施例提供了一种检测槟榔标准汤剂冻干粉和焦槟榔标准汤剂冻干粉的方法,采用实施例1中的方法构建待测样品的特征图谱,得到待测样品的特征图谱;然后,以待测
样品特征图谱中1号峰与2号峰的峰面积比值、4号峰与2号峰的峰面积比值进行检测;具体如下:
[0132]
待测样品溶液的制备方法:标准汤剂冻干粉待测样品研细,取0.1g,精密称定,置锥形瓶中,精密加入体积分数50%乙醇25ml,称定重量,超声处理30min,超声的功率为300w、频率为40khz,放冷,再次称定重量,用体积分数50%乙醇补足减失的重量,摇匀,滤过,取续滤液,即得,供试品溶液的浓度为4mg/ml。
[0133]
按照实施例1中的“色谱条件”测定,进样量为取10μl,得到标准汤剂冻干粉的特征图谱。
[0134]
按照式ⅰ和式ⅱ,计算标准汤剂冻干粉待测样品特征图谱中1号峰与2号峰的峰面积比值、4号峰与2号峰的峰面积比值,当β1>2.2,β2>3.6时,标准汤剂冻干粉待测样品为槟榔;反之为焦槟榔;
[0135][0136]
其中,s1为1号峰的峰面积,s2为2号峰的峰面积,s4为4号峰的峰面积。
[0137]
实验例1洗脱梯度的考察
[0138]
取同一批次的槟榔标准汤剂冻干粉(b1),按照实施例1“供试品溶液的制备”项下的方法制成供试品溶液,共2份;实验组1按照实施例1“色谱条件”和“测定”项测定,得到特征图谱,如图8所示。
[0139]
对照组1与实验组1的区别仅在于洗脱梯度不同,该对照组的洗脱梯度程序为:0-5min,流动相a:流动相b的体积比为3%:97%;5-45min,流动相a:流动相b的体积比为3-20%:97-80%,得到特征图谱,见图9所示。
[0140]
对照组2实验组1的区别仅在于洗脱梯度不同,该对照组的洗脱梯度程序为:0-5min,流动相a:流动相b的体积比为4%:96%;5-6min,流动相a:流动相b的体积比为4-15%:96-85%;6-30min,流动相a:流动相b的体积比为15%:85,得到特征图谱,见图10所示。
[0141]
实验组1与对照组1、2相比,实验组1的基线较平,色谱峰的分离度较好,因此,选择实验组1的洗脱梯度。
[0142]
实验例2流动相的考察
[0143]
取同一批次的槟榔标准汤剂冻干粉(b1),按照实施例1“供试品溶液的制备”项下的方法制成供试品溶液,共2份;实验组1按照实施例1“色谱条件”和“测定法”项测定,得到特征图谱,同图8。
[0144]
对照组1与实验组1的区别在于流动相和洗脱梯度不同,该对照组的流动相为乙腈(a)-水(b),洗脱梯度为0-12min,流动相a:流动相b的体积比为8%:92%;12-40min,流动相a:流动相b的体积比为8-25%:92-75%;40-55min,流动相a:流动相b的体积比为25-70%:75-30%,得到特征图谱,,如图11所示。
[0145]
实验组1与对照组1相比,对照组1氢溴酸槟榔碱色谱峰峰形及分离度差。
[0146]
实验例3供试品溶液提取溶剂的考察
[0147]
取同一批次的槟榔标准汤剂冻干粉(b1),共2份,实验组1按照实施例1“供试品溶液的制备”项下的方法制成供试品溶液,按照实施例1“色谱条件”和“测定”项测定,得到特
征图谱,同图8。
[0148]
对照组1与实验组1的区别仅在于提取溶剂不同,该对照组用水代替50%乙醇。
[0149]
对照组2与实验组1的区别仅在于提取溶剂不同,该对照组用70%乙醇代替50%乙醇。
[0150]
对照组3与实验组1的区别仅在于提取溶剂不同,该对照组用30%乙醇代替50%乙醇。
[0151]
对照组4与实验组1的区别仅在于提取溶剂不同,该对照组用70%甲醇代替50%乙醇。
[0152]
对照组5与实验组1的区别仅在于提取溶剂不同,该对照组用50%甲醇代替50%乙醇。
[0153]
对照组6与实验组1的区别仅在于提取溶剂不同,该对照组用30%甲醇代替50%乙醇。
[0154]
对照组1-6得到的特征图谱见图12,从图12中可以看出,以水和各浓度的甲醇为提取溶媒时,在氢溴酸槟榔碱对应的位置没有色谱峰,而以70%乙醇、50%乙醇、30%乙醇为溶媒获得的特征图谱所呈现的物质信息基本相同。
[0155]
实验例4方法学验证
[0156]
(1)重复性考察
[0157]
取同一批次的槟榔标准汤剂冻干粉(b1),按照实施例1“供试品溶液的制备”项下的方法制成供试品溶液,共6份,分别编号1-6,再按照实施例1“色谱条件”和“测定”测定,得到特征图谱,计算相对保留时间,结果见表3。
[0158]
取同一批次的焦槟榔标准汤剂冻干粉(j1),按照实施例1“供试品溶液的制备”项下的方法制成供试品溶液,共6份,分别编号7-12,然后按照实施例1“色谱条件”和“测定”测定,得到特征图谱,计算相对保留时间,见表4。
[0159]
表3槟榔标准汤剂的相对保留时间
[0160][0161]
表4焦槟榔标准汤剂的相对保留时间
[0162][0163]
表3和表4的结果可以看出,槟榔标准汤剂冻干粉和焦槟榔标准汤剂冻干粉的相对保留时间的rsd在0.0-0.1%范围内,说明特征图谱的重复性较好。
[0164]
(2)中间精密度考察
[0165]
取同一批次的槟榔标准汤剂冻干粉(b1),按照实施例1“供试品溶液的制备”项下的方法制成供试品溶液,共6份,分别编号1-6,然后采用不同的高效液相色谱仪按照实施例1“色谱条件”和“测定法”项测定,得到特征图谱,然后计算相对保留时间,见表5。
[0166]
取同一批次的焦槟榔标准汤剂冻干粉(j1),按照实施例1“供试品溶液的制备”项下的方法制成供试品溶液,共6份,分别编号7-12,然后采用不同的高效液相色谱仪按照实施例1“色谱条件”和“测定”项测定,得到特征图谱,然后计算相对保留时间,见表6。
[0167]
表5槟榔标准汤剂的相对保留时间
[0168][0169]
表6焦槟榔标准汤剂的相对保留时间
[0170]
[0171][0172]
表5和表6的结果中可以看出,槟榔标准汤剂冻干粉的相对保留时间rsd在0.0%-0.1%范围内,不同仪器间相对保留时间rsd范围是0.0-1.8%。焦槟榔标准汤剂冻干粉的相对保留时间rsd在0.1%-0.2%范围内,不同仪器间相对保留时间rsd范围是0.0-1.9%,表明通过不同仪器间的检测结果符合分析要求。
[0173]
(3)稳定性考察
[0174]
取同一批次的槟榔标准汤剂冻干粉(b1),按照实施例1“供试品溶液的制备”项下的方法制成供试品溶液,共7份,然后分别于室温下放置0、2、4、8、10、12、24h后按照实施例1“色谱条件”和“测定”项测定,得到特征图谱,计算相对保留时间,见表7。
[0175]
取同一批次的焦槟榔标准汤剂冻干粉(j1),按照实施例1“供试品溶液的制备”项下的方法制成供试品溶液,共7份,然后分别于室温下放置0、2、4、8、10、12、24h后按照实施例1“色谱条件”和“测定”项测定,得到特征图谱,计算相对保留时间,见表8。
[0176]
表7焦槟榔标准汤剂的相对保留时间
[0177][0178]
表8焦槟榔标准汤剂的相对保留时间
[0179][0180]
表7和表8的结果中可以看出,槟榔各个特征峰的相对保留时间rsd在0.0%-0.1%范围内,焦槟榔各个特征峰的相对保留时间rsd在0.0%-0.1%范围内,表明供试品溶液中的化学成分在24h内具有较好的稳定性。
[0181]
(4)耐用性考察
[0182]
a、流速的考察
[0183]
取同一批次的槟榔标准汤剂冻干粉(b1),按照实施例1“供试品溶液的制备”项下的方法制成供试品溶液,共3份,实验组1按照实施例1“色谱条件”和“测定”项测定,得到特征图谱,然后计算相对保留时间,结果见表9。
[0184]
对照组1与实验组1的区别仅在于流速不同,对照组1的流速为0.8ml/min;
[0185]
对照组2与实验组1的区别仅在于流速不同,对照组2的流速为1.2ml/min。
[0186]
取同一批次的焦槟榔标准汤剂冻干粉(j1),按照实施例1“供试品溶液的制备”项下的方法制成供试品溶液,共3份,实验组2按照实施例1“色谱条件”和“测定”项测定,得到特征图谱,然后计算相对保留时间,结果见表10。
[0187]
对照组3与实验组2的区别仅在于流速不同,对照组3的流速为0.8ml/min;
[0188]
对照组4与实验组2的区别仅在于流速不同,对照组4的流速为1.2ml/min。
[0189]
表9槟榔标准汤剂的相对保留时间
[0190][0191]
表10焦槟榔标准汤剂的相对保留时间
[0192]
[0193]
表9和表10的结果中可以看出,槟榔标准汤剂冻干粉的相对保留时间rsd在0.0%-1.5%范围内,焦槟榔标准汤剂冻干粉的相对保留时间rsd在0.3%-1.5%范围内,表明不同的流速对构建特征图谱无影响。
[0194]
b、柱温的考察
[0195]
取同一批次的槟榔标准汤剂冻干粉(b1),按照实施例1“供试品溶液的制备”项下的方法制成供试品溶液,共3份,实验组1按照实施例1“色谱条件”和“测定”测定,得到特征图谱,然后计算相对保留时间,结果见表11。
[0196]
对照组1与实验组1的区别仅在于柱温不同,对照组1的柱温为28℃;
[0197]
对照组2与实验组1的区别仅在于柱温不同,对照组2的柱温为32℃。
[0198]
取同一批次的焦槟榔标准汤剂冻干粉(j1),按照实施例1“供试品溶液的制备”制成供试品溶液,共3份,实验组2按照实施例1“色谱条件”和“测定”项测定,得到特征图谱,然后计算相对保留时间,结果见表12。
[0199]
对照组3与实验组2的区别仅在于柱温不同,对照组3的柱温为28℃;
[0200]
对照组4与实验组2的区别仅在于柱温不同,对照组4的柱温为32℃。
[0201]
表11槟榔标准汤剂的相对保留时间
[0202][0203]
表12焦槟榔标准汤剂的相对保留时间
[0204][0205][0206]
表11和表12的结果中可以看出,槟榔标准汤剂冻干粉的相对保留时间rsd在0.0%-0.6%范围内,焦槟榔标准汤剂冻干粉的相对保留时间rsd在0.0%-0.6%范围内,表明柱温对构建特征图谱无影响。
[0207]
c、酸度的考察
[0208]
取同一批次的槟榔标准汤剂冻干粉(b1),按照实施例1“供试品溶液的制备”项下的方法制成供试品溶液,共3份,实验组1按照实施例1“色谱条件”和“测定”项测定,得到特征图谱,然后计算相对保留时间,结果见表13。
[0209]
对照组1与实验组1的区别仅在于酸度不同,对照组1中的流动相b为体积分数0.05%磷酸;
[0210]
对照组2与实验组1的区别仅在于酸度不同,对照组2中的流动相b为体积分数
0.15%磷酸。
[0211]
取同一批次的焦槟榔标准汤剂冻干粉(j1),按照实施例1“供试品溶液的制备”项下的方法制成供试品溶液,共3份,实验组2按照实施例1“色谱条件”和“测定”项测定,得到特征图谱,然后计算相对保留时间,结果见表14。
[0212]
对照组3与实验组2的区别仅在于酸度不同,对照组3中的流动相b为体积分数0.05%磷酸;
[0213]
对照组4与实验组2的区别仅在于酸度不同,对照组4中的流动相b为体积分数0.15%磷酸。
[0214]
从表13和表14的结果来看,酸度对特征图谱的构建无影响。
[0215]
表13槟榔标准汤剂的相对保留时间
[0216][0217]
表14焦槟榔标准汤剂的相对保留时间
[0218][0219][0220]
d、色谱柱的考察
[0221]
取同一批次的槟榔标准汤剂冻干粉(b1),按照实施例1“供试品溶液的制备”项下的方法制成供试品溶液,共3份,实验组1按照实施例1“色谱条件”和“测定”项测定,得到特征图谱,然后计算相对保留时间,结果见表13。
[0222]
对照组1与实验组1的区别仅在于色谱柱不同,对照组1中的色谱柱为welch xtimate c18(4.6*250mm,5μm);
[0223]
对照组2与实验组1的区别仅在于色谱柱不同,对照组2中的色谱柱为waters xterra ms c18(4.6*250mm,5μm)。
[0224]
取同一批次的焦槟榔标准汤剂冻干粉(j1),按照实施例1“供试品溶液的制备”项下的方法制成供试品溶液,共3份,实验组2按照实施例1“色谱条件”和“测定”项测定,得到特征图谱,然后计算相对保留时间,结果见表14。
[0225]
对照组3与实验组2的区别仅在于色谱柱不同,对照组3中的色谱柱为welch xtimate c18(4.6*250mm,5μm);
[0226]
对照组4与实验组2的区别仅在于色谱柱不同,对照组4中的色谱柱为waters xterra ms c18(4.6*250mm,5μm)。
[0227]
表15槟榔标准汤剂的相对保留时间
[0228][0229]
表16焦槟榔标准汤剂的相对保留时间
[0230][0231]
(5)β值考察
[0232]
a、标准汤剂冻干粉的β1、β2考察
[0233]
计算18批槟榔标准汤剂冻干粉和18批焦槟榔标准汤剂冻干粉的β1值和β2值,结果见表17。
[0234]
表17槟榔和焦槟榔标准汤剂冻干粉的β1值和β2值
[0235][0236]
槟榔标准汤剂β1范围为2.46-4.48,β2范围为3.98-5.07;焦槟榔标准汤剂β1范围
为1.24-2.14,β2范围为1.71-3.37。β1、β2用来作为检测槟榔和焦槟榔标准汤剂冻干粉的鉴别点。
[0237]
b、配方颗粒的β1、β2考察
[0238]
计算3批槟榔配方颗粒和3批焦槟榔配方颗粒的β1值和β2值,见表18。
[0239]
表18槟榔和焦槟榔配方颗粒的β1值和β2值
[0240][0241]
槟榔配方颗粒β1范围为5.88-6.39,β2范围为6.27-7.12;焦槟榔配方颗粒β1范围为1.95-2.15,β2范围为3.22-3.47;β1、β2用来作为检测槟榔和焦槟榔配方颗粒的鉴别点。
[0242]
c、饮片的β2考察
[0243]
取18批槟榔饮片和18批焦槟榔饮片,按照实施例1中的方法制备得到供试品溶液,按照实施例1“色谱条件”测定,进样量为10μl,得到特征图谱,计算β2值,见表19。
[0244]
表19槟榔和焦槟榔饮片的β2值
[0245][0246]
表19中,槟榔饮片β2范围为1.88-2.30;焦槟榔配方颗粒β2范围为1.02-1.72;β2用来作为检测槟榔和焦槟榔配方颗粒的鉴别点。
[0247]
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或
变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。