1.本发明涉及中药领域,具体涉及一种中药中物质量值传递规律的评价指标的构建及评价方法。
背景技术:
2.众所周知,中药制剂保留了中药化学成分多样化的特性,其有效性是多种化学成分共同作用的结果,在中药制剂中各种化学成分应保持一定的相对比例,某些成分过低则难以发挥药效,某些成分过高则有可能产生毒副作用,具有安全隐患;因此应控制化学成分的传递,应描述化学成分传递的量值趋势及量值范围。在工艺过程中要关注各个成分是否存在转化、降解等现象,控制化学成分的传递,当物质成分的量值传递较低,说明该成分在中药制剂中转移较差或者发生分解(即负转化),若为主要活性成分,在生产中则需要进行控制,保证其临床药效,当物质传递量值传递明显过高时,说明该成分在中药制剂中得到富集或存在物质的正转化过程,则应重点监控,控制富集或正转化程度,保证其临床应用的安全性,因此物质量值传递是中药制剂的关键通路。
3.中药饮片标准汤剂是饮片以中医药理论为指导,临床应用为基础,经标准化工艺制备而成的水煎液。标准汤剂作为中药配方颗粒标准参照物及经典名方制剂质量基准物质,能够保证配方颗粒或经典名方制剂与传统中医临床所使用的质量疗效一致。如何描述饮片
‑
标准汤剂的物质量值传递则是标准汤剂研究的重点。
4.目前,对于如何进行量值传递的评价还处于摸索阶段,虽然学者尝试以相似度、峰相对保留时间及峰数目等方式描述饮片
‑
标准汤剂化学成分的变化,如文章《野菊花饮片、标准煎液、配方颗粒uplc特征图谱相关性研究》以特征图谱相似度表述饮片
‑
标准汤剂
‑
配方颗粒的化学成分变化;文章《栀子标准汤剂的量值传递规律》以特征图谱峰的个数对比饮片
‑
标准煎液的成分对比。但上述评价方式均属于定性评价,不适用于物质量值传递规律的分析。
5.而传统的指标成分转移率是以成分含量的相对值进行定量评价,能够表明物质成分的变化趋势,但仅适用于有对照品参照的成分,对于无对照品参照的成分,并无法有效获取相应物质传递的量值情况,极大地限制物质传递规律的评价。
技术实现要素:
6.因此,本发明要解决的技术问题在于:克服现有技术中在无对照品参照的情况下,现行方法不能够有效用于物质量值传递规律的评价的问题;从而提供一种中药中物质量值传递规律的评价指标的构建方法;该评价指标无需对照品,也能够有效对中药中物质量值的传递规律进行评价,同时,本发明还公开了采用该评价方法对工艺参数进行质控的方法。
7.一种表示中药中物质量值传递规律的评价指标的构建方法,包括:
8.获取采用中药材饮片制备获得的样品的干膏量;
9.获取中药材饮片制备得到的饮片溶液的饮片浓度,样品制备得到的供试品溶液的
供试品浓度,饮片溶液以及供试品溶液的指纹图谱或特征图谱,并根据获取的指纹图谱或特征图谱获得相应特征峰的饮片特征峰面积和供试品特征峰面积;
10.采用干膏量、饮片特征峰面积、样品特征峰面积、饮片浓度、供试品浓度构建表示物质量值传递规律的评价指标k值。
11.所述k值的计算公式如下:
[0012][0013]
同一物质在相同方法至少两个波长进行检测的情况下,选择最大吸收波长下的特征峰的峰面积进行k值的计算。
[0014]
一种评价中药中物质量值传递规律的方法,包括:
[0015]
采用表示中药中物质量值传递规律的评价指标k值对获得的样品的各物质的量值传递规律进行评价,该样品为采用中药材饮片制备成产物的制备工艺中各步骤获取的中间产品或最终的产物;
[0016]
当k值小于0.3时,表示该特征峰所代表的物质不易转移或者发生负转化;k值大于1时,表示该特征峰所代表的物质富集或发生正转化。
[0017]
对k值小于0.3以及k值大于1的特征峰进行重点评价。
[0018]
所述样品为中间产物、标准汤剂或中药配方颗粒。
[0019]
所述k值的获取过程如下:
[0020]
采用中药材饮片制备获得样品,并采用样品制备供试品溶液,获取样品的干膏量以及供试品溶液的供试品浓度;
[0021]
采用中药材饮片制备饮片溶液,获取饮片溶液的饮片浓度;
[0022]
采用饮片溶液和供试品溶液进行检测获得指纹图谱或特征图谱,获取各特征峰的饮片特征峰面积和供试品特征峰面积;
[0023]
根据获取的干膏量、饮片浓度、供试品浓度、饮片特征峰面积以及供试品特征峰面积计算获得各物质的k值,具体计算公式如下:
[0024][0025]
所述饮片溶液的制备过程为:获取中药材饮片,研细,精密称定,加入溶剂,精密称重,加热回流或/和超声处理,放冷,摇匀,再称定重量,用溶剂补足减失的重量,摇匀,滤过,取续滤液,作为饮片溶液;
[0026]
所述供试品溶液的制备过程为:获取样品,精密称定,加入溶剂,精密称重,加热回流或/和超声处理,放冷,摇匀,再称定重量,用溶剂补足减失的重量,摇匀,滤过,取续滤液,作为供试品溶液。
[0027]
采用上述的一种评价中药材物质量值传递规律的方法对工艺参数进行质控的方法,包括:获取中药材饮片的标准汤剂,获取标准汤剂中各个物质所对应的特征峰的k值;获取中药材饮片的样品,获取样品中相应物质所对应的各个特征峰的k值,
[0028]
筛选出样品中与标准汤剂相同物质所对应的特征峰的k值最为接近的k值,该k值
所对应的工艺参数即为最佳工艺。
[0029]
所述制备标准汤剂所用的中药材饮片与制备样品所用的中药材饮片为相同批次的中药材饮片。
[0030]
所述样品为金银花的标准汤剂时,所述标准汤剂中新绿原酸的k值范围为2.13
‑
3.72,绿原酸的k值为0.49
‑
0.72,断氧化马钱苷酸的k值为0.75
‑
0.89,隐绿原酸的k值为 1.23
‑
1.74,獐牙菜苷的k值为0.52
‑
0.90,断氧化马钱子苷的k值为0.73
‑
1.08,异绿原酸 b的k值为4.65
‑
7.23,异绿原酸a的k值为0.21
‑
0.33,异绿原酸c的k值为1.11
‑
1.50。
[0031]
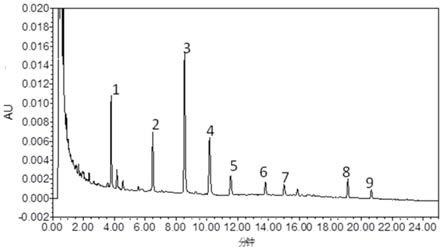
所述样品为地黄的标准汤剂时,所述标准汤剂中洋地黄叶苷b的k值为0.28
‑
0.60,毛蕊花糖苷的k值为0.22
‑
0.49,异毛蕊花糖苷的k值为0.52
‑
1.65,6
‑
o
‑
e
‑
阿魏酰基筋骨草醇的k值为0.23
‑
0.40。
[0032]
所述样品为西洋参的标准汤剂时,所述标准汤剂中人参皂苷rg1的k值为0.12
‑
0.35,人参皂苷re的k值为0.12
‑
0.36,人参皂苷r b1的k值为0.17
‑
0.50,人参皂rc的k值为0.15
‑
0.49,人参皂rd的k值为0.17
‑
0.56。
[0033]
所述样品为乌梅的标准汤剂时,所述标准汤剂中苹果酸的k值为0.37
‑
1.40,枸橼酸的k值为0.57
‑
0.81,5
‑
羟甲基糠醛的k值为0.32
‑
1.69,绿原酸的k值为0.46
‑
0.99。
[0034]
所述样品为北柴胡的标准汤剂时,所述标准汤剂中柴胡皂苷c的k值范围为 0.10
‑
0.21,柴胡皂苷f的k值为0.07
‑
0.18,柴胡皂苷a的k值为0.06
‑
0.14,柴胡皂苷b2的k值为4.11
‑
9.84,柴胡皂苷b1的k值为1.33
‑
5.86。
[0035]
本发明技术方案,具有如下优点:
[0036]
1.本发明提供了一种表示中药中物质量值传递规律的评价指标的构建方法,通过本发明的方法构建了一种新的表示物质量值传递规律的评价指标k值,该评价指标无需成分对照品的引入,在缺少成分对照品的前提下也能够表示中药材饮片制备成产物的过程中样品的物质的量值传递规律,与中药材饮片制备成产物的过程中样品的各物质的转移率的值和变化趋势一致,其不仅仅能表示已知物质的量值传递规律,还能有效表示未知物质的量值传递规律,效果显著。
[0037]
2.本发明提供了一种评价中药材物质量值传递规律的方法,具体为:采用k值对中药材中各物质的量值传递规律进行评价的方法,该k值的变化趋势与有效成分的转移率的变化趋势一致,当k值大于1,表明该类成分至标准汤剂中得到富集或存在物质的正转化过程;当k值小于0.3时,表明该类成分至标准汤剂中不易转移或发生分解(即负转化);且k值的获取无需成分对照品的引入,在缺少成分对照品的前提下也能够进行多成分分析,同时降低了多因子对于结果分析的影响,由于k值能够科学地分析中药材中的各物质的量值传递规律,因此,可以用于实现中药配方颗粒或其中间产物,或者中药经方或者其中间产物中各类已知或未知物质的量值传递规律的评价,更好的保证配方颗粒或经方的临床应用的安全性。
[0038]
3.本发明还提供了采用上述k值进行工艺参数质控的方法,具体包括:获取中药材的标准汤剂,获取标准汤剂中各个特征峰的k值;获取中药材的样品,获取样品中各个特征峰的k值,筛选出样品中与标准汤剂对应特征峰的k值最为接近的k值所对应的工艺参数即可;该方法可以有效筛选出与标准汤剂的物质基础更为接近的样品的工艺参数条件,使制备出的样品与标准汤剂的物质基础一致,进而能够保证样品与标准汤剂的一致性,提高临
床应用的药效及安全性。
附图说明
[0039]
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0040]
图1是本发明中实施例1中18批标准汤剂的特征图谱;
[0041]
图2是本发明中实施例1中乌梅标准汤剂和饮片的对照图谱;
[0042]
图3是本发明实施例2中标准汤剂的特征图谱;
[0043]
图4是本发明实施例3中标准汤剂的特征图谱;
[0044]
图5是本发明实施例4中标准汤剂的特征图谱;
[0045]
图6是本发明实施例5中检测波长为211nm时的标准汤剂的特征图谱;
[0046]
图7是本发明实施例5中检测波长为250nm时的标准汤剂的特征图谱。
具体实施方式
[0047]
实施例1
[0048]
一种评价中药配方颗粒物质量值传递规律的方法,中药配方颗粒为乌梅配方颗粒,具体如下:
[0049]
1.1标准汤剂制备
[0050]
称取乌梅饮片200g,煎煮两次,一煎加入6倍量水,浸泡30min,500w煮沸,200w 持微沸30min,二煎加入4倍量水,500w煮沸,200w保持微沸20min,趁热用200目滤布过滤煎液,合并两次煎液,迅速冷却,50℃减压浓缩至料液比约为1:1,冷冻干燥得乌梅标准汤剂冻干粉。
[0051]
1.2出膏率测定
[0052]
取摇匀后的乌梅标准汤剂总药液重的约十分之一,置于已恒重的蒸发皿中,水浴蒸干,于105℃电热鼓风干燥箱中,干燥5小时后,取出,放于干燥器中冷却30min,称定重量。每批平行2份测定,根据公式“出膏率=干膏量/饮片量
×
100%”计算,结果见表 1。
[0053]
表1乌梅标准汤剂出膏率
[0054]
[0055][0056]
1.3特征图谱方法
[0057]
1.3.1仪器、试剂及试药
[0058]
仪器:仪器:waters acquityh
‑
class超高效液相色谱仪,tuv detector 紫外检测器,empower 3色谱工作站;me104e电子天平(梅特勒
·
托利多),jy2002 电子天平(梅特勒
·
托利多),bsa124s电子天平(赛多利斯科技仪器(北京)有限公司),bt25s电子天平(赛多利斯科技仪器(北京)有限公司),kq
‑
500db超声波清洗器(昆山市超声仪器有限公司)。
[0059]
色谱柱:
[0060]
waters acquityhss t3(2.1*100mm,1.8μm)
[0061]
试药:
[0062]
枸橼酸对照品(批号:100396
‑
201603,中国食品药品检定研究院)
[0063]
乌梅对照药材(批号:121208
‑
201305,中国食品药品检定研究院)
[0064]
乌梅饮片、乌梅标准汤剂冻干粉、乌梅配方颗粒
[0065]
试剂:甲醇(merck)、磷酸(fisher scientific)为色谱纯;水为蒸馏水(屈臣氏);其它试剂均为分析纯。
[0066]
1.3.2方法与结果
[0067]
1.3.2.1特征图谱方法
[0068]
色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂(柱长为10cm,内径为2.1mm,粒径为1.8μm);以甲醇为流动相a,以0.2%磷酸为流动相b,按下表2 中的规定进行梯度洗脱;检测波长为210nm;柱温30℃;流速见梯度洗脱表。理论板数按枸橼酸峰计算应均不低于3000。
[0069]
表2梯度洗脱表
[0070]
[0071][0072]
对照品参照物溶液的制备取枸橼酸对照品适量,精密称定,加10%甲醇制成每1ml 含4.0mg的溶液,作为对照品参照物溶液。
[0073]
对照药材参照物溶液的制备取乌梅对照药材约0.5g,精密称定,置锥形瓶中,精密加水25ml,密塞,超声处理(功率250w,频率40khz)30分钟,放冷,滤过,取续滤液,作为对照药材参照物溶液。
[0074]
供试品溶液的制备取样品适量,研细,取约0.2g,精密称定,置锥形瓶中,精密加水25ml,密塞,称定重量,超声处理(功率250w,频率40khz)30分钟,放冷,再称定重量,用水补足减失的重量,摇匀,滤过,取续滤液,即得。
[0075]
饮片溶液的制备取乌梅饮片粉末(过一号筛)约1.0g,精密称定,置具塞锥形瓶中,加水25ml,超声处理30分钟,放冷,摇匀后,滤过,取续滤液,即得。
[0076]
测定法精密吸取对照品参照物溶液、对照药材参照物溶液、供试品溶液及饮片溶液各2ul,注入液相色谱仪,测定,即得。
[0077]
1.3.2.2特征峰确认
[0078]
按照上述供试品溶液的制备方法及液相色谱条件对18批乌梅标准汤剂进行检测,采用《中药色谱特征图谱相似度评价系统》(2012.1版本)进行分析,发现18批乌梅谱图中有6个共有峰分离度及峰面积响应均较好,故确认该6个共有特征峰,通过与对照品指认并利用高效液相串联高分辨飞行时间质谱仪获得其质谱图,根据质谱图对6个特征峰进行结构推断,推断结果如表3所示,峰1指认为苹果酸,峰2指认为枸橼酸,峰 3推断为5
‑
羟甲基糠醛,峰5推断为绿原酸。其中枸橼酸(2号峰)色谱峰分离度较好,峰面积较大且稳定,同时为2015版《中国药典》一部乌梅项下含量测定的指标性成分,故选择该峰作为参照峰(s)见图1所示。
[0079]
表3特征峰质谱推断结果
[0080][0081]
1.3.2.3方法学验证
[0082]
1.3.2.3.1精密度试验
[0083]
精密吸取供试品溶液,分别按照上述色谱检测条件连续进样6次,以枸橼酸峰为参照峰,各共有峰相对保留时间rsd范围为0.0%~0.1%,相对峰面积rsd范围为0.2%~
0.5%,均小于3%,符合特征图谱要求,表明该方法精密度较好。
[0084]
1.3.2.3.2稳定性试验
[0085]
取供试品溶液,分别于0、2、4、8、10、12、24h按上述方法测定,获得其特征图谱,以枸橼酸峰为参照峰,各共有峰相对保留时间rsd范围为0.3%~0.4%,相对峰面积rsd范围为1.3%~2.5%,均小于3%,表明供试品溶液在24h内的稳定性较好。
[0086]
1.3.2.3.3重复性试验
[0087]
取6份供试品溶液,获得其特征图谱,以枸橼酸峰为参照峰,各共有峰相对保留时间rsd范围为0.2%~0.4%,相对峰面积rsd范围为1.1%~2.0%,均小于3%,表明该方法的重复性良好。
[0088]
1.3.2.3.4耐用性考察
[0089]
精密吸取同一供试品溶液,分别在柱温(25℃、30℃、35℃),流动相中磷酸浓度 (0.10%磷酸、0.15%磷酸、0.20%磷酸)条件下进样检测,以枸橼酸峰为参照峰,各共有峰相对保留时间rsd范围为1.3%~2.5%,相对峰面积rsd范围为0.8%~1.6%,表明该方法的耐用性较好。
[0090]
1.4饮片至标准汤剂物质传递分析
[0091]
采用上述特征图谱方法对18批标准汤剂、饮片溶液,按上述色谱条件测定其特征图谱,标准汤剂和饮片供试品溶液的对照图谱如图2所示,并获得的特征图谱数据,包括特征峰峰面积、样品浓度及出膏率,通过检测结果,并根据以下计算公式计算得到k值和有效成分的含量转移率,检测结果如表4和表5所示。
[0092][0093][0094]
表4 18批乌梅k值与转移率对比结果
[0095]
[0096][0097]
表5
[0098][0099]
由图2可见,乌梅饮片经过标准煎煮后,特征图谱所标记的目标峰未有丢失,表明其主要化学成分能从饮片中转移至标准汤剂中。由表4
‑
表5所得饮片到标准汤剂的k值可知:峰1(苹果酸)的k值均值为0.66,转移率均值为0.73;峰2(枸橼酸)转移的k值均值为0.67,转移率均值为0.74;峰3(5
‑
羟甲基糠醛)的k值均值为0.88,转移率均值为 0.98;峰4的k值均值为0.60;峰5(绿原酸)的k值均值为0.68,转移率均值为0.76;峰6 的k值均值为0.66;由于18批次标准汤剂与饮片检测条件存在一定差别,因此k值与含量转移率数值存在区别,但k值与含量转移率的趋势一致,表明在不需要使用对照品的前提下,k值能描述多种成分物质的变化趋势。
[0100]
乌梅中5
‑
羟甲基糠醛成分与含有的其他有机酸成分从饮片到标准汤剂的转移情
况不同,而有机酸类成分转移的趋势一致,k值均值均在0.6~0.7范围内,表明k值能反应有机酸类成分的传递趋势。从而为含有有机酸类成分的中药配方颗粒及经典方制剂生产过程中关键质量控制要点提供参考。
[0101]
1.5工艺关键属性确定
[0102]
由于标准汤剂是配方颗粒的物质基础,因此以标准汤剂的物质成分变化规律作为配方颗粒的关键工艺属性,能够保证配方颗粒与标准汤剂的一致性。由表4、5可知:乌梅标准汤剂峰1的k值范围为0.37
‑
1.40,峰2的k值范围为0.57
‑
0.81,峰3的k值范围为 0.32
‑
1.69,峰4的k值范围为0.38
‑
1.09,峰5的k值范围为0.46
‑
0.99,峰6的k值范围为 0.43
‑
1.04,各峰的k值范围较大。分析主要由于目前原料的质量差异较大导致,若以该范围值作为参照,会出现工艺偏差。鉴于原料质量差异问题不可避免,因此选择符合标准汤剂范围的同批次中药材饮片对应的标准汤剂的k值作为参照,对工艺研究进行质控,保证所得终产品与标准汤剂的一致性。
[0103]
乌梅性平味酸涩,归肝、脾、肺、大肠经,具有敛肺涩肠、生津止渴、驱虫止痢的功效,有机酸与其功效密切相关。通过k值分析可知,6个特征峰的k值除个别批次外均在0.3
‑
1.0范围内,各成分转移的趋势一致,不需要重点监控。鉴于峰2(枸橼酸)为乌梅的指标性成分,因此选择对峰2进行控制,进而控制乌梅有机酸类成分。以同批次标准汤剂中的k值作为可接受转化程度的标准对生产工艺进行质控,制得三批配方颗粒,该三批次乌梅配方颗粒的工艺过程中的各中间产物以及最终的乌梅配方颗粒的k值结果如下表6所示:
[0104]
表6乌梅工艺过程中k值分析
[0105][0106][0107]
由上述结果可知,通过k值确定的工艺关键控制点对颗粒制备过程进行质控后,,
峰2的k值与相应批次标准汤剂k值接近,并均在标准汤剂范围内。可以确定制备得到的颗粒与标准汤剂药效物质基础一致性较好。因此采用k值确定的工艺关键属性能够保证配方颗粒与标准汤剂的一致性,临床应用的药效及安全性。
[0108]
实施例2
[0109]
一种评价中药配方颗粒物质量值传递规律的方法,中药配方颗粒为地黄配方颗粒,具体如下:
[0110]
1.1特征图谱方法
[0111]
色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂(柱长为10cm,柱内径为2.1mm,粒径为1.8μm);以乙腈(含0.1%甲酸)为流动相a,以0.1%甲酸为流动相b,按下表7中的规定进行洗脱;检测波长为334nm;柱温45℃;流速0.45ml/min;进样体积5μl;理论板数按毛蕊花糖苷峰计算应均不低于5000。
[0112]
表7流动相梯度洗脱程序
[0113][0114]
参照物溶液的制备对照品参照物溶液的制备取毛蕊花糖苷对照品适量,精密称定,加水制成每1ml含毛蕊花糖苷3μg的溶液,摇匀,作为对照品参照物溶液。
[0115]
对照药材参照物溶液的制备取地黄(生地黄)对照药材,研细,取约0.2g,精密称定,置具塞锥形瓶中,精密加入水20ml,密塞,超声处理(功率250w,频率40khz) 30分钟,放冷,摇匀,滤过,取续滤液,作为对照药材参照物溶液。
[0116]
供试品溶液的制备取样品适量,研细,取约0.2g,精密称定,置具塞锥形瓶中,精密加入水20ml,密塞,超声处理(功率250w,频率40khz)30分钟,放冷,摇匀,滤过,取续滤液,即得。
[0117]
饮片溶液的制备采用与供试品溶液同批次的中药材饮片,并采用对照药材参照物溶液的制备方法进行制备获得。
[0118]
其中,供试品溶液中的样品的为标准汤剂,该地黄的标准汤剂制备工艺如下:
[0119]
取地黄饮片,置于砂锅中,浸泡30分钟,一煎加入饮片量9倍水,500w煮沸后,200w 煎煮20分钟,趁热过滤,迅速冷却,备用;二煎加饮片量7倍水,500w煮沸后,200w煎煮15分钟,趁热过滤,迅速冷却备用;合并滤液,浓缩(50℃),浓缩至料液比约为1:1,冷冻干燥,即得。
[0120]
测定法精密吸取参照物溶液、饮片溶液、对照药材参照物溶液和供试品溶液各5μl,注入超高效液相色谱仪,测定,即得。
[0121]
供试品特征图谱中应有9个特征峰,如图3所示,并应与对照药材参照物色谱峰中的9个特征峰相对应,且与毛蕊花糖苷参照物峰相应的峰为s峰,计算各特征峰与s峰的相对保留时间,其相对保留时间应在规定值的
±
5%之内。规定值为:0.44(峰1)、 0.76(峰2)、1.00(峰3s)、1.19(峰4)、1.35(峰5)、1.61(峰6)、1.75(峰7)、 2.24(峰8)、2.41(峰9)。其中,峰3为毛蕊花糖苷。
[0122]
1.2k值与含量转移率对比
[0123]
采用上述特征图谱方法对15批地黄饮片及标准汤剂进行测定,以特征峰峰面积、饮片浓度、供试品浓度及出膏率计算k值,并根据现有的对照品对相应特征峰进行含量转移率计算,对比结果如下表8
‑
表9所示:
[0124]
表8地黄k值与转移率对比结果
[0125][0126]
表9
[0127]
[0128][0129]
由表8
‑
9可知,洋地黄叶苷b的转移率均值为0.43,k值均值为0.41;毛蕊花糖苷的转移率均值为0.36,k值均值为0.35;异毛蕊花糖苷的转移率均值为1.14,k值均值为1.08; 6
‑
o
‑
e
‑
阿魏酰基筋骨草醇的转移率均值为0.30,k值均值为0.32。由于15批次标准汤剂与饮片检测条件存在一定差别,因此k值与含量转移率数值存在区别,但k值与含量转移率的趋势一致,表明在不需要使用对照品的前提下,k值能描述多种成分物质的变化趋势。
[0130]
通过质谱分析,对9个特征峰进行结构推断,确定了4个特征峰为:环烯醚萜苷类:洋地黄叶苷b(峰1)、6
‑
o
‑
e
‑
阿魏酰基筋骨草醇(峰6);苯乙醇苷类:毛蕊花糖苷(峰 3),异毛蕊花糖苷(峰4),通过k值分析,地黄饮片
‑
标准汤剂过程中9个特征峰均进行了传递,除峰4、9外,其余各峰k值均小于1。有文献表明,环烯醚萜苷类成分在不同炮制品中含量有显著差异,结合的糖越多,分解速度越慢,由特征峰化学结构可知,地黄标准汤剂中成分多含双糖结构,表明结合二糖的环烯醚萜苷在汤剂中较为稳定,能够实现其有效的转移;而峰4中有9个批次k值大于1,地黄标准汤剂中同时含有毛蕊花糖苷和异毛蕊花糖苷,根据文献报道毛蕊花糖苷与异毛蕊花糖苷在一定条件下可以相互转化,其峰4的k值大于1可能与毛蕊花糖苷在煎煮过程中动态转化为异毛蕊花糖苷有关;峰9未推断出化学结构,但其k大于1,表明有其它成分向其转化。由此可知,地黄标准汤剂中上述成分传递规律符合环烯醚萜苷类及苯乙醇苷类成分的特性,表明k值能够辅助分析饮片
‑
标准汤剂的物质传递情况,利用该传递规律可更好的指导中药配方颗粒的生产和控制。
[0131]
1.3工艺关键属性确定
[0132]
由于标准汤剂是配方颗粒的物质基础,因此以标准汤剂的物质成分变化规律作为配方颗粒的关键工艺属性,能够保证配方颗粒与标准汤剂的一致性。
[0133]
由表8、9可知:地黄标准汤剂峰1的k值范围为0.28
‑
0.60,峰2的k值范围为0.26
‑
0.55,峰3的k值范围为0.22
‑
0.49,峰4的k值范围为0.52
‑
1.65,峰5的k值范围为0.22
‑
0.62,峰6 的k值范围为0.23
‑
0.40,峰7的k值范围为0.27
‑
0.59,峰8的k值范围为0.12
‑
0.68,峰9的k 值范围为0.32
‑
2.74,各峰的k值范围较大。分析主要由于目前原料的质量差异较大导致,若以该范围值作为参照,会出现工艺偏差。鉴于原料质量差异问题不可避免,因此选择符合标准汤剂范围的同批次的中药材饮片制备得到的标准汤剂k值作为参照,对工艺研究进行质控,保证所得终产品与标准汤剂的一致性。
[0134]
在标准汤剂中各个峰k值变化的趋势有些许差别,分析主要由于地黄经过复杂的炮制工艺导致饮片含量差异较大,进而使各峰的k值出现一定差别。鉴于该问题不可避免,因此以各个峰的整体变化趋势进行分析。在标准汤剂中峰1、2、3、5、6、7的k值除个别批次外均在0.30
‑
1.0范围内,峰4、9的k值除个别批次外均大于1.0。其中峰4 (异毛蕊花糖苷)k值大于1,主要由峰3(毛蕊花糖苷)转化导致,而峰3为地黄主要药效成分,因此通过质控峰3可
间接控制峰4的转化。故确定地黄的工艺关键控制成分为峰3、9所代表的成分。
[0135]
以同批次标准汤剂中的k值作为可接受转化程度的标准对生产工艺进行质控,制得三批地黄配方颗粒,该三批次地黄配方颗粒的工艺过程中的各中间产物以及最终的地黄配方颗粒的的k值结果如下表10所示:
[0136]
表10地黄颗粒工艺控制前后的k值分析
[0137][0138]
由上述结果可知,通过k值确定的工艺关键控制点对颗粒制备过程进行质控后,峰 3、峰9的k值均与相应批次标准汤剂k值接近,并均在标准汤剂范围内。可以确定制备得到的颗粒与标准汤剂药效物质基础一致性较好,因此,进一步确定上述三批次的工艺条件制备得到的颗粒均符合要求;综上可知:采用k值确定的工艺关键属性能够保证配方颗粒临床应用的药效及安全性。
[0139]
实施例3
[0140]
一种评价中药配方颗粒物质量值传递规律的方法,中药配方颗粒为西洋参配方颗粒,具体如下:
[0141]
1.1特征图谱方法
[0142]
色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂,柱长为15cm,柱内径为2.1mm,粒径为2.6μm;以乙腈为流动相a,以水为流动相b,按下表11中的规定进行梯度洗脱;检测波长为203nm;柱温30℃;流速0.4ml/min;理论板数均按人参皂苷rb1峰计算应均不低于10000。
[0143]
表11梯度洗脱表
[0144][0145]
参照物溶液的制备取人参皂苷rb1对照品适量,精密称定,加乙腈
‑
水(20:80)混合溶液制成每1ml含人参皂苷rb
1 0.5mg,摇匀,作为对照品参照物溶液。
[0146]
对照药材参照物溶液的制备取西洋参对照药材约1g,精密称定,置锥形瓶中,精密加水25ml,密塞,称定重量,加热回流30分钟,滤过,取续滤液10ml于20ml容量瓶中,加甲醇定容,超声(功率250w,频率40khz)30分钟,取出,放冷,用50%甲醇补足减失的重量,摇匀,滤过,取续滤液,作为对照药材参照物溶液。
[0147]
供试品溶液的制备取样品适量,研细,取约0.5g,精密称定,置具塞锥形瓶中,精密加入50%甲醇50ml,密塞,称定重量,超声处理(功率250w,频率40khz)30 分钟,放冷,再称定重量,用50%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
[0148]
饮片溶液的制备采用与供试品溶液同批次的中药材饮片采用对照药材参照物溶液的制备方法进行制备获得。
[0149]
测定法精密吸取参照物溶液、饮片溶液、对照药材参照物溶液、供试品溶液各 10μl,注入超高效液相色谱仪,测定,即得。
[0150]
其中,供试品溶液中的样品的为标准汤剂,该西洋参的标准汤剂制备工艺如下:
[0151]
取西洋参饮片,置于砂锅中,浸泡30分钟,一煎加入饮片量8倍水,500w煮沸后, 200w煎煮60分钟,趁热过滤,迅速冷却,备用;二煎加饮片量6倍水,500w煮沸后,200w 煎煮40分钟,趁热过滤,迅速冷却备用;合并滤液,浓缩(50℃以下),浓缩至料液比约为1:1,冷冻干燥,即得。
[0152]
供试品特征图谱应呈现8个特征峰,如图4所示,并应与对照药材参照物色谱峰中的8个特征峰相对应,其中峰3应与对照品参照物峰保留时间相一致,以3号峰为s峰,计算各特征峰的相对保留时间,峰1、峰2相对保留时间应在规定值的
±
20%之内,其余峰相对保留时间应在规定值的
±
5%之内,规定值为0.45(峰1)、0.46(峰2)、1.00(峰 s)、1.02(峰4)、1.07(峰5)、1.09(峰6)、1.13(峰7)、1.22(峰8)。其中,峰1为人参皂苷rg1;峰2为人参皂苷re;峰3为人参皂苷rb1;峰4为人参皂苷rc;峰6为人参皂苷rd。
[0153]
1.2k值与含量转移率对比
[0154]
采用上述特征图谱方法对18批西洋参饮片及标准汤剂进行测定,以特征峰峰面积、饮片浓度、供试品浓度及出膏率计算k值,并根据现有的对照品对相应特征峰进行含量转移率计算,对比结果如下表12
‑
表13所示:
[0155]
表12西洋参k值与转移率对比结果
[0156][0157]
表13
[0158]
[0159][0160]
由表12
‑
13可知,人参皂苷rg1的转移率均值为0.15,k值均值为0.17;人参皂苷re 的转移率均值为0.16,k值均值为0.18;人参皂苷rb1的转移率均值为0.18,k值均值为 0.21;人参皂苷rc的转移率均值为0.25,k值均值为0.20;人参皂苷rd的转移率均值为 0.30,k值均值为0.23。由于18批次标准汤剂与饮片检测条件存在一定差别,因此k值与含量转移率数值存在区别,但k值与含量转移率的趋势一致,表明在不需要使用对照品的前提下,k值能描述多种成分物质的变化趋势。
[0161]
1.3工艺关键属性确定
[0162]
由于标准汤剂是配方颗粒的物质基础,因此以标准汤剂的物质成分变化规律作为配方颗粒的关键工艺属性,能够保证配方颗粒与标准汤剂的一致性。
[0163]
由表12、13可知:西洋参标准汤剂峰1的k值范围为0.12
‑
0.35,峰2的k值范围为 0.12
‑
0.36,峰3的k值范围为0.17
‑
0.50,峰4的k值范围为0.15
‑
0.49,峰5的k值范围为 0.26
‑
0.50,峰6的k值范围为0.17
‑
0.56,峰7的k值范围为0.08
‑
0.31,峰8的k值范围为 0.11
‑
0.51,各峰的k值范围较大。分析主要由于目前原料的质量差异较大导致,若以该范围值作为参照,会出现工艺偏差。鉴于原料质量差异问题不可避免,因此选择符合标准汤剂范围的同批次的中药材饮片制备得到的标准汤剂k值作为参照,对工艺研究进行质控,保证所得终产品与标准汤剂的一致性。
[0164]
西洋参作为名贵的滋补药材,具有补气养阴,清热生津之功效,现代研究认为,西洋参中的皂苷类成分既是其功效成分也是其主要活性物质。通过k值分析西洋参标准汤剂的8个特征峰的18批次k值除个别批次外都小于0.30,其中特征峰多为皂苷类成分。可知西洋参皂苷类成分转移的趋势基本一致,因此可以选择对人参皂苷rg1、re、rb1、 rc、rd,进行控制,进而控制西洋参中皂苷类成分的转化。故确定西洋参的工艺关键控制成分为峰1(人参皂苷rg1)、峰2(人参皂苷re)、峰3(人参皂苷rb1)、峰4(人参皂苷rc)、峰6(人参皂苷rd)代表的成分。
[0165]
以同批次标准汤剂中的k值均值作为可接受转化程度的标准对生产工艺进行质控,制得三批配方颗粒,该三批次西洋参配方颗粒的工艺过程中的各中间产物以及最终西洋参配方颗粒的k值结果如表14所示:
[0166]
表14西洋参工艺研究过程中k值变化
[0167]
[0168][0169]
由表14可知,3批西洋参配方颗粒在研究过程中的各峰量值传递的k趋势一致。通过k值确定的工艺关键控制点对颗粒制备过程进行质控后,峰1、峰2、峰3、峰4及峰6的k值均与相应批次标准汤剂k值接近,并均在标准汤剂范围内。可以确定制备得到的颗粒与标准汤剂药效物质基础一致性较好,因此,进一步确定上述三批次的工艺条件制备得到的颗粒均符合要求,综上可知:采用k值确定的工艺关键属性能够保证配方颗粒临床应用的药效及安全性。
[0170]
实施例4
[0171]
一种评价中药配方颗粒物质量值传递规律的方法,本实施例中的中药配方颗粒为金银花配方颗粒。具体的过程如下:
[0172]
1.1特征图谱方法
[0173]
色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂,本实施例中采用色谱柱为acquityhss t3,柱长为10cm,柱内径为2.1mm,粒径为1.8μm。以乙腈为流动相a,0.2%甲酸为流动相b,按下表15中规定的梯度洗脱程序进行梯度洗脱;检测波长为238nm;柱温30℃;流速0.4ml/min。理论塔板数按绿原酸计算应不低于7000。
[0174]
表15流动相梯度洗脱程序
[0175][0176]
参照物溶液的制备对照品参照物溶液的制备取绿原酸、新绿原酸、断氧化马钱苷酸、隐绿原酸、獐牙菜苷、断氧化马钱子苷、异绿原酸a、异绿原酸b、异绿原酸c、对照品适量,精密称定,加70%乙醇分别制成每1ml含0.4mg的溶液,摇匀,作为对照品参照物溶液。
[0177]
对照药材参照物溶液的制备取金银花对照药材,该对照药材为中检所提供,研细,
取约1.0g,精密称定,置具塞锥形瓶中,精密加入70%乙醇50ml,称重,加热回流1h,放冷,摇匀,再称定重量,用70%乙醇补足减失的重量,摇匀,滤过,取续滤液,作为对照药材参照物溶液。
[0178]
供试品溶液的制备取样品适量,研细,取约0.5g,精密称定,置具塞锥形瓶中,精密加入70%乙醇50ml,称重,加热回流1h,放冷,摇匀,再称定重量,用70%乙醇补足减失的重量,摇匀,滤过,取续滤液,即得。
[0179]
饮片溶液的制备采用与供试品溶液同批次的金银花饮片,并采用对照药材参照物溶液的制备方法进行制备获得。
[0180]
其中,供试品溶液中的样品的为标准汤剂,该金银花的标准汤剂制备工艺如下:
[0181]
取金银花饮片,置于砂锅中,浸泡30分钟,一煎加入饮片量16倍水,500w煮沸后, 200w煎煮20分钟,趁热过滤,迅速冷却,备用;二煎加饮片量12倍水,500w煮沸后, 200w煎煮15分钟,趁热过滤,迅速冷却备用;合并滤液,浓缩(50℃以下),浓缩至料液比约为1:1,冷冻干燥,即得。
[0182]
测定法精密吸取参照物溶液、饮片溶液、对照药材参照物溶液及供试品溶液各1μl,注入超高效液相色谱仪,测定,即得。
[0183]
在238nm下,供试品溶液特征图谱应呈现11个特征峰,如图5所示,并应与对照药材参照物色谱中的11个特征峰保留时间相对应,与绿原酸参照物峰相应的峰为s峰,计算其余各特征峰的相对保留时间,其相对保留时间应在规定值的
±
7%之内。规定值为:0.49 (峰1)、1.00(峰s)、1.10(峰3)、1.22(峰4)、1.76(峰5)、2.11(峰6)、2.17 (峰7)、3.05(峰8)、3.17(峰9)、3.41(峰10)、3.46(峰11)。其中,峰1为新绿原酸;峰2为绿原酸(s);峰3为断氧化马钱苷酸;峰4为隐绿原酸;峰5为獐牙菜苷;峰 6为断氧化马钱子苷;峰8为异绿原酸b;峰9为异绿原酸a;峰11为异绿原酸c。
[0184]
1.2k值与含量转移率对比
[0185]
采用上述特征图谱方法对15批金银花饮片及标准汤剂进行测定,测定值包括特征峰峰面积、饮片浓度、供试品浓度及出膏率计算k值,并根据现有的对照品对相应特征峰进行含量转移率计算,检测结果如表16
‑
表18所示。
[0186]
表16
[0187]
[0188][0189]
表17
[0190][0191]
表18
[0192]
[0193][0194]
由表16
‑
表18可知,新绿原酸的转移率均值为3.10,k值均值为3.02;绿原酸的转移率均值为0.55,k值均值为0.58;断氧化马钱苷酸的转移率均值为0.78,k值均值为0.81;隐绿原酸的转移率均值为1.60,k值均值为1.47;獐牙菜苷的转移率均值为0.73,k值均值为0.68;断氧化马钱子苷的转移率均值为0.86,k值均值为0.90;异绿原酸b的转移率均值为6.31,k值均值为6.10;异绿原酸a的转移率均值为0.25,k值均值为0.26;异绿原酸c的转移率均值为1.33,k值均值为1.28。由于15批次标准汤剂与饮片检测条件存在一定差别,因此k值与含量转移率数值存在区别,但k值与含量转移率的趋势一致,表明在不需要使用对照品的前提下,k值能描述多种成分物质的变化趋势。
[0195]
通过质谱分析,对11个特征峰进行结构推断,确定了9个特征峰为:新绿原酸(峰1)、绿原酸(峰2)、断氧化马钱苷酸(峰3),隐绿原酸(峰4),獐牙菜苷(峰5),断氧化马钱子苷(峰6),异绿原酸b(峰8),异绿原酸a(峰9),异绿原酸c(峰11);通过k值分析,金银花饮片
‑
标准汤剂过程中11个特征峰均进行了传递,除新绿原酸、隐绿原酸、异绿原酸b、异绿原酸c中各批次k值均大于1外,各峰k值小于1,但偶有受产地因素影响使k值略大于1。有文献研究表明,有机酸类化合物在提取过程中,受酯键、不饱和双键和多元酚三个不稳定结构影响,会通过水解和分子内酯基迁移而发生异构化,且在中性和碱性条件下,绿原酸异构化为新绿原酸和隐绿原酸;异绿原酸a异构化为异绿原酸b和异绿原酸c,因此,新绿原酸和隐绿原酸k值大于1,绿原酸k值小于1,可能与绿原酸异构化生成新绿原酸和隐绿原酸有关;异绿原酸b和异绿原酸c的k值大于 1,异绿原酸a的k值小于1,可能与异绿原酸a异构化生成异绿原酸b和异绿原酸c有关。由此可知,金银花标准汤剂中上述成分传递规律符合有机酸类成分的特性,表明k值能够辅助分析饮片
‑
标准汤剂的物质传递情况,利用该传递规律可更好的指导中药配方颗粒的生产和控制。
[0196]
1.3工艺关键属性确定
[0197]
由于标准汤剂是配方颗粒的物质基础,因此以标准汤剂的物质成分变化规律作为配方颗粒的关键工艺属性,能够保证配方颗粒与标准汤剂的一致性。
[0198]
由表16
‑
18可知:金银花标准汤剂峰1的k值范围为2.13
‑
3.72,峰2的k值范围为 0.49
‑
0.72,峰3的k值范围为0.75
‑
0.89,峰4的k值范围为1.23
‑
1.74,峰5的k值范围为 0.52
‑
0.90,峰6的k值范围为0.73
‑
1.08,峰7的k值范围为0.48
‑
1.08,峰8的k值范围为4.65
‑
7.23,峰9的k值范围为0.21
‑
0.33,峰10的k值范围为0.77
‑
0.99,峰11的k值范围为 1.11
‑
1.50,各峰的k值范围较大。分析主要由于目前原料的质量差异较大导致,若以该范围值作为参照,会出现工艺偏差。鉴于原料质量差异问题不可避免,因此选择符合标准汤剂范围的
同批次的中药材饮片制备得到的标准汤剂k值作为参照,对工艺研究进行质控,保证所得终产品与标准汤剂的一致性。
[0199]
其中峰9的k值小于0.3,表明该成分不易转移或发生分解(即负转化),需要重点监控;峰1、4、8、11的k值远大于1,也需要重点监控。其中峰1(新绿原酸)、峰4(隐绿原酸)的k值大于1,主要由峰2(绿原酸)转化而来;峰8(异绿原酸b)、峰11(异绿原酸c)的k值大于1,主要由峰9(异绿原酸a)转化而来,因此为简化工艺监控指标,只需监控峰2、9即可。故确定金银花的工艺关键控制成分为峰2、峰9 所代表的成分。
[0200]
以同批次标准汤剂中的k值均值作为可接受转化程度的标准对生产工艺进行质控,制得三批金银花配方颗粒,该三批次金银花配方颗粒的工艺过程中的各中间产物以及最终的金银花配方颗粒的k值结果如下表19所示:
[0201]
表19金银花颗粒工艺的k值分析
[0202][0203]
由上述结果可知,通过k值确定的工艺关键控制点对颗粒制备过程进行质控后,峰 2、峰9的k值均与相应批次标准汤剂k值接近,并均在标准汤剂范围内。可以确定制备得到的颗粒与标准汤剂药效物质基础一致性较好,因此,进一步确定上述三批次的工艺条件制备得到的颗粒均符合要求。综上可知:采用k值确定的工艺关键属性能够保证配方颗粒临床应用的药效及安全性。
[0204]
实施例5
[0205]
一种评价中药配方颗粒物质量值传递规律的方法,中药配方颗粒为北柴胡配方颗粒,具体如下:
[0206]
1.1特征图谱方法
[0207]
色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂,柱长为10cm,柱
内径为2.1mm,粒径为1.7μm;以乙腈为流动相a,以水为流动相b,按下表20中的规定进行梯度洗脱;检测波长为211nm、250nm;柱温35℃;流速0.4ml/min;理论板数均按柴胡皂苷a峰计算应均不低于10000。
[0208]
表20梯度洗脱表
[0209][0210]
对照品参照物溶液的制备取柴胡皂苷a对照品适量,精密称定,加甲醇制成每1ml 含柴胡皂苷a 75μg,摇匀,作为对照品参照物溶液。
[0211]
对照药材参照物溶液的制备取柴胡对照药材约0.5g,精密称定,置锥形瓶中,精密加水25ml,密塞,称定重量,加热回流30分钟,滤过,取续滤液20ml,回收溶剂至干,精密加入5%浓氨50%乙醇25ml,密塞,称定重量,超声(功率250w,频率40khz) 30分钟,取出,放冷,再称定重量,用5%浓氨50%乙醇补足减失的重量,摇匀,滤过,取续滤液,作为对照药材参照物溶液。
[0212]
供试品溶液和饮片溶液的制备取配方颗粒/标准汤剂/饮片粉末适量,研细(饮片粉末过三号筛),取约1.0g,精密称定,置具塞锥形瓶中,精密加入含5%浓氨试液的50%乙醇25ml,密塞,称定重量,超声处理(功率250w,频率40khz)30分钟,放冷,再称定重量,用5%浓氨试液的50%乙醇补足减失的重量,摇匀,滤过,取续滤液,即得。
[0213]
其中,该北柴胡的标准汤剂的制备工艺如下:
[0214]
取北柴胡饮片,置于砂锅中,浸泡30分钟,一煎加入饮片量9倍水,500w煮沸后, 200w煎煮20分钟,趁热过滤,迅速冷却,备用;二煎加饮片量6倍水,500w煮沸后,200w 煎煮15分钟,趁热过滤,迅速冷却备用;合并滤液,浓缩(50℃以下),浓缩至料液比约为1:1,冷冻干燥,即得。
[0215]
测定法精密吸取对照品参照物溶液、饮片溶液、对照药材参照物溶液及供试品溶液各3ul,注入液相色谱仪,测定,即得。
[0216]
在211nm下,供试品特征图谱应呈现4个特征峰,如图6所示,并应与对照药材参照物色谱中的4个特征峰保留时间相对应,与柴胡皂苷a参照物峰相应的峰为s峰,计算各特征峰与s峰的相对保留时间,峰1和峰2的相对保留时间应在规定值的
±
10%范围之内,峰4的相对保留时间应在规定值的
±
8%范围之内,规定值为:0.61(峰1)、0.69(峰2)、 1.04(峰4);
[0217]
在250nm下,供试品色谱中应呈现4个特征峰,如图7所示,并应与对照药材参照物色谱中的4个特征峰保留时间相对应,与柴胡皂苷a参照物峰相应的峰为s峰,计算各特征峰与s峰的相对保留时间,峰5的相对保留时间应在规定值的
±
10%范围之内,峰7和峰8的相对保留时间应在规定值的
±
8%范围之内,规定值为:0.78(峰5)、1.04(峰7)、 1.20(峰8)。其中,峰1为柴胡皂苷c;峰2为柴胡皂苷f;峰3为柴胡皂苷a;峰4为柴胡皂苷b2;峰6为柴胡皂
苷a;峰7为柴胡皂苷b2;峰8为柴胡皂苷b1。
[0218]
1.2k值与含量转移率对比
[0219]
采用上述特征图谱方法对18批北柴胡饮片及其标准汤剂进行测定,以特征峰峰面积、饮片浓度、供试品浓度及出膏率计算k值,并根据现有的对照品对相应特征峰进行含量转移率计算,对比结果如下表21
‑
22所示:
[0220]
表21北柴胡k值与转移率对比结果
[0221][0222]
表22
[0223]
[0224][0225]
由表21
‑
22可知,柴胡皂苷c的转移率均值为0.15,k值均值为0.14;柴胡皂苷f的转移率均值为0.13,k值均值为0.12;柴胡皂苷a的转移率均值为0.13,k值均值为0.09;均远远小于1。柴胡皂苷b2的转移率均值为5.83,k值均值为5.91;柴胡皂苷b1的转移率均值为2.74,k值均值为2.85;均大于1。由于18批次标准汤剂与饮片检测条件存在一定差别,因此k值与含量转移率数值存在区别,但k值与含量转移率的趋势一致,表明在不需要使用对照品的前提下,k值能描述多种成分物质的变化趋势。
[0226]
通过图谱指认,知晓峰1、2、3分别为柴胡皂苷c、柴胡皂苷f、柴胡皂苷a,由于转化为次生皂苷,因此k值多在0.10左右。峰6为250nm下的柴胡皂苷a,而柴胡皂苷a末端紫外吸收,在250nm上灵敏度较差,导致传递趋势不一;同样峰4为211nm下的次生皂苷柴胡皂苷b2,在211nm上灵敏度较差,柴胡皂苷b2的传递规律以250nm峰7为参照。峰7、 8为次生苷柴胡皂苷b2和柴胡皂苷b1,k值均大于1,不仅由于柴胡皂苷b2和柴胡皂苷b1在标准汤剂中转移好,且由原生苷柴胡皂苷d、柴胡皂苷a在标准汤剂中不同程度的转化导致。文章《柴胡水煎液中柴胡皂苷a和d的溶出与转化差异》对水煎液中柴胡皂苷a、柴胡皂苷d的溶出与转化差异研究结果表明:柴胡皂苷d转化程度远大于柴胡皂苷a,在水煎液中不发挥主要药理作用。北柴胡中柴胡皂苷b2的k值大于柴胡皂苷b1,说明柴胡皂苷d转化程度较大,符合文献研究结果。上述物质传递规律符合柴胡皂苷成分特性,同样表明k值能够准确描述其中化学成分间的变化及传递趋势。
[0227]
1.3工艺关键属性确定
[0228]
由于标准汤剂是配方颗粒的物质基础,因此以标准汤剂的物质成分变化规律作为配方颗粒的关键工艺属性,能够保证配方颗粒与标准汤剂的一致性。
[0229]
由表21、22可知:北柴胡标准汤剂峰1的k值范围为0.10
‑
0.21,峰2的k值范围为 0.07
‑
0.18,峰3的k值范围为0.06
‑
0.14,峰4的k值范围为0.15
‑
1.32,峰5的k值范围为 0.16
‑
3.52,峰6的k值范围为0.46
‑
1.69,峰7的k值范围为4.11
‑
9.84,峰8的k值范围为1.33
‑
5.86,各峰的k值范围较大。分析主要由于目前原料的质量差异较大导致,若以该范围值作为参照,会出现工艺偏差。鉴于原料质量差异问题不可避免,因此选择符合标准汤剂范围的
同批次的中药材饮片制备得到的标准汤剂k值作为参照,对工艺研究进行质控,保证所得终产品与标准汤剂的一致性。
[0230]
在标准汤剂中峰4与峰7分别为同一成分不同吸收波长下的特征峰,因此该成分k 值变化规律以最大吸收波长下的峰7为主;峰6与峰3也为同一成分不同吸收波长下的特征峰,同样该成分k值变化规律以最大吸收波长下的峰3为主,因此峰4、6不需要进行监控。而由于峰5的k值变化不规律,分析可能为:该成分含量很低或在该波长下紫外吸收较弱,导致计算不准确,峰5不进行监控。
[0231]
而峰1、2、3的k值均小于0.3,表明该成分不易转移或发生分解(即负转化),需要重点监控;峰7的k值远大于1,也需要重点监控,其中峰8的k值远大于1,需要重点监控,但由于该成分主要由峰3(柴胡皂苷a)转化而来,因此二者只需控制一个即可,因此峰8不进行监控。故确定柴胡的工艺关键控制成分为峰1、峰2、峰3、峰 7所代表的成分。
[0232]
以同批次标准汤剂中的k值作为可接受转化程度的标准对生产工艺进行质控,制得三批北柴胡配方颗粒,该三批次北柴胡配方颗粒的工艺过程中的各中间产物以及最终的北柴胡配方颗粒的k值结果如下表23所示:
[0233]
表23北柴胡颗粒工艺的k值分析
[0234][0235]
由上述结果可知,通过k值确定的工艺关键控制点对颗粒制备过程进行质控后,峰 1、峰2、峰3及峰7的k值均与相应批次标准汤剂k值接近,并均在标准汤剂范围内。可以确定制备得到的颗粒与标准汤剂药效物质基础一致性较好,因此,进一步确定上述三批次的工艺条件制备得到的颗粒均符合要求。综上可知:采用k值确定的工艺关键属性能够保证配方颗粒临床应用的药效及安全性。
[0236]
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对
于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。