改进葡基胺的检测的方法
相关申请的交叉引用
1.本技术要求2019年5月3日提交的美国临时专利申请号62/842,809的权益和优先权,其内容出于所有目的通过引用并入本文。联邦资助声明
2.不适用。
背景技术:
3.本发明涉及改进检测被胺反应性染料标记的葡基胺的能力的领域,特别是当葡基胺在含有竞争被胺反应性染料标记的其他胺的溶液中时。
4.多个商业和法规要求使得需要确定糖蛋白或糖肽上存在的聚糖的性质和量,并且特别是对于用作治疗剂的糖蛋白。由于附着至糖蛋白的聚糖可以影响对于糖蛋白的功能至关重要的特征,包括其药代动力学、稳定性、生物活性和免疫原性,重要的是确定存在哪些聚糖。食品药品监督管理局(food and drug administration)要求进行附着至生物制品(如治疗性糖蛋白和疫苗)的聚糖的表征,以显示物质的组成和制造的一致性,从而导致需要对产品进行广泛表征。对于治疗性和非治疗性重组蛋白二者的生产中的质量控制,对碳水化合物谱的分析也是重要的,其中碳水化合物谱的变化可以指示系统中的应激,从而表明可能需要丢弃商业规模发酵罐的内容物的状况。因此,生物化学家、临床化学家、制药商和蛋白质生产商对确定生物学样品(如治疗性糖蛋白)中聚糖的分布谱非常感兴趣。
5.传统上,碳水化合物已经通过还原性胺化使用适合于通过该反应标记的染料进行标记。例如,通过去糖基化酶肽n
‑
糖苷酶f从糖蛋白释放的n
‑
聚糖的还原性胺化典型地是通过将聚糖的游离还原端与标记(如荧光染料或具有电荷的部分,如美国专利号5,747,347中传授的2
‑
氨基苯甲酰胺或“2
‑
ab”)的游离氨基缀合来完成的。根据所用标记,然后可以通过多种分析方法中的任何方法来分析被标记的聚糖,所述分析方法如高效液相色谱(“hplc”)、毛细管电泳(“ce”,包括毛细管区带电泳、毛细管凝胶电泳、毛细管等电聚焦、毛细管等速电泳和胶束电动色谱)或微流体分离。
6.近年来,已经开发出几种染料或标记(所述术语在本文中通常可互换使用),其比传统程序更快地标记碳水化合物(如通过肽n
‑
糖苷酶f从糖蛋白释放的n
‑
聚糖)。肽n
‑
糖苷酶f的作用释放呈葡基胺形式的n
‑
聚糖。染料(如(prozyme,inc.)和rapifluor
‑
(waters corp.))能够与从糖蛋白释放的葡基胺快速反应。不幸的是,所述染料也与反应溶液中的任何其他游离胺(可用于与目的葡基胺竞争被胺反应性染料标记的胺),并且许多缓冲溶液(如tris缓冲液)含有游离胺。对于一些糖蛋白上存在的聚糖的分析而言,这是一个值得担忧的问题,因为如稳定性、ph、溶解度和成本的考虑因素可能要求使用tris缓冲液或其他游离胺来源来运输或储存糖蛋白。
7.治疗性糖蛋白是昂贵的,并且一些治疗性糖蛋白只能以少量获得。因此,可用于分析的聚糖的量通常相当小,并且可能是皮克级的,而溶液中游离胺的量可能具有更高数量级。因此,缓冲液或其他来源中的胺与目的聚糖相比的过量可能严重降低测定的灵敏度。目
前这个问题尚未通过尝试避免使用含有游离胺的缓冲液(如含tris缓冲液)或通过缓冲液交换(其冗长,不适合自动化并且并非总是成功的)完全解决。
8.本领域中仍然需要当在具有游离胺的溶液中提供葡基胺时,改进通过胺反应性染料标记葡基胺的灵敏度的方法。令人惊讶的是,本发明满足这些和其他需求。
技术实现要素:
9.本发明提供用于改进通过电泳分离标记的分析物的组合物、方法、系统和试剂盒。在第一组实施方案中,本发明提供用于标记葡基胺以及任选地用于分析所述标记的葡基胺的体外方法。所述方法按以下顺序包括以下步骤:(a)获得水溶液中的葡基胺,(b)将其中存在葡基胺的所述水溶液与一定量的有机溶剂混合,从而产生由约80%或更多有机溶剂构成的有机溶剂混合物,(c)使含有所述葡基胺的所述有机溶剂混合物通过多孔固体支持物,从而将所述葡基胺固定在所述多孔固体支持物上,以及,(d)通过以下方式用胺反应性染料标记所述葡基胺:(1)当所述葡基胺被固定在所述多孔固体支持物上时进行所述标记,然后用水溶液将所述标记的葡基胺从所述多孔固体支持物洗脱至容器中,或者,(2)用水溶液将所述固定的葡基胺从所述多孔固体支持物洗脱至容器中,然后用所述胺反应性染料标记所述洗脱的葡基胺,从而标记所述葡基胺。在一些实施方案中,多孔固体支持物由亲水材料制得,并且有机溶剂混合物是约80%至95%有机溶剂与约20%至5%水溶液。在一些实施方案中,亲水材料是(a)纤维素,(b)玻璃纤维,(c)氧化铝,(d)二氧化硅,(e)含有二醇、氨丙基、氨基甲酰基、氰丙基、乙二胺
‑
n
‑
丙基的官能化表面,(f)用二醇、氨丙基或氨基甲酰基衍生的二氧化硅,(g)纤维素,(h)环糊精,(i)天冬酰胺,(j)三唑,(k)二乙基氨基乙基,(l)用于碳水化合物的固相萃取的树脂,或者,(m)这些中的两种或更多种的组合。在一些实施方案中,固体支持物由二氧化硅制得,并且所述二氧化硅与一个或多个氨基甲酰基共价键结。在一些实施方案中,二氧化硅呈珠或颗粒的形式。在一些实施方案中,珠或颗粒的大小为3
‑
60微米。在一些实施方案中,珠或颗粒的大小为约30微米。在一些实施方案中,与氨基甲酰基共价键结的珠或颗粒是酰胺
‑
80(amide
‑
80)。在一些实施方案中,多孔固体支持物呈膜的形式。在一些实施方案中,多孔固体支持物呈整料(monolith)的形式。在一些实施方案中,多孔固体支持物呈珠的形式。在一些实施方案中,多孔固体支持物呈纤维的形式。在一些实施方案中,多孔固体支持物是树脂。在一些实施方案中,所述方法还包括在步骤(c)与(d)之间的步骤(c'),即用溶液洗涤所述多孔固体支持物,所述溶液是80至90%有机溶剂和20至10%水溶液。在一些实施方案中,所述方法还包括步骤(e),即通过使标记的葡基胺经历分离方法来分离所述标记的葡基胺。在一些实施方案中,分离方法使标记的葡基胺经历高效液相色谱、超高效液相色谱、亲水相互作用液相色谱、毛细管电泳、微流体分离或这些中的两种或更多种的组合,从而分离所述标记的葡基胺。在一些实施方案中,通过检测标记的荧光来分析分离的标记的葡基胺。在一些实施方案中,通过质谱分析分离的标记的葡基胺。在一些实施方案中,有机溶剂是乙腈、无水乙醇、无水甲醇、异丙醇、丁醇、甲苯、乙酸乙酯、丙酮、四氢呋喃、乙醚、二氯甲烷、氯仿、叔丁基甲基醚、苯、四氯化碳、异辛烷、己烷,或者这些中的任何两种或更多种的组合。在一些实施方案中,有机溶剂是乙腈。在一些实施方案中,将多孔固体支持物布置在多孔板或微孔板的孔中。在一些实施方案中,将固体支持物布置在微流体装置的内腔中。在一些实施方案中,将多孔固体支持物布置在离心柱或固相萃取
筒柱中。在一些实施方案中,将多孔固体支持物布置在离心柱中。在一些实施方案中,多孔固体支持物具有非亲水材料的表面,并且有机溶剂混合物具有95%或更多有机溶剂。在一些实施方案中,非亲水材料是聚乙烯、尼龙、聚偏二氟乙烯或聚丙烯。在一些实施方案中,多孔固体支持物具有10微米或更小的孔或开口。
10.在第二组实施方案中,本发明提供用于用胺反应性染料标记通过酶从糖蛋白或糖肽释放的葡基胺的试剂盒。所述试剂盒包含去糖基化酶、适合于将去糖基化酶与糖蛋白或糖肽一起孵育的水溶液、胺反应性染料、有机溶剂和其内布置有多孔固体支持物的容器。在一些实施方案中,水溶液和有机溶剂是以预先测量的形式在试剂盒中提供,使得在合并时,它们形成有机溶剂与水溶液的混合物,所述混合物是80%
‑
95%有机溶剂与20%
‑
5%水溶液。在一些实施方案中,水溶液和有机溶剂是以预先测量的形式在试剂盒中提供,使得在合并时,它们形成有机溶剂与水溶液的混合物,所述混合物是80%
‑
90%有机溶剂与20%
‑
10%水溶液。在一些实施方案中,水溶液和有机溶剂是以预先测量的形式提供,使得在合并时,它们形成有机溶剂与水溶液的混合物,所述混合物是85%
±
2%有机溶剂与15%
±
2%水溶液。在一些实施方案中,有机溶剂是乙腈、无水乙醇、无水甲醇、异丙醇、丁醇、甲苯、乙酸乙酯、丙酮、四氢呋喃、乙醚、二氯甲烷、氯仿、叔丁基甲基醚、苯、四氯化碳、异辛烷、己烷,或者这些中的任何两种或更多种的组合。在一些实施方案中,有机溶剂是乙腈。在一些实施方案中,去糖基化酶是肽n
‑
糖苷酶f。在一些实施方案中,试剂盒还包含变性剂。在一些实施方案中,多孔固体支持物是亲水材料。在一些实施方案中,多孔固体支持物呈膜的形式。在一些实施方案中,亲水材料是(a)纤维素,(b)玻璃纤维,(c)氧化铝,(d)二氧化硅,(e)含有二醇、氨丙基、氨基甲酰基、氰丙基、乙二胺
‑
n
‑
丙基的官能化表面,(f)用二醇、氨丙基或氨基甲酰基衍生的二氧化硅,(g)纤维素,(h)环糊精,(i)天冬酰胺,(j)三唑,(k)二乙基氨基乙基,(l)用于碳水化合物的固相萃取的树脂,或者,(m)这些中的两种或更多种的组合。在一些实施方案中,固体支持物由二氧化硅制得,并且所述二氧化硅与一个或多个氨基甲酰基共价键结。在一些实施方案中,固体支持物由二氧化硅制得,并且二氧化硅呈珠或颗粒的形式。在一些实施方案中,珠或颗粒的大小为3
‑
60微米。在一些实施方案中,珠或颗粒的大小为约30微米。在一些实施方案中,与氨基甲酰基共价键结的珠或颗粒是酰胺
‑
80。
附图说明
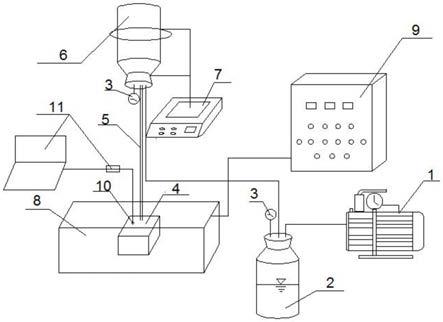
11.图1.图1是显示一些本发明方法的范例实施方案的简图。数字1显示容纳位于水溶液中的糖蛋白的小瓶。蛋白质部分显示为实线,而聚糖显示为表示不同糖部分的标准几何图形。每一聚糖与蛋白质部分的附着由比表示蛋白质部分的线条更细的线条来表示。在通过肽n
‑
糖苷酶f进行酶消化(通过图上的数字2来指明)后,数字3显示现在容纳无糖基化蛋白质(由与之前相同的实线来表示)和通过酶从蛋白质释放的葡基胺(由几何形状来表示)的小瓶。数字4指明将有机溶剂以足以产生有机溶剂/水溶液混合物的量添加至起始水溶液中,所述有机溶剂/水溶液混合物是80%至95%有机溶剂和20%至5%水溶液(注意:尽管说明陈述添加有机溶剂以形成80%至95%溶液,但是在说明书中将含有葡基胺的有机溶剂与水溶液的混合物称为“有机溶剂混合物”)。在所示范例实施方案中,之后使有机溶剂混合物通过由亲水材料制得并且布置在第二容器中的多孔固体支持物。如数字5中所示,葡基胺已经被保留和固定在第二容器中的多孔固体支持物上,而有机溶剂混合物已经流过并且已经
离开所述容器,不再与固定的葡基胺接触。数字6显示任选的洗涤步骤,其中用作为80至95%有机溶剂/20至5%水溶液的溶液洗涤固定的葡基胺,以减少并非位于固定的葡基胺上或以其他方式保留在固体支持物上的存在的胺的数量。数字7显示实施方案,其中在葡基胺固定于多孔固体支持物上时用胺反应性染料标记固定的葡基胺。数字8显示任选的洗涤步骤,其中用作为80至95%有机溶剂/20至5%水溶液的溶液洗涤标记的固定的葡基胺,以去除任何过量的染料。数字9显示通过水溶液从多孔固体支持物洗脱标记的固定的葡基胺。
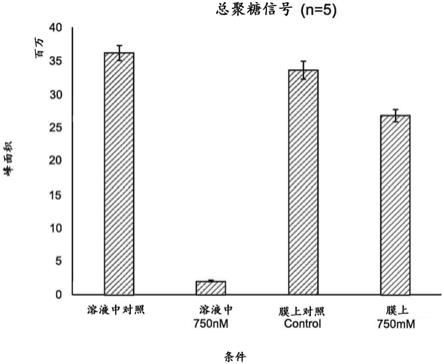
12.图2.图2呈现显示研究结果的柱形图,其中使依那西普的样品变性,去糖基化,并且分为四个重复样品。当葡基胺位于溶液中时(左起前两个柱形)或者当固定在多孔固体支持物上时(左起第三个和第四个柱形),以及在750mm tris缓冲液的存在下(左起第二个和第四个柱形,标为“750mm”)或者在不存在tris缓冲液的情况下(左起第一个和第三个柱形,标为“对照”),通过胺反应性染料instantpc
tm
标记样品中的葡基胺。
具体实施方式
引言
13.如背景技术中所述,出于多个法规和质量控制的目的,对附着至糖蛋白的聚糖的种类和量的分析已经变得很重要。特定地,在此类糖蛋白的生产中以及在确认它们将具有所需药理学活性时,分析附着至治疗性糖蛋白(如单克隆抗体)的聚糖的类型以及每个类型的聚糖的量已经成为重要的质量控制措施。
14.确定样品中存在的碳水化合物的类型通常是通过标记所述碳水化合物,然后使用合适的仪器分析标记的碳水化合物来进行。n
‑
聚糖可以通过以下方式来分析:用酶(如肽n
‑
糖苷酶f)将其从糖蛋白释放,对其进行标记,然后例如通过检测它们的荧光来检测标记的化合物的存在。通过酶以葡基胺的形式释放聚糖,然后将其用与葡基胺上的胺部分快速反应的胺反应性染料(如(prozyme,inc.)和rapifluor
‑
(waters corp.))进行标记。然而,所述染料不仅与葡基胺反应,还与溶液中的任何其他胺基团反应。例如,缓冲液如“tbe”(tris/硼酸盐/edta)和“tae”(tris/乙酸/edta)含有携带伯胺的tris(三(羟甲基)氨基甲烷)。在用胺反应性染料标记含有胺基团的溶液中的目的葡基胺时,溶液中的其他胺可能与靶葡基胺竞争被所述胺反应性染料标记,从而减少可用于标记目的葡基胺的染料的量。
15.如背景技术章节中所述,治疗性糖蛋白是昂贵的,并且一些治疗性糖蛋白只能以极少量获得。从这种糖蛋白的样品释放的葡基胺的量本身相应较小,并且可能是皮克级的,而tris缓冲液或含有葡基胺的其他溶液中游离胺的量可能具有更高数量级。因此,缓冲液或其他来源中的胺与目的聚糖相比的过量可能由于与葡基胺竞争胺反应性染料并胜出而严重降低测定的灵敏度。因此,在含有tris或来自其他来源的游离胺的缓冲液中,在来自缓冲液中或存在于其他含胺化合物上的标记的胺的信号中,可能难以检测糖蛋白上存在的少量聚糖的存在。不幸的是,如稳定性、溶解度、ph或成本的考虑因素可能要求使用含胺配制剂以允许运输或储存目的糖蛋白。
16.令人惊讶的是,本发明解决了这个问题,并且允许对样品中存在的聚糖(或者,在它们通过酶消化从糖蛋白释放时,葡基胺)进行灵敏的检测,即使在样品位于含有含胺配制剂(如含tris缓冲液或游离胺的其他来源)的溶液中时。
17.在当前方案中,糖蛋白上存在的n
‑
聚糖是通过使位于水溶液(其通常含有还原剂、其他变性剂和缓冲盐)中的糖蛋白变性来分析。变性通常涉及将包含糖蛋白的水溶液加热至升高的温度,通常约95℃,然后冷却溶液。然后通常通过在具有所选去糖基化酶(如肽n
‑
糖苷酶f)的水溶液中孵育糖蛋白来使糖蛋白去糖基化。所得水溶液不仅包含其中进行酶消化的水溶液本身,而且包含(i)在已经通过酶的作用将n
‑
聚糖作为葡基胺释放后保留的完全或部分无糖基化的蛋白质,(ii)通过酶消化释放的任何葡基胺,(iii)去糖基化酶,(iv)缓冲盐,(v)还原剂,以及(vi)变性步骤中使用的任何其他变性剂。在一些实施方案中,糖蛋白可能最初位于生物学样品中,在这种情况下溶液可能还含有脂质、另外的蛋白质、盐和其他代谢物。当前工作流的这些部分作为项目1
‑
3示意性地显示于图1中。
18.为便于参考,在糖蛋白的变性以及部分或完全去糖基化后产生含有葡基胺的水溶液在本文中有时将被称为“获得含有葡基胺的水溶液”,并且溶液本身在本文中有时将被称为“起始葡基胺溶液”。在当前方案中,通常将胺反应性染料添加至起始葡基胺溶液以标记起始葡基胺溶液中所含的葡基胺,并且之后使标记的葡基胺经历净化程序以将其与溶液中的其他分子种类分离,使得可以分析标记的葡基胺。胺反应性染料是与起始葡基胺溶液相容的有机溶剂,并且起始葡基胺溶液在添加染料前不需要进行干燥。
19.在本发明方法的实施方案中,变性和去糖基化步骤照常进行。然而,一旦将n
‑
聚糖作为葡基胺从糖蛋白释放至起始葡基胺溶液中,工作流发生变化。如图1,项目4中所示,将有机溶剂添加至起始葡基胺溶液中,添加的量足以将起始水溶液变为具有约80%直至95%有机溶剂(以及相应的约20%直至6%水溶液,其中“约”在这种情况下意指
±
1%)的溶液。为便于参考,所得溶液(现在是约80%至95%有机溶剂的溶液)可以被称为“有机溶剂混合物”。然后执业医师可以将有机溶剂混合物中的葡基胺固定在多孔固体支持物上,如图1,项目5中示意性地显示。不希望受限于理论,人们相信所述浓度的有机溶剂溶液中的葡基胺会通过葡基胺与支持物之间的极性相互作用保留在亲水多孔固体支持物或多孔固体支持物的亲水表面上。有机溶剂混合物中的其他组分通常将保留在溶液中,通过多孔固体支持物,并且可以从容纳多孔固体支持物的容器被去除。这导致去除起始葡基胺溶液中可用于与胺反应性染料反应的任何胺(除了固定的葡基胺上的那些)的大部分(如果并非全部),并且导致存在的任何其他游离胺的量的显著减少。
20.一旦将葡基胺固定在固体支持物上,可以任选地用约80
‑
95%有机溶剂(优选约80%至约90%有机溶剂)的有机溶液对其进行洗涤,以去除没有固定在多孔固体支持物上的任何胺,如图1,项目6中所示,之后可以将其(a)在位于固体支持物上时用胺反应性染料标记,如图1,项目7中所描绘,任选地用约80
‑
95%有机溶剂(优选约80%至约90%有机溶剂)的溶液洗涤,以去除过量染料(图1,项目8),然后通过水溶液洗脱,因此可以将其提供至分析手段,如图1,项目9中所描绘,或者,(b)用水溶液从固体支持物洗脱至新容器中,用新容器中的胺反应性染料进行标记,然后将其提供至分析手段(实施方案(b)在图1中未显示)。关于在固体支持物上标记(实施方案(a),上文),胺反应性染料是昂贵的,并且执业医师通常仅使用足以用染料使多孔固体支持物饱和的量。由于染料通常位于有机溶液中,其不会将葡基胺从支持物洗脱。如所述,在标记后,可以将标记的葡基胺用水溶液从支持物洗脱,并提供至分析手段。
21.如所述,可以将标记的葡基胺提供至标准分析程序以确定从其释放葡基胺的糖蛋
白或糖肽上存在的n
‑
聚糖的类型和量。通常,通过液相色谱(如高效液相色谱(hplc)、超高效液相色谱或亲水相互作用液相色谱(“hilic”))、毛细管电泳或微流体分离来分离标记的葡基胺,然后通过将分离的标记的葡基胺提供至分析手段,如提供至荧光检测器或质谱仪,来进行分析。在一些实施方案中,首先将分离的标记的葡基胺提供至荧光检测器,然后提供至质谱仪。当然,也可以使用本领域中已知的其他分析程序和装置。
22.与当前方案相比,本发明工作流向工作流添加一个或多个步骤,以及另外的试剂的量的使用,所述另外的试剂即用于产生所需百分比的有机溶剂与起始葡基胺溶液的有机溶剂混合物的有机溶剂。修改方法的目标通常是减少步骤数以及减少所用试剂的数量和量,简化工作流并降低成本。然而,违反直觉地,在这种情况下,添加另外的步骤和试剂是值得的。减少游离胺在与葡基胺竞争胺反应性染料中的影响的问题已经通过当前方法充分解决,其依赖于避免使用含有游离胺的溶液或者通过缓冲液交换(一种冗长的且并非总是有效的方法,其无法被自动化)来解决。
23.如实施例中所述,进行本发明的基础研究,其中使范例糖蛋白变性,去糖基化,然后分为四个样品。将tris缓冲液添加至两个样品以达到750mm tris的浓度,而将等量水添加至另两个样品,使得四个样品的样品体积相等。然后遵循常规工作流在具有胺反应性染料instantpctm的溶液中标记已添加tris的一个样品和已添加水的一个样品,并通过荧光进行分析。将有机溶剂乙腈添加至另两个样品(一个样品已添加tris并且一个样品已添加水)以产生85%有机溶剂/15%水溶液的有机溶剂混合物,并将每个样品固定在用于碳水化合物的hilic分离或用于碳水化合物的固相萃取的固体支持物上。将固体支持物用85%有机溶剂/15%水溶液洗涤两次,以在保持聚糖固定的同时去除游离胺。然后将固定的葡基胺用instantpctm标记,从固体支持物洗脱,并通过荧光进行分析。
24.图2是显示在存在或不存在tris缓冲液的情况下标记的葡基胺的荧光分析的结果的图表,所述tris缓冲液含有与葡基胺竞争胺反应性染料的胺。左侧两个柱显示在溶液中标记的样品的结果。第一个柱显示已添加水然后在溶液中标记的样品的结果:其峰面积为约36。第二个柱显示已添加tris然后在溶液中标记的样品的结果:其峰面积为约2,或者信号是在不存在tris的情况下标记的样品的大约18分之一。换言之,在tris的存在下标记的样品的峰面积是在不存在tris的情况下标记的样品的峰面积的5.55%。所述结果证实了在溶液中竞争标记的胺的存在下标记葡基胺的困难。
25.参考图2,右侧两个柱显示当固定在多孔固体支持物上时标记的样品的结果。右起第二个柱显示已添加水,固定在多孔固体支持物上,然后当固定在支持物上时进行标记的样品的结果:其峰面积为约33,并且因此信号比在溶液中标记的相应样品的信号略低。图右侧的柱显示已添加tris,固定在多孔固体支持物上,洗涤以去除游离胺,然后标记的样品的结果:其峰面积为约27,或者信号是在不存在tris的情况下标记的样品的信号的大约81%,这与在溶液中标记的相应样品的信号相比是显著改进。另外,固定、洗涤、然后标记的含有tris的样品的峰面积是27,比在溶液中在tris的存在下通过相同胺反应性染料标记的样品大一个数量级。
26.因此,如图2中所示,本发明方法显著提高标记的灵敏度以及随后检测位于水溶液中的标记的葡基胺的能力,所述水溶液含有可以竞争用胺反应性染料标记的胺。尽管对于位于基于tris的缓冲液或者已知含有可用于与胺反应性染料反应的胺的其他缓冲液或溶
液中的样品也将是如此,但是一些样品可能具有未知量的此类胺的存在。另外,执业医师可能希望对于所有葡基胺分析采用单一工作流,其将仍然足够灵敏以得到良好结果,无论进入该工作流的样品是否具有存在于缓冲液或其他溶液中的胺。因此,预期本发明方法的实施方案会变成常用工作流,特别是在要分析的样品可能未表征(例如,生物学样品),可能含有含tris缓冲液或其他含胺缓冲液,或者可能具有可能干扰标记的游离胺的其他来源的情况下。
27.现在讨论本发明方法的多个实施方案的某些方面以提供进一步的解释和指导。有机溶剂
28.在本发明方法的实施方案中使用有机溶剂以将起始葡基胺水溶液的浓度降低至样品中的葡基胺将保留在多孔固体支持物上的点,从而允许通过例如用所得有机溶剂混合物洗涤多孔固体支持物来去除起始葡基胺溶液中的其他化合物。在一些实施方案中,有机溶剂是乙腈,其使用是特别优选的。乙腈既是疏水的也是质子惰性的。预期在本发明方法的实施方案中可以使用其他有机溶剂,并且既是疏水的也是质子惰性的有机溶剂是优选的。人们相信多种其他有机溶剂适用于本发明的实施方案中,包括无水乙醇、无水甲醇、异丙醇、丁醇、甲苯、乙酸乙酯、丙酮、四氢呋喃、乙醚、二氯甲烷、氯仿、叔丁基甲基醚、苯、四氯化碳、异辛烷和己烷。还可以使用两种或更多种有机溶剂(如所提及的那些)的混合物。
29.对于在本发明方法的实施方案中使用,二甲亚砜(“dmso”)和二甲基甲酰胺(“dmf”)不太优选用作主要有机溶剂或用作有机溶剂混合物的主要成分。人们相信,dmso或dmf可以以相对不大的量(如0.1%至2%)与前一段落中提及的有机溶剂之一混合,或者与上文提及的有机溶剂的混合物混合,而不影响固体支持物在有机溶剂或有机溶剂混合物的存在下保留葡基胺的能力。
30.因为聚糖和其他碳水化合物是亲水的,在它们位于约80%
‑
95%有机溶剂的溶液中时,它们往往会被保留在亲水表面上。在一些优选实施方案中,有机溶剂的浓度为约85%,其中“约”在此情况下意指
±
2%。
31.技术人员将认识到,没有一种有机溶剂可以用于所有情况中,可以用于可能适用于本发明方法的实施方案中的所有固体支持物上。另外,标记从糖蛋白释放的聚糖的本领域技术人员了解,一般必须测试试剂的组合以确定所述组合是否可用于释放、标记和分析许多糖蛋白上存在的聚糖,并且这种测试被认为是本领域中的常规测试。执业医师可以容易地测试任何特定有机溶剂关于含有执业医师希望通过任何特定胺反应性染料标记的聚糖的任何特定样品的适合性,以及执业医师希望将葡基胺保留于其上以供标记的任何特定固体支持物,通过以下方式来测试:将过量的所测试有机溶剂添加至含有已知量的所选葡基胺(“测试葡基胺”)的起始葡基胺溶液样品,使溶剂/溶液混合物与所选固体支持物(已知可用于标记葡基胺的方案中的固体支持物或者针对其对于此目的的实用性测试的多孔固体支持物)接触,用所选胺反应性染料标记葡基胺,将葡基胺用水性缓冲液从固体支持物洗脱,并且使洗脱的溶液经历分析,以确定测试葡基胺是否已被标记,以及如果已被标记,其是否以预期的量存在。如果在所分析的洗脱液中没有以预期量鉴定出标记的测试葡基胺,这表明有机溶剂、标记与固体支持物的特定组合不适于用该标记来标记测试葡基胺。将有机溶剂添加至起始葡基胺溶液
32.在本发明方法中,含有目的葡基胺(并且其还可以含有蛋白质、变性剂、盐、酶或其
他化合物)的起始葡基胺溶液位于初始容器中。然后将起始葡基胺溶液样品与有机溶剂混合以产生所选浓度的有机溶剂(即,约80%至95%、约80至90%、85%
±
3%,优选地85%
±
2%,其中“约”意指
±
1%)的有机溶剂混合物,此时将有机溶剂混合物置于与多孔固体支持物接触。技术人员将认识到,有多种方式来完成此步骤。例如,可以将有机溶剂以在有机溶剂混合物中产生有机溶剂的所需浓度的量添加至最初容纳起始水溶液样品的容器中。或者,可以将起始葡基胺溶液样品转移至更大容器中,并且与有机溶剂混合,以产生具有所需浓度的有机溶剂的混合物,之后将所述混合物添加至具有多孔固体支持物的容器中。可替代地,在容纳多孔固体支持物的容器中可以存在一定量的有机溶剂,使得在将起始葡基胺溶液添加至容器时,有机溶剂与起始葡基胺溶液的混合物产生具有所需浓度的有机溶剂的混合物(在这些实施方案中,将从容器离开的物质优选地加盖或封闭而不是流出,使得起始葡基胺溶液与有机溶剂混合以产生所需浓度的混合物)。最后,可以足够缓慢地开始将所需量的有机溶剂添加至容纳多孔固体支持物的容器中以及开始将起始葡基胺溶液添加至所述容器中,使得在容器中多孔固体支持物处的有机溶剂与起始葡基胺溶液的混合物具有有机溶剂与起始葡基胺溶液的所需浓度。
33.如实施例中所述,在本公开文本的基础研究中,将有机溶剂以产生具有85%有机溶剂和15%水溶液的有机溶剂混合物的量添加至起始葡基胺溶液。
34.为便于参考,容纳多孔固体支持物的容器在本文中有时将被称为“反应容器”。(在微流体设备中,不将起始葡基胺溶液样品转移至容纳多孔固体支持物的单独容器中,而是从通道、管道等的第一部分转移至通道、管道等的第二部分,所述第二部分含有多孔固体支持物。短语“反应室”在本文中有时用于表示微流体装置中被配置用于本发明方法的实施方案的部分。为便于参考,下文的讨论将大体上关于其中将起始葡基胺溶液转移至反应容器的实施方案进行讨论,但是将被理解为也涉及微流体应用,其中将起始葡基胺溶液转移至一部分,所述部分包含足够大的空间以容纳有机溶剂与起始葡基胺溶液样品的混合物和多孔固体支持物,除非上下文另有说明或需要。)反应容器具有第一开口,通常位于顶部,可以通过它引入溶液和试剂;本体,通常是圆筒形,并且含有多孔固体支持物;以及第二开口,通常布置在容器底部,其通常与第一开口相对。第二开口可以是可封闭的,以防止溶液离开反应容器,直至需要为止。容器的本体的内腔的横截面(圆形,在圆筒形本体的情况下)的面积由本体的内部尺寸界定。多孔固体支持物通常定位于反应容器中,填满反应室的横截面面积,使得含有要标记的葡基胺的有机溶剂混合物必须穿过多孔固体支持物中的孔或开口才能到达第二开口。
35.在一些典型实施方案中,可以在如下末端打开容器,将容器设计为使液体于所述末端处离开容器(通常是底部,如果将容器设计为液体从顶部至底部竖直移动,或者水平移动,如在一些微流体应用中可能的情况,其中可以将微流体管设计为将流体从一侧引入并且从另一侧离开,从与引入所述流体的开口不同的开口离开)。然而,如果需要,容器可以具有密封离开开口的手动或自动化手段,使得在需要试剂的存在的步骤期间将试剂保留在容器中,同时允许打开离开开口以允许在需要时将试剂排出或从容器洗脱。例如,底部可以具有翻门(flap)、盖或其他遮盖物,当其在开口上封闭时,使流体可保留在容器中,并且当打开其时,使流体可离开容器。在微流体应用中,其中标记发生在反应室中,所述反应室可以竖直布置或水平布置,在反应室与执业医师希望反应物可以沿其行进的通道或其他通路之
间可以存在例如一个或多个阀,其中阀将反应室与被打开以允许溶液和溶剂沿所需通路从反应室洗脱的特定通道分离。用于固体支持物的材料
36.所选用于多孔固体支持物的材料呈一种构造,如是编织的,以允许有机溶剂混合物接触所述材料的大表面积,或者具有多个孔或开口以允许有机溶剂混合物接触所述材料的大表面积。在一些实施方案中,多孔固体支持物由亲水材料制得,相对于蛋白质、缓冲盐、还原剂或已知存在于要从其分离碳水化合物的特定混合物中的其他试剂,所述亲水材料优先保留葡基胺。
37.技术人员将认识到,可以将葡基胺在多孔固体支持物上保留大约数秒,但是不期望葡基胺流经固体支持物时过快(例如,小于1秒)而没有时间进行保留,也不期望过慢(例如,超过15分钟)而使方案增加不必要的时间。因此,流过多孔固体支持物的速度应慢至使葡基胺足以有机会保留在多孔固体支持物上,但快至足以避免延迟,不使工作流增加不必要的时间。技术人员熟悉如用于固相萃取方案的筒柱的材料选择,熟悉导致所需流速的孔径和其他特征,以及熟悉多种程序(如正压、离心)的使用,或真空歧管的使用,用于增加液体在固体支持物上或穿过固体支持物的流速。预期执业医师非常熟悉通过选择用于萃取的材料、孔径和流速使用固相萃取程序从样品萃取葡基胺,并且这种熟悉针对多孔固体支持物、针对孔径且针对流速,关于材料的选择提供充分指导,用于在本发明方法的多个实施方案中使溶剂/溶液混合物流过多孔固体支持物。
38.在一些实施方案中,多孔固体支持物由用于碳水化合物的固相萃取(“spe”)或用于碳水化合物的亲水相互作用液相色谱(“hilic”)分离的材料制得。考虑用于碳水化合物的hilic分离和用于碳水化合物的spe萃取的材料通常适用于多孔固体支持物中。spe在本领域中广泛使用,并且关于适用于spe的材料以及如何进行有许多传授,如以下参考文献中所例示:thurman和mills,solid
‑
phase extraction:principles and practice,john wiley&sons inc.(纽约,纽约州,1998);n.simpson,solid
‑
phase extraction:principles,techniques,and applications,marcel dekker inc.(纽约,纽约州,2000);以及waters corp.,beginner's guide to spe:solid
‑
phase extraction,john wiley&sons inc.(纽约,纽约州,2014)。因此,预期技术人员可以容易地选择适合用作多孔固体支持物的材料。
39.可以容易地构造以用作多孔固体支持物的亲水材料的例子包括:(a)纤维素、(b)玻璃纤维、(c)氧化铝、(d)氨丙基、(e)天冬酰胺、(f)环糊精、(g)三唑、(h)二乙基氨基乙基、(i)通常用于碳水化合物的hilic分离中的树脂、(j)已经用二醇、氰丙基、乙二胺
‑
n
‑
丙基或酰胺(氨基甲酰基)基团修饰的二氧化硅,或者(k)这些材料中两种或更多种的组合。在一些实施方案中,多孔固体支持物可以是石墨化碳,其结合葡基胺,但是其使用不太优选,尤其因为其可以被通常用于使糖蛋白或糖肽变性的表面活性剂饱和。
40.在一些优选实施方案中,多孔固体支持物由与氨基甲酰基共价键结的二氧化硅珠或颗粒构成。在一些优选实施方案中,与氨基甲酰基共价键结的二氧化硅珠或颗粒是酰胺
‑
80。在一些优选实施方案中,酰胺
‑
80珠或颗粒的大小为3
‑
60微米,更优选地大小为5
‑
50微米,并且仍更优选地大小为约30微米,此处“约”意指
±
2微米。如本文所用,术语“官能化的”、“衍生的”和“修饰的”(在可以用作多孔固体支持物的材料的情况下)是等效的,并且意
指形成固体支持物的本体的材料表面与列出的官能团(例如,氨丙基、二醇、氨基甲酰基)中的一种的分子共价键结,或者在一些实施方案中,与这些官能团中的两种或更多种的分子共价键结(例如,二醇分子和氨基甲酰基分子二者都共价附着至多孔固体支持物的材料表面)。
41.如所述,在一些实施方案中,多孔固体支持物可以由玻璃制得。优选地,玻璃所呈形式具有大量表面积以促进溶剂/溶液混合物中葡基胺的保留,并且玻璃所呈形式优选地使混合物可以流过所述玻璃以促进这种捕获。例如,玻璃可以具有允许流体经由玻璃过滤的多个小孔,或者呈珠或颗粒的形式。在一些优选实施方案中,玻璃呈玻璃纤维的形式。在一些实施方案中,玻璃纤维可以是松散的。在一些实施方案中,玻璃纤维可以是编织的。在其中玻璃纤维是松散的实施方案中,在溶剂、溶液和不期望的试剂流过时,纤维通常将在容器中与保持纤维的基础结构支持物结合使用。在这些实施方案中,将结构支持物布置在玻璃纤维与开口之间,溶剂、溶液和不期望的组分通过所述开口从容器离开。或者,容器可被配置具有出口,所述出口小至足以在允许溶液流出的同时将纤维保持在适当位置。
42.在一些实施方案中,多孔固体支持物可以由氨丙基的形式制得。本领域中已知多种形式的氨丙基可用于分离碳水化合物,并且几种可商业购得。例如,用于分离碳水化合物的氨丙基ap(nh2)hplc柱可从separation methods technologies,inc.(纽瓦克,特拉华州)获得。aphera
tm
nh2 hplc柱由sigma
‑
aldrich co.(圣路易斯,密苏里州)出售。氨丙基硅烷在本领域中用于糖的hilic分离。预期技术人员熟悉在程序如hplc或hilic中将氨丙基用于分离碳水化合物的多种方式,并且可以在本发明方法的其中要采用氨丙基的实施方案中选择合适形式的氨丙基用于结合葡基胺。
43.在一些实施方案中,多孔固体支持物可以由纤维素制得。纤维素可以以薄板使用,但其一般作为微晶粉末用于固相萃取中,并且该形式是优选的,因为它提供用于结合葡基胺的更大表面积。如执业医师将了解,呈粉末、纳米颗粒或其他小颗粒形式的固相支持物的使用通常将与过滤器或其他结构结合使用,所述过滤器或其他结构在洗脱时允许溶剂、溶液和不期望的试剂流过,同时将粉末或纳米颗粒或其他小颗粒保留在容器中。在这些实施方案中,将过滤器或其他结构布置在粉末、纳米颗粒或其他小颗粒与开口之间,溶剂、溶液和不期望的组分经由所述开口从容器离开。
44.在一些实施方案中,多孔固体支持物可以是用二醇、氰丙基、乙二胺
‑
n
‑
丙基或酰胺(氨基甲酰基)基团官能化的磁珠。
45.进一步考虑,在用水溶液(如磷酸盐缓冲盐水)洗涤时,用于多孔固体支持物的材料将释放保留的葡基胺(为清晰起见,应注意,在此步骤中将葡基胺从多孔固体支持物洗脱的水溶液与用于将过量标记从多孔固体支持物洗去的有机溶剂/水溶液混合物(如图1,项目6和9中所述任选的洗涤中示意性地描绘)不同,因为所述水溶液不含该洗涤中约80%
‑
95%浓度的有机溶剂。通常,用于将葡基胺从多孔固体支持物洗脱的溶液的20%或更少是有机溶剂,其中至少80%(且优选地更多)是水溶液。)
46.较不常见地,在一些实施方案中,多孔固体支持物可以由非亲水材料制得,但是在其表面上用亲水材料涂布。由于葡基胺通过与表面的相互作用,而非通过与表面上亲水材料下方的任何非亲水材料相互作用来保持在固体支持物上,预期葡基胺将与固体支持物相互作用,正如固体支持物由亲水材料制得时的葡基胺一般。因此,对本发明方法的其中多孔
固体支持物是由非亲水材料制得,但是在其表面上用亲水材料涂布的实施方案的处理如同多孔固体支持物是由亲水材料制得一般。
47.不希望受限于理论,人们相信,在有机溶剂的浓度为约80%至95%(此处约意指
±
1%)的有机溶剂混合物中且使用亲水材料的多孔固体支持物时,样品中的葡基胺通过亲水相互作用保持在多孔固体支持物上。不希望受限于理论,人们相信,在超过95%的有机溶剂浓度下且使用多孔固体支持物时,葡基胺样品将沉淀或聚集,并且可以通过经由多孔固体支持物中的孔或开口简单过滤而被捕获和保留在固体支持物上,不管多孔固体支持物的材料是亲水的还是非亲水的。例如,如果执业医师选择将有机溶剂的浓度提高至高于95%(例如,至99%或更高),将水性组分稀释至葡基胺位于几乎纯有机溶剂中的点,则非亲水材料可以用于多孔固体支持物。这允许执业医师使用不太昂贵且易于在其中产生所需大小(例如,10微米或更小)的孔或开口的材料(如聚乙烯、尼龙、聚偏二氟乙烯或聚丙烯)用于多孔固体支持物。对于上文讨论的亲水材料,选择用作多孔固体支持物的非亲水材料不应是含有如下化学基团或用所述化学基团衍生的材料,预期所述化学基团会与预期会位于有机溶剂混合物中的蛋白质或其他化合物反应。不希望受限于理论,人们相信,在高于95%的有机溶剂浓度中,葡基胺从起始葡基胺溶液样品聚集或沉淀,并且可以通过将其经由多孔固体支持物中10微米或更小的孔或开口过滤而被捕获和保留在多孔固体支持物上。尽管使用有机溶剂浓度高于95%的溶液由此允许使用更宽范围的材料用于多孔固体支持物(如聚乙烯),但其也减少存在以帮助从多孔固体支持物洗去不期望的试剂的水溶液的量,所述不期望的试剂可能含有游离胺并且因此与葡基胺竞争用胺反应性染料标记。因此,人们相信,在本发明方法的实施方案中,其中有机溶剂混合物的有机溶剂浓度为约80%至95%(此处约意指
±
1%)且其中多孔固体支持物由亲水材料制得或具有亲水材料表面的实施方案大体上是优选的。多孔固体支持物的形式
48.术语“固体支持物”意指,支持物具有固体表面,但是固体支持物不一定由单块的用于制备它的材料制得。“固体支持物”可以例如由多个衍生的二氧化硅珠或颗粒构成,所述珠或颗粒在集合在一起且跨越容器内部布置时提供亲水表面,葡基胺可以保留在所述亲水表面上。如果固体支持物由珠或颗粒制得,则所述珠或颗粒可以被压紧或保留在例如塑料保留器中,以将珠或颗粒保留在容器中的所需位置处。在此类实施方案中,塑料保留器可以由大小恰好跨越容器的内腔配合的塑料环构成,其具有跨越容器内部像网球拍线一样从所述环成网状线(cross hatched)的塑料股线,在成网状线的股线之间具有孔,产生小于珠或颗粒的直径的空隙,从而在允许液体流过时将珠或颗粒保持在适当位置。类似地,固体支持物可以由玻璃纤维制得,其可以布置在彼此之上以及彼此交叉布置,以提供可以保留葡基胺于其上的表面。如果需要,玻璃纤维可以通过塑料保留器(如上文所述的塑料保留器)保持在适当位置。在一些实施方案中,可以将珠、颗粒、玻璃纤维等填塞至容器底部的床中。珠和其他颗粒可以通过例如以下方式来保留:使容器的壁变窄至直径低于珠或颗粒的直径,或者通过定位具有成网状线的部分的合适保留器,所述部分留下的孔或开口对于珠或颗粒而言过小而无法通过,但是所述孔或开口允许流体从容器洗脱。
49.在一些实施方案中,将亲水材料成型为膜或整料,其是刚性且多孔的。然后可以将膜或整料成型为精确配合至容器内腔中且在所需位置填满内腔横截面的形状。可替代地,
可以将膜或整料成型为略小于容器内腔的形状,并且通过例如环绕容器内部的唇边或凸缘,或者通过容器内部的两个或更多个突出物保持在适当位置,所述唇边或凸缘或突出物的布置将所述膜或整料定位在所需位置处。
50.不论多孔固体支持物是否是珠、颗粒、膜或整料,其跨越容器内腔的整个横截面定位于容器中的所需点处,使得容器中的溶液或溶剂在离开前必须通过多孔固体支持物。如果容器如例如埃彭道夫管(eppendorf tube)中那样从圆筒形部分变窄为圆锥形部分,则珠、颗粒、膜或整料的大小可以例如完全覆盖圆筒形部分的底部的面积,并且可以通过在下方使容器壁变窄以形成圆锥形部分而保留在适当位置(但是,与正常的埃彭道夫管不同,本发明方法的实施方案中使用的容器优选地在底部有孔,以允许从容器洗脱流体)。类似地,如果容器是多孔板的孔的圆筒形部分,并且所述孔在底部具有喷嘴,其开口允许溶液在需要时离开孔,则膜或整料的大小可以完全覆盖孔的圆筒形部分的底部的面积,并且可以通过使孔壁变窄以在膜或整料下方形成喷嘴部分而保留在适当位置,而珠或颗粒可以通过使孔的侧面变窄至比所述珠或颗粒的直径更窄而得以保留,同时仍允许流体离开。在其中将亲水材料用于多孔固体支持物,并且葡基胺不属于单糖或者极小的实施方案中,孔或开口的大小可以比下文讨论的实施方案中更大,只要在有机溶剂混合物流过多孔固体支持物时,孔或开口迫使葡基胺与亲水材料接触即可。当位于浓度为80%或更多有机溶剂与20%或更少水溶液的有机溶剂中时,葡基胺将倾向于与固体支持物的亲水材料相互作用并保留在所述亲水材料上。
51.如本文所用,用于描述固体支持物的术语“多孔的”和“可渗透的”意图表达,固体支持物允许溶剂和溶液逐渐经由其过滤。除非上下文另外指明或需要,否则本公开文本中描述的所有固体支持物都是多孔固体支持物。应注意,在一些实施方案中,多孔固体支持物可能通过例如配合件、使容器壁变窄或者其中布置所述固体支持物的容器的内部结构来置于或保持在适当位置处。此类配合件、变窄处或内部结构是固体并且可以保留或支持多孔固体支持物,但是它们无需由与反应容器的材料相同的材料制得,并且意图不被视为多孔固体支持物,如同该短语在本公开文本中所用。
52.多孔固体支持物的形式可以根据执业医师的选择而变,只要其样式要求含有要标记的葡基胺的有机溶剂混合物穿过它即可。例如,多孔固体支持物可以是跨越管(如微流体装置的管)的内腔的整料、过滤器或膜,或者可以是填充固相萃取(“spe”)筒柱的内部的一些或全部的玻璃纤维或树脂。在一些实施方案中,用于固体支持物的材料可以呈珠或颗粒的形式,其可以通过例如定位在容器内腔内珠或颗粒下方的具有小于珠或颗粒的直径的网状线的塑料框而保持在反应容器内的适当位置。如果多孔固体支持物是树脂,其可以例如定位于具有圆锥形末端的容器中,所述圆锥形末端逐渐变细至将允许液体通过但不允许树脂通过的直径。
53.有机溶剂混合物通常流过多孔固体支持物。在一些实施方案中,含有葡基胺的有机溶剂混合物可以通过在多孔固体支持物下游施加真空来抽吸通过多孔固体支持物,或者,特别是在微流体装置中,可以通过在多孔固体支持物上游加压来推动通过多孔固体支持物。应注意,技术人员已经使用多种固相材料(如固相萃取筒柱)多年来捕获聚糖用于许多方案的“净化”步骤,并因此假设技术人员熟悉适用于在允许洗去混合物中不期望组分的同时捕获有机溶剂混合物中存在的葡基胺的材料的多种形状、构造和类型。
从多孔固体支持物洗脱葡基胺
54.在有机溶剂混合物(其为约80
‑
95%有机溶剂)的存在下保留在多孔固体支持物上的葡基胺可以用水溶液从多孔固体支持物洗脱。用于从固体支持物洗脱葡基胺的溶液的高达20%可以是有机溶剂,但是其是至少80%水溶液,且更高浓度的水溶液是优选的。应注意,“水溶液”可以是水,但是优选地是缓冲溶液,如hepes(2
‑
[4
‑
(2
‑
羟乙基)哌嗪
‑1‑
基]乙磺酸)缓冲液、磷酸盐缓冲盐水或甲酸铵缓冲液。缓冲溶液中盐的存在增加水溶液的极性,从而促进在洗脱期间从固体支持物释放葡基胺。缓冲液帮助将葡基胺维持在ph受控溶液中,从而增加其稳定性。
[0055]
然后收集洗脱的标记的葡基胺,并且其可用于提供至分析仪器以供分析。例如,可以通过高效液相色谱、毛细管电泳、微流体分离或亲水相互作用液相色谱(“hilic”)来分离标记的葡基胺。然后可以通过检测其荧光并测量该荧光的强度,通过质谱,或者通过检测荧光强度与质谱的组合来分析标记的葡基胺。容纳固体支持物的容器
[0056]
如上所述,在典型实施方案中,要标记的葡基胺最初位于水溶液中,然后通过向溶液中添加更大量的有机溶剂来将其稀释。方便地,将含有葡基胺的所得有机溶剂混合物置入设计用于此目的的第二容器中。在典型实施方案中,所述容器的本体具有长度和两个末端。在一些实施方案中,所述两个末端沿容器本体的长度彼此相对地布置。所述末端各自独立地开放或者可以独立地可开放,以允许溶液和试剂在第一末端引入,以及溶液和试剂在第二末端离开。在一些实施方案中,容器是圆筒形。在一些实施方案中,容器是圆筒形,但是在第二末端变窄为喷嘴,以促进在洗脱标记的葡基胺时捕获洗脱的标记的葡基胺用于分析。在一些实施方案中,容器可以与标准埃彭道夫管、微量离心管或离心管类似,但是在底部具有开口。通常,此类管具有:具有开放或可开放第一末端开口的第一部分、连接至与第一末端相对的第二部分的圆筒形本体,所述第二部分具有圆锥形,所述圆锥形随着其远离圆筒形第一部分延伸而变窄,直至其到达第二末端。第二末端可以是开放的,但是在一些实施方案中可以是可封闭的,从而允许容器中的溶液在底部末端封闭时在容器中进行孵育,但是允许溶液在打开第二末端时流出容器。例如,底部末端可以配备有盖或可去除罩,以允许使用者或自动化装置打开底部末端并允许容器中的溶液流出。在其他实施方案中,容器的形状可以是大体上圆筒形、圆锥形、四面体形或立方形。容器可以成型以被收纳至被设计为收纳容器的设备中,在此情况下,它们可以被称为“筒柱”。
[0057]
在一些实施方案中,第二容器是多孔板中的孔,并且在优选实施方案中,多孔板的每个孔是适应于捕获和保留葡基胺的容器。此类孔通常具有圆筒形本体,其变窄至包含开口以允许溶液离开孔的底部部分。孔底部的出口优选地比孔的直径更窄,并且可以是从孔的底部突出的喷嘴,特别是在需要在用于自动化样品收集的系统中使用所述板的情况下。
[0058]
不论第二容器是管、筒柱还是孔,其具有布置于容器顶部与出口之间的多孔固体支持物。在包含喷嘴的孔中,第一多孔固体支持物优选地紧靠喷嘴上方布置。多孔固体支持物优选为如先前章节中讨论的亲水材料。在其中多孔固体支持物由例如珠(如衍生的二氧化硅珠)构成的实施方案中,出口的直径可以小于珠的直径,或者珠可以通过常规手段保持在适当位置,如通过具有一个或多个多孔压缩玻璃料,或通过在珠下方具有塑料保留器,所述保留器具有交叉构件。
[0059]
含有用于保留碳水化合物的亲水聚合物的固相萃取(spe)筒柱和其他装置通常具有用于将聚合物保留在装置内的构件。这些构件通常被选择以与预期它们会暴露于的碳水化合物和其他试剂不反应,并且允许流体(如洗涤溶液)通过计划的出口(如喷嘴)离开装置。这些常规构件中的任一种可以用于或适应于将多孔固体支持物保留在装置中。
[0060]
反应容器本身由与将在容器中使用的试剂和溶液不反应的材料制得。通常,反应容器是塑料的。用于碳水化合物的spe的筒柱和容器是本领域中熟知的,并且可从多个供货商获得。对于用于将碳水化合物与其他类型的化合物(如蛋白质)分离的spe筒柱,所用塑料或其他材料通常适用于本发明方法中。从多孔固体支持物洗脱保留的葡基胺
[0061]
一旦从多孔固体支持物上保留的标记的葡基胺去除任何过量的标记,通过用水溶液洗涤支持物从多孔固体支持物洗脱保留的标记的葡基胺。已经添加盐的水溶液是优选的。还可以使用溶液的组合。水溶液可以包含多达20%有机溶剂或者仅含水或缓冲溶液。可以通过进行平行测定容易地测试任何特定溶液或组合在从由任何特定材料制得的固体支持物洗脱葡基胺中的适合性。试剂盒
[0062]
在一些实施方案中,本发明提供用于根据上文讨论的方法标记通过酶消化从糖蛋白或糖肽释放的葡基胺的试剂盒。试剂盒含有用于以下的试剂和材料:通过酶消化使糖蛋白或糖肽去糖基化,产生含有所得葡基胺的有机溶剂混合物,将葡基胺固定在多孔固体支持物上,然后用胺反应性染料标记葡基胺。
[0063]
试剂盒包括去糖基化酶。在一些实施方案中,所述酶是肽n
‑
糖苷酶f。试剂盒包含适合于将糖蛋白或糖肽与去糖基化酶一起孵育的水溶液(如缓冲液)。在用于变性的实施方案中,试剂盒可能还含有洗涤剂或变性剂。
[0064]
试剂盒还包括有机溶剂,如乙腈、无水乙醇、无水甲醇、异丙醇、丁醇、甲苯、乙酸乙酯、丙酮、四氢呋喃、乙醚、二氯甲烷、氯仿、叔丁基甲基醚、苯、四氯化碳、异辛烷、己烷,或者这些中的任何两种或更多种的组合。在试剂盒的一些实施方案中,有机溶剂是乙腈。所述酶、溶液和溶剂以及洗涤剂或变性剂(如果包括)方便地在单独容器中提供。
[0065]
在一些实施方案中,水溶液和有机溶剂各自以预先测量的量在试剂盒中提供,使得在合并时,它们形成有机溶剂与水溶液的混合物,所述混合物是80%
‑
95%有机溶剂与20%
‑
5%水溶液。在一些实施方案中,预先测量的量使得在合并时,它们形成有机溶剂与水溶液的混合物,所述混合物是80%
‑
90%有机溶剂与20%
‑
10%水溶液。在一些实施方案中,预先测量的量使得在合并时,它们形成有机溶剂与水溶液的混合物,所述混合物是85%
±
2%有机溶剂与15%
±
2%水溶液。
[0066]
试剂盒还包含其内布置有多孔固体支持物的容器。多孔固体支持物布置在容器内的合适位置,使得在例如通过将混合物倾倒或移液在固体支持物上而将混合物引入多孔固体支持物时,含有释放的葡基胺的有机溶剂与水溶液的混合物穿过多孔固体支持物。在一些实施方案中,多孔固体支持物呈膜的形式。在一些实施方案中,多孔固体支持物是亲水材料。在一些实施方案中,亲水材料是(a)纤维素,(b)玻璃纤维,(c)氧化铝,(d)二氧化硅,(e)含有二醇、氨丙基、氨基甲酰基、氰丙基、乙二胺
‑
n
‑
丙基的官能化表面,(f)用二醇、氨丙基或氨基甲酰基衍生的二氧化硅,(g)纤维素,(h)环糊精,(i)天冬酰胺,(j)三唑,(k)二乙基
氨基乙基,(l)用于碳水化合物的固相萃取的树脂,或者,(m)这些中的两种或更多种的组合。在一些实施方案中,多孔固体支持物由二氧化硅制得,并且所述二氧化硅与一个或多个氨基甲酰基共价键结。在一些实施方案中,二氧化硅呈珠或颗粒的形式。在一些实施方案中,珠或颗粒的大小为3
‑
60微米。在一些实施方案中,珠或颗粒的大小为约30微米。在一些实施方案中,与氨基甲酰基共价键结的珠或颗粒是酰胺
‑
80。
[0067]
试剂盒还包含胺反应性染料。在一些实施方案中,染料是instantpc
tm
。实施例实施例1.
[0068]
此实施例陈述在下文一些实施例中使用范例碳水化合物进行的标记程序的范例工作流中使用的一些试剂的缩写。“sds”:十二烷基硫酸钠“tris”:三(羟甲基)氨基甲烷“肽n
‑
糖苷酶f混合物”:肽n
‑
糖苷酶f(约1mg/ml)与750mm hepes(4
‑
(2
‑
羟乙基)
‑1‑
哌嗪乙磺酸)ph 8.0缓冲液的1:1混合物。实施例2.
[0069]
此实施例陈述了用于使用范例酰胺支持物的n
‑
聚糖instantpc
tm
标记的范例工作流。n
‑
聚糖释放和制备
[0070]
将10μl 4mg/ml范例糖蛋白依那西普的四个样品添加至pcr板上的孔中。将2μl sds添加至每孔并且将pcr板在90℃下孵育3分钟以使糖蛋白变性。在将样品冷却至低于50℃后,将2μl肽n
‑
糖苷酶f混合物添加至每孔,以引起糖蛋白的酶消化并且使聚糖从糖蛋白作为葡基胺释放。然后将pcr板在50℃下孵育5min。然后将10μl 1.5m tris ph 8缓冲液添加至两个样品中的每一个,以达到750mm tris的最终浓度,同时将10μl h2o添加至另两个样品中的每一个,以保持四个样品的体积相同。每个样品的体积为大约26μl。维持在溶液中的两个样品的标记和随后的分析
[0071]
将已经添加tris缓冲液的一个样品和已经仅添加水的一个样品各自通过将15μl标记反应混合物(与染料溶剂混合的instantpc
tm
染料)添加至水溶液来进行标记,所述水溶液还含有现在去糖基化的糖蛋白、sds、肽n
‑
糖苷酶f以及在缓冲液和肽n
‑
糖苷酶f混合物中存在的任何其他试剂。将两个样品在50℃下孵育3分钟。将水添加至每个样品以使体积高达100μl,以使样品体积与下一章节中讨论的样品的样品体积相同。然后注入1μl的每个样品用于高效液相色谱(hplc)分离以及随后通过标记的葡基胺的荧光进行的分析。两个样品的固定及其随后的标记
[0072]
将另两个样品(即已添加tris缓冲液的一个样品和已经仅添加水的一个样品,各自体积为大约26μl)与174μl有机溶剂乙腈混合,以形成大约85%有机溶剂与15%水溶液的溶液。将所得混合物加载于“monospin”酰胺固相萃取(“spe”)离心柱(gl sciences,inc.,美国,托伦斯,加利福尼亚州)上,从而允许在乙腈/水溶液中的其他组分流过时,混合物中的葡基胺固定在柱中的固体支持物上。然后用85%乙腈/15%水的溶液将固体支持物洗涤一次。
[0073]
然后通过将15μl标记反应混合物(与染料溶剂混合的instantpc
tm
染料)添加至固
体支持物以标记固定在固体支持物上的任何葡基胺来标记每个样品。将两个样品在50℃下孵育3分钟。然后通过用100μl水溶液洗涤固体支持物来洗脱现在标记的葡基胺。在洗脱后,注入1μl的每个样品用于通过高效液相色谱分离以及对标记的葡基胺的荧光的分析。实施例3
[0074]
此实施例报告实施例2中陈述的研究的结果。
[0075]
结果以图表形式描绘于图2中。图左侧的两个柱显示在溶液中标记的样品的荧光。对照(仅向去糖基化混合物添加水的样品)显示峰面积超过35百万单位,而含有tris缓冲液的样品显示峰面积为约2百万,反映出当样品中存在tris缓冲液或可以与胺反应性染料反应的胺的另一来源时检测葡基胺的困难。图右侧的两个柱显示样品的荧光,所述样品被置于85%有机溶剂/15%水溶液中,固定在亲水固体支持物上,在支持物上标记,进行洗脱和分析。右起第二个柱显示对照(仅向去糖基化混合物添加水)的结果,并且显示峰面积为接近33百万单位,接近溶液中标记的对照样品的误差棒的下限。含有tris缓冲液的样品显示峰面积为大约26百万,其信号是溶液中标记的含有tris的样品的峰面积的至少10倍。
[0076]
应当理解,本文所述的实施例和实施方案仅用于说明目的,并且根据它们进行的各种修改或改变将为本领域技术人员知晓,并且应包括在本技术的精神和范围内以及所附权利要求的范围内。本文引用的所有公开案、专利和专利申请出于所有目的通过引用以其整体特此并入。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。