jak抑制剂和p53
‑
mdm2抑制剂联合用于制备治疗t
‑
all药物的用途
技术领域
1.本发明涉及药物治疗领域,特别涉及一种jak抑制剂和p53
‑
mdm2抑制剂联合用于制备治疗t
‑
all药物的用途。
背景技术:
2.t细胞急性淋巴细胞白血病(t
‑
all)是最常见的血液系统恶性肿瘤之一。t
‑
all患者5年生存率低于50%,复发的成人t
‑
all死亡率高达90%。迄今为止,t
‑
all的低治愈率尚未得到改善,在达到完全缓解后的复发仍然是t
‑
all治疗的主要挑战,所以科研人员一直致力于开发新的治疗靶点和新的有效药物。最近的研究表明,超过25%的t
‑
all患者携带jak
‑
stat突变,其中jak3突变在t
‑
all患者中最为常见。m511i点突变作为最常见的jak3突变,在所有jak3突变中的突变率为34.7%。jak3突变经常伴随着t
‑
all的大量遗传变化,例如表观遗传调控基因phf6突变。研究发现t
‑
all患者中phf6突变常与jak3突变共存,具有jak/stat突变和phf6突变的患者的平均生存时间明显短于仅有jak/stat突变的患者。虽然多种药物已应用于t
‑
all的治疗,但患者预后仍不佳。因此,对于phf6
△
和jak3
m511i
共突变的患者,新型有效的治疗方案是延长患者的生存期,改善患者的预后关键问题。
3.jak激酶是一类胞内非受体酪氨酸激酶家族,该激酶家族有4个成员:jak
‑
1、jak
‑
2、jak
‑
3和tyk
‑
2。其通过与信号转导及转录激活蛋白(stat)之间的相互作用在细胞因子受体信号通路中发挥着重要作用。因此,jak激酶是一类非常重要的药物靶点,针对这一靶点而研发的jak抑制剂托法替尼(tofacitinib),可有效抑制jak1和jak3的活性,但其副作用明显,如感染、贫血、血细胞减少等。p53信号通路在phf6 ko jak3
m511i t
‑
all发病机制中起着关键调节作用,idasanutlin可以选择性地抑制p53与mdm2相互结合,其选择性结合在mdm2表面的p53位点,将p53与mdm2隔离,导致p53稳定后细胞凋亡程序被激活,从而杀死癌细胞。但mdm2抑制剂并不总是会诱导p53野生型癌细胞凋亡,这可能是由于下游信号通路失效所致,并且最初对mdm2抑制剂敏感的细胞随着时间的推移也会产生耐药性。
技术实现要素:
4.本发明为了解决现有治疗t
‑
all的药物治疗效果不佳的问题,提供了一种jak抑制剂和p53
‑
mdm2抑制剂联合用于制备治疗t
‑
all药物的用途。
5.本发明是通过以下技术方案得以实现的。
6.一种jak抑制剂和p53
‑
mdm2抑制剂联合用于制备治疗phf6
△
和jak3
m511i
共突变的t
‑
all药物的用途。
7.进一步的,所述jak抑制剂选用tofacitinib。
8.进一步的,所述p53
‑
mdm2抑制剂选用idasanutlin。
9.进一步的,所述jak抑制剂和p53
‑
mdm2抑制剂的质量比为(3.5
‑
4.5):(2.5
‑
3.5)。
10.一种药物组合物,包括jak抑制剂和p53
‑
mdm2抑制剂。
11.进一步的,所述jak抑制剂选用tofacitinib。
12.进一步的,所述p53
‑
mdm2抑制剂选用idasanutlin。
13.进一步的,所述jak抑制剂和p53
‑
mdm2抑制剂的质量比为4:3。
14.一种上述药物组合物在制备治疗phf6
△
和jak3
m511i
共突变的t
‑
all药物的用途。
15.本技术具有以下有益效果。
16.本技术通过在phf6
△
和jak3
m511i
共突变的小鼠模型中,联合应用tofacitinib和idasanutlin进行治疗,二者协同作用克服单药应用的耐药及毒副作用,缓解小鼠的疾病,延长其生存期,改善预后,达到了很好的治疗效果,也为tofacitinib和idasanutlin在临床上联合应用治疗phf6
△
和jak3
m511i
突变的t
‑
all患者提供了理论基础。
附图说明
17.图1是本发明phf6
△
和jak3
m511i
共突变t
‑
all小鼠模型构建模式图;
18.图2是本发明携带phf6
△
与jak3
m511i
共突变的t
‑
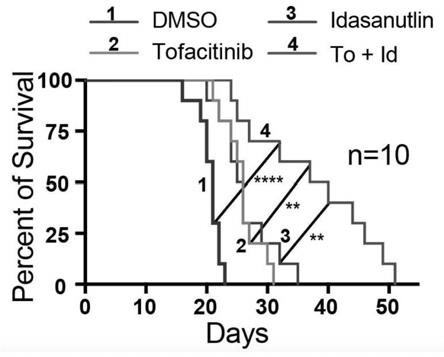
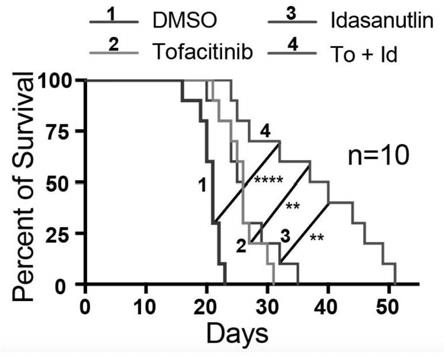
all小鼠经过四种治疗方案治疗后的生存期监测图;
19.图3是本发明携带phf6
△
与jak3
m511i
共突变的t
‑
all小鼠经过四种治疗方案治疗后外周血血常规检测图;
20.图4是本发明携带phf6
△
与jak3
m511i
共突变的t
‑
all小鼠经过四种治疗方案治疗后白血病细胞在各器官的浸润程度图;
21.图5本发明携带phf6
△
与jak3
m511i
共突变的t
‑
all小鼠经过四种治疗方案治疗后各器官重量图;
22.图6是本发明携带phf6
△
与jak3
m511i
共突变的t
‑
all小鼠经过四种治疗方案治疗后,he染色检测白血病细胞浸润程度图;
23.图7是本发明携带phf6
△
与jak3
m511i
共突变的t
‑
all小鼠经过四种治疗方案治疗后,tunel染色检测白血病细胞凋亡图;
24.图8是本发明携带phf6
△
与jak3
m511i
共突变的t
‑
all小鼠经过四种治疗方案治疗后,ki67染色检测白血病细胞增殖图。
具体实施方式
25.本技术的tofacitinib购自medchemexpress(mce),货号为hy
‑
40354a。
26.本技术的idasanutlin购自medchemexpress(mce),货号为hy
‑
15676。
27.实施例1构建phf6
△
和jak3
m511i
共突变t
‑
all小鼠
28.利用同源重组技术将phf6的外显子4到外显子5两端插入两个loxp序列,将小鼠与表达cre重组酶的vav1
‑
cre转基因小鼠交配,产生在造血系统条件性敲除phf6小鼠。
29.处死phf6野生型或phf6基因敲除的雄性小鼠,从股骨和胫骨获取骨髓细胞。将lin
‑
细胞富集并培养在含有10%胎牛血清(fbs)、50ng/ml重组小鼠干细胞因子、10ng/ml重组小鼠白介素
‑
3和50ng/ml重组小鼠血小板生成素的培养基。将mscv
‑
jak3
m511i
‑
ires
‑
gfp逆转录病毒载体转染到293t细胞中,并在48小时和72小时后收获病毒。将jak3
m511i
‑
gfp病毒转染lin
‑
细胞。雄性小鼠静脉注射gfp
细胞,建立vav1
‑
cre phf6
fl/y
jak3
m511i
的t
‑
all小鼠模型(phf6
△
和jak3
m511i
共突变t
‑
all小鼠)(构建模式参见图1)。
30.实施例2给药方法
31.phf6
△
和jak3
m511i
共突变t
‑
all小鼠经口灌胃给予安慰剂(dmso)、单用tofacitinib、单用idasanutlin或联合tofacitinib和idasanutlin四种方案进行治疗
32.给药剂量:tofacitinib(每天40mg/kg),idasanutlin(每天30mg/kg),dmso(浓度0.01%,每天150ul)
33.给药途径:经口灌胃法给药
34.给药时间:每天接受药物治疗直至死亡。
35.实施例3生存期检测
36.phf6
△
和jak3
m511i
共突变t
‑
all小鼠发病后,每天接受药物直至死亡,计算其四种给药方案的小鼠的生存期(图2为不同给药方案小鼠的生存期)。
37.实验结果表明,联合tofacitinib和idasanutlin治疗小鼠的生存期明显长于安慰剂(dmso)、单用tofacitinib、单用idasanutlin治疗的小鼠。
38.实施例4外周血血常规检测
39.在1.5ml ep管中加入480ul预稀释液(购自mindray迈瑞生物,主要成分为十二烷基三甲基氯化铵、缓冲剂),取20ul小鼠眼血,加入ep管混匀后,血常规仪检测(图3为外周血血常规检测结果)
40.实验结果表明,联合tofacitinib和idasanutlin治疗小鼠的外周血中血红蛋白和血小板数目明显高于其余三组治疗小鼠,而白血病细胞数目明显低于其余三组治疗小鼠。
41.实施例5流式检测白血病细胞比例
42.在流氏管中加入80ul pbe buffer(pbs 2%fbs 2nm edta),取20ul小鼠眼血,与pbe buffer混匀。每管加入1ml红细胞裂解液,室温静置10min,4度离心1500rpm,5min,弃上清,用100ul pbs重悬,流式分析仪检测gfp 白血病细胞比例,即白血病细胞比例。
43.分离出小鼠的胫骨,股骨和髂骨,在3ml pbe,使用1ml注射器从骨的两端反复冲洗骨髓腔,以获得骨髓细胞,用100目尼龙膜过滤收集全骨髓细胞,4度离心1500rpm,5min,弃上清,用100ul pbs重悬,流式分析仪检测gfp
白血病细胞比例。
44.取出小鼠的脾脏、肝脏、胸腺,分别在3ml pbe中研磨,用100目尼龙膜过滤收集细胞,4度离心1500rpm,5min,弃上清,用100ul pbs重悬,流式分析仪检测各gfp 白血病细胞比例。(图4为流式检测外周血、骨髓、肝脏、脾脏、胸腺中白血病细胞比例情况)
45.实验结果表明,联合tofacitinib和idasanutlin治疗小鼠的外周血、骨髓、肝脏、脾脏、胸腺中白血病细胞的比例明显低于其余三组治疗小鼠。
46.实施例6检测各脏器重量
47.分别取出四种给药方案的小鼠的肝脏,胸腺,脾脏,分别称重,以此作为一个判断疾病严重程度的指标(图5为各脏器重量)。
48.实验结果表明,与其余三组治疗小鼠相比,联合tofacitinib和idasanutlin治疗小鼠小鼠脾脏、肝脏和胸腺的重量明显降低。
49.实施例7he染色检测白血病细胞浸润程度
50.对四种给药方案的小鼠的骨髓、脾脏、肝脏、胸腺、脑石蜡切片,脱蜡处理后,进行he染色,检测这些脏器组织中,白血病细胞的浸润程度(图6为he染色检测白血病细胞浸润情况)。
51.实验结果表明,与其余三组治疗小鼠相比,联合tofacitinib和idasanutlin治疗明显降低了小鼠脾脏、肝脏、脑、胸腺和骨髓的白血病细胞浸润程度。
52.实施例8tunel染色检测白血病细胞凋亡
53.对四种给药方案的小鼠的骨髓石蜡切片,脱蜡处理后,进行tunel染色,检测骨髓中白血病细胞的凋亡情况(图7为tunel染色检测白血病细胞凋亡情况)。
54.实验结果表明,与其余三组治疗小鼠相比,联合tofacitinib和idasanutlin治疗小鼠骨髓中的凋亡细胞明显增加。
55.实施例9ki67染色检测白血病细胞增殖
56.对四种给药方案的小鼠的脾脏、肝脏、脑、胸腺石蜡切片,脱蜡处理后,进行ki67染色,检测这些脏器组织中,白血病细胞的增殖能力(图8为ki67染色检测白血病细胞增殖情况)。
57.实验结果表明,与其余三组治疗小鼠相比,联合tofacitinib和idasanutlin治疗小鼠的肝脏、脾脏、脑和胸腺中白血病细胞的增殖能力明显降低。
58.本具体实施方式的实施例均为本发明的较佳实施例,并非依此限制本发明的保护范围,故:凡依本发明的结构、形状、原理所做的等效变化,均应涵盖于本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。