组合疗法
1.优先权
2.本技术要求2019年2月28日提交的美国申请号62/811,861和2019年8月30日提交的美国申请号62/894,479的权益和优先权,所述申请各自特此以引用的方式整体并入。
技术领域
3.本发明尤其涉及包含嵌合蛋白的组合物的组合,所述组合物的组合可用于治疗疾病的方法如用于癌症和自身免疫的免疫疗法中。
4.以电子方式提交的文本文件的说明
5.本技术含有序列表。它已经由efs
‑
web以名称为“shk
‑
014pc_sequencelisting_st25”的ascii文本文件形式通过电子方式提交。序列表的大小是45,056字节,并且创建于2020年2月27日。所述序列表特此以引用的方式整体并入。
背景技术:
6.免疫系统对于人体对癌细胞和引起疾病的异物的响应至关重要。然而,许多癌症已经发展了通过例如传递或传播免疫抑制性信号来避免免疫系统的机制。另外,许多抗癌治疗剂不直接刺激和/或激活免疫响应。目前使用双特异性抗体、连接的scfv或t细胞衔接器的组合免疫疗法不能阻断检查点(免疫抑制性信号),也不能激动(刺激)tnf受体。这可能是因为这些分子在工程化以通过单价抗原结合臂结合多个靶标时失去靶标亲合力。因此,仍然需要开发至少具有多种功能但仍保留靶标亲合力
‑
例如,反向免疫抑制性信号和刺激抗癌免疫响应的治疗剂。
技术实现要素:
7.因此,在各个方面,本发明提供了可用于癌症免疫疗法的组合物和方法。例如,本发明部分地涉及用于治疗癌症的方法,所述方法包括(同时或顺序地)施用至少一种针对免疫检查点分子的抗体;干扰素基因刺激因子(sting)激动剂;和/或一种或多种嵌合蛋白,其中每种嵌合蛋白能够阻断免疫抑制性信号和/或刺激免疫激活信号。
8.本发明的一方面涉及用于治疗有需要的受试者的癌症的方法,所述方法包括:向所述受试者提供第一药物组合物,所述第一药物组合物包含能够结合细胞毒性t淋巴细胞相关抗原4(ctla
‑
4)的抗体;以及向所述受试者提供第二药物组合物,所述第二药物组合物包含异源嵌合蛋白。在此,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体;(b)第二结构域,所述第二结构域包含ox40l的细胞外结构域的一部分,其中所述部分能够结合ox40l受体;和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
9.本发明的另一方面涉及用于治疗受试者的癌症的方法,所述受试者已经进行或正在进行用能够结合细胞毒性t淋巴细胞相关抗原4(ctla
‑
4)的抗体治疗。所述方法包括向所
述受试者提供包含异源嵌合蛋白的药物组合物,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体;(b)第二结构域,所述第二结构域包含ox40l的细胞外结构域的一部分,其中所述部分能够结合ox40l受体;和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
10.本发明的另一方面提供了用于治疗受试者的癌症的方法,所述方法包括:向所述受试者提供药物组合物,所述药物组合物包含能够结合细胞毒性t淋巴细胞相关抗原4(ctla
‑
4)的抗体。在此,所述受试者已经进行或正在进行用异源嵌合蛋白治疗,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体;(b)第二结构域,所述第二结构域包含ox40l的细胞外结构域的一部分,其中所述部分能够结合ox40l受体;和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
11.本发明的一方面涉及用于治疗有需要的受试者的癌症的方法,所述方法包括:向所述受试者提供第一药物组合物,所述第一药物组合物包含能够结合程序性细胞死亡蛋白1(pd
‑
1)或结合pd
‑
1配体的抗体;以及向所述受试者提供第二药物组合物,所述第二药物组合物包含异源嵌合蛋白。在此,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体;(b)第二结构域,所述第二结构域包含ox40l的细胞外结构域的一部分,其中所述部分能够结合ox40l受体;和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
12.本发明的另一方面涉及用于治疗受试者的癌症的方法,所述受试者已经进行或正在进行用能够结合程序性细胞死亡蛋白1(pd
‑
1)或结合pd
‑
1配体的抗体治疗。所述方法包括向所述受试者提供包含异源嵌合蛋白的药物组合物,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体;(b)第二结构域,所述第二结构域包含ox40l的细胞外结构域的一部分,其中所述部分能够结合ox40l受体;和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
13.本发明的另一方面提供了用于治疗受试者的癌症的方法,所述方法包括:向所述受试者提供药物组合物,所述药物组合物包含能够结合程序性细胞死亡蛋白1(pd
‑
1)或结合pd
‑
1配体的抗体。在此,所述受试者已经进行或正在进行用异源嵌合蛋白治疗,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体;(b)第二结构域,所述第二结构域包含ox40l的细胞外结构域的一部分,其中所述部分能够结合ox40l受体;和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
14.本发明的一方面涉及用于治疗有需要的受试者的癌症的方法,所述方法包括:向所述受试者提供第一药物组合物,所述第一药物组合物包含干扰素基因刺激因子(sting)激动剂;以及向所述受试者提供第二药物组合物,所述第二药物组合物包含异源嵌合蛋白。在此,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体;
(b)第二结构域,所述第二结构域包含ox40l的细胞外结构域的一部分,其中所述部分能够结合ox40l受体;和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
15.本发明的另一方面涉及用于治疗受试者的癌症的方法,所述受试者已经进行或正在进行用干扰素基因刺激因子(sting)激动剂治疗。所述方法包括向所述受试者提供包含异源嵌合蛋白的药物组合物,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体;(b)第二结构域,所述第二结构域包含ox40l的细胞外结构域的一部分,其中所述部分能够结合ox40l受体;和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
16.本发明的另一方面提供了用于治疗受试者的癌症的方法,所述方法包括向所述受试者提供包含干扰素基因刺激因子(sting)激动剂的药物组合物。在此,所述受试者已经进行或正在进行用异源嵌合蛋白治疗,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体;(b)第二结构域,所述第二结构域包含ox40l的细胞外结构域的一部分,其中所述部分能够结合ox40l受体;和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
17.本发明的一方面涉及用于治疗有需要的受试者的癌症的方法,所述方法包括:向所述受试者提供第一药物组合物,所述第一药物组合物包含能够结合程序性细胞死亡蛋白1(pd
‑
1)或结合pd
‑
1配体的抗体;以及向所述受试者提供第二药物组合物,所述第二药物组合物包含异源嵌合蛋白。在此,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体;(b)第二结构域,所述第二结构域包含light的细胞外结构域的一部分,其中所述部分能够结合light受体;和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
18.本发明的另一方面涉及用于治疗受试者的癌症的方法,所述受试者已经进行或正在进行用能够结合程序性细胞死亡蛋白1(pd
‑
1)或结合pd
‑
1配体的抗体治疗。所述方法包括向所述受试者提供包含异源嵌合蛋白的药物组合物,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体;(b)第二结构域,所述第二结构域包含light的细胞外结构域的一部分,其中所述部分能够结合light受体;和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
19.本发明的另一方面提供了用于治疗受试者的癌症的方法,所述方法包括:向所述受试者提供药物组合物,所述药物组合物包含能够结合程序性细胞死亡蛋白1(pd
‑
1)或结合pd
‑
1配体的抗体。在此,所述受试者已经进行或正在进行用异源嵌合蛋白治疗,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体;(b)第二结构域,所述第二结构域包含light的细胞外结构域的一部分,其中所述部分能够结合light受体;和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
20.本发明的另一方面提供了用于评估癌症治疗在有需要的受试者中的功效的方法,
其中所述受试者患有癌症,所述方法包括以下步骤:(i)向所述受试者提供包含异源嵌合蛋白的药物组合物,所述药物组合物包含:(a)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体,(b)第二结构域,所述第二结构域包含ox40l的细胞外结构域的一部分,其中所述部分能够结合ox40l受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;以及(b)抗免疫检查点抗体;(ii)从所述受试者获得生物样品;(iii)对所述生物样品进行测定以测定单核细胞的水平和/或活性;以及(iv)如果所述受试者的cd4
t细胞、cd8
t细胞和/或nkp46
nk细胞的水平和/或活性增加,则继续施用所述异源嵌合蛋白。
21.本发明的另一方面提供了用于评估癌症治疗在有需要的受试者中的功效的方法,其中所述受试者患有癌症,所述方法包括以下步骤:(i)向所述受试者提供药物组合物,所述药物组合物包含(a)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体,(b)第二结构域,所述第二结构域包含ox40l的细胞外结构域的一部分,其中所述部分能够结合ox40l受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;以及(b)抗免疫检查点抗体;(ii)从所述受试者获得生物样品;(iii)对所述生物样品进行测定以测定单核细胞的水平和/或活性;以及(iv)如果所述受试者的cd4
t细胞、cd8
t细胞和/或nkp46
nk细胞的水平和/或活性增加,则继续施用所述异源嵌合蛋白。
22.本文公开的任何方面或实施方案可与本文公开的任何其他方面或实施方案组合。
附图说明
23.图1a至图1d示出i型跨膜蛋白(图1a和图1b,左侧蛋白)和ii型跨膜蛋白(图1a和图1b,右侧蛋白)的示意图。可对i型跨膜蛋白和ii型跨膜蛋白进行工程化,以使得它们的跨膜结构域和细胞内结构域被省略,并且所述跨膜蛋白的细胞外结构域使用接头序列邻接在一起,以生成单一嵌合蛋白。如图1c和图1d所示,将i型跨膜蛋白(例如pd
‑
1、sirpα(cd172a)、tigit和tim
‑
3)的细胞外结构域与ii型跨膜蛋白(例如4
‑
1bbl、cd40l、gitrl和ox40l)的细胞外结构域组合成单一嵌合蛋白。图1c描绘通过省略每种蛋白的跨膜结构域和细胞内结构域i型跨膜蛋白和ii型跨膜蛋白的连接,以及其中来自每种蛋白的释放的细胞外结构域已通过接头序列邻接。此描绘中的细胞外结构域可包括i型蛋白(例如pd
‑
1、sirpα(cd172a)、tigit和tim
‑
3)和/或ii型蛋白(例如4
‑
1bbl、cd40l、gitrl和ox40l)的完整氨基酸序列(其通常位于细胞膜外部),或其保留与预期受体或配体结合的任何部分。此外,用于本发明的方法中的嵌合蛋白在结构域之间包含足够的总体柔性和/或物理距离,以使得第一细胞外结构域(在图1c和图1d中的嵌合蛋白的左端示出)在空间上能够结合其受体/配体和/或第二细胞外结构域(在图1c和图1d中的嵌合蛋白的右端示出)在空间上能够结合其受体/配体。图1d描绘线性嵌合蛋白中的邻接细胞外结构域,其中嵌合蛋白的每个细胞外结构域都面向“向外”。
24.图2示出与本发明相关的免疫抑制性和免疫刺激信号传导(来自mahoney,nature reviews drug discovery 2015:14;561
‑
585)。
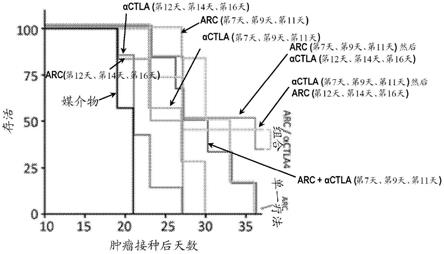
25.图3a示出由根据本发明的癌症治疗方法产生的体内肿瘤体积尺寸减小。图3b示出
对于图3a中所示的不同组合,在肿瘤接种后的存活天数百分比的卡普兰
‑
迈耶曲线。在这些图中,术语“arc”是指tigit
‑
fc
‑
ox40l嵌合蛋白。图3c包括与图3a和图3b的图有关的数据。
26.图4a示出由根据本发明的癌症治疗方法产生的体内肿瘤体积尺寸减小。图4b示出对于图4a中所示的不同抗体组合,在肿瘤接种后的存活天数百分比的卡普兰
‑
迈耶曲线。在这些图中,术语“arc”是指tigit
‑
fc
‑
ox40l嵌合蛋白。图4c包括与图4a和图4b的图有关的数据。
27.图5a示出用ct26肿瘤攻击并如图例所指示治疗的小鼠中的肿瘤生长动力学(在第10天,曲线的顺序从上至下是媒介物、抗pd1、tigit
‑
fc
‑
light、tigit
‑
fc
‑
light 抗pd1)。图5b是图5a的ct26肿瘤实验的存活和统计数据的卡普兰迈耶曲线。图5c和图5d包括与图5a和图5b的图有关的数据。
28.图6a至图6g示出用arc(tigit
‑
fc
‑
ox40l活tigit
‑
fc
‑
light)单独或与抗pd
‑
1(克隆rmp1
‑
14)抗体的组合治疗的具有ct26(结肠直肠癌)肿瘤同种异体移植物的balb/c小鼠中的肿瘤浸润淋巴细胞(til)的免疫表型分型。如通过流式细胞术分析所确定,分离的肿瘤组织中所指示细胞群体中的总cd8
细胞(图6a)、总穿孔素
cd8
细胞(图6b)、总ifnγ
cd8
细胞(图6c)、总ah1
‑
四聚体
cd8
细胞(抗原特异性cd8
细胞)(图6d)、总cd4
细胞(图6e)、总nkp46
nk细胞(图6f)和总ifnγ
(nkp46
nk)细胞(图6g)的级分(以百分比表示)。
具体实施方式
29.本发明部分地基于用于治疗癌症的方法的发现,所述方法包括(同时或顺序地)施用至少一种针对免疫检查点分子的抗体;干扰素基因刺激因子(sting)激动剂;和/或一种或多种嵌合蛋白,其中每种嵌合蛋白能够阻断免疫抑制性信号和/或刺激免疫激活信号。
30.重要的是,因为针对本发明的方法中使用的免疫检查点分子的抗体;sting激动剂;和/或嵌合蛋白破坏、阻断、减少、抑制和/或隔离例如源自试图避免其检测和/或破坏和/或增强、增加和/或刺激免疫刺激信号至抗癌免疫细胞的传递的癌细胞的免疫抑制性信号的传递,所以所述方法可通过多种不同的途径提供抗肿瘤作用。通过经由多种不同的途径治疗癌症,本发明的方法更可能在患者中提供任何抗肿瘤作用和/或在患者中提供增强的抗肿瘤作用。此外,因为所述方法通过多种不同的途径起作用,因此至少在对靶向所述途径中的一者的治疗没有响应、响应差或产生抗性的患者中,它们可以是有效的。因此,对经由两种途径之一起作用的治疗的响应差的患者可通过靶向多种途径来获得治疗益处。
31.抗体
32.本发明的方法包括用于治疗癌症的方法,在实施方案中,所述方法包括施用包含能够结合免疫检查点分子的抗体的免疫疗法。
33.所述抗体可选自以下中的一者或多者:单克隆抗体、多克隆抗体、抗体片段、fab、fab
′
、fab
′‑
sh、f(ab
′
)2、fv、单链fv、双抗体、线性抗体、双特异性抗体、多特异性抗体、嵌合抗体、人源化抗体、人抗体和包含抗体的抗原结合部分的融合蛋白。在实施方案中,抗体是单克隆抗体,例如人源化单克隆抗体。因此,如本文所用,术语“抗体”包括单克隆抗体(例如,人源化单克隆抗体)、多克隆抗体、抗体片段、fab、fab'、fab'
‑
sh、f(ab')2、fv、单链fv、双抗体、线性抗体、双特异性抗体、多特异性抗体、嵌合抗体、人源化抗体、人抗体或包含抗体的抗原结合部分的融合蛋白。
34.在实施方案中,所述抗体能够结合ctla
‑
4。能够结合ctla
‑
4的说明性抗体包括yervoy(伊匹单抗)、9d9、曲美木单抗(以前为替奇木单抗,cp
‑
675,206;medimmune)、agen1884和rg2077。
35.在实施方案中,所述抗体能够结合pd
‑
1或pd
‑
1配体。能够结合pd
‑
1或pd
‑
1配体的说明性抗体包括纳武单抗(ono 4538,bms 936558,mdx1106,opdivo(bristol myers squibb))、派姆单抗(keytruda/mk 3475,merck)和西米普利单抗((regn
‑
2810)。这种抗体能够抑制pd
‑
1与其一种或多种配体的相互作用。
36.sting激动剂
37.本发明的方法包括用于治疗癌症的方法,在实施方案中,所述方法包括施用包含干扰素基因刺激因子(sting)激动剂的药物组合物。已知sting途径开启吸引免疫细胞的干扰素应答。不希望受理论束缚,通过sting激动剂开启sting途径将导致免疫细胞的免疫激活和刺激以攻击癌症。
38.在实施方案中,所述sting激动剂选自由以下组成的组:5,6
‑
二甲基呫吨酮
‑4‑
乙酸(dmxaa)、miw815(adu
‑
s100)、crd5500、mk
‑
1454、sb11285、imsa101以及在us20140341976、us20180028553、us20180230178、us9549944、wo2015185565、wo2016120305、wo2017044622、wo2017027645、wo2017027646、wo2017093933、wo2017106740、wo2017123657、wo2017123669、wo2017161349、wo2017175147、wo2017175156、wo2017176812、wo2018009466、wo2018045204、wo2018060323、wo2018098203、wo2018100558、wo2018138684、wo2018138685、wo2018152450、wo2018152453、wo2018172206、wo2018198084、wo2018234805、wo2018234807、wo2018234808、wo2019023459、wo2019046496、wo2019046498、wo2019046500、wo2019074887、wo2019079261、wo2019118839、wo2019125974或wo2019160884中描述的任何sting激动剂,所述专利的内容以引用的方式整体并入本文。
39.嵌合蛋白
40.本发明的方法包括用于治疗癌症的方法,在实施方案中,所述方法包括施用包含能够阻断免疫抑制性信号和/或刺激免疫激活信号的嵌合蛋白的药物组合物。
41.在本发明的方法中使用的嵌合蛋白包含以下通用结构:n末端
‑
(a)
‑
(b)
‑
(c)
‑
c末端,其中(a)是包含i型跨膜蛋白的细胞外结构域的第一结构域,(b)是邻接所述第一结构域和第二结构域的接头,例如,包含至少一个能够形成二硫键的半胱氨酸残基和/或包含铰链
‑
ch2
‑
ch3 fc结构域的接头,并且(c)是包含ii型跨膜蛋白的细胞外结构域的第二结构域;其中所述接头连接所述第一结构域和所述第二结构域。或者,在本发明的方法中使用的嵌合蛋白包含以下通用结构:n末端
‑
(a)
‑
(b)
‑
(c)
‑
c末端,其中(a)是包含i型跨膜蛋白的细胞外结构域的第一结构域,(b)是邻接所述第一结构域和第二结构域的接头,例如,包含至少一个能够形成二硫键的半胱氨酸残基和/或包含铰链
‑
ch2
‑
ch3 fc结构域的接头,并且(c)是包含另一种i型跨膜蛋白的细胞外结构域的第二结构域;其中所述接头连接所述第一结构域和所述第二结构域。
42.跨膜蛋白通常由细胞外结构域、一个或一系列跨膜结构域以及细胞内结构域组成。不希望受理论束缚,跨膜蛋白的细胞外结构域负责与细胞外环境中的可溶性受体或配体或膜结合的受体或配体(即,相邻细胞的膜)相互作用。不希望受理论束缚,跨膜结构域负
责将跨膜蛋白定位于质膜。不希望受理论束缚,跨膜蛋白的细胞内结构域负责协调与细胞信号传导分子的相互作用,以协调细胞内响应与细胞外环境(反之亦然)。
43.在实施方案中,细胞外结构域是指跨膜蛋白的一部分,所述部分足以结合至配体或受体并且有效地将信号传递至细胞。在实施方案中,细胞外结构域是通常存在于细胞或细胞膜的外部的跨膜蛋白的整个氨基酸序列。在实施方案中,细胞外结构域是跨膜蛋白的氨基酸序列的一部分,所述部分在细胞或细胞膜的外部并且是信号转导和/或配体结合所需的,如可使用本领域已知的方法所测定(例如,体外配体结合和/或细胞激活测定)。
44.通常存在两种类型的单程跨膜蛋白:具有细细胞外氨基末端和细胞内羧基末端的i型跨膜蛋白(参见图1a,左侧蛋白)和具有细胞外羧基末端和细胞内氨基末端的ii型跨膜蛋白(参见图1a,右侧蛋白)。i型和ii型跨膜蛋白可以是受体或配体。对于i型跨膜蛋白(例如,pd
‑
1、sirpα(cd172a)、tigit和tim
‑
3),所述蛋白的氨基末端面向细胞外部,并且因此含有负责在细胞外环境中与其他结合配偶体(配体或受体)相互作用的功能结构域(参见,图1b,左侧蛋白)。对于ii型跨膜蛋白(例如,4
‑
1bbl、cd40l、gitrl和ox40l),所述蛋白的羧基末端面向细胞外部,并且因此含有负责与细胞外环境中的其他结合配偶体(配体或受体)相互作用的功能结构域(参见图1b,右侧蛋白)。因此,这两种类型的跨膜蛋白相对于细胞膜具有彼此相反的取向。
45.在本发明的方法中使用的嵌合蛋白包含选自pd
‑
1、sirpα(cd172a)、tigit和tim
‑
3的i型跨膜蛋白的细胞外结构域和选自4
‑
1bbl、cd40l、gitrl和ox40l的ii型跨膜蛋白的细胞外结构域。因此,在本发明的方法中使用的嵌合蛋白至少包含含有pd
‑
1、sirpα(cd172a)、tigit或tim
‑
3的细胞外结构域的第一结构域,所述第一结构域直接或通过接头连接至包含4
‑
1bbl、cd40l、gitrl或ox40l的细胞外结构域的第二结构域。如图1c和图1d所示,当结构域以氨基末端至羧基末端取向连接时,第一结构域位于嵌合蛋白的“左”侧并且“面向外”,并且第二结构域位于嵌合蛋白的“右”侧并且“面向外”。
46.设想第一结构域和第二结构域的其他构型,例如,第一结构域面向内并且第二结构域面向外,第一结构域面向外并且第二结构域面向内,并且第一结构域和第二结构域都面向内。当两个结构域均“面向内”时,嵌合蛋白将具有氨基末端至羧基末端构型,其包含ii型跨膜蛋白的细胞外结构域、接头和i型跨膜蛋白的细胞外结构域。在此类构型中,如本文其他地方所述,嵌合蛋白可能必须包含额外的“松弛”,以允许嵌合蛋白的结构域结合至其受体/配体之一或两者。
47.在实施方案中,i型跨膜蛋白的细胞外结构域是来自tigit。
48.tigit是脊髓灰质炎病毒受体(pvr)样蛋白,在t细胞上表达的含有基于免疫球蛋白和免疫受体酪氨酸的抑制基序(itim)结构域的免疫受体。因此,tigit充当t细胞和自然杀伤(nk)细胞两者上的抑制性免疫检查点,从而提供了靶向免疫系统的适应性和先天性臂的机会。
49.tigit在nk细胞以及激活、记忆和调控性t细胞亚群上表达,特别是在次级淋巴器官内的滤泡辅助t细胞上表达。cd155/pvr通过ifn
‑
γ在内皮细胞上上调,并且在不成熟的胸腺细胞、淋巴结树突细胞以及上皮和神经元来源的肿瘤细胞上高度表达。在实施方案中,本发明的嵌合蛋白(例如,包含tigit细胞外结构域)调节紧接上文描述的任何细胞(例如,在免疫突触的情况下)。
50.tigit结合cd155/pvr、连接蛋白
‑
2、连接蛋白
‑
3和连接蛋白
‑
4。在实施方案中,本发明的嵌合蛋白(例如,包含tigit细胞外结构域)调节tigit与cd155/pvr的结合(例如,减少或破坏结合或信号传递)。在实施方案中,本发明的嵌合蛋白(例如,包含tigit细胞外结构域)调节tigit与连接蛋白
‑
2的结合(例如,减少或破坏结合或信号传递)。在实施方案中,本发明的嵌合蛋白(例如,包含tigit细胞外结构域)调节tigit与连接蛋白
‑
3的结合(例如,减少或破坏结合或信号传递)。在实施方案中,本发明的嵌合蛋白(例如,包含tigit细胞外结构域)调节tigit与连接蛋白
‑
4的结合(例如,减少或破坏结合或信号传递)。
51.在方面中,异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体;(b)第二结构域,所述第二结构域包含ox40l的细胞外结构域的一部分,其中所述部分能够结合ox40l受体;和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
52.在实施方案中,异源嵌合蛋白包含第一结构域,所述第一结构域基本上包含tigit的细胞外结构域的全部;和/或第二结构域,所述第二结构域基本上包含ox40l的细胞外结构域的全部。在实施方案中,所述第一结构域基本上包含tigit的细胞外结构域的全部。在实施方案中,所述第二结构域基本上包含ox40l的细胞外结构域的全部。
53.在实施方案中,在本发明的方法中使用的嵌合蛋白包含人tigit的细胞外结构域的一部分,其包含以下氨基酸序列:
54.mmtgtiettgnisaekggsiilqchlssttaqvtqvnweqqdqllaicnadlgwhispsfkdrvapgpglgltlqsltvndtgeyfciyhtypdgtytgriflevlessvaehgarfqip(seq id no:57)
55.在实施方案中,在本发明的方法中使用的嵌合蛋白包含tigit的细胞外结构域的变体。作为实例,所述变体可与seq id no:57具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性。
56.普通技术人员可通过参考文献来选择tigit的已知氨基酸序列的变体,所述文献例如stanietsky等人,“the interaction of tigit with pvr and pvrl2 inhibits human nk cell cytotoxicity.”pnas u.s.a.106(42),17858
‑
17863(2009);boles等人,“a novel molecular interaction for the adhesion of follicular cd4 t cells to follicular dc.”eur.j.immunol.39(3),695
‑
703(2009);yu等人,“the surface protein tigit suppresses t cell activation by promoting the generation of mature immunoregulatory dendritic cells.”nat.immunol.10(1),48
‑
57(2009);以及levin等人,“vstm3 is a member of the cd28 family and an important modulator of t
‑
cell function.”eur.j.immunol.41(4),902
‑
915(2011);所述文献各自以引用的方式整体并入。
57.在实施方案中,ii型跨膜蛋白的细胞外结构域是来自ox40l。
58.在实施方案中,在本发明的方法中使用的嵌合蛋白包含人ox40l的细胞外结构域,
alpha are ligands for herpesvirus entry mediator.”immunity 8(1),21
‑
30(1998);tamada等人,“light,a tnf
‑
like molecule,costimulates t cell proliferation and is required for dendritic cell
‑
mediated allogeneic t cell response.”j.immunol.164(8),4105
‑
4110(2000);liu等人,“mechanistic basis for functional promiscuity in the tnf and tnf receptor superfamilies:structure of the light:dcr3 assembly”structure 22 1252
‑
62(2014);faustman等人,“structural principles of tumor necrosis factor superfamily signaling.”sci signal 11(2018);sudhamsu等人,“dimerization of ltβr by ltα1β2is necessary and sufficient for signal transduction”proc.natl.acad.sci.u.s.a.110 19896
‑
19901(2013);savvides等人,“mechanisms of immunomodulation by mammalian and viral decoy receptors:insights from structures.felix j,sn.nat rev immunol 17 112
‑
129(2017)”;ward
‑
kavanagh等人,“the tnf receptor superfamily in co
‑
stimulating and co
‑
inhibitory responses.”immunity 44 1005
‑
1019(2016);以及wajant“principles of antibody
‑
mediated tnf receptor activation.”cell death differ 22 1727
‑
1741(2015),所述文献各自以引用的方式整体并入
67.在实施方案中,本发明的嵌合蛋白和/或本发明的方法中使用的嵌合蛋白包含来自人igg4抗体序列(seq id no:1、seq id no:2或seq id no:3)的铰链
‑
ch2
‑
ch3结构域。
68.在实施方案中,本发明的嵌合蛋白和/或本发明的方法中使用的嵌合蛋白包含tigit的细胞外结构域和ox40l的细胞外结构域,使用来自人igg4抗体序列的铰链
‑
ch2
‑
ch3结构域作为接头。在实施方案中,所谓的tigit
‑
fc
‑
ox40l嵌合蛋白包含以下氨基酸序列:
69.mmtgtiettgnisaekggsiilqchlssttaqvtqvnweqqdqllaicnadlgwhispsfkdrvapgpglgltlqsltvndtgeyfciyhtypdgtytgriflevlessvaehgarfqipskygppcppcpapeflggpsvflfppkpkdqlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlsgkeykckvsskglpssiektisnatgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvlhealhnhytqkslslslgkiegrmdqvshrypriqsikvqfteykkekgfiltsqkedeimkvqnnsviincdgfylislkgyfsqevnislhyqkdeeplfqlkkvrsvnslmvasltykdkvylnvttdntslddfhvnggelilihqnpgefcvl(seq id no:60)
70.在实施方案中,本发明嵌合蛋白可以是本文所述的变体,例如,本发明嵌合蛋白可具有与本发明嵌合蛋白的氨基酸序列例如seq id no:60中的一个或多个的氨基酸序列具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性的序列。
71.在实施方案中,本发明的嵌合蛋白和/或本发明的方法中使用的嵌合蛋白包含tigit的细胞外结构域和light的细胞外结构域,使用来自人igg4抗体序列的铰链
‑
ch2
‑
ch3
结构域作为接头。在实施方案中,所谓的tigit
‑
fc
‑
light嵌合蛋白包含以下氨基酸序列:
72.mewswvflfflsvttgvhsmmtgtiettgnisaekggsiilqchlssttaqvtqvnweqqdqllaicnadlgwhispsfkdrvapgpglgltlqsltvndtgeyfciyhtypdgtytgriflevlessvaehgarfqipskygppcppcpapeflggpsvflfppkpkdqlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlsgkeykckvsskglpssiektisnatgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvlhealhnhytqkslslslgkiegrmdlqlhwrlgemvtrlpdgpagsweqliqerrshevnpaahltganssltgsggpllwetqlglaflrglsyhdgalvvtkagyyyiyskvqlggvgcplglastithglykrtprypeelellvsqqspcgratsssrvwwdssflggvvhleagekvvvrvlderlvrlrdgtrsyfgafmv(seq id no:61)。
73.在实施方案中,本发明嵌合蛋白可以是本文所述的变体,例如,本发明嵌合蛋白可具有与本发明嵌合蛋白的氨基酸序列例如seq id no:61中的一个或多个的氨基酸序列具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性的序列。
74.在本文公开的任何方面和实施方案中,嵌合蛋白可包含相对于本文公开的任何蛋白质序列具有一种或多种氨基酸突变的氨基酸序列。在实施方案中,所述一种或多种氨基酸突变可独立地选自取代、插入、缺失和截短。
75.在实施方案中,氨基酸突变是氨基酸取代,并且可包括保守性取代和/或非保守性取代。可例如基于所涉及的氨基酸残基的极性、电荷、大小、溶解度、疏水性、亲水性和/或两亲性质的相似性来进行“保守性取代”。20种天然氨基酸可分为以下六个标准氨基酸组:(1)疏水性:met、ala、val、leu、ile;(2)中性亲水性:cys、ser、thr;asn、gln;(3)酸性:asp,glu;(4)碱性:his、lys、arg;(5)影响链取向的残基:gly、pro;以及(6)芳香族:trp、tyr、phe。如本文所用,“保守性取代”定义为氨基酸被上面所示六个标准氨基酸组中的同一组中列出的另一种氨基酸交换。例如,asp被glu交换在这样修饰的多肽中保留一个负电荷。另外,基于甘氨酸和脯氨酸破坏α
‑
螺旋的能力,它们可彼此取代。如本文所用,“非保守性取代”定义为氨基酸被上面所示六个标准氨基酸组(1)至(6)中的不同组中列出的另一种氨基酸交换。
76.在实施方案中,取代还可包括非经典氨基酸(例如,硒代半胱氨酸、吡咯赖氨酸、n
‑
甲酰基甲硫氨酸β
‑
丙氨酸、gaba和δ
‑
氨基乙酰丙酸、4
‑
氨基苯甲酸(paba)、常见氨基酸的d
‑
异构体、2,4
‑
二氨基丁酸、α
‑
氨基异丁酸、4
‑
氨基丁酸、abu、2
‑
氨基丁酸、γ
‑
abu、ε
‑
ahx、6
‑
氨基己酸、aib、2
‑
氨基异丁酸、3
‑
氨基丙酸、鸟氨酸、正亮氨酸、正缬氨酸、羟脯氨酸、肌氨酸、瓜氨酸、高瓜氨酸、磺丙氨酸、叔丁基甘氨酸、叔丁基丙氨酸、苯基甘氨酸,环己基丙氨酸、β
‑
丙氨酸、氟代
‑
氨基酸、设计者氨基酸如β
‑
甲基氨基酸、cα
‑
甲基氨基酸、nα
‑
甲基氨基酸以及一般的氨基酸类似物)。
77.还可参考遗传密码,包括将密码子简并性考虑在内来对嵌合蛋白的核苷酸序列进
行突变。
78.在实施方案中,嵌合蛋白能够结合一种或多种鼠配体/受体。
79.在实施方案中,嵌合蛋白能够结合一种或多种人配体/受体。
80.在实施方案中,嵌合蛋白的每个细胞外结构域(或其变体)以约1nm至约5nm,例如约1nm、约1.5nm、约2nm、约2.5nm、约3nm、约3.5nm、约4nm、约4.5nm或约5nm的k
d
结合至其同源受体或配体。在实施方案中,嵌合蛋白以约5nm至约15nm,例如5nm、约5.5nm、约6nm、约6.5nm、约7nm、约7.5nm、约8nm、约8.5nm、约9nm、约9.5nm、约10nm、约10.5nm、约11nm、约11.5nm、约12nm、约12.5nm、约13nm、约13.5nm、约14nm、约14.5nm或约15nm的k
d
结合至同源受体或配体。
81.在实施方案中,嵌合蛋白的每个细胞外结构域(或其变体)以小于约1μm、约900nm、约800nm、约700nm、约600nm、约500nm、约400nm、约300nm、约200nm、约150nm、约130nm、约100nm、约90nm、约80nm、约70nm、约60nm、约55nm、约50nm、约45nm、约40nm、约35nm、约30nm、约25nm、约20nm、约15nm、约10nm、或约5nm、或约1nm的k
d
(例如,如通过表面等离子体共振或生物层干涉法所测量)结合至其同源受体或配体。在实施方案中,嵌合蛋白以小于约1nm、约900pm、约800pm、约700pm、约600pm、约500pm、约400pm、约300pm、约200pm、约100pm、约90pm、约80pm、约70pm、约60pm、约55pm、约50pm、约45pm、约40pm、约35pm、约30pm、约25pm、约20pm、约15pm、或约10pm、或约1pm的k
d
(例如,如通过表面等离子体共振或生物层干涉法所测量)结合至人csf1。
82.如本文所用,细胞外结构域的变体能够结合天然细胞外结构域的受体/配体。例如,变体可在细胞外结构域中包含一种或多种不影响其与其受体/配体的结合亲和力的突变;或者,细胞外结构域中的一种或多种突变可改善对受体/配体的结合亲和力;或者细胞外结构域中的一种或多种突变可降低对受体/配体的结合亲和力,但不完全消除结合。在实施方案中,一种或多种突变位于结合口袋外部,其中细胞外结构域与其受体/配体相互作用。在实施方案中,一种或多种突变位于结合口袋内部,其中细胞外结构域与其受体/配体相互作用,只要所述突变不完全消除结合即可。基于熟练技术人员的知识以及本领域中关于受体
‑
配体结合的知识,他/她将知道哪些突变将允许结合以及哪些突变将消除结合。
83.在实施方案中,相对于单结构域融合蛋白或抗体对照,嵌合蛋白表现出增强的稳定性、高亲合力结合特性、延长的靶标结合的解离速率和蛋白质半衰期。
84.在本发明的方法中使用的嵌合蛋白可包含多于两个细胞外结构域。例如,嵌合蛋白可包含三个、四个、五个、六个、七个、八个、九个、十个或更多个细胞外结构域。如本文所公开的,第二细胞外结构域可经由接头与第三细胞外结构域分开。或者,第二细胞外结构域可直接连接(例如,经由肽键)至第三细胞外结构域。在实施方案中,嵌合蛋白包含直接连接的细胞外结构域和经由接头间接连接的细胞外结构域,如本文所公开。
85.本发明的嵌合蛋白和/或在本发明的方法中使用的嵌合蛋白具有在空间上能够结合其配体/受体的第一结构域和/或在空间上能够结合其配体/受体的第二结构域。这意味着嵌合蛋白中存在足够的总体柔性和/或细胞外结构域(或其一部分)与嵌合蛋白的剩余部分之间存在物理距离,以使得细胞外结构域的配体/受体结合结构域在空间上不受阻碍地结合其配体/受体。这种柔性和/或物理距离(在本文中称为“松弛”)通常可存在于一个或多个细胞外结构域中,通常存在于接头中,和/或通常存在于嵌合蛋白中(作为整体)。或者或
另外地,可通过包含一个或多个另外的氨基酸序列(例如,下文描述的接合接头)或合成接头(例如,聚乙二醇(peg)接头)来修饰嵌合蛋白,其提供了避免空间位阻所需的额外松弛。
86.可在本发明中使用但不限于描述于wo2018/157162;wo2018/157165;wo2018/157164;wo2018/157163;和wo2017/059168中的一者或多者中的嵌合蛋白。其各自的内容以引用的方式整体并入本文。
87.接头
88.在实施方案中,在本发明的方法中使用的嵌合蛋白包含接头。
89.在实施方案中,所述接头包含至少一个能够形成二硫键的半胱氨酸残基。所述至少一个半胱氨酸残基能够在一对(或更多)嵌合蛋白之间形成二硫键。不希望受理论束缚,这种二硫键的形成负责维持嵌合蛋白的有用的多聚体状态。这允许嵌合蛋白的有效产生;它允许体外和体内的所需活性。
90.尤其重要的是,在包含一个或多个二硫键的接头区域中的稳定化提供了可维持稳定且可生产的多聚体状态的改进的嵌合蛋白。
91.在本发明的方法中使用的嵌合蛋白中,接头是选自柔性氨基酸序列、igg铰链区或抗体序列的多肽。
92.在实施方案中,接头源自天然存在的多结构域蛋白,或者是例如,如chichili等人,(2013),protein sci.22(2):153
‑
167;chen等人,(2013),adv drug deliv rev.65(10):1357
‑
1369中所描述的经验接头,所述文献的全部内容特此以引用的方式并入。在实施方案中,接头可使用诸如以下文献中描述的那些的接头设计数据库和计算机程序来设计:chen等人,(2013),adv drug deliv rev.65(10):1357
‑
1369和crasto等人,(2000),protein eng.13(5):309
‑
312,所述文献的全部内容特此以引用的方式并入。
93.在实施方案中,接头包含多肽。在实施方案中,所述多肽小于约500个氨基酸长、约450个氨基酸长、约400个氨基酸长、约350个氨基酸长、约300个氨基酸长、约250个氨基酸长、约200个氨基酸长、约150个氨基酸长或约100个氨基酸长。例如,接头的长度可小于约100、约95、约90、约85、约80、约75、约70、约65、约60、约55、约50、约45、约40、约35、约30、约25、约20、约19、约18、约17、约16、约15、约14、约13、约12、约11、约10、约9、约8、约7、约6、约5、约4、约3或约2个氨基酸。
94.在实施方案中,接头是柔性的。
95.在实施方案中,接头是刚性的。
96.在实施方案中,接头基本上包含甘氨酸和丝氨酸残基(例如,约30%、或约40%、或约50%、或约60%、或约70%、或约80%、或约90%、或约95%、或约97%、或约98%、或约99%、或约100%的甘氨酸和丝氨酸)。
97.在实施方案中,接头包含抗体(例如,igg、iga、igd和ige,包括亚类(例如,igg1、igg2、igg3和igg4、以及iga1和iga2))的铰链区。在igg、iga、igd和ige类抗体中所见的铰链区充当柔性间隔区,由此允许fab部分在空间中自由移动。与恒定区相反,铰链结构域在结构上是多样的,在免疫球蛋白类和亚类中在序列和长度上都有所不同。例如,igg亚类中的铰链区的长度和柔性有所不同。igg1的铰链区包含氨基酸216
‑
231,并且,由于它是自由灵活的,因此fab片段可以围绕其对称轴旋转并在以两个重链间二硫桥中的第一个为中心的球体内移动。igg2具有比igg1短的铰链,带有12个氨基酸残基和四个二硫桥。缺乏甘氨酸残
health,bethesda,md.(1991),明确地以引用的方式并入本文)处含有一个或多个氨基酸取代,或其等效物。在实施方案中,在氨基酸残基250处的氨基酸取代是被谷氨酰胺取代。在实施方案中,在氨基酸残基252处的氨基酸取代是被酪氨酸、苯丙氨酸、色氨酸或苏氨酸取代。在实施方案中,在氨基酸残基254处的氨基酸取代是被苏氨酸取代。在实施方案中,在氨基酸残基256处的氨基酸取代是被丝氨酸、精氨酸、谷氨酰胺、谷氨酸、天冬氨酸或苏氨酸取代。在实施方案中,在氨基酸残基308处的氨基酸取代是被苏氨酸取代。在实施方案中,在氨基酸残基309处的氨基酸取代是被脯氨酸取代。在实施方案中,在氨基酸残基311处的氨基酸取代是被丝氨酸取代。在实施方案中,在氨基酸残基385处的氨基酸取代是被精氨酸、天冬氨酸、丝氨酸、苏氨酸、组氨酸、赖氨酸、丙氨酸或甘氨酸取代。在实施方案中,在氨基酸残基386处的氨基酸取代是被苏氨酸、脯氨酸、天冬氨酸、丝氨酸、赖氨酸、精氨酸、异亮氨酸或甲硫氨酸取代。在实施方案中,在氨基酸残基387处的氨基酸取代是被精氨酸、脯氨酸、组氨酸、丝氨酸、苏氨酸或丙氨酸取代。在实施方案中,在氨基酸残基389处的氨基酸取代是被脯氨酸、丝氨酸或天冬酰胺取代。在实施方案中,在氨基酸残基416处的氨基酸取代是被丝氨酸取代。在实施方案中,在氨基酸残基428处的氨基酸取代是被亮氨酸取代。在实施方案中,在氨基酸残基433处的氨基酸取代是被精氨酸、丝氨酸、异亮氨酸、脯氨酸或谷氨酰胺取代。在实施方案中,在氨基酸残基434处的氨基酸取代是被组氨酸、苯丙氨酸或酪氨酸取代。
103.在实施方案中,fc结构域接头(例如,包含igg恒定区)包含一种或多种突变,如在氨基酸残基252、254、256、433、434或436(根据kabat编号,如kabat,等人,sequences of proteins of immunological interest,第5版public health service,national institutes of health,bethesda,md.(1991),明确地以引用的方式并入本文)处的取代。在实施方案中,igg恒定区包含三重m252y/s254t/t256e突变或yte突变。在实施方案中,igg恒定区包含三重h433k/n434f/y436h突变或kfh突变。在实施方案中,igg恒定区包含组合的yte和kfh突变。
104.在实施方案中,接头包含igg恒定区,所述igg恒定区在氨基酸残基250、253、307、310、380、428、433、434和435(根据kabat编号,如kabat,等人,sequences of proteins of immunological interest,第5版public health service,national institutes of health,bethesda,md.(1991),明确地以引用的方式并入本文)处含有一种或多种突变。示例性突变包括t250q、m428l、t307a、e380a、i253a、h310a、m428l、h433k、n434a、n434f、n434s和h435a。在实施方案中,igg恒定区包含m428l/n434s突变或ls突变。在实施方案中,igg恒定区包含t250q/m428l突变或ql突变。在实施方案中,igg恒定区包含n434a突变。在实施方案中,igg恒定区包含t307a/e380a/n434a突变或aaa突变。在实施方案中,igg恒定区包含i253a/h310a/h435a突变或ihh突变。在实施方案中,igg恒定区包含h433k/n434f突变。在实施方案中,igg恒定区包含组合的m252y/s254t/t256e和h433k/n434f突变。
105.igg恒定区中的另外示例性突变描述于例如robbie,等人,antimicrobial agents and chemotherapy(2013),57(12):6147
‑
6153;dall’acqua等人,jbc(2006),281(33):23514
‑
24;dall’acqua等人,journal of immunology(2002),169:5171
‑
80;ko等人nature(2014)514:642
‑
645;grevys等人journal of immunology.(2015),194(11):5497
‑
508;以及美国专利号7,083,784中,所述文献的全部内容特此以引用的方式并入。
106.说明性的fc稳定化突变体是s228p。说明性的延长fc半衰期的突变体是t250q、
m428l、v308t、l309p和q311s,并且本发明的接头可包含这些突变体中的1者、或2者、或3者、或4者、或5者。
107.在实施方案中,嵌合蛋白以高亲和力结合至fcrn。在实施方案中,嵌合蛋白可以约1nm至约80nm的k
d
结合至fcrn。例如,嵌合蛋白可以约1nm、约2nm、约3nm、约4nm、约5nm、约6nm、约7nm、约8nm、约9nm、约10nm、约15nm、约20nm、约25nm、约30nm、约35nm、约40nm、约45nm、约50nm、约55nm、约60nm、约65nm、约70nm、约71nm、约72nm、约73nm、约74nm、约75nm、约76nm、约77nm、约78nm、约79nm或约80nm的k
d
结合至fcrn。在实施方案中,嵌合蛋白可以约9nm的k
d
结合至fcrn。在实施方案中,嵌合蛋白基本上不结合至具有效应子功能的其他fc受体(即,不同于fcrn)。
108.在实施方案中,接头中的fc结构域具有seq id no:1的氨基酸序列(参见下文表1),或与其具有至少90%、或93%、或95%、或97%、或98%、或99%同一性。在实施方案中,对seq id no:1进行突变以增加稳定性和/或半衰期。例如,在实施方案中,接头中的fc结构域包含seq id no:2的氨基酸序列(参见下文表1),或与其具有至少90%、或93%、或95%、或97%、或98%、或99%同一性。例如,在实施方案中,接头中的fc结构域包含seq id no:3的氨基酸序列(参见下文表1),或与其具有至少90%、或93%、或95%、或97%、或98%、或99%同一性。
109.此外,可采用一个或多个接合接头来连接接头中的fc结构域(例如,seq id no:1、seq id no:2、seq id no:3之一或与其至少90%、或93%、或95%、或97%、或98%、或99%同一性)和细胞外结构域。例如,seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:9中的任一者或其变体可连接如本文所公开的细胞外结构域和如本文所公开的接头中的fc结构域。任选地,seq id no:4至seq id no:50中的任一者或其变体位于如本文公开的细胞外结构域和如本文公开的fc结构域之间。
110.在实施方案中,在本发明的方法中使用的嵌合蛋白可包含下文表1中公开的接合接头的变体。例如,接头可与seq id no:4至seq id no:50中的任一者的氨基酸序列具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性。
111.在实施方案中,第一和第二接合接头可不同或它们可相同。
112.不希望受理论束缚,在嵌合蛋白中包括包含fc结构域的至少一部分的接头有助于避免形成不溶性和可能的非功能性蛋白级联低聚物和/或聚集体。这部分是由于在fc结构域中存在半胱氨酸,所述半胱氨酸能够在嵌合蛋白之间形成二硫键。
113.在实施方案中,嵌合蛋白可包含如本文所公开的一个或多个接合接头,并且缺乏如本文所公开的fc结构域接头。
114.在实施方案中,第一和/或第二接合接头独立地选自seq id no:4至seq id no:50的氨基酸序列,并且提供在下文表1中:
115.表1:说明性接头(fc结构域接头和接合接头)
116.117.[0118][0119]
在实施方案中,接合接头基本上包含甘氨酸和丝氨酸残基(例如,约30%、或约40%、或约50%、或约60%、或约70%、或约80%、或约90%、或约95%、或约97%、或约98%、或约99%、或约100%的甘氨酸和丝氨酸)。例如,在实施方案中,接合接头是(gly4ser)
n
,其中n是约1至约8,例如1、2、3、4、5、6、7或8(分别seq id no:25至seq id no:32)。在实施方案中,接合接头序列是ggsggsggggsggggs(seq id no:33)。另外的说明性接合接头包括但不限于具有序列le,(eaaak)
n
(n=1
‑
3)(seq id no:36至seq id no:38)、a(eaaak)
n
a(n=2
‑
5)(seq id no:39至seq id no:42)、a(eaaak)4alea(eaaak)4a(seq id no:43)、papap(seq id no:44)、kesgsvsseqlaqfrsld(seq id no:45)、gsagsaagsgef(seq id no:46)和(xp)
n
的接头,其中x表示任何氨基酸,例如ala、lys或glu。在实施方案中,接合接头是ggs。在实施方案中,接合接头具有序列(gly)
n
,其中n是1至100的任何数字,例如:(gly)8(seq id no:34)和(gly)6(seq id no:35)。
[0120]
在实施方案中,接合接头是gggse(seq id no:47)、gsesg(seq id no:48)、gsegs(seq id no:49)、geggsgegssgegsssegggsegggsegggseggs(seq id no:50)和每4个氨基酸间隔随机放置g、s和e的接合接头中的一者或多者。
[0121]
在实施方案中,在本发明的方法中使用的嵌合蛋白包含第一跨膜蛋白的细胞外结构域(ecd)、在fc结构域之前的一个接合接头、在所述fc结构域之后的第二接合接头以及第二跨膜蛋白的ecd,所述嵌合蛋白可包含以下结构:
[0122]
ecd
–
接合接头1
–
fc结构域
–
接合接头2
–
ecd。
[0123]
第一接合接头、fc结构域接头和第二接合接头的组合在本文中称为“模块化接头”。在实施方案中,在本发明的方法中使用的嵌合蛋白包含如表2中所示的模块化接头:
[0124]
表2:说明性模块化接头
[0125]
[0126]
[0127]
[0128][0129]
在实施方案中,在本发明的方法中使用的嵌合蛋白可包含以上表2中公开的模块化接头的变体。例如,接头可与seq id no:51至seq id no:56中的任一者的氨基酸序列具有至少约60%、或至少约61%、或至少约62%、或至少约63%、或至少约64%、或至少约65%、或至少约66%、或至少约67%、或至少约68%、或至少约69%、或至少约70%、或至少约71%、或至少约72%、或至少约73%、或至少约74%、或至少约75%、或至少约76%、或至少约77%、或至少约78%、或至少约79%、或至少约80%、或至少约81%、或至少约82%、或至少约83%、或至少约84%、或至少约85%、或至少约86%、或至少约87%、或至少约88%、或至少约89%、或至少约90%、或至少约91%、或至少约92%、或至少约93%、或至少约94%、或至少约95%、或至少约96%、或至少约97%、或至少约98%、或至少约99%序列同一性。
[0130]
在实施方案中,接头可以是柔性的,包括但不限于高度柔性的。在实施方案中,接头可以是刚性的,包括但不限于刚性α螺旋。说明性接合接头的特征在下文表3中示出:
[0131]
表3:说明性接合接头的特征
[0132][0133]
在实施方案中,接头可以是功能性的。例如但不限于,接头可起到提高折叠和/或稳定性、提高表达、改善药物动力学和/或改善本发明方法中使用的嵌合蛋白的生物活性的作用。在另一个实例中,接头可起到将嵌合蛋白靶向特定细胞类型或位置的作用。
[0134]
在实施方案中,在本发明的方法中使用的嵌合蛋白仅包含一个接合接头。
[0135]
在实施方案中,在本发明的方法中使用的嵌合蛋白缺乏接合接头。
[0136]
在实施方案中,接头是合成接头,如聚乙二醇(peg)。
[0137]
在实施方案中,嵌合蛋白具有在空间上能够结合其配体/受体的第一结构域和/或在空间上能够结合其配体/受体的第二结构域。因此,嵌合蛋白中存在足够的总体柔性和/或细胞外结构域(或其一部分)与嵌合蛋白的剩余部分之间存在物理距离,以使得细胞外结构域的配体/受体结合结构域在空间上不受阻碍地结合其配体/受体。这种柔性和/或物理距离(其被称为“松弛”)通常可存在于一个或多个细胞外结构域中,通常存在于接头中,和/或通常存在于嵌合蛋白中(作为整体)。或者或另外地,可将氨基酸序列(例如)添加至一个或多个细胞外结构域和/或接头,以提供避免空间位阻所需的松弛。可添加提供松弛的任何氨基酸序列。在实施方案中,所添加的氨基酸序列包含序列(gly)
n
,其中n是1至100的任何
数字。可添加氨基酸序列的另外实例包括表1和表3中所述的接合接头。在实施方案中,可在细胞外结构域与接头之间添加聚乙二醇(peg)接头,以提供避免空间位阻所需的松弛。此类peg接头是本领域众所周知的。
[0138]
可在本发明中使用但不限于描述于wo2018/157162;wo2018/157165;wo2018/157164;wo2018/157163;和wo2017/059168中的一者或多者中的接头。其各自的内容以引用的方式整体并入本文。
[0139]
在实施方案中,异源嵌合蛋白包含第一结构域,所述第一结构域包含tigit的一部分;第二结构域,所述第二结构域包含ox40l的一部分;和接头。在实施方案中,接头是选自柔性氨基酸序列、igg铰链区和抗体序列的多肽。在实施方案中,接头包含至少一个能够形成二硫键的半胱氨酸残基和/或包含铰链
‑
ch2
‑
ch3 fc结构域。在实施方案中,接头包含例如来自igg1或来自igg4(包括人igg1或igg4)的铰链
‑
ch2
‑
ch3 fc结构域。在实施方案中,接头包含与seq id no:1、seq id no:2或seq id no:3的氨基酸序列至少95%同一的氨基酸序列。因此,在实施方案中,当在本发明的方法中使用的异源嵌合蛋白包含tigit的细胞外结构域(或其变体)、包含铰链
‑
ch2
‑
ch3 fc结构域的接头和ox40l的细胞外结构域(或其变体)时,它在本文中可称为“tigit
‑3‑
fc
‑
ox40l”。
[0140]
在实施方案中,异源嵌合蛋白包含第一结构域,所述第一结构域包含tigit的一部分;第二结构域,所述第二结构域包含light的一部分;和接头。在实施方案中,接头是选自柔性氨基酸序列、igg铰链区和抗体序列的多肽。在实施方案中,接头包含至少一个能够形成二硫键的半胱氨酸残基和/或包含铰链
‑
ch2
‑
ch3 fc结构域。在实施方案中,接头包含例如来自igg1或来自igg4(包括人igg1或igg4)的铰链
‑
ch2
‑
ch3 fc结构域。在实施方案中,接头包含与seq id no:1、seq id no:2或seq id no:3的氨基酸序列至少95%同一的氨基酸序列。因此,在实施方案中,当在本发明的方法中使用的异源嵌合蛋白包含tigit的细胞外结构域(或其变体)、包含铰链
‑
ch2
‑
ch3 fc结构域的接头和tigit的细胞外结构域(或其变体)时,它在本文中可称为“tigit
‑3‑
fc
‑
light”。
[0141]
疾病、治疗方法和作用机制
[0142]
所述方法包括以下步骤:向有需要的受试者(同时或顺序地)施用有效量的至少一种针对免疫检查点分子的抗体;干扰素基因刺激因子(sting)激动剂;和/或一种或多种嵌合蛋白,其中每种嵌合蛋白能够阻断免疫抑制性信号和/或刺激免疫激活信号。在实施方案中,所述嵌合蛋白包含第一结构域,所述第一结构域包含tigit的一部分;第二结构域,所述第二结构域包含ox40l的一部分;和接头。在实施方案中,所述嵌合蛋白包含第一结构域,所述第一结构域包含tigit的一部分;第二结构域,所述第二结构域包含light的一部分;和接头。
[0143]
通常期望破坏、阻断、减少、抑制和/或隔离免疫抑制性信号的传递,并且同时或同期地增强、增加和/或刺激免疫刺激信号至抗癌免疫的传递,以增强免疫响应,例如增强患者的抗肿瘤免疫响应。
[0144]
在实施方案中,在本发明方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白能够调节免疫响应的幅度,例如调节效应子输出的水平,或者可用于包括调节免疫响应的幅度,例如调节效应子输出的水平的方法中。
[0145]
在实施方案中,例如当用于治疗癌症时,与免疫抑制相比,本发明方法中使用的针
对免疫检查点分子的抗体;sting激动剂;和/或嵌合蛋白改变免疫刺激的程度以增加t细胞响应的幅度,包括但不限于刺激细胞因子产生、增殖或靶标杀伤潜力的水平增加。在实施方案中,患者的t细胞通过本发明方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白激活和/或刺激,其中激活的t细胞能够分裂和/或分泌细胞因子。
[0146]
癌症或肿瘤是指不受控制的细胞生长和/或异常增加的细胞存活和/或细胞凋亡的抑制,其干扰身体器官和系统的正常功能。包括良性和恶性癌症、息肉、增生以及休眠状态肿瘤或微转移。此外,包括具有不受免疫系统阻碍的异常增殖的细胞(例如,病毒感染的细胞)。所述癌症可以是原发性癌症或转移性癌症。原发性癌症可以是在临床上可检测到的起源部位处的癌细胞区域,并且可以是原发性肿瘤。相比之下,转移性癌症可以是疾病从一个器官或部分扩散至另一非相邻器官或部分。转移性癌症可由癌细胞引起,所述癌细胞具有穿透并浸润局部区域中的周围正常组织的能力,从而形成新的肿瘤,其可以是局部转移。癌细胞也可由癌细胞引起,所述癌细胞具有穿透淋巴管和/或血管壁的能力,此后癌细胞能够通过血流循环(从而成为循环中肿瘤细胞)至体内的其他部位和组织。癌症可由于诸如淋巴或血源性播散的过程引起。癌症也可由肿瘤细胞引起,所述肿瘤细胞停留在另一个部位,重新穿透血管或壁,继续繁殖,并且最终形成另一种临床上可检测的肿瘤。癌症可以是这种新肿瘤,其可以是转移性(或继发性)肿瘤。
[0147]
癌症可由已转移的肿瘤细胞引起,其可以是继发性或转移性肿瘤。肿瘤的细胞可与原始肿瘤中的细胞相似。例如,如果结肠直肠癌细胞转移至肝脏,则继发性肿瘤虽然存在于肝脏中,但由结肠细胞或直肠细胞而不是异常的肝细胞组成。因此,肝脏中的肿瘤可以是转移性结肠直肠癌,而不是肝癌。
[0148]
在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白治疗患有难治性癌症的受试者。在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白治疗对一种或多种免疫调节剂而言难治的受试者。例如,在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白治疗在治疗约12周后对治疗无响应或甚至进展的受试者。例如,在实施方案中,所述受试者对pd
‑
1和/或pd
‑
l1和/或pd
‑
l2剂而言是难治性的,包括例如纳武单抗(ono
‑
4538/bms
‑
936558,mdx1106,opdivo,bristol myers squibb)、派姆单抗(keytruda,merck)、匹地利珠单抗(ct
‑
011,cure tech)、mk
‑
3475(merck)、bms 936559(bristol myers squibb)、依鲁替尼(pharmacyclics/abbvie)、阿特珠单抗(tecentriq,genentech)和/或mpdl328oa(roche)难治性患者。例如,在实施方案中,所述受试者对抗ctla
‑
4剂而言是难治性的,例如伊匹单抗(yervoy)难治性患者(例如,黑素瘤患者)。因此,在实施方案中,本发明提供了挽救对各种疗法(包括一种或多种免疫调节剂的单一疗法)无响应的患者的癌症治疗方法。
[0149]
在实施方案中,本发明提供了靶向肿瘤微环境内的细胞或组织的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白。在实施方案中,肿瘤微环境内的细胞或组织表达针对本发明方法中使用的免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白的一种或多种靶标或结合配偶体。肿瘤微环境是指细胞环境,包括存在肿瘤的细胞、分泌的蛋白质、生理小分子和血管。在实施方案中,肿瘤微环境内的细胞或组织是以下中的一者或多者:肿瘤血管;肿瘤浸润淋巴细胞;成纤维细胞网状细胞;内皮祖细胞(epc);癌症相关的成纤维细
胞;周细胞;其他基质细胞;细胞外基质(ecm)的组分;树突细胞;抗原呈递细胞;t细胞;调控性t细胞;巨噬细胞;嗜中性粒细胞;以及位于肿瘤近端的其他免疫细胞。在实施方案中,本发明方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白靶向癌细胞。在实施方案中,癌细胞表达针对本发明方法中使用的免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白的一种或多种靶标或结合配偶体。
[0150]
调控性t细胞的激活受到共刺激信号和共抑制信号的严重影响。共刺激分子的两个主要家族包括b7和肿瘤坏死因子(tnf)家族。这些分子分别结合至t细胞上属于cd28或tnf受体家族的受体。许多明确定义的共抑制剂及其受体属于b7和cd28家族。
[0151]
在实施方案中,免疫刺激信号是指增强免疫响应的信号。例如,在肿瘤学的背景下,此类信号可增强抗肿瘤免疫性。例如但不限于,可通过直接刺激白细胞的增殖、细胞因子产生、杀伤活性或吞噬活性来鉴定免疫刺激信号。具体实例包括使用受体激动剂抗体或使用包含此类受体的配体(分别ox40l、light、4
‑
1bbl和tl1a)的嵌合蛋白直接刺激tnf超家族受体(如ox40、ltbr、4
‑
1bb或tnfrsf25)。来自这些受体中任一者的刺激都可直接刺激单独t细胞亚群的增殖和细胞因子产生。另一个实例包括通过抑制这种免疫遏制细胞的活性的受体直接刺激免疫抑制性细胞。
[0152]
在实施方案中,针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白能够增强、恢复、促进和/或刺激免疫调节,或者适用于涉及增强、恢复、促进和/或刺激免疫调节的方法中。在实施方案中,在本文所述的本发明方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白恢复、促进和/或刺激一种或多种针对肿瘤细胞的免疫细胞的活性或激活,所述免疫细胞包括但不限于:t细胞、细胞毒性t淋巴细胞、t辅助细胞、自然杀伤(nk)细胞、自然杀伤t(nkt)细胞、抗肿瘤巨噬细胞(例如m1巨噬细胞)、b细胞和树突细胞。在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白增强、恢复、促进和/或刺激t细胞的活性和/或激活,包括(作为非限制性实例)激活和/或刺激一种或多种t细胞内源信号,包括促存活信号;自分泌或旁分泌生长信号;p38 mapk
‑
、erk
‑
、stat
‑
、jak
‑
、akt
‑
或pi3k
‑
介导的信号;抗凋亡信号;和/或促进以下中的一者或多者和/或对于以下中的一者或多者必要的信号:促炎性细胞因子产生或t细胞迁移或t细胞肿瘤浸润。
[0153]
在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白能够引起进入肿瘤或肿瘤微环境中的t细胞(包括但不限于细胞毒性t淋巴细胞、t辅助细胞、自然杀伤t(nkt)细胞)、b细胞、自然杀伤(nk)细胞、自然杀伤t(nkt)细胞、树突细胞、单核细胞和巨噬细胞(例如,m1和m2中的一者或多者)中的一者或多者增加,或者适用于涉及引起进入肿瘤或肿瘤微环境中的t细胞(包括但不限于细胞毒性t淋巴细胞、t辅助细胞、自然杀伤t(nkt)细胞)、b细胞、自然杀伤(nk)细胞、自然杀伤t(nkt)细胞、树突细胞、单核细胞和巨噬细胞(例如,m1和m2中的一者或多者)中的一者或多者增加的方法中。在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白增强cd8 t细胞,特别是已经渗透到肿瘤微环境中的那些t细胞对肿瘤抗原的识别。在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白诱导cd19表达和/或增加cd19阳性细胞(例如,cd19阳性b细胞)的数量。在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋
白诱导il
‑
15rα表达和/或增加il
‑
15rα阳性细胞(例如,il
‑
15rα阳性树突细胞)的数量。
[0154]
在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白能够抑制和/或引起免疫遏制细胞(例如,骨髓来源的遏制细胞(mdsc)、调控性t细胞(treg)、肿瘤相关的嗜中性粒细胞(tan)、m2巨噬细胞和肿瘤相关的巨噬细胞(tam))、并且特别是在肿瘤和/或肿瘤微环境(tme)内减少,或者适用于涉及抑制和/或引起免疫遏制细胞(例如,骨髓来源的遏制细胞(mdsc)、调控性t细胞(treg)、肿瘤相关的嗜中性粒细胞(tan)、m2巨噬细胞和肿瘤相关的巨噬细胞(tam))、并且特别是在肿瘤和/或肿瘤微环境(tme)内减少的方法中。在实施方案中,本发明的疗法可改变肿瘤部位和/或tme中m1与m2巨噬细胞的比例,以有利于m1巨噬细胞。
[0155]
在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白能够增加各种细胞因子或趋化因子的血清水平,所述细胞因子或趋化因子包括但不限于以下中的一者或多者:ifnγ、tnfα、il
‑
2、il
‑
4、il
‑
5、il
‑
6、il
‑
7、il
‑
9、il
‑
10、il
‑
13、il
‑
15、il
‑
17a、il
‑
17f、il
‑
22、ccl2、ccl3、ccl4、cxcl8、cxcl9、cxcl10、cxcl11和cxcl12。在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白能够增强所治疗受试者的血清中的il
‑
2、il
‑
4、il
‑
5、il
‑
10、il
‑
13、il
‑
17a、il
‑
22、tnfα或ifnγ。在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白的施用能够增强tnfα分泌。在具体实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白的施用能够增强白细胞的超抗原介导的tnfα分泌。对这种细胞因子响应的检测可提供用于确定本发明方法中使用的针对免疫检查点分子的所示抗体、sting激动剂和/或嵌合蛋白的最佳给药方案的方法。
[0156]
在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白能够增加cd4 和/或cd8 t细胞亚群或防止cd4 和/或cd8 t细胞亚群的减少。
[0157]
在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白能够增强t细胞的肿瘤杀伤活性。
[0158]
在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白抑制、阻断和/或减少抗肿瘤cd8 和/或cd4 t细胞的细胞死亡;或刺激;诱导和/或增加促肿瘤t细胞的细胞死亡。t细胞耗尽是t细胞功能障碍的一种状态,其特征在于增殖和效应子功能逐渐丧失,最终导致克隆缺失。因此,促肿瘤t细胞是指在许多慢性感染、炎症性疾病和癌症期间出现的t细胞功能障碍的状态。这种功能障碍由较差的增殖和/或效应子功能、抑制性受体的持续表达以及与功能性效应子或记忆t细胞的转录状态不同的转录状态定义。耗尽防止感染和肿瘤的最佳控制。说明性的促肿瘤t细胞包括但不限于表达一种或多种检查点抑制性受体的treg、cd4 和/或cd8 t细胞,th2细胞和th17细胞。检查点抑制性受体是指在免疫细胞上表达的可预防或抑制不受控制的免疫响应的受体。相比之下,抗肿瘤cd8 和/或cd4 t细胞是指可发动针对肿瘤的免疫响应的t细胞。
[0159]
在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白能够增加效应t细胞与调控性t细胞的比例,并且可用于包括增加效应t细胞与调控性t细胞的比例的方法中。说明性的效应t细胞包括icos
效应t细胞;细胞毒性t细胞(例如,αβtcr、cd3
、cd8
、cd45ro
);cd4
效应t细胞(例如αβtcr、cd3
、cd4
、ccr7
、
cd62lhi、il
‑
7r/cd127
);cd8
效应t细胞(例如,αβtcr、cd3
、cd8
、ccr7
、cd62lhi、il
‑
7r/cd127
);效应记忆t细胞(例如,cd62l低、cd44
、tcr、cd3
、il
‑
7r/cd127
、il
‑
15r
、ccr7低);中心记忆t细胞(例如,ccr7
、cd62l
、cd27
;或ccr7hi、cd44
、cd62lhi、tcr、cd3
、il
‑
7r/cd127
、il
‑
15r
);cd62l
效应t细胞;cd8
效应记忆t细胞(tem),包括早期效应记忆t细胞(cd27
cd62l
‑
)和晚期效应记忆t细胞(cd27
‑
cd62l
‑
)(分别teme和teml);cd127(
)cd25(低/
‑
)效应t细胞;cd127(
‑
)cd25(
‑
)效应t细胞;cd8
干细胞记忆效应细胞(tscm)(例如,cd44(低)cd62l(高)cd122(高)sca(
));th1效应t细胞(例如,cxcr3
、cxcr6
和ccr5
;或αβtcr、cd3
、cd4
、il
‑
12r
、ifnγr
、cxcr3
)、th2效应t细胞(例如,ccr3
、ccr4
和ccr8
;或αβtcr、cd3
、cd4
、il
‑
4r
、il
‑
33r
、ccr4
、il
‑
17rb
、crth2
);th9效应t细胞(例如,αβtcr、cd3
、cd4
);th17效应t细胞(例如,αβtcr、cd3
、cd4
、il
‑
23r
、ccr6
、il
‑
1r
);cd4
cd45ro
ccr7
效应t细胞、cd4
cd45ro
ccr7(
‑
)效应t细胞;以及分泌il
‑
2、il
‑
4和/或ifn
‑
γ的效应t细胞。说明性的调控性t细胞包括icos
调控性t细胞、cd4
cd25
foxp3
调控性t细胞、cd4
cd25
调控性t细胞、cd4
cd25
‑
调控性t细胞、cd4
cd25高调控性t细胞、tim
‑3
pd
‑1
调控性t细胞、淋巴细胞激活基因
‑
3(lag
‑
3)
调控性t细胞、ctla
‑
4/cd152
调控性t细胞、神经纤毛蛋白
‑
1(nrp
‑
1)
调控性t细胞、ccr4
ccr8
调控性t细胞、cd62l(l
‑
选择素)
调控性t细胞、cd45rb低调控性t细胞、cd127低调控性t细胞、lrrc32/garp
调控性t细胞、cd39
调控性t细胞、gitr
调控性t细胞、lap
调控性t细胞、1b11
调控性t细胞、btla
调控性t细胞、1型调控性t细胞(tr1细胞)、t辅助3型(th3)细胞、自然杀伤t细胞表型的调控性细胞(nktreg)、cd8
调控性t细胞、cd8
cd28
‑
调控性t细胞和/或分泌il
‑
10、il
‑
35、tgf
‑
β、tnf
‑
α、半乳凝素
‑
1、ifn
‑
γ和/或mcp1的调控性t细胞。
[0160]
在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白引起效应t细胞(例如,cd4 cd25
‑
t细胞)的增加。
[0161]
在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白引起调控性t细胞(例如,cd4 cd25 t细胞)的减少。
[0162]
在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白产生记忆响应,所述记忆响应可例如能够预防复发或保护动物免于复发和/或预防转移或/或降低转移的可能性。因此,用本发明方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白治疗的动物稍后在用本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白初始治疗后再次攻击时能够攻击肿瘤细胞和/或预防肿瘤发展。因此,在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白刺激主动肿瘤破坏并且还刺激肿瘤抗原的免疫识别,这在编程能够预防复发的记忆响应中是必不可少的。
[0163]
在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白能够引起抗原呈递细胞的激活。在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白能够增强抗原呈递细胞呈递抗原的能力。
[0164]
在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白能够瞬时刺激效应t细胞超过约12小时、约24小时、约48小时、约72小时或约96小时或约1周或约2周,并且可用于包括刺激效应t细胞超过约12小时、约24小时、约48
小时、约72小时或约96小时或约1周或约2周的方法中。在实施方案中,效应t细胞的瞬时刺激基本上发生在患者的血流中或特定的组织/部位(包括淋巴组织,例如像骨髓、淋巴结、脾、胸腺、粘膜相关的淋巴组织(malt)、非淋巴组织)中或肿瘤微环境中。
[0165]
在本发明的方法中使用的嵌合蛋白出人意料地提供了细胞外结构域组分与其具有慢解离速率(kd或k
off
)的对应结合配偶体的结合。在实施方案中,这提供了受体与配体的出人意料的长相互作用,反之亦然。这种作用允许更长的阳性信号作用,例如免疫刺激信号的增加或激活。例如,在本发明的方法中使用的嵌合蛋白(例如通过长解离速率结合)允许足够的信号传递以提供免疫细胞增殖,允许抗肿瘤攻击,允许足够的信号传递以提供刺激性信号(例如细胞因子)的释放。
[0166]
在本发明的方法中使用的嵌合蛋白能够在细胞之间形成稳定的突触。嵌合蛋白所促进的细胞的稳定突触(例如,在带有负信号的细胞之间)提供了空间取向以有利于肿瘤减少
‑
如将t细胞定位为攻击肿瘤细胞和/或在空间上阻止肿瘤细胞传递负信号,包括除嵌合蛋白所掩蔽的信号以外的负信号。在实施方案中,与嵌合蛋白的血清t
1/2
相比,这提供了更长的中靶(例如,肿瘤内)半衰期(t
1/2
)。此类性质可具有降低与嵌合蛋白的全身分布相关的脱靶毒性的综合优点。
[0167]
在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白能够提供持续免疫调节作用。
[0168]
在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白提供协同治疗作用(例如,抗肿瘤作用),因为它允许两种免疫治疗剂的改善的位点特异性相互作用。在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白提供降低异位和/或全身毒性的潜力。
[0169]
在实施方案中,在本发明的方法中使用的嵌合蛋白表现出增强的安全性概况。在实施方案中,在本发明的方法中使用的嵌合蛋白表现出降低的毒性概况。例如,本发明的方法中使用的嵌合蛋白的施用可产生减轻的副作用,如腹泻、炎症(例如,肠道炎症)或体重减轻中的一种或多种,所述副作用在施用针对由本发明的方法中使用的嵌合蛋白的细胞外结构域所靶向的一种或多种配体/受体的抗体之后发生。在实施方案中,与针对由本发明的方法中使用的嵌合蛋白的细胞外结构域所靶向的一种或多种配体/受体的抗体相比,在本发明的方法中使用的嵌合蛋白提供了改进的安全性,但是不牺牲功效。
[0170]
在实施方案中,相对于当前免疫疗法,例如针对由本发明的方法中使用的嵌合蛋白的细胞外结构域所靶向的一种或多种配体/受体的抗体,本发明的方法中使用的嵌合蛋白提供减少的副作用,例如gi并发症。说明性的gi并发症包括腹痛、食欲不振、自身免疫作用、便秘、痉挛、脱水、腹泻、进食问题、疲劳、肠胃气胀、腹部积液或腹水、胃肠(gi)生态失调、gi粘膜炎、炎症性肠病、肠易激综合征(ibs
‑
d和ibs
‑
c)、恶心、疼痛、粪便或尿液变化、溃疡性结肠炎、呕吐、由于积液所致的体重增加和/或虚弱。
[0171]
治疗方法
[0172]
在各个方面,本发明提供了可用于癌症免疫疗法的组合物和方法。例如,本发明部分地涉及用于治疗癌症的方法,所述方法包括以下步骤:向有需要的受试者(同时或依次)施用有效量的至少一种针对免疫检查点分子的抗体;干扰素基因刺激因子(sting)激动剂;和/或一种或多种嵌合蛋白。在实施方案中,所述嵌合蛋白包含第一结构域,所述第一结构
域包含tigit的一部分;第二结构域,所述第二结构域包含ox40l的一部分;和接头。
[0173]
本发明的一方面涉及用于治疗有需要的受试者的癌症的方法,所述方法包括:向所述受试者提供第一药物组合物,所述第一药物组合物包含能够结合细胞毒性t淋巴细胞相关抗原4(ctla
‑
4)的抗体;以及向所述受试者提供第二药物组合物,所述第二药物组合物包含异源嵌合蛋白。在此,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体;(b)第二结构域,所述第二结构域包含ox40l的细胞外结构域的一部分,其中所述部分能够结合ox40l受体;和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
[0174]
在实施方案中,第一药物组合物的剂量小于提供给尚未进行或未正在进行用第二药物组合物治疗的受试者的第一药物组合物的剂量。
[0175]
在实施方案中,提供的第二药物组合物的剂量小于提供给尚未进行或未正在进行用第一药物组合物治疗的受试者的第二药物组合物的剂量。
[0176]
在实施方案中,同时提供所述第一药物组合物和所述第二药物组合物。在实施方案中,第一药物组合物的剂量小于提供给尚未进行或未正在进行用第二药物组合物治疗的受试者的第一药物组合物的剂量。在实施方案中,提供的第二药物组合物的剂量小于提供给尚未进行或未正在进行用第一药物组合物治疗的受试者的第二药物组合物的剂量。
[0177]
在实施方案中,在提供所述第二药物组合物之后提供所述第一药物组合物。在实施方案中,第一药物组合物的剂量小于提供给尚未进行或未正在进行用第二药物组合物治疗的受试者的第一药物组合物的剂量。
[0178]
在实施方案中,在提供所述第二药物组合物之前提供所述第一药物组合物。在实施方案中,第一药物组合物的剂量小于提供给尚未进行或未正在进行用第二药物组合物治疗的受试者的第一药物组合物的剂量。在实施方案中,提供的第二药物组合物的剂量小于提供给尚未进行或未正在进行用第一药物组合物治疗的受试者的第二药物组合物的剂量。
[0179]
在实施方案中,与仅已经进行或仅正在进行用第一药物组合物治疗的受试者相比,所述受试者具有增加的存活机会而没有胃肠炎症和体重减轻,和/或具有降低的肿瘤大小或癌症患病率。
[0180]
在实施方案中,与仅已经进行或仅正在进行用第二药物组合物治疗的受试者相比,所述受试者具有增加的存活机会而没有胃肠炎症和体重减轻,和/或具有降低的肿瘤大小或癌症患病率。
[0181]
本发明的另一方面涉及用于治疗受试者的癌症的方法,所述受试者已经进行或正在进行用能够结合细胞毒性t淋巴细胞相关抗原4(ctla
‑
4)的抗体治疗。所述方法包括向所述受试者提供包含异源嵌合蛋白的药物组合物,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体;(b)第二结构域,所述第二结构域包含ox40l的细胞外结构域的一部分,其中所述部分能够结合ox40l受体;和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
[0182]
在实施方案中,提供给所述受试者的药物组合物的剂量小于提供给尚未进行或未正在进行用能够结合pd
‑
1或结合pd
‑
1配体的抗体治疗的受试者的药物组合物的剂量。
[0183]
在实施方案中,与尚未进行或未正在进行用能够结合pd
‑
1或结合pd
‑
1配体的抗体治疗的受试者相比,所述受试者具有增加的存活机会、增加的体重和/或降低的肿瘤大小或癌症患病率。
[0184]
本发明的另一方面提供了用于治疗受试者的癌症的方法,所述方法包括:向所述受试者提供药物组合物,所述药物组合物包含能够结合细胞毒性t淋巴细胞相关抗原4(ctla
‑
4)的抗体。在此,所述受试者已经进行或正在进行用异源嵌合蛋白治疗,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体;(b)第二结构域,所述第二结构域包含ox40l的细胞外结构域的一部分,其中所述部分能够结合ox40l受体;和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
[0185]
在实施方案中,提供给所述受试者的药物组合物的剂量小于提供给尚未进行或未正在进行用异源嵌合蛋白治疗的受试者的药物组合物的剂量。
[0186]
在实施方案中,受试者患有对于包含能够结合pd
‑
1或结合pd
‑
1配体的抗体的治疗响应差或难治性的癌症。
[0187]
在实施方案中,所述第一结构域基本上包含tigit的细胞外结构域的全部,和/或所述第二结构域基本上包含ox40l的细胞外结构域的全部。
[0188]
在实施方案中,接头是选自柔性氨基酸序列、igg铰链区和抗体序列的多肽。
[0189]
在实施方案中,接头包含至少一个能够形成二硫键的半胱氨酸残基和/或包含铰链
‑
ch2
‑
ch3 fc结构域。在实施方案中,接头包含源自igg1或igg4例如人igg1或人igg4的铰链
‑
ch2
‑
ch3 fc结构域。在实施方案中,接头包含与seq id no:1、seq id no:2或seq id no:3的氨基酸序列至少95%同一的氨基酸序列。
[0190]
在实施方案中,受试者患有对于包含能够结合pd
‑
1或结合pd
‑
1配体的抗体的治疗响应差或难治性的癌症。
[0191]
在实施方案中,所述癌症在用能够结合pd
‑
1或结合pd
‑
1配体的抗体治疗大约12周后对这种治疗响应差或无响应。
[0192]
在实施方案中,所述抗体能够结合ctla
‑
4。能够结合ctla
‑
4的说明性抗体包括yervoy(伊匹单抗)、9d9、曲美木单抗(以前为替奇木单抗,cp
‑
675,206;medimmune)、agen1884和rg2077。
[0193]
在实施方案中,癌症是适合用能够结合ctla
‑
4的抗体治疗的癌症。能够结合ctla
‑
4的说明性抗体包括yervoy(伊匹单抗)、9d9、曲美木单抗(以前为替奇木单抗,cp
‑
675,206;medimmune)、agen1884和rg2077。这种抗体部分地通过抑制ctla
‑
4与其一种或多种配体的相互作用而有助于癌症治疗。
[0194]
本发明的一方面涉及用于治疗有需要的受试者的癌症的方法,所述方法包括:向所述受试者提供第一药物组合物,所述第一药物组合物包含能够结合程序性细胞死亡蛋白1(pd
‑
1)或结合pd
‑
1配体的抗体;以及向所述受试者提供第二药物组合物,所述第二药物组合物包含异源嵌合蛋白。在此,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体;(b)第二结构域,所述第二结构域包含ox40l的细胞外结构域的一部分,其中所述部分能够结合ox40l受体;和(c)接头,所述接头连接所述第一结构域和所述第
二结构域。
[0195]
在实施方案中,第一药物组合物的剂量小于提供给尚未进行或未正在进行用第二药物组合物治疗的受试者的第一药物组合物的剂量。
[0196]
在实施方案中,提供的第二药物组合物的剂量小于提供给尚未进行或未正在进行用第一药物组合物治疗的受试者的第二药物组合物的剂量。
[0197]
在实施方案中,同时提供所述第一药物组合物和所述第二药物组合物。在实施方案中,第一药物组合物的剂量小于提供给尚未进行或未正在进行用第二药物组合物治疗的受试者的第一药物组合物的剂量。在实施方案中,提供的第二药物组合物的剂量小于提供给尚未进行或未正在进行用第一药物组合物治疗的受试者的第二药物组合物的剂量。
[0198]
在实施方案中,在提供所述第二药物组合物之后提供所述第一药物组合物。在实施方案中,第一药物组合物的剂量小于提供给尚未进行或未正在进行用第二药物组合物治疗的受试者的第一药物组合物的剂量。
[0199]
在实施方案中,在提供所述第二药物组合物之前提供所述第一药物组合物。在实施方案中,第一药物组合物的剂量小于提供给尚未进行或未正在进行用第二药物组合物治疗的受试者的第一药物组合物的剂量。在实施方案中,提供的第二药物组合物的剂量小于提供给尚未进行或未正在进行用第一药物组合物治疗的受试者的第二药物组合物的剂量。
[0200]
在实施方案中,与仅已经进行或仅正在进行用第一药物组合物治疗的受试者相比,所述受试者具有增加的存活机会而没有胃肠炎症和体重减轻,和/或具有降低的肿瘤大小或癌症患病率。
[0201]
在实施方案中,与仅已经进行或仅正在进行用第二药物组合物治疗的受试者相比,所述受试者具有增加的存活机会而没有胃肠炎症和体重减轻,和/或具有降低的肿瘤大小或癌症患病率。
[0202]
本发明的另一方面涉及用于治疗受试者的癌症的方法,所述受试者已经进行或正在进行用能够结合程序性细胞死亡蛋白1(pd
‑
1)或结合pd
‑
1配体的抗体治疗。所述方法包括向所述受试者提供包含异源嵌合蛋白的药物组合物,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体;(b)第二结构域,所述第二结构域包含ox40l的细胞外结构域的一部分,其中所述部分能够结合ox40l受体;和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
[0203]
在实施方案中,提供给所述受试者的药物组合物的剂量小于提供给尚未进行或未正在进行用能够结合pd
‑
1或结合pd
‑
1配体的抗体治疗的受试者的药物组合物的剂量。
[0204]
在实施方案中,与尚未进行或未正在进行用能够结合pd
‑
1或结合pd
‑
1配体的抗体治疗的受试者相比,所述受试者具有增加的存活机会而没有胃肠炎症和体重减轻,和/或具有降低的肿瘤大小或癌症患病率。
[0205]
本发明的另一方面提供了用于治疗受试者的癌症的方法,所述方法包括:向所述受试者提供药物组合物,所述药物组合物包含能够结合程序性细胞死亡蛋白1(pd
‑
1)或结合pd
‑
1配体的抗体。在此,所述受试者已经进行或正在进行用异源嵌合蛋白治疗,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体;(b)第二结构域,
所述第二结构域包含ox40l的细胞外结构域的一部分,其中所述部分能够结合ox40l受体;和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
[0206]
在实施方案中,提供给所述受试者的药物组合物的剂量小于提供给尚未进行或未正在进行用异源嵌合蛋白治疗的受试者的药物组合物的剂量。
[0207]
在实施方案中,受试者患有对于包含能够结合pd
‑
1或结合pd
‑
1配体的抗体的治疗响应差或难治性的癌症。
[0208]
在实施方案中,所述第一结构域基本上包含tigit的细胞外结构域的全部,和/或所述第二结构域基本上包含ox40l的细胞外结构域的全部。
[0209]
在实施方案中,接头是选自柔性氨基酸序列、igg铰链区和抗体序列的多肽。
[0210]
在实施方案中,接头包含至少一个能够形成二硫键的半胱氨酸残基和/或包含铰链
‑
ch2
‑
ch3 fc结构域。在实施方案中,接头包含源自igg1或igg4例如人igg1或人igg4的铰链
‑
ch2
‑
ch3 fc结构域。在实施方案中,接头包含与seq id no:1、seq id no:2或seq id no:3的氨基酸序列至少95%同一的氨基酸序列。
[0211]
在实施方案中,受试者患有对于包含能够结合pd
‑
1或结合pd
‑
1配体的抗体的治疗响应差或难治性的癌症。
[0212]
在实施方案中,所述癌症在用能够结合pd
‑
1或结合pd
‑
1配体的抗体治疗大约12周后对这种治疗响应差或无响应。
[0213]
在实施方案中,所述抗体能够结合pd
‑
1或pd
‑
1配体。能够结合pd
‑
1或pd
‑
1配体的说明性抗体包括纳武单抗(ono 4538,bms 936558,mdx1106,opdivo(bristol myers squibb))、派姆单抗(keytruda/mk 3475,merck)、匹地利珠单抗(ct 011,cure tech)、rmp1
‑
14、agen2034(agenus)和西米普利单抗((regn
‑
2810)。这种抗体能够抑制pd
‑
1与其一种或多种配体的相互作用。
[0214]
在实施方案中,癌症是适合用能够结合pd
‑
1或pd
‑
1配体的抗体治疗的癌症。能够结合pd
‑
1或pd
‑
1配体的说明性抗体包括纳武单抗(ono 4538,bms 936558,mdx1106,opdivo(bristol myers squibb))、派姆单抗(keytruda/mk 3475,merck)、匹地利珠单抗(ct 011,cure tech)、rmp1
‑
14、agen2034(agenus)和西米普利单抗((regn
‑
2810)。这种抗体部分地通过抑制pd
‑
1与其一种或多种配体的相互作用而有助于癌症治疗。
[0215]
本发明的一方面涉及用于治疗有需要的受试者的癌症的方法,所述方法包括:向所述受试者提供第一药物组合物,所述第一药物组合物包含干扰素基因刺激因子(sting)激动剂;以及向所述受试者提供第二药物组合物,所述第二药物组合物包含异源嵌合蛋白。在此,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体;(b)第二结构域,所述第二结构域包含ox40l的细胞外结构域的一部分,其中所述部分能够结合ox40l受体;和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
[0216]
在实施方案中,第一药物组合物的剂量小于提供给尚未进行或未正在进行用第二药物组合物治疗的受试者的第一药物组合物的剂量。
[0217]
在实施方案中,提供的第二药物组合物的剂量小于提供给尚未进行或未正在进行用第一药物组合物治疗的受试者的第二药物组合物的剂量。
[0218]
在实施方案中,同时提供所述第一药物组合物和所述第二药物组合物。在实施方
案中,第一药物组合物的剂量小于提供给尚未进行或未正在进行用第二药物组合物治疗的受试者的第一药物组合物的剂量。在实施方案中,提供的第二药物组合物的剂量小于提供给尚未进行或未正在进行用第一药物组合物治疗的受试者的第二药物组合物的剂量。
[0219]
在实施方案中,在提供所述第二药物组合物之后提供所述第一药物组合物。在实施方案中,第一药物组合物的剂量小于提供给尚未进行或未正在进行用第二药物组合物治疗的受试者的第一药物组合物的剂量。
[0220]
在实施方案中,在提供所述第二药物组合物之前提供所述第一药物组合物。在实施方案中,第一药物组合物的剂量小于提供给尚未进行或未正在进行用第二药物组合物治疗的受试者的第一药物组合物的剂量。在实施方案中,提供的第二药物组合物的剂量小于提供给尚未进行或未正在进行用第一药物组合物治疗的受试者的第二药物组合物的剂量。
[0221]
在实施方案中,与仅已经进行或仅正在进行用第一药物组合物治疗的受试者相比,所述受试者具有增加的存活机会而没有胃肠炎症和体重减轻,和/或具有降低的肿瘤大小或癌症患病率。
[0222]
在实施方案中,与仅已经进行或仅正在进行用第二药物组合物治疗的受试者相比,所述受试者具有增加的存活机会而没有胃肠炎症和体重减轻,和/或具有降低的肿瘤大小或癌症患病率。
[0223]
在实施方案中,与仅已经进行或仅正在进行用第一药物组合物治疗的受试者相比,所述受试者具有增加的存活机会而没有胃肠炎症和体重减轻,和/或具有降低的肿瘤大小或癌症患病率。
[0224]
在实施方案中,与仅已经进行或仅正在进行用第二药物组合物治疗的受试者相比,所述受试者具有增加的存活机会而没有胃肠炎症和体重减轻,和/或具有降低的肿瘤大小或癌症患病率。
[0225]
本发明的另一方面涉及用于治疗受试者的癌症的方法,所述受试者已经进行或正在进行用干扰素基因刺激因子(sting)激动剂治疗。所述方法包括向所述受试者提供包含异源嵌合蛋白的药物组合物,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体;(b)第二结构域,所述第二结构域包含ox40l的细胞外结构域的一部分,其中所述部分能够结合ox40l受体;和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
[0226]
在实施方案中,提供给所述受试者的药物组合物的剂量小于提供给尚未进行或未正在进行用能够结合pd
‑
1或结合pd
‑
1配体的抗体治疗的受试者的药物组合物的剂量。
[0227]
在实施方案中,与尚未进行或未正在进行用能够结合pd
‑
1或结合pd
‑
1配体的抗体治疗的受试者相比,所述受试者具有增加的存活机会、没有胃肠炎症和体重减轻和/或肿瘤大小或癌症患病率降低。
[0228]
本发明的另一方面提供了用于治疗受试者的癌症的方法,所述方法包括向所述受试者提供包含干扰素基因刺激因子(sting)激动剂的药物组合物。在此,所述受试者已经进行或正在进行用异源嵌合蛋白治疗,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体;(b)第二结构域,所述第二结构域包含ox40l的细胞外结构域的
一部分,其中所述部分能够结合ox40l受体;和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
[0229]
在实施方案中,提供给所述受试者的药物组合物的剂量小于提供给尚未进行或未正在进行用异源嵌合蛋白治疗的受试者的药物组合物的剂量。
[0230]
在实施方案中,受试者患有对于包含能够结合pd
‑
1或结合pd
‑
1配体的抗体的治疗响应差或难治性的癌症。
[0231]
在实施方案中,所述第一结构域基本上包含tigit的细胞外结构域的全部,和/或所述第二结构域基本上包含ox40l的细胞外结构域的全部。
[0232]
在实施方案中,接头是选自柔性氨基酸序列、igg铰链区和抗体序列的多肽。
[0233]
在实施方案中,接头包含至少一个能够形成二硫键的半胱氨酸残基和/或包含铰链
‑
ch2
‑
ch3 fc结构域。在实施方案中,接头包含源自igg1或igg4例如人igg1或人igg4的铰链
‑
ch2
‑
ch3 fc结构域。在实施方案中,接头包含与seq id no:1、seq id no:2或seq id no:3的氨基酸序列至少95%同一的氨基酸序列。
[0234]
在实施方案中,受试者患有对于包含能够结合pd
‑
1或结合pd
‑
1配体的抗体的治疗响应差或难治性的癌症。
[0235]
在实施方案中,所述癌症在用能够结合pd
‑
1或结合pd
‑
1配体的抗体治疗大约12周后对这种治疗响应差或无响应。
[0236]
在实施方案中,所述sting激动剂选自由以下组成的组:5,6
‑
二甲基呫吨酮
‑4‑
乙酸(dmxaa)、miw815(adu
‑
s100)、crd5500、mk
‑
1454、sb11285、imsa101以及在us20140341976、us20180028553、us20180230178、us9549944、wo2015185565、wo2016120305、wo2017044622、wo2017027645、wo2017027646、wo2017093933、wo2017106740、wo2017123657、wo2017123669、wo2017161349、wo2017175147、wo2017175156、wo2017176812、wo2018009466、wo2018045204、wo2018060323、wo2018098203、wo2018100558、wo2018138684、wo2018138685、wo2018152450、wo2018152453、wo2018172206、wo2018198084、wo2018234805、wo2018234807、wo2018234808、wo2019023459、wo2019046496、wo2019046498、wo2019046500、wo2019074887、wo2019079261、wo2019118839、wo2019125974或wo2019160884中描述的任何sting激动剂,所述专利的内容以引用的方式整体并入本文。在实施方案中,所述sting激动剂选自由以下组成的组:5,6
‑
二甲基呫吨酮
‑4‑
乙酸(dmxaa)、miw815(adu
‑
s100)、crd5500、mk
‑
1454、sb11285、imsa101。
[0237]
在实施方案中,癌症是适合用sting激动剂治疗的癌症。说明性sting激动剂包括5,6
‑
二甲基呫吨酮
‑4‑
乙酸(dmxaa)、miw815(adu
‑
s100)、crd5500、mk
‑
1454、sb11285、imsa101以及在us20140341976、us20180028553、us20180230178、us9549944、wo2015185565、wo2016120305、wo2017044622、wo2017027645、wo2017027646、wo2017093933、wo2017106740、wo2017123657、wo2017123669、wo2017161349、wo2017175147、wo2017175156、wo2017176812、wo2018009466、wo2018045204、wo2018060323、wo2018098203、wo2018100558、wo2018138684、wo2018138685、wo2018152450、wo2018152453、wo2018172206、wo2018198084、wo2018234805、wo2018234807、wo2018234808、wo2019023459、wo2019046496、wo2019046498、
wo2019046500、wo2019074887、wo2019079261、wo2019118839、wo2019125974或wo2019160884中描述的任何sting激动剂,所述专利的内容以引用的方式整体并入本文。此类sting激动剂有助于癌症治疗,部分是通过促进免疫激活和刺激免疫细胞来攻击癌症。
[0238]
在本发明的方面和实施方案中,需要包括如本文所公开的在本发明的方法中使用的针对免疫检查点分子的抗体;sting激动剂;和/或嵌合蛋白的癌症治疗的患者对或被预测为对免疫疗法,例如,如本文所公开的抗癌免疫疗法响应差或无响应。此外,在实施方案中,需要如本文所公开的抗癌剂的患者被或可被预测为对免疫检查点免疫疗法响应差或无响应。免疫检查点分子可选自pd
‑
1、pd
‑
l1、pd
‑
l2、icos、icosl和ctla
‑
4。
[0239]
适合根据本发明治疗的癌症的实例包括霍奇金淋巴瘤、非霍奇金淋巴瘤、肾上腺癌、肛门癌、乳腺癌、宫颈癌、胆管癌、结肠直肠癌、子宫内膜癌、食道癌、胃癌、头颈癌、肝细胞癌、黑素瘤、梅克尔细胞癌、非小细胞肺癌、前列腺癌、胰腺癌、肾细胞癌、卵巢癌(包括输卵管癌和腹膜癌)、小细胞肺癌、皮肤鳞状细胞癌、肉瘤、甲状腺癌和尿路上皮癌。
[0240]
本发明的一方面涉及用于治疗有需要的受试者的癌症的方法,所述方法包括:向所述受试者提供第一药物组合物,所述第一药物组合物包含能够结合程序性细胞死亡蛋白1(pd
‑
1)或结合pd
‑
1配体的抗体;以及向所述受试者提供第二药物组合物,所述第二药物组合物包含异源嵌合蛋白。在此,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体;(b)第二结构域,所述第二结构域包含light的细胞外结构域的一部分,其中所述部分能够结合light受体;和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
[0241]
在实施方案中,第一药物组合物的剂量小于提供给尚未进行或未正在进行用第二药物组合物治疗的受试者的第一药物组合物的剂量。
[0242]
在实施方案中,提供的第二药物组合物的剂量小于提供给尚未进行或未正在进行用第一药物组合物治疗的受试者的第二药物组合物的剂量。
[0243]
在实施方案中,同时提供所述第一药物组合物和所述第二药物组合物。在实施方案中,第一药物组合物的剂量小于提供给尚未进行或未正在进行用第二药物组合物治疗的受试者的第一药物组合物的剂量。在实施方案中,提供的第二药物组合物的剂量小于提供给尚未进行或未正在进行用第一药物组合物治疗的受试者的第二药物组合物的剂量。
[0244]
在实施方案中,在提供所述第二药物组合物之后提供所述第一药物组合物。在实施方案中,第一药物组合物的剂量小于提供给尚未进行或未正在进行用第二药物组合物治疗的受试者的第一药物组合物的剂量。
[0245]
在实施方案中,在提供所述第二药物组合物之前提供所述第一药物组合物。在实施方案中,第一药物组合物的剂量小于提供给尚未进行或未正在进行用第二药物组合物治疗的受试者的第一药物组合物的剂量。在实施方案中,提供的第二药物组合物的剂量小于提供给尚未进行或未正在进行用第一药物组合物治疗的受试者的第二药物组合物的剂量。
[0246]
在实施方案中,与仅已经进行或仅正在进行用第一药物组合物治疗的受试者相比,所述受试者具有增加的存活机会而没有胃肠炎症和体重减轻,和/或具有降低的肿瘤大小或癌症患病率。
[0247]
在实施方案中,与仅已经进行或仅正在进行用第二药物组合物治疗的受试者相
比,所述受试者具有增加的存活机会而没有胃肠炎症和体重减轻,和/或具有降低的肿瘤大小或癌症患病率。
[0248]
本发明的另一方面涉及用于治疗受试者的癌症的方法,所述受试者已经进行或正在进行用能够结合程序性细胞死亡蛋白1(pd
‑
1)或结合pd
‑
1配体的抗体治疗。所述方法包括向所述受试者提供包含异源嵌合蛋白的药物组合物,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体;(b)第二结构域,所述第二结构域包含light的细胞外结构域的一部分,其中所述部分能够结合light受体;和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
[0249]
在实施方案中,提供给所述受试者的药物组合物的剂量小于提供给尚未进行或未正在进行用能够结合pd
‑
1或结合pd
‑
1配体的抗体治疗的受试者的药物组合物的剂量。
[0250]
在实施方案中,与尚未进行或未正在进行用能够结合pd
‑
1或结合pd
‑
1配体的抗体治疗的受试者相比,所述受试者具有增加的存活机会、增加的体重和/或降低的肿瘤大小或癌症患病率。
[0251]
本发明的另一方面提供了用于治疗受试者的癌症的方法,所述方法包括:向所述受试者提供药物组合物,所述药物组合物包含能够结合程序性细胞死亡蛋白1(pd
‑
1)或结合pd
‑
1配体的抗体。在此,所述受试者已经进行或正在进行用异源嵌合蛋白治疗,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体;(b)第二结构域,所述第二结构域包含light的细胞外结构域的一部分,其中所述部分能够结合light受体;和(c)接头,所述接头连接所述第一结构域和所述第二结构域。
[0252]
在实施方案中,提供给所述受试者的药物组合物的剂量小于提供给尚未进行或未正在进行用异源嵌合蛋白治疗的受试者的药物组合物的剂量。
[0253]
在实施方案中,受试者患有对于包含能够结合pd
‑
1或结合pd
‑
1配体的抗体的治疗响应差或难治性的癌症。
[0254]
在实施方案中,所述第一结构域基本上包含tigit的细胞外结构域的全部,和/或所述第二结构域基本上包含light的细胞外结构域的全部。
[0255]
在实施方案中,接头是选自柔性氨基酸序列、igg铰链区和抗体序列的多肽。
[0256]
在实施方案中,接头包含至少一个能够形成二硫键的半胱氨酸残基和/或包含铰链
‑
ch2
‑
ch3 fc结构域。在实施方案中,接头包含源自igg1或igg4例如人igg1或人igg4的铰链
‑
ch2
‑
ch3 fc结构域。在实施方案中,接头包含与seq id no:1、seq id no:2或seq id no:3的氨基酸序列至少95%同一的氨基酸序列。
[0257]
在实施方案中,受试者患有对于包含能够结合pd
‑
1或结合pd
‑
1配体的抗体的治疗响应差或难治性的癌症。
[0258]
在实施方案中,所述癌症在用能够结合pd
‑
1或结合pd
‑
1配体的抗体治疗大约12周后对这种治疗响应差或无响应。
[0259]
在实施方案中,所述抗体能够结合pd
‑
1或pd
‑
1配体。能够结合pd
‑
1或pd
‑
1配体的说明性抗体包括纳武单抗(ono 4538,bms 936558,mdx1106,opdivo(bristol myers squibb))、派姆单抗(keytruda/mk 3475,merck)和西米普利单抗((regn
‑
2810)。这种抗体
能够抑制pd
‑
1与其一种或多种配体的相互作用。
[0260]
在实施方案中,癌症是适合用能够结合pd
‑
1或pd
‑
1配体的抗体治疗的癌症。能够结合pd
‑
1或pd
‑
1配体的说明性抗体包括纳武单抗(ono 4538,bms 936558,mdx1106,opdivo(bristol myers squibb))、派姆单抗(keytruda/mk 3475,merck)和西米普利单抗((regn
‑
2810)。这种抗体部分地通过抑制pd
‑
1与其一种或多种配体的相互作用而有助于癌症治疗。
[0261]
药物组合物
[0262]
本发明的方法包括施用药物组合物,所述药物组合物包含治疗有效量的在如本文所公开的本发明的方法中使用的针对免疫检查点分子的抗体和/或sting激动剂和嵌合蛋白。
[0263]
在本文所公开的本发明的方法中使用的针对免疫检查点分子的抗体;sting激动剂;和/或嵌合蛋白可具有可与无机或有机酸反应的足够碱性的官能团,或可与无机碱或有机碱反应的羧基,以形成药学上可接受的盐。如本领域众所周知的,药学上可接受的酸加成盐由药学上可接受的酸形成。此类盐包括例如在journal of pharmaceutical science,66,2
‑
19(1977)和the handbook of pharmaceutical salts;properties,selection,and use.p.h.stahl和c.g.wermuth(编著),verlag,zurich(switzerland)2002中列出的药学上可接受的盐,所述文献特此以引用的方式整体并入。
[0264]
在实施方案中,本文公开的组合物呈药学上可接受的盐的形式。
[0265]
此外,在本文所公开的本发明的方法中使用的针对免疫检查点分子的任何抗体;sting激动剂;和/或嵌合蛋白可作为包含药学上可接受的载体或媒介物的组合物,例如药物组合物的组分施用于受试者。此类药物组合物可任选地包含适合的量的药学上可接受的赋形剂以便提供用于适当施用的形式。药物赋形剂可为液体,如水和油,包括石油、动物、植物或者合成来源的那些,如花生油、大豆油、矿物油、芝麻油等。药物赋形剂可例如是盐水、阿拉伯树胶、明胶、淀粉糊、滑石、角蛋白、硅胶、尿素等。此外,可使用助剂、稳定剂、增稠剂、润滑剂和着色剂。在实施方案中,当施用给受试者时,药学上可接受的赋形剂是无菌的。当静脉内施用本文公开的任何剂时,水是有用的赋形剂。盐溶液和葡萄糖水溶液以及甘油溶液也可用作液体赋形剂,特别是对于可注射的溶液。适合的药物赋形剂还包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、大米、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石、氯化钠、脱脂乳粉、甘油、丙烯、乙二醇、水,乙醇等。如果需要,本文公开的任何剂还可包含少量的润湿剂或乳化剂或ph缓冲剂。
[0266]
在实施方案中,将本文公开的组合物,例如药物组合物重悬于盐水缓冲液(包括但不限于tbs、pbs等)中。
[0267]
在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白可通过与另一种剂缀合和/或融合来延长半衰期或以其他方式改善药效学和药代动力学性质。在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体、sting激动剂和/或嵌合蛋白可与peg、xten(例如,作为rpeg)、聚唾液酸(polyxen)、白蛋白(例如,人血清白蛋白或has)、弹性蛋白样蛋白(elp)、pas、hap、glk、ctp、转铁蛋白等中的一者或多者融合或缀合。在实施方案中,每种单独的嵌合蛋白与biodrugs(2015)29:215
–
239中描述的一种或多种剂融合,所述文献的全部内容特此以引用的方式并入。
[0268]
本发明包括呈药物组合物的各种制剂形式的在本发明的方法中使用的针对免疫
检查点分子的抗体、sting激动剂和/或嵌合蛋白。在本文所公开的本发明的方法中使用的针对免疫检查点分子的任何抗体;sting激动剂;和/或嵌合蛋白可采取溶液、悬浮液、乳液、滴剂、片剂、丸剂、小丸、胶囊、含液体的胶囊、粉末剂、持续释放制剂、栓剂、乳液、气雾剂、喷雾剂、悬浮液的形式,或任何其他适合使用的形式。也可使用编码蛋白质序列的dna或rna构建体。在实施方案中,所述组合物呈胶囊的形式(参见例如,美国专利号5,698,155)。合适的药物赋形剂的其他实例描述于remington’s pharmaceutical sciences 1447
‑
1676(alfonso r.gennaro编著,第19版1995)中,所述文献以引用的方式并入本文。
[0269]
必要时,包含在本发明的方法中使用的针对免疫检查点分子的抗体;sting激动剂;和/或嵌合蛋白的药物组合物还可包含增溶剂。此外,可用本领域已知的合适的媒介物或递送装置来递送剂。本文概述的组合疗法可在单一递送媒介物或递送装置中共同递送。用于施用的组合物可任选地包含局部麻醉剂,例如像利多卡因,以减轻注射部位的疼痛。
[0270]
包含在本发明的方法中使用的针对免疫检查点分子的抗体;sting激动剂;和/或嵌合蛋白的药物组合物可方便地以单位剂型存在,并且可通过药学领域公知的任何方法来制备。此类方法一般包括将治疗剂结合于由一种或多种附加成分所构成的载体的步骤。通常,通过将治疗剂与液体载体、细分的固体载体或两者均匀且紧密地结合在一起,然后如果需要,将产品成型为所需制剂的剂型(例如,湿或干法制粒、粉末共混物等,然后使用本领域已知的常规方法压片)来制备药物组合物。
[0271]
在实施方案中,在本文所公开的本发明的方法中使用的针对免疫检查点分子的任何抗体;sting激动剂;和/或嵌合蛋白根据常规程序配制为适合于本文所公开的施用模式的药物组合物。
[0272]
施用、给药和治疗方案
[0273]
作为实例,施用使得在本文公开的本发明的方法中使用的针对免疫检查点分子的抗体;sting激动剂;和/或嵌合蛋白释放到血流中,或者在本发明的方法中使用的针对免疫检查点分子的抗体;sting激动剂;和/或嵌合蛋白直接施用至活动性疾病的部位。
[0274]
在本发明的方法中使用的针对免疫检查点分子的任何抗体;sting激动剂;和/或嵌合蛋白也可通过任何方便的途径施用,例如通过静脉内输注或快速浓注。施用可以是全身性的,或者可以是局部的(例如,肿瘤内注射)。不同递送系统是已知的,例如包封在脂质体、微粒、微胶囊、胶囊等中,并且可用于施用剂。
[0275]
在具体实施方案中,向需要治疗的区域局部施用可为希望的。在实施方案中,例如在癌症的治疗中,在本发明的方法中使用的针对免疫检查点分子的抗体;sting激动剂;和/或嵌合蛋白施用在肿瘤微环境(例如,围绕和/或喂养肿瘤细胞的细胞、分子、细胞外基质和/或血管,包括例如肿瘤血管系统;肿瘤浸润淋巴细胞;成纤维细胞网状细胞;内皮祖细胞(epc);癌症相关的成纤维细胞;周细胞;其他基质细胞;细胞外基质(ecm)的组分;树突细胞;抗原呈递细胞;t细胞;调控性t细胞;巨噬细胞;嗜中性粒细胞;以及位于肿瘤近端的其他免疫细胞)或淋巴结中和/或靶向肿瘤微环境或淋巴结。在实施方案中,例如在癌症的治疗中,在本发明的方法中使用的针对免疫检查点分子的抗体;sting激动剂;和/或嵌合蛋白通过肿瘤内施用。
[0276]
在实施方案中,在本发明的方法中使用的针对免疫检查点分子的抗体;sting激动剂;和/或嵌合蛋白允许双重作用,其与常规免疫疗法(例如,用opdivo、keytruda、yervoy和
tecentriq中的一者或多者进行治疗)情况下观察到的相比提供较少副作用。例如,在本发明的方法中使用的针对免疫检查点分子的抗体;sting激动剂;和/或嵌合蛋白减少或预防通常观察到的免疫相关的不良事件,所述不良事件影响各种组织和器官,包括皮肤、胃肠道、肾脏、外周和中枢神经系统、肝脏、淋巴结、眼睛、胰腺和内分泌系统;如垂体炎、结肠炎、肝炎、肺炎、皮疹和风湿病。此外,本发明的局部施用(例如肿瘤内)消除了用于常规免疫疗法(例如,用opdivo、keytruda、yervoy和tecentriq中的一者或多者进行治疗)的标准全身施用(例如iv输注)情况下所观察到的不良事件。
[0277]
剂型包括例如溶液、悬浮液、分散液、乳液等。它们也可以无菌固体组合物(例如冻干组合物)的形式制造,所述无菌固体组合物可在使用前立即溶解或悬浮于无菌可注射介质中。它们可含有例如本领域已知的悬浮剂或分散剂。
[0278]
在本文公开的本发明的方法中使用的针对免疫检查点分子的任何抗体;sting激动剂;和/或嵌合蛋白的剂量以及给药时间表可取决于各种参数,包括但不限于所治疗的疾病、疾患的严重程度、疾患是待治疗或还是待预防、待治疗受试者的年龄、体重、性别、医学状况和健康状况、受试者的肾或肝功能、所使用的本发明的特定化合物、施用途径和施用医师的判断。另外,关于特定受试者的药物基因组学(基因型对治疗剂的药物动力学、药效学或功效分布的影响)信息可影响所用剂量和剂量方案。此外,可根据多种因素稍微调整精确的单个剂量和给药时间表,所述因素包括所施用的剂的特定组合、施用时间、施用途径、制剂的性质、排泄速率、所治疗的特定疾病、病症的严重程度以及病症的解剖学位置。可预期一些剂量的变化。
[0279]
在另一个实施方案中,递送可为小囊,特别地为脂质体(参见langer,1990,science 249:1527
‑
1533;treat等人,于liposomes in therapy of infectious disease and cancer,lopez
‑
berestein and fidler(编辑),liss,new york,第353
‑
365页(1989)中。
[0280]
在本文所公开的本发明的方法中使用的针对免疫检查点分子的抗体;sting激动剂;和/或嵌合蛋白可通过受控释放或持续释放方式或通过本领域普通技术人员熟知的递送装置来施用。实例包括但不限于美国专利号3,845,770;3,916,899;3,536,809;3,598,123;4,008,719;5,674,533;5,059,595;5,591,767;5,120,548;5,073,543;5,639,476;5,354,556;和5,733,556中描述的那些,所述专利各自以引用的方式整体并入本文。此类剂型可适用于使用例如羟丙基纤维素、其它聚合物基质、凝胶、可渗透性膜、渗透系统、多层包衣、微粒、脂质体、微球体或其组合来提供一种或多种活性成分的控制或持续释放,从而以不同比例提供所需的释放曲线。可通过不同条件刺激活性成分的控制或持续释放,所述条件包括但不限于ph的变化、温度的变化、经由适当波长的光的刺激、酶的浓度或利用度、水的浓度或利用度或其它生理学条件或化合物。
[0281]
在另一个实施方案中,可使用聚合材料(参见,medical applications of controlled release,langer和wise(编辑),crc pres.,boca raton,florida(1974);controlled drug bioavailability,drug product design and performance,smolen和ball(编辑),wiley,new york(1984);ranger和peppas,1983,j.macromol.sci.rev.macromol.chem.23:61;还参见levy等人,1985,science 228:190;during等人,1989,ann.neurol.25:351;howard等人,1989,j.neurosurg.71:105)。
[0282]
在另一个实施方案中,受控释放系统可邻近待治疗的靶标区域放置,由此仅需要全身剂量的一部分(参见例如,goodson,medical applications of controlled release,同上,第2卷,第115
‑
138页(1984))。可使用在langer,1990,science 249:1527
‑
1533)的综述中讨论的其它受控释放系统。
[0283]
此外,在本文所公开的本发明的方法中使用的针对免疫检查点分子的任何抗体;sting激动剂;和/或嵌合蛋白可在整个剂量方案中连续地而不是间歇地施用。
[0284]
融合蛋白、核酸和细胞
[0285]
在本发明的方法中使用的嵌合蛋白可以是重组融合蛋白,例如具有本文公开的细胞外结构域的单个多肽。例如,在实施方案中,嵌合蛋白在原核细胞、真核细胞或无细胞表达系统中作为单个单元翻译。
[0286]
在实施方案中,嵌合蛋白是包含多个多肽,例如本文公开的多个细胞外结构域的重组蛋白,所述多肽组合(经由共价或非共价键合)以例如在体外产生单个单元(例如具有本文公开的一个或多个合成接头)。
[0287]
在实施方案中,嵌合蛋白被化学合成为一个多肽,或者每个结构域可单独地化学合成且然后组合。在实施方案中,嵌合蛋白的一部分是翻译的并且一部分是化学合成的。
[0288]
可通过将编码三个片段(i型跨膜蛋白的细胞外结构域,然后是接头序列,然后是ii型跨膜蛋白的细胞外结构域)的核酸克隆到载体(质粒、病毒或其他)来产生构建体,其中完整序列的氨基末端对应于含有i型跨膜蛋白的细胞外结构域的分子的“左侧”,并且完整序列的羧基末端对应于含有ii型跨膜蛋白的细胞外结构域的分子的“右侧”。在实施方案中,在如本文其他地方所述的具有其他构型之一的嵌合蛋白中,构建体将包含三种核酸,以使得所产生的翻译的嵌合蛋白将具有所需的构型,例如双重面向内的嵌合蛋白。因此,在实施方案中,对在本发明的方法中使用的嵌合蛋白如此进行工程化。
[0289]
在本发明的方法使用的嵌合蛋白可由克隆到表达载体中的核酸编码。在实施方案中,表达载体包含dna或rna。在实施方案中,表达载体是哺乳动物表达载体。
[0290]
原核载体和真核载体两者均可用于表达嵌合蛋白。原核载体包括基于大肠杆菌序列的构建体(参见例如,makrides,microbiol rev 1996,60:512
‑
538)。可用于在大肠杆菌中表达的调控区的非限制性实例包括lac、trp、lpp、phoa、reca、tac、t3、t7和λp
l
。原核表达载体的非限制性实例可包括λgt载体系列,如λgt11(huynh等人,于“dna cloning techniques,第i卷:a practical approach,”1984,(d.glover,编辑),第49
‑
78页,irl press,oxford)和pet载体系列(studier等人,methods enzymol 1990,185:60
‑
89)。然而,原核宿主
‑
载体系统无法完成哺乳动物细胞的大部分翻译后加工。因此,真核宿主
‑
载体系统可特别有用。多种调控区可用于在哺乳动物宿主细胞中表达嵌合蛋白。例如,可使用sv40早期和晚期启动子、巨细胞病毒(cmv)立即早期启动子和劳斯肉瘤病毒长末端重复序列(rsv
‑
ltr)启动子。可适用于哺乳动物细胞中的诱导型启动子包括但不限于与金属硫蛋白ii基因、小鼠乳腺肿瘤病毒糖皮质激素响应性长末端重复序列(mmtv
‑
ltr)、β
‑
干扰素基因和hsp70基因相关的启动子(参见,williams等人,cancer res 1989,49:2735
‑
42;和taylor等人,mol cell biol 1990,10:165
‑
75)。热休克启动子或应激启动子也可有利于驱动嵌合蛋白在重组宿主细胞中的表达。
[0291]
在实施方案中,表达载体包含编码与在哺乳动物细胞中起作用的表达控制区或其
补体可操作连接的嵌合蛋白或其补体的核酸。表达控制区能够驱动可操作地连接的阻断剂和/或刺激剂编码核酸的表达,以使得所述阻断剂和/或刺激剂在用所述表达载体转化的人细胞中产生。
[0292]
在实施方案中,在本发明的方法中使用的嵌合蛋白在哺乳动物宿主细胞中可产生为可分泌的和完全功能性的单一多肽链。
[0293]
表达控制区是影响可操作地连接的核酸的表达的调控性聚核苷酸(在本文中有时称为元件),如启动子和增强子。本发明表达载体的表达控制区能够使可操作地连接的编码核酸在人细胞中表达。在实施方案中,细胞是肿瘤细胞。在另一个实施方案中,细胞是非肿瘤细胞。在实施方案中,表达控制区使得可操作地连接的核酸的表达可调节。信号(有时称为刺激物)可增加或减少可操作地连接于这种表达控制区的核酸的表达。响应于信号增加表达的此类表达控制区通常称为诱导型。响应于信号减少表达的此类表达控制区通常称为阻遏型。通常,由此类元件赋予的增加或减少的量与所存在信号的量成比例;信号量越大,表达增加或减少越多。
[0294]
在实施方案中,本发明设想使用能够瞬时响应于线索实现高水平表达的诱导型启动子。例如,当与肿瘤细胞接近时,通过使转化细胞暴露于适当线索诱导用包含这种表达控制序列的嵌合蛋白的表达载体转化的细胞瞬时产生高水平的所述剂。说明性诱导型表达控制区包括包含用线索(如小分子化合物)刺激的诱导型启动子的那些诱导型表达控制区。在其他实例中,嵌合蛋白由含有嵌合抗原受体的细胞或体外扩增的肿瘤浸润淋巴细胞在对细胞识别抗原敏感的启动子的控制下表达,并导致嵌合蛋白响应于肿瘤抗原识别的局部分泌。特定实例可见于例如美国专利号5,989,910、5,935,934、6,015,709和6,004,941中,所述专利各自以引用的方式整体并入本文。
[0295]
表达控制区和基因座控制区包括全长启动子序列,如天然启动子和增强子元件,以及保留全部或部分全长或非变异型功能的子序列或聚核苷酸变体。如本文所用,术语“功能性”及其语法变体当在提及核酸序列、子序列或片段的情况下使用时,意指所述序列具有天然核酸序列(例如非变异型或未修饰序列)的一种或多种功能。
[0296]
如本文所用,“可操作地连接”是指所述组分的物理并置关系允许其以预定方式起作用。在表达控制元件与核酸可操作地连接的实例中,所述关系使得控制元件可调节所述核酸的表达。通常,调节转录的表达控制区并置于所转录核酸的5'端附近(即“上游”)。表达控制区还可位于所转录序列的3’端(即“下游”)或在转录物内(例如在内含子中)。表达控制元件可位于距所转录序列一定距离处(例如距所述核酸100至500、500至1000、2000至5000或更多个核苷酸)。表达控制元件的特定实例是启动子,其通常位于所转录序列的5'。表达控制元件的另一实例是增强子,其可位于所转录序列的5'或3',或在所转录序列内部。
[0297]
在人细胞中具有功能性的表达系统在本领域中是已知的,并且包括病毒系统。一般来说,在人细胞中具有功能性的启动子是能够结合哺乳动物rna聚合酶并起始编码序列下游(3')转录成mrna的任何dna序列。启动子将具有转录起始区,其通常接近编码序列5'端安置,并且tata盒通常位于转录起始位点上游25
‑
30个碱基对处。认为tata盒引导rna聚合酶ii在正确位点开始rna合成。启动子通常还含有上游启动子元件(增强子元件),其通常位于tata盒上游100至200个碱基对以内。上游启动子元件决定转录起始速率并且可以任何取向起作用。来自哺乳动物病毒基因的启动子特别适用作启动子,因为病毒基因通常高水平
表达并且具有广泛宿主范围。实例包括sv40早期启动子、小鼠哺乳动物肿瘤病毒ltr启动子、腺病毒主要晚期启动子、单纯疱疹病毒启动子和cmv启动子。
[0298]
通常,由哺乳动物细胞识别的转录终止和聚腺苷酸化序列是位于转录终止密码子3'的调控区并且因此连同启动子元件一起侧接编码序列。成熟mrna的3’末端通过位点特异性翻译后裂解和聚腺苷酸化形成。转录终止子和聚腺苷酸化信号的实例包括来源于sv40的那些。表达构建体中还可包含内含子。
[0299]
存在多种可用于将核酸引入到存活细胞中的技术。适于在体外将核酸转移至哺乳动物细胞中的技术包括使用脂质体、电穿孔、显微注射、细胞融合、基于聚合物的系统、deae
‑
葡聚糖、病毒转导、磷酸钙沉淀法等。对于体内基因转移,也可使用多种技术和试剂,包括脂质体;基于天然聚合物的递送媒介物,如壳聚糖和明胶;病毒载体也适用于体内转导。在一些情况下,希望提供靶向剂,如对于肿瘤细胞表面膜蛋白具有特异性的抗体或配体。在采用脂质体的情况下,结合至与内吞作用相关的细胞表面膜蛋白的蛋白质可用于靶向和/或促进摄取,例如对于特定细胞类型具有趋向性的衣壳蛋白或其片段、针对在循环中发生内化的蛋白质的抗体、靶向细胞内定位并增强细胞内半衰期的蛋白质。受体介导的内吞作用的技术例如由wu等人,j.biol.chem.262,4429
‑
4432(1987);和wagner等人,proc.natl.acad.sci.usa 87,3410
‑
3414(1990)描述。
[0300]
在适当情况下,也可采用基因递送因子,诸如,例如整合序列。众多整合序列在本领域中是已知的(参见例如,nunes
‑
duby等人,nucleic acids res.26:391
‑
406,1998;sadwoski,j.bacteriol.,165:341
‑
357,1986;bestor,cell,122(3):322
‑
325,2005;plasterk等人,tig 15:326
‑
332,1999;kootstra等人,ann.rev.pharm.toxicol.,43:413
‑
439,2003)。这些包括重组酶和转座酶。实例包括cre(sternberg和hamilton,j.mol.biol.,150:467
‑
486,1981)、λ(nash,nature,247,543
‑
545,1974)、fip(broach,等人,cell,29:227
‑
234,1982)、r(matsuzaki,等人,j.bacteriology,172:610
‑
618,1990)、cpc31(参见例如,groth等人,j.mol.biol.335:667
‑
678,2004)、睡美人、水手家族的转座酶(plasterk等人,同上)和整合型病毒的组分,如具有可供病毒整合的组分的aav、逆转录病毒和抗病毒,如逆转录病毒或慢病毒的ltr序列和aav的itr序列(kootstra等人,ann.rev.pharm.toxicol.,43:413
‑
439,2003)。另外,直接和靶向遗传整合策略可用于插入编码嵌合融合蛋白的核酸序列,包括crispr/cas9、锌指、talen和大范围核酸酶基因编辑技术。
[0301]
在实施方案中,用于表达嵌合蛋白的表达载体是病毒载体。已知许多适用于基因疗法的病毒载体(参见例如,lundstrom,trends biotechnol.,21:1 17,122,2003。说明性的病毒载体包括选自抗病毒(lv)、逆转录病毒(rv)、腺病毒(av)、腺相关病毒(aav)和α病毒的那些载体,不过也可使用其它病毒载体。对于体内用途,不整合到宿主基因组中的病毒载体是适合使用的,如α病毒和腺病毒。α病毒的说明性类型包括辛德毕斯病毒、委内瑞拉马脑炎(vee)病毒和塞姆利基森林病毒(sfv)。对于体外使用,整合到宿主基因组中的病毒载体是合适的,如逆转录病毒、aav和抗病毒。在实施方案中,本发明提供体内转导人细胞的方法,所述方法包括在体内使实体瘤与本发明的病毒载体接触。
[0302]
可将表达载体引入宿主细胞中以产生用于本发明方法中的嵌合蛋白。例如,细胞可在体外培养或进行遗传工程化。有用的哺乳动物宿主细胞包括但不限于源自人、猴和啮
齿动物的细胞(参见例如,kriegler于“gene transfer and expression:a laboratory manual,”1990,new york,freeman&co.中)。这些包括被sv40转化的猴肾细胞系(例如,cos
‑
7,atcc crl 1651);人胚胎肾系(例如,293,293
‑
ebna或被亚克隆以在悬浮培养中生长的293细胞,graham等人,j gen virol 1977,36:59);幼仓鼠肾细胞(例如,bhk,atcc ccl 10);中国仓鼠卵巢细胞dhfr(例如,cho,urlaub和chasin,proc natl acad sci usa 1980,77:4216);dg44 cho细胞、cho
‑
k1细胞、小鼠支持细胞(mather,biol reprod 1980,23:243
‑
251);小鼠成纤维细胞(例如,nih
‑
3t3);猴肾细胞(例如,cv1 atcc ccl 70);非洲绿猴肾细胞(例如,vero
‑
76,atcc crl
‑
1587);人宫颈癌细胞(例如,hela,atcc ccl 2);犬肾细胞(例如,mdck,atcc ccl 34);水牛大鼠肝细胞(例如,brl 3a,atcc crl 1442);人肺细胞(例如,w138,atcc ccl 75);人肝细胞(例如,hep g2,hb 8065);以及小鼠乳腺肿瘤细胞(例如,mmt 060562,atcc ccl51)。用于表达本文公开的嵌合蛋白的说明性癌细胞类型包括小鼠成纤维细胞系nih3t3、小鼠lewis肺癌细胞系llc、小鼠肥大细胞瘤细胞系p815、小鼠淋巴瘤细胞系el4及其卵白蛋白转染子e.g7、小鼠黑素瘤细胞系b16f10、小鼠纤维肉瘤细胞系mc57和人小细胞肺癌细胞系sclc#2和sclc#7。
[0303]
宿主细胞可从正常受试者或受影响的受试者(包括健康人、癌症患者以及患有感染性疾病的患者)、私人实验室储存物、公共培养物保藏中心诸如美国典型培养物保藏中心(atcc)或商业供应商处获得。
[0304]
可用于在体外、离体和/或体内产生用于本发明方法中的嵌合蛋白的细胞包括但不限于上皮细胞、内皮细胞、角质形成细胞、成纤维细胞、肌肉细胞、肝细胞;血细胞,如t淋巴细胞、表达嵌合抗原受体的t细胞、肿瘤浸润淋巴细胞、b淋巴细胞、单核细胞、巨噬细胞、嗜中性粒细胞、嗜酸性粒细胞、巨核细胞、粒细胞;各种干细胞或祖细胞,特别是造血干细胞或祖细胞(例如,如从骨髓获得)、脐带血、外周血和胎儿肝脏。细胞类型的选择取决于所治疗或预防的肿瘤或感染性疾病的类型,并且可由本领域技术人员来确定。
[0305]
含fc的大分子(如单克隆抗体)的产生和纯化已成为标准化过程,产品之间的修改很小。例如,许多含fc的大分子由人胚肾(hek)细胞(或其变体)或中国仓鼠卵巢(cho)细胞(或其变体)产生,或在一些情况下由细菌或合成方法产生。在产生后,由hek或cho细胞分泌的含fc的大分子通过结合至蛋白a柱上进行纯化,然后使用各种方法进行“精修”。一般而言,纯化的含fc的大分子以液体形式储存一段时间,冷冻延长的时间段,或者在一些情况下冻干。在实施方案中,与传统的含fc的大分子相比,本文考虑的嵌合蛋白的产生可具有独特的特征。在某些实例中,可使用特定色谱树脂或使用不依赖于蛋白质a捕获的色谱方法来纯化嵌合蛋白。在实施方案中,可以低聚状态或以多种低聚状态纯化嵌合蛋白,并使用特定方法富集特定低聚状态。不受理论束缚,这些方法可包括用特定缓冲液处理,所述缓冲液包括规定的盐浓度、ph和添加剂组成。在其他实例中,此类方法可包括有利于一种低聚状态而不是另一种低聚状态的治疗。可使用本领域中指定的方法对本文获得的嵌合蛋白进行另外“精修”。在实施方案中,嵌合蛋白是高度稳定的并且能够耐受广泛范围的ph暴露(介于ph 3
‑
12之间),能够耐受大量的冻/融应激(大于3个冻/融循环)并且能够耐受在高温下的长时间孵育(在40摄氏度下超过2周)。在实施方案中,显示嵌合蛋白在此类应激条件下保持完整,没有降解、脱酰胺等的迹象。
[0306]
受试者和/或动物
[0307]
在实施方案中,受试者和/或动物是哺乳动物,例如人、小鼠、大鼠、豚鼠、狗、猫、马、牛、猪、兔、绵羊或非人灵长类动物,如猴子、黑猩猩或狒狒。在实施方案中,受试者和/或动物是非哺乳动物,例如像斑马鱼。在实施方案中,受试者和/或动物可包含(例如,用gfp)荧光标记的细胞。在实施方案中,受试者和/或动物是转基因动物,其包含荧光细胞。
[0308]
在实施方案中,受试者和/或动物是人。在实施方案中,人是儿科人。在实施方案中,人是成年人。在实施方案中,人是老年人。在实施方案中,人可被称为患者。
[0309]
在某些实施方案中,人的年龄在约0个月至约6个月、约6至约12个月、约6至约18个月、约18至约36个月、约1至约5岁、约5至约10岁、约10至约15岁、约15至约20岁、约20至约25岁、约25至约30岁、约30至约35岁、约35至约40岁、约40至约45岁、约45至约50岁、约50至约55岁、约55至约60岁、约60至约65岁、约65至约70岁、约70至约75岁、约75至约80岁、约80至约85岁、约85至约90岁、约90至约95岁大或约95至约100岁的范围内。
[0310]
在实施方案中,受试者是非人动物,并且因此本发明涉及兽医用途。在具体实施方案中,非人动物是家养宠物。在另一个具体实施方案中,非人动物是家畜动物。
[0311]
在实施方案中,受试者患有对于包含能够结合pd
‑
1或结合pd
‑
1配体的抗体的治疗响应差或难治性的癌症。在实施方案中,受试者患有在用能够结合pd
‑
1或结合pd
‑
1配体的抗体治疗大约12周后对这种治疗响应差或无响应的癌症。
[0312]
药盒和药物
[0313]
本发明的方面提供了可简化本文所公开的药物组合物和/或嵌合蛋白的施用的药盒。
[0314]
本发明的说明性药盒包括在本文所公开的本发明的方法中使用的针对免疫检查点分子的任何抗体;sting激动剂;和/或嵌合蛋白,和/或呈单位剂型的本文所公开的药物组合物。在实施方案中,单位剂型是容器,如可以是无菌的预填充注射器,其含有本文公开的任何剂和药学上可接受的载体、稀释剂、赋形剂或媒介物。药盒还可包括指示使用本文公开的任何剂的标签或印刷说明书。药盒还可包括眼睑窥器、局部麻醉剂和用于施用位置的清洁剂。在实施方案中,药盒包括含有有效量的本发明的组合物和有效量的另一种组合物(如本文公开的那些)的容器。
[0315]
本发明的方面包括如本文公开的嵌合蛋白在制造药物,例如用于治疗癌症和/或治疗炎症性疾病的药物中的用途。
[0316]
选择治疗的受试者和评估癌症治疗的功效的方法
[0317]
在一个方面,本公开涉及用于评估癌症治疗在有需要的受试者中的功效的方法,其中所述受试者患有癌症,所述方法包括以下步骤:(i)向所述受试者提供包含异源嵌合蛋白的药物组合物,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体,(b)第二结构域,所述第二结构域包含ox40l的细胞外结构域的一部分,其中所述部分能够结合ox40l受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;(ii)从所述受试者获得生物样品;(iii)对所述生物样品进行测定以测定单核细胞的水平和/或活性;以及(iv)如果所述受试者的cd4
t细胞、cd8
t细胞和/或nkp46
nk细胞的水平和/或活性增加,则继续施用所述异源嵌合蛋白。
[0318]
在一个方面,本公开涉及用于评估癌症治疗在有需要的受试者中的功效的方法,
其中所述受试者患有癌症,所述方法包括以下步骤:(i)向所述受试者提供药物组合物,所述药物组合物包含(a)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体,(b)第二结构域,所述第二结构域包含ox40l的细胞外结构域的一部分,其中所述部分能够结合ox40l受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;以及(b)抗免疫检查点抗体;(ii)从所述受试者获得生物样品;(iii)对所述生物样品进行测定以测定单核细胞的水平和/或活性;以及(iv)如果所述受试者的cd4
t细胞、cd8
t细胞和/或nkp46
nk细胞的水平和/或活性增加,则继续施用所述异源嵌合蛋白。
[0319]
在一个方面,本公开涉及选择用癌症的疗法治疗的受试者的方法,所述方法包括以下步骤:(i)向所述受试者提供包含异源嵌合蛋白的药物组合物,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体,(b)第二结构域,所述第二结构域包含ox40l的细胞外结构域的一部分,其中所述部分能够结合ox40l受体,(c)接头,所述接头连接所述第一结构域和所述第二结构域;(ii)从所述受试者获得生物样品;(iii)对所述生物样品进行测定以测定单核细胞的水平和/或活性;以及(iv)如果所述受试者的cd4
t细胞、cd8
t细胞和/或nkp46
nk细胞的水平和/或活性增加,则选择所述受试者用于用癌症的疗法进行治疗。
[0320]
在一个方面,本公开涉及选择用癌症的疗法治疗的受试者的方法,所述方法包括以下步骤:(i)向所述受试者提供药物组合物,所述药物组合物包含(a)异源嵌合蛋白,所述异源嵌合蛋白包含:(a)第一结构域,所述第一结构域包含具有ig和itim结构域的t细胞免疫受体(tigit)的细胞外结构域的一部分,其中所述部分能够结合tigit配体,(b)第二结构域,所述第二结构域包含ox40l的细胞外结构域的一部分,其中所述部分能够结合ox40l受体,和(c)接头,所述接头连接所述第一结构域和所述第二结构域;以及(b)任选地,抗免疫检查点抗体;(ii)从所述受试者获得生物样品;(iii)对所述生物样品进行测定以测定单核细胞的水平和/或活性;以及(iv)如果所述受试者的cd4
t细胞、cd8
t细胞和/或nkp46
nk细胞的水平和/或活性增加,则选择所述受试者用于用癌症的疗法进行治疗。
[0321]
在一些实施方案中,与阴性对照相比,cd4
t细胞、cd8
t细胞和/或nkp46
nk细胞的水平和/或活性的增加以至少约0.1
×
、约0.2
×
、约0.3
×
、约0.4
×
、约0.5
×
、约0.6
×
、约0.7
×
、约0.8
×
、约0.9
×
、约1
×
、约1.1
×
、约1.2
×
、约1.3
×
、约1.4
×
、约1.5
×
、约1.6
×
、约1.7
×
、约1.8
×
、约1.9
×
、约2
×
、约2.1
×
、约2.2
×
、约2.3
×
、约2.4
×
、约2.5
×
、约2.6
×
、约2.7
×
、约2.8
×
、约2.9
×
、约3
×
、约3.1
×
、约3.2
×
、约3.3
×
、约3.4
×
、约3.5
×
、约3.6
×
、约3.7
×
、约3.8
×
、约3.9
×
、约4
×
、约4.1
×
、约4.2
×
、约4.3
×
、约4.4
×
、约4.5
×
、约4.6
×
、约4.7
×
、约4.8
×
、约4.9
×
、约5
×
、约5.1
×
、约5.2
×
、约5.3
×
、约5.4
×
、约5.5
×
、约5.6
×
、约5.7
×
、约5.8
×
、约5.9
×
、约6
×
、约6.1
×
、约6.2
×
、约6.3
×
、约6.4
×
、约6.5
×
、约6.6
×
、约6.7
×
、约6.8
×
、约6.9
×
、约7
×
、约7.1
×
、约7.2
×
、约7.3
×
、约7.4
×
、约7.5
×
、约7.6
×
、约7.7
×
、约7.8
×
、约7.9
×
、约8
×
、约8.1
×
、约8.2
×
、约8.3
×
、约8.4
×
、约8.5
×
、约8.6
×
、约8.7
×
、约8.8
×
、约8.9
×
、约9
×
、约9.1
×
、约9.2
×
、约9.3
×
、约9.4
×
、约9.5
×
、约9.6
×
、约9.7
×
、约9.8
×
、约9.9
×
或约10
×
的倍数发生。
[0322]
在一些实施方案中,与阳性对照中的细胞因子的水平和/或活性相比计算所述增
加。在一些实施方案中,阳性对照包含细胞因子。在一些实施方案中,阳性对照包括在经历炎症应答的个体中发现的细胞因子的水平。
[0323]
此外或可替代地,在一些实施方案中,受试者的至少一种细胞因子的水平和/或活性降低,所述细胞因子选自ifnγ、ifnα、il
‑
27、ccl2、ccl3、ccl4、il
‑
2、tnfα和il
‑
18。在一些实施方案中,在向受试者施用嵌合蛋白的剂量之前,与所述受试者中另一生物样品中的细胞因子的水平和/或活性相比计算所述降低。在一些实施方案中,与来自未施用嵌合蛋白的剂量的不同受试者的另一生物样品中的细胞因子的水平和/或活性相比计算所述降低。在一些实施方案中,与阴性对照中的细胞因子的水平和/或活性相比计算所述降低。在一些实施方案中,阴性对照不含细胞因子。在一些实施方案中,阴性对照含有在未经历炎症应答的个体中发现的细胞因子的水平。在一些实施方案中,与阴性对照相比,所述降低以至少约0.1
×
、约0.2
×
、约0.3
×
、约0.4
×
、约0.5
×
、约0.6
×
、约0.7
×
、约0.8
×
、约0.9
×
、约1
×
、约1.1
×
、约1.2
×
、约1.3
×
、约1.4
×
、约1.5
×
、约1.6
×
、约1.7
×
、约1.8
×
、约1.9
×
、约2
×
、约2.1
×
、约2.2
×
、约2.3
×
、约2.4
×
、约2.5
×
、约2.6
×
、约2.7
×
、约2.8
×
、约2.9
×
、约3
×
、约3.1
×
、约3.2
×
、约3.3
×
、约3.4
×
、约3.5
×
、约3.6
×
、约3.7
×
、约3.8
×
、约3.9
×
、约4
×
、约4.1
×
、约4.2
×
、约4.3
×
、约4.4
×
、约4.5
×
、约4.6
×
、约4.7
×
、约4.8
×
、约4.9
×
、约5
×
、约5.1
×
、约5.2
×
、约5.3
×
、约5.4
×
、约5.5
×
、约5.6
×
、约5.7
×
、约5.8
×
、约5.9
×
、约6
×
、约6.1
×
、约6.2
×
、约6.3
×
、约6.4
×
、约6.5
×
、约6.6
×
、约6.7
×
、约6.8
×
、约6.9
×
、约7
×
、约7.1
×
、约7.2
×
、约7.3
×
、约7.4
×
、约7.5
×
、约7.6
×
、约7.7
×
、约7.8
×
、约7.9
×
、约8
×
、约8.1
×
、约8.2
×
、约8.3
×
、约8.4
×
、约8.5
×
、约8.6
×
、约8.7
×
、约8.8
×
、约8.9
×
、约9
×
、约9.1
×
、约9.2
×
、约9.3
×
、约9.4
×
、约9.5
×
、约9.6
×
、约9.7
×
、约9.8
×
、约9.9
×
或约10
×
的倍数发生。
[0324]
在一些实施方案中,与阳性对照中的细胞因子的水平和/或活性相比计算所述降低。在一些实施方案中,阳性对照包含细胞因子。在一些实施方案中,阳性对照包括在经历炎症应答的个体中发现的细胞因子的水平。
[0325]
在本文公开的任何方面的一些实施方案中,所述癌症选自以下癌症,所述癌症是选自以下的癌症或与选自以下的癌症有关:霍奇金淋巴瘤、非霍奇金淋巴瘤、肾上腺癌、肛门癌、乳腺癌、宫颈癌、胆管癌、结肠直肠癌、子宫内膜癌、食道癌、胃癌、头颈癌、肝细胞癌、黑素瘤、梅克尔细胞癌、非小细胞肺癌、前列腺癌、胰腺癌、肾细胞癌、卵巢癌(包括输卵管癌和腹膜癌)、小细胞肺癌、皮肤鳞状细胞癌、肉瘤、甲状腺癌或尿路上皮癌。
[0326]
在一些实施方案中,生物样品是体液、分离细胞的样品、来自组织或器官的样品、或从受试者的外体或内体表面获得的洗涤/冲洗液样品。在一些实施方案中,生物样品是选自以下的体液:血液、血浆、血清、泪液、眼泪、骨髓、血液、血细胞、腹水、组织或细针活检样品、含有细胞的体液、自由浮动的核酸、痰、唾液、尿、脑脊髓液、腹膜液、胸膜液、粪便、淋巴液、妇科流体、皮肤拭子、阴道拭子、口腔拭子、鼻拭子、洗涤物或灌洗物如导管灌洗物或支气管肺泡灌洗物、抽吸物、刮屑、骨髓样本、组织活检样本、手术样本、粪便、其他体液、分泌物和/或排泄物、和/或来自其的细胞。
[0327]
在一些实施方案中,生物样品是新鲜组织样品、冷冻肿瘤组织样本、培养的细胞、循环肿瘤细胞或福尔马林固定石蜡包埋的肿瘤组织样本。在一些实施方案中,生物样品是选自以下的癌症或与选自以下的癌症有关:霍奇金淋巴瘤、非霍奇金淋巴瘤、肾上腺癌、肛
门癌、乳腺癌、宫颈癌、胆管癌、结肠直肠癌、子宫内膜癌、食道癌、胃癌、头颈癌、肝细胞癌、黑素瘤、梅克尔细胞癌、非小细胞肺癌、前列腺癌、胰腺癌、肾细胞癌、卵巢癌(包括输卵管癌和腹膜癌)、小细胞肺癌、皮肤鳞状细胞癌、肉瘤、甲状腺癌和尿路上皮癌。
[0328]
在一些实施方案中,生物样品通过众所周知的技术获得,所述技术包括但不限于刮擦、拭子或活检。在一些实施方案中,生物样品通过针刺活检获得。在一些实施方案中,生物样品通过选自刮擦、拭子和活检的技术获得。在一些实施方案中,生物样品通过使用刷子、(棉)拭子、刮刀、冲洗液/洗涤液、穿刺活检装置、用针或手术器械穿刺空腔获得。在一些实施方案中,生物样品是或包含从个体获得的细胞。在一些实施方案中,所获得的细胞是或包括来自获得生物样品的个体的细胞。在一些实施方案中,生物样品是通过任何适当手段直接从目标来源获得的“初级样品”。例如,在一些实施方案中,生物样品通过选自由以下组成的组的方法获得:活检(例如,细针抽吸或组织活检)、手术、体液(例如,血液、淋巴、粪便等)的收集。在一些实施方案中,生物样品源自肿瘤、血液、肝脏、泌尿生殖道、口腔、上呼吸消化道、表皮或肛管。应当理解,可进一步加工生物样品以实施本技术的方法。这种“加工的样品”可包括例如从样品提取或通过使初级样品经受诸如扩增或mrna的逆转录、分离和/或纯化某些组分等的技术获得的核酸或蛋白质。
[0329]
在一些实施方案中,cd4
t细胞、cd8
t细胞和/或nkp46
nk细胞的水平和/或活性通过rna测序、免疫组织化学染色、蛋白质印迹、细胞内蛋白质印迹、免疫荧光染色、elisa和流式细胞术或它们的组合来测量。在一些实施方案中,cd4
t细胞、cd8
t细胞和/或nkp46
nk细胞的水平和/或活性通过使样品与特异性地结合至cd4
t细胞、cd8
t细胞和/或nkp46
nk细胞中的一种或多种的剂接触来测量。在一些实施方案中,特异性地结合至cd4
t细胞、cd8
t细胞和/或nkp46
nk细胞中的一种或多种的剂是抗体或其片段。在一些实施方案中,特异性地结合至cd4
t细胞、cd8
t细胞和/或nkp46
nk细胞中的一种或多种的剂是抗体或其片段。在一些实施方案中,抗体是重组抗体、单克隆抗体、多克隆抗体或其片段。在一些实施方案中,抗体对选自t细胞受体、天然细胞毒性受体、cd3、cd4、cd8、cd16、cd30、cd40、cd38、cd57、cd127、nkp46、hla
‑
dr、穿孔素、颗粒酶和颗粒溶素的表面标志物具有特异性。
[0330]
在一些实施方案中,细胞因子的水平和/或活性通过rna测序、免疫组织化学染色、蛋白质印迹、细胞内蛋白质印迹、免疫荧光染色、elisa和流式细胞术中的一种或多种测量。
[0331]
在一些实施方案中,细胞因子的水平和/或活性通过使样品与特异性地结合至一种或多种细胞因子的剂接触来测量。在一些实施方案中,特异性地结合至一种或多种细胞因子的剂是抗体或其片段。在一些实施方案中,抗体是重组抗体、单克隆抗体、多克隆抗体或其片段。在一些实施方案中,抗体对选自t细胞受体、天然细胞毒性受体、cd3、cd4、cd8、cd16、cd30、cd40、cd38、cd57、cd127、nkp46、hla
‑
dr、穿孔素、颗粒酶和颗粒溶素的标志物具有特异性。在一些实施方案中,抗体对肿瘤抗原具有特异性。
[0332]
在一些实施方案中,细胞因子的水平和/或活性通过使样品与特异性地结合至一种或多种核酸的剂接触来测量。在一些实施方案中,特异性地结合至一种或多种核酸的剂是核酸引物或探针。在一些实施方案中,细胞因子选自ifnγ、tnfα、il
‑
2、il
‑
4、il
‑
5、il
‑
6、il
‑
7、il
‑
9、il
‑
10、il
‑
13、il
‑
15、il
‑
17a、il
‑
17f、il
‑
22、ccl2、ccl3、ccl4、cxcl8、cxcl9、cxcl10、cxcl11和cxcl12。
[0333]
在一些实施方案中,评估包括预后或对治疗的响应。在一些实施方案中,评估包括
预后和/或对治疗的响应。在一些实施方案中,评估告知将受试者分类为高风险组或低风险组。在一些实施方案中,高风险分类包括高水平的癌症侵袭性,其中侵袭性的特征在于高肿瘤等级、低总体存活率、高转移概率和指示侵袭性的肿瘤标志物的存在中的一者或多者。在一些实施方案中,低风险分类包括低水平的癌症侵袭性,其中侵袭性的特征在于低肿瘤等级、高总体存活率、低转移概率和指示侵袭性的肿瘤标志物不存在和/或减少中的一者或多者。在一些实施方案中,低风险或高风险分类指示停止新辅助疗法。在一些实施方案中,低风险或高风险分类指示停止辅助疗法。在一些实施方案中,低风险或高风险分类指示继续嵌合蛋白的施用。在一些实施方案中,低风险或高风险分类指示停止嵌合蛋白的施用。在一些实施方案中,低风险或高风险分类指示继续异源嵌合蛋白的施用。在一些实施方案中,低风险或高风险分类指示停止异源嵌合蛋白的施用。在一些实施方案中,评估预测对异源嵌合蛋白的施用的阳性响应和/或受益于异源嵌合蛋白的施用。在一些实施方案中,评估预测对异源嵌合蛋白的施用的阴性或中性响应和/或受益于异源嵌合蛋白的施用。
[0334]
在一些实施方案中,评估预测对嵌合蛋白的施用的阳性响应和/或受益于嵌合蛋白的施用。在一些实施方案中,评估预测对嵌合蛋白的施用的阴性或中性响应和/或受益于嵌合蛋白的施用。在一些实施方案中,评估告知继续施用或停止异源嵌合蛋白的施用。在一些实施方案中,评估告知继续异源嵌合蛋白的施用。在一些实施方案中,评估告知改变异源嵌合蛋白的剂量。在一些实施方案中,评估告知增加异源嵌合蛋白的剂量。在一些实施方案中,评估告知降低异源嵌合蛋白的剂量。在一些实施方案中,评估告知改变异源嵌合蛋白的施用方案。在一些实施方案中,评估告知增加异源嵌合蛋白的施用频率。
[0335]
在一些实施方案中,评估告知新辅助疗法的施用。在一些实施方案中,评估告知辅助疗法的施用。在一些实施方案中,评估告知停止新辅助疗法。在一些实施方案中,评估告知改变新辅助疗法。在一些实施方案中,评估告知改变辅助疗法。在一些实施方案中,评估告知停止辅助疗法。
[0336]
在一些实施方案中,评估预测对新辅助化学疗法的阳性响应和/或受益于新辅助化学疗法或者对新辅助化学疗法无响应和/或没有受益于新辅助化学疗法。在一些实施方案中,评估预测对辅助化学疗法的阳性响应和/或受益于辅助化学疗法或者对辅助化学疗法无响应和/或没有受益于辅助化学疗法。在一些实施方案中,评估预测对新辅助化学疗法的阴性或中性响应和/或受益于新辅助化学疗法或者对新辅助化学疗法无响应和/或没有受益于新辅助化学疗法。在一些实施方案中,评估预测对辅助化学疗法的阴性或中性响应和/或受益于辅助化学疗法或者对辅助化学疗法无响应和/或没有受益于辅助化学疗法。
[0337]
在一些实施方案中,新辅助疗法和/或辅助疗法是化学治疗剂。在一些实施方案中,化学治疗剂选自烷化剂,所述烷化剂选自噻替派和cytoxan环磷酰胺;烷基磺酸酯,所述烷基磺酸酯选自白消安、英丙舒凡和哌泊舒凡;氮杂环丙烷,所述氮杂环丙烷选自苯佐多巴(benzodopa)、卡波醌、米特多巴和尤利多巴;乙烯亚胺和甲基蜜胺,包括六甲蜜胺、三亚乙基蜜胺、三亚乙基磷酰胺、三亚乙基硫代磷酰胺和三羟甲基蜜胺;多聚乙酰(例如布拉他辛和布拉他辛酮);喜树碱(包括合成类似物托泊替康);苔藓抑素;cc
‑
1065(包括其阿多来新、卡折来新和比折来新合成类似物);念珠藻素(例如念珠藻素1和念珠藻素8);尾海兔素;倍癌霉素(包括合成类似物kw
‑
2189和cb1
‑
tm1);艾榴塞洛素(eleutherobin);水鬼蕉碱;匍枝珊瑚醇;海绵抑素(spongistatin);氮芥,所述氮芥选自苯丁酸氮芥、萘氮芥、氯磷酰胺、雌
莫司汀、异环磷酰胺、氮芥、氮芥氧化物盐酸盐、美法仑、新恩比兴、苯芥胆甾醇、泼尼莫司汀、曲磷胺和尿嘧啶氮芥;亚硝基脲,所述亚硝基脲选自卡莫司汀、氯脲霉素、福莫司汀、洛莫司汀、尼莫司汀和雷莫司汀;抗生素,所述抗生素选自烯二炔抗生素(例如,卡奇霉素,尤其卡奇霉素γii和卡奇霉素ωii(参见例如,agnew,chem.intl.ed.engl.,33:183
‑
186(1994));达内霉素,包括达内霉素a;二膦酸盐,所述二膦酸盐选自氯膦酸盐;埃斯培拉霉素;以及新制癌菌素生色团和相关色蛋白烯二炔抗生素生色团)、阿克拉霉素、放线菌素、安曲霉素、重氮丝氨酸、博莱霉素、放线菌素c、卡柔比星、洋红霉素、嗜癌菌素、色霉素、更生霉素、道诺霉素、地托比星、6
‑
重氮基
‑5‑
氧代基
‑
l
‑
正亮氨酸、adriamycin阿霉素(包括吗啉代
‑
阿霉素、氰基吗啉代
‑
阿霉素、2
‑
吡咯啉并
‑
阿霉素和去氧阿霉素)、表柔比星、依索比星、伊达比星、麻西罗霉素、丝裂霉素(选自丝裂霉素c)、霉酚酸、诺拉霉素、橄榄霉素、培洛霉素、泊非霉素、嘌呤霉素、三铁阿霉素、罗多比星、链黑菌素、链佐星、杀结核菌素、乌苯美司、净司他丁、佐柔比星;抗代谢药,所述抗代谢药选自甲氨蝶呤和5
‑
氟尿嘧啶(5
‑
fu);叶酸类似物,所述叶酸类似物选自二甲叶酸、氨甲蝶呤、蝶罗呤、三甲曲沙;嘌呤类似物,所述嘌呤类似物选自氟达拉滨、6
‑
巯基嘌呤、硫咪嘌呤、硫鸟嘌呤;嘧啶类似物,所述嘧啶类似物选自安西他滨、阿扎胞苷、6
‑
氮尿苷、卡莫氟、阿糖胞苷、双去氧尿苷、去氧氟尿苷、依诺他滨、氟尿苷;雄激素,所述雄激素选自卡普睾酮、丙酸屈他雄酮、环硫雄醇、美雄烷、睾内酯;抗肾上腺素药,所述抗肾上腺素药选自氨鲁米特、米托坦、曲洛司坦;叶酸补充剂,所述叶酸补充剂选自亚叶酸;醋葡醛内酯;醛磷酰胺糖苷;氨基乙酰丙酸;恩尿嘧啶;安吖啶;倍曲布西;比生群;依达曲沙(edatraxate);秋水仙胺;地吖醌;依氟鸟氨酸(elformithine);依利醋铵;埃博霉素;依托格鲁;硝酸镓;羟基脲;香菇多糖;氯尼达明(lonidainine);美登木素生物碱,所述美登木素生物碱选自美登素和安丝菌素;米托胍腙;米托蒽醌;莫哌达醇(mopidanmol);二胺硝吖啶(nitraerine);喷司他丁;蛋氨氮芥;吡柔比星;洛索蒽醌;鬼臼酸;2
‑
乙基酰肼;丙卡巴肼;psk多糖复合物(jhs natural products,eugene,oreg.);雷佐生;根霉素(rhizoxin);西佐喃(sizofuran);锗螺胺;细交链孢菌酮酸;三亚胺醌;2,2',2"
‑
三氯三乙胺;单端孢霉烯族毒素(例如t
‑
2毒素、疣孢菌素a(verracurin a)、杆孢菌素a和蛇形菌素(anguidine));乌拉坦;长春地辛;达卡巴嗪;甘露莫司汀;二溴甘露醇;二溴卫矛醇;哌泊溴烷;加西托星(gacytosine);阿糖胞苷(“ara
‑
c”);环磷酰胺;噻替派;紫杉烷类,例如taxol紫杉醇、abraxane无克列莫佛的白蛋白工程化紫杉醇纳米颗粒制剂(american pharmaceutical partners,schaumberg,111.)和taxotere多西他赛(rhone
‑
poulenc rorer,antony,france);苯丁酸氮芥(chloranbucil);gemzar吉西他滨;6
‑
硫鸟嘌呤;巯基嘌呤;氨甲蝶呤;铂类似物,所述铂类似物选自顺铂、奥沙利铂和卡铂;长春花碱;铂;依托泊苷(vp
‑
16);异环磷酰胺;米托蒽醌;长春新碱;navelbine,长春瑞滨;诺安托;替尼泊苷;依达曲沙;道诺霉素;氨蝶呤;希罗达;伊班膦酸盐;伊立替康(camptosar,cpt
‑
11)(包括伊立替康联合5
‑
fu和亚叶酸的治疗方案);拓扑异构酶抑制剂rfs 2000;二氟甲基鸟氨酸(dmfo);类视黄醇,所述类视黄醇选自视黄酸;卡培他滨;康普瑞汀;亚叶酸(lv);奥沙利铂,包括奥沙利铂治疗方案(folfox);拉帕替尼(tykerb);降低细胞增殖的pkc
‑
α、raf、h
‑
ras、egfr(例如埃罗替尼(tarceva))和vegf
‑
a的抑制剂,其药学上可接受的盐、酸或衍生物以及其任何两者或更多者的组合。
[0338]
在一些实施方案中,新辅助疗法和/或辅助疗法是细胞毒性剂。在一些实施方案
中,细胞毒性剂选自甲氨蝶呤、氨基蝶呤、6
‑
巯基嘌呤、6
‑
硫鸟嘌呤、阿糖胞苷、5
‑
氟尿嘧啶达卡巴嗪(5
‑
fluorouracil decarbazine);烷化剂,所述烷化剂选自氮芥、噻替派苯丁酸氮芥、美法仑、卡莫司汀(bsnu)、丝裂霉素c、洛莫司汀(ccnu)、1
‑
甲基亚硝基脲、环磷酰胺(cyclothosphamide)、氮芥、白消安、二溴甘露醇、链脲佐菌素、丝裂霉素c、顺式
‑
二氯二胺铂(ii)(ddp)顺铂和卡铂(paraplatin);蒽环类药物,包括柔红霉素、阿霉素(adriamycin)、地托比星、洋红霉素、伊达比星、表柔比星、米托蒽醌和比生群;抗生素包括更生霉素(放线菌素d)、博莱霉素、卡奇霉素、光神霉素和安曲霉素(amc);以及抗有丝分裂剂,所述抗有丝分裂剂选自长春花生物碱、长春新碱和长春花碱;紫杉醇(taxol);蓖麻毒素;假单胞菌外毒素;吉西他滨、细胞松弛素b、短杆菌肽d、溴化乙锭、吐根碱、依托泊苷、替诺泊苷(tenoposide)、秋水仙碱、二羟基蒽二酮(dihydroxy anthracin dione)、1
‑
去氢睾酮、糖皮质激素、普鲁卡因、丁卡因、利多卡因、普萘洛尔、嘌呤霉素、丙卡巴肼、羟基脲、其药学上可接受的盐、酸或衍生物以及其任何两者或更多者的组合。
[0339]
在一些实施方案中,评估告知降低嵌合蛋白的施用频率。
[0340]
在一些实施方案中,新辅助疗法和/或辅助疗法是检查点抑制剂。在一些实施方案中,检查点抑制剂是靶向以下中的一者或多者的剂:tim
‑
3、btla、ctla
‑
4、b7
‑
h4、gitr、半乳凝素
‑
9、hvem、pd
‑
l1、pd
‑
l2、b7
‑
h3、cd244、cd160、tigit、sirpα、icos、cd172a和tmigd2。
[0341]
本文公开的任何方面或实施方案可与本文公开的任何其他方面或实施方案组合。
[0342]
本发明将在以下实施例中进一步描述,所述实施例不限制权利要求书中所述的本发明范围。
[0343]
实施例
[0344]
提供本文的实施例以说明本技术的优点和益处并进一步帮助本领域普通技术人员实施本技术的治疗癌症的方法。还提供了本文中的实施例以更全面地说明本技术的某些方面。例如,针对免疫检查点分子(例如抗ctla
‑
4和抗pd
‑
1)的抗体与tigit
‑
fc
‑
ox40l嵌合蛋白的特定组合的功能性抗肿瘤活性是说明性实施方案。这些实施例决不应被解释为限制本技术的范围,如所附权利要求书所定义。实施例可包括或结合上述本技术的任何变型、方面或实施方案。上述变型、方面或实施方案还可进一步各自包括或结合本技术的任何或所有其他变型、方面或实施方案的变型。
[0345]
实施例1:抗ctla
‑
4抗体和tigit
‑
fc
‑
ox40l嵌合蛋白的功能性抗肿瘤活性
[0346]
确定了tigit
‑
fc
‑
ox40l嵌合蛋白与抗ctla
‑
4抗体(图3a至图3c)的组合靶向和治疗肿瘤的体内能力。
[0347]
将小鼠接种肿瘤,并用媒介物、抗体、tigit
‑
fc
‑
ox40l嵌合蛋白或tigit
‑
fc
‑
ox40l嵌合蛋白与抗ctla
‑
4抗体的组合进行治疗;在组合中,在所述抗体之前施用tigit
‑
fc
‑
ox40l嵌合蛋白,在所述抗体之后施用tigit
‑
fc
‑
ox40l嵌合蛋白,或与所述抗体一起施用tigit
‑
fc
‑
ox40l嵌合蛋白。关于剂量方案,参见图3a。如图3a所示,比较了以下剂量方案:
[0348]
(1)仅媒介物;
[0349]
(2)αctla抗体(在第7天、第9天和第11天施用);
[0350]
(3)αctla抗体(在第12天、第14天和第16天施用);
[0351]
(4)tigit
‑
fc
‑
ox40l嵌合蛋白(arc,在第7天、第9天和第11天施用);
[0352]
(5)tigit
‑
fc
‑
ox40l嵌合蛋白(arc,在第12天、第14天和第16天施用);
[0353]
(6)αctla抗体与tigit
‑
fc
‑
ox40l嵌合蛋白(arc)的组合,各自在第7天、第9天和第11天施用;
[0354]
(7)αctla抗体与tigit
‑
fc
‑
ox40l嵌合蛋白(arc)的组合,其中αctla抗体在第7天、第9天和第11天施用,并且tigit
‑
fc
‑
ox40l嵌合蛋白在第12天、第14天和第16天施用,以及
[0355]
(8)αctla抗体与tigit
‑
fc
‑
ox40l嵌合蛋白(arc)的组合,其中tigit
‑
fc
‑
ox40l嵌合蛋白在第7天、第9天和第11天施用,并且αctla抗体在第12天、第14天和第16天施用。
[0356]
图3a示出由包含tigit
‑
fc
‑
ox40l嵌合蛋白和/或抗ctla
‑
4抗体的治疗引起的肿瘤大小(即,体积)的变化。图3b示出由包含tigit
‑
fc
‑
ox40l嵌合蛋白和/或抗ctla
‑
4抗体的治疗引起的肿瘤接种后存活天数百分比的卡普兰
‑
迈耶曲线。图3c包括与图3a和图3b的图有关的数据。
[0357]
如中仅媒介物治疗的小鼠所示,显示肿瘤迅速发展且到第21天致死(图3a
‑
3b)。与仅媒介物治疗的小鼠相比,在第12天、第14天和第16天施用αctla抗体的小鼠显示出稍微更慢的肿瘤发展(图3a)和延长的存活期(图3b)。与仅媒介物治疗的小鼠以及在第12天、第14天和第16天用αctla抗体治疗的小鼠相比,在第7天、第9天和第11天施用αctla抗体的小鼠显示出较慢的肿瘤发展(图3a)和延长的存活期(图3b)。
[0358]
与仅媒介物治疗的小鼠相比,在第12天、第14天和第16天施用tigit
‑
fc
‑
ox40l嵌合蛋白抗体的小鼠显示出较慢的肿瘤发展(图3a)和延长的存活期(图3b)。同样,与仅媒介物治疗的小鼠以及在第12天、第14天和第16天用tigit
‑
fc
‑
ox40l嵌合蛋白治疗的小鼠相比,在第7天、第9天和第11天施用tigit
‑
fc
‑
ox40l嵌合蛋白的小鼠显示出较慢的肿瘤发展(图3a)和延长的存活期(图3b)。与给药方案匹配的αctla抗体治疗的小鼠相比,施用tigit
‑
fc
‑
ox40l嵌合蛋白的小鼠显示出较慢的肿瘤发展(图3a)和延长的存活期(图3b)。
[0359]
与经受在第7天、第9天和第11天施用tigit
‑
fc
‑
ox40l和αctla抗体中的任一者的单一疗法的小鼠相比,经受tigit
‑
fc
‑
ox40l和αctla抗体(各自在第7天、第9天和第11天施用)的组合疗法的小鼠显示出较慢的肿瘤发展(图3a)和延长的存活期(图3b)。此外,与经受在第7天、第9天和第11天施用tigit
‑
fc
‑
ox40l和αctla抗体中的任一者的单一疗法的小鼠相比,经受在第7天、第9天和第11天施用tigit
‑
fc
‑
ox40l嵌合蛋白和在第12天、第14天和第16天施用αctla抗体的组合疗法的小鼠显示出较慢的肿瘤发展(图3a)和延长的存活期(图3b)。此外,与经受在第7天、第9天和第11天施用tigit
‑
fc
‑
ox40l和αctla抗体中的任一者的单一疗法的小鼠相比,经受在第7天、第9天和第11天施用αctla抗体和在第12天、第14天和第16天施用tigit
‑
fc
‑
ox40l嵌合蛋白的组合疗法的小鼠显示出较慢的肿瘤发展(图3a)和延长的存活期(图3b)。这些结果表明,与使用αctla抗体和tigit
‑
fc
‑
ox40l异源嵌合蛋白中的任一者的单一疗法相比,αctla抗体和tigit
‑
fc
‑
ox40l异源嵌合蛋白的组合显示出更好的抗肿瘤活性。因此,本技术的αctla抗体和tigit
‑
fc
‑
ox40l异源嵌合蛋白的组合疗法可用于治疗本文公开的癌症的方法。这些结果还证明了αctla抗体和tigit
‑
fc
‑
ox40l异源嵌合蛋白可同时施用或者一者可在另一者之前施用。
[0360]
出人意料地,与经受在第7天、第9天和第11天同时施用tigit
‑
fc
‑
ox40l和αctla抗体的组合疗法的小鼠相比,经受在第7天、第9天和第11天施用tigit
‑
fc
‑
ox40l嵌合蛋白和在第12天、第14天和第16天施用αctla抗体的组合疗法的小鼠显示出显著较慢的肿瘤发展(图3a)和延长的存活期(在第37天约40%存活率,参见图3b)。如图3c所示,这些小鼠表现出
17%的原发性肿瘤排斥和100%的继发性肿瘤排斥。这是出人意料的,因为虽然在第12天、第14天和第16天(在未经另外治疗的小鼠中)施用的αctla抗体与仅媒介物治疗的小鼠相比显示肿瘤生长和存活中的非常轻微的改善(图3a
‑
3b),但αctla抗体在第12天、第14天和第16天施用至已经或正在用tigit
‑
fc
‑
ox40l嵌合蛋白治疗的小鼠时显示出显著抗肿瘤作用。因此,αctla抗体可用于治疗已经进行或正在进行用本技术的tigit
‑
fc
‑
ox40l异源嵌合蛋白治疗的受试者的癌症的方法。
[0361]
出人意料地,与经受在第7天、第9天和第11天同时施用tigit
‑
fc
‑
ox40l和αctla抗体的组合疗法的小鼠相比,经受在第7天、第9天和第11天施用αctla抗体和在第12天、第14天和第16天施用tigit
‑
fc
‑
ox40l嵌合蛋白的组合疗法的小鼠显示出显著较慢的肿瘤发展(图3a)和延长的存活期(在第37天约30%存活率,参见图3b)。如图3c所示,这些小鼠表现出43%的原发性肿瘤排斥和67%的继发性肿瘤排斥。因此,本技术的tigit
‑
fc
‑
ox40l异源嵌合蛋白可用于治疗已经进行或正在进行用αctla抗体治疗的受试者的癌症的方法。
[0362]
实施例2:抗pd
‑
1抗体和tigit
‑
fc
‑
ox40l嵌合蛋白的功能性抗肿瘤活性
[0363]
确定了tigit
‑
fc
‑
ox40l嵌合蛋白与抗pd
‑
1抗体(图4a至图4d)的组合靶向和治疗肿瘤的体内能力。
[0364]
将小鼠接种肿瘤,并用媒介物、抗体、tigit
‑
fc
‑
ox40l嵌合蛋白或tigit
‑
fc
‑
ox40l嵌合蛋白与抗pd
‑
1抗体的组合进行治疗;在组合中,在所述抗体之前施用tigit
‑
fc
‑
ox40l嵌合蛋白,在所述抗体之后施用tigit
‑
fc
‑
ox40l嵌合蛋白,或与所述抗体一起施用tigit
‑
fc
‑
ox40l嵌合蛋白。如图4a所示,比较了以下剂量方案:
[0365]
(1)仅媒介物;
[0366]
(2)αpd
‑
1抗体(在第7天、第9天和第11天施用);
[0367]
(3)αpd
‑
1抗体(在第12天、第14天和第16天施用);
[0368]
(4)tigit
‑
fc
‑
ox40l嵌合蛋白(arc,在第7天、第9天和第11天施用);
[0369]
(5)tigit
‑
fc
‑
ox40l嵌合蛋白(arc,在第12天、第14天和第16天施用);
[0370]
(6)αpd
‑
1抗体与tigit
‑
fc
‑
ox40l嵌合蛋白(arc)的组合,各自在第7天、第9天和第11天施用;
[0371]
(7)αpd
‑
1抗体与tigit
‑
fc
‑
ox40l嵌合蛋白(arc)的组合,其中αpd
‑
1抗体在第7天、第9天和第11天施用,并且tigit
‑
fc
‑
ox40l嵌合蛋白在第12天、第14天和第16天施用,以及
[0372]
(8)αpd
‑
1抗体与tigit
‑
fc
‑
ox40l嵌合蛋白(arc)的组合,其中tigit
‑
fc
‑
ox40l嵌合蛋白在第7天、第9天和第11天施用,并且αpd
‑
1抗体在第12天、第14天和第16天施用。
[0373]
图4a示出由包含tigit
‑
fc
‑
ox40l嵌合蛋白和/或抗ctla
‑
4抗体的治疗引起的肿瘤大小(即,体积)的变化。图4b示出由包含tigit
‑
fc
‑
ox40l嵌合蛋白和/或抗ctla
‑
4抗体的治疗引起的肿瘤接种后存活天数百分比的卡普兰
‑
迈耶曲线。图4c和图4d包括与图4a和图4b的图有关的数据。
[0374]
如中仅媒介物治疗的小鼠所示,显示肿瘤迅速发展且到第21天致死(图4a
‑
4b)。在第12天、第14天和第16天施用αpd
‑
1抗体的小鼠显示出与仅媒介物治疗的小鼠相当的肿瘤发展(图4a)和存活期(图4b)。与仅媒介物治疗的小鼠以及在第12天、第14天和第16天用αpd
‑
1抗体治疗的小鼠相比,在第7天、第9天和第11天施用αpd
‑
1抗体的小鼠显示出较慢的肿瘤发展(图4a)和延长的存活期(图4b)。
[0375]
与仅媒介物治疗的小鼠相比,在第12天、第14天和第16天施用tigit
‑
fc
‑
ox40l嵌合蛋白抗体的小鼠显示出较慢的肿瘤发展(图4a)和延长的存活期(图4b)。同样,与仅媒介物治疗的小鼠以及在第12天、第14天和第16天用tigit
‑
fc
‑
ox40l嵌合蛋白治疗的小鼠相比,在第7天、第9天和第11天施用tigit
‑
fc
‑
ox40l嵌合蛋白的小鼠显示出较慢的肿瘤发展(图4a)和延长的存活期(图4b)。与给药方案匹配的αpd
‑
1抗体治疗的小鼠相比,施用tigit
‑
fc
‑
ox40l嵌合蛋白的小鼠显示出较慢的肿瘤发展(图4a)和延长的存活期(图4b)。
[0376]
令人感兴趣地,与经受在第7天、第9天和第11天施用tigit
‑
fc
‑
ox40l和αpd
‑
1抗体中的任一者的单一疗法的小鼠相比,经受tigit
‑
fc
‑
ox40l和αpd
‑
1抗体(各自在第7天、第9天和第11天施用)的组合疗法的小鼠显示出较慢的肿瘤发展(图4a)和延长的存活期(图4b)。如图4c所示,这些小鼠表现出29%的原发性肿瘤排斥和100%的继发性肿瘤排斥。此外,与经受在第7天、第9天和第11天施用tigit
‑
fc
‑
ox40l和αpd
‑
1抗体中的任一者的单一疗法的小鼠相比,经受在第7天、第9天和第11天施用tigit
‑
fc
‑
ox40l嵌合蛋白和在第12天、第14天和第16天施用αpd
‑
1抗体的组合疗法的小鼠显示出较慢的肿瘤发展(图4a)和延长的存活期(图4b)。此外,与经受在第7天、第9天和第11天施用tigit
‑
fc
‑
ox40l和αpd
‑
1抗体中的任一者的单一疗法的小鼠相比,经受在第7天、第9天和第11天施用αpd
‑
1抗体和在第12天、第14天和第16天施用tigit
‑
fc
‑
ox40l嵌合蛋白的组合疗法的小鼠显示出较慢的肿瘤发展(图4a)和延长的存活期(图4b)。这些结果表明,与使用αpd
‑
1抗体和tigit
‑
fc
‑
ox40l异源嵌合蛋白中的任一者的单一疗法相比,αpd
‑
1抗体和tigit
‑
fc
‑
ox40l异源嵌合蛋白的组合显示出更好的抗肿瘤活性。因此,本技术的αpd
‑
1抗体和tigit
‑
fc
‑
ox40l异源嵌合蛋白的组合疗法可用于治疗本文公开的癌症的方法。这些结果还证明了αpd
‑
1抗体和tigit
‑
fc
‑
ox40l异源嵌合蛋白可同时施用或者一者可在另一者之前施用。
[0377]
出人意料地,与经受tigit
‑
fc
‑
ox40l和αpd
‑
1抗体中的任一者的单一疗法的小鼠相比,经受在第7天、第9天和第11天施用tigit
‑
fc
‑
ox40l嵌合蛋白和在第12天、第14天和第16天施用αpd
‑
1抗体的组合疗法的小鼠显示出显著较慢的肿瘤发展(图4a)和延长的存活期(在第37天约40%存活率,参见图4b)。这是出人意料的,因为虽然在第12天、第14天和第16天(在未经另外治疗的小鼠中)施用的αpd
‑
1抗体显示与仅媒介物治疗的小鼠相当的肿瘤生长和存活(图4a
‑
4b),但αpd
‑
1抗体在第12天、第14天和第16天施用至已经或正在用tigit
‑
fc
‑
ox40l嵌合蛋白治疗的小鼠时显示出显著抗肿瘤作用。此外,如图4c所示,这些小鼠表现出43%的原发性肿瘤排斥和100%的继发性肿瘤排斥。因此,αpd
‑
1抗体可用于治疗已经进行或正在进行用本技术的tigit
‑
fc
‑
ox40l异源嵌合蛋白治疗的受试者的癌症的方法。
[0378]
出人意料地,与经受在第7天、第9天和第11天同时施用tigit
‑
fc
‑
ox40l和αpd
‑
1抗体的组合疗法的小鼠相比,经受在第7天、第9天和第11天施用αpd
‑
1抗体和在第12天、第14天和第16天施用tigit
‑
fc
‑
ox40l嵌合蛋白的组合疗法的小鼠显示出显著较慢的肿瘤发展(图4a)和延长的存活期(在第37天约30%存活率,参见图4b)。如图4c所示,这些小鼠表现出71%的原发性肿瘤排斥和80%的继发性肿瘤排斥。因此,本技术的tigit
‑
fc
‑
ox40l异源嵌合蛋白可用于治疗已经进行或正在进行用αpd
‑
1抗体治疗的受试者的癌症的方法。
[0379]
图4a示出由包含tigit
‑
fc
‑
ox40l嵌合蛋白和/或抗pd
‑
1抗体的治疗引起的肿瘤大小(即,体积)的变化。图4b示出由包含tigit
‑
fc
‑
ox40l嵌合蛋白和/或抗pd
‑
1抗体的治疗引起的肿瘤接种后存活天数百分比的卡普兰
‑
迈耶曲线。出人意料地,抗体和嵌合蛋白的施用
顺序影响了治疗结果。更具体地,尽管与任何单独嵌合蛋白治疗或单独抗体治疗相比,嵌合蛋白与抗体的所有组合提供了改善的治疗益处,但是在组合治疗中,在tigit
‑
fc
‑
ox40l嵌合蛋白之前施用抗pd
‑
1抗体的组合具有最大的治疗效果。
[0380]
实验证据表明,相对于用单独tigit
‑
fc
‑
ox40l嵌合蛋白或单独任一种抗体进行治疗,用tigit
‑
fc
‑
ox40l嵌合蛋白和抗ctla
‑
4抗体进行治疗或用tigit
‑
fc
‑
ox40l嵌合蛋白和抗pd
‑
1抗体进行治疗提供肿瘤体积和存活的最显著改善。
[0381]
实施例3:抗pd
‑
1抗体和tigit
‑
fc
‑
light嵌合蛋白的功能性体内抗肿瘤活性
[0382]
图5a示出用ct26肿瘤攻击并如图例所指示治疗的小鼠中的肿瘤生长动力学(在第10天,曲线的顺序从上至下是媒介物、抗pd1、tigit
‑
fc
‑
light、tigit
‑
fc
‑
light 抗pd1)。tigit
‑
fc
‑
light嵌合蛋白和抗pd1抗体的组合提供了最慢的肿瘤生长。
[0383]
图5b是图5a的ct26肿瘤实验的存活和统计数据的卡普兰迈耶曲线。如所示,tigit
‑
fc
‑
light嵌合蛋白与抗pd1抗体的组合最有效,因为它在第24天提供了37.5%的存活率,相比之下单一疗法的存活率为0%。图5c和图5d包括与图5a和图5b的图有关的数据。
[0384]
如图5a所示,比较了以下剂量方案:
[0385]
(1)仅媒介物;
[0386]
(2)抗pd
‑
1(rpm1
‑
14;100μg第1天、第3天和第6天);
[0387]
(3)mtigit
‑
fc
‑
light嵌合蛋白(300μg第1天、第3天和第6天);以及
[0388]
(4)抗pd
‑
1抗体与mtigit
‑
fc
‑
light嵌合蛋白(arc)的组合,各自在第1天、第3天和第6天施用;
[0389]
图5a示出用ct26肿瘤攻击并如图例所指示治疗的小鼠中的肿瘤生长动力学(在第10天,曲线的顺序从上至下是媒介物、抗pd1、tigit
‑
fc
‑
light、tigit
‑
fc
‑
light 抗pd1)。tigit
‑
fc
‑
light嵌合蛋白和抗pd1抗体的组合提供了最慢的肿瘤生长。
[0390]
如仅媒介物治疗的小鼠中所示,显示肿瘤迅速发展且到第13天致死(图5a
‑
5b)。与仅媒介物治疗的小鼠相比,在第1天、第3天和第6天施用αpd
‑
1抗体的小鼠显示出较慢的肿瘤发展(图5a)和延长的存活期(图5b)。与仅媒介物治疗的小鼠以及在第12天、第14天和第16天用αpd
‑
1抗体治疗的小鼠相比,在第1天、第3天和第6天施用tigit
‑
fc
‑
light嵌合蛋白的小鼠显示出较慢的肿瘤发展(图5a)和延长的存活期(图5b)。
[0391]
令人感兴趣地,与经受在第7天、第9天和第11天施用tigit
‑
fc
‑
light和抗pd
‑
1抗体中的任一者的单一疗法的小鼠相比,经受tigit
‑
fc
‑
light和抗pd
‑
1抗体(各自在第1天、第3天和第6天施用)的组合疗法的小鼠显示出较慢的肿瘤发展(图5a)和延长的存活期(图5b)。如图5d所示,与使用tigit
‑
fc
‑
light(p=0.03)和抗pd
‑
1(p=0.0022)中的任一者的单一疗法相比,由组合治疗引起的存活率在统计学上是显著的。这些结果表明,与使用αpd
‑
1抗体和tigit
‑
fc
‑
light异源嵌合蛋白中的任一者的单一疗法相比,αpd
‑
1抗体和tigit
‑
fc
‑
light异源嵌合蛋白的组合显示出更好的抗肿瘤活性。因此,本技术的αpd
‑
1抗体和tigit
‑
fc
‑
light异源嵌合蛋白的组合疗法可用于治疗本文公开的癌症的方法。这些结果还证明了αpd
‑
1抗体和tigit
‑
fc
‑
light异源嵌合蛋白可同时施用或者一者可在另一者之前施用。
[0392]
实施例4:经受本技术的组合疗法的动物中肿瘤浸润淋巴细胞的表型分析
[0393]
上述结果证明,与每种单一疗法相比,当嵌合蛋白(例如tigit
‑
fc
‑
ox40l和tigit
‑
fc
‑
light)各自与抗免疫检查点抗体(例如抗pd
‑
1和αctla抗体)组合时的优异抗肿瘤活性
和增加的存活率。tigit是t细胞和自然杀伤(nk)细胞的抑制性受体。不受理论束缚,认为tigit与靶受体的相互作用抑制t/nk细胞毒性功能。不受理论束缚,tigit上调被认为是在抗pd
‑
1疗法难治的肿瘤中观察到的一种补偿性检查点机制。不受理论束缚,嵌合蛋白例如tigit
‑
fc
‑
ox40l和tigit
‑
fc
‑
light可阻断这种抑制性相互作用,从而允许在来自arc共刺激结构域的共刺激后的抗肿瘤免疫响应。不受理论束缚,上述结果表明嵌合蛋白(例如tigit
‑
fc
‑
ox40l和tigit
‑
fc
‑
light)与抗免疫检查点抗体(例如抗pd
‑
1和αctla抗体)的组合具有同时阻断两种检查点途径(例如pd
‑
1和tigit、ctla和tigit)的潜力,同时还提供免疫协同刺激(例如通过ox40/l和ltbr/light)。
[0394]
为了进一步研究使用激动剂重定向检查点(arc)嵌合融合蛋白(例如tigit
‑
fc
‑
ox40l和tigit
‑
fc
‑
light)的单一疗法和本技术的组合疗法(例如嵌合融合蛋白(例如tigit
‑
fc
‑
ox40l和tigit
‑
fc
‑
light)与抗免疫检查点抗体(例如抗pd
‑
1和αctla抗体)的组合)的优异治疗作用,对肿瘤浸润淋巴细胞(til)进行了免疫表型分析。将balb/c小鼠接种ct26(结肠直肠癌)肿瘤,并且当起始肿瘤体积达到30
‑
60mm3(表示第0天)时,开始治疗。在第0天、第3天和第6天通过腹膜内(ip)注射用300mg的arc(tigit
‑
fc
‑
ox40l或tigit
‑
fc
‑
light)或每种arc与100mg抗pd
‑
1(克隆rmp1
‑
14)的组合治疗小鼠。在第7天,对小鼠实施安乐死,收集并分离肿瘤组织,并且通过流式细胞术进行分析并计算为细胞类型百分比。在肿瘤中检测到的总cd8 t细胞的%在治疗组之间是相似的(图6a)。如图6b所示,在用tigit
‑
fc
‑
ox40l或tigit
‑
fc
‑
light嵌合融合蛋白治疗的小鼠中,总cd8
细胞中总穿孔素
cd8
细胞增加。tigit
‑
fc
‑
ox40l或tigit
‑
fc
‑
light嵌合融合蛋白与抗pd
‑
1抗体的组合治疗导致总cd8
细胞群体中穿孔素
cd8
细胞的进一步增加(图6b)。类似地,如图6c所示,在用tigit
‑
fc
‑
ox40l或tigit
‑
fc
‑
light嵌合融合蛋白治疗的小鼠中的总cd8
细胞中,总ifnγ
cd8
细胞增加;并且tigit
‑
fc
‑
ox40l或tigit
‑
fc
‑
light嵌合融合蛋白与抗pd
‑
1抗体的组合治疗导致总cd8
细胞群体中ifnγ
cd8
细胞的进一步增加(图6c)。
[0395]
针对ct26癌细胞的免疫显性cd8 t细胞响应是针对肿瘤/自身抗原gp70423
‑
431(也称为ah1)。为了评估针对ct26的t细胞响应,对总ah1
‑
四聚体
cd8
细胞进行了定量。如图6d所示,在用tigit
‑
fc
‑
ox40l或tigit
‑
fc
‑
light嵌合融合蛋白治疗的小鼠中,总cd8
细胞中总ah1四聚体
cd8
细胞增加。tigit
‑
fc
‑
ox40l或tigit
‑
fc
‑
light嵌合融合蛋白与抗pd
‑
1抗体的组合治疗导致总cd8
细胞群体中总ah1四聚体
cd8
细胞的进一步增加(图6d)。总的来说,这些数据表明,虽然总cd8 t细胞的%不受任何治疗的影响,但被激活的细胞的比例(如通过穿孔素、ifnγ和肿瘤抗原特异性的表达所测定)在用tigit arcs治疗小鼠时更高;并且在大多数情况下当arc与抗pd
‑
1组合时进一步增加。
[0396]
这些结果表明,cd8 t细胞的激活增加与观察到的本技术的嵌合蛋白(例如tigit
‑
fc
‑
ox40l和tigit
‑
fc
‑
light)与抗免疫检查点抗体(例如抗pd
‑
1和αctla抗体)的组合治疗的功效相关。因此,激活的t细胞的测量(例如通过测量总穿孔素
cd8
细胞、ifnγ
cd8
细胞或肿瘤特异性t细胞)可用于选择受试者以用本文公开的癌症的疗法进行治疗的方法中。
[0397]
还定量了其他相关细胞类型,包括总cd4 t细胞、nkp46
nk细胞(包括肿瘤中的总ifnγ
nkp46
nk细胞)的%。如图6e所示,在用tigit
‑
fc
‑
ox40l或tigit
‑
fc
‑
light嵌合融合蛋白治疗的小鼠中,总单核细胞中总cd4
细胞增加。tigit
‑
fc
‑
ox40l或tigit
‑
fc
‑
light嵌合融合蛋白与抗pd
‑
1抗体的组合治疗导致总单核细胞群体中cd4
细胞的进一步增加(图
和il
‑
17a。
[0406]
以引用的方式并入
[0407]
本文引用的所有专利和出版物以引用的方式整体并入本文。
[0408]
本文所论述的出版物仅仅出于其在本技术的提交日期之前公开而提供。本文中的任何内容均不应解释为承认本发明无权借助在先发明而先于此类公开。
[0409]
如本文所用的,所有标题仅用于组织,并不意图以任何方式限制本公开。任何单个部分的内容可同样适用于所有部分。
[0410]
等效方案
[0411]
尽管已经结合本发明具体的实施方案公开了本发明,但应理解本发明能够具有另外的修改,并且本技术意图涵盖通常遵循本发明原理的、包括虽然不属于本发明所公开内容范围但属于本发明所属领域的公知技术或常用的技术手段并可以应用于上文中阐述和所附权利要求的范围所列出的必要特征的任何变型、用途或者变更。
[0412]
本领域技术人员仅使用常规实验将会认识到或将能够确定本文中确切公开的具体实施方案的许多等效方案。此类等效方案意图涵盖在所附权利要求书的范围中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。