一种天然分子pa在预防、治疗细胞或组织损伤制剂中的应用
技术领域
1.本发明涉及抗铁死亡和氧化应激药物技术领域,特别是涉及一种天然分子pa在预防、治疗细胞或组织损伤制剂中的应用。
背景技术:
2.植酸(phytic acid,pa),俗名为六磷酸肌醇,分子式为c6h
18
o
24
p6,分子量为660.04,广泛存在于豆类、谷物、及坚果中。每个植酸分子含有6个磷酸基团,可在较宽的ph范围内与铁离子、铜离子等螯合形成稳定的配合物,在金属防腐和防锈等领域有大量的应用。植酸作为天然无毒的化合物,在生物医学领域具有巨大的应用前景。
3.铁死亡(ferroptosis)是一种铁依赖性的,区别于细胞凋亡、细胞坏死、细胞自噬的新型的细胞程序性死亡方式。铁死亡主要特征包括细胞膜脂质的过氧化、细胞活性氧(ros)水平升高、线粒体皱缩变小等。经典的铁死亡抑制剂ferrostatin
‑
1(fer
‑
1)是一种人工合成的抗氧化剂,通过还原机制来防止膜脂过氧化,从而抑制细胞死亡。fer
‑
1昂贵的合成成本限制、较差的水溶性限制了其在生物医学领域的应用,因此发展成本低廉、安全无毒、性能优异的天然有机分子作为铁死亡的抑制剂具有重要的科学价值和应用前景。天然分子pa在抗铁死亡和氧化应激药物中的应用还未见报道。
技术实现要素:
4.鉴于以上所述现有技术的缺点,本发明的目的在于提供一种天然分子pa在预防、治疗细胞或组织损伤制剂中的应用。
5.为实现上述目的及其他相关目的,本发明提供一种天然分子pa在预防、治疗细胞或组织损伤制剂中的应用。
6.一种天然分子pa在预防、治疗细胞或组织损伤制剂中的应用,所述天然分子pa的结构式为:
[0007][0008]
作为优选,所述细胞或组织损伤由铁死亡或氧化应激失衡引起。
[0009]
作为优选,所述铁死亡为由紫外线诱导的铁死亡。
[0010]
作为优选,所述细胞或组织为角膜内皮细胞或角膜内皮。
[0011]
作为优选,所述制剂为抑制脂质化合物过氧化的药物。
[0012]
作为优选,所述制剂为治疗细胞线粒体损伤的药物。
[0013]
作为优选,所述制剂为预防或治疗细胞zo
‑
1表达减少的药物;
[0014]
作为优选,所述制剂为预防或治疗细胞的细胞核损伤的药物。
[0015]
作为优选,所述制剂为液体制剂。
[0016]
作为进一步优选,所述制剂为直接治疗铁死亡损伤或氧化应激损伤的液体制剂。
[0017]
作为进一步优选,所述制剂为治疗铁死亡损伤或氧化应激损伤的角膜内皮的眼药水。
[0018]
作为进一步优选,所述制剂可用于治疗氧化应激损伤疾病,如帕金森症病、阿尔兹海默病、肿瘤、中风、局部缺血
‑
再灌注损伤等。
[0019]
本发明的目的在于使用该天然分子pa,通过螯合二价铁离子,维持氧化应激反应的平衡,达到抗铁死亡的目的,从而被用于预防和治疗组织、器官的损伤等,并通过实验验证该天然分子pa在医疗领域应用的可行性。
[0020]
如上所述,本发明的天然分子pa在预防、治疗细胞或组织损伤制剂中的应用,具有以下有益效果:
[0021]
1、本发明利用天然分子pa具有良好的抗氧化活性,将其应用于治疗铁死亡或氧化应激损伤的细胞或组织的药物中,能够有效螯合二价铁离子,抑制细胞内芬顿反应和羟基自由基的产生,维持氧化应激反应的平衡,达到抗铁死亡,预防和/或治疗细胞或组织损伤的目的。
[0022]
2、本发明通过实验验证了天然分子pa对紫外线诱导角膜内皮损伤细胞的细胞形态起到保护作用,能抑制紫外线诱导角膜内皮损伤细胞内脂质过氧化物的产生和积累,能促进紫外线诱导角膜内皮损伤细胞的生长与增殖,促进紫外线诱导角膜内皮损伤细胞zo
‑
1表达和保护细胞线粒体的大小和形态,在通过其他途径治疗氧化应激损伤疾病如帕金森病、阿尔兹海默病、肿瘤、中风、局部缺血
‑
再灌注损伤等方面也具有良好的前景。
附图说明
[0023]
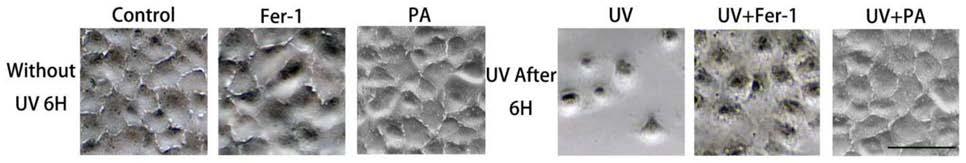
图1为紫外线诱导角膜内皮损伤前后细胞形态图。
[0024]
图2为紫外线诱导角膜内皮损伤后细胞内脂质过氧化物的荧光检测图。
[0025]
图3为紫外线诱导角膜内皮损伤后细胞内脂质过氧化物的荧光检测结果统计图。
[0026]
图4为紫外线诱导角膜内皮损伤后细胞内脂质过氧化物荧光流式细胞学检测图。
[0027]
图5为紫外线诱导角膜内皮损伤后细胞内脂质过氧化物荧光流式细胞学检测统计图。
[0028]
图6为紫外线诱导角膜内皮损伤细胞生长曲线图。
[0029]
图7为紫外线诱导角膜内皮损伤细胞的zo
‑
1的表达图。
[0030]
图8为紫外线诱导角膜内皮损伤细胞的线粒体变化图。
[0031]
图9为紫外线诱导兔角膜组织内皮细胞损伤过程中细胞轮廓、细胞核结构变化图。
[0032]
图10为紫外线诱导人角膜组织内皮细胞损伤过程中细胞轮廓、细胞核结构变化图。
[0033]
图11为紫外线诱导兔角膜组织内皮细胞损伤过程中nrf2蛋白细胞定位图。
[0034]
图12为紫外线诱导兔角膜组织内皮细胞损伤过程中nrf2蛋白在细胞核内聚集情况统计图。
具体实施方式
[0035]
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
[0036]
角膜内皮细胞是位于角膜五层结构中最内侧的一层,体内损伤后没有再生的能力,该细胞结构和较多数细胞类似,最具代表性。在环境中uv
‑
a占紫外线的95%,可以对位于表层的角膜产生损伤。
[0037]
以下实验均在角膜内皮细胞上完成。各组所用培养液如下:
[0038]
对照组:角膜内皮培养液;
[0039]
fer
‑
1组:fer
‑
1浓度为5μmol/l的角膜内皮培养液;
[0040]
pa组:pa浓度为1μmol/l的角膜内皮培养液;
[0041]
uv组:角膜内皮培养液;
[0042]
uv fer
‑
1组:fer
‑
1浓度为5μmol/l的角膜内皮培养液;
[0043]
uv pa组:pa浓度为1μmol/l的角膜内皮培养液。
[0044]
实施例1:兔角膜内皮细胞分离和培养
[0045]
细胞取自于新西兰白兔,对兔实施安乐死后,使兔处于仰卧位,用高压消毒过的有齿镊夹住上眼睑,一助手将上眼睑向外翻,术者一手用有齿镊夹住结膜组织,另一手用剪刀从结膜上皮与基质间剪开,沿睑缘向两边分离,再从眼球的角膜缘部分往外夹住球结膜部分,剪刀沿球体分离球结膜,完全分离后,夹住两侧结膜组织,沿穹窿处剪短。分离结膜后,一只手持镊夹住剩余结膜组织,另一手持弯头剪剪出眼球周围组织和视神经,完整分离眼球。将眼球完全浸入30s,pbs清洗两遍。
[0046]
另拿一只干净无菌的10cm培养皿,铺一块无菌纱布,一手持镊夹住一只眼球,置于纱布上,另一手持无菌刀片,从角巩膜缘后侧刺入球体,换剪刀,从刺破口进入,沿角巩膜缘剪开,将剪下的角巩膜片放入无血清,含1%双抗(青霉素10ku/ml
‑
链霉素10mg/ml混合液)的opti液中,置于冰上。准备体视显微镜,鹅颈灯,调整体视显微镜,直到角膜可完整观察到。左手持有齿显微镊,右手持无齿显微镜,右手将镊头闭合,由巩膜向角膜划几下,直到单层内皮细胞卷起,换个方向,直到整个角膜内皮层分离出来(注意:若不能完整分离,尽量将四周的内皮组织分离出来,周围的内皮细胞比中间的增殖能力强,活性好)。
[0047]
将完整剥离的角膜内皮置于0.1%胶原酶消化14
‑
16h。第二日,将消化完全的角膜内皮细胞用1ml移液枪(1000μl,ependorff)吹打几次,显微镜下观察直至分散成均一的小细胞团,加入含血清的培养液中消化,8000rpm离心4min,去掉上清。加入1mltryple(胰酶)吹打几次,置于37℃,5%co2培养箱消化7
‑
10min,每3min拿出来吹打一下,直至小细胞团分离成单个细胞。
[0048]
将fibronectin(纤粘蛋白)铺于6孔板中,培养箱过夜,第二日早上将6孔板中的fibronectin回收,置于超净台中晾干待用。将得到的角膜内皮细胞全部种于6孔板中的一个孔中,加入2ml角膜内皮培养液(45mlopti 4mlfbs 0.5μlegf 500μl双抗 2μlsb431542 50μly27632)进行培养。day2(第二天)、day3(第三天)观察细胞状态,显微镜下拍照,每48h换液一次,细胞密度达到80%时即可传代,传代比例为1:3。
[0049]
实施例2:pa对紫外线诱导角膜内皮损伤细胞形态起到保护作用
[0050]
实验方法:吸出培养皿中的培养液,加入pbs(phosphate buffered solution,ph=7.4)清洗两遍,光学显微镜下观察细胞形态,拍照。将清洗过的细胞分成对照组、fer
‑
1组、pa组、uv组、uv fer
‑
1组和uv pa组六组。
[0051]
对照组:加入角膜内皮培养液培养6h,在光学显微镜下观察细胞的形态;
[0052]
fer
‑
1组:加入fer
‑
1浓度为5μmol/l的角膜内皮培养液培养6h,在光学显微镜下观察细胞的形态;
[0053]
pa组:加入pa浓度为1μmol/l的角膜内皮培养液培养6h,在光学显微镜下观察细胞的形态;
[0054]
uv组:加入角膜内皮培养液并放入uv紫外线加速老化试验箱中,照射功1.75j/cm2下进行紫外uv
‑
a照射240s,照射结束用pbs清洗两遍,光学显微镜下观察此时的细胞形态,并拍照;后加入角膜内皮培养液培养6h,每隔2h在光学显微镜下观察细胞的形态;
[0055]
uv fer
‑
1组:加入fer
‑
1浓度为5μmol/l的角膜内皮培养液并放入uv紫外线加速老化试验箱中,照射功1.75j/cm2下进行紫外uv
‑
a照射240s,照射结束用pbs清洗两遍,光学显微镜下观察此时的细胞形态,并拍照;后加入含有fer
‑
1的角膜内皮培养液培养6h,每隔2h在光学显微镜下观察细胞的形态;
[0056]
uv pa组:加入pa浓度为1μmol/l的角膜内皮培养液并放入uv紫外线加速老化试验箱中,照射功1.75j/cm2下进行紫外uv
‑
a照射240s,照射结束用pbs清洗两遍,光学显微镜下观察此时的细胞形态,并拍照;后加入含有pa的角膜内皮培养液培养6h,每隔2h在光学显微镜下观察细胞的形态。
[0057]
结果分析:如图1所示,所有细胞在进行uv
‑
a处理之前都保持相同的细胞密度和状态,消除了初始状态对实验的影响。未进行任何处理的细胞(对照组,图中显示为control)的生长和增殖速率处于正常状态,使用fer
‑
1培养基(含有fer
‑
1的角膜内皮培养液)培养的细胞(fer
‑
1组)与对照组表现相似,提示fer
‑
1对cec无细胞毒性,使用pa培养基(含有pa的角膜内皮培养液)培养的细胞(pa组)与对照组表现相似,提示pa对cec无细胞毒性。而在uv组,即接受1.75j/cm
2 uv
‑
a辐射后的细胞中,出现了异常的细胞形态,并且细胞数量在6h后明显减少;而fer
‑
1培养基处理过的细胞在数量和形态上均优于uv组;然而pa处理的细胞(uv pa组)保持增殖状态并呈现规则的形状,表明pa对uv
‑
a处理后的细胞起到保护作用,并且在作用6h后保护作用更加明显。
[0058]
实施例3:pa能抑制紫外线诱导角膜内皮损伤细胞产生脂质过氧化物
[0059]
实验方法:本实验使用脂质ros检测试剂盒,根据分组进行细胞铺板,待密度接近80%时,用相应培液预处理12h,pbs清洗两遍,进行紫外线照射诱导损伤,照射完成后加入pbs清洗两遍,光学显微镜下观察细胞形态,拍照,加入含bodipy 581/591的培液进行培养,每3h在荧光显微镜下观察一次,记录荧光图像。
[0060]
对照组:加入含bodipy 581/591的角膜内皮培养液培养12h,在荧光显微镜下观察细胞形态,拍摄荧光照片;
[0061]
uv组:(无细胞培养液,干燥状态下)放入uv紫外线加速老化试验箱中,照射功1.75j/cm2下进行紫外uv
‑
a照射240s,照射结束用pbs清洗两遍,加入含bodipy 581/591的角膜内皮培养液培养12h,在荧光显微镜下观察细胞形态,拍摄荧光照片;
[0062]
uv pa组:(无细胞培养液,干燥状态下)放入uv紫外线加速老化试验箱中,照射功1.75j/cm2下进行紫外uv
‑
a照射240s,照射结束用pbs清洗两遍,加入pa浓度为1μmol/l的含bodipy 581/591的角膜内皮培养液培养12h,在荧光显微镜下观察细胞形态,拍摄荧光照片;
[0063]
结果分析:脂质过氧化物(lipid ros)的产生和积累是铁死亡的最大特征。bodipy 581/591十一烷酸用于检测细胞和膜中的脂质ros的存在,一旦发生氧化反应,bodipy 581/591十一烷酸的结构就会发生变化,导致其荧光发射峰从
‑
590nm变为
‑
510nm,荧光显微镜下观察到红色到绿色的变化。使用bodipy 581/591十一烷酸检测uv
‑
a辐射角膜内皮细胞后脂质过氧化物的变化。由图2可知,对照组的细胞(无任何处理)只发出红色的荧光,几乎没有绿色荧光的表达;相反,在uv
‑
a处理组(接受uv
‑
a辐射),大部分细胞发出绿色荧光,这意味着许多细胞在受到uv
‑
a刺激后产生了脂质ros,使得bodipy 581/591十一烷酸发生氧化反应,接受了pa处理的角膜内皮细胞绿色荧光表达量相比单uv
‑
a辐射的细胞大量减少,逆转了脂质ros反应的免疫荧光染色变化。图3是根据图2荧光强度所做的统计结果,结果与其一致。
[0064]
实施例4:脂质过氧化物荧光流式细胞学检测
[0065]
实验方法:将实施例3中荧光表现最明显的时间点记录,消化下此时的细胞,进行流式细胞分析。标记为pi荧光的细胞为进行统计的有效细胞数,标记为fitc荧光的细胞为有脂质过氧化物产生的细胞。
[0066]
结果分析:将发生荧光反应的细胞消化下来,进行流式检测,使用结果中的mean值进行统计,如图4所示,与对照组细胞峰值相比,uv处理过后峰值向右偏,意味着带有目的荧光(即绿色荧光)的细胞变多;加入pa处理的细胞峰值向左回落,即绿色荧光的细胞变少。对图4进行统计分析,得到图5流式实验的统计图,uv
‑
a刺激更多细胞生成脂质ros,而pa降低这一比例,与荧光实验结果一致。
[0067]
实施例5:pa能促进紫外线诱导角膜内皮损伤细胞生长与增殖
[0068]
实验方法:根据分组进行细胞铺板,使用96孔板进行cck8实验。day0,每孔种1000个细胞,根据分组加入相应的含10%cck8溶液的培养液,培养箱静置4h,酶标仪测450nm吸光度,保存数据。day1,吸净培液,将需要照射的细胞培养板置于消毒过的紫外照射箱进行照射,pbs清洗三遍,根据分组加入相应的含10%cck8溶液的培养液,培养箱静置4h,酶标仪测450nm吸光度,保存数据。day3,吸净培液,pbs清洗三遍,根据分组加入相应的含10%cck8溶液的培养液,培养箱静置4h,酶标仪测450nm吸光度,保存数据。将所有数据根据day0进行标准化,统计作图。
[0069]
结果分析:收集三次实验的数据,以第0天数据进行标准化,得到统计数据,如图6所示,对照组(黑色,无任何处理组)和pa组(深灰色,使用含pa培养基组)具有相似的生长曲线,统计结果为ns,无明显统计学差异,表示pa在第0天、第1天和第3天对细胞生长均无负面影响;在接受紫外线uv
‑
a的两组中,第1天的数据显示,无pa保护的uv(银色)组细胞和含有pa的uv pa(浅灰色)组细胞存活率均呈显著下降的趋势;但在第3天,含有pa的uv pa(浅灰色)组呈现细胞增殖、数量增多的趋势,而无pa保护的uv(银色)组的细胞数量则进一步减少。由此可见,pa不仅在无任何处理的情况下对细胞的增殖无负面影响,而且在uv
‑
a损伤的情况下可以促进细胞更好的恢复到正常状态。
[0070]
实施例6:pa能促进紫外线诱导角膜内皮损伤细胞zo
‑
1表达
[0071]
实验方法:根据分组将状态良好的p1代细胞分种在铺好细胞爬片的24孔板中,待密度接近80%时,用相应培液预处理12h,pbs清洗两遍。进行紫外线照射诱导损伤,在照射的before,0h,6h时间点进行固定,即4%多聚甲醛室温固定15min,pbs清洗三遍。使用5%驴血清封闭液室温封闭1h,pbs清洗三遍,使用封闭液配制的zo
‑
1一抗在4℃冷库孵育过夜,使用pbst tween清洗三遍,最后一遍吸净。使用pbs配置的鼠源荧光二抗室温孵育1h,使用pbst tween清洗三遍。准备干净的载玻片,在玻片上滴加dapi,小心夹起细胞爬片,慢慢将有细胞的一面放在玻片上,静置5min,避光条件中,在荧光显微镜下进行观察拍摄。
[0072]
结果分析:zo
‑
1的完整表达反映了cec的完好结构,如图7所示,uv
‑
a辐射之前,三组细胞通过zo
‑
1免疫荧光染色均呈现完整的绿色轮廓,蓝色代表细胞核;在没有任何处理的细胞(对照组)中,随着时间的延长,细胞数量和紧密连接的表达略有增加;而uv
‑
a组在照射的0h,zo
‑
1表达降低,6h后,不仅zo
‑
1的表达减少,蓝色代表的细胞核数量也大幅减少;而uv pa组虽然在0h的即时时间点没有显著的保护作用,但在同样的6h时间点使得角膜内皮细胞紧密连接表达增加,细胞核数量恢复到正常水平。
[0073]
实施例7:pa能保护紫外线诱导角膜内皮损伤细胞的线粒体
[0074]
实验方法:吸出培养皿中的培养液,加入pbs清洗两遍,光学显微镜下观察细胞形态,打开uv紫外线加速老化试验箱,调节时间为240s,将清洗过的细胞培养皿放入实验箱中进行紫外照射,照射完成后加入pbs清洗两遍,光学显微镜下再次观察细胞形态,加入培养液培养6h,将细胞消化下来后用电竞固定液重悬,移交电镜拍摄实验室进行拍摄。
[0075]
结果分析:如图8所示,正常对照组细胞线粒体大小正常,形态完整;紫外线uv
‑
a损伤后线粒体体积变小、嵴数量减少、膜皱缩;使用fer
‑
1后的细胞线粒体体积有所恢复、嵴数量稍增加、膜皱缩减少;使用pa后的细胞线粒体体积基本恢复到正常、嵴数量增加、膜皱缩减少,表明pa对uv诱导角膜内皮损伤细胞的线粒体保护效果及线粒体损伤治疗效果优于fer
‑
1。
[0076]
实施例8:pa能保护紫外线诱导角膜组织上损伤内皮细胞的结构、细胞核完整及促进nrf2聚集到细胞核中
[0077]
体外器官培养实验方法:取新鲜兔眼球,沿角巩膜缘剪下,用有齿镊将虹膜组织完整剥离下来,将角膜组织沿内皮面朝上放入24孔板中,添加相应组别的培液预处理12h。pbs清洗两遍,进行紫外线照射诱导损伤,照射完成后加入pbs清洗两遍,再放入培液进行培养6h。在各组别角膜孔里加入5%驴血清封闭液室温封闭1h,pbs清洗三遍直至无驴血清封闭液残留,zo
‑
1一抗(1:200)4℃冷库孵育过夜,pbs清洗三遍,鼠源性二抗室温孵育1h,pbs清洗三遍。在体视显微镜下,使用眼科显微器械尽量完整剥离内皮层,将内皮细胞面朝下放置于滴上dapi的载玻片上,小心盖上盖玻片,尽量赶出气泡。避光条件中,在荧光显微镜下进行观察拍摄。
[0078]
结果分析:如图9所示,在无uv
‑
a处理的情况下,三组内皮细胞层染色均显示完整的细胞轮廓,包裹正常的细胞核结构,无任何处理的control组在0h和6h时间点与before时间点相同,呈现正常的细胞结构,而在uv
‑
a辐射的即时,细胞膜的完整性被破坏且细胞核也受到了影响,部分细胞核变小,失去规整的椭圆形状,6h后,不仅zo
‑
1的表达大量减少,正常的细胞核也几乎没有。与之形成鲜明对比的是,pa处理的细胞层在uv
‑
a辐射的即刻保存了
部分膜结构,且在6h后恢复了大部分细胞的紧密连接,形成较为完整的细胞结构。除兔组织的器官培养实验外,还使用了人的角膜组织验证了此结果。实验采用角膜移植术后角膜巩膜环,与兔角膜处理类似,在剥离了虹膜等其他组织后,分为三组使用相应的培养基预处理12h,随后进行uv
‑
a辐射处理,继续使用培养基培养6h后使用多聚甲醛固定细胞,体视显微镜下分离角巩膜缘的内皮环,使用zo
‑
1进行染色,dapi代表细胞核。结果如图10所示,在uv
‑
a照射前,所有组细胞均呈紧密连接蛋白勾勒的六角形鹅卵石轮廓状,细胞核形态为椭圆形但体积小于兔内皮细胞的细胞核,绿色边界未完全涵盖细胞核,此种情况源于角巩膜环过窄,分离过程有所损伤,难以完全分离导致cec片有所重叠,不能完全铺于同一水平面上。
[0079]
通过体外器官培养实验在uv
‑
a损伤角膜内皮细胞的过程中观察到了nrf2蛋白细胞定位的变化,如图11所示,uv
‑
a处理之前的三组都可以观察到完整的蓝色细胞核,nrf2(红色)染色均匀的分布在核的周围,红色与蓝色重叠的部分几乎没有,表明nrf2的分布都在细胞质中,符合正常情况下的分布情况。在6h的同时刻状态,control组细胞维持原有状态,uv组细胞不仅没有nrf2的表达,细胞核还受到了损伤,虽然红色与蓝色重叠增多,提示部分nrf2入核,而用pa处理的uv照射组细胞,细胞核完整无损伤,并且在细胞核部分有大量的红色表达,表明更多的nrf2聚集到细胞核中,与功能状态的蛋白分布相对应。从图12可知,在pa处理的6h组,核内nrf2占比较大,显示更多的nrf2聚集到细胞核中。
[0080]
由以上实验结果可知,本发明中天然分子pa对紫外线诱导角膜内皮损伤细胞的细胞形态起到保护作用,能抑制紫外线诱导角膜内皮损伤细胞内脂质过氧化物的产生和积累,能促进紫外线诱导角膜内皮损伤细胞的生长与增殖,促进紫外线诱导角膜内皮损伤细胞zo
‑
1表达和保护细胞线粒体的大小和形态。还通过兔及人的角膜组织体外培养实验证明了天然分子pa能保护紫外线诱导角膜内皮损伤细胞结构、细胞核完整及促进nrf2聚集到细胞核中,因此,本发明天然分子pa制剂可制作眼药水直接治疗uv损伤或氧化应激损伤的角膜内皮,在通过其他途径治疗氧化应激损伤疾病如帕金森病、阿尔兹海默病、肿瘤、中风、局部缺血
‑
再灌注损伤等也具有良好的前景。
[0081]
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。