一种强酸介质中阳极电解制备mno2辅助高效制氢的方法
技术领域
1.本发明属于电解水制氢技术领域,具体涉及一种强酸介质中阳极电解制备mno2辅助高效制氢的方法。
背景技术:
2.氢能作为一种储量丰富、热值高、能量密度大、来源多样的绿色能源,被誉为二十一世纪的“终极能源”。然而,氢能的利用需要从制氢开始,由于氢气在自然界极少以单质的形式存在,需要通过工业的途径制取。氢气的来源主要分为:工业副产氢、化石燃料制氢、电解水制氢等,其差别在于原料的再生性、co2排放和制氢成本。目前,世界上超过95%的氢气制取来源于化石燃料重整,生产过程必然会排放大量co2;而约4%~5%的氢气来源于电解水制氢,其生产过程不会出现co2排放所带来的环境危害。当前,全球都在呼吁低碳生产,这将进一步提速减碳的过程。而电解水制“绿氢”的技术成为解决未来能源结构问题的主要手段之一,其发展态势受到越来越多的关注。
3.为实现“水
‑
氢气
‑
水”循环的绿色能源利用模式,开发以水为原料且不消耗化石燃料的高效制氢技术是本领域的重要研究方向。催化电极材料作为电解水制氢设备的核心部件,其催化性能直接影响着电解水制氢的速率和成本。在强酸环境下析氧的标准电极电势为1.229v vs.rhe,而实际电解过程中,由于存在很高的析氧过电势,使电解水的阳极分压远远超过这一理论电势,这也是电解水制氢能耗的主要组成部分。此外,酸性体系下,过大的阳极电压会使大多数的金属基催化电极材料氧化溶解,因此,阳极催化材料必须适应强酸性和高电位的工作环境。基于此,研究者从两方面来寻求突破。一方面,合成析氧催化性能良好的耐酸性电极材料,以降低析氧过电位,从而减少电解水制氢的能量消耗;另一方面,通过探索反应能垒更低的氧化反应来取代传统的析氧过程,例如甲醇氧化(e0=0.04v vs.rhe)和尿素氧化(e0=0.37v vs.rhe)等反应取代析氧反应就是一些成功的案例。然而,这些反应所使用的催化剂,必须在其催化活性、稳定性和成本之间追求平衡。且对于大多数取代阳极析氧的技术手段,虽然从降低能耗等方面具有突出的作用,但是氧化过程的产物仍或多或少的将带来不良结果,比如甲醇氧化产生的co2会造成温室效应、尿素氧化产生的n2是无附加值产物等。因此,研究一种高效稳定,绿色环保,既能有效降低能耗,又能产生附加价值的取代阳极析氧的电解水制氢方法具有重大的经济价值和环保价值,应用前景广阔。
技术实现要素:
4.为了解决上述问题,在降低电解水制氢成本的同时,获得高附加值的阳极电解产品,本发明提供一种强酸介质中阳极电解制备mno2辅助高效制氢的方法。采用廉价的碳基体作电解水反应的电极材料,在酸性水溶液体系下,向电解液中添加mn
2
,使其在阳极端氧化生成mno2,并取代传统的析氧过程;mno2作为一种耐酸材料,电解生成的mno2覆盖在电极表面,有效解决了电极的腐蚀问题,避免了传统电解水制氢过程中使用其他昂贵的耐酸催
化析氧电极材料;同时,mno2作为一种高附加值的工业产品,能为企业带来直接的经济效益,也避免了传统电解水过程中o2的直接排放所带来的经济浪费。
5.为实现上述目的,本发明提供如下的技术方案:
6.本发明的技术方案之一,一种强酸介质中阳极电解制备mno2辅助高效制氢的方法,包括以下步骤:
7.以碳基体作为电极材料,以含有mn
2
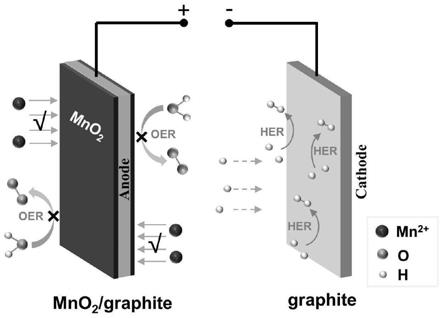
的酸性水溶液作为复合电解液,在电极体系下施加恒电流进行电解,使阳极侧发生氧化反应生成mno2,阴极侧发生还原反应生成氢气,所述电解过程的示意图如图1所示。
8.进一步地,所述碳基体为石墨片、碳纸或碳布。
9.进一步地,所述复合电解液为含有mn
2
的h2so4水溶液。
10.进一步地,所述复合电解液中的mn
2
由mnso4·
h2o作为锰源提供。
11.进一步地,所述复合电解液中h2so4的浓度为10~200g/l。
12.进一步地,所述复合电解液中mn
2
的浓度为5~100g/l。
13.进一步地,所述电解过程的温度为25~80℃。
14.进一步地,所述电解过程的温度优选为80℃。
15.进一步地,所述电解过程的电流密度为1~500ma
·
cm
‑2。
16.进一步地,所述电解过程的电流密度通过控制阴极板和阳极板的工作面积来调节,通过调节施加的阴/阳极电流密度对电解过程的阴/阳极分压进行控制。
17.进一步地,所述电解过程中使用hg/hg2so4参比电极和万用表来监测电压分配情况。
18.进一步地,所述电解过程的电解周期为1h~168h。
19.进一步地,所述电解过程的电流为恒流电源提供的直流电。
20.进一步地,所述电解过程中电极材料的极间距为3cm。
21.进一步地,所述电解过程的阴极和阳极都选择碳基体作为电极材料,当选择石墨片作为阴极材料和阳极材料时,在进行电解前先对石墨电极进行预处理,具体的预处理操作为:将石墨电极置于去离子水中进行超声清洗30min,然后用去离子水反复冲洗,最后进入鼓风干燥箱中干燥备用。
22.进一步地,所述电解过程在聚四氟乙烯电解槽中进行,并通过蠕动泵将复合电解液进行循环,控制循环液的流动速度为300ml/min。
23.电解制备mno2的工艺是采用mnso4‑
h2so4水溶液作为电介质,其电解过程为:
24.阳极反应:mn
2
2h2o
→
mno2 4h
2e
‑ e1=1.23v vs.rhe
25.阴极反应:2h
2e
‑
→
h2ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
e2=0v vs.rhe
26.总反应:mn
2
2h2o
→
mno2 h2 2h
ꢀꢀꢀꢀ
e3=1.23v vs.rhe而电解水的过程为:
27.阳极反应:2h2o
→
o2 4h
4e
‑
ꢀꢀꢀꢀꢀꢀꢀ
e4=1.229v vs.rhe
28.总反应:2h2o
→
o2 2h2ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
e5=1.229v vs.rhe
29.比较mno2的生成反应和析氧反应,虽然两者的理论电位非常接近,但由于析氧反应存在很高的过电位,造成水分解实际电压远远大于这一理论电压。因此,电解液中mn
2
存在的情况下,在电解水制氢过程中mno2将优先于o2在阳极端形成。在进一步地技术方案中,本发明对电解过程中的h2so4浓度、mn
2
浓度、电解温度和电流密度等条件进行筛选,来优化
电解过程,从而在达到在降低电解水制氢能耗的同时,使mno2的产率最大化。
30.根据阴、阳极端能量守恒原则,通过电解过程施加的电流密度,可计算出电解过程所消耗的能量,然后通过理论计算,可获得阴极析氢和阳极生成mno2的理论效率。具体计算过程如下:
31.阳极端mno2的沉积库仑数:q
阳极
=i
×
t(单位:c)
32.mno2的理论增重计算公式为:
33.生成mno2的电流效率(η)为:
34.基于阴、阳极能量守恒原则(q
阴极
=q
阳极
),阴极端h2的理论生成速率的计算方法如下:
35.电解时间内h2生成的摩尔量:(单位:mol)
36.再根据气体状态方程:
37.可计算出h2的体积量:(单位:l)
38.通过整个电解时间,即可算出h2的理论生成速率:(单位:l/s)
39.其中i为施加电流(a);t为电解时间(s);为mno2的相对分子质量(87g/mol);n为单个mn
2
氧化为mno2时转移的电子数(2);f为法拉第常数(96485);z为单个h2分子生成所消耗的电子数(2);p为大气压强(pa);r为摩尔气体常数(8.314j/(molk));t为体系温度(k);v为h2的理论生成速率(l/s)。
40.与现有技术相比,本发明具有以下有益效果:
41.(1)本发明采用廉价的碳基体作电解水反应的电极材料,在强酸介质体系下,向电解液中添加mn
2
,使其在阳极端氧化生成mno2,并取代传统的析氧过程,能直接避免析氧过电位过大所带来的电耗问题;mno2作为一种耐酸材料,电解生成的mno2覆盖在电极表面,有效解决了电极的腐蚀问题,避免了传统电解水制氢过程中使用其他昂贵的耐酸催化析氧电极材料,该方法仅需廉价、惰性的碳基体电极就能满足酸性电解水制氢条件,为当前难以寻求廉价、高催化性能的酸性电解水材料提供了一种可行的新途径;同时,mno2作为一种高附加值的固体工业产品,其良好的电催化活性和耐酸性使其成为电池行业的优良催化电极材料,与o2相比,具有更高的回收利用价值,能为企业带来直接可观的经济效益,也避免了传统电解水过程中o2的直接排放所带来的经济浪费。
42.(2)本发明发现mno2的电解效率受h2so4浓度、mn
2
浓度、电解温度和电流密度等条件的影响,并通过条件探索优化了电解过程,达到了在实现最低电解水制氢能耗的同时,使mno2的产率最大化的效果,符合绿色生产的理念,在降低电解水制氢的成本的同时得到了可观的附加价值。
附图说明
43.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
44.图1为电解过程示意图;
45.图2为实施例1中通过电化学测试得到的双电极和三电极体系下mn
2
离子的线性扫描伏安曲线,其中(a)为双电极体系下mn
2
的极化曲线测试结果,(b)为三电极体系下mn
2
的极化曲线测试结果;
46.图3为实施例2中恒电压沉积所响应的i
‑
t曲线;
47.图4为实施例3中不同温度下沉积的i
‑
t曲线以及相应mno2产物的xrd图谱,其中(a)为不同温度下沉积的i
‑
t曲线,(b)为不同温度下电解产物mno2的xrd图谱;
48.图5为实施例3中电解温度为80℃时得到的mno2产物的sem图;
49.图6为实施例4中不同电流密度下电解槽压和阳极分压的响应曲线;
50.图7为实施例5中25℃下mn
‑
h2o体系的电位
‑
ph图。
具体实施方式
51.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
52.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
53.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
54.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见的。本发明说明书和实施例仅是示例性的。
55.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
56.以下实施例中,所述电化学测试过程均在电化学工作站chi760e上采用三电极体系进行,双石墨棒(φ=5mm)分别用作工作电极和对电极,hg/hg2so4电极(填充饱和k2so4溶液)用作参比电极。电解过程均在容量为5l的长方形聚四氟乙烯电解槽中进行,并通过蠕动泵将电解液进行循环,控制循环液的流动速度为300ml/min。以直流电源对电解过程提供恒定电流,采用双石墨片(厚度:5mm)分别做阴极和阳极进行双电极体系电解,hg/hg2so4电极
用作参比电极,并用万用表记录电解过程的电压分配情况(参比电极仅作为端口,通过万用表与阳极相连,测试和记录阳极分压的变化过程)。
57.实施例1
58.称取31.04g mnso4·
h2o(纯度≥99%)溶解于1l的50g/l h2so4溶液中,经定容后,配制成含10g/lmn
2
的酸性水溶液复合电解液。在chi760e电化学工作站上采用双电极体系对复合电解液进行线性伏安曲线测试(lsv),双石墨棒(φ=5mm)分别用作工作电极和对电极,极间距为3cm,扫描速度为10mv
·
s
‑1,试验温度为25℃。作为对比,上述lsv测试同样在单纯的50g/l h2so4溶液中进行。此外,引入hg/hg2so4电极作为参比电极,在三电极体系下进行lsv测试,探索mn
2
在阳极端的氧化行为,测试结果如图2所示。
59.图2(a)为双电极体系下mn
2
的极化曲线测试结果,其显示了溶液中mn
2
在双电极体系下的极化过程。在50g/l h2so4溶液中,当电流密度达到10ma
·
cm
‑2时对应的槽电压为2.835v,而向溶液中加入10g/lmn
2
后,电流密度同样达到10ma
·
cm
‑2时对应的槽电压仅为2.369v,电解体系达到相同的电流密度时,电解液中添加了10g/lmn
2
的电解体系的槽电压可降低466mv。通过三电极体系下阳极极化测试,图2(b)为三电极体系下mn
2
的极化曲线测试结果,其显示当电流密度达到1ma
·
cm
‑2时,50g/l h2so4溶液中对应的阳极电位为1.373v vs.hg/hg2so4,这对应着酸性水溶液中的阳极析氧电位,而体系中加入10g/lmn
2
后,电流密度同样达到1ma
·
cm
‑2时对应的阳极电位仅为0.773v,阳极电位降低了600mv。因此,证明了mn
2
的引入,可显著降低酸性电解水制氢过程中阳极端的电极电位,从而降低了电解过程的槽电压,达到了节能降耗的目的。
60.在电解水制备mno2和氢气的过程中,对于mn
2
在阳极端的氧化过程需要进行合理控制。图2(b)的实线显示了mn
2
氧化生成mno2存在明显的极化过程的影响,即存在浓差极化现象,在0.8v以前,响应电流密度(纵坐标)随阳极电位(横坐标)的升高而增大,说明此时电化学反应所消耗的mn
2
速率小于体系中的传质速率,此时电极表面处于电化学极化过程;而随着阳极分压的进一步增大,电化学反应所消耗的mn
2
速率大于传质速率,此时消耗的mn
2
得不到及时补充,则会造成浓差极化,其表现形式就是电流密度开始减小。而到1.373v左右时,析氧反应则开始了,这不利于电解生成mno2,因此必须将电解过程的阳极分压控制在较低的电压范围内(在本实施例的电解液条件下最好控制在0.8v左右)。此外,极化曲线显示mn
2
氧化的极限电流密度≤2.5ma
·
cm
‑2,这表明mn
2
失电子而被氧化生成mno2的速度很慢,从而限制mno2的生成速率,以及降低电解水产氢速率。针对这些问题,必须严格对阳极分压进行控制(具体控制方法如实施例4所述),使阳极mno2生成速率和阴极产氢速率达到最佳效果。
61.实施例2
62.采用实施例1所配制的50g/l h2so4 10g/lmn
2
溶液作为复合电解液,两块石墨片(单个面积:26cm2)分别用作阴极和阳极,极间距为3cm,在2.50v的槽电压下进行电解实验,体系温度为25℃,电解时间为12h,并通过万用表实时记录电解过程的电流值,作为对比,将上述的试验同样在50g/l h2so4体系中进行,恒电压沉积所响应的i
‑
t曲线如图3所示,且相关数据汇总于表1。
63.图3所示的i
‑
t曲线表明,在2.50v的槽电压下,纯50g/l h2so4溶液中电解过程的响应电流密度仅约1.5ma
·
cm
‑2,而通过引入10g/lmn
2
离子后,mn
2
在阳极端氧化生成mno2的
反应取代传统的析氧反应,使反应体系的响应电流密度增加到了约2.5ma
·
cm
‑2,表明溶液中的mn
2
比h2o分子更易失电子而被氧化,从而加快了电解反应速率。此外,电解后的阳极实际增重为0.947g,并对响应的i
‑
t曲线进行积分计算,得出mno2的理论增重为1.211g,从而计算出阳极mno2生成的电流效率为78.2%。
64.实施例3
65.采用实施例1所配制的50g/l h2so4 10g/lmn
2
溶液作为复合电解液,两块石墨片(单个面积:26cm2)分别用作阴极和阳极,极间距为3cm,在2.50v的槽电压下进行电解实验,电解时间为12h,分别在40℃、60℃和80℃的电解温度下进行电解,探索温度对电解过程和产物物相的影响,并通过万用表实时记录电解过程的电流值,不同温度下沉积的i
‑
t曲线如图4(a)所示,且相关数据汇总于表1。
66.图4(a)所示的i
‑
t曲线表明,在2.50v的槽电压下,电解温度在40℃、60℃和80℃的响应电流密度分别约为3.3ma
·
cm
‑2、4.6ma
·
cm
‑2和6.5ma
·
cm
‑2。响应电流密度随温度的上升而上升,表明温度促进了体系中的传质过程,使电解反应速率加快。电解后的阳极mno2增重分别为1.024g、1.101g和1.118g,相应的电流效率分别为84.5%、90.8%和92.3%,表明升高温度有利于mno2的沉积,但是电解温度不能过高,温度超过80℃会使电解体系的蒸发变得严重,形成酸雾,恶化电解操作环境,因此,本发明中将80℃作为电解的最佳温度。此外,通过xrd粉末衍射对mno2产物物相进行分析,不同温度下电解产物mno2的xrd图谱如图4(b)所示,图4(b)显示mno2主要为α和γ型晶体结构,且mno2结晶度随温度的上升而变高,表明电解温度能够调控mno2产物的结晶度。另取电解温度为80℃时生成的mno2产物进行电子显微镜扫描成像,其sem图如图5所示,由图5可知,mno2产物镀层由均匀的多孔纳米片构成。
67.实施例4
68.采用实施例1所配制的50g/l h2so4 10g/lmn
2
溶液作为复合电解液,在25℃下进行12h的电解实验。同样将两块石墨片分别用作阴极和阳极,极间距为3cm,在相同的施加电流下,通过人为控制电极的浸入面积,使阴/阳极之间达到电流密度不同的效果,从而调控阴极和阳极端的电压分配,相关实验数据汇总于表1。
69.根据上述思路,本实施例首先控制阴/阳极板浸入的工作面积均为26cm2,施加恒电流为0.052a,使阴/阳极之间的电流密度均为2ma
·
cm
‑2,电解槽压和阳极分压的响应曲线如图6所示。从图6的结果来看,槽电压和阳极分压分别维持在2.33v和0.99v左右;而进一步地减小阴极板浸入面积至5.2cm2,在相同的施加电流下,使阴极的电流密度变为10ma
·
cm
‑2,而阳极电流密度仍为2ma
·
cm
‑2,此条件下的槽电压和阳极分压分别为2.55v和1.02v,阴极分压为1.53v(忽略体系内阻的影响,阴极分压可直接通过槽电压与阳极分压的差值来获得)。槽电压随阴极电流密度的上升而上升,主要归因于电流密度上升使h
在阴极端还原的驱动力变大,从而导致阴极析氢速率加快,这在一定程度上增大了体系的槽电压。因此,本发明通过控制电极板之间的工作面积,使电流密度在阴/阳极间的分配不同,从而实现了对阴/阳极分压的控制。
70.对于沉积电流效率,(
‑
)2ma
·
cm
‑2||2ma
·
cm
‑2( )条件下阳极的mno2增重为0.873g,该阳极电流密度下的mno2理论增重为1.013g,从而计算得阳极电流效率为86.2%,在(
‑
)10ma
·
cm
‑2||2ma
·
cm
‑2( )条件下阳极mno2的增重为0.901g,电流效率为88.9%。通过电流效率的对比,发现改变阴极端的施加电流密度对阳极端mno2的沉积没有明显影响,而
通过该方法提高阴极电流密度,能够提高阴极析氢速率,从而使酸性电解水制氢速率加快。
71.实施例5
72.对比实施例1所配制的复合电解液,本实施例将h2so4浓度增大,配制成150g/l h2so4 10g/lmn
2
溶液作复合电解液。控制阴/阳极的施加电流密度均为2ma
·
cm
‑2,在25℃下电解12h,探索溶液酸度对电解过程的影响,25℃下mn
‑
h2o体系的电位
‑
ph图如图7所示,相关数据汇总于表1。
73.根据阳极增重结果,mno2的产量为0.908g,电流效率可达89.6%,而实施例4中50g/l h2so4体系下获得的阳极电流效率为86.2%,说明增大体系中h2so4浓度,可进一步提高阳极mno2的生成效率。结合图7所示mn
‑
h2o体系的电位
‑
ph图分析,发现溶液的ph对mno2的生成有明显影响,当h2so4浓度大于50g/l后(ph<0),mno2在阳极端生成所需的最大电压逐渐增大,在这一点上,能使mn
2
在阳极端氧化的极限电流密度增大,可实现大电流密度下电解制备mno2和高效电解水制氢的目的。此外,溶液酸度上升,使mno4‑
的生成电压增大,可避免mno4‑
生成副反应的发生,从而保证阳极mno2的电解效率。
74.实施例6
75.向150g/l h2so4溶液中加入一定量的mnso4·
h2o,经溶解和定容后,配制成含50g/l mn
2
的酸性水溶液复合电解质。控制阴/阳极的施加电流密度均为2ma
·
cm
‑2,在25℃下电解12h,通过与实施例5对比,探索mn
2
浓度对电解过程的影响,相关数据汇总于表1。
76.根据阳极增重结果,mno2的产量为0.944g,电流效率可达93.2%,而实施例5中10g/lmn
2
体系下获得的阳极电流效率为89.6%,说明增大体系中mn
2
浓度,可进一步提高阳极mno2的生成效率。
77.实施例7
78.向150g/l h2so4溶液中加入一定量的mnso4·
h2o,经溶解和定容后,配制成含50g/lmn
2
的酸性水溶液复合电解质。将阴极的电流密度提升到300ma
·
cm
‑2,阳极的电流密度提升到50ma
·
cm
‑2,在25℃下电解12h,探索大电流密度下的电解实验,相关数据汇总于表1。
79.根据阳极增重结果,mno2的产量为8.803g,理论增重为9.738g,计算的电流效率可达90.4%。对比实施例6中低电流密度下的阳极电解效率,高电流密度下仍能获得良好的阳极效率,说明大电流密度仍适用于本发明所提出的新型酸性电解水制氢工艺。
80.实施例8
81.向150g/l h2so4溶液中加入一定量的mnso4·
h2o,经溶解和定容后,配置成含50g/lmn
2
的酸性水溶液复合电解质。将阴极的电流密度提升到300ma
·
cm
‑2,阳极的电流密度提升到50ma
·
cm
‑2,在80℃下电解12h,并与实施例7相结合,分析温度对电解过程的影响,相关数据汇总于表1。
82.根据阳极增重结果,mno2的产量为9.271g,理论增重为9.738g,计算的电流效率可达95.2%。对比实施例7中25℃下的阳极电解效率,80℃下的阳极电流效率有明显上升,说明升高温度对阴极电解水制氢和阳极电解制备mno2均有利。
83.实施例9
84.向10g/l h2so4溶液中加入一定量的mnso4·
h2o,经溶解和定容后,配制成5g/lmn
2
的酸性水溶液复合电解质,并将该溶液命名为电解液a;同时,向200g/l h2so4溶液中加入一定量的mnso4·
h2o,经溶解和定容后,配制成100g/lmn
2
的酸性水溶液复合电解质,并将该
溶液命名为电解液b,探索低浓度电解溶液和高浓度电解溶液环境对电解过程的影响。采用电解液a作为短周期的电解质体系,将双石墨片电极(26cm2)用作阴极和阳极,施加电流为0.052a,在阴/阳极电流密度均为2ma
·
cm
‑2下室温(25℃)电解1h;同时,采用电解液b作为长周期的电解质体系,根据实施例4设计的阳极分压控制手段,在阴极电流密度为500ma
·
cm
‑2和阳极电流密度为100ma
·
cm
‑2下室温电解168h(7天)。在长周期电解过程中,每12h向电解槽内添加250ml电解液b,以保证电解液中的离子平衡,并采用蠕动泵对电解液进行循环。相关实验数据汇总于表1。
85.在短周期的温和电解条件下,电解过程响应的槽电压约为2.38v,阳极分压为0.88v,该分压已与mno2的理论生成电位(0.85v vs.hg/hg2so4)非常接近,说明在温和电解条件下,电解水制备mno2和氢气能够达到最佳的工业效果。通过电流效率计算,阳极mno2的增重为0.077g,电流效率可达91.6%。作为对比,在长周期的极端电解条件下,电解过程响应的槽电压为2.66v,阳极分压为1.05v,电解mno2的增重为635.93g,计算的电流效率为89.7%,说明在极端条件下,阳极电解效率也能达到90%左右,标志着本发明所提供的一种电解水制备mno2和氢气的方法在有效降低电解水制氢能耗的同时,还能够高效生成高附加值的mno2产品,具有良好的工业应用前景。
86.表1各实施例的电解实验结果汇总
[0087][0088]
由各实施例的电解实验结果可知,复合电解液中h2so4的浓度为150g/l,mn
2
的浓度为50g/l,阴极电流密度为300ma
·
cm
‑2,阳极电流密度为50ma
·
cm
‑2,电解温度为80℃时能够达到最佳的电解效果,此时的阳极电解效率为95.2%。
[0089]
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。