1.本发明涉及医药和食品领域,具体涉及一种黑莓提取物的制备方法及其应用。
背景技术:
2.酒精滥用与酒精依赖是全球范围内的重要公共卫生问题。随着人民的生活水平不断提高,酒精消费人群在我国逐年升高,酒精中毒造成的神经及消化系统损害也与日俱增。肝脏是乙醇代谢过程中的主要器官,长期酗酒,将会导致酒精性肝损伤(alcoholic liver disease,ald),如脂肪肝,酒精性肝炎,肝纤维化,肝硬化,同时还会增加肝癌的患病几率。根据世界卫生组织(who)的报道,全球有20亿人饮酒,其中超过750万人存在滥用酒精的现象,过度饮酒已成为肝脏疾病的主要发病原因。酒精性肝病是我国继传染性肝病之后的第二大类肝病,且患者人数呈年轻化态势正以惊人的速度上升。肝脏疾病已成为继心脏病和卒中后全球第五大致死性疾病。近年来,具有低毒副作用、多途径、多靶点作用优势的天然产物备受关注,多种食源性天然产物已被报道具有防护酒精性肝损伤的作用,寻找一种具有疗效确切、活性较强的抗酒精性肝损伤的药物、功能饮料或保健食品,具有重要的意义。
3.黑莓(blackberry)为蔷薇科悬钩子属植物,别名覆盆子,原产北美,是近年来世界发展较为迅速的、集营养与保健为一身的新兴水果。其鲜果柔软多汁、风味独特,具有丰富的营养价值;黑莓的药用价值也非常高,具有调节代谢机能、延缓衰老、消除疲劳和提高免疫力等作用,特别是具有降低胆固醇含量、防治心脏疾病和抗癌(降低化疗引起的毒副作用)的功效,被誉为“紫色生命果”。
4.申请号cn201711145154.x,发明名称为一种新型黑莓粉的制备方法及其应用,公开了制备方法:清洗处理,将采收后的黑莓采用清洗剂进行清洗处理;粉碎打浆:将经过清洗处理的黑莓进行初榨后,再进行高压蒸汽喷射,冷风快速冷却至5℃以下,打浆得到第一黑莓原液;混合搅拌:向黑莓原液中加入复合稳定剂,混合均匀,然后使用高速粉碎机进行粉碎,得到第二黑莓原液;生物发酵:将第二黑莓原液用酵母菌进行发酵,得到第三黑莓原液;无菌处理:高温瞬时灭菌,再冷却到30~40℃,得到第四黑莓原液;冻干处理:将第四黑莓原液用真空冷冻干燥机进行冻干、粉碎处理,并用100目筛网过筛,得到新型黑莓粉;还公开了黑莓粉食品中的运用。
5.申请号cn201711145154.x存在的技术问题:1)黑莓原液的提取经过了四次提取,操作复杂,成本高,不易于工业化生产;2)生物发酵易破坏黑莓细胞,影响黑莓原有的成分及质量;采用高温瞬时灭菌,易破坏黑莓的有效成分;4)只提及了黑莓粉食品中的运用,未提及黑莓提取物在抗酒精性肝损伤方面的运用。
6.申请号cn201510433616.2,发明名称为黑莓提取物的制备方法,公开了明公开一种黑莓提取物的制备方法,将清洗干净的黑莓置于匀浆机中,加入重量为黑莓5~10倍的乙醇溶液,匀浆提取;匀浆提取后的滤液置于超声装置中,进行超声提取;将超声提取后的滤液在2℃~8℃下放置后,并离心;将离心后的滤液进行分子蒸馏,在进料速度为100~200g/h、刮膜速度为300~500r/min、蒸馏温度为40℃~50℃、蒸馏压力为100~200pa条件下分离
得到黑莓提取物。本发明提取方法为纯物理方法,匀浆提取法实现了对物料的粉碎、提取一步完成,超声提取法能够深入物料的细胞内部,大幅度提高了有效成分提取率;能够在较温和的条件下进行,从而避免有效成分破坏。
7.申请号cn201510433616.2存在的技术问题:1)黑莓直接置于匀浆机中加入5~10倍的乙醇溶进行提取,未经过酸化除去杂质,易造成提取物杂质多,提取不完全、提取物收率低等现象;2)分子蒸馏制备提取物成本高。
8.申请号cn201510018395.2,发明名称为一种黑莓提取物及其在制备肝脏细胞氧化损伤抑制剂中的应用,公开了一种黑莓提取物,按质量百分含量计,该黑莓提取物的组成为:矢车菊素
‑3‑
葡萄糖苷58.3%~72.5%;矢车菊素
‑3‑
木糖苷11.6%~15.8%;矢车菊素
‑3‑
草酸酰葡萄糖苷9.8%~14.6%;矢车菊素
‑3‑
丙二酰葡萄糖苷3.1%~6.4%;飞燕草素
‑3‑
木糖2.7%~4.1%和矢车菊素
‑3‑
阿拉伯糖苷0.3%~0.8%。提取步骤为:黑莓鲜果依次经胃蛋白酶、胰蛋白酶酶解后,离心分离得到上清液,所述上清液经超滤膜过滤后截留分子量大于10kda的成分,滤出液经真空冷冻干燥,得到所述的黑莓提取物。本发明还公开了该黑莓提取物在制备肝脏细胞氧化损伤的抑制剂中的应用。
9.申请号cn201510018395.2存在的技术问题:1)提取方法复杂,提取需用胃蛋白酶、胰蛋白酶、超滤膜过滤等,成本高;2)该提取物的主要成分为:矢车菊素
‑3‑
葡萄糖苷,矢车菊素
‑3‑
木糖苷,矢车菊素
‑3‑
草酸酰葡萄糖苷,矢车菊素
‑3‑
丙二酰葡萄糖苷,飞燕草素
‑3‑
木糖苷和矢车菊素
‑3‑
阿拉伯糖苷,未提及提取物中的黑莓花色苷;3)该提取物虽然提及了在由丙烯酰胺诱导的肝脏细胞氧化损伤的抑制剂中的应用,但并未针对在抗酒精性肝损伤药物方面的应用。
10.针对以上问题,为了解决目前酒精消费人群中,酒精中毒造成的肝损伤的问题,发明团队结合上述黑莓提取中存在的技术问题,经过了大量实验研究,并对提取中酸化剂、提取剂、超声时间、甲醇体积分数、超声温度、超声时间及超声功率对黑莓花色苷提取率的影响,得到了一种黑莓提取物的制备方法,该制备方法操作简单,有效、提取率高、成本低,利于大规模生产,经过提取物药效学实验研究表明,该提取物对肝细胞变性、肝细胞坏死脂肪沉积、胶原纤维延伸等有病理改变,对抗酒精性肝损伤等方面的有积极作用。
技术实现要素:
11.本发明的目的是提供一种黑莓提取物的制备方法。
12.本发明的另一目的是提供一种黑莓提取物在制备治疗抗酒精性肝损伤药物方面的应用。
13.本发明所述黑莓提取物的制备方法包括以下步骤:
14.(1)取黑莓鲜果或黑莓叶放入冷冻干燥机托盘中,以冷冻干燥参数为
‑
50℃,真空度为60pa,托盘温度为20℃干燥45
‑
52h,粉碎至20
‑
30目,即得冻干粉末,备用;
15.(2)精密称取冻干粉末适量,按料液比为1:4
‑
10g/ml,加入含有0.1%甲酸的60
‑
80%甲醇溶液作为提取溶液,采用超声法、回流法、浸渍法的任一种提取方法提取3次,提取液抽滤合并,浓缩至相对密度为1.1
‑
1.5的浸膏,备用;
16.(3)取浸膏,采用真空冷冻干燥,得到黑莓提取物。
17.优选的
18.本发明所述黑莓提取物的制备方法包括以下步骤:
19.(1)取黑莓鲜果或黑莓叶放入冷冻干燥机托盘中,以冷冻干燥参数为
‑
50℃,真空度为60pa,托盘温度为20℃干燥48h,粉碎至20
‑
30目,即得冻干粉末,备用;
20.(2)精密称取冻干粉末适量,按料液比为1:8g/ml,加入含有0.1%甲酸的70%甲醇溶液作为提取溶液,采用回流法、超声法、浸渍法的任一种提取方法提取3次,提取液抽滤合并,浓缩至相对密度为1.3的浸膏,备用;
21.(3)取浸膏,采用真空冷冻干燥,得到黑莓提取物。
22.本发明步骤2)所述的超声法、回流法、浸渍法;其中,所述超声法:温度为40℃,功率为300w、时间为90min;所述回流法:提取温度为35℃,时间为90min;所述浸渍法:浸提时间为3h/次。
23.本发明步骤3)还可以为:
24.取浸膏,采用含有0.1%甲酸的10%乙醇进行复溶,复溶比1:5
‑
10,超声使其完全溶解,将浸膏复溶液用30
‑
60目的聚酰胺色谱进行纯化,再用10个保留体积的10%,20个保留体积的30%浓度乙醇以及15个保留体积的50%浓度乙醇进行洗脱,收集30%及50%乙醇洗脱馏分,收集洗脱液至无色,40℃下减压浓缩,并冷冻干燥,得到黑莓提取物。
25.本发明所述的黑莓提取物在制备治疗抗酒精性肝损伤药物方面的应用。
26.本发明所述的黑莓提取物在制备治疗酒精性脂肪肝、肝纤维化、肝硬化、肝腹水、肝炎药物方面的应用。
27.本发明所述药物可以加入药学上可接受的辅料制成颗粒剂、片剂、胶囊剂、口服液、糖浆剂、合剂、丸剂或散剂。
28.本发明所述黑莓提取物在抗酒精性肝损伤的总有效剂量为25
‑
100mg/kg/d。
29.所述的黑莓提取物主成分为黑莓花色苷。
30.本发明所述的黑莓提取物在制备保健食品及其功能饮料方面的应用。
31.本发明有益效果:
32.1、本发明制备方法通过了对酸化剂、提取剂、超声时间、甲醇体积分数、超声温度、超声时间及超声功率的优化实验得到的,该制备方法得到的黑莓提取物能够有效降低酒精性肝损伤的危害,同模型组相比较,黑莓提取物能够显著降低小鼠肝指数以及血清中ast、alt、sod、mda的水平,同时h&e染色显示,黑莓提取物能够改善小鼠酒精性肝损伤造成的组织空泡变性、水肿、炎症以及细胞坏死等细胞形态变化;红油o染色显示,黑莓提取物能够改善小鼠酒精性肝损伤造成的脂肪沉积,降低脂滴晕染面积;天狼星红染色显示,黑莓提取物能够改善酒精性肝损伤中胶原纤维的延伸,减弱酒精造成的肝纤维化程度。
33.2、本发明制备方法参数通过了响应面模型的建立与分析实验,采用design
‑
expert 8.0软件对回归模型进行方差分析,得到花色苷提取率对甲醇体积分数(a)、料液比(b)、超声时间(c)、超声功率(d)、超声温度(e),最终得到黑莓花色苷提取率与因素变量的多元二次方程模型:y(花色苷提取率)=2775.40 46.8a 17.08b 0.16c 0.27d 12.64ce 0.16de 1356.10a2 668.75b2 597.06c2 772.99d2 1341.82e2,由方差分析表3可知,模型的显著水平p<0.0001,说明该回归方差模型是显著的。此外,还进行了黑莓提取物降解动力学分析。
34.3、本发明根据实验结果各因素关于黑莓花色苷含量的响应面的三维图和等高图
可以看出响应面开口朝下,花色苷提取率随各因素的变化呈先增加后减少的趋势,说明此模型存在最大值的稳定点。最终根据f值和p值,回归模型与实测值能较好的拟合,所以该模型可以预测和分析黑莓花色苷提取工艺结果。根据响应面的陡峭程度可知,各个因素对黑莓花色苷提取量影响的大小顺序为:超声温度(e)>甲醇体积分数(a)>料液比(b)>超声功率(c)>超声时间(d)。根据所得模型,可预测黑莓花色苷提取最优工艺参数为:甲酸酸化的70%甲醇,料液比1:8,超声时间90min,超声温度40℃,超声功率300w,提取率约为52.00%。
35.4、本发明通过最佳条件的确定和回归模型的验证,结果系统模型优化的最佳提取方案为超声功率299.81w,超声温度37.69℃,甲醇体积分数70.99%,料液比1:9.58,超声时间为89.90min,提取效率模型值52.2467%,由于实际工艺条件和应用方便,选择甲醇体积分数70%,料液比1:10,超声时间90min,超声温度38℃,超声功率300w,在此条件下,花色苷提取率为52.00%,与理论值相差不大,表明此模型能较好地测定黑莓中花色苷含量。
36.5、本发明通过了黑莓花色苷的降解动力学分析,结果表明,黑莓花色苷降解符合动力学一级反应,降解常数k随温度和ph值的升高而增大;t1/2则随温度和ph值的升高而减小,活化能随着ph值的增大而减小,在ph=2时的热稳定性最高,说明黑莓花色苷在ph近似为2环境下时降解需要的能量最高,反之最稳定,不易分解。本实验结果为黑莓花色苷在食品、药品和化妆品等行业中的生产、运输、储存、使用等过程中的提取和防分解提供了一定的实验基础和理论依据。
附图说明:
37.图1提取方法对花色苷提取率的影响;
38.图2提取溶剂对花色苷提取率的影响;
39.图3酸化剂对花色苷提取率的影响;
40.图4甲醇体积分数对花色苷提取率的影响;
41.图5料液比对花色苷提取率的影响;
42.图6超声功率对花色苷提取率的影响;
43.图7超声时间对花色苷提取率的影响;
44.图8超声温度对花色苷提取率的影响;
45.图9响应面优化法优化黑莓花色苷三维图;
46.图10响应面优化法优化黑莓花色苷等高图;
47.图11不同ph值、温度和加热时间处理下黑莓花色苷的热降解(图中a:ph=1,b:ph=2,c:ph=3,d:ph=4);
48.图12病理组织学观察h&e染色评价黑莓提取物对慢性(a)、急性(b)酒精性肝脏损伤的影响(
×
400倍).(从左到右一次为:空白组、模型组、低剂量组、中剂量组、高剂量组、阳性药组);
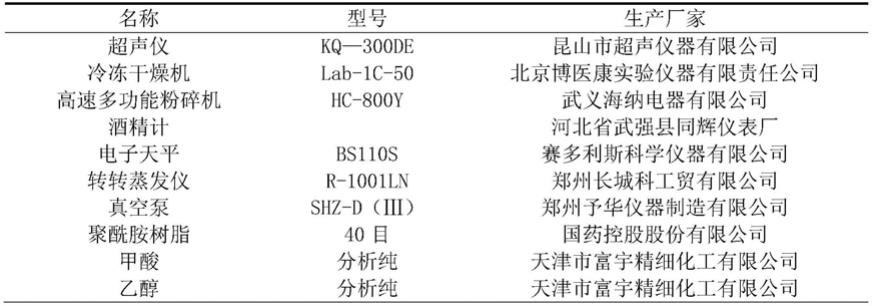
49.图13病理组织学观察红油o染色评价黑莓花色苷对慢性(a)、急性(b)酒精性肝脏损伤的影响(
×
400倍).(从左到右一次为:空白组、模型组、低剂量组、中剂量组、高剂量组、阳性药组);
50.图14理组织学观察天狼星红染色评价黑莓花色苷对慢性(a)、急性(b)酒精性肝脏
损伤的影响(
×
100倍).(从左到右一次为:空白组、模型组、低剂量组、中剂量组、高剂量组、阳性药组)。
51.下面通过具体实施例,对本发明的技术方案作进一步地具体说明。
52.实施例1 黑莓提取物的制备
53.(1)取黑莓鲜果1000g放入冷冻干燥机托盘中,以冷冻干燥参数为
‑
50℃,真空度为60pa,托盘温度为20℃干燥48h,粉碎至20目,即得冻干粉末,备用;
54.(2)精密称取冻干粉末3.00g,按料液比为1:8g/ml,加入含有0.1%甲酸的70%甲醇溶液作为提取溶液,以温度为40℃,功率为300w超声法提取90min,重复提取3次,提取液抽滤合并,浓缩至相对密度为1.3的浸膏,备用;
55.(3)取浸膏,采用真空冷冻干燥,得到黑莓提取物。
56.实施例2 黑莓提取物的制备
57.(1)取黑莓鲜果1000g放入冷冻干燥机托盘中,以冷冻干燥参数为
‑
50℃,真空度为60pa,托盘温度为20℃干燥45h,粉碎至20目,即得冻干粉末,备用;
58.(2)精密称取冻干粉末3.00g,按料液比为1:4g/ml,加入含有0.1%甲酸的60%甲醇溶液作为提取溶液,以温度为40℃,功率为300w超声法提取90min,重复提取3次,提取液抽滤合并,浓缩至相对密度为1.1的浸膏,备用;
59.(3)取浸膏,采用真空冷冻干燥,得到黑莓提取物。
60.实施例3 黑莓提取物的制备
61.(1)取黑莓鲜果1000g放入冷冻干燥机托盘中,以冷冻干燥参数为
‑
50℃,真空度为60pa,托盘温度为20℃干燥52h,粉碎至30目,即得冻干粉末,备用;
62.(2)精密称取冻干粉末3.00g,按料液比为1:10g/ml,加入含有0.1%甲酸的80%甲醇溶液作为提取溶液,以温度为40℃,功率为300w超声法提取90min,重复提取3次,提取液抽滤合并,浓缩至相对密度为1.5的浸膏,备用;
63.(3)取浸膏,采用真空冷冻干燥,得到黑莓提取物。
64.实施例4 黑莓提取物的制备
65.(1)取黑莓叶1000g放入冷冻干燥机托盘中,以冷冻干燥参数为
‑
50℃,真空度为60pa,托盘温度为20℃干燥48h,粉碎至20目,即得冻干粉末,备用;
66.(2)精密称取冻干粉末3.00g,按料液比为1:8g/ml,加入含有0.1%甲酸的70%甲醇溶液作为提取溶液,以温度为40℃,功率为300w超声法提取90min,重复提取3次,提取液抽滤合并,浓缩至相对密度为1.3的浸膏,备用;
67.(3)取浸膏,采用真空冷冻干燥,得到黑莓提取物。
68.实施例5 黑莓提取物的制备
69.(1)取黑莓鲜果1000g放入冷冻干燥机托盘中,以冷冻干燥参数为
‑
50℃,真空度为60pa,托盘温度为20℃干燥48h,粉碎至20目,即得冻干粉末,备用;
70.(2)精密称取冻干粉末3.00g,按料液比为1:8g/ml,加入含有0.1%甲酸的70%甲醇溶液作为提取溶液,以温度为35℃回流提取90min,重复提取3次,提取液抽滤合并,浓缩至相对密度为1.3的浸膏,备用;
71.(3)取浸膏,采用真空冷冻干燥,得到黑莓提取物。
72.实施例6 黑莓提取物的制备
73.(1)取黑莓叶1000g放入冷冻干燥机托盘中,以冷冻干燥参数为
‑
50℃,真空度为60pa,托盘温度为20℃干燥48h,粉碎至20目,即得冻干粉末,备用;
74.(2)精密称取冻干粉末3.00g,按料液比为1:8g/ml,加入含有0.1%甲酸的70%甲醇溶液作为提取溶液,以温度为35℃回流提取90min,重复提取3次,提取液抽滤合并,浓缩至相对密度为1.3的浸膏,备用;
75.(3)取浸膏,采用真空冷冻干燥,得到黑莓提取物。
76.实施例7 黑莓提取物的制备
77.(1)取黑莓鲜果1000g放入冷冻干燥机托盘中,以冷冻干燥参数为
‑
50℃,真空度为60pa,托盘温度为20℃干燥48h,粉碎至20目,即得冻干粉末,备用;
78.(2)精密称取冻干粉末3.00g,按料液比为1:8g/ml,加入含有0.1%甲酸的70%甲醇溶液作为提取溶液,以3h/次进行浸渍提取,重复提取3次,提取液抽滤合并,浓缩至相对密度为1.3的浸膏,备用;
79.(3)取浸膏,采用真空冷冻干燥,得到黑莓提取物。
80.实施例8 黑莓提取物的制备
81.(1)取黑莓叶1000g放入冷冻干燥机托盘中,以冷冻干燥参数为
‑
50℃,真空度为60pa,托盘温度为20℃干燥48h,粉碎至20目,即得冻干粉末,备用;
82.(2)精密称取冻干粉末3.00g,按料液比为1:8g/ml,加入含有0.1%甲酸的70%甲醇溶液作为提取溶液,以3h/次进行浸渍提取,重复提取3次,提取液抽滤合并,浓缩至相对密度为1.3的浸膏,备用;
83.(3)取浸膏,采用真空冷冻干燥,得到黑莓提取物。
84.实施例9 黑莓提取物的制备
85.(1)取黑莓鲜果1000g放入冷冻干燥机托盘中,以冷冻干燥参数为
‑
50℃,真空度为60pa,托盘温度为20℃干燥48h,粉碎至20目,即得冻干粉末,备用;
86.(2)精密称取冻干粉末3.00g,按料液比为1:8g/ml,加入含有0.1%甲酸的70%甲醇溶液作为提取溶液,以温度为40℃,功率为300w超声法提取90min,重复提取3次,提取液抽滤合并,浓缩至相对密度为1.3的浸膏,备用;
87.(3)取浸膏,采用含有0.1%甲酸的10%乙醇进行复溶,复溶比1:8,超声使其完全溶解,将浸膏复溶液用40目的聚酰胺色谱进行纯化,再用10个保留体积的10%,20个保留体积的30%浓度乙醇以及15个保留体积的50%浓度乙醇进行洗脱,收集30%及50%乙醇洗脱馏分,收集洗脱液至无色,40℃下减压浓缩,并冷冻干燥,得到黑莓提取物。
88.实施例10 黑莓提取物的制备
89.(1)取黑莓叶1000g放入冷冻干燥机托盘中,以冷冻干燥参数为
‑
50℃,真空度为60pa,托盘温度为20℃干燥48h,粉碎至20目,即得冻干粉末,备用;
90.(2)精密称取冻干粉末3.00g,按料液比为1:8g/ml,加入含有0.1%甲酸的70%甲醇溶液作为提取溶液,以温度为40℃,功率为300w超声法提取90min,重复提取3次,提取液抽滤合并,浓缩至相对密度为1.3的浸膏,备用;
91.(3)取浸膏,采用含有0.1%甲酸的10%乙醇进行复溶,复溶比1:8,超声使其完全溶解,将浸膏复溶液用40目的聚酰胺色谱进行纯化,再用10个保留体积的10%,20个保留体积的30%浓度乙醇以及15个保留体积的50%浓度乙醇进行洗脱,收集30%及50%乙醇洗脱
馏分,收集洗脱液至无色,40℃下减压浓缩,并冷冻干燥,得到黑莓提取物。
92.实施例11 取黑莓提取物,加入5%的微晶纤维素和20%的蔗糖,得颗粒剂。
93.实施例12 取黑莓提取物,加入20%的淀粉桨和0.2%的糊精,制粒,压片,制成片剂。
94.实施例13 取黑莓提取物,加入5%的预胶化淀粉、5%微晶纤维素和3%滑石粉混匀,装入胶囊,得胶囊剂。
95.实施例14 取黑莓提取物,加入15倍量纯净水和0.02%丙二醇,混合均匀,过滤,灭菌,得口服液。
96.实施例15 取黑莓提取物,加入5倍量纯净水和45%的蔗糖和0.03%对羟基苯甲酸,混合均匀,灭菌,得糖浆剂。
97.实施例16 取黑莓提取物,加入5%的炼蜜和5%的水混合均匀,制成丸剂。
98.实施例17 取黑莓提取物,加入5%的乙基纤维素和20%的淀粉,得颗粒剂。
99.实施例18 取黑莓提取物,加入苯甲酸钠0.03%和10%的水,得合剂。
100.为了进一步验证本发明的可行性及有效性,发明人进行了一系列的试验,具体如下:
101.一、黑莓提取物提取方法的筛选
102.1仪器及试剂、材料
103.1.1仪器及试剂
[0104][0105]
1.2材料
[0106]
实验药材(黑莓鲜果):南京行悠果维黑莓基地,批号20200823
[0107]
2提取方法筛选
[0108]
2.1黑莓鲜果的冻干
[0109]
取适量黑莓鲜果放入冷冻干燥机托盘中,均匀铺开,设置冷冻干燥参数为
‑
50℃,真空度为60pa,托盘温度为20℃。冷冻干燥48h,取出放置于
‑
20℃冷冻保存,并破碎成粉末待用。
[0110]
2.2提取方法的优化
[0111]
准确称取3.00g黑莓冻干果粉末3份,分别按料液比1:10g/ml分别加入70%甲醇(含0.1%甲酸)作为提取溶液,分别采用回流法、超声法、浸渍法提取,超声和回流温度为35℃,时间90min,超声功率300w,浸提时间为3h/次,提取3次,提取液抽滤合并,浓缩,冻干,计算花色苷提取率,平行实验3次。
[0112]
结果:提取方法对花色苷提取率影响的结果见图1。由图1可知,采用超声、浸提、回流三种方法对黑莓花色苷进行提取,提取率各不相同。回流提取得到的花色苷提取率最低,原因可能是回流提取过程中,导致局部温度过高,使得花色苷的结构受到破坏,同时,回流提取容易造成杂质溶出较多。超声和浸提的提取率相差不大,但考虑到浸提耗时较长,故选择超声作为最优的提取方法。
[0113]
2.3提取溶剂的优化
[0114]
准确称取3.00g黑莓冻干果粉末4份,分别按料液比1:10g/ml,分别加入70%甲醇溶液、75%乙醇溶液、75%丙酮溶液及超纯水作提取剂,超声温度为35℃,超声时间90min,超声功率300w,提取3次,提取液抽滤合并,浓缩,冻干,计算花色苷提取率,平行实验3次。
[0115]
结果:取溶剂对花色苷提取率影响的结果见图2。由图2可知,采用75%丙酮、70%甲醇、75%乙醇及超纯水作提取剂对黑莓花色苷进行提取,提取率具有显著性差异(p<0.05)。70%甲醇作提取剂时花色苷提取率最高,其次为75%乙醇、75%丙酮和超纯水,原因可能是由于花色苷的极性较大,在丙酮的溶解度较小,而在超纯水中除了花色苷类成分,有大量的多糖被提取出来,降低了花色苷的提取率,同时考虑试剂的安全性问题,故选择70%甲醇作为提取溶剂。
[0116]
2.4酸化剂的优化
[0117]
准确称取3.00g黑莓冻干果粉末4份,分别按料液比1:10g/ml,分别在70%甲醇中加入0.1%乙酸、盐酸、磷酸、甲酸作酸化剂,超声温度为35℃,超声时间90min,超声功率300w,提取3次,提取液抽滤合并,浓缩,冻干,计算花色苷提取率,平行实验3次。
[0118]
结果:酸化剂对花色苷提取率影响结果见图3。由图3可知,甲酸作为酸化剂提取花色苷提取率最高,其次为乙酸、柠檬酸、盐酸和磷酸,故选择甲酸作为酸化剂。
[0119]
2.5黑莓花色苷提取单因素考察实验
[0120]
称取3.00g黑莓冻干果粉末,以酸性甲醇为提取剂,超声辅助提取,选取甲醇体积分数、超声功率、超声时间、超声温度、料液比作为自变量分别进行单因素试验。
[0121]
2.5.1甲醇体积分数的优化
[0122]
准确称取3.00g黑莓冻干果粉末4份,按料液比为1:10g/ml,分别加入提取溶剂为35%、55%、70%、95%甲醇(含0.1%甲酸),在功率为300w条件下进行超声提取,超声温度为35℃,超声时间90min,提取3次,提取液抽滤合并,浓缩,冻干,计算花色苷提取率,平行实验3次。
[0123]
结果:甲醇体积分数对花色苷提取率影响结果见图4。由图4可知,70%甲醇提取花色苷提取率最高,其次为35%甲醇、55%甲醇和95%甲醇。这可能是由于低浓度甲醇条件下,大量的大极性杂质被一起提取出来,降低了花色苷的纯化,而高浓度下的95%甲醇,极性较小,导致大量的极性偏大花色苷没有被完全提取出来,因此适宜的甲醇的浓度为70%甲醇。
[0124]
2.5.2料液比的优化
[0125]
准确称取3.00g黑莓冻干果粉末4份,提取溶剂为70%甲醇(含0.1%甲酸),分别按照料液比为1:2、1:4、1:8、1:16g/ml,在功率为300w条件下进行超声提取,超声温度为35℃,超声时间90min,提取3次,提取液抽滤合并,浓缩,冻干,计算花色苷提取率,平行实验3次。
[0126]
结果:料液比对花色苷提取率影响结果见图5。由图5可知,料液比在1.4
‑
1:8范围
内,花色苷的提取率随着料液比的增加而升高,当料液比为1:8时,花色苷提取率最高,当料液比高于1:8时,提取率有所下降。可能是因为料液比太小时,溶剂不能有效浸润样品,无法完全有效提取出花色苷,因而花色苷提取率较低;料液比的增大,可以使固液两相的浓度差增大,传质推动力提高,有助于花色苷的提取,而料液比过大时,样品中醇溶性杂质大量被吸附,溶液升温速度较慢,导致花色苷无法完全浸出。也可能是由于超声波在溶液中传播时,声波能量随着传播距离的增加急速衰减,因而随着固液比的增加,体系中总的溶液体积增大,在距离声源较远的距离处,超声波能量降低,空化能力削弱,不利于花色苷的溶出。因此,选用料液比为1:8为适宜的比例。
[0127]
2.5.3超声功率的优化
[0128]
准确称取3.00g黑莓冻干果粉末4份,按料液比为1:10g/ml,提取溶剂为70%甲醇(含0.1%甲酸),在功率为100、200、300、400w条件下进行超声提取,超声温度为35℃,超声时间90min,提取3次,提取液抽滤合并,浓缩,冻干,计算花色苷提取率,平行实验3次。
[0129]
结果:超声功率对花色苷提取率影响结果见图6。由图6可知,在超声功率为200
‑
300w范围内,随着功率的增加,花色苷提取率增加,当超声功率高于300w后,随着功率的增加,提取率反而有所下降。这可能是因为超声波在媒质中传播时可产生空化现象,空化中产生的极大压力造成被破碎物在瞬间破碎,同时,超声波产生的振动作用加强了被破碎物的扩散及溶解。功率加大,空化及机械作用以增大物分子运动频率和速率,从而增加溶剂穿透力,提高花色苷的溶出。功率大于300w,色素含量降低。可能原因是超声波频率过大,作用过程中媒质升温过高,导致花色苷发生降解,提取量降低。因此,选择超声功率为300w作为最适宜功率。
[0130]
2.5.4超声时间的优化
[0131]
准确称取3.00g黑莓冻干果粉末4份,按料液比为1:10g/ml,提取溶剂为70%甲醇(含0.1%甲酸),在功率为300w条件下进行超声提取,超声温度为35℃,超声时间分别为30、60、90、120min,提取3次,提取液抽滤合并,浓缩,冻干,计算花色苷提取率,平行实验3次。
[0132]
结果:超声时间对花色苷提取率影响结果见图7。由图7可知,在30
‑
90min内,随着超声时间的增加,花色苷提取率增加,当超声时间超过90min后,花色苷提取率下降,这可能是因为随着超声时间延长,总花色苷逐渐溶于甲醇提取液,得率逐渐增大。而超声时间超过90min,一方面溶剂蒸发,另一方面总花色苷结构可能受到破坏,被分解、降解或氧化为其他物质,导致提取率下降
[30,31]
。
[0133]
2.5.5超声温度的优化
[0134]
准确称取3.00g黑莓冻干果粉末4份,按料液比为1:10g/ml,提取溶剂为70%甲醇(含0.1%甲酸),在功率为300w条件下进行超声提取,超声温度分别为20、40、60、80℃,超声时间为90min,提取3次,提取液抽滤合并,浓缩,冻干,计算花色苷提取率,平行实验3次。
[0135]
结果:超声温度对花色苷提取率影响结果见图8。由图8可知,在20
‑
40℃范围内,随着温度的升高,花色苷提取率增加,待超过40℃后,花色苷提取率随着温度的增加而有所下降,这可能是因为花色苷为热敏性成分,高温条件下,花色苷的结构受到破坏,糖苷键容易发生断裂,且提取溶剂的挥发导致花色苷的溶出减少,使得花色苷的提取率下降。因此,实验选择40℃作为超声温度。
[0136]
2.6响应面优化实验的设计
[0137]
根据上述各单因素考察实验结果,采用design expert 8.0软件的box
‑
behnken模型进行实验设计及响应面分析。综合单因素试验结果,以超声功率、超声温度、超声时间、料液比和甲醇体积分数设计五因素三水平的响应面实验,以花色苷提取率为响应值进行分析,得到最优提取工艺条件。结果见表1、表2。
[0138]
表1 响应面分析因素与水平
[0139][0140][0141]
2.6.1响应面模型的建立与分析
[0142]
采用design
‑
expert 8.0软件对回归模型进行方差分析,得到花色苷提取率对甲醇体积分数(a)、料液比(b)、超声时间(c)、超声功率(d)、超声温度(e),最终得到黑莓花色苷提取率与因素变量的多元二次方程模型:y(花色苷提取率)=2775.40 46.82a 17.08b 0.16c 0.27d 12.64ce 0.16de 1356.10a2 668.75b2 597.06c2 772.99d2 1341.82e2,由方差分析表3可知,模型的显著水平p<0.0001,说明该回归方差模型是显著的。
[0143]
根据实验结果各因素关于黑莓花色苷含量的响应面的三维图和等高图见图9、图10,从图中可以看出响应面开口朝下,花色苷提取率随各因素的变化呈先增加后减少的趋势,说明此模型存在最大值的稳定点。最终根据f值和p值,回归模型与实测值能较好的拟合,所以该模型可以预测和分析黑莓花色苷提取工艺结果。根据响应面的陡峭程度可知,各个因素对黑莓花色苷提取量影响的大小顺序为:超声温度(e)>甲醇体积分数(a)>料液比(b)>超声功率(c)>超声时间(d)。根据所得模型,可预测黑莓花色苷提取最优工艺参数为:甲酸酸化的70%甲醇,料液比1:8,超声时间90min,超声温度40℃,超声功率300w,提取率约为52.00%。
[0144]
表2 box
‑
behnken试验设计及响应面分析结果
[0145]
[0146][0147]
表3 回归模型方差分析
[0148]
[0149][0150]
2.6.2最佳条件的确定和回归模型的验证
[0151]
系统模型优化的最佳提取方案为超声功率299.81w,超声温度37.69℃,甲醇体积分数70.99%,料液比1:9.58,超声时间为89.90min,提取效率模型值52.2467%,由于实际工艺条件和应用方便,选择甲醇体积分数70%,料液比1:10,超声时间90min,超声温度38℃,超声功率300w,在此条件下,花色苷提取率为52.00%,与理论值相差不大,表明此模型能较好地测定黑莓中花色苷含量。
[0152]
2.7黑莓花色苷热降解动力学分析
[0153]
配制ph为1、2、3、4的去离子水备用,取1.00g黑莓冻干果粉末4份于100ml容量瓶中,去离子水定容,配制成1.0mg/ml的溶液,吸取适量分别置于25℃、55℃、75℃、95℃恒温水浴锅中,每隔1h取1ml,迅速冷水冷却,避光保存待测,共取5次。平行测三次计算取平均值。结果见图11。
[0154]
根据花色苷残留率,按以下公式计算一级动力学反应速率常数(k):
[0155]
ln(ct/c0)=
‑
kt
[0156]
式中c0为加热黑莓花色苷初始浓度,ct为加热黑莓花色苷浓度,t为热处理时间(h)。
[0157]
黑莓花色苷降解的半衰期(t1/2)用下式计算:
[0158]
t1/2=
‑
ln0.5/k
[0159]
黑莓花色苷热降解活化能[ea(kj/mol)]根据以下公式计算:
[0160]
lnk=lnk0‑
ea/rt
[0161]
式中k为降解速率常数(min
‑
1),r为气体常数(8.314
×
10
‑
3kj/mol
·
k),k0为频率常数(min
‑
1),t为温度(k)。
[0162]
2.7.1ph值和温度对黑莓花色苷稳定性的影响
[0163]
由图11可知,在同一ph条件下,花色苷的降解速率随着温度的升高而增加,表明在低温条件下有利于花色苷的稳定,高温条件下花色苷不稳定,易降解或转变为其他物质。此外,随着ph值得增高,降解速率k值也随之增大,表明在高ph环境下时花色苷易降解,而在低ph环境下时花色苷稳定。
[0164]
2.6.2黑莓花色苷降解动力学解析
[0165]
分别以25、55、75、95℃条件下黑莓花色苷水浴后1h的质量浓度为起始值,测吸光度(质量浓度与吸光度a成正比关系),以花色苷质量浓度保存率对数的负值
‑
ln(ct/c0)对加热时间t作图,如上图11所示。分别进行线性回归,得回归方程和斜率,可知
‑
ln(ct/c0)和t明显成线性关系,由公式ln(ct/c0)=
‑
kt可知,黑莓花色苷的热降解符合一级反应模型,其反应级数为一级反应。
[0166]
此外,由公式
‑
ln(ct/c0)=
‑
kt及图11可知,黑莓花色苷浓度保存率对数的负值
‑
ln(ct/c0)对加热时间t作图所得直线的斜率即为该温度时的热降解反应常数k。根据同温度时的k值,以lnk对1/t作线性回归,由公式lnk=lnk0
‑
ea/rt可得,直线的斜率为
‑
ea/r,由直线的斜率和截距即可求出活化能ea。
[0167]
不同温度及ph值条件下,黑莓花色苷热降解速率常数(k)、半衰期(t1/2)及活化能(ea)的变化见表4。从表4数据可知,不同温度和ph值对黑莓花色苷热降解速率常数(k)及半衰期(t1/2)有显著影响。k值随温度和ph值的升高而增大;t1/2则随温度和ph值的升高而减小;活化能代表物质在发生转变时需要越过的能垒,能垒越高则物质的稳定性越高,结合试验数据分析可知花色苷的活化能随着ph值的增大而减小,表明花色苷在ph=2时的热稳定性最高。这些结果表明,较高温度下黑莓花色苷极易降解,低温和低ph值有利于保持其稳定性。
[0168]
表4 不同温度和ph值对黑莓花色苷热降解速率常数(k),半衰期(t1/2)及活化能(ea)的影响
[0169]
[0170][0171]
3结论
[0172]
本文研究了酸化剂、提取剂、超声时间、甲醇体积分数、超声温度、超声时间及超声功率对黑莓花色苷提取率的影响,确定甲酸为酸化剂,采用超声辅助提取,甲醇为提取剂,通过响应面优化了超声时间、超声温度、甲醇体积分数、超声功率和超声时间对黑莓花色苷提取率的影响最优工艺参数为:甲酸酸化的70%甲醇,料液比1:8,超声时间90min,超声温度40℃,超声功率300w,提取率约为52.00%。响应面优化实验结果为:各因素对响应值的显著性影响表现为超声温度(e)>甲醇体积分数(a)>为料液比(b)>超声功率>超声时间(d),优化实验结果表明该模型对黑莓花色苷的提取工艺优化具有一定的实际价值。热降解动力学实验表明,黑莓花色苷降解符合动力学一级反应,降解常数k随温度和ph值的升高而增大;t1/2则随温度和ph值的升高而减小,活化能随着ph值的增大而减小,在ph=2时的热稳定性最高,说明黑莓花色苷在ph近似为2环境下时降解需要的能量最高,反之最稳定,不易分解。本实验结果为黑莓花色苷在食品、药品和化妆品等行业中的生产、运输、储存、使用等过
[0173]
程中的提取和防分解提供了一定的实验基础和理论依据。
[0174]
二、提取物药效学实验研究
[0175]
1材料与方法
[0176]
1.1样品:黑莓提取物。
[0177]
1.2实验动物:昆明种小鼠,雄性,18
‑
22克,每组10只。
[0178]
2实验方法:
[0179]
2.1剂量和分组
[0180]
实验分为空白组(急性、慢性)、模型组(急性、慢性)、黑莓提取物低(25mg/kg/d)、中(50mg/kg/d)、高(100mg/kg/d)三个剂量组(急性、慢性)、联苯双酯滴丸阳性药组(急性、慢性)。
[0181]
2.2受试样品的给予
[0182]
称取受试样品适量,研磨,溶于0.5%羧甲基纤维素钠溶液中,混合均匀,经口灌胃
with control:***,p<0.001.compared with model:
###
,p<0.001.
[0193]
2.4镜检
[0194]
用相应倍数显微镜连续观察整张组织切片,主要观察肝细胞变性、肝细胞坏死脂肪沉积、胶原纤维延伸等病理改变,并同时给予记录。结果见图12、图13、图14。
[0195]
虽然,上文中已经用一般性说明、具体实施方式及试验,对本发明作了详尽的描述,但在本发明基础上,可以对之作出一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。