1.本发明属于微环境敏感型荧光探针领域,具体涉及一系列新型环境敏感型荧光有机小分子化合物及其合成方法和应用。
背景技术:
2.荧光探针,是指在紫外
‑
可见
‑
近红外区有特征荧光发射,并且其荧光性质(包括荧光波长、强度、寿命、偏振等)会随着周围环境的性质变化,如极性、粘度、相互作用的分子等,而做出灵敏改变的一类荧光活性物质。由于其对特定环境改变(包括物理和化学改变)的灵敏响应,以及对特定待测物的特应性识别和标记,荧光探针已经被广泛地应用在工业、农业以及生化研究领域。
3.目前常用的荧光探针有聚合物荧光探针、有机小分子荧光探针、量子点等。其中,有机小分子探针因为其分子结构可设计性强,且合成简单、可重复性好等优点,备受关注。有机小分子荧光探针通常由识别基团、荧光团和连接部分组成。荧光团在整个荧光体系中起主导作用,目前常见的有机小分子荧光团主要有香豆素、1,8
‑
萘酰亚胺、罗丹明、氟硼荧类染料。通过对这些荧光团的母体进行修饰,就可以得到具有特异性检测的探针。
4.除了基于化学作用的化学反应型荧光探针,有一部分荧光探针是通过感知周围环境的物理变化,通过物理作用来影响其荧光并进行识别或标记的,比如环境敏感极性荧光探针与环境敏感粘度荧光探针。这些探针分子都具有ict(intramolecular charge transfer,ict)的结构特点。因为只有少量的ict荧光染料分子的荧光性质受到环境粘度的影响,相对于环境敏感极性荧光探针,环境敏感粘度荧光探针报道的数量和种类都较少。
5.目前已报道的环境敏感粘度荧光探针,大多为氮杂环/n,n
‑
二烷基胺基
‑
荧光团组成的d(donor)
‑
a(acceptor)或d
‑
π
‑
a的分子结构。粘度的改变能够影响分子内键的转动,从而影响这类分子的非辐射跃迁过程及荧光量子产率。但这些分子的d(donor)与a(acceptor)之间的连接键为碳
‑
氮键,共轭后会带有部分双键的性质,便大大降低了其粘度敏感性。
技术实现要素:
6.针对现有技术中存在的问题,本发明提供一种微环境敏感型荧光有机小分子化合物及其合成方法和应用,所述荧光有机小分子在具有极性敏感性的同时,也具有较好的粘度敏感性。
7.本发明是通过以下技术方案来实现:
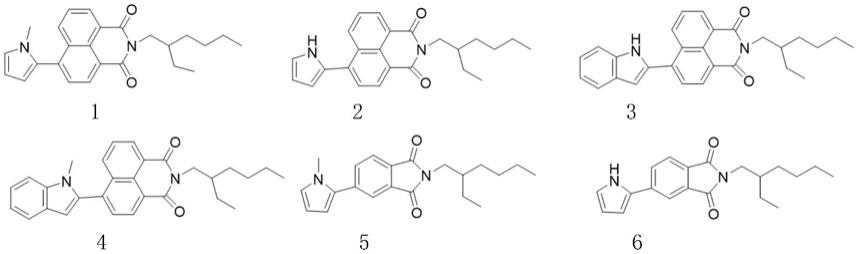
8.微环境敏感型荧光有机小分子化合物,其为如下化合物中的一种:
[0009][0010][0011]
所述的微环境敏感型荧光有机小分子化合物的制备方法,为如下方法中的一种:
[0012]
方法一:
[0013]
将4
‑
溴
‑
1,8
‑
萘二甲酸酐、2
‑
乙基己胺和乙醇搅拌混合,加热回流;待反应结束后,冷却至室温,加水产生黄色沉淀物,抽滤收集沉淀,洗涤滤饼,干燥,制得化合物nap;
[0014]
将化合物nap和n,n
‑
二甲基甲酰胺以及n
‑
甲基吡咯或吡咯混合,鼓泡法除氧后,在惰性气体氛围下,400nm光照下搅拌,待反应结束后,减压除去溶剂,柱色谱分离,得到产物;
[0015]
或者将化合物nap、碳酸钾、双三苯基磷二氯化钯、四氢呋喃和水以及吲哚
‑2‑
硼酸频哪醇酯或1
‑
甲基吲哚
‑2‑
硼酸混合,在惰性气体氛围下,搅拌,加热回流;待反应结束后,用二氯甲烷对溶液进行萃取,收集有机相,减压除去溶剂,柱色谱分离,得到产物;
[0016]
方法二:
[0017]
将邻苯二甲酰亚胺、2
‑
乙基己胺和冰醋酸搅拌混合,加热回流;待反应结束后,冷却至室温,加水产生白色沉淀物,抽滤收集沉淀,洗涤滤饼,干燥,制得化合物pmd;
[0018]
将化合物pmd和n,n
‑
二甲基甲酰胺以及n
‑
甲基吡咯或吡咯混合,鼓泡法除氧后,在惰性气体氛围下,400nm光照下搅拌;待反应结束后,减压除去溶剂,柱色谱分离,得到产物;
[0019]
或者,将化合物pmd、碳酸钾、双三苯基磷二氯化钯、四氢呋喃和水以及吲哚
‑2‑
硼
酸频哪醇酯或1
‑
甲基吲哚
‑2‑
硼酸混合,在惰性气体氛围下,搅拌,加热回流;待反应结束后,用二氯甲烷对溶液进行萃取,收集有机相,减压除去溶剂,柱色谱分离,得到产物;
[0020]
方法三:
[0021]
将4
‑
二乙氨基酮酸、3
‑
碘苯酚和甲磺酸混合,搅拌,加热回流;待反应结束后,冷却至室温,将溶液ph值调至9,用二氯甲烷对溶液进行萃取,收集有机相,减压除去溶剂,柱色谱分离,制得化合物rho;
[0022]
将化合物rho、n
‑
甲基吡咯和n,n
‑
二甲基甲酰胺依次加入烧瓶内,鼓泡法除氧后,在惰性气体氛围下,400nm光照下搅拌;待反应结束后,减压除去溶剂,柱色谱分离,得到产物;
[0023]
或者,将化合物rho、碳酸钾、双三苯基磷二氯化钯、四氢呋喃和水以及吲哚
‑2‑
硼酸频哪醇酯或1
‑
甲基吲哚
‑2‑
硼酸混合,在惰性气体氛围下,搅拌,加热回流;待反应结束后,用二氯甲烷对溶液进行萃取,收集有机相,减压除去溶剂,柱色谱分离,得到产物;
[0024]
方法四:
[0025]
将3
‑
碘苯酚滴加至0℃的浓硫酸中,搅拌,然后滴加乙酰乙酸乙酯,继续搅拌至反应结束,将所得混合液滴入冰水中,析出白色沉淀,过滤,制得化合物cou1;
[0026]
将化合物cou1、1
‑
甲基吡咯
‑2‑
硼酸频哪醇酯、碳酸钾、双三苯基磷二氯化钯、四氢呋喃和水混合,在惰性气体氛围下,搅拌,加热回流;待反应结束后,用二氯甲烷对溶液进行萃取,收集有机相,减压除去溶剂,柱色谱分离,得到产物;
[0027]
方法五:
[0028]
将4
‑
溴
‑2‑
羟基苯甲醛、1
‑
甲基吡咯
‑2‑
硼酸频哪醇酯、碳酸钾、双三苯基磷二氯化钯、四氢呋喃和水混合,在惰性气体氛围下搅拌,加热回流;待反应结束后,用二氯甲烷对溶液进行萃取,收集有机相,减压除去溶剂,柱色谱分离,制得化合物cou2;
[0029]
将乙醇、化合物cou2、丙二酸二乙脂和哌啶搅拌混合,加热回流至反应结束,减压除去溶剂,柱色谱分离,得到产物。
[0030]
优选的,柱色谱分离是以石油醚
‑
乙酸乙酯体系为洗脱液。
[0031]
优选的,方法一中,4
‑
溴
‑
1,8
‑
萘二甲酸酐、2
‑
乙基己胺和乙醇的摩尔比为1:(5~10):(800~1000),其加热回流温度为78~83℃;化合物nap、n
‑
甲基吡咯或吡咯、n,n
‑
二甲基甲酰胺的摩尔比为1:(5~15):(10~25);400nm光照反应温度为20~25℃;化合物nap、吲哚
‑2‑
硼酸频哪醇酯或1
‑
甲基吲哚
‑2‑
硼酸、碳酸钾、双三苯基磷二氯化钯、四氢呋喃和水的摩尔比为1:(1~3):(1~6):(1/20~1/10):(250~500):(500~1000),其加热回流温度为73~77℃;
[0032]
优选的,方法二中,邻苯二甲酰亚胺、2
‑
乙基己胺和冰醋酸的摩尔比为1:(5~10):(1000~1300),加热回流温度为117~122℃;化合物pmd、n
‑
甲基吡咯或吡咯、n,n
‑
二甲基甲酰胺的摩尔比为1:(5~15):(10~25),400nm光照反应温度为20~25℃;化合物pmd、吲哚
‑2‑
硼酸频哪醇酯或1
‑
甲基吲哚
‑2‑
硼酸、碳酸钾、双三苯基磷二氯化钯、四氢呋喃和水的摩尔比为1:(1~3):(1~6):(1/20~1/10):(250~500):(500~1000),其加热回流温度为73~77℃。
[0033]
优选的,方法三中,4
‑
二乙氨基酮酸、3
‑
碘苯酚和甲磺酸的摩尔比为1:(1~3):(400~800);加热回流反应温度为150~155℃;化合物rho、n
‑
甲基吡咯和n,n
‑
二甲基甲酰
胺的摩尔比为1:(5~15):(10~25),其反应温度为20~25℃;化合物rho、吲哚
‑2‑
硼酸频哪醇酯或1
‑
甲基吲哚
‑2‑
硼酸、碳酸钾、双三苯基磷二氯化钯、四氢呋喃和水的摩尔比为1:(1~3):(1~6):(1/20~1/10):(250~500):(500~1000),其加热回流反应温度为73~77℃。
[0034]
优选的,方法四中,3
‑
碘苯酚、浓硫酸、乙酰乙酸乙酯的摩尔比为1:(15~35):(1~5),其反应温度为20~25℃;化合物cou1、1
‑
甲基吡咯
‑2‑
硼酸频哪醇酯、碳酸钾、双三苯基磷二氯化钯、四氢呋喃和水的摩尔比为1:(1~3):(1~6):(1/20~1/10):(250~500):(500~1000),其反应温度为73~77℃。
[0035]
优选的,方法五中,4
‑
溴
‑2‑
羟基苯甲醛、1
‑
甲基吡咯
‑2‑
硼酸频哪醇酯、碳酸钾、双三苯基磷二氯化钯、四氢呋喃和水的摩尔比为1:(1~3):(1~6):(1/20~1/10):(250~500):(500~1000),其加热回流反应温度为73~77℃;化合物cou2、乙醇、丙二酸二乙脂和哌啶的摩尔比为1:(100~200):(1~5):(0.2~0.7),其加热回流反应温度为78~83℃。
[0036]
所述的微环境敏感型荧光有机小分子化合物在制备检测血清白蛋白试剂中的应用。
[0037]
所述的微环境敏感型荧光有机小分子化合物作为染色剂在细胞免洗生物成像中的应用。
[0038]
与现有技术相比,本发明具有以下有益的技术效果:
[0039]
本发明对微环境敏感型荧光有机小分子化合物进行了分子设计:选择萘酰亚胺、邻苯二甲酰亚胺、香豆素和罗丹明具有吸电子基团的荧光团母体,选择吡咯、n
‑
甲基吡咯、吲哚、n
‑
甲基吲哚这样的给电子基团,因为其2/5位易发生取代反应,便可与荧光团母体之间形成碳
‑
碳单键相连的d
‑
a结构,给分子带来易于旋转的特性,使其具有粘度敏感性,并且碳
‑
碳单键相连的d
‑
a结构避免了碳
‑
氮单键相连的d
‑
a结构共轭后带有双键性质致使粘度敏感性下降的问题。同时两者所构成的新型分子作为ict分子在不同极性的微环境下,分子内部产生不同程度的电荷分离,化合物的荧光发射光谱的最大峰值出现蓝移或红移,荧光强度改变,具有极性敏感性。该类化合物在大极性溶剂(如水)中,由于发生分子内扭曲电荷转移,其几乎没有荧光。但是,若向水溶液中加入血清白蛋白,化合物即可与血清白蛋白的疏水位点相结合,导致其产生荧光,并且荧光强度与血清白蛋白浓度相关联,从而实现血清白蛋白的灵敏检测。同时,化合物在细胞培养液中的荧光较弱,但是,当化合物进入细胞,到达细胞中的非极性区域或与细胞中的蛋白质结合之后,其荧光会明显增强,使细胞内外荧光产生较大差异,因此也可以用于活细胞免洗成像。因此,本发明将吡咯及其衍生物引入到荧光分子的设计中来,合成了一系列具有微环境敏感性的荧光有机小分子,为合成同时具有粘度、极性敏感性的荧光分子提供了新的设计思路。
[0040]
本发明合成方法操作简便,所合成的化合物有较好的粘度、极性敏感性和aie(aggregation
‑
induced emission,聚集诱导发光)特性。
附图说明
[0041]
图1
‑
图13分别为本发明制得的化合物mnap、hnap、inap、minap、mpmd、hpmd、ipmd、mipmd、mrho、irho、mirho、mcoua和mcoub的核磁氢谱图;
[0042]
图14
‑
图25分别为本发明制得的化合物mnap、hnap、inap、minap、mpmd、hpmd、ipmd、mipmd、mrho、irho、mcoua、mcoub的激发发射光谱图;
[0043]
图26和图27分别为本发明制得的化合物irho、ipmd在不同粘度溶液中的荧光光谱图;图28
‑
图29分别为本发明制得的化合物mcoua和mcoub在不同极性溶液中的荧光光谱图;图30和图31分别为本发明制得的化合物mnap和mpmd的聚集诱导发光荧光光谱图;
[0044]
图32为本发明制得的化合物mrho在不同浓度牛/人血清白蛋白溶液中的荧光光谱图;
[0045]
图33为本发明制得的化合物mnap染色的细胞未洗/洗后的激光共聚焦显微镜拍摄图片。
具体实施方式
[0046]
为了使本技术领域的人员更好地理解本发明方案,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分的实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护的范围。
[0047]
本发明公开了一系列新型微环境敏感型荧光有机小分子,包括萘酰亚胺衍生物mnap、hnap、inap和minap,邻苯二甲酰亚胺衍生物mpmd、hpmd、ipmd和mipmd,罗丹明衍生物mrho、irho和mirho,以及香豆素衍生物mcoua和mcoub。
[0048]
其中,mnap的结构式为:hnap的结构式为:inap的结构式为:minap的结构式为:mpmd的结构式为:hpmd的结构式为:ipmd的结构式为:mipmd的结构式为:mrho的结构式为:irho的结构式为:mirho的结构式为:mcoua的结构式为:
mcoub的结构式为:
[0049]
本发明还公开了上述萘酰亚胺衍生物、邻苯二甲酰亚胺衍生物、罗丹明衍生物以及香豆素衍生物的合成方法,包括以下步骤:
[0050]
1)制备化合物nap
[0051]
将4
‑
溴
‑
1,8
‑
萘二甲酸酐、2
‑
乙基己胺、乙醇加入烧瓶中,搅拌,加热回流。待反应结束后,冷却至室温,停止搅拌,加水产生黄色沉淀物,抽滤收集沉淀,并用乙醇洗涤滤饼,得到的产物进行干燥,制得化合物nap;
[0052]
其中,所述化合物nap的结构式为:
[0053]
2)制备化合物mnap
[0054]
将化合物nap、n
‑
甲基吡咯、n,n
‑
二甲基甲酰胺依次加入烧瓶内,鼓泡法除氧后,在惰性气体氛围下,400nm光照下搅拌,待反应结束后,停止搅拌,减压除去溶剂,柱色谱分离,制得化合物mnap;
[0055]
3)制备化合物hnap
[0056]
将化合物nap、吡咯、n,n
‑
二甲基甲酰胺依次加入烧瓶内,鼓泡法除氧后,在惰性气体氛围下,400nm光照下搅拌。待反应结束后,停止搅拌,减压除去溶剂,柱色谱分离,制得化合物hnap;
[0057]
4)制备化合物inap
[0058]
将化合物nap、吲哚
‑2‑
硼酸频哪醇酯、碳酸钾、双三苯基磷二氯化钯、四氢呋喃、水依次加入烧瓶内,在惰性气体氛围下,搅拌,加热回流。待反应结束后,用二氯甲烷对溶液进行萃取,收集有机相,减压除去溶剂,柱色谱分离,制得化合物inap;
[0059]
5)制备化合物minap
[0060]
将化合物nap、1
‑
甲基吲哚
‑2‑
硼酸、碳酸钾、双三苯基磷二氯化钯、四氢呋喃、水依次加入烧瓶内,在惰性气体氛围下,搅拌,加热回流。待反应结束后,用二氯甲烷对溶液进行萃取,收集有机相,减压除去溶剂,柱色谱分离,制得化合物minap;
[0061]
6)制备化合物pmd
[0062]
将邻苯二甲酰亚胺、2
‑
乙基己胺、冰醋酸加入烧瓶中,搅拌,加热回流。待反应结束后,冷却至室温,停止搅拌,加水产生白色沉淀物,抽滤收集沉淀,并用水洗涤滤饼,得到的产物进行干燥,制得化合物pmd;
[0063]
其中,所述化合物pmd的结构式为:
[0064]
7)制备化合物mpmd
[0065]
将化合物pmd、n
‑
甲基吡咯、n,n
‑
二甲基甲酰胺依次加入烧瓶内,鼓泡法除氧后,在惰性气体氛围下,400nm光照下搅拌。待反应结束后,停止搅拌,减压除去溶剂,柱色谱分离,制得化合物mpmd;
[0066]
8)制备化合物hpmd
[0067]
将化合物pmd、吡咯、n,n
‑
二甲基甲酰胺依次加入烧瓶内,鼓泡法除氧后,在惰性气体氛围下,400nm光照下搅拌。待反应结束后,停止搅拌,减压除去溶剂,柱色谱分离,制得化合物hpmd;
[0068]
9)制备化合物ipmd
[0069]
将化合物pmd、吲哚
‑2‑
硼酸频哪醇酯、碳酸钾、双三苯基磷二氯化钯、四氢呋喃、水依次加入烧瓶内,在惰性气体氛围下,搅拌,加热回流。待反应结束后,用二氯甲烷对溶液进行萃取,收集有机相,减压除去溶剂,柱色谱分离,制得化合物ipmd;
[0070]
10)制备化合物mipmd
[0071]
将化合物pmd、1
‑
甲基吲哚
‑2‑
硼酸、碳酸钾、双三苯基磷二氯化钯、四氢呋喃、水依次加入烧瓶内,在惰性气体氛围下,搅拌,加热回流。待反应结束后,用二氯甲烷对溶液进行萃取,收集有机相,减压除去溶剂,柱色谱分离,制得化合物mipmd;
[0072]
11)制备化合物rho
[0073]
将4
‑
二乙氨基酮酸、3
‑
碘苯酚、甲磺酸加入烧瓶中,搅拌,加热回流。待反应结束后,冷却至室温,停止搅拌,用饱和碳酸钠溶液将溶液ph值调至9。用二氯甲烷对溶液进行萃取,收集有机相,减压除去溶剂,柱色谱分离,制得化合物rho;
[0074]
其中,所述化合物rho的结构式为:
[0075]
12)制备化合物mrho
[0076]
将化合物rho、n
‑
甲基吡咯、n,n
‑
二甲基甲酰胺依次加入烧瓶内,鼓泡法除氧后,在惰性气体氛围下,400nm光照下搅拌。待反应结束后,停止搅拌,减压除去溶剂,柱色谱分离,制得化合物mrho;
[0077]
13)制备化合物irho
[0078]
将化合物rho、吲哚
‑2‑
硼酸频哪醇酯、碳酸钾、双三苯基磷二氯化钯、四氢呋喃、水依次加入烧瓶内,在惰性气体氛围下,搅拌,加热回流。待反应结束后,用二氯甲烷对溶液进行萃取,收集有机相,减压除去溶剂,柱色谱分离,制得化合物irho;
[0079]
14)制备化合物mirho
[0080]
将化合物rho、1
‑
甲基吲哚
‑2‑
硼酸、碳酸钾、双三苯基磷二氯化钯、四氢呋喃、水依次加入烧瓶内,在惰性气体氛围下,搅拌,加热回流。待反应结束后,用二氯甲烷对溶液进行萃取,收集有机相,减压除去溶剂,柱色谱分离,制得化合物mirho;
[0081]
15)制备化合物cou1
[0082]
将3
‑
碘苯酚缓慢滴加至0℃的80%浓硫酸中,并在此条件下搅拌30分钟,后向其中滴加乙酰乙酸乙酯,继续搅拌使其缓慢恢复至室温,在室温下继续搅拌至反应结束,将混合液滴入冰水中,析出白色沉淀,过滤,制得化合物cou1;
[0083]
其中,所述化合物cou1的结构式为:
[0084]
16)制备化合物mcoua
[0085]
将化合物cou1、1
‑
甲基吡咯
‑2‑
硼酸频哪醇酯、碳酸钾、双三苯基磷二氯化钯、四氢呋喃、水依次加入烧瓶内,在惰性气体氛围下,搅拌,加热回流。待反应结束后,用二氯甲烷对溶液进行萃取,收集有机相,减压除去溶剂,柱色谱分离,制得化合物mcoua;
[0086]
17)制备化合物cou2
[0087]
将4
‑
溴
‑2‑
羟基苯甲醛、1
‑
甲基吡咯
‑2‑
硼酸频哪醇酯、碳酸钾、双三苯基磷二氯化钯、四氢呋喃、水依次加入烧瓶内,在惰性气体氛围下,搅拌,加热回流。待反应结束后,用二氯甲烷对溶液进行萃取,收集有机相,减压除去溶剂,柱色谱分离,制得化合物cou2;
[0088]
其中,所述化合物cou2的结构式为:
[0089]
18)制备化合物mcoub
[0090]
将乙醇、化合物cou2、丙二酸二乙脂、哌啶依次加入烧瓶内,搅拌,加热回流至反应结束,停止搅拌,减压除去溶剂,柱色谱分离,制得化合物mcoub;
[0091]
上述方法中各步骤的反应物用量配比如下:
[0092]
步骤1)中,4
‑
溴
‑
1,8
‑
萘二甲酸酐、2
‑
乙基己胺、乙醇的摩尔比为1:(5~10):(800~1000);步骤1)中,具体反应温度为78~83℃;
[0093]
步骤2)中,nap、n
‑
甲基吡咯、n,n
‑
二甲基甲酰胺的摩尔比为1:(5~15):(10~25);步骤2)中,具体反应温度为20~25℃;
[0094]
步骤3)中,nap、吡咯、n,n
‑
二甲基甲酰胺的摩尔比为1:(5~15):(10~25);步骤3)中,具体反应温度为20~25℃;
[0095]
步骤4)中,nap、吲哚
‑2‑
硼酸频哪醇酯、碳酸钾、双三苯基磷二氯化钯、四氢呋喃、水的摩尔比为1:(1~3):(1~6):(1/20~1/10):(250~500):(500~1000);步骤4)中,具体反应温度为73~77℃;
[0096]
步骤5)中,nap、1
‑
甲基吲哚
‑2‑
硼酸、碳酸钾、双三苯基磷二氯化钯、四氢呋喃、水的摩尔比为1:(1~3):(1~6):(1/20~1/10):(250~500):(500~1000);步骤5)中,具体反应温度为73~77℃;
[0097]
步骤6)中,邻苯二甲酰亚胺、2
‑
乙基己胺、冰醋酸的摩尔比为1:(5~10):(1000~1300);步骤6)中,具体反应温度为117~122℃;
[0098]
步骤7)中,pmd、n
‑
甲基吡咯、n,n
‑
二甲基甲酰胺的摩尔比为1:(5~15):(10~25);步骤7)中,具体反应温度为20~25℃;
[0099]
步骤8)中,pmd、吡咯、n,n
‑
二甲基甲酰胺的摩尔比为1:(5~15):(10~25);步骤8)中,具体反应温度为20~25℃;
[0100]
步骤9)中,pmd、吲哚
‑2‑
硼酸频哪醇酯、碳酸钾、双三苯基磷二氯化钯、四氢呋喃、水的摩尔比为1:(1~3):(1~6):(1/20~1/10):(250~500):(500~1000);步骤9)中,具体反应温度为73~77℃;
[0101]
步骤10)中,pmd、1
‑
甲基吲哚
‑2‑
硼酸、碳酸钾、双三苯基磷二氯化钯、四氢呋喃、水的摩尔比为1:(1~3):(1~6):(1/20~1/10):(250~500):(500~1000);步骤10)中,具体反应温度为73~77℃;
[0102]
步骤11)中,4
‑
二乙氨基酮酸、3
‑
碘苯酚、甲磺酸的摩尔比为1:(1~3):(400~800);步骤11)中,具体反应温度为150~155℃;
[0103]
步骤12)中,rho、n
‑
甲基吡咯、n,n
‑
二甲基甲酰胺的摩尔比为1:(5~15):(10~25);步骤12)中,具体反应温度为20~25℃;
[0104]
步骤13)中,rho、吲哚
‑2‑
硼酸频哪醇酯、碳酸钾、双三苯基磷二氯化钯、四氢呋喃、水的摩尔比为1:(1~3):(1~6):(1/20~1/10):(250~500):(500~1000);步骤13)中,具体反应温度为73~77℃;
[0105]
步骤14)中,rho、1
‑
甲基吲哚
‑2‑
硼酸、碳酸钾、双三苯基磷二氯化钯、四氢呋喃、水的摩尔比为1:(1~3):(1~6):(1/20~1/10):(250~500):(500~1000);步骤14)中,具体反应温度为73~77℃;
[0106]
步骤15)中,3
‑
碘苯酚、浓硫酸、乙酰乙酸乙酯的摩尔比为1:(15~35):(1~5);步骤15)中,室温的具体温度为20~25℃;
[0107]
步骤16)中,cou1、1
‑
甲基吡咯
‑2‑
硼酸频哪醇酯、碳酸钾、双三苯基磷二氯化钯、四氢呋喃、水的摩尔比为1:(1~3):(1~6):(1/20~1/10):(250~500):(500~1000);步骤16)中,具体反应温度为73~77℃;
[0108]
步骤17)中,4
‑
溴
‑2‑
羟基苯甲醛、1
‑
甲基吡咯
‑2‑
硼酸频哪醇酯、碳酸钾、双三苯基磷二氯化钯、四氢呋喃、水的摩尔比为1:(1~3):(1~6):(1/20~1/10):(250~500):(500~1000);步骤17)中,具体反应温度为73~77℃;
[0109]
步骤18)中,化合物cou2、乙醇、丙二酸二乙脂、哌啶的摩尔比为1:(100~200):(1~5):(0.2~0.7)。步骤18)中,具体反应温度为78~83℃。
[0110]
上述方法以柱色谱分离方法作为实际使用的纯化操作,柱色谱分离是以石油醚
‑
乙酸乙酯体系为洗脱液;步骤2)、3)、7)、8)和17)中,石油醚和乙酸乙酯的体积比为10:1;步骤4)和5)中,石油醚和乙酸乙酯的体积比为15:1;步骤9)和10)中,石油醚和乙酸乙酯的体积比为20:1;步骤11)、12)和18)中,石油醚和乙酸乙酯的体积比为5:1;步骤13)中,石油醚和乙酸乙酯的体积比为3:1;步骤14)和16)中,石油醚和乙酸乙酯的体积比为4:1。
[0111]
下面结合具体实施例对本发明作进一步说明:
[0112]
实施例1合成化合物nap
[0113]
将4
‑
溴
‑
1,8
‑
萘二甲酸酐1g、2
‑
乙基己胺、乙醇加入烧瓶中,搅拌,加热冷凝回流2h。待反应结束后,冷却至室温,停止搅拌,加水产生黄色沉淀物,抽滤收集沉淀,并用乙醇洗涤滤饼,得到的产物进行干燥,制得化合物nap。进行三组实验,不同物料配比及温度条件见下表1。
[0114]
表1实施例1三组实验条件
[0115]4‑
溴
‑
1,8
‑
萘二甲酸酐2
‑
乙基己胺乙醇温度1g0.5ml30ml78℃1g0.75ml40ml80℃1g1ml50ml83℃
[0116]
其反应方程式如下:
[0117][0118]
实施例2合成化合物mnap
[0119]
将实施例1第一组实验得到的化合物nap0.232g、n
‑
甲基吡咯、n,n
‑
二甲基甲酰胺依次加入烧瓶内,鼓泡法除氧后,在惰性气体氛围下,400nm光照下搅拌10h。待反应结束后,停止搅拌,减压除去溶剂,以石油醚:乙酸乙酯(10:1)体系为洗脱液柱色谱分离,制得化合物mnap。进行三组实验,不同物料配比条件见下表2。第一组实验得到的mnap表征结构为:[c13h13no2na] 的hrms计算值:411.2048;实测值:411.2045,核磁氢谱见图1。
[0120]
表2实施例2三组实验条件
[0121]
napn
‑
甲基吡咯n,n
‑
二甲基甲酰胺0.232g3ml6ml0.232g6ml15ml0.232g9ml10ml
[0122]
其反应方程式如下:
[0123][0124]
实施例3合成化合物minap
[0125]
将实施例1第一组实验得到的化合物nap 0.194g、1
‑
甲基吲哚
‑2‑
硼酸、碳酸钾、双三苯基磷二氯化钯、四氢呋喃、水依次加入烧瓶内,在惰性气体氛围下,搅拌,加热冷凝回流12h。待反应结束后,用二氯甲烷对溶液进行萃取,收集有机相,减压除去溶剂,以石油醚:乙酸乙酯(15:1)体系为洗脱液柱色谱分离,制得化合物minap。进行三组实验,不同物料配比条件见下表3。第一组实验得到的minap表征结构为:([c
29
h
30
n2o2na]
的hrms计算值:461.2199;实测值:461.2201;核磁氢谱见图4。
[0126]
表3实施例3三组实验条件
[0127]
nap1
‑
甲基吲哚
‑2‑
硼酸碳酸钾双三苯基磷二氯化钯四氢呋喃水温度0.194g0.105g0.138g35mg10ml10ml73℃0.194g0.3g0.4g17mg15ml15ml77℃0.194g0.2g0.7g25mg25ml25ml75℃
[0128]
其反应方程式如下:
[0129][0130]
实施例4合成化合物pmd
[0131]
将邻苯二甲酰亚胺1g、2
‑
乙基己胺、冰醋酸加入烧瓶中,搅拌,加热至120℃冷凝回流2h。待反应结束后,冷却至室温,停止搅拌,加水产生白色沉淀物,抽滤收集沉淀,并用水
洗涤滤饼,得到的产物进行干燥,制得化合物pmd。进行三组实验,不同物料配比条件见下表4。
[0132]
表4实施例4三组实验条件
[0133]
邻苯二甲酰亚胺2
‑
乙基己胺冰醋酸温度1g0.5ml30ml120℃1g0.75ml40ml122℃1g1ml50ml117℃
[0134]
其反应方程式如下:
[0135][0136]
实施例5合成化合物hpmd
[0137]
将实施例4第一组实验得到的化合物pmd 0.2g、吡咯、n,n
‑
二甲基甲酰胺依次加入烧瓶内,鼓泡法除氧后,在惰性气体氛围下,400nm光照下搅拌10h。待反应结束后,停止搅拌,减压除去溶剂,柱色谱分离,制得化合物hpmd。进行三组实验,不同物料配比条件见下表5。第一组实验得到的hpmd表征结构为:[c
20
h
25
n2o2]
的hrms计算值:325.1911;实测值:325.1909;核磁氢谱见图6。
[0138]
表5实施例5三组实验条件
[0139]
pmd吡咯n,n
‑
二甲基甲酰胺0.2g5ml6ml0.2g3ml15ml0.2g9ml12ml
[0140]
其反应方程式如下:
[0141][0142]
实施例6合成化合物ipmd
[0143]
将实施例4第一组实验得到的化合物pmd 0.169g、吲哚
‑2‑
硼酸频哪醇酯、碳酸钾、双三苯基磷二氯化钯、四氢呋喃、水依次加入烧瓶内,在惰性气体氛围下,搅拌,加热回流12h。待反应结束后,用二氯甲烷对溶液进行萃取,收集有机相,减压除去溶剂,以石油醚:乙酸乙酯(20:1)体系为洗脱液柱色谱分离,制得化合物ipmd。进行三组实验,不同物料配比条件见下表6。第一组实验得到的ipmd表征结构为:[c
24
h
27
n2o2]
的hrms计算值:375.2067;实测值:375.2066;核磁氢谱见图7。
[0144]
表6实施例6三组实验条件
[0145]
[0146][0147]
其反应方程式如下:
[0148][0149]
实施例7合成化合物rho
[0150]
将4
‑
二乙氨基酮酸、3
‑
碘苯酚、甲磺酸加入烧瓶中,搅拌,加热冷凝回流。待反应结束后,冷却至室温,停止搅拌,用饱和碳酸钠溶液将溶液ph值调至9。用二氯甲烷对溶液进行萃取,收集有机相,减压除去溶剂,以石油醚:乙酸乙酯(5:1)体系为洗脱液柱色谱分离,制得化合物rho。进行三组实验,不同物料配比条件见下表7。
[0151]
表7实施例7三组实验条件
[0152]4‑
二乙氨基酮酸3
‑
碘苯酚甲磺酸温度0.64g0.3ml20ml150℃0.64g0.6ml40ml152℃0.64g0.8ml30ml155℃
[0153]
其反应方程式如下:
[0154][0155]
实施例8合成化合物mrho
[0156]
将实施例7第一组实验得到的化合物rho 0.3g、n
‑
甲基吡咯、n,n
‑
二甲基甲酰胺依次加入烧瓶内,鼓泡法除氧后,在惰性气体氛围下,400nm光照下搅拌10h。待反应结束后,停止搅拌,减压除去溶剂,以石油醚:乙酸乙酯(5:1)体系为洗脱液柱色谱分离,制得化合物mrho。进行三组实验,不同物料配比条件见下表8。第一组实验得到的mrho表征结构为:[c
29
h
27
n2o3]
的hrms计算值:451.1977;实测值:451.2017;核磁氢谱见图9。
[0157]
表8实施例8三组实验条件
[0158][0159][0160]
其反应方程式如下:
[0161][0162]
实施例9合成化合物cou2
[0163]
将4
‑
溴
‑2‑
羟基苯甲醛0.3g、1
‑
甲基吡咯
‑2‑
硼酸频哪醇酯、碳酸钾、双三苯基磷二氯化钯、四氢呋喃、水依次加入烧瓶内,在惰性气体氛围下,搅拌,加热冷凝回流12h。待反应结束后,用二氯甲烷对溶液进行萃取,收集有机相,减压除去溶剂,以石油醚:乙酸乙酯(10:1)体系为洗脱液柱色谱分离,制得化合物cou2。进行三组实验,不同物料配比条件见下表9。
[0164]
表9实施例9三组实验条件
[0165][0166]
其反应方程式如下:
[0167][0168]
实施例10合成化合物mcoub
[0169]
将乙醇、实施例9第一组实验得到的化合物cou2 0.2g、丙二酸二乙脂、哌啶依次加入烧瓶内,搅拌,加热冷凝回流12h。待反应结束,停止搅拌,减压除去溶剂,以石油醚:乙酸乙酯(5:1)体系为洗脱液柱色谱分离,制得化合物mcoub。进行三组实验,不同物料配比条件见下表10。第一组实验得到的mcoub表征结构为:[c
17
h
16
no4]
的hrms计算值:298.1035;实测值:298.1087;核磁氢谱见图13。
[0170]
表10实施例10三组实验条件
[0171][0172][0173]
其反应方程式如下:
[0174]
[0175]
实施例11合成化合物hnap
[0176]
将实施例1第一组实验得到的化合物nap 0.232g、吡咯、n,n
‑
二甲基甲酰胺依次加入烧瓶内,鼓泡法除氧后,在惰性气体氛围下,400nm光照下搅拌10h。待反应结束后,停止搅拌,减压除去溶剂,以石油醚:乙酸乙酯(10:1)体系为洗脱液柱色谱分离,制得化合物hnap。进行三组实验,不同物料配比条件见下表11。第一组实验得到的hnap表征结构为:[c
24
h
27
n2o2]
的hrms计算值:375.2067;实测值:375.2065;核磁氢谱见图2。
[0177]
表11实施例11三组实验条件
[0178]
nap吡咯n,n
‑
二甲基甲酰胺0.232g5ml6ml0.232g3ml15ml0.232g9ml12ml
[0179]
其反应方程式如下:
[0180][0181]
实施例12合成化合物inap
[0182]
将实施例1第一组实验得到的化合物nap 0.194g、吲哚
‑2‑
硼酸频哪醇酯、碳酸钾、双三苯基磷二氯化钯、四氢呋喃、水依次加入烧瓶内,在惰性气体氛围下,搅拌,加热回流12h。待反应结束后,用二氯甲烷对溶液进行萃取,收集有机相,减压除去溶剂,以石油醚:乙酸乙酯(15:1)体系为洗脱液柱色谱分离,制得化合物inap。进行三组实验,不同物料配比条件见下表12。第一组实验得到的inap表征结构为:[c
28
h
29
n2o2]
的hrms计算值:425.2184;实测值:425.2208;核磁氢谱见图3。
[0183]
表12实施例12三组实验条件
[0184]
nap吲哚
‑2‑
硼酸频哪醇酯碳酸钾双三苯基磷二氯化钯四氢呋喃水温度0.194g0.2g0.138g35mg10ml10ml73℃0.194g0.12g0.4g17mg15ml15ml77℃0.194g0.3g0.7g25mg25ml25ml75℃
[0185]
其反应方程式如下:
[0186][0187]
实施例13合成化合物mpmd
[0188]
将实施例4第一组实验得到的化合物pmd 0.2g、n
‑
甲基吡咯3ml、n,n
‑
二甲基甲酰胺6ml依次加入烧瓶内,鼓泡法除氧后,在惰性气体氛围下,400nm光照下搅拌10h。待反应结束后,停止搅拌,减压除去溶剂,以石油醚:乙酸乙酯(10:1)体系为洗脱液柱色谱分离,制得化合物mpmd。进行三组实验,不同物料配比条件见下表13。第一组实验得到的mpmd表征结构为:[c
13
h
13
no2na]
的hrms计算值:361.1892;实测值:361.1894。核磁氢谱见图5。
[0189]
表13实施例13三组实验条件
[0190]
pmdn
‑
甲基吡咯n,n
‑
二甲基甲酰胺0.2g3ml6ml0.2g6ml15ml0.2g9ml10ml
[0191]
其反应方程式如下:
[0192][0193]
实施例14合成化合物mipmd
[0194]
将实施例1第一组实验得到的化合物nap 0.169g、1
‑
甲基吲哚
‑2‑
硼酸、碳酸钾、双三苯基磷二氯化钯、四氢呋喃、水依次加入烧瓶内,在惰性气体氛围下,搅拌,加热冷凝回流12h。待反应结束后,用二氯甲烷对溶液进行萃取,收集有机相,减压除去溶剂,以石油醚:乙酸乙酯(20:1)体系为洗脱液柱色谱分离,制得化合物mipmd。进行三组实验,不同物料配比条件见下表14。第一组实验得到的mipmd表征结构为:[c
25
h
29
n2o2]
的hrms计算值:389.2224;实测值:389.2225。核磁氢谱见图8。
[0195]
表14实施例14三组实验条件
[0196]
pmd1
‑
甲基吲哚
‑2‑
硼酸碳酸钾双三苯基磷二氯化钯四氢呋喃水温度0.169g0.105g0.138g35mg10ml10ml73℃0.169g0.3g0.4g17mg15ml15ml77℃0.169g0.2g0.7g25mg25ml25ml75℃
[0197]
其反应方程式如下:
[0198][0199]
实施例15合成化合物irho
[0200]
将实施例7第一组实验得到的化合物rho 0.25g、吲哚
‑2‑
硼酸频哪醇酯、碳酸钾、双三苯基磷二氯化钯、四氢呋喃、水依次加入烧瓶内,在惰性气体氛围下,搅拌,加热回流12h。待反应结束后,用二氯甲烷对溶液进行萃取,收集有机相,减压除去溶剂,以石油醚:乙酸乙酯(3:1)体系为洗脱液柱色谱分离,制得化合物irho。进行三组实验,不同物料配比条件见下表15。第一组实验得到的irho表征结构为:[c
32
h
27
n2o3]
的hrms计算值:487.2016;实测值:487.2014。核磁氢谱见图10。
[0201]
表15实施例15三组实验条件
[0202]
rho吲哚
‑2‑
硼酸频哪醇酯碳酸钾双三苯基磷二氯化钯四氢呋喃水温度0.25g0.2g0.138g35mg10ml10ml73℃0.25g0.12g0.4g17mg15ml15ml77℃0.25g0.3g0.7g25mg25ml25ml75℃
[0203]
其反应方程式如下:
[0204][0205]
实施例16合成化合物mirho
[0206]
将实施例7第一组实验得到的化合物rho 0.25g、1
‑
甲基吲哚
‑2‑
硼酸、碳酸钾、双三苯基磷二氯化钯、四氢呋喃、水依次加入烧瓶内,在惰性气体氛围下,搅拌,加热冷凝回流12h。待反应结束后,用二氯甲烷对溶液进行萃取,收集有机相,减压除去溶剂,以石油醚:乙酸乙酯(4:1)体系为洗脱液柱色谱分离,制得化合物mirho。进行三组实验,不同物料配比条件见下表16。第一组实验得到的mirho表征结构为:[c
33
h
29
n2o3]
的hrms计算值:501.2173;实测值:501.2167。核磁氢谱见图11。
[0207]
表16实施例16三组实验条件
[0208]
rho1
‑
甲基吲哚
‑2‑
硼酸碳酸钾双三苯基磷二氯化钯四氢呋喃水温度0.25g0.105g0.138g35mg10ml10ml73℃0.25g0.3g0.4g17mg15ml15ml77℃0.25g0.2g0.7g25mg25ml25ml75℃
[0209]
其反应方程式如下:
[0210][0211]
实施例17合成化合物mcou1
[0212]
将3
‑
碘苯酚1.06ml缓慢滴加0℃的80%浓硫酸中,并在此条件下搅拌30min,后向其中滴加乙酰乙酸乙酯,继续搅拌使其缓慢恢复至室温,在室温下继续搅拌36h,反应结束。将混合液滴入100ml冰水中,析出白色沉淀,过滤,制得化合物cou1。不同物料配比条件见下表17。
[0213]
表17实施例17三组实验条件
[0214]3‑
碘苯酚浓硫酸乙酰乙酸乙酯1.06ml20ml1.39ml1.06ml45ml4ml1.06ml30ml7ml
[0215]
其反应方程式如下:
[0216][0217]
实施例18合成化合物mcoua
[0218]
将实施例17第一组实验得到的cou1 0.26g、1
‑
甲基吡咯
‑2‑
硼酸频哪醇酯、碳酸钾、双三苯基磷二氯化钯、四氢呋喃、水依次加入烧瓶内,在惰性气体氛围下,搅拌,加热冷凝回流12h。待反应结束后,用二氯甲烷对溶液进行萃取,收集有机相,减压除去溶剂,以石油醚:乙酸乙酯(4:1)体系为洗脱液柱色谱分离,制得化合物mcoua。进行三组实验,不同物料配比条件见下表18。第一组实验得到的mcoua表征结构为:[c
15
h
14
no2]
的hrms计算值:240.0980;实测值:240.1023。核磁氢谱见图12。
[0219]
表18实施例18三组实验条件
[0220]
cou11
‑
甲基吡咯
‑2‑
硼酸频哪醇酯碳酸钾双三苯基磷二氯化钯四氢呋喃水温度0.26g0.21g0.138g35mg10ml10ml73℃0.26g0.6g0.4g17mg15ml15ml77℃0.26g0.4g0.7g25mg25ml25ml75℃
[0221]
其反应方程式如下:
[0222][0223]
为了验证本发明的效果,对根据上述合成方法所制备的新型微环境敏感型有机荧光小分子进行了大量的实验室研究实验,各种实验情况如下:
[0224]
1、基本荧光行为表征
[0225]
所制备的新型微环境敏感型有机荧光小分子采用爱丁堡仪器fls 920单光子计数荧光光谱仪进行激发发射光谱的表征,结果见图14
‑
25。由图14可知,化合物mnap的最大激发波长为400nm,最大发射波长为530nm;由图15可知,化合物hnap的最大激发波长为410nm,最大发射波长为528nm;由图16可知,化合物inap的最大激发波长为410nm,最大发射波长为552nm;由图17可知,化合物minap的最大激发波长为411nm,最大发射波长为583nm;由图18可知,化合物mpmd的最大激发波长为375nm,最大发射波长为525nm;由图19可知,化合物hpmd的最大激发波长为375nm,最大发射波长为510nm;由图20可知,化合物ipmd的最大激发波长为380nm,最大发射波长为530nm;由图21可知,化合物mipmd的最大激发波长为380nm,最大发射波长为580nm;由图22可知,化合物mrho的最大激发波长为573nm,最大发射波长为637nm;由图23可知,化合物irho的最大激发波长为570nm,最大发射波长为691nm;由图24可知,化合物mcoua的最大激发波长为355nm,最大发射波长为451nm;由图25可知,化合物mcoub的最大激发波长为393nm,最大发射波长为514nm。
[0226]
2、粘度敏感性测试
[0227]
使用不同体积比的乙醇与丙三醇,配制具有不同粘度的溶剂,对化合物进行了粘度敏感性测试。如图26与图27所示,化合物irho(图26)和ipmd(图27)溶液的荧光随着溶剂粘度的增大不断增强。测试结果表明,irho和ipmd具有粘度敏感性。
[0228]
3、极性敏感性测试
[0229]
使用不同体积比的三氯甲烷与甲醇,配制具有不同极性的溶剂,对化合物进行了极性敏感测试。如图28与图29所示,化合物mcoua(图28)和mcoub(图29)溶液的荧光随着溶剂极性的增大不断减弱。测试结果表明,mcoua和mcoub具有极性敏感性。
[0230]
4、aie测试
[0231]
使用不同体积比的甲醇与水,配制具有不同水含量的溶剂,对化合物进行了aie测试。如图30与图31所示,化合物mnap(图30)和mpmd(图31)溶液的荧光随着水含量增加不断增强。测试结果表明,mnap和mpmd具有aie特性。
[0232]
5、化合物mrho对牛/人血清白蛋白的检测测试
[0233]
称取不同质量的血清白蛋白,溶解于pbs溶液,配制具有不同血清白蛋白浓度的溶液,进行化合物mrho对牛/人血清白蛋白的检测测试。如图32所示,随着pbs溶液中牛血清白蛋白或人血清白蛋白含量增加,血清白蛋白内可供mrho存在的疏水空腔位点增多,更多的mrho被固定在疏水空腔位点内,分子内的tict(twisted intramolecular charge transfer,分子内扭转电荷转移)被抑制,致使荧光强度不断增加。测试结果表明,mrho可检测牛/人血清白蛋白。
[0234]
6、化合物mnap的细胞免洗成像实验
[0235]
免洗生物成像,可以简化成像操作及减小对生物样品的干扰和损伤。图33为经mnap染色的a549细胞未洗/洗后激光共聚焦显微镜拍摄图片。化合物mnap在细胞培养液中的荧光较弱,但是,当化合物进入细胞,到达细胞中的非极性区域或与细胞中的蛋白质结合之后,其荧光会明显增强,使细胞内外荧光产生较大差异。经mnap染色的a549细胞未洗/洗后激光共聚焦显微镜拍摄图片结果表明,mnap可进行活细胞免洗生物成像。
[0236]
对于微环境敏感型荧光有机小分子而言,最重要的部分便是分子设计。在分子设计过程中,有两点需要着重考虑:(1)构建d
‑
a体系的分子片段;(2)d与a之间的键合方式。这两者都对荧光分子的敏感性有着重要影响。萘酰亚胺、邻苯二甲酰亚胺、香豆素和罗丹明是常见的具有吸电子基团的荧光团母体,因其分子结构可设计性强、合成简单、可重复性好等优点而受到广泛关注;吡咯、n
‑
甲基吡咯、吲哚、n
‑
甲基吲哚这样的给电子基团,因为其2/5位易发生取代反应,便可与荧光团母体之间形成碳
‑
碳单键相连的d
‑
a结构,给分子带来易于旋转的特性,具有粘度敏感性,同时两者所构成的新型分子作为ict分子,也具有着极性敏感性。因此综上所述,本发明将吡咯及其衍生物引入到荧光分子的设计中来,合成了一系列具有微环境敏感性的荧光有机小分子,为合成同时具有粘度、极性敏感性的荧光分子提供了新的设计思路。本发明合成方法操作简便,所合成的化合物有较好的粘度、极性敏感性和aie特性,可实现对血清白蛋白的检测,以及活细胞免洗成像。
[0237]
以上内容仅为说明本发明的技术思想,不能以此限定本发明的保护范围,凡是按照本发明提出的技术思想,在技术方案基础上所做的任何改动,均落入本发明权利要求书的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。