1.本发明涉及包含取代的苯并咪唑、更具体地为奥美拉唑的两部分药物制剂。本发明还涉及这类抑制剂的制备方法。
背景技术:
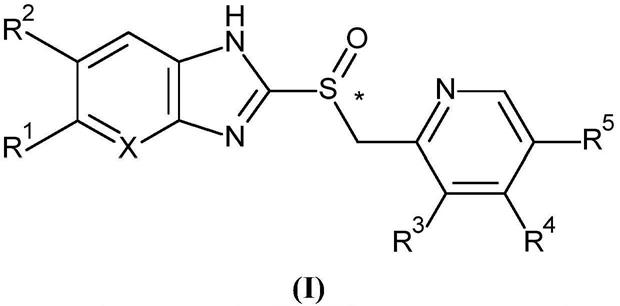
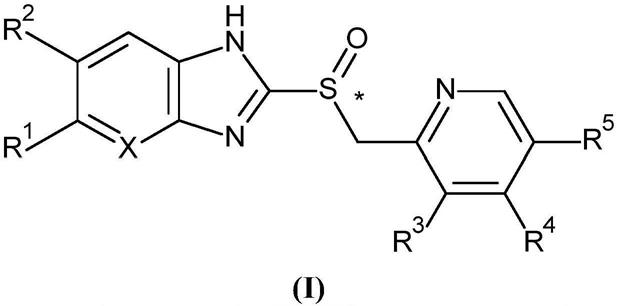
2.质子泵抑制剂为一类药物,其主要作用是显著、持久地减少胃酸的产生。它们具有一般结构(i)
[0003][0004]
名称r1r2r3r4r5x替莫拉唑hhhhhch奥美拉唑och3hch3och3ch3ch兰索拉唑hhch3och2cf3hch泮托拉唑cf2hohoch3och3hch雷贝拉唑hhch3o(ch2)3och3hch替那拉唑och3hch3och3ch3n吡考拉唑ch3co2ch3ch3hhch
[0005]
另外,表中所示的化合物的某些作为单一对映异构体使用(在式(i)中*指示的手性中心)。艾美拉唑为奥美拉唑的单一对映异构体。右兰索拉唑为兰索拉唑的单一对映异构体。
[0006]
奥美拉唑为取代的苯并咪唑,即6
‑
甲氧基
‑2‑
[[(4
‑
甲氧基
‑
3,5
‑
二甲基
‑2‑
吡啶基)甲基]亚磺酰基]
‑
1h
‑
苯并咪唑,其通过不可逆地抑制胃壁细胞(gastric parietal)分泌表面上的h
/k
atpase(质子泵)来减少胃酸的产生。奥美拉唑的式为:
[0007]
质子泵直接负责将h
离子分泌到胃腔中。奥美拉唑通过抑制质子泵调节哺乳动物
胃肠道胃酸分泌途径中氢离子产生的最终步骤。
[0008]
奥美拉唑和其他质子泵抑制剂(ppi)用于治疗需要通过质子泵抑制减少酸产生的众多病症,例如胃炎、胃食管返流疾病(gerd)、消化不良、消化性溃疡病、咽喉返流(laryngopharyngeal reflux)、胃和十二指肠溃疡和佐林格
‑
埃利森综合征。
[0009]
典型地,将奥美拉唑配制成用于口服施用的片剂或胶囊。然而,对于可能无法和/或不愿意吞咽胶囊或片剂的患者,这类制剂存在问题。这种形式也不适合儿科使用。
[0010]
已经证实用于口服施用的奥美拉唑的液体制剂因活性成分不稳定的性质而存在问题。奥美拉唑为酸不稳定的化合物,且由此在酸性条件下快速降解,例如在胃中发现的环境中。已知奥美拉唑在具有低于4.0的ph的环境中以小于10分钟的半衰期降解;在ph 6.5,半衰期为18小时,且在ph 11,半衰期约为300天。
[0011]
上述制剂的替代方案在于提供作为固体混悬剂的奥美拉唑,其中将奥美拉唑颗粒与适合的载体混合。该混悬剂需要在使用前立即制备,并且需要对其制备方式进行严格控制。如果制备不当,结果是药物可能会失效。一些患者还发现使用该混悬剂非常不愉快。由于奥美拉唑混悬剂的贮存期很短,因此也难以批量生产。
[0012]
一种解决方案在于提供一种不需要控制制备的奥美拉唑混悬剂。然而,这种混悬剂要求具有高粘度,以确保奥美拉唑微粒完全悬浮在溶液中。这种高粘度使得难以测量正确的剂量。此外,这类制剂提供奥美拉唑的缓慢释放,因此它们在使用中受到限制。
[0013]
因此,需要提供一种包含奥美拉唑或其他ppi的稳定的药物制剂,这也解决了上述确定的问题。
[0014]
本发明涉及一种包含奥美拉唑、艾美拉唑、或其他质子泵抑制剂或其混合物的药物制剂,为上述病症的治疗提供了具有成本效益(cost
‑
effective)的方式,且制备便利。本发明还为不能和/或不愿意摄入胶囊的患者提供替代方案。本制剂是稳定的、易溶解的并且它允许治疗剂的立即释放(immediate release)和快速吸收而不会被胃酸降解。
技术实现要素:
[0015]
根据第一个方面,本发明提供了药物制剂,其包含:
[0016]
第一组合物,其为具有10
‑
12的ph的液体,包含浓度为0.5mg/ml
‑
5mg/ml的取代苯并咪唑、缓冲剂、碱和抗氧化剂;和
[0017]
第二组合物,其为具有7
‑
9的ph的包含稀释剂和ph调节剂的液体;
[0018]
其中第一和第二组合物被配置为在使用前即刻合并,以便得到ph为8
‑
9的合并的液体药物。
[0019]
根据本发明的第二个方面,提供了药物制剂,其包含:
[0020]
第一组合物,其为ph为10
‑
12的包含浓度为0.5mg/ml
‑
5mg/ml的治疗剂、缓冲剂和抗氧化剂;和
[0021]
第二组合物,其为ph 7
‑
9,包含稀释剂和ph调节剂;
[0022]
其中第一和第二组合物被配置为在使用前即刻合并,以便得到ph为8
‑
9的合并溶液。
[0023]
根据另一个方面,提供本发明的药物制剂作为治疗病症的药物,所述病症选自胃炎、胃食管返流疾病、消化不良、消化性溃疡病、咽喉返流、胃和十二指肠溃疡或佐林格
‑
埃
利森综合征。
[0024]
根据另一个方面,提供了药盒,其包含:
[0025]
包含如本文所定义的第一组合物的第一隔室;
[0026]
包含如本文所定义的第二组合物的第二隔室;
[0027]
其中第一和第二容器适合于在启动时允许它们之间的流体连通以形成如权利要求1
‑
15任一项中所定义的合并的液体药物。
[0028]
发明详述
[0029]
根据本发明,提供了一种包含第一组合物和第二组合物的两部分药物制剂,其中第一组合物包含治疗剂、抗氧化剂和缓冲剂,且第二组合物包含稀释剂和ph调节剂,并且其中将两种组合物合并以得到合并的用于即刻口服使用的液体药物。
[0030]
在一个优选的实施方案中,所述治疗剂选自质子泵抑制剂。质子泵抑制剂优选为如上述式(i)中所定义的那些之一,包括其药学上可接受的盐、酯和对映异构体混合物。更优选所述治疗剂选自奥美拉唑、艾美拉唑、兰索拉唑、右兰索拉唑、替莫拉唑、吡考拉唑、泮托拉唑、雷贝拉唑和替那拉唑。这些质子泵抑制剂可以单独使用或彼此联用。这些抑制剂通过阻滞胃壁细胞的氢/钾三磷酸腺苷酶系统(h
/k
atpase)来提供胃酸产生的持续减少。
[0031]
优选地,所述治疗基选自奥美拉唑、艾美拉唑、泮托拉唑及其药学上可接受的盐、对映异构体、水合物或衍生物。在一个优选的实施方案中,所述治疗剂为奥美拉唑或其药学上可接受的盐。治疗剂的药学上可接受的盐可以包含碱金属盐,例如钠、锂和钾盐。治疗剂的药学上可接受的盐还可以包含碱土金属和过渡金属盐,例如钙和镁盐。
[0032]
第一组合物中存在的治疗剂浓度为约0.5mg/ml
‑
约5mg/ml。优选地,第一组合物中治疗剂的量为约2mg/ml
‑
约4mg/ml。更优选地,治疗剂浓度为约2mg/ml。发现治疗剂在约ph 8
‑
14下稳定,特别是在ph 10
‑
13。更具体地,治疗剂在11.5
‑
12.5的ph下稳定。在一个更优选的实施方案中,治疗剂以约ph 12存在。
[0033]
本发明的特征在于第一组合物包含缓冲剂和碱。本领域技术人员显而易见,缓冲剂通常能够将溶液的ph维持在指定范围内(缓冲范围),在该范围内添加强碱不会显著改变ph。然而,第一组合物包含足量的碱以超过缓冲容量,且结果是,具有明显的碱性。
[0034]
治疗剂可以以任意适合的形式存在于第一组合物中,例如混悬剂、液体、溶液、粉末、颗粒、干粉、干颗粒或微粒形式。还可以给治疗剂配备包衣层,例如肠溶衣,当接触酸性介质,例如存在于胃中时,可以稳定地防止降解,但在胃肠道中用于吸收时,在更高ph下可以快速分解。在一个优选的实施方案中,以液体、优选溶液的形式提供治疗剂。优选地,所述液体为水性液体。
[0035]
治疗剂可以为混悬于适当混悬介质或溶于适合的溶剂中的粉末、颗粒或微粒的形式。在一个优选的实施方案中,所述介质为水性的。
[0036]
用于第一组合物的适合的抗氧化剂选自抗坏血酸衍生物、硫醇衍生物、亚硫酸盐、硫酸钠、合成受阻酚(synthetic hindered phenols)如没食子酸丙酯、丁羟茴醚(bha)、丁羟甲苯(bht)、天然受阻酚(natural hindered phenols)如生育酚或其混合物。在一个更优选的实施方案中,抗氧化剂为硫醇衍生物,更优选地为n
‑
乙酰
‑
l
‑
半胱氨酸。抗氧化剂为治疗剂提供稳定性并防止酸降解。组合物中抗氧化剂的量可以占第一组合物的约0.05%(w/v)
‑
约0.5%(w/v),优选约0.1%(w/v)
‑
约0.3%(w/v)。
[0037]
本发明的第二组合物还包含稀释剂和ph调节剂。所述稀释剂可以为任意适合的液体稀释剂,例如水、极性有机溶剂、水性溶剂或其混合物。优选地,所述稀释剂为水。稀释剂的量取决于根据治疗剂浓度不同的所要求的制剂的最终体积。
[0038]
在本发明的上下文中,ph调节剂用于调节制剂的ph。因此,ph调节剂能够改变最终制剂的ph,得到期望的ph,其防止酸性胃液降解的治疗剂形式,并且适合于口服施用。在一个优选的实施方案中,最终制剂(合并溶液)的ph为6
‑
10。在一个更优选的实施方案中,最终制剂的ph为8
‑
9。在一个更优选的实施方案中,合并溶液的ph为ph 8.5
‑
9。在一个更优选的实施方案中,合并溶液的ph约为9。ph调节剂可以选自碱金属或碱土金属碳酸盐或碳酸氢盐,碱金属或碱土金属氢氧化物,碱金属或碱土金属氧化物,碱金属或碱土金属磷酸盐、柠檬酸盐、乙酸盐及其混合物。优选地,ph
‑
调节剂为碳酸氢钠。
[0039]
ph调节剂确保当第一和第二组合物混合时,缓冲剂返回至缓冲范围内,且由此合并液体药物的ph为一致性的且在施用时稳定。
[0040]
在另一个实施方案中,第一和第二组合物可以包含药学上可接受的赋形剂、添加剂或载体。为了本发明的目的,赋形剂可以为分散剂、增粘剂(viscosity building agents)、螯合剂、矫味剂、甜味剂和防腐剂中的一种或多种。
[0041]
防腐剂(或稳定剂)通过螯合活性药物成分来保存它,并且出于本发明的目的称作二级防腐剂(secondary preservative)。防腐剂可以选自edta或其盐;糖醇,例如甘油和山梨醇;聚氧乙烯20脱水山梨糖醇单油酸酯,例如聚山梨醇酯80,聚氧乙烯20脱水山梨糖醇单月桂酸酯,例如聚山梨醇酯20;磷酸二钠;或其混合物。优选地,稳定剂为edta钠或磷酸二钠。更优选地,稳定剂为edta钠。稳定剂可以以约0.01%(w/v)
‑
约0.5%(w/v)、更优选约0.1%(w/v)的量存在。
[0042]
增粘剂(或增稠剂)用于调节制剂的粘度并降低活性药物成分的苦味。增稠剂的量取决于最终制剂的粘度和/或所需的治疗剂。dv2t rv粘度计用于本发明的表观粘度测量。在一个优选的实施方案中,本发明的最终药物制剂(合并溶液)的粘度可以约为200厘泊至约600厘泊。在优选的实施方案中,最终制剂的粘度为约300厘泊
‑
约400厘泊。第一组合物的粘度可以约为150厘泊
‑
约450厘泊或约200厘泊
‑
约300厘泊。第二组合物的粘度可以约为350厘泊
‑
约650厘泊,或约400厘泊
‑
约550厘泊。增稠剂可选自角叉菜胶、粉状纤维素、甲基纤维素、羟乙基纤维素、羟丙基纤维素、羧甲基纤维素、羧甲基纤维素钠/微晶纤维素混合物、离子交换交联聚丙烯酸聚合物、多糖、淀粉、卡波姆或其混合物。在一个优选的实施方案中,增稠剂为多糖和羧甲基纤维素钠的组合。黄原胶为优选的多糖。
[0043]
本发明中使用的治疗剂优选微溶于ph 7的水中。本发明中的表面活性剂、溶剂和共溶剂的目的在于改善活性药物成分的溶解度。在一个实施方案中,表面活性剂可以选自多元醇酯、山梨坦衍生物、聚氧乙烯酯、泊洛沙姆、月桂基硫酸盐/酯(lauryl sulfates)、十二烷基硫酸盐/酯(dodecyl sulfates)、季铵化合物或其混合物。表面活性剂可以约为0.1%(w/v)
‑
约1.0%(w/v),更优选地,表面活性剂可以为约0.5%(w/v)。
[0044]
在另一个实施方案中,溶剂和共溶剂可以选自甘油、山梨醇、丙二醇、醇、聚乙二醇或其混合物。在一个优选的实施方案中,溶剂和共溶剂可以为糖醇。溶剂和共溶剂可以以约5%(w/v)
‑
约20%(w/v)、更优选约10%(w/v)
‑
约15%(w/v)的量存在。
[0045]
消泡剂可以防止形成任何气泡或起泡。适合消泡剂可以选自基于硅酮的消泡剂,
例如西甲硅油或其乳液或混悬剂,以及非硅酮类消泡剂,如基于聚丙烯的聚醚分散体、蓖麻油、脂肪醇酯、甘油酯及其混合物。消泡剂可以约0.01%(w/v)
‑
约0.08%(w/v)的量存在。
[0046]
在另一个实施方案中,稀释剂还可以包含渗透剂、防腐剂、分散剂、甜味剂和矫味剂。
[0047]
用于本发明的渗透剂的目的在于将合并制剂的重量摩尔渗透压浓度给定在约1000
‑
约3000mosmol/kg的范围。在一个优选的实施方案中,重量摩尔渗透压浓度可以在约1000
‑
约1500mosmol/kg或约1500
‑
约2500mosmol/kg或约1500
‑
约2200mosmol/kg。该范围内渗透剂的存在确保药物制剂具有可接受的高渗性,使得该制剂可以以未稀释的形式被消耗。渗透剂可以选自右旋糖、甘露醇、山梨醇、甘油、氯化钠和硫酸钠或其组合。
[0048]
本发明的药物制剂可以包含防腐剂,以确保制剂免受微生物污染。防腐剂可以选自对羟基苯甲酸酯、苯甲酸及其盐、山梨酸及其盐、硫酸钠、硫酸钾、丙二醇、edta及其盐。优选地,防腐剂为对羟基苯甲酸甲酯钠(sodium methylparaben)或度米芬(domiphen bromide)。防腐剂的量可以在约0.1%(w/v)
‑
约0.2%(w/v),更优选约0.15%(w/v)。
[0049]
分散剂的作用在于辅助微溶组分适当溶解。用于本发明的适合的分散剂为甘油、山梨醇、丙二醇、聚乙二醇、醇及其组合。
[0050]
甜味剂和矫味剂用于掩盖活性药物成分的苦味,从而提供具有良好适口性和可接受性的制剂。用于本发明的适合的甜味剂为糖、糖醇、糖精钠、阿司帕坦、乙酰舒泛钾、甜叶菊、环拉酸钠、甘草提取物、甘草甜素、槭树提取物(maple extract)和刺槐豆提取物。适合的矫味剂可以选自掩味甜味香精(flavour)、三氯蔗糖、薄荷醇、柠檬、橙子、桃子、肉桂、黑醋栗(black current)、樱桃和巧克力。甜味剂和矫味剂可以以约1.0%(w/v)
‑
约0.01%(w/v)的量存在。更优选地,这些试剂可以以约0.25%(w/v)、0.2%(w/v)、0.15%(w/v)或0.015%(w/v)的量存在。
[0051]
优选地,第一和第二组合物均以溶液形式提供。在一个更优选的实施方案中,合并的液体药物为均匀的。
[0052]
第一组合物和第二组合物按体积提供,使得当合并时,合并的液体药物的体积是单次口服剂量的可接受的。典型地,合并的液体药物的体积在1
‑
50ml,优选5
‑
30ml,更优选10
‑
25ml,例如约15ml。因此,选择第一和第二组合物的体积,得到合并的液体药物的总体积。
[0053]
在另一个实施方案中,本发明提供了包含第一和第二组合物的药盒,使得这两种组合物分开储存并且在使用前即刻合并以形成合并的液体。得到的溶液优选具有8
‑
9的ph并且该ph稳定性维持至少2小时。
[0054]
第一组合物和第二组合物分开保存至少可以存放12个月,且活性药物药剂至少可以维持其活性达至少12个月。
[0055]
药盒可以在两种组合物之间包含可移除的屏障。可移除屏障被配置为防止两种组合物之间的接触,由此可移除屏障的移除允许两种组合物在消耗之前即刻合并以得到合并的溶液。在一个优选的实施方案中,实施屏障为易碎膜。
[0056]
任选地,可移除屏障可以是可重复使用的,只要它可以将两种组合物分开并且被移除以允许两种组合物混合。例如,可移除的屏障可以为用于两种组合物的两个单独的容器,其具有可移除的开口,例如帽或盖。或者,可移除屏障可以具有单个容器的部件
(feature),该容器包含由可移除屏障隔开的两种组合物。优选地,可移除屏障由塑料或玻璃制成。更优选地,可移除屏障由琥珀色高密度聚乙烯制成。
[0057]
提供了本发明的药物制剂在治疗众多病症中的液体,所述病症例如胃炎、胃食管返流疾病、消化不良、消化性溃疡病、咽喉返流、胃和十二指肠溃疡和佐林格
‑
埃利森综合征,其中通过质子泵抑制治疗所述病症。本发明的药物制剂适合于成年人且更适合于儿童。
[0058]
在应用中,临床医师或患者混合第一和第二组合物,形成合并的液体,然后直接口服施用于患者。
[0059]
本发明的制剂和药盒将长贮存期与活性物质的最小降解以及用于施用的便利和适口剂型合并。
[0060]
下列实施例进一步描述本发明:
[0061]
实施例1.
[0062]
表1
[0063][0064]
表2
[0065][0066][0067]
在一种可替代选择中,第二组合物相同,但包含替代对羟基苯甲酸甲酯钠的度米芬0.025%w/v和0.3%w/v薄荷香精。
[0068]
在实施例1中,第一组合物包含2mg/ml奥美拉唑、磷酸二氢钠作为缓冲剂、氢氧化钠作为碱和硫醇衍生物作为抗氧化剂。第二组合物包含水作为稀释剂和碳酸氢钠作为ph调节剂。
[0069]
实施例2.
[0070]
表3
[0071][0072]
表4
[0073][0074]
在一种可替代选择中,第二组合物相同,但包含替代对羟基苯甲酸甲酯钠的度米
芬0.025%w/v,且代替(instead of)0.2%w/v的0.3%w/v薄荷香精。
[0075]
在实施例2中,第一组合物包含2mg/ml奥美拉唑、磷酸二氢钠作为缓冲剂、氢氧化钠作为碱和硫醇衍生物作为抗氧化剂。第二组合物包含水作为稀释剂和碳酸氢钠作为ph调节剂。
[0076]
实施例3.
[0077]
表5
[0078][0079]
表6
[0080][0081]
在一种可替代选择中,第二组合物相同,但包含替代对羟基苯甲酸甲酯钠的度米芬0.025%w/v,且代替0.2%w/v的0.3%w/v薄荷香精。
[0082]
在实施例3中,第一组合物包含2mg/ml奥美拉唑、氢氧化钾作为缓冲剂和硫醇衍生物作为抗氧化剂。第二组合物包含水作为稀释剂和碳酸氢钠作为ph调节剂。
[0083]
实施例4.
[0084]
包含上述实施例中举出的奥美拉唑的第一组合物与第二组合物分开保持在约ph 12。实施例1中提供的第一组合物奥美拉唑的稳定性数据如下所示:
[0085][0086]
实施例5.
[0087]
当本发明的第一和第二组合物在使用前即刻合并时,得到ph值约为8
‑
9的合并溶液。以下是合并的溶液在第一和第二组合物混合后即刻在0min、15min、60min和120min期限期间的ph稳定性数据。
[0088]
表8
[0089][0090]
从上表中呈现的结果可以看出,合并溶液的ph值稳定至少120min。
[0091]
实施例6
[0092]
奥美拉唑20mg/15ml口服溶液制剂包含奥美拉唑作为活性物质,作为呈灰白色至淡黄色溶液的带有薄荷和柠檬味的制剂。
[0093]
药物产品的组成
[0094]
奥美拉唑20mg/15ml口服溶液由奥美拉唑4mg/ml溶液(第一组合物)和稀释剂(第二组合物)组成。奥美拉唑4mg/ml溶液(5ml)和稀释剂(10ml)的组分如表9和表10中所示。
[0095]
第一组合物的制备方法如图1中所示。第二组合物的制备方法如图2中所示。
[0096]
表9:奥美拉唑4mg/ml口服溶液(第一组合物)的组分
[0097][0098][0099]
表10:稀释剂10ml(第二组合物)的组分
[0100][0101][0102]
在一种可替代选择中,第二组合物相同,但包含替代对羟基苯甲酸甲酯钠的度米芬(0.25mg/ml;0.025g/100ml),并且代替薄荷醇香精的薄荷香精(3.00mg/ml;0.3g/100ml)。
[0103]
实施例7
[0104]
泮托拉唑10mg/15ml口服溶液制剂包含泮托拉唑作为活性物质,作为泮托拉唑钠倍半水合物。
[0105]
制剂呈灰白色至淡黄色溶液,带有薄荷和柠檬味。
[0106]
泮托拉唑10mg/15ml口服溶液由泮托拉唑2mg/ml溶液(第一组合物)和稀释剂(第二组合物)组成。泮托拉唑2mg/ml溶液(5ml)的组成如表11中所示。
[0107]
表11:泮托拉唑2mg/ml溶液(第一组合物)的组成
[0108][0108][0109]
稀释剂10ml(第二组合物)的组成
–
如实施例3表6。
[0110]
实施例8
[0111]
泮托拉唑20mg/15ml口服溶液制剂包含泮托拉唑作为活性物质,作为泮托拉唑钠倍半水合物。
[0112]
制剂呈灰白色至淡黄色溶液,带有薄荷和柠檬味。
[0113]
泮托拉唑20mg/15ml口服溶液由泮托拉唑4mg/ml溶液(第一组合物)和稀释剂(第二组合物)组成。泮托拉唑4mg/ml溶液(5ml)的组成如表12中所示。
[0114][0115]
表12:泮托拉唑4mg/ml溶液(第一组合物)的组成
[0116][0116][0117]
稀释剂10ml(第二组合物)的组成
–
如实施例3表6。
[0118]
实施例9
[0119]
艾美拉唑10mg/15ml口服溶液制剂包含活性物质艾美拉唑,作为镁三水合物。呈淡黄色溶液,具有薄荷和柠檬味。
[0120]
艾美拉唑10mg/15ml口服溶液由艾美拉唑(作为镁三水合物)2mg/ml溶液(第一组合物)和稀释剂(第二组合物)组成。艾美拉唑2mg/ml溶液(5ml)的组分如表13中所示。
[0121][0122]
表13:艾美拉唑2mg/ml溶液(第一组合物)的组成
[0123][0123][0124]
稀释剂10ml(第二组合物)的组成
–
如实施例3表6。
[0125][0126]
实施例10
[0127]
艾美拉唑20mg/15ml口服溶液制剂包含活性物质艾美拉唑,作为镁三水合物。制剂呈淡黄色至黄色溶液,具有薄荷和柠檬味。
[0128]
艾美拉唑20mg/15ml包含艾美拉唑4mg/ml溶液(第一组合物)和稀释剂(第二组合物)。艾美拉唑4mg/ml溶液(5ml)的组成如表14中所示。
[0129]
表14:艾美拉唑4mg/ml溶液(第一组合物)的组成
[0130][0131][0132]
稀释剂10ml(第二组合物)的组成
–
如实施例6。
[0133]
实施例11
[0134]
将奥美拉唑20mg/15ml(实施例6)、泮托拉唑10mg/15ml(实施例7)、泮托拉唑20mg/15ml(实施例8)、艾美拉唑10mg/15ml(实施例9)或艾美拉唑20mg/15ml(实施例10)口服溶液制备成单剂量、随时可用的口服液体药物产品。
[0135]
对于上述产品,使用双
–
室单剂量包装。如图3中所示。第一个室填充有第一组合物5ml。第二室填充有稀释剂(第二组合物)10ml,分开存放并在施用时混合。参考图3,双
–
室单剂量包装包含:
[0136]
带有防篡改(tamper evident)撕裂带的帽
[0137]
第一腔室上方的帽(1)包含将压力施加到柱塞(plunger)(3)上的装置(means),以便部分破裂插塞(plug)的易碎聚合物膜(4)并将溶液递送至具有第二液体组合物的容器(6)中,奥美拉唑溶液的稀释剂的量为10ml。
[0138]
防篡改撕裂带(2)
[0139]
防篡改撕裂带(2)确保产品在施用前的整体完整性。
[0140]
构成的第一腔室包含:
[0141]
柱塞
–
第一容器(3)
[0142]
柱塞(3)适于装入具有顶部平坦表面的插塞(4)中,其中包含5ml的量第一组合物奥美拉唑口服溶液。
[0143]
插塞(4)
[0144]
插塞(4)带有易碎的聚合物膜,适合于从下端装入开口瓶衬垫(5),从上端端进入帽(1)。
[0145]
第二腔室包含:
[0146]
开口瓶衬垫(5)
[0147]
容器
‑
第二容器(6)
[0148]
容器(6)形式的第二腔室配备上端具有开口瓶衬垫(5),包含10ml量的奥美拉唑口服溶液的液体稀释剂。在容器(6)中,两种液体组合物在施用时混合。
[0149]
实施例12
[0150]
第一和第二组合物和合并的溶液的粘度测量
[0151]
上述举出的溶液的粘度测定方法如下所述:
[0152]
仪器:具有锭子sc4
‑
18的旋转粘度计(brookfield dv2t lv粘度计)。
[0153]
方法:将6.7ml溶液放入sc4—18室。将sc4
‑
18转子浸入测试溶液中,并将速度设置在6rpm。通过1分钟后,读出粘度值。将该溶液维持在23 3℃的温度。该溶液粘度的测量值必须满足150
‑
450cps的验收标准。
[0154]
表15.来自泮托拉唑2mg/ml溶液(实施例7
–
第一组合物)的粘度的结果;锭子cs4
–
18
[0155][0156]
表16.来自泮托拉唑4mg/ml溶液(实施例8
–
第一组合物)的粘度的结果;锭子cs4
–
18
[0157][0158]
表17.来自奥美拉唑4mg/ml溶液(实施例6
–
第一组合物)的粘度的结果;锭子cs4
–
18
[0159]
[0160][0161]
表18.来自艾美拉唑2mg/ml溶液的粘度的结果;锭子cs4
–
18(实施例9
–
第一组合物)
[0162][0163]
表19.来自艾美拉唑4mg/ml溶液的粘度的结果;锭子cs4
–
18(实施例10
–
第一组合物)
[0164][0165]
稀释剂10 ml(第二组合物)
[0166]
选择的粘度测定方法(基于在先的方法优化)如下所示:
[0167]
实施例6
‑
10稀释剂10ml的粘度测定方法如下所述:
[0168]
仪器:具有锭子sc4
‑
18的旋转粘度计(brookfield dv2t lv粘度计)。
[0169]
方法:将6.7ml溶液放入sc4—18室。将sc4
‑
18转子浸入测试溶液中,并将速度设置在4rpm。通过1分钟后,读出粘度值。在23 3℃温度下测量该溶液。该溶液粘度的测量值必须满足350
‑
650cps的验收标准。
[0170]
表20.来自稀释剂(第二组合物)10ml的粘度的结果,锭子cs4
–
18
[0171][0172]
实施例6
‑
8的合并溶液的粘度测定方法如下所述:
[0173]
仪器:具有锭子sc4
‑
18的旋转粘度计(brookfield dv2t lv粘度计)。
[0174]
方法:将6.7ml溶液放入sc4—18室。将sc4
‑
18转子浸入测试溶液中,并将速度设置在6rpm。通过1分钟后,读出粘度值。在23 3℃温度下取得测量值。该溶液粘度的测量值必须满足300
‑
600cps的验收标准。
[0175]
表21.来自泮托拉唑10mg/15ml(实施例7)口服合并的溶液的粘度的结果,锭子cs4
–
18
[0176][0177]
表22.来自泮托拉唑20mg/15ml(实施例8)口服合并的溶液的粘度的结果,锭子cs4
–
18
[0178][0179]
表23.来自奥美拉唑20mg/15ml(实施例6)口服合并的溶液的粘度的结果,锭子cs4
–
18
[0180][0181]
表24.来自艾美拉唑(实施例9)10mg/15ml口服合并的溶液的粘度的结果,锭子cs4
–
18
[0182][0183]
表25.来自艾美拉唑(实施例10)20mg/15ml口服合并的溶液的粘度的结果,锭子cs4
–
18
[0184][0185]
实施例13
[0186]
重量摩尔渗透压浓度的测量
[0187]
与用一定量的水(约250ml水)服用的固体药物形式(胶囊、片剂)不同,口服溶液通常以未稀释的形式服用。口服液体药物通常是高渗的,且无需稀释即可服用。存在具有3500、5000或更高mosm/kg的非常高的重量摩尔渗透压浓度值的口服液体药物形式的药物。如果以未稀释的形式服用这类液体药物,则存在渗透性腹泻的潜在风险,这在儿科患者群体中很明显。
[0188]
由于这些原因,奥美拉唑溶液的重量摩尔渗透压浓度被确定为证实具有可接受的
高渗性,以确保药物可以以未稀释的形式服用。
[0189]
·
结果:
[0190]
使用osmometer vogel 802测量重量摩尔渗透压浓度。测量对1:10之比的稀释样品进行。
[0191]
对于泮托拉唑2mg/ml溶液、泮托拉唑4mg/ml和奥美拉唑4mg/ml溶液的重量摩尔渗透压浓度的得到的结果如下所示:
[0192]
表26.泮托拉唑2mg/ml溶液(实施例7
–
第一组合物)的重量摩尔渗透压浓度结果
[0193][0194][0195]
表27.泮托拉唑4mg/ml溶液(实施例8
–
第一组合物)的重量摩尔渗透压浓度结果
[0196][0197]
表28.泮托拉唑4mg/ml溶液(实施例8
–
第一组合物)的重量摩尔渗透压浓度结果
[0198][0199]
泮托拉唑2mg/ml;4mg/ml以及奥美拉唑4mg/ml溶液的优选范围重量摩尔渗透压浓度为1000
–
1500mosm/kg。
[0200]
表29.艾美拉唑2mg/ml溶液(实施例9
–
第一组合物)的重量摩尔渗透压浓度结果
[0201][0202][0203]
艾美拉唑2mg/ml溶液;4mg/ml以及艾美拉唑4mg/ml溶液的优选范围重量摩尔渗透压浓度为1000
–
1500mosm/kg。
[0204]
表30.艾美拉唑4mg/ml溶液(实施例10
–
第一组合物)的重量摩尔渗透压浓度结果
[0205][0206]
表31.稀释剂(第二溶液)10ml的重量摩尔渗透压浓度结果
[0207][0208][0209]
稀释剂(第二组合物)的重量摩尔渗透压浓度的优选范围在1500
–
2500mosm/kg。
[0210]
对于泮托拉唑10mg/15ml、泮托拉唑20mg/15ml和奥美拉唑20mg/15ml、艾美拉唑10mg/15ml和艾美拉唑20mg/15ml口服的得到的重量摩尔渗透压浓度结果如下所示:
[0211]
表32奥美拉唑20mg/15ml(实施例6)合并的口服溶液的重量摩尔渗透压浓度结果.
[0212][0213]
表33.泮托拉唑10mg/15ml(实施例7)合并的口服溶液的重量摩尔渗透压浓度结果
[0214][0215][0216]
表34.泮托拉唑20mg/15ml(实施例8)口服溶液的重量摩尔渗透压浓度结果
[0217][0218]
表35.艾美拉唑10mg/15ml(实施例9)溶液的重量摩尔渗透压浓度结果
[0219][0220]
表36.艾美拉唑20mg/15ml(实施例10)口服溶液的重量摩尔渗透压浓度结果
[0221][0222][0223]
结论:混合形式的奥美拉唑、泮托拉唑和艾美拉唑合并的口服溶液的重量摩尔渗透压浓度在口服溶液的可接受的范围1500
–
2500mosm/kg。因此,合并的溶液适合于直接口服施用。
[0224]
实施例12
[0225]
适口性评价
[0226]
实施例6
‑
8各自的适口性评价结果分别如表37和图4中所示。
[0227]
表37.适口性评价结果
[0228][0229]
关键点:
[0230]
味道评分极佳5良好4中等3差2极差1
[0231]
结果在图4中图示。
[0232]
由以上数据可以看出泮托拉唑2mg/ml和泮托拉唑4mg/ml显示出极佳的适口性,而奥美拉唑4mg/ml显示出比其他产品更苦的味道。
[0233]
每种产品的适口性评价结果分别如表38和图5中所示。
[0234]
表38.适口性评价结果
–
艾美拉唑与奥美拉唑.
[0235][0236]
从上述数据可以得出结论,艾美拉唑2mg/ml显示出非常好的适口性结果。与显示出中等适口性评分的奥美拉唑20mg/15ml口服溶液相比,艾美拉唑4mg/ml显示出极佳至良好的适口性结果。特别地,艾美拉唑20mg/15ml口服溶液比奥美拉唑20mg/15ml口服溶液苦味小,因此无论是低浓度还是高浓度都无需改善适口性。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。