1.本发明属于生物医用材料技术领域,具体涉及一种可消除伤口处生物膜的可溶解微针贴片及制备方法和应用。
背景技术:
2.慢性伤口已成为全球主要的威胁医疗健康的一大问题,60
‑
90%的慢性伤口与生物膜有关,其形成对慢性炎症、延迟伤口愈合和感染有影响。生物膜的复杂结构使它们比普通的浮游细菌更具抵抗力。生物膜是由细菌分泌的核酸、蛋白质、多糖等生物大分子组成的胞外聚合物(eps),是由多微生物包围而成的聚集体。eps的致密结构不仅为细菌的生长提供了一个适宜的环境,而且为细菌提供了一个强大的屏障,使其免受外界的伤害,使通常剂量的抗生素不能有效地渗透到生物膜中,从而大大降低了其抗菌性能。
3.目前临床上去除生物膜的有效方法主要是物理清创去除坏死组织,或使用含有次氯酸钠或次氯酸等防腐剂的漂洗液进行化学清创。然而,这些方法可能无法完全去除生物膜,同时给患者带来巨大的痛苦,因为经常会发现生物膜在首次清创后2天内再次出现。而常规的将抗菌或抗生物膜材料有效地输送到生物膜内部仍然是一个巨大的挑战。因此,迫切需要开发能够杀死微生物聚集物和破坏生物膜屏障结构的新平台,以提高抗生素的治疗性能,以对抗生物膜相关感染。
技术实现要素:
4.本发明的目的在于克服现有技术中存在的问题,提供一种可消除伤口处生物膜的可溶解微针贴片。该微针贴片能够消除生物膜致密的屏障,杀死包裹在生物膜中的细菌,减少抗生素的用量。
5.为解决上述技术问题,本发明采用的技术方案是:一种可消除伤口处生物膜的可溶解微针贴片,其特征在于,所述微针贴片的针尖上包裹有α
‑
淀粉酶和负载左氧氟沙星的聚多巴胺纳米颗粒。
6.另外,本发明还提供了一种制备上述可消除伤口处生物膜的可溶解微针贴片的方法,其特征在于,制备方法包括:
7.步骤一、在微针阵列的母模结构上浇注聚二甲基硅氧烷,固化成型后脱模,得到与所述微针阵列的母模结构相反的阴模微针阵列模具;
8.步骤二、将聚多巴胺纳米颗粒与左氧氟沙星溶液混合,避光搅拌,离心并用pbs清洗,冻干得到负载左氧氟沙星的聚多巴胺纳米颗粒;
9.步骤三、将聚乙烯醇溶液和α
‑
淀粉酶溶液混合均匀,将步骤二中所述负载左氧氟沙星的聚多巴胺纳米颗粒配制成溶液,然后加入混合均匀的聚乙烯醇和α
‑
淀粉酶溶液,混合均匀,得到针尖制备溶液;
10.步骤四、将步骤三制备的针尖制备溶液加入到步骤一的阴模微针阵列模具中,用真空泵抽真空,使针尖制备溶液进入阴模微针阵列模具的针尖部位;
11.步骤五、吸出除针尖外多余的针尖制备溶液,向阴模微针阵列模具中加入聚乙烯醇溶液,以填满模具基座部位;
12.步骤六、将填充好的阴模微针阵列模具置于真空干燥箱中干燥,脱模后得到可消除伤口处生物膜的可溶解微针贴片。
13.上述的方法,其特征在于,步骤二中聚多巴胺纳米颗粒与左氧氟沙星溶液的混合物中聚多巴胺纳米颗粒的浓度为0.5mg/ml~2mg/ml,左氧氟沙星的浓度为0.1mg/ml~0.6mg/ml。
14.上述的方法,其特征在于,步骤二中避光搅拌的时间为12h~36h。
15.上述的方法,其特征在于,步骤三中所述针尖制备溶液中聚乙烯醇的质量百分含量为20%~25%,α
‑
淀粉酶的质量百分含量不大于1%,负载左氧氟沙星的聚多巴胺纳米颗粒的质量百分含量不大于0.05%。
16.上述的方法,其特征在于,步骤五中所述聚乙烯醇溶液中聚乙烯醇的质量百分含量为20%~25%。
17.上述的方法,其特征在于,步骤六中所述干燥的时间为12h~24h。
18.进一步地,本发明还提供了一种上述可消除伤口处生物膜的可溶解微针贴片在消除伤口处形成的生物膜中的应用。
19.上述的应用,其特征在于,所述可溶解微针贴片与光热疗法联合使用。
20.本发明与现有技术相比具有以下优点:
21.1、本发明的微针贴片能够消除生物膜致密的屏障,杀死包裹在生物膜中的细菌,减少抗生素的用量。
22.2、本发明的微针贴片的针尖部位可以物理破坏生物膜屏障,穿透生物膜,将所载物质递送至生物膜内部,有助于后续生物膜的消除;针尖上包裹有负载左氧氟沙星的聚多巴胺纳米颗粒,可以在生物膜内部释放抗生素左氧氟沙星,同时在近红外808nm的激光照射下,聚多巴胺纳米颗粒具有的光热效应可以促进药物释放,同时局部提高伤口处温度,将暴露出来的细菌杀死,达到消除生物膜的作用。
23.3、本发明的针尖制备液中含有α
‑
淀粉酶,能够降解生物膜的细胞外聚合物中的多糖,从而破坏生物膜致密的结构,将包裹在其中的较难杀死的细菌暴露出来。
24.下面结合具体实施方式和附图,对本发明的技术方案做进一步详细说明。
附图说明
25.图1为本发明实施例1制备的聚多巴胺的sem图。
26.图2为本发明实施例2制备的负载左氧氟沙星的聚多巴胺的sem图。
27.图3为盐酸多巴胺、左氧氟沙星、本发明实施例1制备的聚多巴胺和本发明实施例2制备的负载左氧氟沙星的聚多巴胺的uv
‑
vis的图。
28.图4为pda@levo np的光热性质。其中图4(a)为不同浓度的pda@levo np随时间的温度变化图,图4(b)为浓度为500μg/ml的pda@levo np在不同强度的808nm光照下随时间的温度变化图。
29.图5为微针与细菌悬液共培养后涂平板的图。
30.图6为微针与细菌悬液共培养后的sem图。
31.图7为微针与生物膜作用后生物膜残留生物质量的图。
32.图8为微针与生物膜作用后残留细菌的涂平板的图。
33.图9为微针贴片在离体鼠皮中溶解的图。
34.图10为微针贴片的sem图。
35.图11为装载有罗丹明b的微针贴片穿透体外鼠皮的图。
具体实施方式
36.聚多巴胺的制备
37.实施例1
38.将6ml氨水溶液与120ml无水乙醇和270ml去离子水在30℃下混合搅拌20分钟;然后,将30ml多巴胺盐酸盐溶液(50mg/ml)快速加入上述混合溶液中。1分钟后,溶液颜色变为淡黄色。剧烈搅拌24小时后,所得溶液变成深棕色。经离心和清洗后得到pda(聚多巴胺)纳米颗粒。通过扫描电镜检测产物为粒径约300nm的纳米球,如图1所示。
39.负载左氧氟沙星的聚多巴胺的制备:
40.实施例2
41.将盐酸左氧氟沙星粉末溶于ph值为7.4的磷酸盐缓冲溶液中,配置为不同浓度0.1mg/ml~0.6mg/ml的左氧氟沙星溶液,将聚多巴胺纳米颗粒加入上述溶液,其终浓度为1mg/ml,室温下在避光的条件下搅拌24小时,以使药物负载到纳米颗粒上,负载结束后离心并用pbs清洗三次去除未负载的游离药物,经冻干得到负载左氧氟沙星的聚多巴胺纳米颗粒,如图2所示。
42.对实施例2制备的负载左氧氟沙星的聚多巴胺和实施例1制备的聚多巴胺以及左氧氟沙星和盐酸
‑
多巴胺进行紫外
‑
可见光光谱分析,如图3所示。从图中可以看出,通过氧化作用和聚合,聚多巴胺纳米颗粒的紫外可见光吸收光谱的吸收范围延伸到近红外区,具有光热治疗材料光吸收性质的基本要求。在负载了左氧氟沙星后,负载左氧氟沙星的聚多巴胺在290nm处有明显的吸收峰,表明左氧氟沙星成功负载。
43.将实施例2制备的负载左氧氟沙星的聚多巴胺纳米颗粒经超声处理后配制成不同浓度的悬液,以波长808nm的激光为光源,检测不同浓度聚多巴胺悬浊液的温度随照射时间的变化,如图4(a)所示。经过10min持续照射后,随着聚多巴胺纳米颗粒溶液浓度的增加,溶液温度不断上升,1ml500μg/ml负载左氧氟沙星的聚多巴胺纳米颗粒悬浊液温度由23℃升至50℃;同样,将浓度为500μg/ml的负载左氧氟沙星的聚多巴胺纳米颗粒悬浊液置于不同强度的近红外光照下,随着光强度的增加,悬液的浓度不断增加,如图4(b)所示,在强度为2w/cm2的照射下,10min后,悬液的温度可达65℃,表明在负载了左氧氟沙星后,负载左氧氟沙星的聚多巴胺纳米颗粒依然具有良好的光热性质。
44.制备微针贴片
45.实施例3
46.步骤一、在微针阵列的母模结构上浇注聚二甲基硅氧烷,固化成型后脱模,得到与所述微针阵列的母模结构相反的阴模微针阵列模具;
47.步骤二、将聚多巴胺纳米颗粒与左氧氟沙星溶液混合,避光搅拌12h,离心并用pbs清洗,冻干得到负载左氧氟沙星的聚多巴胺纳米颗粒;聚多巴胺纳米颗粒与左氧氟沙星溶
液的混合物中聚多巴胺纳米颗粒的浓度为0.5mg/ml,左氧氟沙星的浓度为0.1mg/ml;
48.步骤三、将聚乙烯醇溶液和α
‑
淀粉酶溶液混合均匀,将步骤二中所述负载左氧氟沙星的聚多巴胺纳米颗粒配制成溶液,然后加入混合均匀的聚乙烯醇和α
‑
淀粉酶溶液,混合均匀,得到针尖制备溶液;所述针尖制备溶液中聚乙烯醇的质量百分含量为25%,α
‑
淀粉酶的质量百分含量为0.1%,负载左氧氟沙星的聚多巴胺纳米颗粒的质量百分含量为0.01%;
49.步骤四、将步骤三制备的针尖制备溶液加入到步骤一的阴模微针阵列模具中,用真空泵抽真空,使针尖制备溶液进入阴模微针阵列模具的针尖部位;
50.步骤五、吸出除针尖外多余的针尖制备溶液,向阴模微针阵列模具中加入质量百分含量为25%的聚乙烯醇水溶液,以填满模具基座部位;
51.步骤六、将填充好的阴模微针阵列模具置于真空干燥箱中干燥12h,脱模后得到可消除伤口处生物膜的可溶解微针贴片。
52.实施例4
53.步骤一、在微针阵列的母模结构上浇注聚二甲基硅氧烷,固化成型后脱模,得到与所述微针阵列的母模结构相反的阴模微针阵列模具;
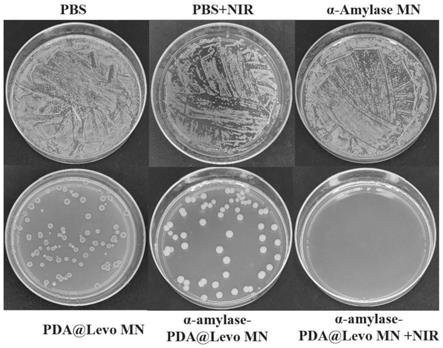
54.步骤二、将聚多巴胺纳米颗粒与左氧氟沙星溶液混合,避光搅拌36h,离心并用pbs清洗,冻干得到负载左氧氟沙星的聚多巴胺纳米颗粒;聚多巴胺纳米颗粒与左氧氟沙星溶液的混合物中聚多巴胺纳米颗粒的浓度为2mg/ml,左氧氟沙星的浓度为0.6mg/ml;
55.步骤三、将聚乙烯醇溶液和α
‑
淀粉酶溶液混合均匀,将步骤二中所述负载左氧氟沙星的聚多巴胺纳米颗粒配制成溶液,然后加入混合均匀的聚乙烯醇和α
‑
淀粉酶溶液,混合均匀,得到针尖制备溶液;所述针尖制备溶液中聚乙烯醇的质量百分含量为20%,α
‑
淀粉酶的质量百分含量为1%,负载左氧氟沙星的聚多巴胺纳米颗粒的质量百分含量为0.05%;
56.步骤四、将步骤三制备的针尖制备溶液加入到步骤一的阴模微针阵列模具中,用真空泵抽真空,使针尖制备溶液进入阴模微针阵列模具的针尖部位;
57.步骤五、吸出除针尖外多余的针尖制备溶液,向阴模微针阵列模具中加入质量百分含量为20%的聚乙烯醇水溶液,以填满模具基座部位;
58.步骤六、将填充好的阴模微针阵列模具置于真空干燥箱中干燥24h,脱模后得到可消除伤口处生物膜的可溶解微针贴片。
59.实施例5
60.步骤一、在微针阵列的母模结构上浇注聚二甲基硅氧烷,固化成型后脱模,得到与所述微针阵列的母模结构相反的阴模微针阵列模具;
61.步骤二、将聚多巴胺纳米颗粒与左氧氟沙星溶液混合,避光搅拌24h,离心并用pbs清洗,冻干得到负载左氧氟沙星的聚多巴胺纳米颗粒;聚多巴胺纳米颗粒与左氧氟沙星溶液的混合物中聚多巴胺纳米颗粒的浓度为1mg/ml,左氧氟沙星的浓度为0.3mg/ml;
62.步骤三、将聚乙烯醇溶液和α
‑
淀粉酶溶液混合均匀,将步骤二中所述负载左氧氟沙星的聚多巴胺纳米颗粒配制成溶液,然后加入混合均匀的聚乙烯醇和α
‑
淀粉酶溶液,混合均匀,得到针尖制备溶液;所述针尖制备溶液中聚乙烯醇的质量百分含量为22.5%,α
‑
淀粉酶的质量百分含量为0.5%,负载左氧氟沙星的聚多巴胺纳米颗粒的质量百分含量为0.03%;
63.步骤四、将步骤三制备的针尖制备溶液加入到步骤一的阴模微针阵列模具中,用真空泵抽真空,使针尖制备溶液进入阴模微针阵列模具的针尖部位;
64.步骤五、吸出除针尖外多余的针尖制备溶液,向阴模微针阵列模具中加入质量百分含量为22.5%的聚乙烯醇水溶液,以填满模具基座部位;
65.步骤六、将填充好的阴模微针阵列模具置于真空干燥箱中干燥20h,脱模后得到可消除伤口处生物膜的可溶解微针贴片。
66.对比例1
67.pva可溶解微针的制备
68.按照以下步骤制备pva可溶解微针贴片:
69.步骤一、将pdms浇铸在钢制微针母模上,在60℃烘箱中干燥2h以获得pdms阴模;
70.步骤二、使用电子天平精密称取1.25g分子量为1万的聚乙烯醇于5ml去离子水中,将离心管中在80℃水浴下溶解,在5000rpm下离心3min脱除溶液中的气泡,得到微针制备液;
71.步骤三、使用注射器将微针制备液加入到pdms阴模模具中,并通过气泵对微针模具进行负压抽真空处理,保证溶液完全进入针孔中,将注入的模具置于通风处干燥24小时,然后将微针剥离,作为空白对照。
72.对比例2
73.载有α
‑
淀粉酶的可溶解微针的制备
74.按照以下步骤制备载有α
‑
淀粉酶的可溶解微针贴片:
75.步骤一、使用电子天平精密称取1.25g分子量为1万的聚乙烯醇于5ml去离子水中,将离心管中在80℃水浴下溶解,然后称取0.05gα
‑
淀粉酶加入离心管中,混合至完全溶解。将上述溶液混合均匀,使用离心法脱除溶液中的气泡,得到微针制备液;
76.步骤二、使用注射器将微针制备液加入到pdms阴模模具中,并通过气泵对微针模具进行负压抽真空处理,保证溶液完全进入针孔中,将注入的模具置于通风处干燥24小时,然后将微针剥离,记为α
‑
amylase mn。
77.对比例3
78.载有pda@levo的可溶解微针的制备
79.步骤一、使用电子天平精密称取1.25g分子量为1万的聚乙烯醇于5ml去离子水中,将离心管中在80℃水浴下溶解,然后称取0.0025g pda@levo加入离心管中,超声至溶解。将上述溶液混合均匀,使用离心法脱除溶液中的气泡,得到微针制备液;
80.步骤二、使用注射器将微针制备液加入到pdms阴模模具中,并通过气泵对微针模具进行负压抽真空处理,保证溶液完全进入针孔中,将注入的模具置于通风处干燥24小时,然后将微针剥离,记为pda@levo mn。
81.可溶解微针贴片性能测试和说明。
82.杀菌性能的测试:选用金黄色葡萄球菌用于以下抗菌和抗生物膜实验。因为金黄色葡萄球菌(s.aureus,atcc 29213)作为临床上常见的感染细菌,对人们的健康造成了极大的威胁。在浓度为105cfu/ml的金黄色葡萄球菌菌液中分别放入实施例5和对比例1
‑
3制备的微针,对于近红外组,将混合菌液置于808nm的近红外激光下,在1w/cm2的强度下照射10min后,和其他组一起于37℃摇床中振荡培养24h后,测量共培养液在600nm处的吸光度,
之后将共培养的菌液经过梯度稀释,取100μl共培养菌液均匀涂于琼脂培养基上,于37℃培养箱中培养48h观察细菌生长情况并拍照。如图5所示,和空白组(对应对比例1的微针)相比,单一nir组(单一近红外光照射)以及单一α
‑
淀粉酶组(对应对比例2的微针)均未显示出抗菌性能,当在微针贴片中载入pda@levo(对应对比例3的微针)后,微针贴片具有明显的抗菌能力,菌落数大大减少;结合光热治疗后,平板上没有一个菌落数,证明了载有pda@levo和α
‑
淀粉酶的可溶解微针(对应实施例5的微针)具有优异的抗菌性能。
83.同时,将共培养的菌液取10μl滴于盖玻片上,干燥5~10min后,加入多聚甲醛以固定细菌于盖玻片上,2h后分别用50%,75%,90%,95%和无水乙醇梯度脱水,最后,样品被溅射镀金以在sem下观察不同处理后细菌的形态。如图6所示,与空白组相比,单一nir组以及单一α
‑
淀粉酶组的细菌大部分为存活的状态,具有光滑完整的球形细胞结构。用pda@levo处理后,大量的np颗粒附着在细菌周围,且随着levo的释放,细菌的表面出现了一定程度的皱纹和塌陷,表明细菌的死亡。结合近红外辐射,几乎看不到完整的细胞结构,大部分细菌细胞膜已完全被破坏成碎片,活细菌数量极少,表明抗生素与ptt协同组合具有优异的抗菌性能。
84.体外抗生物膜性能的测试:
85.生物膜体外生成实验:首先,将固体溶原性肉汤(lb)琼脂平板上的金黄色葡萄球菌和铜绿假单胞菌的单菌落分别转移到富含3%w/v nacl和0.5%w/v葡萄糖的tsb培养基中,并在振荡中生长37℃培养箱,直到其od
600
值达到~0.5(约等于108cfu/ml)。为了获得生物膜,将500μl金黄色葡萄球菌或铜绿假单胞菌(1
×
108cfu ml
‑
1)添加到48孔板中。然后,将细菌在37℃下培养48小时,每24小时更换一次培养基。除去培养基后,在孔底部观察到可见的生物膜。然后用生理盐水轻轻洗去未附着的细菌3次。
86.在形成生物膜的48孔板中加入不同成分的mns,然后加入300μl生理盐水。对于细菌 nir和细菌 pda@levo@α
‑
淀粉酶 nir组,在微针完全溶化后,使用808nm激光(1.0w/cm2,10分钟)照射生物膜。37℃培养24h后,弃去孔内液体,用生理盐水冲洗处理过的生物膜3次,去除浮游细菌。抗生物膜试验通过平板法和结晶紫染色进行。首先,残留生物膜的生物量通过结晶紫测定进行量化。将48孔板置于通风橱下20分钟以干燥残留的生物膜。然后,每孔加入500μl 0.1%结晶紫,染色生物膜15min。弃去结晶紫,用生理盐水洗3次,以除去未结合的结晶紫。之后,每孔加入500μl 95%乙醇溶解染料,使用酶标仪在595nm处测量吸光度。结果如图7所示,唯一的nir组显示没有去除生物膜的能力。用α
‑
淀粉酶处理后,生物膜质量明显降低到50%,这是因为作为eps主要成分之一的多糖被α
‑
淀粉酶降解,破坏了生物膜的致密结构。相比之下,虽然pda@levo可以有效杀灭游离细菌,但单独的pda@levo处理对生物膜的清除能力较差,孵育后生物膜生物量仍有80%。原因在于,pda@levo np无法穿透生物膜致密的eps结构,无法发挥药物的功效。通过pda@levo和α
‑
淀粉酶的组合,生物膜仅剩下40%的生物量。α
‑
淀粉酶的降解可以破坏生物膜的结构,破坏生物膜的屏障,使包裹的细菌暴露出来,使np可以直接与细菌相互作用,杀灭细菌,避免细菌积聚和随后形成生物膜。结合光热疗法,生物膜的残留生物质量下降幅度最大。
87.对于涂平板试验,将处理过的生物膜用pbs洗涤3次后,进行涡旋(5分钟)和超声处理(10分钟)两个循环,使固着细菌分离到pbs中。梯度稀释后,将100μl悬浮液涂在lb琼脂培养基上。37℃培养24h后拍照,计数菌落数。如图8所示,空白组和近红外组一样,生物膜中仍
然存在大量细菌。用α
‑
淀粉酶处理后,平板上的菌落数量明显减少。然而,由于生物膜作为细菌保护屏障的存在,pda@levo未能充分发挥其抗菌性能,因此经过pda@levo处理后仍有大量细菌残留。α
‑
淀粉酶与pda@levo相互作用后,α
‑
淀粉酶的生物膜分散与levo的抗菌作用产生协同作用,有助于进一步减少活菌数量。同时,在近红外照射后,与其他组相比,用α
‑
淀粉酶 pda@levo 近红外处理的生物膜中的活细菌数量进一步减少。这些结果揭示了α
‑
淀粉酶 pda@levo与近红外辐射协同抗生物膜的作用。
88.载有pda@levo和α
‑
淀粉酶的可溶解微针的皮内溶解测试
89.采用实施例5制备的可溶解微针进行3min的鼠皮穿刺实验,具体方法为:取新鲜的老鼠皮,使用手术刀裁取适当大小的皮肤块,用滤纸吸净表面水分,平铺在泡沫板上固定,含有角质层一面朝上,将待测试微针置于鼠皮上,用力加压刺穿20s,然后等待3min后,用镊子将微针取下,置于立式显微镜下观察微针针尖溶解情况,结果见图9。
90.载有pda@levo和α
‑
淀粉酶的可溶解微针形貌及皮肤穿刺效果
91.将实施例5制备的微针溅射镀金以在sem下观察。如图10,通过该方法制得的微针贴片在干燥完全后,基底平整,针尖尖锐、饱满。进行鼠皮穿刺实验,如图11,罗丹明b染色后,皮肤上留有完整的微针针孔阵列,证明了该方法所制的微针贴片具有良好的皮肤穿刺效果。
92.以上所述,仅是本发明的较佳实施例,并非对本发明做任何限制,凡是根据发明技术实质对以上实施例所作的任何简单修改、变更以及等效结构变化,均仍属于本发明技术方案的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。