1.本发明涉及电化学与细胞电生理学领域,具体涉及一种基于癌细胞表面电荷强度的评估肿瘤恶性程度的方法,即一种细胞表面电荷检测的方法及其生物医学应用,即检测肿瘤患者的癌细胞表面电荷强度并将其作为评估肿瘤恶性程度的指标。
背景技术:
2.生物电是所有生命活动的重要部分。然而,动物体细胞的电学性质却依然没有被充分了解。过去的几十年中,电生理学的进展表明,细胞表面电荷是细胞特性的重要属性,在调节细胞功能中起着至关重要的作用。早在20世纪40年代,就有人通过癌细胞的一些细微的行为猜测癌细胞表面的电学性质应该与正常细胞不同。大多数癌细胞表面带负电,并产生影响表面活性的表面电势,离子在细胞膜上的浓度从而影响重要的细胞事件,例如细胞粘附,细胞摄取,细胞间通讯,信号转导和蛋白质运输。
3.为了测量细胞表面电荷,已经开发了多种方法,包括静电相互作用,等电平衡分析和电泳。静电相互作用法通常基于静电相互作用色谱(esic)技术,它使用带电的离子交换树脂/分子与细胞相互作用;相互作用的亲和力取决于细胞表面的电荷。因此,根据细胞与树脂之间的亲和力,可以评估相对的细胞表面电荷。最近,就测量纳米探针(nps)与细胞之间的亲和力而言,具有一定电荷的纳米探针(nps)也已用于细胞表面电荷检测。但是,这种类型的方法无法提供直接的表面电荷测量,并且通常很耗时。对于等电平衡分析方法,将细胞加载到具有线性ph梯度的色谱柱上,并在适当的电压下迁移。细胞表面电荷会影响等电位置,等电平衡后细胞迁移至等电位置。尽管细胞的ζ电势可以从等电位置导出,但是该方法需要很长时间才能实现等电平衡。它不适用于单细胞表面电荷的原位测量。
技术实现要素:
4.本发明所要解决的技术问题是针对现有技术中存在上述缺陷,提供一种一种更灵敏、更精确的普适性细胞表面电荷测试方法,并为后续探索癌细胞表面电荷对其功能的影响甚至是临床应用提供了可能。
5.根据本发明,提供了一种基于癌细胞表面电荷强度的评估肿瘤恶性程度的方法,包括:
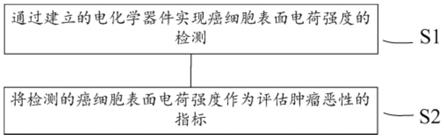
6.第一步骤,用于通过建立的电化学器件实现癌细胞表面电荷强度的检测;
7.第二步骤,用于将检测的癌细胞表面电荷强度作为评估肿瘤恶性的指标。
8.优选地,第一步骤采用的检测方法为三电极体系测试法,而且三电极体系测试法采用的三电极体系包括工作电极、对电极、参比电极,其中工作电极包括依次设置的柔性基底和碳纳米管薄膜,对电极为铂丝对电极,参比电极由浸渍在氯化钾溶液中的覆盖着氯化银的金属银组成,即银/氯化银电极。
9.优选地,所述三电极体系测试法包括:
10.将经过预处理的碳纳米管薄膜固定于柔性聚二甲基硅氧烷基底上,得到碳纳米管
薄膜电极;
11.将所得的碳纳米管薄膜电极连接在电化学工作站的工作电极一端,将铂丝连接在电化学工作站的对电极一端,将银/氯化银电极连接在电化学工作站的参比电极一端。
12.优选地,第一步骤采用的检测方法为三电极体系测试法,所述三电极体系测试法包括:确立癌细胞表面电荷与即时响应电流之间的关系,并在三电极体系中检测待检测肿瘤并通过推算得到癌细胞表面电荷强度水平。
13.优选地,确立癌细胞表面电荷与即时响应电流之间的关系包括:
14.以磷酸盐缓冲液为电解质,将三电极体系的工作电极、对电极、参比电极浸入电解质中,通过电化学工作站的线性扫描伏安法测试空白曲线;
15.依次在电解质中加入不同浓度或不同种类的癌细胞,通过电化学工作站的线性扫描伏安法测试相同电压下电流的变化情况。
16.优选地,在三电极体系检测待检测肿瘤并通过推算得到癌细胞表面电荷强度水平的步骤包括:
17.将待检测肿瘤置于磷酸盐缓冲液为电解质中,并对三电极体系施加外加电压,测试反应过程中工作电极上电子的转移量,并根据确立的癌细胞表面电荷与即时响应电流之间的关系,推算癌细胞表面电荷强度水平,实现检测癌细胞表面电荷强度的检测。
18.优选地,碳纳米管薄膜的厚度为5
‑
20μm,面积为0.3
‑
0.5cm2。
19.优选地,柔性聚二甲基硅氧烷基底的制备过程为:将聚二甲基硅氧烷与固化剂按照预定质量比混合均匀,并在70
‑
80℃下加热固化40
‑
60min得到。
20.优选地,电解质的体积为10
‑
20ml,磷酸盐缓冲液的摩尔浓度为0.05
‑
0.2mmol l
‑1。
21.优选地,线性扫描伏安法的扫描范围为0
‑
3v,扫描速度为50
‑
150mvs
‑1。
22.与现有技术相比,本发明的有益效果和独创性主要体现在以下几个方面:
23.1.本发明设计的癌细胞表面电荷检测器件,极大地简化了器件结构(现有器件结构多为三电极体系)且完成了癌细胞在不脱离生理条件下(多数器件无法完成在pbs条件下)的直接检测;而且确立了癌细胞表面电荷与即时响应电流之间的关系,能够快速推算得到癌细胞表面电荷强度水平。本发明实现了准确、高灵敏度、快速的癌细胞表面电荷检测,具有巨大的实际应用价值。
24.2.本发明采用癌细胞表面电荷强度与病理学相结合的方法对乳腺癌进行分析,研究癌细胞表面电荷在评估肿瘤恶性程度方面的价值,将更好地指导临床治疗并预测预后。
附图说明
25.结合附图,并通过参考下面的详细描述,将会更容易地对本发明有更完整的理解并且更容易地理解其伴随的优点和特征,其中:
26.图1示意性地示出了根据本发明优选实施例的基于癌细胞表面电荷强度的评估肿瘤恶性程度的方法的总体流程图。
27.图2示意性地示出了根据本发明优选实施例的基于癌细胞表面电荷强度的评估肿瘤恶性程度的方法采用的三电极体系测试法的原理示意图。
28.图3为人骨肉瘤细胞株细胞数量为80w时的细胞表面电荷量;(恶性程度:u2os<zos<sjsa
‑
1)
29.图4肺癌细胞数量为80w时的细胞表面电荷量;(恶性程度:a549>h460)
30.图5结直肠癌细胞数量为80w时的细胞表面电荷量;(恶性程度:hct116>ht29)
31.图6肝癌细胞数量为80w时的细胞表面电荷量;(恶性程度:hcclm3>hep
‑
3b)
32.图7膀胱癌细胞数量为80w时的细胞表面电荷量;(恶性程度从上至下,由低到高)
33.需要说明的是,附图用于说明本发明,而非限制本发明。注意,表示结构的附图可能并非按比例绘制。并且,附图中,相同或者类似的元件标有相同或者类似的标号。
具体实施方式
34.为了使本发明的内容更加清楚和易懂,下面结合具体实施例和附图对本发明的内容进行详细描述。
35.在本发明中,通过建立的电化学器件实现癌细胞表面电荷强度的检测,并将检测的癌细胞表面电荷强度作为评估肿瘤恶性的指标。
36.<第一实施例>
37.图1示意性地示出了根据本发明优选实施例的基于癌细胞表面电荷强度的评估肿瘤恶性程度的方法的总体流程图。
38.如图1所示,根据本发明优选实施例的基于癌细胞表面电荷强度的评估肿瘤恶性程度的方法包括:
39.第一步骤s1:通过建立的电化学器件实现癌细胞表面电荷强度的检测;
40.第二步骤s2:将检测的癌细胞表面电荷强度作为评估肿瘤恶性的指标。
41.癌细胞表面电荷能够对癌细胞的能量代谢水平(糖酵解过程是癌细胞表面带负电的主要原因)进行评估,间接反应肿瘤的恶性程度(恶性肿瘤的糖酵解程度增强),可作为无创性评估肿瘤生物学的一个指标。目前对乳腺癌的研究大多是单独采用病理学或影像诊断的方法,本发明采用癌细胞表面电荷强度与病理学相结合的方法对例如乳腺癌之类的癌进行回顾性分析,旨在研究癌细胞表面电荷在评估肿瘤恶性程度方面的价值,以期更好地指导临床治疗并预测预后。
42.<具体实例>
43.第一步骤采用的检测方法为三电极体系测试法。具体地,图2示意性地示出了根据本发明优选实施例的基于癌细胞表面电荷强度的评估肿瘤恶性程度的方法采用的三电极体系测试法的原理示意图。如图2所示,三电极体系测试法采用的三电极体系包括工作电极、对电极、参比电极,其中工作电极包括依次设置的柔性基底和碳纳米管薄膜,对电极为铂丝对电极,参比电极由浸渍在氯化钾溶液中的覆盖着氯化银的金属银组成。其中短箭头显示了电子e
‑
的流向。
44.例如,在具体操作时,可以首先确立癌细胞表面电荷与即时响应电流之间的关系,并在三电极体系中检测待检测肿瘤并通过推算得到癌细胞表面电荷强度水平。具体可以将待检测肿瘤置于磷酸盐缓冲液为电解质中,并对三电极体系施加外加电压,测试反应过程中工作电极上电子的转移量,并根据确立的癌细胞表面电荷与即时响应电流之间的关系,推算癌细胞表面电荷强度水平,实现检测癌细胞表面电荷强度的检测。
45.与现有技术相比,本发明通过三电极体系可检测不同种类癌细胞表面电荷,进而评估不同肿瘤的恶性程度。
46.优选地,所述工作电极的柔性基底为聚二甲基硅氧烷,厚度为0.8
‑
1.5mm,优选为1.0mm。优选地,所述碳纳米管薄膜的厚度为5
‑
20μm,优选为10μm,碳纳米管薄膜的面积为0.3
‑
0.5cm2,优选为0.4cm2。
47.具体地,例如,三电极体系测试法包括:
48.(a)将经过预处理的一定尺寸的碳纳米管薄膜固定于柔性聚二甲基硅氧烷基底上,得到碳纳米管薄膜电极;
49.(b)将步骤(a)所得的碳纳米管薄膜电极连接在电化学工作站的工作电极一端,将铂丝连接在电化学工作站的对电极一端,将银/氯化银电极连接在电化学工作站的参比电极一端;
50.(c)以一定体积的磷酸盐缓冲液(pbs)为电解质,将步骤(b)所述的三个电极浸入电解质中,通过电化学工作站的线性扫描伏安法(lsv)测试空白曲线;
51.(d)依次在电解质中加入不同浓度或不同种类的癌细胞,通过电化学工作站的lsv曲线测试相同电压下电流的变化情况。
52.具体地,例如,步骤(a)中,碳纳米管薄膜的预处理具体为:将碳纳米管薄膜在摩尔浓度为8
‑
12mol l
‑1的硝酸中浸泡8
‑
12h,用去离子水冲洗后,在去离子水中浸泡8
‑
12h,之后用去离子水冲洗,并用无尘纸吸干碳纳米管薄膜表面的水分。
53.具体地,例如,在步骤(a)中,碳纳米管薄膜的厚度为5
‑
20μm,面积为0.3
‑
0.5cm2。
54.具体地,例如,在步骤(a)中,所述柔性聚二甲基硅氧烷基底的制备过程为:将聚二甲基硅氧烷与固化剂按照(5
‑
10):1的质量比混合均匀,并在70
‑
80℃下加热固化40
‑
60min得到。
55.具体地,例如,在步骤(c)中,所述的电解质的体积为10
‑
20ml,所述的pbs的摩尔浓度为0.05
‑
0.2mmol l
‑1。
56.具体地,例如,在步骤(c)和(d)中,所述的lsv的扫描范围为0
‑
3v,扫描速度为50
‑
150mv s
‑1。
57.具体地,例如,在步骤(d)中,所述的癌细胞的种类包括:乳腺癌细胞,肺癌细胞,肝癌细胞等10种癌细胞。所述的癌细胞的浓度为20w/ml。
58.具体地,例如,在步骤(d)中,收集不同乳腺癌患者瘤组织原代提取癌细胞作为样本;癌细胞的浓度为20w/ml。
59.其中,优选地,pbs的体积为10
‑
20ml,优选为15ml,pbs的摩尔浓度为0.05
‑
0.2mmo l l
‑1,优选为0.067mmo l l
‑1。优选地,线性扫描伏安法的扫描范围为0
‑
3v,优选为0
‑
1.6v,扫描速度为50
‑
150mv s
‑1,优选为100mv s
‑1。
60.本发明通过三电极测试法检测细胞表面电荷,以碳纳米管薄膜为工作电极,以铂丝电极为对电极,以银/氯化银电极为参比电极,以pbs为电解质,以电化学工作站的lsv为测试方法,检测不同癌细胞加入电解质后,响应电流的变化。本发明通过施加电场,驱动表面带有电荷的癌细胞迁移,引起电极表面的电荷累积,根据加入不同癌细胞后,响应电流的变化,评估肿瘤的恶性程度。
61.该器件可用于包括高分子、细菌和细胞等携带电荷量的检测,本发明特别是将乳腺癌患者瘤组织原代提取癌细胞后,将癌细胞加入器件的检测室(室内事先加入pbs缓冲液,保证癌细胞检测过程的生理活性),施加外加电压后,工作电极上通过测试反应过程中
电子的转移量,实现检测癌细胞表面电荷强度的检测,实验结果表明,本发明所涉及的二电极体系电化学器件可以实现准确、快速的癌细胞表面电荷的检测。
62.实施例1
63.该检测器件采用以下步骤制备得到:
64.(1)碳纳米管薄膜的预处理具体为:将碳纳米管薄膜在摩尔浓度为8
‑
12mol l
‑1的硝酸中浸泡8
‑
12h,用去离子水冲洗后,在去离子水中浸泡8
‑
12h,之后用去离子水冲洗,并用无尘纸吸干碳纳米管薄膜表面的水分。
65.(2)碳纳米管薄膜的厚度为5
‑
20μm,面积为0.3
‑
0.5cm2。
66.(3)所述柔性聚二甲基硅氧烷基底的制备过程为:将聚二甲基硅氧烷与固化剂按照(5
‑
10):1的质量比混合均匀,优选为10:1,并在70
‑
80℃下加热固化40
‑
60min得到。聚二甲基硅氧烷和固化剂均购自道康宁公司,配合使用,固化剂的型号为184。
67.(4)所述的电解质的体积为10
‑
20ml,所述的pbs的摩尔浓度为0.05
‑
0.2mmol l
‑
1。
68.(5)将lsv扫描范围设定为0
‑
3v,扫描速度为50
‑
150mv s
‑1。
69.(6)依次在电解质中加入浓度为20w/ml的待检测样本,即不同类型的癌细胞,如mda
‑
mb
‑
231,k562,a549等,通过电化学工作站的lsv曲线测试,在与步骤(5)中相同的扫描范围和扫描速度下,测试电流变化情况。
70.以上实验结果均证实了本发明设计并制备的三电极体系癌细胞表面电荷检测器件成功地实现了对癌细胞准确、快速的检测,具有较大的优势。
71.实施例2
72.该检测器件采用以下步骤制备得到:
73.(1)碳纳米管薄膜的预处理具体为:将碳纳米管薄膜在摩尔浓度为8
‑
12mol l
‑1的硝酸中浸泡8
‑
12h,用去离子水冲洗后,在去离子水中浸泡8
‑
12h,之后用去离子水冲洗,并用无尘纸吸干碳纳米管薄膜表面的水分。
74.(2)碳纳米管薄膜的厚度为5
‑
20μm,面积为0.3
‑
0.5cm2。
75.(3)所述柔性聚二甲基硅氧烷基底的制备过程为:将聚二甲基硅氧烷与固化剂按照(5
‑
10):1的质量比混合均匀,优选为10:1,并在70
‑
80℃下加热固化40
‑
60min得到。聚二甲基硅氧烷和固化剂均购自道康宁公司,配合使用,固化剂的型号为184。
76.(4)所述的电解质的体积为10
‑
20ml,所述的pbs的摩尔浓度为0.05
‑
0.2mmol l
‑
1。
77.(5)将lsv扫描范围设定为0
‑
3v,扫描速度为50
‑
150mv s
‑1。
78.(6)依次在电解质中加入浓度为20w/ml的乳腺癌患者a,瘤组织原代提取的癌细胞,通过电化学工作站的lsv曲线测试,在与步骤(5)中相同的扫描范围和扫描速度下,测试电流变化情况。
79.(7)在与步骤(6)中相同的乳腺癌患者样本进行病理学分析,评估肿瘤间质比,并根据肿瘤间质比将病灶分为两组,即富间质性组(肿瘤间质比≤50%)和少间质型组(>50%)。根据scarff
‑
bloom
‑
richardson分级对病灶进行评级,8
‑
9分为3级,分化差,高度恶性;6
‑
7分分为2级,中度分化,中度恶性;3
‑
5分分为1级,分化好,低度恶性;3分以下视为分级不可知,无法评估。
80.(8)在与步骤(7)中得到的数据,进行统计学处理,采用spss 19.0统计软件对数据进行分析。符合正态分布的计量资料以均数
±
标准差(x
±
s)表示,2组间比较采用两样本t
检验;非正态分布的计量资料用中位数m(p25,p75)表示,2组间比较采用mann
‑
whitney u检验。计数资料以个(%)表示,2组间比较采用χ2检验。采用spearman相关分析肿瘤最大直径、肿瘤间质比及肿瘤分级与癌细胞表面电荷强度的相关性。采用多重线性回归和逐步回归分析肿瘤电荷强度值与肿瘤特征的关系。p<0.05为差异有统计学意义。
81.实施例3
82.该检测器件采用以下步骤制备得到:
83.(1)碳纳米管薄膜的预处理具体为:将碳纳米管薄膜在摩尔浓度为8
‑
12mol l
‑1的硝酸中浸泡8
‑
12h,用去离子水冲洗后,在去离子水中浸泡8
‑
12h,之后用去离子水冲洗,并用无尘纸吸干碳纳米管薄膜表面的水分。
84.(2)碳纳米管薄膜的厚度为5
‑
20μm,面积为0.3
‑
0.5cm2。
85.(3)所述柔性聚二甲基硅氧烷基底的制备过程为:将聚二甲基硅氧烷与固化剂按照(5
‑
10):1的质量比混合均匀,优选为10:1,并在70
‑
80℃下加热固化40
‑
60min得到。聚二甲基硅氧烷和固化剂均购自道康宁公司,配合使用,固化剂的型号为184。
86.(4)所述的电解质的体积为10
‑
20ml,所述的pbs的摩尔浓度为0.05
‑
0.2mmol l
‑
1。
87.(5)将lsv扫描范围设定为0
‑
3v,扫描速度为50
‑
150mv s
‑1。
88.(6)依次在电解质中加入浓度为20w/ml的乳腺癌患者b,瘤组织原代提取的癌细胞,通过电化学工作站的lsv曲线测试,在与步骤(5)中相同的扫描范围和扫描速度下,测试电流变化情况。
89.(7)在与步骤(6)中相同的乳腺癌患者样本进行病理学分析,评估肿瘤间质比,并根据肿瘤间质比将病灶分为两组,即富间质性组(肿瘤间质比≤50%)和少间质型组(>50%)。根据scarff
‑
bloom
‑
richardson分级对病灶进行评级,8
‑
9分为3级,分化差,高度恶性;6
‑
7分分为2级,中度分化,中度恶性;3
‑
5分分为1级,分化好,低度恶性;3分以下视为分级不可知,无法评估。
90.(8)在与步骤(7)中得到的数据,进行统计学处理,采用spss 19.0统计软件对数据进行分析。符合符合正态分布的计量资料以均数
±
标准差(x
±
s)表示,2组间比较采用两样本t检验;非正态分布的计量资料用中位数m(p25,p75)表示,2组间比较采用mann
‑
whitney u检验。计数资料以个(%)表示,2组间比较采用χ2检验。采用spearman相关分析肿瘤最大直径、肿瘤间质比及肿瘤分级与癌细胞表面电荷强度的相关性。采用多重线性回归和逐步回归分析肿瘤电荷强度值与肿瘤特征的关系。p<0.05为差异有统计学意义。
91.实施例4
92.该检测器件采用以下步骤制备得到:
93.(1)碳纳米管薄膜的预处理具体为:将碳纳米管薄膜在摩尔浓度为8
‑
12mol l
‑1的硝酸中浸泡8
‑
12h,用去离子水冲洗后,在去离子水中浸泡8
‑
12h,之后用去离子水冲洗,并用无尘纸吸干碳纳米管薄膜表面的水分。
94.(2)碳纳米管薄膜的厚度为5
‑
20μm,面积为0.3
‑
0.5cm2。
95.(3)所述柔性聚二甲基硅氧烷基底的制备过程为:将聚二甲基硅氧烷与固化剂按照(5
‑
10):1的质量比混合均匀,优选为10:1,并在70
‑
80℃下加热固化40
‑
60min得到。聚二甲基硅氧烷和固化剂均购自道康宁公司,配合使用,固化剂的型号为184。
96.(4)所述的电解质的体积为10
‑
20ml,所述的pbs的摩尔浓度为0.05
‑
0.2mmol l
‑
1。
97.(5)将lsv扫描范围设定为0
‑
3v,扫描速度为50
‑
150mv s
‑1。
98.(6)依次在电解质中加入浓度为20w/ml的乳腺癌患者c,瘤组织原代提取的癌细胞,通过电化学工作站的lsv曲线测试,在与步骤(5)中相同的扫描范围和扫描速度下,测试电流变化情况。
99.(7)在与步骤(6)中相同的乳腺癌患者样本进行病理学分析,评估肿瘤间质比,并根据肿瘤间质比将病灶分为两组,即富间质性组(肿瘤间质比≤50%)和少间质型组(>50%)。根据scarff
‑
bloom
‑
richardson分级对病灶进行评级,8
‑
9分为3级,分化差,高度恶性;6
‑
7分分为2级,中度分化,中度恶性;3
‑
5分分为1级,分化好,低度恶性;3分以下视为分级不可知,无法评估。
100.(8)在与步骤(7)中得到的数据,进行统计学处理,采用spss 19.0统计软件对数据进行分析。符合符合正态分布的计量资料以均数
±
标准差(x
±
s)表示,2组间比较采用两样本t检验;非正态分布的计量资料用中位数m(p25,p75)表示,2组间比较采用mann
‑
whitney u检验。计数资料以个(%)表示,2组间比较采用χ2检验。采用spearman相关分析肿瘤最大直径、肿瘤间质比及肿瘤分级与癌细胞表面电荷强度的相关性。采用多重线性回归和逐步回归分析肿瘤电荷强度值与肿瘤特征的关系。p<0.05为差异有统计学意义。
101.与现有技术相比,本发明的有益效果和独创性主要体现在以下几个方面:
102.1.本发明设计的癌细胞表面电荷检测器件,极大地简化了器件结构(现有器件结构多为三电极体系)且完成了癌细胞在不脱离生理条件下(多数器件无法完成在pbs条件下)的直接检测;而且确立了癌细胞表面电荷与即时响应电流之间的关系,能够快速推算得到癌细胞表面电荷强度水平。本发明实现了准确、高灵敏度、快速的癌细胞表面电荷检测,具有巨大的实际应用价值。
103.2.本发明采用癌细胞表面电荷强度与病理学相结合的方法对乳腺癌进行分析,研究癌细胞表面电荷在评估肿瘤恶性程度方面的价值,将更好地指导临床治疗并预测预后。
104.需要说明的是,除非特别指出,否则说明书中的术语“第一”、“第二”、“第三”等描述仅仅用于区分说明书中的各个组件、元素、步骤等,而不是用于表示各个组件、元素、步骤之间的逻辑关系或者顺序关系等。
105.可以理解的是,虽然本发明已以较佳实施例披露如上,然而上述实施例并非用以限定本发明。对于任何熟悉本领域的技术人员而言,在不脱离本发明技术方案范围情况下,都可利用上述揭示的技术内容对本发明技术方案作出许多可能的变动和修饰,或修改为等同变化的等效实施例。因此,凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所做的任何简单修改、等同变化及修饰,均仍属于本发明技术方案保护的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。