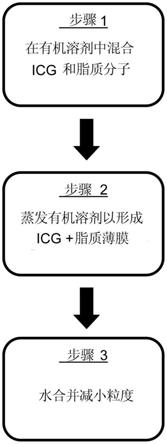
1.本发明涉及血液长循环、癌细胞靶向性及防泄露介孔二氧化硅纳米载药系统的制备方法及应用,属于生物医药技术领域。
背景技术:
2.介孔二氧化硅纳米颗粒(msn)由于其在纳米医学领域,特别是在癌症化疗方面应用的潜力而引起了广泛的关注。msn的主要优点在于其制备方法简便,可体内降解,可控制粒径和孔道的直径,成本低廉以及具有较大的孔体积和表面积,已获得美国fda的批准在临床试验中可用于癌症治疗或成像应用。然而,负载在空隙较大而开放的固体孔道中的药物由于其不受控制的泄漏和爆释放而限制了其应用。尽管人们已经通过用聚合物覆盖微孔和纳米阀堵塞微孔来控制药物的泄露,但这些修饰过的介孔二氧化硅纳米药物仍然有较高的药物泄露率、较短的体内血液循环时间、较低的癌细胞摄取率等,对正常细胞产生明显的细胞毒性。因此,如何提高介孔二氧化硅纳米载药颗粒的血液长循环性能、降低药物在血液及正常组织细胞环境中的泄露率、增强对肿瘤细胞的靶向作用及微环境快速释放性能是决定其能否应用的关键。
技术实现要素:
3.本发明的目的是克服现有介孔二氧化硅纳米药物易泄露的不足,解决介孔二氧化硅纳米粒子作为纳米载体时血液长循环性能差,以及对肿瘤细胞主动靶向能力弱的不足,提供一种开关型介孔二氧化硅纳米药物载体的制备方法。
4.为实现上述目的,本发明技术方案如下:一种开关型介孔二氧化硅纳米药物载体的制备方法,包括以下步骤:(1)制备表面含有氨基的介孔二氧化硅纳米颗粒;(2)在介孔二氧化硅表面及其孔道内形成聚多巴胺涂层;(3)将聚多巴胺涂层改性的介孔二氧化硅纳米颗粒分散在水中,加入n
‑
羟基琥珀酰亚胺(nhs)和1
‑
乙基
‑
(3
‑
二甲基氨基丙基)碳酰二亚胺盐酸盐(edc
·
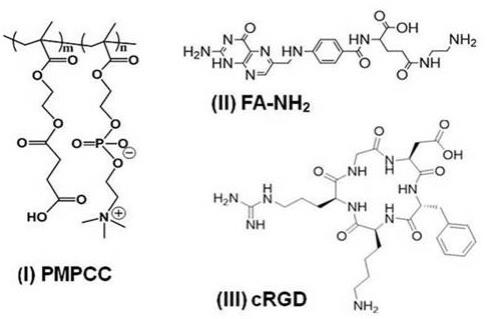
hcl)活化过的结构式(i)所示的含羧基的两性离子聚合物pmpcc,pmpcc中m:n=3:1~10:1,于ph 6~7反应得到两性离子聚合物pmpcc改性的介孔二氧化硅纳米颗粒;然后加入edc和nhs活化后的二硫代二丙酸反应,构建表面及孔道内含活性羧基和两性离子聚合物pmpcc改性的介孔二氧化硅纳米颗粒;
(4)将步骤(3)所得改性纳米颗粒离心洗涤后,加入结构式(ii)所示的氨基化叶酸及结构式(iii)所示的环状rgd进行酰胺化共价结合,得到叶酸及crgd改性的开关型介孔二氧化硅纳米药物载体。
5.上述步骤(1)中,使用氨丙基三乙氧基硅烷或氨丙基三甲氧基硅烷与硅酸乙酯,在ph为7.5~8.5的碱性溶液中共缩聚制备表面含有氨基的介孔二氧化硅纳米颗粒。
6.制成含有氨基的介孔二氧化硅纳米颗粒,孔道表面的氨基既有利于负载带负电性的药物,又容易与多巴胺反应形成聚多巴胺涂层缩小孔道直径。具体制备方法为:将十六烷基三甲基氯化铵(ctac)在40~60℃条件下溶于蒸馏水和乙醇体积比为5:1~15:1混合溶剂溶液中,搅拌溶解后加入三乙醇胺调节ph为7.5~8.5,搅拌下滴入正硅酸乙酯与氨丙基三甲氧基硅烷/氨丙基三乙氧基硅烷质量比为4:1~9:1的混合液,最后滴入与混合溶液等体积的蒸馏水后继续搅拌反应制备含有氨基的介孔二氧化硅纳米颗粒。
7.上述步骤(2)中,在含有氨基的介孔二氧化硅纳米颗粒溶液中加入多巴胺盐酸盐,在介孔二氧化硅表面及其孔道内形成聚多巴胺涂层。具体来说,介孔二氧化硅纳米颗粒在ph 为7.1~7.6的多巴胺溶液中反应,形成既覆盖在介孔二氧化硅纳米颗粒表面,又进入介孔二氧化硅孔道形成涂层缩小介孔孔径的聚多巴胺涂层。
8.聚多巴胺涂层的引入为后续改性提供反应位点、提高对药物的封堵效果。
9.上述制备方法得到的介孔二氧化硅纳米载体可应用于载药,可采取以下两种方式载药进行应用:(1)步骤(1)中,在制备表面含有氨基的介孔二氧化硅纳米颗粒时加入需要负载的药物;(2)在步骤(1)与步骤(2)之间增加载药步骤。
10.介孔二氧化硅纳米颗粒制备后,或在药物溶液中吸附载药,均可按需要灵活调整载药量及载药种类,所述药物为亲水药物或疏水药物,如阿霉素。
11.本发明在含有氨基的介孔二氧化硅纳米颗粒表面及介孔内构建聚多巴胺涂层,使用含有侧链端羧基的仿细胞膜两性离子聚合物,与载药介孔二氧化硅纳米颗粒表面氨基的
酰胺化反应进行多点锚定提高长循环性能,并通过含二硫键及两端羧基的分子(如二硫代二丙酸)将不同类型的靶向配体如含叶酸及rgd环肽偶联在介孔二氧化硅纳米药物表面提升对肿瘤细胞的靶向能力。其中不同大小尺寸的靶向配体可以选择性进入或共同进入对应孔径的孔道被偶联锚定,形成严密封堵药物释放孔道的开关型介孔二氧化硅纳米药物。
12.本发明在制备介孔二氧化硅纳米颗粒的过程中加入含有氨基的三甲(乙)氧基硅烷,与四乙(甲)氧基硅烷反应形成掺杂氨基缺陷的介孔二氧化硅纳米颗粒,既可加速其在肿瘤细胞微环境中的降解/溶解,又能促进药物负载及形成聚多巴胺涂层;通过控制多巴胺溶液的ph,实现在含有氨基的介孔二氧化硅纳米颗粒表面及介孔内壁构建聚多巴胺涂层;在多点锚定两性离子聚合物仿细胞膜涂层后裸露的表面及介孔孔道氨基上,用含二硫键的连接剂分子偶联叶酸、环状rgd等不同大小的肿瘤细胞靶向配体,在不同孔径的孔道内构建开关分子实现对载药孔道的封堵作用,也就是二硫键分子连接的孔道封堵开关分子在肿瘤细胞微环境断开后加速降解和药物释放。
13.本发明结合在纳米药物表面的配体发挥肿瘤细胞靶向作用,固定在介孔中的配体分子则起到孔道药物封堵开关的作用,降低药物在血液及正常组织环境中的泄露产生的毒副作用。在肿瘤细胞酸性及高谷胱甘肽浓度微环境中,含二硫键的连接链断裂导致孔道封堵开关分子扩散、介孔二氧化硅纳米颗粒降解/溶解、药物快速释放产生肿瘤细胞毒性。
14.本发明在制备介孔二氧化硅纳米颗粒过程中加入含有氨基的硅烷偶联剂分子,与四乙(甲)氧基硅烷在偏碱性溶液中共缩聚形成含有氨基的介孔二氧化硅纳米颗粒,促进其载药纳米颗粒在肿瘤细胞微环境中的快速降解或溶解。含有氨基的介孔二氧化硅纳米颗粒表面及其介孔内表面氨基,既可促进带负电性药物的负载,又可加速与多巴胺反应形成聚多巴胺涂层,显著缩小介孔孔径,提高孔道封堵效果。为提高介孔二氧化硅纳米载药颗粒的血液循环半衰期及癌细胞靶向效果,将两性离子聚合物多点锚定在聚多巴胺涂层改性的介孔二氧化硅纳米药物表面,然后在剩余及暴露的表面氨基和孔道氨基上接枝含二硫键及两端羧基的分子(hooc
‑
r
‑
ss
‑
r
‑
cooh),最后偶合肿瘤靶向配体发挥靶向作用。耦合在缩小的孔道中不同大小尺寸的靶向配体分子则起到“一夫当关”的孔道封堵开关作用,降低药物泄露率。两种及多种靶向配体的共同/协同靶向作用可提升肿瘤细胞对药物的摄取率。在肿瘤细胞酸性微环境及高浓度谷胱甘肽作用下连接介孔封堵剂的二硫键断裂使封堵的孔道打开,药物释放。另外,酸性微环境中介孔二氧化硅纳米颗粒的快速降解/溶解也会加速药物释放,从而增强对肿瘤细胞的毒性。与此相反,在血液循环及正常组织细胞环境中,被封堵药物的泄漏率降低,加之两性离子聚合物(仿细胞膜)涂层良好的细胞相容性,这种开关型纳米药物的细胞毒性仅为游离阿霉素的千分之一。与常规介孔二氧化硅纳米药物相比,本发明制备的开关型介孔二氧化硅纳米药物,在血液及正常组织细胞环境中药物(以阿霉素为例)96小时泄漏率由改性前的61%降低到8%;正常细胞l929的细胞毒性(ic50值)由游离阿霉素的3.8 μg/ml提升到载药阿霉素的9000 μg/ml,比hela癌细胞ic50值2.3 μg/ml提高了4000倍;对正常细胞l929的细胞毒性比文献报道结果(nanoscale2012, 4, 3365
‑
3372)低一百倍,几乎达到癌症治疗无毒负作用的理想状态。本发明开关型纳米药物载体既可负载亲水药物,又可负载疏水药物,且对正常组织细胞几乎无毒性,但对癌细胞毒性显著增强,适用于相关肿瘤的靶向治疗,大幅度降低毒副作用。
附图说明
15.图1为空白msn及pda改性msn(msn/pda)的透射电镜照片(a, b)和bjh 孔径分布曲线(c) ;图2为游离dox和负载dox的开关型msn纳米药物与细胞共培养48 小时后的细胞毒性ic
50
曲线图. (a) 游离dox,(b) 开关型msn纳米药物(dox
.
msn/pda/pmpcc/fa
‑
crgd);图3为开关型msn纳米药物(msn/pda/pmpcc/fa
‑
crgd)与msn及msn/pda纳米药物在不同ph介质中于37
°
c 96小时累积释药率对比图。
具体实施方式
16.以下具体实施方式是对本发明进行进一步说明,应理解这些实施例仅限于具体说明而不是作为本发明范围的限制。
17.实施例1聚多巴胺改性介孔二氧化硅纳米颗粒(msn/pda)的制备在250 ml三口瓶中加入1.80 g ctac (十六烷基三甲基氯化铵),45 ml 水和6.0 ml无水乙醇,并在50℃油浴条件下,快速磁力搅拌使ctac充分溶解;将0.9 g 三乙醇胺溶于5 ml 水,快速加入上述三口烧瓶中,并保持50℃和1200 rpm搅拌。将10.9 ml 正硅酸乙酯与1.2 ml 氨丙基三乙氧基硅烷混合后缓慢滴加入三口烧瓶中;然后滴加70 ml 水继续保持50℃和高速搅拌条件下反应2 h得到含有氨基的介孔二氧化硅纳米颗粒。经洗济及离心分离5次后得到除去表面活性剂的含有氨基的介孔二氧化硅纳米颗粒(msn)。
18.在含有表面活性剂的介孔二氧化硅纳米颗粒溶液中加入500 mg 多巴胺盐酸盐,并调节ph到7.2~7.5,室温反应6小时后离心超滤5次除去未结合的多巴胺、聚多巴胺及表面活性剂,沉淀分散在定量的水中得到聚多巴胺改性的含有氨基的可降解介孔二氧化硅纳米颗粒(msn/pda)。
19.分别将含有氨基的介孔二氧化硅纳米颗粒(msn)及聚多巴胺改性的含有氨基的可降解介孔二氧化硅纳米颗粒(msn/pda)水分散液冷冻干燥后,用bet氮气吸附法测定介孔二氧化硅纳米颗粒样品的孔径分布曲线如图1所示。聚多巴胺改性后介孔二氧化硅纳米颗粒的孔径由5.1纳米显著降低到3.0纳米。
20.实施例2聚多巴胺改性载阿霉素介孔二氧化硅纳米颗粒(dox
.
msn/dpa)的制备将实施例1中制备的含有氨基的介孔二氧化硅纳米颗粒(msn)与阿霉素(dox)溶液混合配制成含msn 2.0 mg/ml,dox 0.6 mg/ml,ph 5.0的水溶液100 ml。在400 rpm搅拌下缓慢调节ph到7.0,室温继续搅拌12小时。加入100 mg 多巴胺盐酸盐溶解后调节ph至7.3左右,室温反应6小时后离心超滤5次除去未结合的多巴胺、聚多巴胺及阿霉素,沉淀分散在定量的水中得到聚多巴胺改性的载dox的可降解介孔二氧化硅纳米药物(dox
.
msn/dpa)。
21.实施例3聚多巴胺改性直接载阿霉素介孔二氧化硅纳米颗粒(dox
.
msn/dpa)的制备在250 ml三口瓶中加入1.8 g 十六烷基三甲基氯化铵,45 ml 水和5 ml无水乙醇,在50℃油浴条件下快速搅拌溶解;将0.9 g 三乙醇胺溶于5 ml 水加入上述三口烧瓶中,并保持50℃和1200 rpm搅拌。将9.8 ml 正硅酸乙酯与2.0 ml 氨丙基三乙氧基硅烷混
合液与0.6 g阿霉素盐酸盐水溶液(20 ml)同时缓慢滴加到三口烧瓶中;然后滴加60 ml 水继续保持50℃和高速搅拌条件下反应2 h得到载药的介孔二氧化硅纳米颗粒溶液。加入500 mg 多巴胺盐酸盐,并调节ph至7.3左右,室温反应6小时后离心超滤5次除去未结合的多巴胺、聚多巴胺、阿霉素(dox)及表面活性剂,沉淀分散在定量的水中得到聚多巴胺改性的载dox的可降解介孔二氧化硅纳米药物(dox
.
msn/dpa)。
22.实施例4开关型介孔二氧化硅纳米药物制备取实施例2聚多巴胺改性后的载药介孔二氧化硅纳米颗粒50 ml(2 mg/ml),加入200 mg 两性离子聚合物pmpcc
‑
9:1,20 mg n
‑
羟基琥珀酰亚胺(nhs),30 mg 1
‑
乙基
‑
(3
‑
二甲基氨基丙基)碳酰二亚胺盐酸盐(edc
·
hcl),将ph调至7于50℃,400 rpm搅拌下反应12小时得到两性离子聚合物改性的载药介孔二氧化硅纳米颗粒(dox
.
msn/dpa/pmpcc
‑
9:1)。然后加入nhs和edc活化后的二硫代二丙酸使其浓度为0.40 mg/ml,于50℃、ph 7溶液中搅拌反应6小时。 12000 rpm离心弃去上清液后将沉淀分散于50ml蒸馏水中。向上述溶液中加入50 mg 氨基化的叶酸(fa
‑
nh2),50℃磁力搅拌反应6小时后,再加入40 mg环状rgd肽(crgd)配体继续反应2小时。12000 rpm离心弃去上清液并将沉淀再分散于定量的蒸馏水中得到开关型介孔二氧化硅纳米药物(dox
.
msn/dpa/pmpcc
‑
9:1/fa
‑
crgd)。
23.实施例5hela及l929细胞毒性测定:hela及l929细胞分别在dmem和mem培养液中于37℃培养箱12小时,吸出培养液,加入200
ꢀµ
l 含设定浓度的载药msn载体的培养液,培养48小时后吸出培养液并用pbs缓冲液洗济两次,用mtt法测定细胞存活率。用等量的游离药物做阳性对照样品,测定结果如图2和图3所示。本发明实施例4制备的开关型介孔二氧化硅纳米药物,在血液及正常组织细胞环境中药物(以阿霉素为例)96小时泄漏率由改性前的61%降低到8%;正常细胞l929的细胞毒性(ic
50
值)由游离阿霉素的3.8 μg/ml 提升到9000 μg/ml,比hela癌细胞ic
50
值2.3 μg/ml提高了4000倍,几乎达到癌症治疗无毒负作用的理想状态。
24.对比例1参照cn108434460a(一种靶向性介孔二氧化硅纳米药物及其制备方法)制备fa和crgd靶向配体修饰的介孔二氧化硅纳米药物,与开关型介孔二氧化硅纳米药物泄漏率进行对比。
25.(1) 在100 ml三口瓶中加入0.75 g十六烷基三甲基氯化铵,0.3 g阿霉素盐酸盐(dox
•
hcl),18 ml h2o和2.4 ml无水乙醇,在50℃油浴下快速磁力搅拌使十六烷基三甲基氯化铵充分溶解;将0.315 g三乙醇胺溶于2 ml h2o中加入上述三口烧瓶中,在50℃和1200 rpm搅拌下,将4.38 ml正硅酸乙酯用恒压滴液漏斗滴加入三口烧瓶中;然后将50 ml h2o加入滴液漏斗中,继续保持温度和转速条件下反应2 h,得到载阿霉素介孔二氧化硅纳米颗粒;(2) 向上述溶液中加入200 mg多巴胺盐酸盐,调节ph至8.5,室温反应30min后得到聚多巴胺包裹的载阿霉素介孔二氧化硅纳米颗粒msn/pda;(3) 取2 mg/ml聚多巴胺包裹的载阿霉素介孔二氧化硅纳米颗粒溶液50 ml,加入20 mg分子量2000的羧基封端聚乙二醇、6 mg n
‑
羟基琥珀酰亚胺、9 mg 1
‑
乙基
‑
(3
‑
二甲基氨基丙基)碳酰二亚胺盐酸盐,35℃搅拌反应30 min后加入250 mg含活性酯基团的两性离
子聚合物pmen,将ph调至7,35℃搅拌反应12小时后,12000 rpm离心弃去上清液,将离心后的沉淀再分散于蒸馏水中,得到pmen修饰的msn/pda,即msn/pda/pmen;(4)向步骤(3)得到的溶液中加入6 mg n
‑
羟基琥珀酰亚胺、9 mg 1
‑
乙基
‑
(3
‑
二甲基氨基丙基)碳酰二亚胺盐酸盐和50 mg氨基化的叶酸(fa
‑
nh2),35℃磁力搅拌反应6小时后,再加入40 mg环状rgd肽(crgd)配体继续反应2小时。 12000 rpm离心弃去上清液并将沉淀再分散于定量的蒸馏水中得到本发明开关型介孔二氧化硅纳米药物的对比介孔二氧化硅纳米药物(msn/pda/pmen/fa
‑
crgd)。
26.在模拟血液环境(ph 7.4,37.0
°
c pbs溶液)中震荡48小时的药物释放实验结果显示,该对比药物(msn/pda/pmen/fa
‑
crgd)的dox释放(泄露)率为23.4%,比本发明的开关型介孔二氧化硅纳米药物(msn/pda/pmpcc/fa
‑
crgd)dox的泄露率(4.0%)高5.8倍。该对比结果证明,本发明的开关型介孔二氧化硅纳米药物对正常血液环境中阻止药物泄露的有良好效果,是常规聚多巴胺涂层介导构建的靶向性介孔二氧化硅纳米药物无法实现的。主要原因是对比的常规靶向纳米药物使用分子较长较大的peg链连接靶向基团,因介孔孔道中对较大分子的空间位阻较大使其难以进入,即使少数peg进入并锚定了靶向配体分子,因peg链较长锚定的靶向配体分子因远离孔道而难以起到对孔道的封堵作用。还有,对比的常规靶向纳米药物使用ph 8.5的多巴胺溶液以最快速度构建聚多巴胺涂层,容易产生聚多巴胺聚集颗粒等较大尺寸物体,因而较难进入到介孔内形成聚多巴胺涂层。而本发明采用ph 7.3左右以缓慢速度构建聚多巴胺涂层,使多巴胺小分子有充足时间扩散到介孔内,在孔道壁缓慢形成聚多巴胺涂层。然后利用小分子连接靶向基团,将其固定在孔道内发挥对载药孔道的封堵作用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。