一株可缓解溃疡性结肠炎的菌株phocaeicola sp.及其应用
技术领域
1.本发明涉及一株可缓解溃疡性结肠炎的菌株phocaeicola sp.及其应用,属于微生物技术领域。
背景技术:
2.溃疡性结肠炎(uc)是一种典型的慢性复发性特发性肠道炎症,可引发结肠黏膜炎症、直肠出血和腹泻等。溃疡性结肠炎往往伴随着肠上皮屏障功能紊乱,其主要表现形式是肠道通透性增加。研究发现,与正常组织相比,溃疡性结肠炎的肠组织中紧密连接结构和功能发生改变,肠黏膜通透性增加。鉴于溃疡性结肠炎的巨大危害,寻找能够缓解溃疡性结肠炎严重程度的方法引起了人们的广泛关注。过去对于缓解溃疡性结肠炎的方法主要是药物治疗。然而,一些研究表明长期使用传统美沙拉嗪(5
‑
氨基水杨酸、氢化可的松、布尼尼德)等药物可能会引起一定的副作用,如诱导糖尿病、高血压或骨质疏松症,从而影响治疗的成功率。随着研究的进展,取代传统药物治疗溃疡性结肠炎的替代治疗策略逐步被人们发掘,如益生菌。
3.拟杆菌是下一代益生菌的候选细菌之一,由于其对人类健康的潜在益处,已受到一定的关注。已有研究表明,某些拟杆菌可以调节机体代谢,抑制病原菌定居,减轻肠道炎症等。phocaeicola是由拟杆菌属在2009年划分为拟杆菌门(bacteroidetes)的一个新属。与拟杆菌门(bacteroidetes,alistipes,parabacteroides,prevotella)的其他属相似。一些种类的phocaeicola已被证实与炎症疾病有密切的关系。例如,最初被归类为拟杆菌种的phocaeicola vulgatus菌株,已经显示出它们在缓解炎症疾病方面的潜在作用,如大肠杆菌mpk引发的结肠炎和小肠结肠炎耶尔森菌诱导的宿主上皮细胞(ec)中nf
‑
kappab激活和白细胞介素(il)
‑
8的产生。除了这种被广泛研究的物种phocaeicola vulgatus,许多微生物组分析发现,phocaeicola的一些物种与疾病的发生发展具有紧密的关联。
4.肠道微生物的代谢产物是与宿主生理病理过程相关的重要因素之一,例如短链脂肪酸。短链脂肪酸是肠道菌群发酵多糖等产生的代谢产物,主要包括乙酸、丙酸、丁酸和戊酸等。短链脂肪酸在宿主炎症调节中起到重要的作用,短链脂肪酸是结肠细胞的能量来源,同时其在肠腔积累而引起的肠道环境ph的降低能抑制致病菌的生长粘附。此外,短链脂肪酸可以通过调节肠道免疫和肠道屏障功能来维持肠道的稳态。例如,有报道称乙酸盐可以通过上皮细胞介导的肠道防御作用来保护宿主免受致命感染。丁酸可以通过抑制肿瘤细胞增殖、诱导细胞凋亡从而诱导更分化的表型来降低结直肠癌(crc)的发生风险。此外,一些研究进一步强化了其在抑制炎症中的重要作用。肠道内短链脂肪酸的浓度被认为是评估不同菌株缓解疾病的主要指标。
5.找到一种对于溃疡性结肠炎具有良好的治疗作用且高产短链脂肪酸的菌株的益生菌菌株,用来取代传统药物治疗溃疡性结肠炎成为研究的热点。
技术实现要素:
6.为了找到一种对于溃疡性结肠炎具有良好的治疗作用且高产短链脂肪酸的菌株的益生菌菌株,本发明提供了一株菌株(phocaeicola sp.),所述菌株保藏于广东省微生物菌种保藏中心,保藏日期为:2021年07月08日,保藏编号为gdmcc no:61790。
7.所述菌株(phocaeicola sp.)是从来源于健康成年人粪便样本中分离得到的,该菌株经测序分析,将测序得到的序列在genbank中进行核酸序列比对,结果显示该菌株为phocaeicola属,将其命名为(phocaeicola sp.)ccfm1183。
8.本发明还提供了含有菌株(phocaeicola sp.)ccfm1183的微生物制剂。
9.在本发明的一种实施方式中,所述微生物制剂的剂型为液态、粉末或者颗粒状。
10.在本发明的一种实施方式中,上述微生物制剂中,所述菌株(phocaeicola sp.)ccfm1183的活菌数不低于1
×
106cfu/ml或1
×
106cfu/g。
11.本发明还提供了一种产品,所述产品中含有上述菌株(phocaeicola sp.)ccfm1183,或上述微生物制剂。
12.在本发明的一种实施方式中,所述产品中,所述菌株(phocaeicola sp.)ccfm1183的活菌数不低于1
×
106cfu/ml或1
×
106cfu/g。
13.在本发明的一种实施方式中,所述产品包括食品、药品或保健品。
14.在本发明的一种实施方式中,所述食品包括发酵果蔬、发酵乳、乳酪、含乳饮料、乳粉,或其他含有上述菌株(phocaeicola sp.)ccfm1183的食品。
15.在本发明的一种实施方式中,所述药品含有上述菌株(phocaeicola sp.)ccfm1183、药物载体和/或药用辅料。
16.本发明的一种实施方式中,所述药品中,上述菌株(phocaeicola sp.)ccfm1183的活菌数为不低于1
×
106cfu/ml或1
×
106cfu/g。
17.在本发明的一种实施方式中,所述药物载体包含微囊、微球、纳米粒和/或脂质体。
18.本发明的一种实施方式中,所述药用辅料包含赋形剂和/或附加剂。
19.本发明的一种实施方式中,所述赋形剂包含溶剂、抛射剂、增溶剂、助溶剂、乳化剂、着色剂、吸收剂、稀释剂、絮凝剂、反絮凝剂、助滤剂和/或释放阻滞剂。
20.本发明的一种实施方式中,所述附加剂包含微晶纤维素、羟丙基甲基纤维素和/或精制卵磷脂。
21.本发明的一种实施方式中,所述药品的剂型为粉剂、颗粒剂、胶囊剂、片剂、丸剂或口服液。
22.本发明还提供上述菌株(phocaeicola sp.)ccfm1183,或上述微生物制剂在制备改善肠道健康的产品,或在制备益生菌产品中的应用。
23.本发明的一种实施方式中,所述产品为食品或化学品。
24.本发明提供了上述菌株(phocaeicola sp.)ccfm1183,或上述微生物制剂在制备促进肠道中短链脂肪酸的产生的产品中的应用。
25.在本发明的一种实施方式中,所述产品中,所述菌株(phocaeicola sp.)ccfm1183的活菌数不低于1
×
106cfu/ml或1
×
106cfu/g。
26.在本发明的一种实施方式中,所述短链脂肪酸包括:乙酸、丙酸、丁酸、戊酸、异丁酸、异戊酸中的一种或多种。
27.在本发明的一种实施方式中,所述微生物制剂中,所述菌株(phocaeicola sp.)ccfm1183的活菌数不低于1
×
106cfu/ml或1
×
106cfu/g。
28.在本发明的一种实施方式中,所述微生物制剂的剂型包括液体、固体或颗粒型。
29.在本发明的一种实施方式中,所述产品包括食品、药品或保健品。
30.在本发明的一种实施方式中,所述食品包括发酵果蔬、发酵乳、乳酪、含乳饮料、乳粉,或其他含有上述菌株(phocaeicola sp.)ccfm1183的食品。
31.在本发明的一种实施方式中,所述药品含有上述菌株(phocaeicola sp.)ccfm1183、药物载体和/或药用辅料。
32.在本发明的一种实施方式中,所述药物载体包含微囊、微球、纳米粒和/或脂质体。
33.在本发明的一种实施方式中,所述药用辅料包含赋形剂和/或附加剂。
34.本发明的一种实施方式中,所述赋形剂包含溶剂、抛射剂、增溶剂、助溶剂、乳化剂、着色剂、吸收剂、稀释剂、絮凝剂、反絮凝剂、助滤剂和/或释放阻滞剂。
35.本发明的一种实施方式中,所述附加剂包含微晶纤维素、羟丙基甲基纤维素和/或精制卵磷脂。
36.本发明的一种实施方式中,所述药品的剂型为粉剂、颗粒剂、胶囊剂、片剂、丸剂或口服液。
37.有益效果
38.(1)本发明的菌株(phocaeicola sp.)ccfm1183显著将因葡聚糖硫酸钠(dss)感染而造成的小鼠体重下降、结肠长度变短、结肠组织病理损伤恢复至接近正常小鼠水平。因此,本发明所述具有缓解溃疡性结肠炎的菌株ccfm1183在食品和微生态制剂方向具有广泛的应用前景;与dss组相比,菌株(phocaeicola sp.)ccfm1183显著增加了小鼠体重,其体重降低比例为dss组的76.64%;菌株(phocaeicola sp.)ccfm1183组小鼠的结肠长度明显提高,提高了1.19倍;ccfm1183能显著下调tnf
‑
α(下调了26%)和il
‑
1β(下调了16%)两种促炎因子。
39.(2)本发明所提供的菌株(phocaeicola sp.)ccfm1183可用于制备能够缓解脂多糖感染的药物组合物,具有广泛的应用前景。
40.(3)本发明所提供的菌株(phocaeicola sp.)ccfm1183显著促进炎症小鼠肠道中短链脂肪酸的产生;相对于模型组,小鼠盲肠内容物中乙酸的含量提高了39%,小鼠盲肠内容物中丁酸的含量提高了41%;并且该菌株ccfm1183对异丁酸、戊酸和异戊酸都有不同程度的提高。由于短链脂肪酸已经被广泛证明在缓解炎症方面具有巨大的作用。
41.(4)本发明提供的菌株(phocaeicola sp.)ccfm1183可以有效提高肠道粘膜的屏障功能,增加紧密连接蛋白的表达,修复结肠黏膜损伤;ccfm1183组小鼠的肠道紧密连接蛋白zo
‑
1,occludin,claudin
‑
1表达水平显著提升;相对于造模组,分别提高了82%,56%,30%,明显高于造模组。
42.因此,本发明所述菌株(phocaeicola sp.)ccfm1183在制备缓解炎症性疾病的食品和微生态制剂方向具有广泛的应用前景。
43.生物材料保藏
44.一株菌株(phocaeicola sp.)ccfm1183,分类学命名为phocaeicola sp.,已于2021年07月08日保藏于广东省微生物菌种保藏中心,保藏编号为gdmcc no:61790,保藏地
址为广州市先烈中路100号大院59号楼5楼,广东省微生物研究所。
附图说明
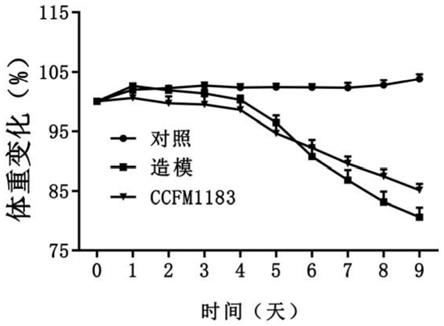
45.图1:菌株(phocaeicola sp.)ccfm1183对结肠炎小鼠体重的影响(与dss组对比,***表示p<0.001,**表示p<0.01,*表示p<0.05)。
46.图2:菌株(phocaeicola sp.)ccfm1183对结肠炎小鼠结肠长度的影响(与dss组对比,***表示p<0.001,**表示p<0.01,*表示p<0.05)。
47.图3:小鼠结肠组织形态学观察及组织评分(与dss组对比,***表示p<0.001,**表示p<0.01,*表示p<0.05)。
48.图4:菌株(phocaeicola sp.)ccfm1183对小鼠粪便中短链脂肪酸含量的影响。
具体实施方式
49.为了使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明的优选实施例进行详细的描述。
50.下述实施例中所涉及的c57bl/6j小鼠购自维通利华实验动物技术有限公司(浙江,中国)。
51.下述实施例中涉及的培养基如下:
52.拟杆菌特异性筛选培养基:43.1g布氏培养基粉末均匀溶于1l水后,加入0.01
‰
的氯化血红素及0.01
‰
的维生素k1,121℃灭菌15min。待降温至50℃时,加0.1
‰
的卡那霉素、0.0075
‰
的万古霉素及5%的绵羊血后,混匀倒入无菌的培养皿中。
53.bhis液体培养基:脑心浸液中加入半胱氨酸盐酸盐1g/l、氯化血红素0.01g/l、维生素k1 0.002g/l,ph为7.0。
54.bhis固体培养基:脑心浸液中加入半胱氨酸盐酸盐1g/l、氯化血红素0.01g/l、维生素k1 0.002g/l、琼脂20g/l,ph为7.0。
55.下述实施例中涉及的菌株(phocaeicola sp.)ccfm1183菌悬液的制备方法如下:
56.将菌株(phocaeicola sp.)ccfm1183划线于bhis固体培养基上,37℃条件下培养48h,得到单菌落;挑取单菌落接种于bhis液体培养基中,37℃条件下培养18h进行活化,连续活化两代,得到活化液;将活化液按2%(v/v)的接种量接种于bhis液体培养基中,37℃条件下培养18h,得到菌液;将菌液经8000g离心10min,得到菌株(phocaeicola sp.)ccfm1183菌体;将菌株(phocaeicola sp.)ccfm1183菌体经生理盐水洗涤后重悬于浓度为200g/l的甘油溶液(含1g/l半胱氨酸盐酸盐)中至菌终浓度为1
×
10
10
cfu/ml,得到菌悬液,将菌悬液于
‑
80℃下保存待用。
57.下述实施例中所涉及的检测方法如下:
58.疾病活动指数(disease activity index,dai)的检测方法:
59.疾病活动指数结合患病动物的体重下降百分率(体重不变为0,1
‑
5为1分,5
‑
10为2分,10
‑
15为3分,大于15为4分)、大便黏稠度(正常为0,松散的大便为2分,腹泻为4分)和大便出血(正常0分,隐血阳性为2分,显性出血为4分)三种情况进行综合评分,将3项结果的总分除以3即得到dai值。即dai=(体重指数 大便形状 出血情况)/3。
60.结肠长度的检测方法:
61.造模成功后,将小鼠进行处死后解剖,取小鼠结肠组织,用直尺对每只小鼠结肠全长进行测定(单位:厘米)。
62.结肠组织病理学特征的检测方法及组织损伤评分标准:
63.结肠组织病理学特征的检测方法及组织损伤评分标准参见论文:synbiotic supplementation with prebiotic green banana resistant starch and probiotic bacillus coagulans spores ameliorates gut inflammation in mouse model of inflammatory bowel diseases。
64.结肠组织生化指标的测定:
65.取小鼠结肠组织,称重后冰浴下加入9倍体积的无菌生理盐水后匀浆,4℃下15000
×
g离心15min取上清,所得的蛋白样品按照bca试剂盒(碧云天生物技术有限公司)说明书测定蛋白浓度。细胞因子的检测全部使用r&d试剂盒。
66.短链脂肪酸的检测方法如下:
67.具体如下:称取20mg结肠中粪便样品,重悬于500μl饱和氯化钠溶液,加入20μl10%的硫酸溶液酸化,加入800μl乙醚,充分振荡混合均匀。18000g离心15min后,取上层乙醚相,提取脂肪酸,加入0.25g无水硫酸钠进行干燥。室温静置30min后,18000g离心5min,取上层乙醚相,采用gc
‑
ms分析乙酸、丙酸、异丁酸、丁酸、异戊酸及戊酸等短链脂肪酸的含量。gc
‑
ms采用rtx
‑
wax柱,柱长30m,内径0.25μm;载气为氦气,流速2ml/min;进样体积1μl,分流比为10:1;进样温度为240℃,升温程序为:起始温度100℃,以7.5℃/min升温至140℃,再以60℃/min升温至200℃,保持3min,离子化温度为220℃;分析方法为全扫描模式,并采用外标法计算样品中相应短链脂肪酸的浓度。
68.实施例1:菌株(phocaeicola sp.)ccfm1183的分离筛选
69.1、样品采集
70.采集新疆自治区伊宁县人群粪便样本,样本置于装有30%甘油的大便管中,保存于装有冰袋的保温盒中,带回实验室后迅速置于
‑
80℃冰箱待分离筛选。
71.2、菌株的分离纯化
72.(1)稀释涂布:取0.5g左右的保存于30%甘油的内容物在无菌环境下加入装有4.5ml生理盐水的10ml离心管中,得到10
‑1稀释液,重复上述稀释步骤,依次得到10
‑2、10
‑3、10
‑4、10
‑5、10
‑6稀释液;
73.(2)涂布培养:分别吸取100μl上述10
‑4、10
‑5、10
‑6三个梯度稀释液于拟杆菌特异性筛选培养基上,用涂布棒涂布均匀,至37℃厌氧条件下培养48h,得到稀释涂布平板;
74.(3)一级纯化培养:取菌落数在30~300区间的稀释涂布平板,每个样本随机挑选10个乳白色或白色,表面光滑,边缘整齐,大小不一的单菌落在bhis固体培养基上划线,放至37℃厌氧条件下培养48h,得到单菌落;
75.(4)二级纯化培养:取步骤(3)划线平板上单菌落接种于bhis液体培养基中,至37℃厌氧条件下培养20h,得到二级纯化培养液。
76.3、菌种保藏与鉴定
77.(1)菌种保藏:
78.将上述二级纯化培养液混匀,取菌体(培养16
‑
20h)至2ml干净的菌种保藏管,平行5份,其中4份加入750μl菌液和750μl 60%甘油重悬,静止30分钟后放入
‑
80℃冰箱;1份加
入1ml菌液用于菌种鉴定,6000r/min离心3min,弃上清得菌体。
79.(2)菌种鉴定:
80.步骤(1)用于菌种鉴定的保藏管中加入1ml无菌水吹打洗菌体后,10000r/min离心1min,弃上清得菌体,加入500μl无菌水重悬,作为菌液模板;其中,16s rdna pcr的体系和引物分别见表1和表2;16s rdna pcr的条件:第一步:94℃,5min第二步:94℃,30s第三步:55℃,30s,第四步:72℃,2min,第五步:72℃,10min,第二到四步进行30个循环,27f(5
’‑
agagtttgatcctggcctca
‑3’
)0.25μl,1492r(ggttaccttgttacgactt)0.25μl,taq酶mix 12.5μl,模板1μl,双蒸水11μl,μl,μl,pcr产物经核酸电泳分析确认后,送华大基因测序;将测序返回序列正在ncbi进行种属确认;通过在ncbi数据库中比对,结果发现菌株ccfm1183归属于phocaeicola属,将其命名为菌株(phocaeicola sp.)ccfm1183。
81.实施例2:菌株(phocaeicola sp.)ccfm1183对dss诱导的溃疡性结肠炎的作用
82.具体步骤如下:
83.1、菌株的选择与制备:
84.将菌株(phocaeicola sp.)ccfm1183划线于bhis固体培养基上,37℃条件下培养48h,分别得到单菌落;分别挑取单菌落接种于bhis液体培养基中,37℃条件下培养18h进行活化,连续活化两代,分别得到活化液;
85.将得到的活化液以2%(v/v)的接种量接入bhis液体培养基中,37℃厌氧培养18h后,得到菌液;将菌液经6000r/min离心5min,分别得到菌株(phocaeicola sp.)ccfm1183菌体,将菌株(phocaeicola sp.)ccfm1183菌体用无菌pbs缓冲液清洗菌体后收集菌泥,并重悬于含有30%甘油的pbs缓冲液中,于
‑
80℃条件下保存,待用;制备得到ccfm1183菌悬液。
86.2、动物实验设计:
87.将30只7周龄的雄性c57bl/6j小鼠按平均体重分为10只/组,共3组,如表1所示,分别为空白组(control)、模型组(dss)和菌株(phocaeicola sp.)ccfm1183组(简称为ccfm1183组)。
88.小鼠经适应性喂养一周后,ccfm1183组预先连续灌胃步骤1制备得到的菌悬液7天,同时空白组和模型组灌胃无菌pbs缓冲液。从第8天开始,模型组和ccfm1183组、空白组的处理方法如表1所示。
89.其中,3%dss的水溶液的配制方法为:称取30g dss固体粉末溶于1000ml无菌水中,轻轻摇晃至完全溶解。
90.模型组:第8~14天,连续灌胃200μl无菌pbs缓冲液7天,第15~23天,每天灌胃无菌200μl pbs溶液,自由饮用含3%dss的水溶液。
91.ccfm1183组:第8~14天,连续灌胃200μl ccfm1183菌悬液7天,第15~23天,每天灌胃200μl ccfm1183菌悬液,自由饮用含3%dss的水溶液。
92.空白组:第8~14天,连续灌胃200μl无菌pbs缓冲液7天,第15~23天,每天灌胃无菌200μl pbs溶液,自由饮用纯水。
93.结肠炎造模期间,每日定时称量小鼠体重,计算小鼠体重变化的百分比。第24天处死小鼠,取样用于后续实验。
94.表1动物实验设计
[0095][0096]
注:无菌pbs和菌悬液每日灌胃剂量为200μl,菌悬液的活菌数为5
×
109cfu/ml。
[0097]
实施例3:菌株(phocaeicola sp.)ccfm1183对dss诱导的溃疡性结肠炎的小鼠体重和结肠长度变化
[0098]
dss诱导小鼠结肠炎会导致小鼠体重下降和结肠缩短,因此,体重和结肠长度是评价结肠炎小鼠炎症严重程度的重要指标。造模成功后,将小鼠进行处死后解剖,取小鼠结肠组织,用直尺对每只小鼠结肠全长进行测定。
[0099]
体重变化如图1和表2所示,与正常组比较,dss组小鼠体重显著下降,说明溃疡性结肠炎模型构造成功;与dss组相比,菌株(phocaeicola sp.)ccfm1183显著增加了小鼠体重,其体重降低比例为dss组的76.64%。
[0100]
表2不同组别培养不同时间的体重变化
[0101][0102][0103]
结肠长度变化如图2及表3所示,正常组小鼠的结肠长度最长,其他组小鼠的结肠长度都有不同程度的下降;与dss组相比,菌株(phocaeicola sp.)ccfm1183组小鼠的结肠长度明显提高,提高了1.19倍。
[0104]
表3造模成功后不同组别小鼠结肠长度
[0105][0106]
实施例4:菌株(phocaeicola sp.)ccfm1183对dss诱导的溃疡性结肠炎的小鼠结肠组织切片观察及其损伤评分
[0107]
取约1cm的小鼠远端结肠置于4%多聚甲醛溶液中固定12h,再通过洗涤、乙醇溶液梯度脱水、透明、浸蜡、包埋和切片等步骤制备切片,使用苏木精
‑
伊红染色液对切片进行h&e染色,接着使用pannoramic midi数字切片扫描仪对h&e染色切片进行扫描、观察和拍照,最后根据扫描照片从上皮糜烂、隐窝畸变(溃疡)、杯状细胞消耗、粘膜水肿和炎性浸润五个方面对结肠进行组织损伤评分,该评分委托武汉赛维尔生物科技有限公司完成。小鼠结肠组织病理切片如图3所示,小鼠结肠组织损伤评分如表4所示。
[0108]
表4是小鼠结肠组织损伤评分
[0109][0110]
从h&e染色结果可以看出,空白组小鼠的结肠组织各层结构清晰,粘膜上皮完整,无明显上皮细胞变性、坏死和脱落,固有层腺体数量丰富,排列整齐,无明显炎性细胞浸润,而dss引起模型组小鼠的结肠组织出现粘膜溃疡,粘膜上皮和腺体结构缺失,结缔组织增生,隐窝变长,杯状细胞大量减少,粘膜下层和固有层水肿以及大量的淋巴细胞和中性粒细胞浸润,这表明dss造成了小鼠结肠组织的严重损伤,从而造成其结肠组织病理评分明显升高。与模型组小鼠相比,ccfm1183明显增加了结肠隐窝结构完整性,减少杯状细胞消耗。因此,ccfm1183菌株显著降低了结肠组织病理评分。综上,dss对小鼠结肠组织造成了严重的损伤,ccfm1183对结肠组织具有一定的保护作用。
[0111]
实施例5:菌株(phocaeicola sp.)ccfm1183对dss诱导的溃疡性结肠炎的小鼠结肠组织细胞因子水平检测
[0112]
分别对实施例4制备得到的小鼠结肠组织进行细胞因子水平进行检测,结果如表5所示:
[0113]
与空白组相比,模型组小鼠结肠的促炎因子tnf
‑
α、il6和il
‑
1β水平显著升高,il
‑
17a含量也上升(无显著差异),而抑炎因子il
‑
10水平明显降低,这表明dss引起了小鼠严重的肠道炎症反应。
[0114]
与模型组小鼠相比,ccfm1183能显著下调tnf
‑
α(下调了26%)和il
‑
1β(下调了16%)两种促炎因子,但对il6、il
‑
17a和il
‑
10没有显著调节作用。以上结果表明,ccfm1183调节结肠炎小鼠的免疫反应失调,从而降低肠道炎症损伤。
[0115]
表5不同组别小鼠结肠组织细胞因子水平
[0116]
细胞因子(平均值)空白造模ccfm1183il
‑
10654.49320.86384.88il
‑
643.8698.6698.18tnf
‑
α48.7688.9365.42il
‑
1β341.76550.48464.00il
‑
17a73.3282.3372.07
[0117]
实施例6:菌株(phocaeicola sp.)ccfm1183对dss诱导的溃疡性结肠炎的小鼠盲肠内容物中短链脂肪酸含量
[0118]
取结肠内容物,称重,干燥,检测短链脂肪酸的含量,结果如表6所示:
[0119]
表6不同组别小鼠的盲肠内容物中的短链脂肪酸的含量
[0120][0121]
如图4所示,空白组小鼠盲肠内容物中乙酸,丙酸和丁酸的含量显著高于模型组小鼠,虽然戊酸、异丁酸和异戊酸的含量也存在变化,但无统计学显著意义。
[0122]
由图中可知,ccfm1183明显增加了小鼠盲肠内容物中乙酸和丁酸的含量。其中,相对于模型组,小鼠盲肠内容物中乙酸的含量提高了39%,小鼠盲肠内容物中丁酸的含量提高了41%;并且该菌株ccfm1183对异丁酸、戊酸和异戊酸都有不同程度的提高。
[0123]
实施例7:菌株(phocaeicola sp.)ccfm1183对dss诱导的溃疡性结肠炎的结肠紧密连接蛋白的mrna表达的影响
[0124]
分别对实施例4制备得到的小鼠结肠组织的结肠紧密连接蛋白表达水平进行检测。
[0125]
结果如表7所示,dss组小鼠的肠道紧密连接蛋白表达水平显著下降,说明dss造成小鼠肠道屏障的破坏;与dss组相比,ccfm1183组小鼠的肠道紧密连接蛋白zo
‑
1,occludin,claudin
‑
1表达水平显著提升;相对于造模组,分别提高了82%,56%,30%,明显高于造模组,这说明,在紧密连接蛋白调节方面,拟杆菌ccfm1183较造模组具有明显的优势。综上所述,拟杆菌ccfm1183可以显著提高结肠炎小鼠结肠紧密连接蛋白zo
‑
1,occludin的水平从而保护肠粘膜屏障。
[0126]
表7:不同组别紧密连接蛋白mrna表达量
[0127][0128]
以上结果为ccfm1183辅助宿主抵抗结肠炎的能力提供了进一步的证据。
[0129]
实施例8:菌株(phocaeicola sp.)ccfm1183的应用
[0130]
菌株(phocaeicola sp.)ccfm1183可用于制备牛乳,牛乳的具体制备过程如下:
[0131]
(1)将实施例1获得的菌株(phocaeicola sp.)ccfm1183的二级纯化培养液以3%
(v/v)的接种量接种到培养基中,在温度37℃下培养18h,得到菌液;将菌液离心,得到菌泥;将菌泥用ph 7.2的磷酸盐缓冲液清洗3次后用保护剂重悬至浓度为1
×
10
10
cfu/ml,得到悬浮液;将悬浮液在温度37℃下预培养60min后冻干,得到菌剂;
[0132]
其中,培养基的制备方法为:脑心浸液中加入半胱氨酸盐酸盐1g/l、氯化血红素0.01g/l和维生素k1 0.00 2g/l,ph为7.0;
[0133]
保护剂的成分包含:100g/l脱脂奶粉、30ml/l甘油、100g/l麦芽糊精、150g/l海藻糖和10g/l l
‑
谷氨酸钠;
[0134]
(2)将脱脂奶在95℃热杀菌20min后冷却至4℃,得到原料;在原料中添加步骤(1)制得的菌剂至浓度为不低于1
×
106cfu/ml,得到牛乳(牛乳需在4℃下冷藏保存)。
[0135]
实施例9:菌株(phocaeicola sp.)ccfm1183的应用
[0136]
菌株(phocaeicola sp.)ccfm1183可用于制备豆奶,豆奶的具体制备过程如下:
[0137]
(1)将实施例1获得的拟杆菌(bacteroides sp.)ccfm1183的二级纯化培养液以3%(v/v)的接种量接种到培养基中,在温度37℃下培养18h,得到菌液;将菌液离心,得到菌泥;将菌泥用ph 7.2的磷酸盐缓冲液清洗3次后用保护剂重悬至浓度为1
×
10
10
cfu/ml,得到悬浮液;将悬浮液在温度37℃下预培养60min后冻干,得到菌剂;
[0138]
其中,培养基的制备方法为:脑心浸液中加入半胱氨酸盐酸盐1g/l、氯化血红素0.01g/l和维生素k1 0.002g/l,ph为7.0;
[0139]
保护剂的成分包含:100g/l脱脂奶粉、30ml/l甘油、100g/l麦芽糊精、150g/l海藻糖和10g/l l
‑
谷氨酸钠;
[0140]
(2)将大豆在温度80℃下浸泡2h后去除大豆皮,得到去皮大豆;将去皮大豆沥去浸泡水后加沸水磨浆,得到豆浆;将豆浆在高于80℃的温度条件下保温12min,得到熟豆浆;将熟豆浆用150目筛网过滤后离心分离,得到粗豆奶;将粗豆奶加热到温度140~150℃后迅速导入真空冷却室进行抽真空,使得粗豆奶中的异味物质随着水蒸汽迅速排出,得到熟豆奶;将熟豆奶降温至约37℃后在熟豆奶中添加步骤(1)制得的菌剂至浓度为不低于1
×
106cfu/ml,得到豆奶(豆奶需在4℃下冷藏保存)。
[0141]
实施例10:菌株(phocaeicola sp.)ccfm1183的应用
[0142]
菌株(phocaeicola sp.)ccfm1183可用于制备蔬菜饮料,蔬菜饮料的具体制备过程如下:
[0143]
(1)将实施例1获得的菌株(phocaeicola sp.)ccfm1183的二级纯化培养液以3%(v/v)的接种量接种到培养基中,在温度37℃下培养18h,得到菌液;将菌液离心,得到菌泥;将菌泥用ph 7.2的磷酸盐缓冲液清洗3次后用保护剂重悬至浓度为1
×
10
10
cfu/ml,得到悬浮液;将悬浮液在温度37℃下预培养60min后冻干,得到菌剂;
[0144]
其中,培养基的制备方法为:脑心浸液中加入半胱氨酸盐酸盐1g/l、氯化血红素0.01g/l和维生素k1 0.002g/l,ph为7.0;
[0145]
保护剂的成分包含:100g/l脱脂奶粉、30ml/l甘油、100g/l麦芽糊精、150g/l海藻糖和10g/l l
‑
谷氨酸钠;
[0146]
(2)将新鲜蔬菜洗净后榨汁,得到蔬菜汁;将蔬菜汁在温度140℃下高温热杀菌2秒,得到杀菌后的蔬菜汁;将杀菌后的蔬菜汁降温至约37℃后在杀菌后的蔬菜汁中添加步骤(1)制得的菌剂至浓度为不低于1
×
106cfu/ml,得到蔬菜饮料(蔬菜饮料需在4℃下冷藏
保存)。
[0147]
实施例11:菌株(phocaeicola sp.)ccfm1183的应用
[0148]
菌株(phocaeicola sp.)ccfm1183可用于制备胶囊制品,胶囊制品的具体制备过程如下:
[0149]
(1)将实施例1获得的菌株(phocaeicola sp.)ccfm1183的二级纯化培养液以3%(v/v)的接种量接种到培养基中,在温度37℃下培养18h,得到菌液;将菌液离心,得到菌泥;将菌泥用ph 7.2的磷酸盐缓冲液清洗2次后用脱脂乳重悬至浓度为2
×
10
10
cfu/ml,得到悬浮液;
[0150]
(2)将步骤(1)制得的悬浮液添加至浓度为3%的海藻酸钠溶液中至浓度为2
×
109cfu/ml后,充分搅拌,使得菌株(phocaeicola sp.)ccfm1183的细胞均匀地分散于海藻酸钠溶液中,得到混合液;将混合液挤压到浓度为2%的氯化钙溶液中形成胶粒;待形成的胶粒静止固化30min后,过滤收集胶粒;将收集得到的胶粒进行冷冻干燥48h,得到粉剂;将粉剂装入到药用胶囊中,得到胶囊制品。
[0151]
实施例12:菌株(phocaeicola sp.)ccfm1183的应用
[0152]
菌株(phocaeicola sp.)ccfm1183可用于制备发酵乳,发酵乳的具体制备过程如下:
[0153]
(1)将实施例1获得的菌株(phocaeicola sp.)ccfm1183的二级纯化培养液以3%(v/v)的接种量接种到培养基中,在温度37℃下培养18h,得到菌液;将菌液离心,得到菌泥;将菌泥用ph 7.2的磷酸盐缓冲液清洗3次后用保护剂重悬至浓度为1
×
10
10
cfu/ml,得到悬浮液;将悬浮液在温度37℃下预培养60min后冻干,得到冻干粉;
[0154]
其中,培养基的制备方法为:脑心浸液中加入半胱氨酸盐酸盐1g/l、氯化血红素0.01g/l和维生素k1 0.002g/l,ph为7.0;
[0155]
保护剂的成分包含:100g/l脱脂奶粉、30ml/l甘油、100g/l麦芽糊精、150g/l海藻糖和10g/l l
‑
谷氨酸钠;
[0156]
(2)将冻干粉与商业干粉发酵剂保加利亚乳杆菌和商业干粉发酵剂嗜热链球菌按照质量比1:1:1的比例混合,得到发酵剂;
[0157]
(3)将糖添加至鲜奶中至浓度为5%,得到混合液;将混合液在65℃、20mpa的条件下进行均质后在95℃下保温杀菌5min,得到发酵原料;将发酵原料降温至35℃后以0.03%(v/v)的接种量将步骤(2)制得的发酵剂接种至发酵原料中,于35℃下保温发酵16h,得到发酵乳;将发酵乳于42℃的条件下凝乳后,在4℃下冷藏24h进行后熟,得到发酵乳成品。
[0158]
实施例13:菌株(phocaeicola sp.)ccfm1183的应用
[0159]
菌株(phocaeicola sp.)ccfm1183可用于制备片剂,片剂的具体制备过程如下:
[0160]
(1)将实施例1获得的菌株(phocaeicola sp.)ccfm1183的二级纯化培养液以3%(v/v)的接种量接种到培养基中,在温度37℃下培养18h,得到菌液;将菌液离心,得到菌泥;将菌泥用ph 7.2的磷酸盐缓冲液清洗3次后用保护剂重悬至浓度为1
×
10
10
cfu/ml,得到悬浮液;将悬浮液在温度37℃下预培养60min后冻干,得到菌粉;
[0161]
其中,培养基的制备方法为:脑心浸液中加入半胱氨酸盐酸盐1g/l、氯化血红素0.01g/l和维生素k1 0.002g/l,ph为7.0;
[0162]
保护剂的成分包含:100g/l脱脂奶粉、30ml/l甘油、100g/l麦芽糊精、150g/l海藻
糖和10g/l l
‑
谷氨酸钠;
[0163]
(2)称取步骤(1)制得的菌粉25.7重量份、淀粉55.0重量份、纤维素衍生物4.5重量份、羧甲基淀粉钠12.0重量份、滑石粉0.8重量份、蔗糖1.0重量份与水1.0重量份,得到原材料;将原材料混合,得到湿颗粒;将湿颗粒用中南制药机械厂的压片机进行压片后使用青州市益康中药机械有限公司的小型药物干燥机进行干燥,得到片剂。
[0164]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。