用于治疗grn相关成人发作性神经退行性病变的重组腺相关病毒
1.相关申请的交叉引用
2.本技术要求于2019年2月22日提交的美国临时申请第62/809,329号、于2019年10月21日提交的美国临时申请第62/923,812号以及于2020年2月2日提交的美国临时申请第62/969,108号的权益和优先权,所述美国临时申请出于所有目的以全文引用的方式并入本文中。
背景技术:
3.额颞叶痴呆(ftd)是通常在生命的第六个或第七个十年呈现执行功能、行为、言语或语言理解方面的缺陷的致命性神经退行性疾病。这些症状与影响额叶皮质和颞叶皮质的脑萎缩的特征性模式相关。患者普遍表现出自症状发作起平均8年存活期的渐进性过程(coyle
‑
gilchrist it等人,《神经病学(neurology)》,2016;86(18):1736
‑
43)。
4.ftd是高遗传性的,其中大约40%的患者具有阳性家族史(rohrer jd等人,《神经病学》,2009;73(18):1451
‑
6)。在5
‑
10%的ftd患者中,可能在对颗粒蛋白前体(pgrn)进行编码的颗粒体蛋白(grn)基因(即普遍存在的溶酶体蛋白)中鉴定出致病性功能丧失突变(rohrer jd等人,《神经病学》,2009;73(18):1451
‑
6)。grn突变携带者表现出快速且广泛的脑萎缩并且可能呈现出其它神经退行性疾病,如进行性核上性麻痹、皮质基底节综合征、帕金森氏病(parkinson's disease)、路易体痴呆(dementia with lewy bodies)或阿尔茨海默氏病(alzheimer's disease)的临床特征(le ber i等人,《脑:神经病学杂志(brain:a journal of neurology)》,2008;131(3):732
‑
46)。grn突变以常染色体显性方式遗传,到70岁时外显率大于90%(gass j等人,《人类分子遗传学(human molecular genetics)》,2006;15(20):2988
‑
3001)。虽然单个grn突变的遗传导致ftd和其它晚发性神经退行性疾病,但是患有纯合子功能丧失突变的患者表现出在生命早期患有神经元蜡样质脂褐质沉积症(ncl,巴藤病(batten disease)),其特征在于自荧光材料(脂褐质)在神经元溶酶体中的累积、迅速的认知减退和视网膜变性(smith katherine r等人,《美国人类遗传学杂志(american journal of human genetics)》,2012;90(6):1102
‑
7)。尽管对grn突变杂合的患者具有更晚的症状发作,但是所述患者的脑和视网膜最终患上与ncl患者相同的溶酶体贮积病变,并且同样经历进行性神经退行性病变(ward me等人,《科学转化医学(science translational medicine)》,2017;9(385);gotzl jk等人,《神经病理学学报(acta neuropathologica)》,2014;127(6):845
‑
60)。最新发现颗粒蛋白前体通过促进溶酶体酸化并用作溶酶体蛋白酶(包含组织蛋白酶(ctsd))的分子伴侣而在溶酶体功能中起关键作用(beel s等人,《人类分子遗传学》,2017年8月1日;26(15):2850
‑
2863;tanaka y等人,《人类分子遗传学》,2017;26(5):969
‑
88)。对ctsd进行编码的基因的突变还产生支持与有缺陷的溶酶体蛋白酶活性相关的普通病理生理学的ncl表型(siintola e等人,《脑:神经病学杂志》,2006;129(第6部分):1438
‑
45)。
5.目前尚无用于由grn单倍型不足引起的成人发作性神经退行性病变的疾病修饰疗
法。疾病管理包含旨在减少疾病相关行为、认知和/或移动症状的支持性护理和标签外治疗(tsai和boxer,2016,《神经化学杂志》,138增刊1:211
‑
21)。进一步地,在早期阶段,可以通过筛查具有痴呆家族史的个体获得更多患者,鉴于缺乏治疗,所述痴呆家族史尚未表现出来。因此,这种疾病谱代表了高度未被满足的医疗需求的地区。
6.需要的是,用于与gnr单倍型不足相关的成人发作性神经退行性疾病以及与其相关的症状的治疗。
技术实现要素:
7.提供了一种适用于治疗由颗粒蛋白前体(pgrn)相关的额颞叶痴呆(ftd)引起的神经退行性病变以及与grn单倍型不足相关的其它成人发作性神经退行性病症的重组aav(raav)。所述raav包括腺相关病毒1衣壳和包装在所述aav衣壳中的载体基因组,所述载体基因组包括aav反向末端重复序列(itr)、对人颗粒蛋白前体进行编码的编码序列以及引导所述颗粒蛋白前体表达的调控序列。在某些实施例中,所述载体基因组包括aav 5'反向末端重复序列(itr)、人pgrn编码序列以及引导其表达的调控元件和aav 5'itr。
8.还提供了一种药物组合物,所述药物组合物包括水性液体和重组aav(raav)。在某些实施例中,所述水性液体包括适用于鞘内施用的人工脑脊液与表面活性剂。
9.提供了一种治疗患有颗粒蛋白前体相关的额颞叶痴呆(ftd)神经退行性病变或由grn单倍型不足引起的另一种成人发作性神经退行性疾病的人类患者的方法。所述方法包括向中枢神经系统(cns)递送包含人颗粒蛋白前体编码序列的raav。具有腺相关病毒1(aav1)衣壳的重组腺相关病毒(raav),所述raav进一步包括包装在aav衣壳中的载体基因组,所述基因组包括aav反向末端重复序列、人颗粒蛋白前体的编码序列以及引导所述颗粒蛋白前体表达的调控序列。
10.提供了一种在用于治疗患有pgrn
‑
ftd或由grn单倍型不足引起的另一种成人发作性神经退行性疾病的方法中使用的raav1.hpgrn。所述方法包括向cns施用具有对靶向室管膜细胞的人颗粒蛋白前体进行编码的腺相关病毒1衣壳的raav。所述raav1进一步包括包装在所述aav衣壳中的载体基因组,所述载体基因组包括aav反向末端重复序列、人颗粒蛋白前体的编码序列以及引导所述颗粒蛋白前体在所述室管膜细胞中表达的调控序列。在一个实施例中,分泌型人颗粒蛋白前体是在递送raav1基因疗法之后表达的。
11.提供了一种用于治疗患有与颗粒蛋白前体相关的额颞叶痴呆(ftd)神经退行性病变或由grn单倍型不足引起的另一种成人发作性神经退行性疾病相关的脑病变的人类患者的方法。所述方法包括向中枢神经系统(cns)施用具有腺相关病毒1(aav1)衣壳的重组腺相关病毒(raav),所述raav进一步包括包装在所述aav衣壳中的载体基因组,所述载体基因组包括aav反向末端重复序列、人颗粒蛋白前体的编码序列以及引导所述颗粒蛋白前体表达的调控序列。
12.在某些实施例中,本文所提供的方法可以进一步包括:(a)无创评估作为脑病变减少的预测因子的患者视网膜贮积病变减少;(b)进行磁共振成像以评估脑体积;和/或(c)测量所述csf中的颗粒蛋白前体的浓度。
13.通过以下对本发明的详细描述,本发明的这些和其它方面将变得显而易见。
附图说明
14.图1是aav1.hpgrn载体基因组的线性映射。aav1.cb7.ci.hpgrn.rbg载体基因组包括在普遍存在的cb7启动子的控制下的人pgrn的编码序列,所述cb7启动子由位于cmv ie增强子与鸡β肌动蛋白启动子之间的杂合体构成。缩略语:ba,β肌动蛋白;bp,碱基对;cmv ie,巨细胞病毒立即早期;itr,反向末端重复序列;polya,聚腺苷酸化;rbg,兔β珠蛋白。
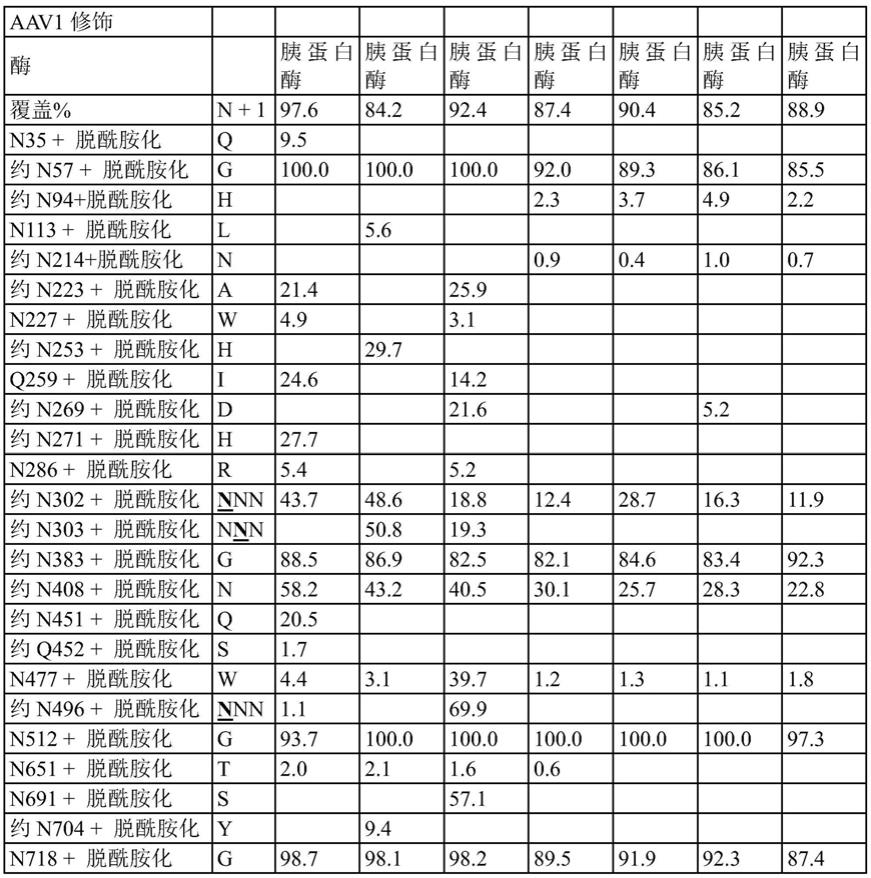
15.图2是携带载体基因组的顺式质粒的线性向量映射。
16.图3a
‑
图3d提供了grn
‑
/
‑
小鼠的脑中的脂褐质累积和氨基己糖苷酶活性的自然病程。在指定年龄处死grn
‑
/
‑
小鼠(ko)或grn
/
(wt)对照(n=每时间点10只)。对海马体、丘脑和额叶皮质的未染色的脑切片进行成像以确定自发荧光材料(脂褐质),并且由三个盲审员对脂褐质沉积物进行定量并求平均值(图3a
‑
图3c)。脂褐质计数是相对于所关注区域的总面积表达的。测量脑样品中的氨基己糖苷酶活性并且使其相对于总蛋白质浓度归一化(图3d)。值表达为与野生型对照的比率。
17.图4a
‑
图4g示出了通过aav介导的pgrn表达对年轻成年grn
‑
/
‑
小鼠的脑中的溶酶体病理学进行的校正。通过单icv注射媒剂(pbs)或表达人pgrn的aavhu68载体(10
11
gc)处理2月龄的grn
‑
/
‑
小鼠(ko)或grn
/
(wt)对照(n=每组10只)。在注射后60天处死动物,并且通过elisa测量脑的csf(图4a)和额叶(图4b)中的人pgrn。测量脑样品中的氨基己糖苷酶活性(图4c)。使脑pgrn浓度和hex活性相对于总蛋白质归一化。对海马体、丘脑和额叶皮质中的未染色的脑切片进行成像以确定自发荧光材料(脂褐质)。由盲审员定量海马体、丘脑和额叶皮质中的脂褐质沉积物(图4d
‑
图4g)。脂褐质计数是按照高倍视野表达的。n=每组10只,除ko pbs海马体(n=8)之外。*p<0.05,**p<0.005,***p<0.001,****p<0.0001,单向anova,随后是图克多重比较检验。测量血清中的氨基己糖苷酶活性(图4g)。
18.图5a
‑
图5d示出了通过人pgrn的aav介导的表达对老年grn
‑
/
‑
小鼠的脑中的溶酶体病理学进行的校正。通过单icv注射媒剂(pbs)或表达人pgrn的aavhu68载体(10
11
gc)处理7月龄的grn
‑
/
‑
小鼠(ko)或grn
/
(wt)对照。注射后4个月处死动物。测量脑样品中的氨基己糖苷酶活性(图5a),并且由盲审员定量海马体、丘脑和额叶皮质中的脂褐质沉积物(图5b
‑
图5d)。脂褐质计数是按照高倍视野表达的。*p<0.05,**p<0.005,单向anova,随后是图克多重比较检验。
19.图6a
‑
图6c示出了通过aav介导的pgrn表达对老年grn
‑
/
‑
小鼠的脑小胶质细胞增生进行的校正。通过单icv注射媒剂(pbs)或表达人pgrn的aavhu68载体(10
11
gc)处理7月龄的grn
‑
/
‑
小鼠(ko)或grn
/
(wt)对照。注射后4个月处死动物,并且对脑切片进行染色以确定cd68。使用imagej软件,由盲审员定量海马体、丘脑和额叶皮质的图像中的cd68阳性面积(图6a
‑
图6c)。面积是按照高倍视野表达的。*p<0.05,**p<0.005,***p<0.001,****p<0.0001,单向anova,随后是图克多重比较检验。
20.图7a
‑
图7c示出了aav递送之后恒河猴的人pgrn表达。在研究第0天,通过icm注射向成年恒河猴施用表达来自鸡β肌动蛋白启动子的人pgrn的aav1载体、aav5载体或aavhu68载体(3
×
10
13
gc)(n=每种载体2只)。向两只另外的恒河猴施用表达来自泛素c启动子(aavhu68 v2)的hpgrn的aavhu68载体。icm注射是在荧光引导下进行的。在通过荧光镜检查确认针放置之后,造影剂材料的csf返注表明在小脑延髓池内的分布。在随后的载体输注期间,造影剂的移位是显而易见的。通过elisa测量经处理的恒河猴(图7a)和健康成年人受试
者(图7b)的csf中和经处理的恒河猴的血清(图7c)中的人pgrn。在图7a和图7b中,虚线是指在1:5稀释度下csf中的hpgrn的定量极限。
21.图8a
‑
图8c示出了对经载体处理的非人灵长类动物中的人pgrn的免疫应答。在icm施用表达来自鸡β肌动蛋白启动子或泛素c启动子(aavhu68 v2)的人pgrn的aav1载体、aav5载体或aavhu68载体(3
×
10
13
gc)之后,每周收集csf以进行化学和细胞学分析。增加的白细胞计数(主要为小淋巴细胞)在大部分动物中是明显的(图8a)。通过elisa测量对用aavhu68或aav1处理的动物的csf(图8b)和血清(图8c)中的人pgrn的抗体应答。没有评估来自用aav5处理的动物的血清或csf样品中的针对人pgrn的抗体。
22.图9示出了在向非人灵长类动物icm施用aav1载体和aavhu68载体之后的脑转导水平。通过icm注射向成年恒河猴施用3
×
10
13
gc的表达来自鸡β肌动蛋白启动子的gfp的aavhu68(n=2)载体或aav1(n=2)载体。载体施用后28天对动物进行尸检,并且在对gfp和dapi进行染色的情况下,通过gfp免疫组织化学或免疫荧光分析脑右半球的五个区域的切片。用特定细胞类型的标志物(neun、gfap和olig2)进行共染色允许对经转导的星形胶质细胞和少突胶质细胞进行定量。计算所有采样的脑区域的每种细胞类型的平均转导。误差条=五个切片的sem。
23.图10提供了示出在向非人灵长类动物icm施用aav1(动物id 1826和2068)载体和aavhu68(动物id 1518和2076)载体之后神经元、星形胶质细胞和少突胶质细胞转导百分比的表格。在研究第0天,通过icm注射向成年恒河猴施用3
×
10
13
gc的表达来自鸡β肌动蛋白启动子的gfp的gc aavhu68(n=2)载体或aav1(n=2)载体。载体施用后28天对动物进行尸检,并且在对特定细胞类型(neun、gfap和olig2)进行共染色的情况下,通过gfp免疫荧光分析脑右半球的五个区域的切片。使用halo软件对每种细胞类型的总细胞和表达每种类型的细胞的gfp的数量进行定量。示出了针对每个区域转导的每种细胞类型的百分比。对于一些动物而言,分析来自第5区域的两个切片。
24.图11a
‑
图11b示出了来自非人灵长类动物的正中感觉神经传导研究的结果。y轴代表施用三种不同剂量(3
×
10
12
gc、1
×
10
13
gc或3
×
10
13
gc的raav1.hpgrn或媒剂对照)之后随时间推移(x轴)测量的从发作到峰值振幅(峰潜时)的潜伏期。
25.图12a
‑
图12d示出了来自用raav1.hpgrn处理后90天的非人灵长类动物(nhp)的背根神经节(drg)、正中神经和脊髓(sc)的神经病理学研究的结果。
26.图13示出了载体调配物的制造工艺流程图。缩略语:aex,阴离子交换;crl,查尔斯河实验室(charles river laboratories);ddpcr,液滴数字聚合酶链反应;dmem,杜氏改性伊格尔培养基(dulbecco's modified eagle medium);dna,脱氧核糖核酸;ffb,最终调配物缓冲液;gc,基因组拷贝;hek293,人胚胎肾293细胞;itffb,鞘内最终调配物缓冲液;pei,聚乙烯亚胺;sds
‑
page,十二烷基硫酸钠聚丙烯酰胺凝胶电泳;tff,切向流过滤;usp,美国药典(united states pharmacopeia);wcb,工作细胞库。
27.图14示出了载体调配物的制造工艺流程图。用于产生gtp
‑
205药物产品的制造工艺。缩略语:ad5,腺病毒血清型5;auc,分析超速离心;bds,原料药物质(bulk drug substance);bsa,牛血清白蛋白;cz,晶体天顶(crystal zenith);ddpcr,液滴数字聚合酶链反应;e1a,早期区域1a(基因);elisa,酶联免疫吸附测定;fdp,最终药物产品;gc,基因组拷贝;hek293,人胚胎肾293细胞;itffb,鞘内最终调配物缓冲液;kanr,卡那霉素抗性(基
因);ms,质谱;ngs,下一
‑
代测序;qpcr,定量聚合酶链反应;sds
‑
page,十二烷基硫酸钠聚丙烯酰胺凝胶电泳;tcid50 50%组织培养物感染剂量;uplc,超高效液相色谱;usp,美国药典。
具体实施方式
28.提供了一种适用于治疗与grn单倍型不足(如颗粒蛋白前体(pgrn)相关额颞痴呆(ftd))相关的神经退行性病状的重组aav(raav)以及含有所述raav的组合物。在某些优选实施例中,所述raav包括腺相关病毒1衣壳和包装在aav衣壳中的载体基因组,所述载体基因组包括aav反向末端重复序列、人颗粒蛋白前体的编码序列以及引导所述颗粒蛋白前体表达的调控序列。在某些实施例中,所述载体基因组包括aav5'反向末端重复序列(itr)、人pgrn编码序列以及引导其表达的调控元件和aav 3'itr。还提供了一种药物组合物,所述药物组合物包括水性液体和重组aav(raav)。在某些实施例中,所述水性液体包括适用于鞘内施用的人工脑脊液与表面活性剂。还提供了用于治疗患有pgrn
‑
ftd的人类患者和/或治疗患有与pgrn
‑
ftd相关的脑病变的患者的方法。在某些实施例中,提供了用于治疗或减少患者的小胶质细胞增生的方法。所述方法包括向中枢神经系统(cns)递送raav.pgrn。在某些实施例中,本文所提供的方法可以进一步包括通过以下监测治疗:(a)无创评估作为脑病变减少的预测因子的患者视网膜贮积病变减少;(b)进行磁共振成像以评估脑体积;和/或(c)测量所述csf中的pgrn的浓度。任选地,可以测量血浆中的pgrn的浓度。
29.如本文所使用的,术语“aav.hpgrn”或“raav.hpgrn”用于指重组腺相关病毒,所述重组腺相关病毒具有aav衣壳,所述aav衣壳内具有载体基因组,所述载体基因组包括在调控序列的控制下的人颗粒蛋白前体编码序列。可以指定特定的衣壳类型,例如aav1.hpgrn,其指代具有aav1衣壳的重组aav;aavhu68.hpgrn,其指代具有aavhu68衣壳的重组aav;aav5.hpgrn,其指代具有aav5衣壳的重组aav。
[0030]“重组aav”或“raav”是含有两个元件的抗dnase的病毒颗粒、aav衣壳和至少含有包装在aav衣壳内的非aav编码序列的载体基因组。除非另有说明,否则此术语可以与短语“raav载体”互换使用。raav是“复制缺陷型病毒”或“病毒载体”,因为其缺少任何功能性aav rep基因或功能性aav cap基因并且不能产生后代。在某些实施例中,仅aav序列是aav反向末端重复序列(itr),通常定位在载体基因组的5'和3'最末端处,以允许定位在itr之间的基因和调控序列包装在aav衣壳内。
[0031]
如本文所使用的,“载体基因组”是指包装在形成病毒颗粒的raav衣壳内部的核酸序列。此类核酸序列含有aav反向末端重复序列(itr)。在本文的实例中,载体基因组至少含有从5'到3'的aav 5'itr、编码序列和aav 3'itr。可以选择来自aav2的itr、不同于衣壳来源或除全长itr之外的aav。在某些实施例中,itr来自与在产生或反式补充aav期间提供rep功能的aav来源相同的aav。进一步地,可以使用其它itr。进一步地,载体基因组含有引导基因产物表达的调控序列。在本文中更详细地讨论载体基因组的合适组分。
[0032]
治疗性蛋白和编码序列:
[0033]
raav包含人颗粒蛋白前体(hpgrn)蛋白的编码序列或其执行hpgrn的生物学功能中的一个或多个生物学功能的变体。这种蛋白的编码序列被工程化为中枢神经系统(cns)中用于表达的载体基因组。
[0034]
hupgrn1最常见的特征在于genbank np_002078的593氨基酸序列,所述氨基酸序列是在seq id no:1中重现的。这种序列含有位置1到17处的信号肽,其中分泌的颗粒蛋白前体蛋白质或分泌的颗粒体蛋白包括氨基酸18到约593。这种蛋白质可以切割为8条链:颗粒体蛋白1(亦称颗粒体蛋白g:约aa 58到约氨基酸113)、颗粒体蛋白2(约氨基酸123到约179)、颗粒体蛋白3(约氨基酸206到约氨基酸261)、颗粒体蛋白4(约氨基酸281到约氨基酸336)、颗粒体蛋白5(约氨基酸364到约氨基酸417)、颗粒体蛋白6(约氨基酸442到约氨基酸496)和颗粒体蛋白7(约氨基酸518到约氨基酸573),参考seq id no:1的编号。在某些实施例中,异源信号肽可以取代天然信号肽。然而,其它实施例可以涵盖具有外源信号肽(例如,人il2前导序列)的颗粒蛋白前体。还可以参考例如www.signalpeptide.de/index.php?m=listspdb_mammalia。因此,含有颗粒蛋白前体和/或其片段的融合蛋白是可设想的。此类融合蛋白可以涵盖与彼此的各种组合中的活性grn中的一种或多种活性grn(例如,grn 1、2、3、4、4、6或7),或者这些肽中的一个或多个肽可以与全长pgrn或另一个蛋白质或肽(例如,另一个活性蛋白或肽和/或对人pgrn具有外源性的信号肽)组合。
[0035]
载体基因组被工程化为携带这种蛋白质的编码序列并且表达人细胞中以及具体地中枢神经系统中的蛋白质。在某些实施例中,编码序列可以是在genbank:nm_002087.3中找到的自然序列,所述自然序列是seq id no:2中重现的。
[0036]
在某些实施例中,编码序列是在seq id no:3中提供的。某些其它实施例将涵盖与seq id no:3的同一性在95%到99.9%或100%内(包含其之间的数值在内)的编码序列。在一些实施例中,编码序列被密码子优化以得出更好的治疗结果,例如,增强的哺乳动物细胞中的表达。可以通过具有信号(前导)序列的全长颗粒蛋白前体的编码序列、通过不具有信号(前导)序列的颗粒蛋白前体或通过如本文所定义的融合蛋白的编码序列的长度评估同一性。在某些实施例中,编码序列是在seq id no:3中提供的。某些其它实施例将涵盖与seq id no:4的同一性在95%到小于100%内的编码序列。可以通过具有信号(前导)序列的全长颗粒蛋白前体的编码序列、通过不具有信号(前导)序列的颗粒蛋白前体或通过如本文所定义的融合蛋白的编码序列的长度评估同一性。
[0037]
适合地,这些编码序列对全长颗粒蛋白前体进行编码。然而,其它实施例可以涵盖具有异源信号肽(例如,人il2前导序列)的活性颗粒体蛋白链。还可以参考例如www.signalpeptide.de/index.php?m=listspdb_mammalia。
[0038]
在某些实施例中,可以利用人pgrn的编码序列(例如,seq id no:3或seq id no:4)的片段或与其具有约95%到99.9%或100%同一性的序列。此类片段可以对活性人grn(aa 18
‑
593)或包括具有活性人grn的异源信号肽的融合肽进行编码。在某些实施例中,活性grn中的一种或多种活性grn(例如,grn 1、2、3、4、4、6或7)的编码序列中的一个或多个编码序列可以包含在与彼此的各种组合的载体基因组内,或者这些肽中的一个或多个肽可以与全长pgrn或另一个编码序列组合。
[0039]
不希望受理论束缚,据信,cns(例如,室管膜细胞)中的细胞亚群中的aav介导的pgrn表达提供了分泌蛋白的储库。分泌pgrn蛋白(和/或一种或多种grn)通过分拣蛋白(sortilin)或甘露糖
‑6‑
磷酸受体被其它细胞摄取,所述分泌pgrn蛋白随后在所述其它细胞中被转运到溶酶体。在某些实施例中,所述分泌蛋白是颗粒蛋白前体。在某些实施例中,所述分泌蛋白是颗粒体蛋白。在某些实施例中,所述分泌蛋白包含颗粒蛋白前体和颗粒体
蛋白的混合物。
[0040]
在某些实施例中,除颗粒蛋白前体编码序列之外,另一种非aav编码序列可以包含在内,例如,肽、多肽、蛋白质、功能性rna分子(例如,mirna、mirna抑制剂)或所关注的其它基因产物。有用的基因产物可以包含mirna。mirna和其它小干扰核酸通过靶信使rna(mrna)的靶rna转录物裂解/降解或转译抑制来调节基因表达。mirna是天然表达的,通常作为最终的19
‑
25种非转译的rna产物。mirna通过与靶mrna的3'非转译区(utr)的序列特异性相互作用展现出其活性。这些内源表达的mirna形成发夹前体,所述发夹前体随后被加工成mirna双链体,并且被进一步加工成“成熟的”单链mirna分子。这种成熟的mirna引导多蛋白复合物mirisc,所述多蛋白复合物基于与成熟的mirna的互补性来鉴定靶mrna的靶位点,例如在3
′
utr区中。
[0041]
在某些实施例中,所述表达盒进一步包括一个或多个mirna靶序列,所述一个或多个靶序列抑制背根神经节(drg)中的hpgrn的表达。在某些实施例中,所述表达盒包括drg特异性mirna靶序列的至少两个串联重复序列,其中所述至少两个串联重复序列包括可以相同或不同的至少一个第一mirna靶序列和至少一个第二mirna靶序列。在某些实施例中,所述串联mirna靶序列是连续的或由1到10个核酸的间隔子隔开,其中所述间隔子不是mirna靶序列。在某些实施例中,至少两个drg特异性mirna靶序列定位在hpgrn编码序列的3'处。在某些实施例中,所述至少两个drg特异性mirna串联重复序列中的第一个的起点在距hpgrn编码序列的3'端20个核苷酸内。在某些实施例中,所述至少两个drg特异性mirna串联重复序列中的第一个的起点距hpgrn编码序列的3'端至少100个核苷酸。在某些实施例中,所述mirna串联重复序列的长度为200到1200个核苷酸。在某些实施例中,至少两个drg特异性mirna靶序列定位在hpgrn编码序列的5'处。在某些实施例中,至少两个drg特异性mirna靶序列定位在hpgrn编码序列的5'和3'两者中。在某些实施例中,表达盒mrna或dna正链的至少第一和/或至少第二mirna靶序列的mirna靶序列选自:(i)agtgaattctaccagtgccata(mir183,seq id no:32);(ii)agcaaaaatgtgctagtgccaaa(seq id no:33);(iii)agtgtgagttctaccattgccaaa(seq id no:34);和(iv)agggattcctgggaaaactggac(seq id no:35)。在某些实施例中,两个或更多个连续的mirna靶序列是连续的并且不由间隔子隔开。在某些实施例中,所述mirna靶序列中的两个或更多个mirna靶序列由间隔子隔开,并且每个间隔子独立地选自以下中的一个或多个:(a)ggat;(b)cacgtg;或(c)gcatgc。在某些实施例中,定位在所述mirna靶序列之间的间隔子可以定位在第一个mirna靶序列的3'和/或最后一个mirna靶序列的5'。在某些实施例中,所述mirna靶序列之间的所述间隔子是相同的。参见于2018年12月21日提交的美国临时专利申请第62/783,956号以及于2020年2月12日提交的国际专利申请第pct/us19/67872号,所述专利申请通过引用特此并入。
[0042]
aav1
[0043]
来自分枝f的aavhu68可以用于产生靶向并表达cns中的hpgrn的载体。然而,出人意料地观察到,aav1介导的pgrn递送提供了高于aavhu68的cns中的pgrn表达,尽管观察到相当的血浆浓度。发明人已经发现,raav1.pgrn的鞘内递送是本文所述的疗法的具有吸引力的递送途径。因此,在特别期望的实施例中,选择了aav1衣壳。
[0044]
在某些实施例中,提供了一种组合物,所述组合物包括适用于鞘内注射的水性液体和具有优先靶向室管膜细胞的aav衣壳的raav原液,其中raav进一步包括具有pgrn编码
序列的递送到中枢神经系统(cns)的载体基因组。在某些实施例中,所述组合物被调配成枕骨下注射到小脑延髓池中(小脑延髓池内)。在某些实施例中,所述raav通过计算机断层扫描
‑
(ct
‑
)引导的raav注射施用。在某些实施例中,向患者施用单剂量的所述组合物。
[0045]
aav1衣壳是指具有aav vp1蛋白、aav vp2蛋白和aav vp3蛋白的衣壳。在特定实施例中,所述aav1衣壳包括组装到60个总vp蛋白的t1二十面体衣壳中的预定比率为约1:1:10的aav vp1蛋白、aav vp2蛋白和aav vp3蛋白。aav1衣壳能够包装基因组序列,以形成aav颗粒(例如重组aav,其中基因组是载体基因组)。通常,例如美国专利6,759,237、美国专利7,105,345、美国专利7,186,552、美国专利8,637,255和美国专利9,567,607中描述了对最长vp蛋白进行编码的衣壳核酸序列,即在产生具有aav1衣壳的raav期间反式表达的vp1,所述专利通过引用并入本文中。
[0046]
衣壳编码序列不存在于最终组装的raav1.hpgrn中。然而,此类序列用于在产生重组aav。在某些实施例中,aav1衣壳编码序列是对seq id no:26的全长aav1 vp1蛋白或其vp2或vp3区域进行编码的任何核酸序列。参考例如美国专利6,759,237、美国专利7,105,345、美国专利7,186,552、美国专利8,637,255和美国专利9,567,607,所述美国专利通过引用并入本文中。在某些实施例中,所述aav1衣壳编码序列是seq id no:25。在某些实施例中,所述aav1衣壳是在使用或不使用翻译后修饰的情况下由seq id no:25的编码序列产生的蛋白质。然而,使用aav1 vp1、aav1 vp2和/或aav vp3氨基酸序列,这种编码序列的变体可以被工程化和/或其它编码序列可以被反向翻译以用于期望的表达系统。
[0047]
在某些实施例中,基于seq id no:26中重现的aav1 vp1的初级序列的编号,包括重组aav1的组合物具有衣壳,其中aav1含有高度脱酰胺化的五个氨基酸(n57、n383、n512和n718)。
[0048][0049]
在某些实施例中,aav1由vp同种型的异质群体的衣壳组合物表征,基于如使用质谱所测定的衣壳中的vp蛋白的总量,所述vp同种型如下表所定义的被脱酰胺化。在某些实施例中,在下文提供的如使用质谱所测定的范围内,在以下位置中的一个或多个位置处修饰aav衣壳。残基编号基于公开的aav1序列,在seq id no:26中重现。
[0050][0051]
合适的修饰包含上文的段落中描述的标记为脱酰胺化调节的修饰,其并入本文中。在某些实施例中,如本文所描述的修饰以下位置中的一个或多个位置或n之后的甘氨酸。在某些实施例中,构建了aav1突变体,其中保存了位置57、383、512和/或718处的n之后的甘氨酸(即,保持未经修饰的)。在某些实施例中,在前一句中鉴定的四个位置处的ng与天然序列一起保存。残基编号基于公开的aav1 vp1,在seq id no:26中重现。在某些实施例中,将人工ng引入到与上表所鉴定的位置之一不同的位置中。
[0052]
raav载体
[0053]
如上文所指示的,具有aav1衣壳的重组aav是用于治疗ftd的本文所述的优选载体。在某些实施例中,例如,在下述实例中(例如,aavhu68或aav5),其它aav衣壳可以用于产生raav。在某些实施例中,可以选择aav1衣壳,并且包括hpgrn编码序列的载体基因组的元件中的一个或多个元件可以被取代。
[0054]
如本文所使用的,aavhu68衣壳是指如wo 2018/160582中所定义的衣壳,其通过引用并入本文中。如本文所述,raavhu68具有在表达来自aavhu68核酸的衣壳的产生系统中产生的raavhu68衣壳(例如,seq id no:30),所述raavhu68衣壳对seq id no:31的vp1氨基酸
序列以及任选地另外的核酸序列进行编码,例如对不含vp1和/或vp2独特区域的vp3蛋白进行编码。使用单个核酸序列vp1从生产中产生的raavhu68产生vp1蛋白、vp2蛋白和vp3蛋白的异质群体。更具体地,aavhu68衣壳含有具有来自seq id no:31中的预测的氨基酸残基的修饰的vp1蛋白内、vp2蛋白内和vp3蛋白内的亚群体。。这些亚群体至少包含脱酰胺化的天冬酰胺(n或asn)残基。例如,天冬酰胺
‑
甘氨酸对中的天冬酰胺是高度脱酰胺化的。在一个实施例中,aavhu68 vp1核酸序列具有seq id no:30的序列或与其互补的链,例如,对应的mrna或trna。在某些实施例中,vp2和/或vp3蛋白可以另外地或可替代地由不同于vp1的核酸序列表达,例如以改变所选表达系统中的vp蛋白的比率。在某些实施例中,还提供了对seq id no:31(约aa 203到736)的aavhu68 vp3氨基酸序列进行编码的核酸序列,所述aavhu68vp3氨基酸序列没有vp1独特区域(约aa 1到约aa 137)和/或vp2独特区域(约aa 1到约aa 202)或与其互补的链,即对应的mrna或trna(seq id no:30的约nt 607到约nt 2211)。在某些实施例中,还提供了对seq id no:31(约氨基酸138到736)的aavhu68 vp2氨基酸序列进行编码的核酸序列,所述aavhu68 vp2氨基酸序列没有vp1独特区域(约aa 1到aa 137)或与其互补的链,即对应的mrna或trna(seq id no:30的nt 411到2211)。
[0055]
如本文所使用的,aav5衣壳具有seq id no:29的预测的氨基酸序列。在某些实施例中,所述aav5衣壳是由seq id no:28的核酸序列表达的。
[0056]
包装到aav衣壳中并递送到宿主细胞的基因组序列通常至少由转基因及其调节序列和aav反向末端重复序列(itr)构成。单链aav和自身互补(sc)aav两者都涵盖在raav内。转基因是与载体序列异源的核酸编码序列,所述核酸编码序列对多肽、蛋白质、功能性rna分子(例如,mirna、mirna抑制剂)或其它所关注的基因产物进行编码。核酸编码序列以允许转基因在靶组织的细胞中转录、翻译和/或表达的方式与调控组分可操作地连接。
[0057]
载体的aav序列通常包括顺式作用的5'和3'反向末端重复序列(参见例如b.j.carter,《细小病毒手册(handbook of parvoviruses)》,p.tijsser编辑,crc出版社,第155到168页(1990))。itr序列的长度为约145bp。优选地,分子中使用了对itr进行编码的基本上整个序列,尽管允许对这些序列进行一定程度的微小修饰。修饰这些itr序列的能力在本领域的技术范围内。(参见例如文本,如sambrook等人,《分子克隆:实验室手册(molecular cloning:a laboratory manual)》,第2版,冷泉港实验室,纽约(1989);以及k.fisher等人,《病毒学杂志(j.virol.)》,70:520 532(1996))。在本发明中采用的这种分子的实例是含有转基因的“顺式作用”质粒,其中所选转基因序列和相关的调节元件侧接5'和3'aav itr序列。在一个实施例中,itr来自与供应衣壳的aav不同的aav。在一个实施例中,itr来自aav2。已经描述了被称为δitr的5'itr的缩短版本,其中缺失了d序列和末端解析位点(trs)。在其它实施例中,使用了全长aav5'和3'itr。然而,可以选择来自其它aav来源的itr。在itr的来源来自aav2并且aav衣壳来自另一个aav来源的情况下,所得载体可以被称为假型的。然而,这些元件的其它构型可以是合适的。
[0058]
除重组aav载体的上文鉴定的主要元件外,aav载体还包含必需的常规控制元件,所述常规控制元件以允许其在用质粒载体转染或用由本发明产生的病毒感染的细胞中转录、翻译和/或表达的方式与转基因可操作地连接。如本文所使用的,“可操作地连接的”序列包含与所关注的基因邻接的表达控制序列和以反式或在远处起作用以控制所关注的基因的表达控制序列。
[0059]
调节控制元件通常含有作为表达控制序列的一部分的启动子序列,例如定位在所选5'itr序列与编码序列之间。可以在本文所描述的载体中使用组成型启动子、可调控启动子[参见例如wo 2011/126808和wo 2013/04943]、组织特异性启动子或对生理学线索有应答的启动子。一种或多种启动子可以选自不同的来源,例如人巨细胞病毒(cmv)立即早期增强子/启动子、sv40早期增强子/启动子、jc多瘤病毒启动子、髓鞘碱性蛋白(mbp)或神经胶质原纤维酸性蛋白(gfap)启动子、单纯疱疹病毒(hsv
‑
1)潜伏期相关启动子(lap)、劳氏肉瘤病毒(rsv)长末端重复(ltr)启动子、神经元特异性启动子(nse)、血小板源性生长因子(pdgf)启动子、hsyn、黑色素浓缩激素(mch)启动子、cba、基质金属蛋白启动子(mpp)和鸡β
‑
肌动蛋白启动子。除了启动子之外,载体还可以含有一个或多个其它合适的转录起始、终止、增强子序列、有效的rna加工信号,如剪接和聚腺苷酸化(polya)信号;稳定胞质mrna的序列,例如wpre;增强翻译效率的序列(即,kozak共有序列);增强蛋白稳定性的序列;以及在需要时,增强所编码产物的分泌的序列。合适的增强子的实例是cmv增强子。其它合适的增强子包含适合于所期望的靶组织适应症的增强子。在一个实施例中,表达盒包括一种或多种表达增强子。在一个实施例中,表达盒含有两种或更多种表达增强子。这些增强子可以相同或彼此不同。例如,增强子可以包含cmv立即早期增强子。这种增强子可以存在于彼此相邻定位的两个拷贝中。可替代地,增强子的双拷贝可以被一个或多个序列分开。在仍另一个实施例中,表达盒进一步含有内含子,例如,鸡β肌动蛋白内含子。其它合适的内含子包含本领域已知的内含子,例如,如wo 2011/126808中描述的内含子。合适的polya序列的实例包含例如sv40、sv50、牛生长激素(bgh)、人生长激素和合成polya。任选地,可以选择一个或多个序列来稳定mrna。此类序列的实例是经修饰的wpre序列,其可以在polya序列的上游和编码序列的下游被工程化[参见例如ma zanta
‑
boussif等人,《基因疗法(gene therapy)》(2009)16:605
‑
619]。
[0060]
在一个实施例中,所述载体基因组包括:aav 5'itr、启动子、任选的增强子、任选的内含子、人pgrn的编码序列或包括其的融合蛋白、polya和aav 3'itr。在某些实施例中,所述载体基因组包括:aav 5'itr、启动子、任选的增强子、任选的内含子、人pgrn的编码序列或包括其的融合蛋白、polya和aav 3'itr。在某些实施例中,所述载体基因组包括:aav 5'itr、启动子、任选的增强子、任选的内含子、hupgrn编码序列、polya和aav 3'itr。在某些实施例中,所述载体基因组包括:aav2 5'itr、ef1a启动子、任选的增强子、任选的启动子、hupgrn、sv40 polya和aav2 3'itr。在某些实施例中,所述载体基因组是aav2 5'itr、ubc启动子、任选的增强子、任选的内含子、hupgrn、sv40 polya和aav2 3'itr。在某些实施例中,所述载体基因组是aav2 5'itr、cb7启动子、内含子、hupgrn、sv40 polya和aav2 3'itr。在某些实施例中,所述载体基因组是aav2 5'itr、cb7启动子、内含子、hupgrn、兔β珠蛋白polya和aav2 3'itr。参考例如seq id no:22(ef1a.hupgrn.sv40)、seq id no:23(ubc.pi.hupgrn.sv40)或seq id no:24(cb7.ci.hpgrn1.rgb)。hupgrn编码序列选自本说明书中定义的那些编码序列。参考例如seq id no:3或与其95%到99.9%相同的序列、或seq id no:4或与其95%到99.9%相同的序列、或如本文所定义的其片段。例如在seq id no:6(兔珠蛋白polya)、aav itr(seq id no:7和8)、人cmv ie启动子(seq id no:9)、cb启动子(seq id no:10)、嵌合内含子(seq id no:11)、ubc启动子(seq id no:12)、ef1a启动子(seq id no:17)、内含子(seq id no:13)和sv40晚期polya(seq id no:14)中提供了以
下实例中使用的载体元件的说明性序列。可以为本发明的某些实施例的载体基因组选择这些序列上的载体基因组或变型的其它元件。
[0061]
载体产生
[0062]
供产生aav病毒载体(例如,重组(r)aav)之用,表达盒可以携带在递送到包装宿主细胞的任何合适的载体(例如,质粒)上。可在本发明使用的质粒可以被工程化,使得其适合于在原核细胞、昆虫细胞、哺乳动物细胞以及其它细胞中进行体外复制和包装。合适的转染技术和包装宿主细胞是已知的和/或可以由本领域的技术人员容易地设计。
[0063]
用于产生和分离适合于用作载体的aav的方法是本领域已知的。通常参见例如grieger和samulski,2005,腺相关病毒作为基因疗法载体:载体开发、产生和临床应用(adeno
‑
associated virus as a gene therapy vector:vector development,production and clinical applications),《生物化学工程/生物技术进展(adv.biochem.engin/biotechnol)》99:119
‑
145;buning等人,2008,腺相关病毒载体技术的最新开发(recent developments in adeno
‑
associated virus vector technology),《基因医学杂志(j.gene med)》,10:717
‑
733;以及下文引用的参考文献,这些参考文献中的每个参考文献通过引用整体并入本文中。为了将转基因包装到病毒粒子中,itr是在与含有表达盒的核酸分子相同的构建体中需要的顺式的唯一aav组分。cap和rep基因可以反式供应。
[0064]
在一个实施例中,本文所描述的表达盒被工程化到基因元件(例如,穿梭质粒),所述基因元件将其上携带的免疫珠蛋白构建体序列转移到包装宿主细胞中以产生病毒载体。在一个实施例中,所选基因元件可以通过任何合适的方法递送到aav包装细胞,所述方法包含转染、电穿孔、脂质体递送、膜融合技术、高速dna包被的粒料、病毒感染和原生质体融合。也可以制备稳定的aav包装细胞。可替代地,表达盒可以用于产生除aav之外的病毒载体,或用于在体外产生抗体的混合物。用于制备此类构建体的方法对核酸操纵技术人员而言是已知的并且包含基因工程、重组工程以及合成技术。参见例如《分子克隆:实验室手册》,由green和sambrook编辑,冷泉港实验室出版社,冷泉港,纽约(2012)。
[0065]
术语“aav中间体”或“aav载体中间体”是指缺少包装在其中的所期望的基因组序列的组装的raav衣壳。这些也可以被称为“空”衣壳。此类衣壳可以不含有表达盒的可检测基因组序列,或者含有不足以实现基因产物的表达的仅部分包装的基因组序列。这些空衣壳是无功能的以将所关注的基因转移到宿主细胞。
[0066]
可以使用已知的技术产生本文所描述的重组腺相关病毒(aav)。参见例如wo 2003/042397;wo 2005/033321、wo 2006/110689;us 7588772 b2。此类方法涉及培养含有对aav衣壳蛋白进行编码的核酸序列的宿主细胞;功能性rep基因;至少由aav反向末端重复序列(itr)和转基因构成的表达盒;以及足够的辅助功能以允许将表达盒包装到aav衣壳蛋白中。已经描述了产生衣壳的方法、其编码序列以及产生raav病毒载体的方法。参见例如gao等人,《美国国家科学院院刊(proc.natl.acad.sci.u.s.a.)》,100(10),6081
‑
6086(2003)和us 2013/0045186a1。
[0067]
在一个实施例中,提供了一种可用于产生重组aav的产生细胞培养物。此类细胞培养物含有在宿主细胞中表达aav衣壳蛋白的核酸;适合于包装到aav衣壳中的核酸分子,例如含有aav itr和对基因产物进行编码的非aav核酸序列的载体基因组,所述基因产物可操
作地连接到引导产物在宿主细胞中进行表达的序列;以及足够的aav rep功能和腺病毒辅助功能,以允许将核酸分子包装到重组aav衣壳中。在一个实施例中,细胞培养物由哺乳动物细胞(例如,人胚肾293细胞以及其它细胞)或昆虫细胞(例如,杆状病毒)构成。
[0068]
通常,rep功能来自作为提供侧接载体基因组的itr的相同aav源。在本文中的实例中,选择了aav2 itr,并且使用了aav2 rep。在seq id no:27中重现了编码序列。任选地,可以选择其它rep序列或另一种rep源(以及任选地另一种itr源)。例如,所述rep可以是但不限于aav1 rep蛋白、aav2 rep蛋白;或rep 78、rep 68、rep 52、rep 40、rep68/78和rep40/52;或其片段;或另一种来源。任选地,rep和cap序列在细胞培养物中位于同一基因元件上。rep序列与cap基因之间可以存在间隔子。这些aav或突变aav衣壳序列中的任一种都可以在引导其在宿主细胞中表达的外源性调控控制序列的控制下。
[0069]
在一个实施例中,在合适的细胞培养物(例如,hek 293)细胞中制造细胞。用于制造本文所描述的基因疗法载体的方法包含本领域众所周知的方法,如产生用于产生基因疗法载体的质粒dna、产生载体以及纯化载体。在一些实施例中,基因疗法载体是aav载体,并且所产生的质粒是对aav基因组和所关注的基因进行编码的aav顺式质粒、含有aav rep和cap基因的aav反式质粒以及腺病毒辅助质粒。载体产生过程可以包含方法步骤,如开始细胞培养、进行细胞传代、接种细胞、用质粒dna转染细胞、将转染后培养基交换为无血清培养基以及采集含载体的细胞和培养基。
[0070]
在某些实施例中,raav.hpgrn的制造工艺涉及用质粒dna瞬间转染hek293细胞。通过在pall icellis生物反应器中对hek293细胞进行pei介导的三重转染来产生单批次或多批次。在可能的情况下,在一次性的、封闭的生物处理系统中通过澄清、tff、亲和色谱和阴离子交换色谱对所采集的aav材料依次进行纯化。
[0071]
所采集的含载体的细胞和培养基在本文中被称为粗细胞采集物。在又另一个系统中,通过用基于杆状病毒的载体进行感染来将基因疗法载体引入到昆虫细胞中。关于这些产生系统的综述,通常参见例如zhang等人,2009,“用于大规模重组腺相关病毒产生的腺病毒
‑
腺相关病毒杂合体(adenovirus
‑
adeno
‑
associated virus hybrid for large
‑
scale recombinant adeno
‑
associated virus production)”,《人类基因疗法(human gene therapy)》20:922
‑
929,这些参考文献中的每个参考文献的内容以全文引用的方式并入本文中。在以下美国专利中也描述了制备和使用这些及其它aav产生系统的方法,这些美国专利中的每个美国专利的内容通过引用整体并入本文中:5,139,941;5,741,683;6,057,152;6,204,059;6,268,213;6,491,907;6,660,514;6,951,753;7,094,604;7,172,893;7,201,898;7,229,823;和7,439,065,这些文献通过引用并入本文中。
[0072]
此后,可以使粗细胞采集物经受另外的方法步骤,如浓缩载体采集物、渗滤载体采集物、微流化载体采集物、核酸酶消化载体采集物、过滤经微流化的中间体、通过色谱粗纯化、通过超速离心法粗纯化、通过切向流过滤进行缓冲液交换和/或调配和过滤以制备大量载体。
[0073]
在高盐浓度下进行两步亲和色谱纯化,然后使用阴离子交换树脂色谱来纯化载体药物产物并去除空衣壳。在于2016年12月9日提交的国际专利申请第pct/us2016/065970号中更详细地描述了这些方法,所述国际专利申请通过引用并入本文中。针对于2016年12月9日提交的国际专利申请第pct/us2016/065976号中的aav8、以及于2016年12月9日提交、还
于2015年12月11日提交的题为“avrh10的可扩展纯化方法(scalable purification method for aavrh10)”的国际专利申请第pct/us16/66013号中的rh10、以及于2016年12月9日提交的国际专利申请第pct/us2016/065974号中的aav1、于2015年12月11日提交的“aav1的可扩展纯化方法(scalable purification method for aav1)”的纯化方法全部通过引用并入本文中。
[0074]
为了计算空颗粒和完整颗粒的含量,将所选样品(例如,在本文的实例中经过碘克沙醇(iodixanol)梯度纯化的制剂,其中gc#=颗粒#)的vp3带体积相对于加载的gc颗粒进行作图。所得线性等式(y=mx c)用于计算测试品峰的带状体积中的颗粒的数量。然后将加载的每20μl颗粒数量(pt)乘以50,以得到颗粒(pt)/ml。将pt/ml除以gc/ml得到颗粒与基因组拷贝的比率(pt/gc)。pt/ml
‑
gc/ml得到空pt/ml。空pt/ml除以pt/ml并且
×
100得到空颗粒的百分比。
[0075]
通常,用于测定具有包装的基因组的空衣壳和aav载体颗粒的方法是本领域已知的。参见例如grimm等人,《基因疗法》(1999)6:1322
‑
1330;sommer等人,《分子疗法(molec.ther.)》(2003)7:122
‑
128。为了测试变性的衣壳,所述方法包含使经处理的aav原液经受sds
‑
聚丙烯酰胺凝胶电泳(由能够分离三种衣壳蛋白的任何凝胶组成,例如在缓冲液中含有3
‑
8%三乙酸盐的梯度凝胶),然后运行凝胶直到分离出样品材料,并且将凝胶印迹到尼龙或硝酸纤维素膜(优选地是尼龙)上。然后,将抗aav衣壳抗体用作与变性的衣壳蛋白结合的初级抗体,优选地抗aav衣壳单克隆抗体,最优选地b1抗aav2单克隆抗体(wobus等人,《病毒学杂志》(2000)74:9281
‑
9293)。然后使用次级抗体,所述次级抗体与初级抗体结合并且含有一种用于检测与初级抗体的结合的装置,更优选地是含有与其共价结合的检测分子的抗igg抗体,最优选地是与辣根过氧化物酶共价连接的绵羊抗小鼠igg抗体。一种用于检测结合的方法用于半定量地确定初级抗体与次级抗体之间的结合,优选地是能够检测放射性同位素发射、电磁辐射或比色变化的检测方法,最优选地是化学发光检测试剂盒。例如,对于sds
‑
page,可以从柱级分中提取样品并在含有还原剂(例如,dtt)的sds
‑
page上样缓冲液中加热,并且在预制的梯度聚丙烯酰胺凝胶(例如,novex)上解析衣壳蛋白。可以根据制造商的说明使用silverxpress(加利福尼亚州英杰公司)或其它合适的染色方法(即sypro红宝石色或考马斯染色)进行银染色。在一个实施例中,可以通过定量实时pcr(q
‑
pcr)测量柱级分中的aav载体基因组(vg)的浓度。将样品稀释并用dnase i(或另一种合适的核酸酶)消化以去除外源性dna。在核酸酶失活后,使用引物和对引物之间的dna序列具有特异性的taqman
tm
荧光探针进一步稀释和扩增样品。在applied biosystems prism 7700序列检测系统上测量每种样品达到定义的荧光水平所需的周期的数量(阈值周期,ct)。含有与aav载体中所含序列相同的序列的质粒dna用于在q
‑
pcr反应中产生标准曲线。从样品获得的周期阈值(ct)的值用于通过相对于质粒标准曲线的ct值对其进行归一化来确定载体基因组效价。也可以使用基于数字pcr的端点测定。
[0076]
一方面,使用了经过优化的q
‑
pcr方法,所述方法利用了广谱丝氨酸蛋白酶,例如蛋白酶k(如可从凯杰公司(qiagen)商购获得)。更具体地,经过优化的qpcr基因组效价测定与标准测定类似,不同之处在于在dnase i消化之后,将样品用蛋白酶k缓冲液稀释并用蛋白酶k处理,然后进行热失活。合适地,以等于样品大小的量用蛋白酶k缓冲液稀释样品。蛋白酶k缓冲液可以浓缩2倍或更多倍。通常,蛋白酶k处理为约0.2mg/ml,但是可以在0.1g/ml
到约1mg/ml之间变化。处理步骤通常在约55℃下进行持续约15分钟,但是可以在较低温度(例如,约37℃到约50℃)下进行持续较长的时间段(例如,约20分钟到约30分钟),或者在较高的温度(例如,最高约60℃)下进行持续较短的时间段(例如,约5到10分钟)。类似地,热失活通常在约95℃下持续约15分钟,但是温度可以降低(例如,约70℃到约90℃)并且时间延长(例如,约20分钟到约30分钟)。然后将样品稀释(例如,1000倍),并如标准测定中所描述的进行taqman分析。
[0077]
另外地或可替代地,可以使用液滴数字pcr(ddpcr)。例如,已经描述了用于通过ddpcr确定单链和自身互补aav载体基因组效价的方法。参见例如m.lock等人,《人类基因疗法方法》,2014年4月;25(2):115
‑
25.doi:10.1089/hgtb.2013.131.电子出版2014年2月14日。
[0078]
简而言之,用于从基因组缺陷型aav中间体中分离具有包装的基因组序列的raav颗粒的方法涉及使包括重组aav病毒颗粒和aav衣壳蛋白中间体的悬浮液经受高效液相色谱,其中aav病毒颗粒和aav中间体与在高ph下平衡的强阴离子交换树脂结合,并经受盐梯度,同时监测洗脱液在约260和约280下的紫外线吸光度。可以基于所选aav调整ph。参见例如wo 2017/160360(aav9)、wo 2017/100704(aavrh10)、wo 2017/100676(例如,aav8)和wo 2017/100674(aav1),这些通过引用并入本文中。在此方法中,当a260/a280的比率达到拐点时,从洗脱的级分中收集aav完整衣壳。在一个实例中,对于亲和色谱步骤,可以将经过渗滤的产物应用于有效捕获aav2血清型的capture select
tm poros
‑
aav2/9亲和树脂(生命科技公司(life technologies))上。在这些离子条件下,显著百分比的残留的细胞dna和蛋白质流过柱,而aav颗粒则被有效捕获。
[0079]
组合物
[0080]
本文提供了一种组合物,所述组合物含有至少一种raav.hpgrn原液(例如,raav原液)以及任选的载体、赋形剂和/或防腐剂。raav原液是指多个raav载体,所述多个raav载体的量与例如在下文关于浓度和剂量单位的讨论中描述的量相同。
[0081]
在某些实施例中,组合物包括病毒原液,所述病毒原液是适用于治疗颗粒蛋白前体相关的额颞痴呆(ftd)的重组aav(raav),所述raav包括:(a)腺相关病毒1衣壳;以及(b)包装在aav衣壳中的载体基因组,所述载体基因组包括aav反向末端重复序列、人颗粒蛋白前体的编码序列以及引导所述颗粒蛋白前体表达的调控序列。在某些实施例中,所述载体基因组包括启动子、增强子、内含子、人pgrn编码序列以及聚腺苷酸化信号。在某些实施例中,所述内含子由鸡β肌动蛋白剪接供体和兔β剪接受体元件组成。在某些实施例中,所述载体基因组进一步包括侧接所述载体基因组的所有元件的aav2 5'itr和aav2 3'itr。
[0082]
可以将优选地悬浮于生理上相容的载体中的raav.hpgrn施用于人或非人哺乳动物患者。在某些实施例中,为了施用于人类患者,将raav适当地悬浮于含有盐水、表面活性剂和生理上相容的盐或盐的混合物的水溶液中。合适地,将调配物调整到生理上可接受的ph,例如,在ph 6到9、或ph 6.5到7.5、ph 7.0到7.7或ph 7.2到7.8的范围内。由于脑脊液的ph为约7.28到约7.32或者ph为7.2到7.4,对于鞘内递送,可能期望在此范围内的ph;而对于静脉内递送,可能期望的ph为约6.8到约7.2。然而,可以选择最宽范围和这些子范围内的其它ph用于其它递送途径。
[0083]
在某些实施例中,调配物可以含有不包括碳酸氢钠的缓冲盐水溶液。此类调配物
可以含有缓冲盐水溶液,所述缓冲盐水溶液包括水中的磷酸钠、氯化钠、氯化钾、氯化钙、氯化镁以及其混合物中的一种或多种,如哈佛缓冲液(harvard's buffer)。水溶液可以进一步含有p188,即可从basf商购获得的泊洛沙姆,其先前以商品名f68出售。水溶液的ph可以为7.2或7.4。
[0084]
在另一个实施例中,调配物可以含有缓冲盐水溶液,所述缓冲盐水溶液包括1mm磷酸钠(na3po4)、150mm氯化钠(nacl)、3mm氯化钾(kcl)、1.4mm氯化钙(cacl2)、0.8mm氯化镁(mgcl2)和0.001%188。参见例如harvardapparatus.com/harvard
‑
apparatus
‑
perfusion
‑
fluid.html。在另一个实施例中,优选的是哈佛缓冲液。
[0085]
在其它实施例中,调配物可以含有一种或多种渗透增强剂。合适的渗透增强剂的实例可以包含例如甘露醇、甘氨胆酸钠、牛磺胆酸钠、脱氧胆酸钠、水杨酸钠、辛酸钠、癸酸钠、月桂基硫酸钠、聚氧乙烯
‑9‑
月桂基醚或edta。
[0086]
在另一个实施例中,组合物包含载体、稀释剂、赋形剂和/或佐剂。鉴于转移病毒所针对的适应症,本领域的技术人员可以容易地选择合适的载体。例如,一种合适的载体包含盐水,其可以与多种缓冲溶液(例如,磷酸盐缓冲盐水)一起调配。其它示例性载体包含无菌盐水、乳糖、蔗糖、磷酸钙、明胶、葡聚糖、琼脂、果胶、花生油、芝麻油和水。缓冲液/载体应包含防止raav粘附到输液管道上但不干扰raav体内结合活性的组分。
[0087]
任选地,除了raav和载体之外,组合物还可以含有其它常规药物成分,如防腐剂或化学稳定剂。适合的示例性防腐剂包含氯丁醇、山梨酸钾、山梨酸、二氧化硫、没食子酸丙酯、对羟基苯甲酸酯、乙基香草醛、甘油、苯酚以及对氯苯酚。适合的化学稳定剂包含明胶和白蛋白。
[0088]
如本文所使用的,“载剂”包含任何和所有溶剂、分散介质、媒剂、涂层、稀释剂、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂、缓冲剂、载剂溶液、悬浮液、胶质物等。将此类培养基和药剂用于药物活性物质在本领域中是众所周知的。还可以将补充性活性成分并入到组合物中。短语“药学上可接受的”是指当向宿主施用时不会产生过敏或类似不良反应的分子实体和组合物。递送媒剂(如脂质体、纳米胶囊、微颗粒、微球、脂质颗粒、囊泡等)可以用于将本发明的组合物引入到合适的宿主细胞中。具体地,raav载体递送的转基因可以被调配成用于递送或包封在脂质颗粒、脂质体、囊泡、纳米球或纳米颗粒等中。
[0089]
在一个实施例中,组合物包含适合于递送到受试者的最终调配物,所述组合物是例如缓冲到生理上相容的ph和盐浓度的水性液体悬浮液。任选地,调配物中存在一种或多种表面活性剂。在另一个实施例中,可以将组合物作为稀释以施用于受试者的浓缩物运输。在其它实施例中,可以在施用时将组合物冻干并重构。
[0090]
可以从无毒的非离子表面活性剂中选择合适的表面活性剂或表面活性剂的组合。在一个实施例中,选择终止于伯羟基的双官能嵌段共聚物表面活性剂,例如f68[basf],也被称为泊洛沙姆(poloxamer)188,其具有中性ph,平均分子量为8400。可以选择其它表面活性剂和其它泊洛沙姆,即非离子型三嵌段共聚物,所述非离子型三嵌段共聚物由与聚氧乙烯(聚(环氧乙烷))的两个亲水链侧接的聚氧丙烯(聚(环氧丙烷))的中心疏水链、solutol hs 15(聚乙二醇
‑
15羟基硬脂酸酯)、labrasol(聚氧辛酸甘油酯)、聚氧10油醚、tween(聚氧乙烯山梨聚糖脂肪酸酯)、乙醇和聚乙二醇构成。在一个实施例中,调配物含有泊洛沙姆。这些共聚物通常以字母“p”(对于泊洛沙姆)命名,后跟三个数字:前两位数字
×
100给出了聚氧丙烯核的近似分子量,并且最后一位数字
×
10给出了聚氧乙烯含量的百分比。在一个实施例中,选择了泊洛沙姆188。表面活性剂可以以悬浮液的至多约0.0005%到约0.001%的量存在。
[0091]
以足够的量施用载体以转染细胞并提供足够水平的基因转移和表达,以便提供治疗益处,而不会产生过度的副作用或具有医学上可接受的生理作用,这可以由医学领域的技术人员确定。任选地,可以使用除鞘内施用之外的途径,例如,直接递送至需要的器官(例如,肝脏(任选地通过肝动脉)肺、心脏、眼睛、肾脏)、口腔、吸入、鼻内、气管内、动脉内、眼内、静脉内、肌肉内、皮下、皮肤内和其它胃肠外施用途径。如果需要,可以组合施用途径。
[0092]
病毒载体的剂量将主要取决于如所治疗的病状、患者的年龄、体重和健康状况等因素,并且因此在患者之间可能有所不同。例如,病毒载体的治疗有效人剂量通常在约25到约1000微升到约100ml溶液范围内,所述溶液含有浓度为约1
×
109到1
×
10
16
的基因组病毒载体(以治疗平均体重为70kg的受试者),包含所述范围内的整数或分数量,并且对于人类患者,优选地为1.0
×
10
12
gc到1.0
×
10
14
gc。在一个实施例中,将组合物调配成每剂量含有至少1
×
109、2
×
109、3
×
109、4
×
109、5
×
109、6
×
109、7
×
109、8
×
109或9
×
109gc,包含所述范围内的所有整数或分数量。在另一个实施例中,将组合物调配成每剂量含有至少1
×
10
10
、2
×
10
10
、3
×
10
10
、4
×
10
10
、5
×
10
10
、6
×
10
10
、7
×
10
10
、8
×
10
10
或9
×
10
10
gc,包含所述范围内的所有整数或分数量。在另一个实施例中,将组合物调配成每剂量含有至少1
×
10
11
、2
×
10
11
、3
×
10
11
、4
×
10
11
、5
×
10
11
、6
×
10
11
、7
×
10
11
、8
×
10
11
或9
×
10
11
gc,包含所述范围内的所有整数或分数量。在另一个实施例中,将组合物调配成每剂量含有至少1
×
10
12
、2
×
10
12
、3
×
10
12
、4
×
10
12
、5
×
10
12
、6
×
10
12
、7
×
10
12
、8
×
10
12
或9
×
10
12
gc,包含所述范围内的所有整数或分数量。在另一个实施例中,将组合物调配成每剂量含有至少1
×
10
13
、2
×
10
13
、3
×
10
13
、4
×
10
13
、5
×
10
13
、6
×
10
13
、7
×
10
13
、8
×
10
13
或9
×
10
13
gc,包含所述范围内的所有整数或分数量。在另一个实施例中,将组合物调配成每剂量含有至少1
×
10
14
、2
×
10
14
、3
×
10
14
、4
×
10
14
、5
×
10
14
、6
×
10
14
、7
×
10
14
、8
×
10
14
或9
×
10
14
gc,包含所述范围内的所有整数或分数量。在另一个实施例中,将组合物调配成每剂量含有至少1
×
10
15
、2
×
10
15
、3
×
10
15
、4
×
10
15
、5
×
10
15
、6
×
10
15
、7
×
10
15
、8
×
10
15
或9
×
10
15
gc,包含所述范围内的所有整数或分数量。在一个实施例中,对于人类应用,剂量的范围可以为每剂量1
×
10
10
到约1
×
10
12
gc,包含所述范围内的所有整数或分数量。
[0093]
在某些实施例中,剂量在约1
×
109gc/g脑质量到约1
×
10
12
gc/g脑质量的范围内。在某些实施例中,剂量在约1
×
10
10
gc/g脑质量到约3.33
×
10
11
gc/g脑质量的范围内。在某些实施例中,剂量在约3.33
×
10
11
gc/g脑质量到约1.1
×
10
12
gc/g脑质量的范围内。在某些实施例中,剂量在约1.1
×
10
12
gc/g脑质量到约3.33
×
10
13
gc/g脑质量的范围内。在某些实施例中,剂量低于3.33
×
10
11
gc/g脑质量。在某些实施例中,剂量低于1.1
×
10
12
gc/g脑质量。在某些实施例中,剂量低于3.33
×
10
13
gc/g脑质量。
[0094]
在某些实施例中,剂量为约1
×
10
10
gc/g脑质量。在某些实施例中,剂量为约2
×
10
10
gc/g脑质量。在某些实施例中,剂量为约2
×
10
10
gc/g脑质量。在某些实施例中,剂量为约3
×
10
10
gc/g脑质量。在某些实施例中,剂量为约4
×
10
10
gc/g脑质量。在某些实施例中,剂量为约5
×
10
10
gc/g脑质量。在某些实施例中,剂量为约6
×
10
10
gc/g脑质量。在某些实施例中,剂量为约7
×
10
10
gc/g脑质量。在某些实施例中,剂量为约8
×
10
10
gc/g脑质量。在某些实
施例中,剂量为约9
×
10
10
gc/g脑质量。在某些实施例中,剂量为约1
×
10
11
gc/g脑质量。在某些实施例中,剂量为约2
×
10
11
gc/g脑质量。在某些实施例中,剂量为约3
×
10
11
gc/g脑质量。在某些实施例中,剂量为约4
×
10
11
gc/g脑质量。
[0095]
在某些实施例中,剂量以范围为约1.44
×
10
13
到4.33
×
10
14
gc的raav的固定剂量施用于人类。在某些实施例中,剂量以范围为约1.44
×
10
13
到2
×
10
14
gc的raav的固定剂量施用于人类。在某些实施例中,剂量以范围为约3
×
10
13
到1
×
10
14
gc的raav的固定剂量施用于人类。在某些实施例中,剂量以范围为约5
×
10
13
到1
×
10
14
gc的raav的固定剂量施用于人类。
[0096]
在一些实施例中,可以以剂量单位调配组合物以含有范围为约1
×
10
13
到8
×
10
14
gc的raav的aav的量。在一些实施例中,可以以剂量单位调配组合物以含有范围为约1.44
×
10
13
到4.33
×
10
14
gc的raav的raav的量。在一些实施例中,可以以剂量单位调配组合物以含有范围为约3
×
10
13
到1
×
10
14
gc的raav的raav的量。在一些实施例中,可以以剂量单位调配组合物以含有范围为约5
×
10
13
到1
×
10
14
gc的raav的raav的量。
[0097]
在某些实施例中,raav是以单剂量施用于受试者的。在某些实施例中,需要多个剂量(例如,2个剂量)。
[0098]
将调整剂量以平衡治疗益处与任何副作用,并且这种剂量可以根据采用重组载体的治疗应用而变化。可以监测转基因的表达水平以确定所得病毒载体的剂量频率,优选地含有迷你基因的aav载体。任选地,与出于治疗目的描述的剂量方案类似的剂量方案可以用于使用本发明的组合物进行免疫。
[0099]
如本文所使用的,术语“鞘内递送”或“鞘内施用”是指通过注射到椎管中,更具体地注射到蛛网膜下腔中使得其到达脑脊液(csf)的药物施用途径。鞘内递送可以包含腰椎穿刺、心室内(包含脑室内(icv))、枕骨下/脑池内和/或c1
‑
2穿刺。例如,可以通过腰椎穿刺引入材料以在整个蛛网膜下腔扩散。在另一个实例中,可以向小脑延髓池中注射或通过实质内递送注射。在某些实施例中,raav是通过计算机断层扫描(ct)引导的枕骨下注射施用于小脑延髓池中(小脑延髓池内)的。在某些实施例中,向患者施用单剂量。
[0100]
如本文所使用的,术语“脑池内递送”或“脑池内施用”是指药物直接进入到小脑延髓池(cisterna magna cerebellomedularis)的脑脊液中,更具体地是通过枕骨下穿刺或通过直接注射到小脑延髓池(cisterna magna)中或通过永久定位的管的施用途径。
[0101]
在某些实施例中,raav.hpgrn的原液是在鞘内最终调配缓冲液(itffb;具有0.001%普朗尼克f
‑
68的人工csf)中调配的。一个或多个批次被冻结,随后被解冻,在需要时被合并,被调整到目标浓度,通过0.22μm过滤器无菌过滤,并且装满小瓶。在某些实施例中,包括调配缓冲液raav1.hpgrn的悬浮液被调整成ph为7.2到7.4。
[0102]
在一个实施例中,可以由本领域的技术人员确定用于递送本文所提供的raav1.hpgrn的剂量的体积以及浓度。例如,可以选择约1μl到150ml的体积,其中对于成人而言,选择更大的体积。通常,对于新生婴儿,合适的体积为约0.5ml到约10ml,对于年龄较大的婴儿,可以选择约0.5ml到约15ml。对于幼儿,可以选择约0.5ml到约20ml的体积。对于儿童,可以选择至多约30ml的体积。对于青春期前的少年和青少年,可以选择最大约50ml的体积。在仍其它实施例中,患者可以接受鞘内施用的体积选择为约5ml到约15ml或约7.5ml到约10ml。可以确定其它合适的体积和剂量。将调整剂量以平衡治疗益处与任何副作用,并
且此类剂量可以根据采用重组载体的治疗应用而变化。
[0103]
在某些实施例中,组合物包括:raav.ef1a.hupgrn.sv40、raav.ubc.pi.hupgrn.sv40或raavcb7.ci.hpgrn1.rgb。以下实例中展示了其中raav衣壳为aavhu68、aav5或aav1的组合物。在特别优选的实施例中,raav是aav1。在某些实施例中,hupgrn编码序列选自本说明书中所定义的那些编码序列。参考例如seq id no:3或与其95%到99.9%相同的序列、或seq id no:4或与其95%到99.9%相同的序列、或如本文所定义的其片段。例如在seq id no:6(兔珠蛋白polya)、aav itr(seq id no:7和8)、人cmv ie启动子(seq id no:9)、cb启动子(seq id no:10)、嵌合内含子(seq id no:11)、ubc启动子(seq id no:12)、ef1a启动子(seq id no:17)、内含子(seq id no:13)和sv40晚期polya(seq id no:14)中提供了以下实例中使用的载体元件的说明性序列。
[0104]
用途
[0105]
如本文所使用的,pgrn单倍型不足是指pgrn基因中有突变的患者,所述突变导致有缺陷的pgrn和/或有缺陷的grn水平。raav1
‑
pgrn疗法的目标群体包含患有pgrn单倍型不足的患者和/或在其它方面具有有缺陷的pgrn或有缺陷的grn水平的患者。在某些实施例中,患者对于pgrn突变是杂合的。在又另一个实施例中,患者对于pgrn突变是纯合的。在某些实施例中,结合本文所提供的raav1介导的hpgrn疗法向患者施用免疫抑制方案。
[0106]
在某些实施例中,raav1.pgrn可用于治疗患有grn单倍型不足的患者。此类患者可能已经被诊断患有由grn单倍型不足引起的成人发作性神经退行性病变或者可能是有症状前的。raav1.pgrn可以通过计算机断层扫描(ct)引导的枕骨下注射以单剂量施用于小脑延髓池中(小脑延髓池内[icm])。以预定剂量水平施用单剂量。通过在nhp中进行的单icm注射实现的优越的脑转导导致选择此施用途径。在某些实施例中,与另一种施用途径(例如,注射到侧脑室中)相比,向icm中施用载体还导致降低的抗pgrn t细胞应答。一旦采用常见程序,icm注射(也称为枕骨下穿刺术)先前就已经被腰椎穿刺代替。然而,可以选择其它剂量水平和递送途径和/或与此raav1介导的hpgrn疗法结合使用。
[0107]
在某些实施例中,本文所描述的raav1介导的疗法可以在约平均、正常、生理水平下向不具有gnr突变(单倍型不足)的人类提供pgrn表达。然而,即使pgrn表达的增加低于正常水平,但是治疗可以提供治疗效果,从而提供正常平均水平的约40%到99%,例如,35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或这些范围之间的其它数值。在某些实施例中,这可能是由高于治疗前患者的表达水平至少5%到约70%或更多的增加的pgrn水平导致的。在某些实施例中,治疗提供了治疗功效,其中施用raav1介导的hpgrn导致csf中的pgrn水平升高(例如,比正常水平高出10倍到40倍)。
[0108]
在某些实施例中,通过以下中的一个或多个评估功效:csf中增加的pgrn水平和/或脑皮质厚度的变化。在某些实施例中,如通过以下中的一个或多个测量的,在施用单icm剂量之后评估raav1介导的疗法的功效:如通过小型精神状态检查(mmse)、临床整体变化印象量表(cgi
‑
c)、额叶功能评定量表(fab)、额颞痴呆评定量表(frs)、额叶行为量表(fbi)、帕金森氏病统一评定量表(updrs)、言语流畅性测试、额颞叶变性的临床痴呆量表
‑
总和(cdr
‑
ftld sb)和/或神经精神量表(npi)评估的延长存活期和改善的临床症状和日常功能。在某些实施例中,功效是通过神经丝轻链(nfl)的csf水平、τ、磷酸化τ和炎性标志物和/或增加的pgrn血浆水平改善展示的。在某些实施例中,功效是通过测量小胶质细胞增生水
平的降低或逆转评估的。
[0109]
在某些实施例中,功效是通过与grn患者相关的临床症状中的一个或多个临床症状的改善测量的,包含例如行为缺陷(去抑制、冷漠、失去同情心或同理心、强迫或刻板行为、或口部过度活动)和认知缺陷(执行功能下降,而对情节记忆或视觉空间技能没有显著影响)。
[0110]
在某些实施例中,在一些其它更多的非典型症状中观察到改善,包含精神病特征(妄想、幻觉和强迫行为)和/或其它认知缺陷(情节记忆障碍、失用症和视觉空间功能障碍)。可以使用可以被评价的ftdc标准进行评估,包含额叶和/或颞叶退化体征的脑成像、临床评定量表上对减退的评估(如额颞叶变性的临床痴呆评定[cdr
‑
ftld]、额叶行为量表[fbi]、神经精神量表[npi]和额颞痴呆评定量表[frs])以及最终地用于确认致病grn突变的基因检测。可以使用包含τ和淀粉样蛋白
‑
β的脑脊髓液(csf)生物标志物以及淀粉样蛋白正电子发射断层扫描(pet)成像。
[0111]
在某些实施例中,在患有特征为与言语和语言相关的症状的原发性进行性失语(ppa)的grn突变携带者中观察到改善。可以使用基于梅苏拉姆(mesulam)标准的指南诊断所述携带者,所述梅苏拉姆标准可以区分ppa的三种临床变异:语义变异ppa(svppa)、迟滞型变异ppa(nfvppa)和logopenic型变异ppa(ivppa)(gomo
‑
tempini等人,(2011),“原发性进行性失语及其变体的分类(classification of primary progressive aphasia and its variants)”,《神经学(neurology)》,76(11):1006
‑
14)。nfvppa呈现出产生言语能力的缺陷,并且核心特征包含语言产生时的语法缺失、言语费力和言语失用症。svppa呈现出理解词语意义能力的缺陷,并且核心特征包含受损的词语命名和单字理解。ivppa的特征在于说话时难以找到适当的词语,而不伴随有词语理解的减退。ivppa的核心特征在于词语检索和重复句子的能力的缺陷。grn突变携带者最常见呈现出nfvppa;然而,所述携带者可能具有跨越ppa临床表现的更广泛的症状,从而导致“未另行说明的ppa”的诊断(gomo
‑
tempini等人,2011;woollacott and rohrer,2016)。
[0112]
提供了一种治疗患有与grn单倍型不足相关的神经退行性病状的人类患者的方法。在某些实施例中,这种病状是颗粒蛋白前体相关的额颞叶痴呆(ftd)。所述方法包括通过具有腺相关病毒1(aav1)衣壳的重组腺相关病毒(raav)将颗粒蛋白前体的编码序列递送到中枢神经系统(cns),所述raav进一步包括包装在aav衣壳中的载体基因组,所述载体基因组包括aav反向末端重复序列、人颗粒蛋白前体的编码序列以及引导所述颗粒蛋白前体表达的调控序列。
[0113]
提供了一种用于治疗患有与颗粒蛋白前体相关的额颞叶痴呆相关的脑病变或与grn单倍型不足相关的另一种神经退行性病状的人类患者的方法。所述方法包括通过具有腺相关病毒1(aav1)衣壳的重组腺相关病毒(raav)向中枢神经系统(cns)施用颗粒蛋白前体的编码序列,所述raav进一步包括包装在aav衣壳中的载体基因组,所述载体基因组包括aav反向末端重复序列、人颗粒蛋白前体的编码序列以及引导所述颗粒蛋白前体表达的调控序列。
[0114]
在某些实施例中,本文所提供的方法可以进一步包括通过以下监测治疗:(a)无创评估作为脑病变减少的预测因子的患者视网膜贮积病变减少;(b)进行磁共振成像以评估脑体积;和/或(c)测量所述csf中的颗粒蛋白前体的浓度。任选地,可以评估血浆中的颗粒
蛋白前体浓度。
[0115]
在某些实施例中,通过以下中的一个或多个评估raav.hpgrn组合物的功效:原发性认知、原发性行为或认知/其它方法。下文描述了合适的评估。
[0116]
原发性认知评估包含言语流畅性测试、ftld的临床痴呆比率或小型精神状态检查(mmse)。言语流畅性测试将可能通过向每位受试者呈现相同的图片/照片并要求其口头描述来进行。在描述期间,将对言语的速率(词语/分钟)进行计数、记录,并最终将其与反映神经标准成年人的速率进行比较。cdr
‑
ftld是经典cdr的扩展版本,所述典型cdr在过去用于评定阿尔茨海默氏病谱系病症的严重程度。评估包含cdr的原始6个领域(记忆、取向、判断以及解决问题、社区事务、家庭和爱好、个人护理)以及两个另外的领域:语言和行为,这允许对ftld减退的检测具有更高灵敏度。评定为“0”表明正常行为或语言,而得分为“1”、“2”或“3”表明轻度到重度缺陷。“总和”或单独领域得分的总和用于确定总体痴呆严重程度。mmse是临床和研究实践中广泛使用的11个问题的总体认知评估。如“今年是哪一年?哪个季节?日期?周几?哪个月?”等问题会被问到,并且每个正确答案得一分,其中每个问题会有最高得分。最高总得分为30分,其中24分和27分为两个截止值。这些截止值是认知减退的指标。
[0117]
原发性动作评估包含例如帕金森氏病统一评定量表(updrs)。updrs是对与帕金森症相关的若干个领域(如日常生活的精神、行为和情绪以及活动)的42项、4部分的评估。每个项包含范围通常为0(通常表明无损害)到4(通常表明最严重的损害)的评定量表。每个部分的得分被记录以提供疾病的严重程度的指示,其中最高得分199分表明最坏/最多的完全残废。
[0118]
原发性行为评估包含例如神经精神量表(npi)或额叶行为量表(fbi)。npi用于阐明患有脑病症的患者的精神病理学的表现。最初,npi被开发用于阿尔茨海默氏病群体中;然而,npi对评估其它病状的行为变化可能是有用的。评估由10个行为领域和2个植物性神经系统区域组成,其中有4个得分:频率、严重程度、总痛苦和照顾者痛苦。npi总得分是通过将行为领域的域得分相加,再减去照顾者痛苦得分得到的。fbi是旨在评估特别与bvftd相关的行为和性格的变化并且区分ftd与其它痴呆的24项评估。fbi以面对面访谈的形式施用于主要照顾者,因为诊断患有bvftd的患者总体对这些类型的变化没有足够的洞察力。fbi集中于若干个行为和性格相关区域,对每个问题的评分从0(无)到3(严重/大多数时间)。总得分提供了对疾病的严重程度的深刻理解,并且可以用于评估随时间推移的变化。
[0119]
其它/认知和动作评估两者包含例如哥伦比亚自杀严重程度评定量表(c
‑
ssrs)、临床整体变化印象量表(cgi
‑
c)、额叶功能评定量表(fab)和/或额颞叶痴呆评定量表(fdr)。c
‑
ssrs是3部分量表,通过评估自杀意念和行为的问题测定自杀意念、意念强度与自杀行为。这种评估的结果由直接从量表中得出的自杀行为致死率评定、自杀意念得分和自杀意念强度排名构成。基于评估指南,大于0的意念得分可能表明需要干预。强度评定的范围为0到25,其中0代表不认可自杀意念。cgi
‑
c是由临床医生观察者评定的3项构成的简洁的、广泛使用的评估的三个部分之一。从参与研究开始,无论是否有完全因为治疗而出现的改善,cgi
‑
c以7点量表进行评定,范围为1(很大程度上改善)到7(非常糟糕)。fab是简单评估,以帮助区分具有额叶执行功能表型的痴呆与阿尔茨海默类型的痴呆。fab尤其可用于轻度痴呆的患者(mmse>24)。评估由强调认知、动作和行为区域的6个部分组成,总得分为18,
并且较高得分表明更好的表现。fdr是针对患有额颞叶痴呆的简洁分期评估,其检测ftd亚型随时间推移的疾病进展差异。这种简要访谈对主要照顾者进行,并且由分类为从未发生、有时或总是的30个项组成。然后计算得分百分比,并将其转换成罗吉特(logit)得分,并且最终转换成严重程度得分。严重程度得分的范围将为非常轻度到极严重。
[0120]
功效的其它度量包含症状发作之后从诊断点起增加的存活期,所述存活期是功效的度量。当前,诊断患有由grn突变引起的神经退行性病变的患者的期望寿命为从症状发作起7
‑
11年。功效的另一个度量是中间额叶皮质和腔壁区域的厚度的萎缩的稳定和/或增加,所述中间额叶皮质和腔壁区域是目标群体中所有临床表现的最常受影响的脑区域。这可以使用mrt或其它成像技术评估。仍其它评估包含生物化学生物标志物。csf和血浆中的pgrn蛋白的水平被测量为aav转导的读数,并且预计在施用raav1.hpgrn之后在患者体内增加。在其它实施例中,评估了神经丝轻链(nfl)、τ、磷酸化τ和其它炎性标志物的csf水平。在某些实施例中,调节和/或降低这些生物标志物水平与功效相关。
[0121]
尽管下文的实例集中于与杂合grn单倍型不足相关的某些病状的治疗,但是在某些实施例中,本文所述的载体和组合物可以用于治疗其它疾病,例如与grn基因的纯合突变相关的疾病,如神经元蜡样脂褐质沉积症、癌症(例如,卵巢癌、乳腺癌、肾上腺癌和/或胰腺癌)、动脉粥样硬化、2型糖尿病和新陈代谢疾病。
[0122]
如本文中所使用的,术语计算机断层摄影(ct)是指放射线照相术,其中通过计算机由沿着轴线制成的一系列平面横截面图像构建身体结构的三维图像。
[0123]
当提及核酸或其片段时,术语“基本同源性”或“基本类似性”表示当与另一个核酸(或其互补链)的适当核苷酸插入或缺失进行最佳比对时,至少约95到99%的比对序列具有核苷酸序列同一性。优选地,同源性在全长序列、或其开放阅读框或长度为至少15个核苷酸的另一个合适的片段上。本文描述了合适片段的实例。
[0124]
在核酸序列的上下文中,术语“序列同一性”、“序列同一性百分比”或“相同百分比”是指两个序列中的残基在比对以获得最大对应性时是相同的。期望序列同一性比较的长度可以超过基因组的全长、基因编码序列的全长或至少约500到5000个核苷酸的片段。然而,也可能期望较小片段之间的同一性,例如至少约九个核苷酸,通常至少约20到24个核苷酸、至少约28到32个核苷酸、至少约36个或更多个核苷酸。类似地,对于氨基酸序列,在蛋白质的全长或其片段上,可以容易地确定“序列同一性百分比”。合适地,片段长度为至少约8个氨基酸,并且可以高达约700个氨基酸。本文描述了合适片段的实例。
[0125]
当提及氨基酸或其片段时,术语“基本同源性”或“基本类似性”表示当与另一个氨基酸(或其互补链)的适当核苷酸插入或缺失进行最佳比对时,至少约95到99%的比对序列具有氨基酸序列同一性。优选地,同源性在全长序列、或其蛋白质(例如,cap蛋白、rep蛋白、或其长度为至少8个氨基酸、或更期望地至少15个氨基酸的片段)上。本文描述了合适片段的实例。
[0126]
术语“高度保守的”意指至少80%同一性、优选地至少90%同一性,并且更优选地超过97%同一性。通过使用本领域技术人员已知的算法和计算机程序,本领域技术人员可以容易地确定同一性。
[0127]
通常,当提及两种不同的腺相关病毒之间的“同一性”、“同源性”或“类似性”时,参考“比对”序列来确定“同一性”、“同源性”或“类似性”。“比对”序列或“比对”是指与参考序
列相比,通常含有对丢失的或另外的碱基或氨基酸的校正的多个核酸序列或蛋白质(氨基酸)序列。在实例中,使用公开的aav9序列作为参考点执行aav比对。使用多种公开或可商购获得的多序列比对程序中的任一种进行比对。此类程序的实例包含“clustalω”、“clustal w”、“cap序列组装”、“map”和“meme”,这些程序可通过因特网上的web服务器进行访问。此类程序的其它来源是本领域技术人员已知的。可替代地,也使用了载体nti实用程序。本领域已知的许多算法可以用于测量核苷酸序列同一性,包含上述程序中包含的那些。作为另一个实例,可以使用gcg 6.1版本的程序fasta
tm
比较多核苷酸序列。fasta
tm
提供了查询序列与搜索序列之间最佳重叠区的比对和序列同一性百分比。例如,核酸序列之间的序列同一性百分比可以是使用如gcg6.1版本中所提供的采用其默认参数(字号6和评分矩阵的nopam系数)的fasta
tm
所确定的,所述程序通过引用并入本文中。多个序列比对程序也可用于氨基酸序列,这些程序例如“clustalω”、“clustal x”、“map”、“pima”、“msa”、“blockmaker”、“meme”和“match
‑
box”程序。通常,以默认设置使用这些程序中的任何程序,尽管本领域技术人员可以根据需要改变这些设置。可替代地,本领域技术人员可以利用另一种算法或计算机程序,所述算法或程序提供至少与通过参考算法和程序所提供的一样水平的同一性或比对。参见例如j.d.thomson等人,《核酸研究(nucl.acid.res.)》,“多个序列比对的全面比较(a comprehensive comparison of multiple sequence alignments)”,27(13):2682
‑
2690(1999)。
[0128]
应注意的是,术语“一个(a)”或“一个(an)”是指一个或多个。如此,术语“一个(a)”或“一种(an)”、“一或多个”以及“至少一个”在本文可互换地使用。
[0129]
词语“包括(comprise)”、“包括(comprises)”和“包括(comprising)”将被解释为是包含性而非排他性的。词语“由
……
组成(consist)”、“由
……
组成(consisting)”及其变体将被解释为是排他性的而非包含性。虽然说明书中的各个实施例是使用“包括”语言来呈现的,但是在其它情况下,也意图使用“由
……
组成”或“基本上由
……
构成”的语言来解释和描述相关的实施例。
[0130]
如本文所使用的,除非另有说明,否则术语“约”意指相对于给定参考的10%(
±
10%,例如,
±
1、
±
2、
±
3、
±
4、
±
5、
±
6、
±
7、
±
8、
±
9和
±
10或其之间的数值)的变化性。
[0131]
如本文所使用的,“疾病”、“病症”和“病状”可互换地用于指示受试者的异常状态。
[0132]
除非在本说明书中另有定义,否则本文所使用的技术术语和科学术语具有与本领域的普通技术人员和参照公开文本所通常理解的相同含义,这为本领域的技术人员提供了本技术中使用的许多术语的通用指南。
[0133]
术语“表达”在本文中以其最广泛的含义使用,并且包括rna或rna和蛋白质的产生。关于rna,术语“表达”或“翻译”尤其涉及肽或蛋白质的产生。表达可以是暂时的或可以是稳定的。
[0134]
如本文所使用的,“表达盒”是指包括编码序列、启动子并可以包含其的其它调节序列的核酸分子,所述盒可以通过基因元件(例如,质粒)递送到包装宿主细胞,并包装到病毒载体(例如,病毒颗粒)的衣壳中。通常,用于产生病毒载体的此类表达盒含有本文所描述的基因产物的编码序列,所述编码序列侧接病毒基因组的包装信号和其它表达控制序列,如本文描述的序列。
[0135]
如本文所使用的,术语“可操作地连接”是指与所关注的基因邻接的表达控制序列
以及以反式或在远处起作用以控制所关注的基因的表达控制序列两者。
[0136]
术语“异源性”当结合蛋白质或核酸使用时表明蛋白质或核酸包括在自然界中未发现彼此间的相同关系的两个或更多个序列或子序列。例如,核酸通常是重组地产生的,具有来自不相关基因的布置成产生新的功能性核酸的两个或更多个序列。例如,在一个实施例中,核酸具有来自一种基因的布置成引导编码序列从不同基因表达的启动子。因此,关于编码序列,启动子是异源的。
[0137]
在本发明的上下文中,术语“转译”涉及核糖体的过程,其中mrna链控制氨基酸序列的组装以产生蛋白质或肽。
[0138]
以下实例仅是说明性的,并且不旨在限制本发明。
[0139]
实例
[0140]
[0141]
[0142]
[0143]
[0144][0145]
实例1:材料与方法
[0146]
载体
[0147]
将工程化的人pgrn cdna克隆到表达构建体中,所述表达构建体含有鸡β肌动蛋白启动子与巨细胞病毒早期增强子、嵌合内含子和兔β珠蛋白聚腺苷酸化序列(图1)。将第二工程化的人pgrn cdna克隆到含有人泛素c启动子的表达构建体中。表达构建体侧接有aav2反向末端重复序列。通过如前所述的hek293细胞的三重转染和碘克沙醇纯化由此构建体产生腺相关病毒血清型1、5和人68(aavhu68)(lock m等人,《人类基因疗法》2010;21(10):1259
‑
71)。
[0148]
动物程序
[0149]
所有动物方案均经宾夕法尼亚大学的机构动物护理和使用委员会(the institutional animal care and use committee of the university of pennsylvania)批准。从杰克逊实验室(the jackson laboratory)购买育种对grn敲除小鼠(库存编号013175),并且将集落维持在宾夕法尼亚大学。野生型c57bl/6(库存编号000664)用作对照。在第一项研究中,用异氟醚麻醉2月龄的小鼠并且以5μl的体积向侧脑室(icv)注射1
×
10
11
载体基因组拷贝(gc)。注射后60天,在氯胺酮/甲苯噻嗪麻醉下通过放血对小鼠实施安乐死,并且通过颈脱位法证实死亡。在第二项研究中,处理7月龄小鼠并在11月龄时处死小鼠。尸检时,通过心脏穿刺收集血清,并且使用连接到聚乙烯管的32号针通过枕骨下穿刺收集csf。在干冰上立即冷冻血清和csf样品,并且将其储存在
‑
80度下直到分析为止。收集额叶皮质以用于生物化学分析,并在干冰上立即冷冻,而脑的其余部分被固定在10%福尔马林中以用于组织学分析。
[0150]
从科文斯(covance)购买3到4岁的恒河猴。对于载体施用,通过肌内右美托咪定和氯胺酮镇静动物,并施用单小脑延髓池内(icm)注射3
×
10
13
gc的含aav载体的1ml人工csf。如前所述,使用荧光镜(oec9800 c
‑
arm,ge)通过脊髓造影核实针放置(katz n等人,《人类基因疗法》,2018年10月;29(5):212
‑
219)。通过过量巴比妥酸盐对动物实施安乐死。在干冰上立即冷冻所收集的组织,或将所收集的组织固定在10%福尔马林中以用于组织学分析。
[0151]
组织学和成像
dis.)》2009;199(3):381
‑
90)。
[0159]
统计学
[0160]
使用单向anova进行野生型、grn敲除和aav处理的grn敲除小鼠的hex酶活性、脂褐质计数和cd68 面积的对比,随后是事后图克多重比较检验。
[0161]
实例2:人grn转基因在鼠类疾病模型中的aav介导的递送
[0162]
使用如例如wo 2018/160582中描述的公开的三重转染技术产生重组aav载体,所述重组aav载体具有表达在cb7启动子和嵌合内含子(cb7.ci.hpgrn.rbg)的控制下的人pgrn(seq id no:3)的aavhu68衣壳。
[0163]
评估人grn转基因在grn敲除小鼠模型中的aav介导的递送。对grn突变杂合的小鼠(grn
/
‑
)没有表现出grn相关的神经退行性疾病的病理特征,这可能是因为小鼠寿命不允许产生grn单倍型不足的后遗症,所述后遗症在几十年后首次在人类中表现出来。相比之下,grn
‑
/
‑
小鼠中的完整pgrn缺陷概括了人类grn单倍型不足的若干个早期特征,如溶酶体功能受损、自发荧光溶酶体贮积物质(脂褐质)累积和小胶质细胞活化,尽管grn
‑
/
‑
小鼠甚至在高达两岁时没有表现出神经元脱失(lui h等人,《细胞(cell)》,2016;165(4):921
‑
35;ward me等人,《科学转化医学》,2017年4月12日,9(385):pii:eaah5642)。据报告,grn
/
‑
和grn
‑
/
‑
小鼠两者表现出行为异常,但小组之间的结果并不一致(ahmed z等人,《美国病理学杂志(am j pathol.)》,2010;177(1):311
‑
24;wils h等人,《病理学杂志(the journal of pathology)》,2012;228(1):67
‑
76;ghoshal n等人,《疾病神经生物学(neurobiology of disease)》,2012;45(1):395
‑
408;filiano aj等人,《神经学杂志:神经科学学会官方杂志(the journal of neuroscience:the official journal of the society for neuroscience)》,2013;33(12):5352
‑
61;yin f等人,《美国实验生物学会联合会杂志(the faseb journal.)》,2010;24(12):4639
‑
47)。同样,一些报告表明grn
‑
/
‑
小鼠的存活率降低,而其它报告发现grn
‑
/
‑
小鼠的寿命正常,这与我们的经验一致(ahmed z等人,《美国病理学杂志》,2010;177(1):311
‑
24;wils h等人,《病理学杂志(the journal of pathology)》,2012;228(1):67
‑
76)。虽然grn
‑
/
‑
小鼠没有表现出明显的神经退行性病变或神经学体征,但与人类grn单倍型不足显著的生物化学和组织学相似性使其成为评估新疗法的潜在信息模型。因此,分析集中在grn
‑
/
‑
小鼠的这些生物化学和组织学发现。
[0164]
本研究的目的是评估将人grn基因递送到脑是否可以消除grn
‑
/
‑
小鼠中现有的溶酶体贮积物质并使溶酶体功能归一化。响应于溶酶体贮积,细胞上调溶酶体酶的表达,所述溶酶体酶可以用作溶酶体贮积病的生物标志物(hinderer c等人,《分子疗法:美国基因治疗学会杂志》,2014;22(12):2018
‑
27;gurda bl等人,《分子疗法:美国基因治疗学会杂志》2016;24(2):206
‑
16;karageorgos le等人,《实验细胞研究(experimental cell research)》,1997;234(1):85
‑
97)。评价了来自不同年龄grn
‑
/
‑
和grn
/
小鼠的脑组织中的溶酶体酶氨基己糖苷酶的活性以及皮质、海马体和丘脑中的脂褐质沉积物的活性(图3a
‑
图3d)。在整个生命中升高的氨基己糖苷酶活性是明显的,而脂褐质表现出进行性累积。脂褐质早在2个月大时就是显而易见的,这与以前的发现一致(klein za等人,《神经元(neuron)》,2017;95(2):281
‑
96e6)。最初的研究是基于天然分离物aavhu68使用aav载体进行的,所述天然分离物与分支f分离物aav9密切相关。通过脑室内(icv)注射表达人grn的aavhu68载体或媒剂(pbs)处理2
‑
3月龄的grn
‑
/
‑
小鼠(n=每组10只)。另外,用媒剂注射一组
野生型小鼠(n=10)。由于2月龄小鼠的小尺寸使得通过icm途径可靠地施用载体变得有挑战性,所述icm途径是用于nhp研究和所提议的fih临床试验的roa,因此使用了icv roa(涉及将aav载体直接注射到的脑室的csf中)。先前的研究表明,以针对此研究选定的剂量(10
11
gc)icv施用aavhu68会导致转导局限于靠近所注射的脑室的脑区域,从而使所述脑区域成为有用系统以评价是否可以通过小细胞群体分泌pgrn来实现脑病变的整体改善。
[0165]
载体施用后两个月,对动物实施安乐死,并且收集脑、csf和血清。脑中的人pgrn蛋白水平的定量证实了aav处理组的转导(图4a
‑
4f)。pgrn是可以在csf中测量到的分泌蛋白,并且在grn突变携带者的csf中减少(lui h等人,《细胞》,2016;165(4):921
‑
35;meeter lh等人,《老年痴呆症及老年认知障碍摘录(dement geriatr cogn dis extra)》,2016;6(2):330
‑
40)。因此,评估了aav处理的grn
/
‑
小鼠的csf中的pgrn蛋白水平,这揭示出平均csf浓度为14ng/ml,而在媒剂处理组中,人pgrn低于检测水平(图4a
‑
图4f)。在aav处理的grn
‑
/
‑
小鼠的脑中,通过使溶酶体酶表达归一化来实现pgrn的表达,其中hex活性水平恢复到接近正常水平(图4a
‑
图4f)。
[0166]
在确认grn
‑
/
‑
小鼠的脑中的pgrn表达之后,评估pgrn表达是否减少了海马体、丘脑和皮质中的脂褐质沉积物的数量。为此目的,将未染色的固定脑切片安装在盖玻片上,并且对自发荧光脂褐质进行成像并以盲检方式进行定量。与媒剂处理的grn
‑
/
‑
小鼠相比,aav处理的grn
‑
/
‑
小鼠表现出所有脑区域中的脂褐质减少,并且与年龄匹配的野生型对照的脂褐质水平类似(图4a
‑
图4f)。
[0167]
最初的概念验证表明当贮积物质刚刚开始出现在脑中时在早期处理的小鼠中的aav介导的pgrn表达的治疗活性。随后评估了基因转移对具有更严重既往病理的老年小鼠的影响。在本研究中,7月龄grn
‑
/
‑
小鼠接受单icv注射表达人pgrn的aavhu68载体或媒剂,并在11月龄时处死。除了大量脑脂褐质沉积物(图5a
‑
图5d)之外,11月龄grn
‑
/
‑
小鼠表现出与患有由grn突变引起的ftd的患者类似的大量小胶质细胞增生(图6a
‑
图6c)(ahmed z等人,《神经炎症杂志(journal of neuroinflammation)》,2007年2月11日;4:7)。grn基因转移减少了老年小鼠的脑hex活性和脂褐质沉积物,这与在年轻小鼠体内的发现类似(图5a
‑
图5d)。另外,使经处理的小鼠的脑中的小胶质细胞的大小和数量归一化(图6a
‑
图6c)。
[0168]
向grn
‑
/
‑
小鼠的脑icv递送表达人pgrn的aav载体累积地清除了脂褐质聚集体并且使溶酶体酶活性几乎完全归一化,从而表明pgrn基因递送可以有效校正grn相关神经退行性病的潜在病理生理学的关键方面。
[0169]
实例3:非人灵长类动物中的aav介导的grn基因转移
[0170]
grn
‑
/
‑
小鼠中的发现表明,向csf中递送aav载体可以实现足够的脑转导,以产生治疗水平的pgrn并且阻止或逆转与pgrn缺陷相关的生物化学和组织学发现。为了将这种方法平移到人类中,使用icm递送(即载体施用的临床相关途径)在非人灵长类动物中进行研究。通过注射向小脑延髓池中鞘内aav递送是微创方法,所述方法产生比通过腰椎穿刺更广泛的脑转导(hinderer c等人,《分子疗法方法与临床发展(molecular therapy methods&clinical development)》,2014;1:14051)。利用3
‑
10岁的nhp,因为此年龄代表预期的成年患者群体。通过单图像引导的icm注射向恒河猴(n=每组2只)施用表达来自被称为hpgrn的转基因(seq id no:3)的在鸡ba启动子和cmv ie增强子(被称为cb7启动子)的控制下的人grn的aav1、aav5或aavhu68载体。使用携带表达来自泛素c启动子(ubc)的不同工程化的转
基因序列(hpgrn v2,seq id no:4)的aavhu68载体处理另外的组。每周测量csf中的人颗粒蛋白前体水平,并且在注射后35天处死动物以用于组织病理学分析。进行初步安全性分析,包含每日笼侧观察、连续身体检查、全血计数、血清化学组、csf化学和细胞学以及对脑和脊髓进行显微镜评估的全尸检。下表中总结了处理组。
[0171][0172]
载体施用之后,在所有nhp的csf中检测到稳健pgrn表达(图7a)。使用aavhu68载体处理的两只动物表现出比健康人类对照的csf人pgrn水平高多达10倍并且类似于逆转grn
‑
/
‑
小鼠的脑中的溶酶体异常的水平的csf人pgrn水平。aav5处理产出了与aavhu68大致相当的csf表达水平。使用aav1载体处理的动物中的人pgrn的表达是最大的,达到超过40倍的正常人类水平。测试来自使用aavhu68和aav1载体处理的nhp的csf和血浆样品对人pgrn的抗体。所有四只动物对人转基因产物产生抗体(图8a
‑
8c),这可以解释研究结束时减退的表达水平。在csf中出现的抗人pgrn抗体应答与转基因表达水平相关,更早在aav1组中达到峰值。
[0173]
icm aav递送在所有处理组中耐受良好。在日常观察、身体检查、全血计数或血清化学组中未鉴定出处理相关的异常。类似于其它利用异种转基因的icm aav研究(hordeaux j等人,《分子疗法方法临床发展(mol ther methods clin dev.)》2018;10(79
‑
88)),csf分析揭示出在注射所有载体血清型后7
‑
21天开始的无症状淋巴细胞的脑脊液细胞增多,反射出对转基因产物的抗体应答(图8a
‑
图8c)。csf细胞计数从峰值水平下降,但对于大部分动物在尸检时保持升高。评估aav1处理组和aavhu68处理组的脑和脊髓的组织病理学。发现与先前的icm aav研究类似(hordeaux j等人,《分子疗法方法临床发展》,2018;10:79
‑
88;hordeaux j等人,《分子疗法方法临床发展》,2018;10:68
‑
78),其中在脑膜和脉络丛中鉴定出偶尔少量淋巴细胞浸润,并且在一些背根神经节(drg)和脊髓切片中鉴定出感觉神经元和其相关轴突的变性。如在之前的icm aav研究中,感觉神经元发现通常具有最小到轻度严重程度,并且与临床体征不相关(gurda bl等人,《分子疗法:美国基因治疗学会杂志》),2016;24(2):206
‑
16;hordeaux j等人,《分子疗法方法临床发展》,2018;10:79
‑
88;hordeaux j等人,《分子疗法方法临床发展》,2018;10:68
‑
78)。任何动物的脑实质中都没注意到载体相关的异常。
[0174]
在向非人灵长类动物icm施用aav1和aavhu68载体之后的cns转导的不同模式
[0175]
使用aav1载体处理的nhp的csf中的明显更高的pgrn表达进一步探索了aav1、aav5和aavhu68载体的转导模式的差异。向nhp单icm注射表达gfp报告基因的aav1、aav5或aavhu68载体(3
×
10
13
gc,n=每种载体2只)。注射后28天处死动物以对脑转导进行组织学分析。
[0176]
免疫组织化学揭示贯穿用aav1和aavhu68载体处理的nhp的脑的弥漫性、分散的转导(未示出)。最低转导在接受aav5载体的动物的脑中是明显的。为了更准确地表征aav1与aavhu68之间转导的差异,研发了半自动化方法来定量从多个脑区域收集的切片中的经转
导的细胞。使用针对gfp的荧光标记的抗体和特定细胞类型的标志物对切片进行染色,分别通过neun、olig2和gfap染色定量神经元、少突胶质细胞和星形胶质细胞的总数,随后是定量每种类型的表达gfp的细胞(图9、图10)。aav1和aavhu68各自转导所检查的所有区域中的小于1%的每种细胞类型。神经元的转导在两种载体之间几乎是相当的,而aavhu68似乎转导了稍微更多数量的星形胶质细胞和少突胶质细胞。
[0177]
考虑到使用aav1实现的显著更高的csf pgrn水平,使用aav1和aavhu68载体观察到的大致相当的脑转导是出乎意料的。通过免疫组织化学评估用aavhu68处理的动物和用aav1处理的动物ra1826的侧脑室和第四脑室的多个区域中的室管膜细胞转导。有趣的是,来自含有脑室系统的部分的aav1处理的动物(ra1826)的多个脑切片表明沿脑室排列成行的室管膜细胞的广泛转导,这在aavhu68处理的动物中没有观察到(未示出)。平均48%的室管膜细胞跨所有采样区域转导,包含侧脑室的额角、颞角和后角和第四脑室。相比之下,只有1
‑
2%的室管膜细胞在给予aavhu68载体的动物的相同脑区域中被转导。可在第二aav1处理的动物中评估一个侧脑室的仅小区段,这示出大约1%的室管膜细胞转导,尽管分析限于小采样区域。这些发现表明,考虑到两种血清型之间的其它细胞类型的转导看起来类似,aav1处理的动物中的高度转导的室管膜细胞可能是csf中的高水平pgrn的来源。由所分泌的pgrn介导的旁观者效应使由grn突变引起的ftd对aav基因疗法异常适合。由于细胞外pgrn可以被神经元摄取,因此使用aav1载体获得的高csf pgrn水平——显然由稳健的室管膜细胞转导介导——使aav1成为grn基因疗法的理想选择。
[0178]
实例4:重组aav1.pgrn
[0179]
raav1.pgrn是使用以下通过hek293细胞的三重质粒转染产生的:1)对侧接有aav itr的转基因盒进行编码的aav顺式质粒(称为penn.aav.cb7.ci.hpgrn.rbg.kanr);2)对aav2 rep和aav1 cap基因进行编码的aav反式质粒(称为paav2/1.kanr);以及3)辅助腺病毒质粒(称为padδf6.kanr)。包装载体基因组的raav1.pgrn的大小为4129个碱基。
[0180]
a.aav载体基因组质粒序列元件
[0181]
来自顺式质粒的载体基因组(称为penn.aav.cb7.ci.hpgrn.rbg.kanr(p4862))的线性映射。参考图2。
[0182]
顺式质粒含有以下载体基因组序列元件:
[0183]
1.反向末端重复序列(itr):itr是源自侧接载体基因组的所有组分的aav2(130个碱基对[bp],genbank:nc_001401)的相同、相反互补序列。当以反式方式提供aav和腺病毒辅助功能时,itr功能既充当载体dna复制的起点,又充当载体基因组的包装信号。如此,itr序列表示载体基因组复制和包装所需的唯一顺式序列。
[0184]
2.人巨细胞病毒立即早期增强子(cmv ie):从人源性cmv(382bp,genbank:k03104.1)获得的这种增强子序列增加了下游转基因的表达。
[0185]
3.鸡β肌动蛋白启动子(ba):选择这种普遍存在的启动子(282bp,genbank:x00182.1)以驱动任何cns细胞类型中的转基因表达。
[0186]
4.嵌合内含子(ci):混合内含子由鸡β肌动蛋白剪接供体(973bp,genbank:x00182.1)以及兔β珠蛋白剪接受体元件组成。内含子是转录的,但却通过剪接从成熟的mrna中去除,从而将其任一侧的序列放在一起。表达盒中内含子的存在已经示出有助于将mrna从核转运到细胞质,因此增强用于翻译的稳定水平的mrna的累积。这是旨在用于增加
pcr)”,《人类基因疗法方法》,25(2):115
‑
25。
[0196]
实例5:鉴定grn
‑
/
‑
小鼠模型中raav1.pgrn的最小有效剂量
[0197][0198]
raav1.pgrn的不同剂量对grn
‑
/
‑
小鼠模型中的cns病变的影响评估如下。疗效是通过脑贮积病理学(脂褐质)的减少程度来评估的,所述减少程度用作与疾病病理生理学直接相关的定量结果度量。此外,还包含包括末端采血,以进行全血细胞计数和血清化学组以及目标器官的组织病理学分析,以鉴定在nhp毒理学研究中可能未检测到的疾病特异性毒性。在大量脂褐质贮积存在时,在5
‑
6个月龄时处理小鼠,以复制患有grn单倍型不足的老年受试者的疾病状态。通过icv注射,grn
‑
/
‑
小鼠接受四个剂量的raav1.pgrn(1.30
×
10
11
gc、4.40
×
10
10
gc、1.30
×
10
10
gc或4.40
×
109gc)中的一个或媒剂(itffb[具有0.001%普朗尼克f
‑
68的人工csf])(n=每组15只)。用媒剂(n=15)处理的grn
/
小鼠用作正常对照。处理之后90天处死动物,采集脑并进行切片,并且对脂褐质病变进行定量。med是由示出脑贮积病变相对于媒剂处理的grn
‑
/
‑
小鼠显著减少的剂量确定的,并且显著性是使用单向anova确定的,如果适用,随后是图克多重比较检验(α=0.05)。
[0199]
实例6:非人灵长类动物中的毒理学研究
[0200]
raav1.cb7.ci.hpgrn.rbg是由血清型aav1组成的非复制的重组腺相关(aav)载体,所述aav载体含有在鸡β肌动蛋白启动子与巨细胞病毒增强子和兔β珠蛋白聚腺苷酸化序列的控制下的工程化的人颗粒蛋白前体(pgrn)cdna,所述兔β珠蛋白聚腺苷酸化序列侧接有在鞘内最终调配缓冲液(itffb)中调配的aav血清型2反向末端重复序列。ddpcr滴度为2.04
×
10
13
gc/ml。itffb的ph被调整到ph 7.4,以使测试品产品的溶解度最大化。在给药当天制备对照制品。将经稀释的制品保持在湿冰上或2
‑
8℃下,直到在同一天给药为止。
[0201]
在成年恒河猴中进行90天符合glp的安全性研究,以研究icm施用后raav1.pgrn的毒理学。此研究利用3
‑
10岁的nhp,因为此年龄代表预期的成年人患者群体。选择90天的评估期,因为这给予分泌的转基因产物足以在施用icm aav后达到稳定的平台水平的时间。恒河猴接受三个剂量水平,总共
‑
3.00
×
10
12
gc、总共1.00
×
10
13
gc或总共3.00
×
10
13
gc(n=每剂量3只)的raav1.hpgrn中的一个或媒剂(itffb;n=2)。当按脑质量(假定小鼠脑为0.4并且恒河猴脑为90g)缩放时,选择的剂量水平与在计划的最低有效剂量(med)研究中评估的剂量相当。执行基线神经检查、临床病理学(具有差异的细胞计数、临床化学和凝血板)、csf化学和csf细胞学。在施用raav1.pgrn或媒剂之后,每日监测动物的不适和异常行为迹象。
[0202]
在raav1.pgrn或媒剂施用后30天,每周一次进行血液和csf临床病理学评估以及神经检查,随后是每30天进行一次。在基线处以及此后的每30天时间点处,通过干扰素γ(ifn
‑
γ)酶联免疫斑点(elispot)测定来评估抗aav1中和抗体(nab)以及对aav1和raav1.pgrn转基因产物的细胞毒性t淋巴细胞(ctl)应答。
[0203][0204][0205]
在raav1.pgrn或媒剂施用后90天,对动物实施安乐死,并且采集组织以进行全面的显微镜组织病理学检查。另外,在尸检时,从肝、脾和骨髓中采集淋巴细胞以评估在这些器官中对衣壳和转基因产物两者均具有反应性的t细胞的存在。
[0206]
通过qpcr评估组织样品中的载体生物分布。在血清和csf样品中也定量了载体基因组。通过分析在尿液和粪便中检测到的载体基因组来评估载体排泄。这些分析仅针对最高剂量队列进行,因为之前的研究已经证明,icm施用后的载体分布模式是不依赖于剂量的,而且在基于qpcr的生物分布测定中,更高的载体剂量产生更大的总体信号,允许对靶组织中的载体沉积的检测具有最高的灵敏度(hordeaux等人,2018b)。
[0207]
神经传导速度评估
[0208]
使用氯胺酮/右旋美托咪定对动物进行麻醉。以侧卧位或背卧位将经麻醉的动物置于手术台上,使用热敷来维持体温。不建议使用电子保温装置,因为可能会干扰电信号采集。
[0209]
对于感觉神经传导研究(ncs),将刺激器探针定位在正中神经上方,其中阴极距记录位点最近,并且将两个针电极在远节指骨(参考电极)和近节指骨(记录电极)的水平处皮下插入指ii,而将接地电极放置在刺激探针(阴极)的近侧。使用儿科刺激器。所引发的应答被不同程度地放大并显示在监测器上。为了确认缺少背景电信号,初始采集刺激强度被设置为0.0ma。为了找到最佳刺激位置,将刺激强度增加到10.0ma,并且在探针沿正中神经移动时产生一连串刺激,直到找到如由最后波形确定的最佳位置为止。将探针保持在最佳位置处,刺激强度逐渐地逐步增加,直到峰值振幅响应不再增加为止。每个刺激反应都被记录下来并保存在软件中。对正中神经的多达10个最大刺激取平均值并报告。测量从记录点到刺激阴极的距离(cm)并将其输入到软件中,并且利用应答的起始潜伏期和距离(cm)计算传导速度。报告了感觉神经动作电位(snap)振幅的传导速度和平均值两者。从双侧测试正中神经。由仪器生成的所有原始数据都保留为研究文件的一部分。
[0210]
图11a和图11b示出了来自nhp中正中感觉神经传导研究的结果。在所施用的剂量
下没有观察到对正中感觉神经传导的影响。初步组织学分析示出主要在drg、trg、脊髓的背侧白质束和周围神经内的发现(图12a
‑
12d)。这些发现由脊髓的背侧白质束和周围神经内的drg/trg内的神经元变性和轴突变性(即轴突病)组成。总的来说,在所有经处理的组中都观察到这些发现;然而,在两个时间点上,来自中剂量组和高剂量组的个体动物的发病率和严重程度趋于较高。
[0211]
考虑到grn相关神经退行性疾病的严重程度,期望icm施用raav1.pgrn的益处/风险特性保持有利的。
[0212]
实例7:人试验
[0213]
执行了在患有由grn基因突变引起的成人发作性神经退行性疾病的患者中单施用raav1.hpgrn的首次人体试验fih 1/2期剂量递增研究(参见下表)。raav1.hpgrn被设计成替代grn基因。这项fih研究评估了安全性和耐受性,并且收集了对功效的初步数据。使用raav1.hpgrn处理最多12例有症状的杂合grn突变载体患者,并且最初随访2年(24个月)时间段,其中给药后继续长期随访5年。本研究提供数据以支持使用1/2期最大耐受剂量(mtd)的登记研究的启动。本登记研究评估raav1.hpgrn对与疾病相关的临床结果和生物标志物的影响。所有试验都包含向患有grn相关神经退行性疾病的成年患者施用单icm剂量的raav1.hpgrn。
[0214]
[0215]
[0216][0217]
施用途径和手术
[0218]
在第1天,将raav1.hpgrn作为单剂量通过ct
‑
引导的枕骨下注射施用到小脑延髓池中。在第1天,在适当滴度下的含有5.6ml的raav1.hpgrn的注射器是通过与本研究相关的研究药房制备的,并被递送到操作间。
[0219]
在研究药物施用之前,受试者是麻醉的、插管的,而且使用消毒技术准备好注射部位并将其覆盖。进行lp以去除预定体积的csf,之后it注射碘化造影剂,以辅助可视化小脑延髓池的相关解剖结构。可以在针插入之前或期间iv施用造影剂,以替代it造影剂。根据执行手术的介入医师的判断决定是否使用iv或it造影剂。在荧光镜引导下,将脊柱针(22
‑
25g)推进到小脑延髓池中。较大的导引针可以用于协助针放置。在确认针放置之后,将扩展套件附接到脊柱针上,并用csf填充。根据介入医师的判断,可以将含有造影剂材料的注射器连接到扩展套件上,并注入少量造影剂材料以确认针在小脑延髓池中的放置。在确认针放置之后,将含有raav1.hpgrn的注射器连接到扩展套件。在1
‑
2分钟内缓慢注射注射器内含物,以递送5.0ml的体积。
[0220]
在研究计划中规定的时间进行安全性评估,包含收集不良事件(ae)、身体/神经检查、生命体征、临床实验室(血清化学、血液学、凝血、lft、尿液分析)、ecg、神经传导研究和csf细胞学和化学(细胞计数、蛋白质、葡萄糖)。
[0221]
没有计划对安全评价进行统计学比较;所有结果仅是描绘性的。列出数据并产生汇总表。
[0222]
对次级端点和探究性端点执行统计学比较。将每个时间点的测量结果与每个受试
者的基线值进行比较,并且将来自健康志愿者和grn患者的自然病史数据与每个端点可用的相当的队列特性进行比较。所有数据都呈现在受试者数据列表中。使用频率和百分比汇总分类变量,并且使用描述性统计(未丢失的观察数、均值、标准偏差、中值、最小值和最大值)汇总连续变量。图形显示以适当形式呈现。
[0223]
由grn单倍型不足引起的成人发作性神经退行性病变的早期临床表现是异质的。随着疾病进展,这种异质性导致具有另外症状的多种诊断。由于患者通常在症状发作后迅速衰退,因此任何诊断患有神经退行性病变的患者都可以被治疗,只要所述患者被证实具有致病性杂合grn突变。可以利用cdr
‑
ftld整体评分筛查患者。这个评定量表被设计成评估患有ftld谱系诊断的患者的疾病严重程度。由于ftld相关症状与其它grn相关诊断重叠以及在cdr
‑
ftld整体评分中捕获的领域(记忆、取向判断和问题解决、社区事务、家庭和爱好、个人护理、行为和语言)的数量,这个量表可以用于诊断。cdr
‑
ftld整体评分大于0.5(包含轻度症状患者)并且小于或等于1将允许在神经退行性病变的早期阶段对有症状患者进行治疗,在此阶段基因疗法的益处可能最大化。在这一早期阶段对患者进行治疗允许随后检测疾病进展中的变化或稳定,并延迟另外症状的发作。然而,这个群体中的cdr
‑
ftld评分最低为0.5的要求排除了动作突出诊断的参与,因为所述量表没有优化以捕获动作表型的缺陷。
[0224]
不期望这种基因疗法产生高于生理水平的pgrn表达。使用非临床nhp研究中高于将用于fih试验中的剂量的raav1.hpgrn剂量,发现在raav1.hpgrn icm施用之后,pgrn在血清中表达的水平接近正常水平。由于纳入fih试验中的受试者最初的循环pgrn水平为正常水平的大约30%,预计循环血清pgrn水平可能会恢复正常。通过全血细胞计数(cbc)组筛查患者的血液工作(bloodwork),并且在随访时间点通过mri对脑和上脊柱进行钆造影来监测患者的肿瘤持续5年。
[0225]
除了测量安全性和耐受性作为主要端点外,基于当前文献并且与专注于研究grn相关神经退行性病变的主要临床医生协商来选择此研究的次级和探究性功效端点。这些端点跟踪临床结果和疾病生物标志物,目的是鉴定后续登记试验的适当端点。
[0226]
因为由grn突变引起的神经退行性病变最终会导致死亡,所以raav1.hpgrn对患者存活率的影响也是此研究的功效端点。然而,研究的持续时间和样品大小可能不足以证明存活率益处,因为大多数患者从症状发作起预期寿命为7
‑
11年。
[0227]
评估raav1.hpgrn对患者的临床症状和日常功能的影响。由于目标患者群体表现出的表型异质性,因此采用了捕获在整个临床表现范围内表达的症状进展的功能和临床量表。所提议的研究利用fab、frs、mmse、cgi
‑
c、npi和fbi来测量随时间推移的变化。这些量表主要测量告知疾病的各种临床表现的进展或稳定性的认知、语言、神经心理行为和与日常功能有关的能力。还包含updrs以于捕获运动症状的变化。在fih中,这些功效评估在本质上是探究性的,并且旨在捕获raav.hpgrn随时间推移稳定症状减退的能力。来自fih的关于具有不同临床表现的患者的各种临床参数进一步下降的速率的数据用于进一步告知适当端点的选择,并限定登记试验的临床上有意义的变化。
[0228]
每个临床量表简述如下:
[0229]
主要测量认知功能的临床量表
[0230]
cdr
‑
ftld:cdr
‑
ftld是经典临床痴呆评定(cdr)量表的扩展版本,所述典型cdr在
过去用于评定ad谱系病症的严重程度。评估包含cdr的原始六个领域(记忆、取向、判断以及解决问题、社区事务、家庭和爱好、个人护理)。还包含两个另外领域——语言和行为,这允许对ftld谱系患者的减退的检测具有更高灵敏度。评定得分“0”表明正常行为或语言,而得分为1、2或3表明轻度到重度缺陷。cdr
‑
ftld总和(cdr
‑
ftld sb)表示单独领域的总和,并且用于确定总体痴呆严重程度。
[0231]
mmse:mmse是临床和研究实践中广泛使用的11个问题的总体认知评估。如“今年是哪一年?哪个季节?日期?周几?哪个月?”等问题会被问到,并且每个正确答案得一分,其中每个问题会有最高得分。最高总得分为30分,其中24分和27分为两个截止值。这些截止值是认知减退的指标。
[0232]
言语流畅性测试:虽然不是所提议的探究性疗效端点之一,但是在整个fih试验中执行语言流利性测试。这可能通过向每位受试者呈现相同的图片并要求其口头描述来进行。在描述期间,对言语的速率(词语/分钟)进行计数、记录,并最终将其与反映神经标准成年人的速率进行比较。
[0233]
主要测量动作功能的临床量表
[0234]
updrs:updrs是对与帕金森症相关的若干个领域(如日常生活的精神、行为和情绪以及活动)的42项、4部分的评估。每个项包含范围为0(表明无损害)到4(表明最严重的损害)的评定量表。每个部分的得分被记录以提供疾病的严重程度的指示,其中最高得分199分表明最严重残废。
[0235]
主要测量行为的临床量表
[0236]
npi:npi用于阐明患有脑病症的患者的精神病理学的表现。最初,npi被开发用于ad群体中;然而,据信其可用于评估其它病状的行为变化。评估由10个行为领域和两个植物性神经系统区域组成,其中有四个得分:频率、严重程度、总痛苦和照顾者痛苦。npi总得分是通过将行为领域的域得分相加,并且减去照顾者痛苦得分得到的。
[0237]
fbi:fbi是评估特别与bvftd相关的行为和性格的变化并且区分bvftd与其它痴呆的24项评估。fbi以面对面访谈的形式施用于主要照顾者,因为诊断患有bvftd的患者总体上不能识别这些类型的变化。fbi集中于若干个行为和性格相关区域,对每个问题的评分从0(无)到3(严重/大多数时间)。总得分通常与疾病的严重程度相关,并且可以用于评估随时间推移的变化。
[0238]
测量认知功能和动作功能两者的临床量表
[0239]
cgi
‑
c:cgi
‑
c是简洁的、广泛使用的评估的三个部分之一。其由临床医生评定的三个项构成。从参与研究开始,无论是否有完全因为治疗而出现的改善,cgi
‑
c以7点量表进行评定,范围为1(很大程度上改善)到7(非常糟糕)。
[0240]
fab:fab是简单评估,以帮助区分具有额叶执行功能表型的痴呆与ad类型的痴呆。fab尤其可用于轻度痴呆的患者(mmse>24)。评估由强调认知、动作和行为区域的六个部分组成。总得分为18或更高表明更好的表现。
[0241]
fdr:fdr是对诊断患有额颞痴呆(ftd)亚型(即bvftd或ppa亚型中的任何一个)的患者的简要分期评估。fdr检测ftd随时间推移的疾病进展差异。这种简要访谈对主要照顾者进行,并且由分类为“从未发生”、“有时”或“总是”的30个项组成。然后计算得分百分比,并将其转换成罗吉特得分,并且最终转换成严重程度得分。严重程度得分的范围为“非常轻
度”到“极严重”。
[0242]
哥伦比亚自杀严重程度评定量表(c
‑
ssrs):尽管c
‑
ssrs得分不是fih的探究性功效端点,但此评估在整个研究中进行。c
‑
ssrs是测量自杀意念、意念强度和自杀行为的三部分量表。这种评估的结果由直接从量表中得出的自杀行为致死率评定、自杀意念得分和自杀意念强度排名构成。基于评估指南,大于0的意念得分可能表明需要干预。强度评定的范围为0到25,其中0代表不认可自杀意念。
[0243]
作为另外的探究性端点,评估患者的存活率。然而,诊断患有由grn单倍型不足引起的神经退行性病变的患者的期望寿命为从症状发作起7
‑
11年。如此,研究的持续时间、样品大小和纳入处于疾病早期的受试者可能不足以证明存活率益处。
[0244]
施用raav1.hpgrn稳定主要在额叶和颞叶皮质的萎缩(神经元细胞脱失)以及由grn相关的单倍型不足引起的全脑体积随时间推移的下降。mri可以用于跟踪中额叶皮质和腔壁区域的厚度变化。
[0245]
也评估了生物化学生物标志物。csf和血浆中的pgrn蛋白的水平被测量为aav转导的读数,并且在施用raav1.hpgrn之后在患者体内增加。还跟踪了神经丝轻链(nfl)、τ、磷酸化τ和其它炎性标志物的csf水平。nfl被认为是神经元脱失或损害的一般指标。τ和磷酸化的τ与可在ad、pd和ftd的一些形式中可见的病理学相关。
[0246]
通过全血细胞计数(cbc)组筛查患者的血液工作(bloodwork),并且在随访时间点通过mri对脑和上脊柱进行钆造影来监测患者的肿瘤持续5年。
[0247]
单施用raav1.hpgrn是安全的而且在施用之后是耐受的。如通过患者的临床症状和日常功能评估的,单施用raav1.hpgrn提高存活率和/或降低疾病进展。治疗减缓了神经认知功能的丧失。
[0248]
(序列表自由文本)
[0249]
对于在数字标识符<223>下含有自由文本的序列,提供了以下信息。
[0250]
[0251]
[0252][0253]
本说明书中引用的所有文件通过引用并入本文中。于2019年2月22日提交的美国临时专利申请第62/809,329号、于2019年10月21日提交的美国临时专利申请第62/923,812号以及于2020年2月2日提交的美国临时专利申请第62/969,108号连同其序列表以全文引用的方式并入。随此提交的名称为“18
‑
8663pct_st25.txt”的序列表及其中的序列和文本通过引用并入。尽管已经参考特定实施例描述了本发明,但是应当理解的是,可以在不脱离本发明的精神的情况下进行修改。此类修改旨在落入所附权利要求的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。