一种包含艾瑞昔布的药物组合物
1.本技术是申请号为201810919234.4,申请日为2018年08月14日,发明名称为“一种包含艾瑞昔布的药物组合物”的中国专利申请的分案申请。
技术领域
2.本发明涉及一种包含艾瑞昔布的药物组合物及其制备方法。
背景技术:
3.骨关节炎(osteoarthirtis,oa)是一种常见的难治性退行性病变,发病率随年龄的增长而增高,没有明显的种族和地域差异。在超过50岁以上人群中,骨关节炎在导致长期残疾的疾病中仅次于心血管疾病排名第二。骨关节炎致残比例在人群中约占2%—6%。世界卫生组织数据显示,全球关节炎患者人数高达3.55亿,而中国关节炎病人已达1亿人。关节炎性疾病由风湿性关节炎、类风湿性关节炎两类不同的疾病构成。据统计,中国60岁以上人群中约62%患有骨关节炎,75岁以上人群患病率高达80%。骨关节炎较其他疾病更易于影响老年患者的行走、上下楼梯和其他下肢功能。因此,骨关节炎是导致50岁以上人群功能残疾、造成经济损失和影响社会发展的主要疾病。膝关节作为主要负责关节,是骨关节炎中最易受累的关节之一。
4.艾瑞昔布(imrecoxib),化学名称为1
‑
正丙基
‑3‑
(4
‑
甲基苯基)
‑4‑
(4
‑
甲磺酰基苯基)
‑
2,5
‑
二氢
‑
1h
‑2‑
吡咯酮,属于非甾体抗炎药家族,通过选择性抑制环氧合酶
‑
2(cox
‑
2)而抑制前列腺素及其衍生物的生成从而减轻炎症及缓解疼痛。同时避免nsaids抑制cox
‑
1而产生的胃肠道毒性发生。
[0005][0006]
艾瑞昔布在进入人体内后转化为多种代谢产物。zhiqiang feng等(bioorganic&medicinal chemistry letters,19(2009),2270
–
2272)报道了艾瑞昔布在人体内的代谢机制。其中,艾瑞昔布在人体内主要转化为7种代谢产物,仅少部分以原型药的形式存在。其中代谢产物m4和原型药具有高的cox
‑
2抑制活性,代谢产物m2基本没有cox
‑
2抑制活性。
[0007][0008]
艾瑞昔布于2011年在我国获批上市,上市剂型为普通片剂,规格为0.1g。经研究发现,目前上市的普通片剂中,由于艾瑞昔布进入人体后大量转化为非活性代谢产物m2(约75%),仅有少部分转化为活性代谢产物m4,导致其cox
‑
2抑制能力较差,治疗效果并不理想。因此有必要对艾瑞昔布制剂进行改良,增加活性代谢产物m4的在体内的含量,降低非活性代谢产物m2的转化,提高药物的治疗效果。
技术实现要素:
[0009]
为解决上述技术问题,本发明的目的在于提供一种包含艾瑞昔布的药物组合物,改善艾瑞昔布的治疗效果。
[0010]
本发明一方面提供了一种包含艾瑞昔布的药物组合物,其中,艾瑞昔布的粒径d90小于20μm,例如小于15μm,或小于12μm,或小于10μm,或小于9μm,或小于8μm,或小于7μm,或小于6μm,或小于5μm,或小于4μm,或小于3μm,例如50nm~3um,优选1100~2500nm,更优选200~2000nm,最优选200~600nm。d50小于5μm,优选小于4μm,或小于3μm,或小于2μm,或小于1μm,更优选10~600nm,最优选50~500nm。d10小于2μm,优选小于1μm,或小于500nm,更优选5~300nm,最优选10~200nm。
[0011]
在某些实施方式中,所述艾瑞昔布的粒径d50小于5μm,d10小于2μm;优选d50小于2μm,d10小于500nm;更优选d50为10~800nm,d10为5~300nm;最优选d50为50~600nm,d10为10~200nm。
[0012]
在某些实施方式中,所述药物组合物还包含表面稳定剂,所述表面稳定剂可以是各种聚合物、低分子量低聚物、天然产物和表面活性剂。优选的表面稳定剂可以是非离子,阴离子,阳离子和两性离子化合物或表面活性剂。例如聚乙烯吡咯烷酮(pvp)、聚乙烯醇、羟丙甲基纤维素、羟丙基纤维素、聚乙二醇1000维生素e琥珀酸酯(vitamin e tpgs)、吐温80、
泊洛沙姆、15
‑
羟基硬脂酸聚乙二醇酯、卵磷脂、脱氧胆酸钠、胆酸钠、多库酯钠、十二烷基硫酸钠、聚氧乙烯蓖麻油35、聚氧乙烯氢化蓖麻油40、羟丙基纤维素、四丁酚醛、聚甘油
‑
10月桂酸酯、卡波姆、共聚维酮中的一种或多种,其中优选共聚维酮、羟丙甲基纤维素、聚乙二醇1000维生素e琥珀酸酯、聚乙烯吡咯烷酮、十二烷基硫酸钠、吐温80、泊洛沙姆、以及多库酯钠中的一种或多种。
[0013]
可用的非离子表面稳定剂包括但不限于羟丙基甲基纤维素(hpmc)、聚乙烯吡咯烷酮、泊洛沙姆、吐温
‑
80、聚羟基硬脂酸羟基硬脂酸酯15、聚氧乙烯蓖麻油35、聚氧乙烯氢化蓖麻油40、羟丙基纤维素、聚乙二醇1000维生素e琥珀酸酯(vitamin e tpgs)、聚乙烯醇、四丁酚醛、聚甘油
‑
10月桂酸酯、卡波姆、共聚维酮。
[0014]
可用的阴离子表面稳定剂包括但不限于二辛基琥珀酸钠(doss)、十二烷基硫酸钠(sls)、十二烷基硫酸钠(sds)、多库酯钠、胆酸钠和脱氧胆酸钠、油酸钾。
[0015]
可用的阳离子表面稳定剂包括但不限于聚合物、生物聚合物、聚
‑
n
‑
甲基吡啶鎓、硫酸吡啶鎓氯化物、阳离子磷脂、壳聚糖、聚赖氨酸、聚乙烯咪唑、聚苯乙烯、聚甲基丙烯酸甲酯三甲基溴化铵(pmmtmabr)、己基甲基三甲基溴化铵(hdmab)和聚乙烯吡咯烷酮
‑2‑
二甲氨基乙基甲基丙烯酸二甲酯硫酸盐。
[0016]
可用的两性离子表面稳定剂包括但不限于蛋白质、磷脂、两性离子聚合物和两性离子表面活性剂分子,例如可以是磷脂酰胆碱、卵磷脂、明胶等。
[0017]
所述艾瑞昔布与表面稳定剂的重量比可以是1:0.01~1:100,优选1:0.01~1:50,更优选1:0.05~1:5,最优选1:0.1~1:1。
[0018]
在某些优选的实施例中,表面稳定剂包括第一表面稳定剂选自hpmc、共聚维酮、pvpk30,第二表面稳定剂选自吐温80、多库脂钠、vitamin e tpgs、泊洛沙姆或十二烷基硫酸钠。
[0019]
其中,艾瑞昔布与所述第一表面稳定剂的重量比可为1:0.01~1:100,优选1:0.01~1:50,更优选1:0.05~1:5,最优选1:0.1~1:1。
[0020]
其中,艾瑞昔布与所述第二表面稳定剂的重量比可为1:0.01~1:100,优选1:0.01~1:50,更优选1:0.01~1:5,最优选1:0.01~1:1。
[0021]
在所述药物组合物中,所述艾瑞昔布的含量可以是0.1~1000mg,优选10~800mg,更优选50~500mg。
[0022]
在某些实施方式中,所述药物组合物还包含填充剂,所述填充剂可以是微晶纤维素、磷酸氢钙、甘露醇、预胶化淀粉、乳糖等中的一种或多种。基于组合物的总重量,所述填充剂含量为约5%~80%。
[0023]
在某些实施方式中,所述药物组合物还包含崩解剂,所述崩解剂可以是交联羧甲基纤维素钠、淀粉、羧甲基淀粉钠及交联聚维酮中的一种或多种。基于组合物的总重量,所述崩解剂含量可为1%~20%。
[0024]
在某些实施方式中,所述药物组合物还包含润滑剂,所述润滑剂可以是硬脂酸镁、硬脂酸锌、山嵛酸甘油酯、月桂基硫酸钠、氢化植物油、微粉硅胶、滑石粉、胶态二氧化硅中的一种或多种,优选硬脂酸镁和胶态二氧化硅中的一种或多种。基于组合物的总重量,润滑剂的含量可为0.5%~5%。
[0025]
本发明另一方面提供了一种包含艾瑞昔布的颗粒分散体,其中,所述艾瑞昔布的
粒径d90小于20μm,例如小于15μm,或小于12μm,或小于10μm,或小于9μm,或小于8μm,或小于7μm,或小于6μm,或小于5μm,或小于4μm,或小于3μm,例如50nm~3um,优选1100~2500nm,更优选200~2000nm,最优选200~600nm。d50小于5μm,优选小于4μm,或小于3μm,或小于2μm,或小于1μm,更优选10~800nm,最优选50~600nm。d10小于2μm,优选小于1μm,或小于500nm,更优选5~300nm,最优选10~200nm。
[0026]
在某些实施方式中,所述艾瑞昔布的粒径d50小于5μm,d10小于2μm;优选d50小于2μm,d10小于500nm;更优选d50为10~800nm,d10为5~300nm;最优选d50为50~600nm,d10为10~200nm。
[0027]
所述的颗粒分散体还包含表面稳定剂,所述表面稳定剂如前文所述,优选的表面稳定剂聚乙烯吡咯烷酮(pvp)、聚乙烯醇、羟丙甲基纤维素、羟丙基纤维素、聚乙二醇1000维生素e琥珀酸酯(vitamin e tpgs)、15
‑
羟基硬脂酸聚乙二醇酯、吐温80、泊洛沙姆、15
‑
羟基硬脂酸聚乙二醇酯、卵磷脂、脱氧胆酸钠、胆酸钠、多库酯钠、十二烷基硫酸钠、聚氧乙烯蓖麻油35、聚氧乙烯氢化蓖麻油40、羟丙基纤维素、四丁酚醛、聚甘油
‑
10月桂酸酯、卡波姆、共聚维酮中的一种或多种,其中优选共聚维酮、羟丙甲基纤维素、聚乙二醇1000维生素e琥珀酸酯、聚乙烯吡咯烷酮、十二烷基硫酸钠、吐温80、泊洛沙姆、以及多库酯钠中的一种或多种。
[0028]
所述艾瑞昔布与表面稳定剂的重量比可以是1:0.01~1:100,优选1:0.01~1:50,更优选1:0.05~1:5,最优选1:0.1~1:1。
[0029]
在某些优选的实施例中,表面稳定剂包括第一表面稳定剂选自hpmc、共聚维酮、pvpk30,第二表面稳定剂选自吐温80、多库脂钠、vitamin e tpgs、泊洛沙姆或十二烷基硫酸钠。
[0030]
其中,艾瑞昔布与所述第一表面稳定剂的重量比可为1:0.01~1:100,优选1:0.01~1:50,更优选1:0.05~1:5,最优选1:0.1~1:1。
[0031]
其中,艾瑞昔布与所述第表面二稳定剂的重量比可为1:0.01~1:100,优选1:0.01~1:50,更优选1:0.01~1:5,最优选1:0.01~1:1。
[0032]
基于颗粒总重量,所述艾瑞昔布在颗粒分散体中的含量可以是10%~95%,优选30%~90%,更优选50%~85%。
[0033]
所述的颗粒分散体可包含液体介质,所述液体介质选自水、盐水溶液、植物油(例如红花籽油)和有机溶剂(例如乙醇,叔丁醇,己烷和乙二醇)等,优选水。
[0034]
在某些实施方式中,所述的颗粒分散体可进一步用于制备艾瑞昔布药物组合物,例如口服制剂、注射剂、吸入制剂或外用制剂,例如可以是片剂、胶囊剂、注射液、冻干粉针等。
[0035]
本发明另一方面提供了一种制备本发明所述的颗粒分散体的方法,包括:将艾瑞昔布与表面稳定剂混合、研磨的步骤。其中,所述步骤可在液体介质中进行,所述液体介质选自水、盐水溶液、植物油(例如红花籽油)和有机溶剂(例如乙醇,叔丁醇,己烷和乙二醇)等,优选水。其中艾瑞昔布在所述液体介质中的溶解度差。
[0036]
本发明另一方面提供了一种制备本发明所述的艾瑞昔布药物组合物的方法,包括:将本发明所述颗粒分散体与任选的填充剂、崩解剂或润滑剂混合的步骤。
[0037]
在某些实施方式中,所述颗粒分散体可直接与任选的填充剂、崩解剂或润滑剂混
合。在某些实施方式中,所述颗粒分散体可先进行固化操作,固化操作可以是但不限定于冷冻干燥、喷雾干燥、制粒工艺或是包衣工艺,再与其他赋形剂混合。
[0038]
本发明另一方面提供了将本发明所述的艾瑞昔布药物组合物或艾瑞昔布颗粒分散体用于提高艾瑞昔布在体内向活性代谢产物转化的转化率的用途,所述活性代谢产物优选代谢产物m4。
[0039]
本发明通过将药物组合物中艾瑞昔布的粒径降至微米以下级别,出人意料地使得艾瑞昔布在体内的活性代谢大大增强。在艾瑞昔布药物组合物中,艾瑞昔布进入体内后更多的以活性代谢产物m4的形式存在,使得cox
‑
2抑制效果更加显著。此外,由于本发明组合物治疗效果的提高,对于降低药物剂量,减少药物不良反应等都具有积极的意义。
[0040]
本发明所述的“d10”是指一个样品的累计粒度分布百分数达到10%时所对应的粒径。“d50”是指一个样品的累计粒度分布百分数达到50%时所对应的粒径。“d90”是指一个样品的累计粒度分布百分数达到90%时所对应的粒径。
附图说明
[0041]
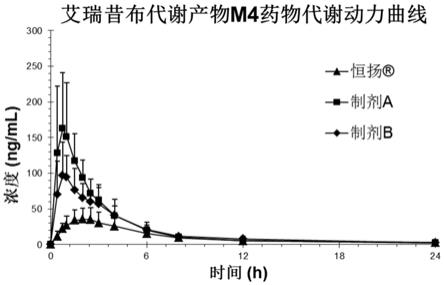
图1为制剂a、制剂b和市售制剂中活性代谢产物m4的平均血药浓度
‑
时间曲线。
[0042]
图2为制剂a、制剂b和市售制剂中非活性代谢产物m2的平均血药浓度
‑
时间曲线。
具体实施方式
[0043]
实施例1:
[0044]
艾瑞昔布药物组合物处方(制剂a):
[0045][0046]
向球磨机的125ml球磨罐中倒入约62.5ml的0.5mm的氧化锆制研磨球。加入55ml含有tween
‑
80的hpmc溶液,之后加入5.5g药物。称量球磨罐,确定平衡重量后加以固定,球磨机研磨80min,后经60目筛过滤除去氧化锆研磨球,制得艾瑞昔布混悬体。取样,采用malvern mastersizer3000 hydro mv法测量粒度分布(见表2)。
[0047]
将艾瑞昔布混悬体进行喷雾干燥得到含药中间体,将含药中间体和处方量的ludipress(乳糖,pvp和pvpp)置于turbula t2f mixer混合15min,加入硬脂酸镁和胶体二氧化硅,混匀后,按照每颗含艾瑞昔布100mg的标准直接压片。
[0048]
实施例2:
[0049]
艾瑞昔布药物组合物处方(制剂b):
[0050][0051][0052]
按照实施例1的方法,球磨机研磨25min制得艾瑞昔布混悬体。取样,测量粒度分布(见表2)。
[0053]
将艾瑞昔布混悬体进行喷雾干燥得到含药中间体,将含药中间体和处方量的ludipress置于turbula t2f mixer混合15min,加入硬脂酸镁和胶体二氧化硅,混匀后,按照每颗含艾瑞昔布100mg的标准直接压片。
[0054]
实施例3
[0055]
使用实施例1的制剂a、实施例2的制剂b和对比,受试者在试验前日晚进统一清淡饮食,晚饭后禁食至次日晨,于试验当日清晨空腹用200ml温水口服试验药。9例受试者年龄22~27(23.5
±
1.9)岁,身高1.68~1.78(1.75
±
0.04)米,体重指数19.88~23.99(23.05
±
1.57),健康体检及血常规,乙肝两对半、心电图检查,肝肾功能,均未发现异常。受试者两周期服药后,按试验设计时间点采取静脉血,采用lc
‑
ms/ms测得全血中tcs的经时血药浓度,平均血药浓度
‑
时间曲线见图1~2,平均auc和cmax数据见表1。各制剂中艾瑞昔布的粒径见表2。
[0056]
表1主要代谢产物m2,m4的auc(h*ng/ml)及cmax(ng/ml)
[0057][0058]
表2各制剂中艾瑞昔布的粒径
[0059][0060]
[0061]
从表1和表2中可以看出,制剂a和制剂b相比于市售制剂,活性代谢产物m4的auc均显著地提高,这大大提高了艾瑞昔布的治疗效果。其中,纳米制剂a相比于微米制剂b,非活性代谢产物m2的auc提高很少(约6%),而活性代谢产物m4的auc却出人意料地提高了15%以上。这意味着,将艾瑞昔布粒径降低至纳米级别时,其在体内转化为非活性代谢产物m2的量基本不增加,但活性代谢产物m4的量却有较大的提高,这使得艾瑞昔布在体内更多地转化为活性代谢产物m4,更加有利于艾瑞昔布的发挥治疗作用,对于降低药物剂量,减少药物不良反应等都具有积极的意义。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。