促进细胞迁移的组织工程水凝胶支架及其制备方法、3d打印浆料及其制备方法
技术领域
1.本发明涉及组织工程领域,特别涉及一种促进细胞迁移的组织工程水凝胶支架及其制备方法、3d打印浆料及其制备方法。
背景技术:
2.许多疾病和灾害都能够导致人体部分组织和器官的损伤,目前由于组织或器官的损伤或缺失而产生的多种疾病是危害人体健康的主要原因。随着临床上移植手术的增多,对器官和组织的需求也迅速增加,然而器官的捐献量远远不能满足需求。在美国,每年有15%等待接受肝脏和心脏移植的病人由于捐献器官不足而去世。尽管自体移植(autotransplantations)和同种异体移植 (allotransplantations)在临床上取得了显著的成效,然而这种方法却要以损害病人身体其他健康部位和捐献者身体健康为代价且远不能满足实际需求。此外,异种移植(xenotransplantation)往往会不可调节的长期的免疫排斥反应。介于此,许多生物相容性好的金属和聚合物作为替代材料被用于损伤器官与组织的修复。对该方面的研究应用称为“组织工程学(tissue engineering)”或“再生疗法 (regenerative therapeutics)”。
3.组织工程支架作为细胞的载体是组织工程学的关键部分发挥着至关重要的作用。组织工程支架为细胞提供生长繁殖的环境并诱导形成具有一定几何外形的组织结构,在植入人体后提供适当的力学性能并能够在体内随着细胞的繁殖、新组织的生成而降解。因此对于不同损伤组织,其所需要的支架结构与性能也大不相同。目前,许多科学研究都致力于制备符合特定组织生长的组织工程支架。由于具有高速,高精度,可定制化的优点,3d打印逐渐成为目前主流的组织工程支架制备方法。经过多年的发展,3d打印技术已经可以制备与人体器官相似结构尺寸,极为复杂的组织工程支架。
4.但是随着组织工程支架越来越复杂,由于缺乏有效的物质交换途径,组织内部细胞缺乏充足的能量来源,生理活性受到影响,成活率偏低,难以实现组织再生的目的。因此,制备一种可以通过3d打印制备复杂支架同时不影响内部细胞活性的组织工程水凝胶支架具有十分重要的意义。
技术实现要素:
5.为了克服现有技术的上述缺点与不足,本发明的目的之一在于提供一种促进细胞迁移的组织工程水凝胶支架,安全性良好,力学性能优异,同时可提升细胞外atp含量,促进细胞的生理活动,利于细胞迁移。
6.本发明的目的之二在于提供上述促进细胞迁移的组织工程水凝胶支架的制备方法。
7.本发明的目的之三在于提供一种用于制备上述促进细胞迁移的组织工程水凝胶支架的3d打印浆料的制备方法。
8.本发明的目的之四在于提供上述3d打印浆料的制备方法制得的3d打印浆料。
9.本发明的目的通过以下技术方案实现:
10.促进细胞迁移的组织工程水凝胶支架,以重量份计,包括
[0011][0012]
优选的,所述光引发剂为2
‑
羟基
‑4’‑
(2
‑
羟乙氧基)
‑2‑
甲基苯丙酮。
[0013]
优选的,所述聚磷酸盐为聚磷酸钠。
[0014]
所述的促进细胞迁移的组织工程水凝胶支架的制备方法,包括以下步骤:
[0015]
(1)配置聚乙二醇(二醇)二丙烯酸酯的水溶液;
[0016]
(2)将光引发剂加入步骤(1)的聚乙二醇(二醇)二丙烯酸酯的水溶液中,搅拌至完全溶解,得到聚乙二醇(二醇)二丙烯酸酯/光引发剂溶液;
[0017]
(3)将聚磷酸盐加入步骤(2)制备的聚乙二醇(二醇)二丙烯酸酯/光引发剂溶液中,搅拌至完全溶解,得到聚乙二醇(二醇)二丙烯酸酯/光引发剂/聚磷酸盐溶液;
[0018]
(4)将海藻酸钠加入步骤(3)制备的聚乙二醇(二醇)二丙烯酸酯/光引发剂/聚磷酸盐溶液中,搅拌至完全均匀,得到聚乙二醇(二醇)二丙烯酸酯/光引发剂/聚磷酸盐/海藻酸钠复合浆料;
[0019]
(5)将步骤(4)得到的聚乙二醇(二醇)二丙烯酸酯/光引发剂/聚磷酸盐/海藻酸钠复合浆料加入到3d打印料筒中,超声除去气泡,并在3d打印机中建模,打印浆料成型为支架;
[0020]
(6)将步骤(5)制备得到的支架放置于紫外灯下进行光交联,之后再用氯化钙溶液浸泡进行离子交联,最后用去离子水进行清洗,获得聚乙二醇(二醇) 二丙烯酸酯/聚磷酸盐/海藻酸钠组织工程支架,即目标产物。
[0021]
优选的,步骤(1)所述配置聚乙二醇(二醇)二丙烯酸酯的水溶液,具体为:
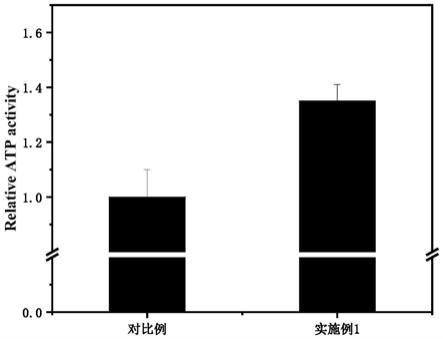
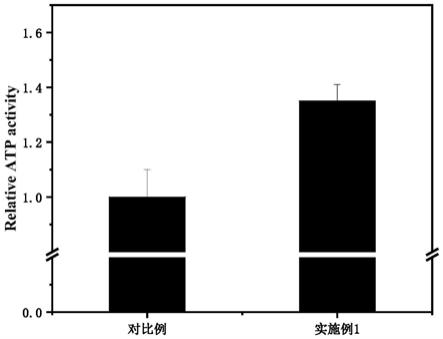
[0022]
将聚乙二醇(二醇)二丙烯酸酯加入到超纯水之中,搅拌20~30min,使其充分溶解,得到聚乙二醇(二醇)二丙烯酸酯溶液。
[0023]
优选的,步骤(2)所述搅拌,具体为:搅拌5~10min。
[0024]
优选的,步骤(3)所述搅拌,具体为:搅拌20~30min。
[0025]
优选的,步骤(4)所述搅拌,具体为:搅拌2~4h。
[0026]
一种3d打印浆料的制备方法,包括以下步骤:
[0027]
(1)配置聚乙二醇(二醇)二丙烯酸酯的水溶液;
[0028]
(2)将光引发剂加入步骤(1)的聚乙二醇(二醇)二丙烯酸酯的水溶液中,搅拌至完全溶解,得到聚乙二醇(二醇)二丙烯酸酯/光引发剂溶液;
[0029]
(3)将聚磷酸盐加入步骤(2)制备的聚乙二醇(二醇)二丙烯酸酯/光引发剂溶液中,搅拌至完全溶解,得到聚乙二醇(二醇)二丙烯酸酯/光引发剂/聚磷酸盐溶液;
[0030]
(4)将海藻酸钠加入步骤(3)制备的聚乙二醇(二醇)二丙烯酸酯/光引发剂/聚磷酸盐溶液中,搅拌至完全均匀,得到聚乙二醇(二醇)二丙烯酸酯/光引发剂/聚磷酸盐/海藻
酸钠3d打印浆料。
[0031]
一种3d打印浆料,由所述的促进细胞迁移的组织工程水凝胶支架的制备方法得到。
[0032]
与现有技术相比,本发明具有以下优点和有益效果:
[0033]
(1)本发明制备的组织工程支架,聚磷酸盐中的高能磷酸键在细胞膜上碱性磷酸酶的作用下酶解,释放能量,为细胞供能,促进细胞迁移,分化等生理活动;改善了以往支架内部细胞由于缺乏充足的能量来源,活性偏低的问题,可以有效地促进细胞的迁移;解决了复杂组织工程支架由于缺乏有效的物质交换途径,影响细胞的生理活性得问题。
[0034]
(2)本发明在水凝胶中引入双网络体系,即聚(乙二醇)二丙烯酸酯 (poly(ethylene glycol)diacrylate,pegda)的共价交联网络和海藻酸钠(sodium alginate,sa)
‑
ca
2
的离子交联网络,两种网络协同作用增强了水凝胶的力学性能,同时可以灵活控制。
[0035]
(3)本发明在打印前,往水凝胶中加入少量的ca
2
形成预交联,提升水凝胶的打印性能,使其可以打印复杂中空的组织工程支架。
[0036]
(4)本发明制备的组织工程支架具有良好的成骨性质和骨修复能力,可以有效的达到骨缺损修复地效果。
[0037]
(5)本发明制备的组织工程支架改善了以往海藻酸钠支架力学性能不佳的缺点,制备的支架具有良好的力学性能。
[0038]
(6)本发明制备工艺简单易操作,材料来源广泛,材料生物活性高,在再生医学和组织修复等邻域有广泛的应用前景。
[0039]
(7)本发明采用生物3d打印技术,成型方便,并且可以控制材料的形状并且获得较高的孔隙率,工艺精确易控,产品质量稳定,可实现个性化定制。
附图说明
[0040]
图1为本发明的对比例的组织工程支架与纯海藻酸钠水凝胶的压缩应力
‑
应变曲线。
[0041]
图2为本发明的实施例1的组织工程支架的流变学行为曲线图。
[0042]
图3为本发明的对比例的组织工程支架与实施例1的组织工程支架的细胞外atp浓度对比图。
[0043]
图4为本发明的对比例的组织工程支架与实施例2的组织工程支架的细胞外atp浓度对比图。
[0044]
图5为本发明的对比例的组织工程支架全部细胞的激光扫描共聚焦显微镜图(比例尺:100微米)。
[0045]
图6为本发明的对比例的组织工程支架内部细胞的激光扫描共聚焦显微镜图(比例尺:100微米)。
[0046]
图7为本发明的实施例2的组织工程支架全部细胞的激光扫描共聚焦显微镜图(比例尺:100微米)。
[0047]
图8为本发明的实施例2的组织工程支架内部细胞的激光扫描共聚焦显微镜图(比例尺:100微米)。
[0048]
图9为本发明的测试例的所有组织工程支架样品的压缩应力
‑
应变曲线图。
[0049]
图10为本发明的测试例的所有组织工程支架样品的压缩模量柱状图。
[0050]
图11为本发明的测试例的不同组织工程支架样品上7天和14天的alp活性柱状图。
具体实施方式
[0051]
下面结合实施例,对本发明作进一步地详细说明,但本发明的实施方式不限于此。
[0052]
对比例1
[0053]
(1)将1g聚乙二醇(二醇)二丙烯酸酯(pegda)加入到30ml超纯水之中,搅拌30min,使其充分溶解,得到聚乙二醇(二醇)二丙烯酸酯溶液;
[0054]
(2)将8mg光引发剂i
‑
2959加入到聚乙二醇(二醇)二丙烯酸酯溶液,搅拌 10min至完全溶解,得到聚乙二醇(二醇)二丙烯酸酯/i
‑
2959溶液;
[0055]
(3)将3g海藻酸钠加入到聚乙二醇(二醇)二丙烯酸酯/i
‑
2959溶液中,搅拌4h至完全均匀,得到聚乙二醇(二醇)二丙烯酸酯/i
‑
2959/海藻酸钠复合浆料;
[0056]
(4)将步骤(3)所获得的聚乙二醇(二醇)二丙烯酸酯/i
‑
2959/海藻酸钠复合浆料加入到3d打印料筒中,超声除去气泡,并在3d打印机中建模,打印浆料成型为支架,其中,支架的尺寸设定为10mm*10mm*4mm,打印针头直径为 0.41mm,打印速度为20mm/s,打印压力为2bar。
[0057]
(5)将步骤(4)的支架放置于紫外灯下进行光交联6min,之后再用3wt%的氯化钙溶液浸泡进行离子交联,最后用去离子水进行清洗,获得聚乙二醇(二醇)二丙烯酸酯/海藻酸钠组织工程支架,即目标产物。
[0058]
本对比例的压缩强度如图1所示,压缩强度高于纯海藻酸钠。
[0059]
实施例1
[0060]
本实施例的促进细胞迁移的组织工程水凝胶支架的制备方法如下:
[0061]
(1)将2g聚乙二醇(二醇)二丙烯酸酯(pegda)加入到30ml超纯水之中,搅拌30min,使其充分溶解,得到聚乙二醇(二醇)二丙烯酸酯溶液;
[0062]
(2)将32mg光引发剂i
‑
2959(2
‑
羟基
‑4’‑
(2
‑
羟乙氧基)
‑2‑
甲基苯丙酮)加入到聚乙二醇(二醇)二丙烯酸酯溶液,搅拌10min至完全溶解,得到聚乙二醇(二醇)二丙烯酸酯/i
‑
2959溶液;
[0063]
(3)将0.3g聚磷酸钠缓慢加入到聚乙二醇(二醇)二丙烯酸酯/i
‑
2959溶液中,搅拌30min至完全溶解,得到聚乙二醇(二醇)二丙烯酸酯/i
‑
2959/聚磷酸钠溶液;
[0064]
(4)将3g海藻酸钠加入到聚乙二醇(二醇)二丙烯酸酯/i
‑
2959/聚磷酸钠溶液中,搅拌4h至完全均匀,得到聚乙二醇(二醇)二丙烯酸酯/i
‑
2959/聚磷酸钠/海藻酸钠复合浆料,即3d打印浆料;
[0065]
(5)将步骤4所获得的聚乙二醇(二醇)二丙烯酸酯/i
‑
2959/聚磷酸钠/海藻酸钠复合浆料加入到3d打印料筒中,超声除去气泡,并在3d打印机中建模,打印浆料成型为支架,其中,支架的尺寸设定为10mm*10mm*4mm,打印针头直径为0.41mm,打印速度为15mm/s,打印压力为1.5bar。
[0066]
(6)将步骤5的支架放置于紫外灯下进行光交联3min,之后再用5%氯化钙溶液浸泡进行离子交联,最后用去离子水进行清洗,获得聚乙二醇(二醇)二丙烯酸酯/聚磷酸钠/
海藻酸钠组织工程支架,即目标产物。
[0067]
图2为本实施例制备得到聚乙二醇(二醇)二丙烯酸酯/聚磷酸钠/海藻酸钠组织工程支架的流变学行为曲线图,表明复合浆料具有剪切变稀特性,这对3d打印十分重要。
[0068]
对本实施例制备得到的乙二醇(二醇)二丙烯酸酯/聚磷酸钠/海藻酸钠组织工程支架及对比例的聚乙二醇(二醇)二丙烯酸酯/海藻酸钠组织工程支架进行细胞外atp含量测试,方法如下:将总量为5x104的细胞种于水凝胶支架上培养3 天。之后,使用atp检测试剂盒检测细胞外atp浓度。
[0069]
图3为采用本实施例的聚乙二醇(二醇)二丙烯酸酯/聚磷酸钠/海藻酸钠组织工程支架与对比例的聚乙二醇(二醇)二丙烯酸酯/海藻酸钠组织工程支架培养的细胞的细胞外atp含量对比图,可以看出本实施例上培养细胞的细胞外atp含量更高,约为对比例的1.37倍。说明在加入0.3g的聚磷酸盐后,细胞外atp含量可以得到提高。
[0070]
实施例2
[0071]
(1)将2g聚乙二醇(二醇)二丙烯酸酯(pegda)加入到30ml超纯水之中,搅拌30min,使其充分溶解,得到聚乙二醇(二醇)二丙烯酸酯溶液;
[0072]
(2)将16mg光引发剂i
‑
2959加入到聚乙二醇(二醇)二丙烯酸酯溶液,搅拌10min至完全溶解,得到聚乙二醇(二醇)二丙烯酸酯/i
‑
2959溶液;
[0073]
(3)将0.9g聚磷酸钠缓慢加入到聚乙二醇(二醇)二丙烯酸酯/i
‑
2959溶液中,搅拌30min至完全溶解,得到聚乙二醇(二醇)二丙烯酸酯/i
‑
2959/聚磷酸钠溶液;
[0074]
(4)将1.5g海藻酸钠加入到聚乙二醇(二醇)二丙烯酸酯/i
‑
2959/聚磷酸钠溶液中,搅拌2h至完全均匀,得到聚乙二醇(二醇)二丙烯酸酯/i
‑
2959/聚磷酸钠/ 海藻酸钠复合浆料,即3d打印浆料;
[0075]
(5)将步骤(4)所获得的聚乙二醇(二醇)二丙烯酸酯/i
‑
2959/聚磷酸钠/海藻酸钠复合浆料加入到3d打印料筒中,超声除去气泡,并在3d打印机中建模,打印浆料成型为支架,其中,支架的尺寸设定为10mm*10mm*4mm,打印针头直径为0.27mm,打印速度为20mm/s,打印压力为3bar。
[0076]
(6)将步骤(5)的支架放置于紫外灯下进行光交联3min,之后再用5%氯化钙溶液浸泡进行离子交联,最后用去离子水进行清洗,获得聚乙二醇(二醇) 二丙烯酸酯/聚磷酸钠/海藻酸钠组织工程支架,即目标产物。
[0077]
对本实施例制备得到的乙二醇(二醇)二丙烯酸酯/聚磷酸钠/海藻酸钠组织工程支架及对比例的聚乙二醇(二醇)二丙烯酸酯/海藻酸钠组织工程支架进行细胞外atp含量测试,方法如下:将总量为5x104的细胞种于水凝胶支架上培养3 天。之后,使用atp检测试剂盒检测细胞外atp浓度。
[0078]
图4为采用本实施例的聚乙二醇(二醇)二丙烯酸酯/聚磷酸钠/海藻酸钠组织工程支架与对比例的聚乙二醇(二醇)二丙烯酸酯/海藻酸钠组织工程支架培养的细胞的细胞外atp含量对比图,可以看出本实施例上培养细胞的细胞外atp含量更高,约为对比例的1.51倍。说明在加入0.9g的聚磷酸盐后,细胞外atp含量可以得到提高。
[0079]
图5~图8为激光扫描共聚焦显微镜对本实施例的聚乙二醇(二醇)二丙烯酸酯/聚磷酸钠/海藻酸钠组织工程支架与对比例的聚乙二醇(二醇)二丙烯酸酯/海藻酸钠组织工程支架进行测试的结果,由图可知,在加入聚磷酸钠后,细胞向支架内部迁移的更深。
[0080]
测试例:
[0081]
本测试例的样品除聚磷酸钠分别加入0、0.15g、0.3g、0.9g、1.5g,其他制备步骤均与实施例2同。
[0082]
本测试例的不同样品的压缩应力
‑
应变曲线如图9所示,由图可知,随着聚磷酸盐含量的逐渐增加,样品的压缩性能逐渐增强。
[0083]
本测试例的不同样品的压缩模量如图10所示,由图可知,随着聚磷酸盐含量的逐渐增加,样品的抗压缩能力逐渐增强,相应的压缩模量逐渐升高, 1.5polyp(聚磷酸盐)的压缩模量约为0polyp的6倍。
[0084]
0.5polyp的压缩模量虽然较高,但是其断裂应变较小,综合考量,选取0, 0.15,0.3,0.9polyp的材料进行生物实验。
[0085]
本测试例的不同样品的第7天和第14天的alp活性如图11所示,由图可知,在第7天,各组分的alp含量相差不大;而到了第14天,在含有polyp的水凝胶上培养的细胞的alp含量显著高于0polyp的,说明聚磷酸盐的加入可以赋予材料促成骨性能。
[0086]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受所述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。