用于检测鼠源tcr转基因拷贝数的试剂盒及方法
技术领域
1.本发明涉及基因组序列分析领域和生物信息学领域,具体涉及用于检测鼠源tcr转基因拷贝数的试剂盒及方法。
背景技术:
2.tcr即t细胞抗原受体(t cell receptor,tcr):是t细胞特异性识别和结合抗原肽-mhc分子的分子结构,通常与cd3分子呈复合物形式存在于t细胞表面。大多数t细胞的tcr由α和β肽链组成,少数t细胞的tcr由γ和δ肽链组成。
3.用人肿瘤特异性抗原免疫转有人源hla基因的转基因老鼠,可发现能识别人源肿瘤特异性抗原的高亲和力鼠源tcr。这是目前筛选有治疗价值的tcr的一种重要手段。
4.tcr-t的治疗方法在实体瘤的治疗中显示出了广阔的前景。但是出于对基因工程改造的细胞的生物安全性的考虑,fda规定经基因工程改造的细胞中,转基因拷贝数不能超过五个拷贝/细胞。这表明在tcr-t产品生产的质量监测和产品放行中需要快速,准确的检测转基因拷贝数。在tcr-t的动物试验中,检测动物样本(组织或血液)中人源tcr基因的拷贝数可以反映出tcr-t在受试动物中扩增和增殖的情况;在tcr-t的临床试验中,检测受试者样本(组织或血液)中外源tcr基因的拷贝数可以反映出tcr-t在受试者中扩增和增殖的情况,作为tcr-t治疗的关键的药物动力学指标(pk)。
5.目前,针对tcr基因拷贝数的检测尚无相关报道,因此,随着鼠源tcr筛选的广泛运用和临床产品的开发,需要开发一种能够快速,准确的检测鼠源tcr转基因拷贝数的方法。
技术实现要素:
6.本发明的目的就是提供一种用于检测鼠源tcr转基因拷贝数的试剂,其能够快速、准确的检测鼠源tcr转基因拷贝数。
7.本发明的第一方面,提供一种用于检测鼠源tcr转基因拷贝数的试剂盒,所述试剂盒包括针对鼠源tcr保守区域的引物对和taqman探针,其中,所述的引物对选自下组:
8.(i)第一引物对(d1):第一引物对包括序列如seq id no:1和seq id no:2所示的引物;
9.(ii)第二引物对(a1):第二引物对包括序列如seq id no:4和seq id no:5所示的引物;和
10.(iii)第一引物对和第二引物对的组合。
11.在另一优选例中,所述的引物对为第一引物对,并且所述试剂盒还包括序列如seq id no:3所示的第一taqman探针。
12.在另一优选例中,所述的引物对为第二引物对,并且所述试剂盒还包括序列如seq id no:6所示的第二taqman探针。
13.在另一优选例中,所述的试剂盒还包括选自下组的引物对:
14.(iii)第三引物对(b1):第三引物对包括序列如seq id no:7和seq id no:8所示
的引物;和
15.(iv)第四引物对(c1):第四引物对包括序列如seq id no:10和seq id no:11所示的引物。
16.在另一优选例,所述的引物对为第三引物对,并且所述试剂盒还包括序列如seq id no:9所示的第三taqman探针。
17.在另一优选例,所述的引物对为第四引物对,并且所述试剂盒还包括序列如seq id no:12所示的第四taqman探针。
18.在另一优选例中,所述taqman探针的5'端标记有荧光报告基团,3'端标记有荧光淬灭基团;
19.或者,所述taqman探针的3'端标记有荧光报告基团,5'端标记有荧光淬灭基团。
20.在另一优选例中,所述的荧光报告基团选自下组:fam、vic,而淬灭基团选自下组:mgb、tamra。
21.在另一优选例中,所述的荧光报告基团为fam,而淬灭基团为mgb。
22.本发明第二方面,提供一种用于检测鼠源tcr转基因拷贝数的试剂组合,所述试剂组合包括第一引物对和第一taqman探针,第一引物对包括序列如seq id no:1和seq id no:2所示的引物;并且,第一taqman探针的序列如seq id no:3所示。
23.本发明第三方面,提供一种用于检测鼠源tcr转基因拷贝数的试剂组合,所述试剂组合包括第二引物对和第二taqman探针,第二引物对包括序列如seq id no:4和seq id no:5所示的引物;并且,第二taqman探针的序列如seq id no:6所示。
24.本发明第四方面,提供一种第一方面所述的试剂盒或第二或第三方面所述的试剂组合的用途,用于制备对鼠源tcr进行质量控制的检测产品。
25.本发明第五方面,提供一种体外对鼠源tcr进行质量控制的方法,包括如下步骤:
26.(a)提供一待检测的样品;
27.(b)用针对鼠源tcr保守区域的引物对和taqman探针,对所述的待检测的样品进行pcr扩增,从而测定tcr转基因的拷贝数;和
28.(c)基于所测定的tcr转基因的拷贝数,对待检测的样品的质量进行评价。
29.在另一优选例中,所述引物浓度为0.45μm,探针浓度为0.125μm。
30.在另一优选例中,标准品的最低拷贝数为10。
31.在另一优选例中,所述的方法是非诊断和非治疗性的。
32.在另一优选例中,在步骤(b)中,采用第一引物对和第一taqman探针。
33.在另一优选例中,在步骤(b)中,同时采用(y1)第一引物对和第一taqman探针以及(y3)rnase p内参基因引物/探针。
34.在另一优选例中,在步骤(b)中,采用单重或多重pcr扩增。
35.在另一优选例中,在步骤(b)中,采用第二引物对和第二taqman探针。
36.在另一优选例中,在步骤(b)中,采用第三引物对和第三taqman探针。
37.在另一优选例中,在步骤(b)中,采用第四引物对和第四taqman探针。
38.在另一优选例中,在步骤(b)中,同时或先后采用(y1)第一引物对和第一taqman探针以及(y2)第二引物对和第二taqman探针进行pcr扩增。
39.在另一优选例中,在步骤(b)中,通过比较ct值,从而确定tcr转基因的拷贝数。
40.在另一优选例中,在步骤(b)中,将待检测的样品的ct值与标准值或标准曲线进行比较,从而确定tcr转基因的拷贝数。
41.在另一优选例中,所述的待检测的样品包括核酸样品。
42.在另一优选例中,所述核酸样品是提取自m个细胞的总核酸,其中,m为正整数。
43.较佳地,m为1、2、3、4、5、6、7、8、9、或10。
44.在另一优选例中,在步骤(b)中包括以下步骤:
45.s1)选取小鼠tcr保守区域作为目的基因片段;
46.s2)将该段目的基因片段插入到载体上从而构建标准质粒,将其作为标准品母液,然后进行梯度稀释得到系列标准品;
47.s3)对标准品和待测样品的基因进行实时荧光定量pcr(qpcr),以系列标准品的ct值及拷贝数绘制标准曲线,获得计算公式;
48.s4)将待测样品的ct值带入步骤s3)中的标准曲线的计算公式,获得待测样品的基因拷贝数。
49.在另一优选例中,在步骤(b)中包括以下步骤:
50.r1)选取小鼠tcr保守区域作为目的基因片段和已知序列的内参基因;
51.r2)将该段目的基因片段插入到载体上从而构建标准质粒,将其作为标准品母液,然后进行梯度稀释得到系列标准品;
52.r3)使用如第一方面所述的试剂,对标准品和待测样品的基因进行实时荧光定量pcr(qpcr),以系列标准品的ct值及拷贝数绘制标准曲线,获得计算公式;
53.r4)使用内参基因rnasep的ct值计算每个样品的校准因子;
54.r5)通过与每μg基因组含内参基因的拷贝数进行校正,获得待测样品的每μg基因组中含tcr基因的拷贝数。
55.在另一优选例中,所述步骤(b)中,还包括加入人源背景dna。
56.在另一优选例中,所述人源背景dna为pbmc的基因组dna。
57.在另一优选例中,所述的人源背景dna使用量为50ng。
58.应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
59.图1为根据鼠源tcr基因的保守区序列进行设计的四对引物探针。
60.图2为单反应中,四对引物探针的标准曲线,图2-1为未存在背景基因组dna;图2-2为存在背景基因组dna。
61.图3为双反应中,四对引物探针的标准曲线。
62.图4为标准曲线最低拷贝点的选取,其中,图4-1为标准曲线各点的扩增曲线,图4-2为使用10拷贝作为最低点的标准曲线,图4-3为去掉最低点10拷贝的标准曲线。
63.图5为不同引物d1浓度的双反应测试,图5-1为1倍引物浓度,图5-2为0.5倍引物浓度,图5-3为2倍引物浓度。
64.图6为不同浓度背景gdna的引物d1的双反应测试,图6-1为100ng gdna,图6-2为
50ng gdna,图6-3为25ng gdna。
65.图7为d1引物在50ng背景下,使用半量引物,进行多次重复的双反应实验。
66.图8为接受鼠源tcr-t细胞治疗的病人血样中的tcr基因拷贝数测定。
具体实施方式
67.本发明人通过广泛而深入的研究,开发了一种能够快速,准确的检测鼠源tcr转基因拷贝数的试剂和方法。为临床检测和产品放行时测定t细胞中鼠源tcr基因的拷贝数量提供可靠的实验方案。
68.为了解决上述技术问题,本发明的发明人在鼠源tcr保守区设计了四对taqman引物进行了目的基因单独反应测试,模拟真实人体样本加入人背景dna的目的基因单独反应测试,和模拟真实人体样本加入人背景dna的目的基因和内参基因双反应实验测试。筛选出了效果较好并符合检测标准的引物探针,其能够快速,准确的检测鼠源tcr转基因拷贝数。在此基础上完成了本发明。
69.试剂盒
70.本发明的试剂盒包括针对鼠源tcr保守区域的引物对和taqman探针,其中,所述的引物对选自下组:
71.(i)第一引物对(d1):第一引物对包括序列如seq id no:1和seq id no:2所示的引物;优选地所述
72.(ii)第二引物对(a1):第二引物对包括序列如seq id no:4和seq id no:5所示的引物;和
73.(iii)第一引物对和第二引物对的组合。
74.优选地,所述的引物对为第一引物对,并且所述试剂盒还包括序列如seq id no:3所示的第一taqman探针。
75.优选地,所述的引物对为第二引物对,并且所述试剂盒还包括序列如seq id no:6所示的第二taqman探针。
76.任选地,上述的试剂盒还包括选自下组的引物对:
77.(iii)第三引物对(b1):第三引物对包括序列如seq id no:7和seq id no:8所示的引物;和
78.(iv)第四引物对(c1):第四引物对包括序列如seq id no:10和seq id no:11所示的引物。
79.优选地,所述的引物对为第三引物对,并且所述试剂盒还包括序列如seq id no:9所示的第三taqman探针。
80.优选地,所述的引物对为第四引物对,并且所述试剂盒还包括序列如seq id no:12所示的第四taqman探针。
81.优选地,本发明所述taqman探针的5'端标记有荧光报告基团(如fam、vic),3'端标记有荧光淬灭基团(如mgb、tamra);
82.或者,所述taqman探针的3'端标记有荧光报告基团(如fam、vic),5'端标记有荧光淬灭基团(如mgb、tamra)。
83.本发明所述的试剂盒还包含1个或多个容器,上述引物对和taqman探针可以分别
放置在不同的容器或组合放置在相同的容器中。
84.试剂组合
85.本发明所述的试剂是指用于检测鼠源tcr转基因拷贝数的试剂组合。
86.本发明试剂包括第一引物对和第一taqman探针,第一引物对包括序列如seq id no:1和seq id no:2所示的引物;并且,第一taqman探针的序列如seq id no:3所示;和/或第二引物对和第二taqman探针,第二引物对包括序列如seq id no:4和seq id no:5所示的引物;并且,第二taqman探针的序列如seq id no:6所示;和/或rnase p内参基因引物/探针。
87.检测鼠源tcr的方法
88.本发明的检测鼠源tcr的方法是非诊断和非治疗性的,
89.包括如下步骤:
90.(a)提供一待检测的样品;
91.(b)用针对鼠源tcr保守区域的引物对和taqman探针,对所述的待检测的样品进行pcr扩增,从而测定tcr转基因的拷贝数;和
92.(c)基于所测定的tcr转基因的拷贝数,对待检测的样品的质量进行评价。
93.优选地,在步骤(b)中,采用第一引物对和第一taqman探针,和任选地rnase p内参基因引物/探针。
94.优选地,在步骤(b)中,采用单重或多重pcr扩增。
95.优选地,在步骤(b)中,采用第二引物对和第二taqman探针。
96.优选地,在步骤(b)中,采用第三引物对和第三taqman探针。
97.优选地,在步骤(b)中,采用第四引物对和第四taqman探针。
98.优选地,在步骤(b)中,同时或先后采用(y1)第一引物对和第一taqman探针以及(y2)第二引物对和第二taqman探针进行pcr扩增。
99.优选地,在步骤(b)中,通过比较ct值,从而确定tcr转基因的拷贝数。
100.优选地,在步骤(b)中,将待检测的样品的ct值与标准值或标准曲线进行比较,从而确定tcr转基因的拷贝数。
101.优选地,所述的待检测的样品包括核酸样品。
102.优选地,所述核酸样品是提取自m个细胞的总核酸,其中,m为正整数;较佳地,m为1、2、3、4、5、6、7、8、9、或10。
103.优选地,在步骤(b)中包括以下步骤:
104.s1)选取小鼠tcr保守区域作为目的基因片段;
105.s2)将该段目的基因片段插入到载体上从而构建标准质粒,将其作为标准品母液,然后进行梯度稀释得到系列标准品;
106.s3)对标准品和待测样品的基因进行实时荧光定量pcr(qpcr),以系列标准品的ct值及拷贝数绘制标准曲线,获得计算公式;
107.s4)将待测样品的ct值带入步骤s3)中的标准曲线的计算公式,获得待测样品的基因拷贝数。
108.优选地,在步骤(b)中包括以下步骤:
109.r1)选取小鼠tcr保守区域作为目的基因片段和已知序列的内参基因;
110.r2)将该段目的基因片段插入到载体上从而构建标准质粒,将其作为标准品母液,然后进行梯度稀释得到系列标准品;
111.r3)使用如权利要求1所述的试剂,对标准品和待测样品的基因进行实时荧光定量pcr(qpcr),以系列标准品的ct值及拷贝数绘制标准曲线,获得计算公式;
112.r4)使用内参基因rnasep的ct值计算每个样品的校准因子;
113.r5)通过与每μg基因组含内参基因的拷贝数进行校正,获得待测样品的每μg基因组中含tcr基因的拷贝数。
114.优选地,所述步骤(b)中,还包括加入人源背景dna。
115.优选地,所述人源背景dna为pbmc的基因组dna。
116.优选地,所述的人源背景dna使用量为50ng。
117.优选地,所述引物浓度为0.45μm,探针浓度为0.125μm。
118.优选地,标准品的最低拷贝数为10。
119.本发明的主要优点:
120.1、本发明检测方法标准曲线的线性r2介于0.994~0.999之间,扩增效率为92.3%~101.6%,标曲各浓度点的批内精密度介于0.09%~1.55%之间,批间精密度介于1.09%~3.07%,内参基因rnasep的批内精密度介于0.58%~2.30%,批间精密度为1.18%。因此,本发明具有良好的线性关系、扩增效率和精密度。
121.2、本发明的引物探针为临床检测和产品放行时测定t细胞中鼠源tcr基因的拷贝数量提供快速可靠的检测方法。
122.3、本发明的双反应法在一个反应中可实现目的基因和内参基因的同时检测,降低另行检测内参基因检测中产生的误差。
123.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
124.材料和通用方法
125.一、实验材料
126.1.仪器:
127.[0128][0129][0130]
2.引物和探针信息:
[0131]
2.1引物探针的设计:
[0132]
四对引物探针根据鼠源tcr基因的保守区序列进行设计,如图1所示:2.2引物探针序列信息:
[0133]
实验用引物探针均订购于thermo fisher,
[0134][0135]
[0136][0137][0138][0139]
3.质粒的合成与分装
[0140]
3.1标准质粒(puc57-pc25j)的设计,合成及分装
[0141]
标准质粒的设计根据taqman引物探针检测的目的片段进行。具体是将鼠源tcr的两段保守区构建于puc57载体上。保守区的序列如下:
[0142]
gacctgcgcaatgtgaccccccctaaggtgtccctgttcgagccttctaaggccgagatcgccaacaagaggaaggccaccctggtgtgcctggcaaggggcttctttccagatcacgtggagctgtcctggtgggtgaatggcaaggaggtgcactctggcgtgagcacagacccccaggcctacaaggagtccaactattcttactgcctgtctagccggctgagagtgagcgccaccttttggcacaaccccaggaatcacttccgctgtcaggtgcagtttcacggcctgtccgaggaggataagtggcctgagggctctcccaagcctgtgacacagaacatcagcgccgaggcatggggaagggcagactgtggcatcaccagcgcctcctatcagcagggcgtgctgagcgccacaatcctgtacgagatcctgctgggcaaggccaccctgtatgctgtgctggtgtcaactctggtggtcatggctatggtgaaacggaaaaactccatccagaatccagagcccgccgtgtatcagctgaaggacccacggagccaggatagcaccctgtgcctgttcaccgactttgatagccagatcaatgtgcctaagacaatggagtccggcacctttatcacagacaagaccgtgctggatatgaaggccatggacagcaagtccaacggcgccatcgcctggtctaatcagacaagcttcacctgccaggatatctttaaggagacaaacgccacctacccatctagcgacgtgccctgtgatgccaccctgacagagaagagcttcgagacagacatgaacctgaattttcagaacctgtccgtgatgggcctgagaatcctgctgctgaaggtggccggcttcaatctgctgatgacactgcgcctgtggtcctct(seq id no.:13)
[0143]
3.2puc57空载质粒
[0144]
puc57是不含目的基因的空载质粒。
[0145]
4.阴性对照
[0146]
阴性对照(nc)选用人pbmc的基因组dna。
[0147]
5.阳性对照
[0148]
阳性对照(pc)来自tcr阳性细胞基因组dna
[0149][0150]
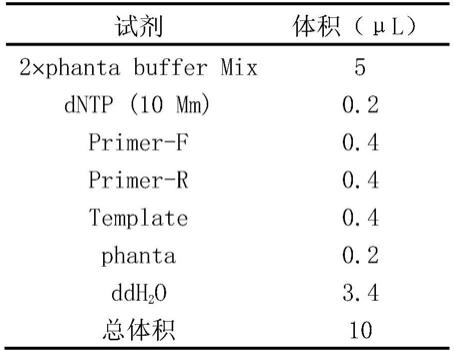
6.单反应实验:
[0151]
标准引物探针浓度(tcr引物0.9μm,探针0.25μm)
[0152][0153]
7.双反应实验:
[0154]
标准引物探针浓度(tcr引物0.9μm,探针0.25μm)
[0155]
[0156][0157]
双倍引物探针浓度(tcr引物1.8μm,探针0.5μm)
[0158][0159]
低倍引物探针浓度(tcr引物0.45μm,探针0.125μm)
[0160][0161]
上机进行qpcr检测,反应以标准条件进行:
[0162]
聚合酶活化:10min at 95℃
[0163]
pcr:40循环
[0164]
变性:15 sec at 95℃
[0165]
anneal/extend:60 sec at 60℃
[0166]
8.实验结果处理:
[0167]
反应结束后,软件自动输出每个样品的ct值和每个反应的阴阳性对照的tcr基因
拷贝数,根据rnasep的ct值计算每个样品的校准因子cf1=2-(ctrnasep(nc)-ctrnasep(pc))
。cf2=ct(pc)/average ct(pc),其中average ct(pc)为之前测定无误实验中阳性对照ct值的平均值。计算1μg pc基因组中tcr基因拷贝数:
[0168]
tcr基因拷贝数=拷贝数/每个反应加入的dna量(ng)
×
cf1
×
cf2
×
1000ng
[0169]
9.数据分析:
[0170]
标准曲线r2值应≥0.99,扩增效率在90%~110%之间;tcr基因的检测ct值阈值为0.1,方便优化实验方案过程中进行组间比较,实际进行检测时可将阈值设置为auto;rnasep内参基因检测的ct值阈值设为自动阈值;ntc和nc对照的ct值应为无或≥39。
[0171]
实施例1单反应taqman qpcr
[0172]
本实施例中,测试了对4组引物-探针试剂在有无dna背景情况下的扩增结果。
[0173]
方法如下:在仅存在tcr引物探针,而不存在内参基因rnasep引物探针的情况下检测4对tcr引物探针在没有和存在人源背景gdna时的标曲参数。
[0174]
四对引物探针的标准曲线如图2所示,其中,红色标记表示标准品、蓝色标记表示待测样品、绿色标记表示待测样品。
[0175]
四对引物探针无背景gdna的单反应参数信息如下:
[0176][0177]
四对引物探针存在背景gdna的单反应参数信息如下:
[0178][0179]
结果表明:
[0180]
(a)四组引物-探针在单反应,有无背景人源gdna的条件下,r2和扩增效率均达标。
[0181]
(b)在有背景人源gdna的条件下,a1和d1在单反应测试中显示出更高的扩增效率和更高的灵敏度,具有优异的可靠性。
[0182]
(c)在最小拷贝数为10拷贝到最大拷贝数107拷贝的范围内,无论是在存在或不存在背景人源gdna的条件下,四组引物-探针均可有效扩增获得所需的扩增产物,其中a1和d1的扩增特异性更好,几乎不受背景人源gdna干扰。而b1明显受到背景人源gdna的干扰。
[0183]
实施例2双反应taqman qpcr
[0184]
在存在tcr引物探针,同时存在内参基因rnasep引物探针的情况下检测4对tcr引物探针在存在人源背景gdna时的标曲参数。
[0185]
在双反应中,在反应体系中除了加入模拟病人血样的人源单核细胞基因组dna之外,还添加了检测内参基因rnasep的引物探针。在检测目的tcr基因的同时,对内参基因rnasep也进行检测。结果表明,在加入人源gdna模拟背景,进行双(duplex)反应实验时,四对引物的r2和扩增效率降低的很严重,均不能达标。其中,相对于其他三对引物探针,d1引物在双反应条件下数据相对较好,接近达标标准。后续针对引物d1进行实验条件优化。
[0186]
四对引物探针的标准曲线如图3所示,其中,红色标记表示标准品、蓝色标记表示待测样品、绿色标记表示待测样品。
[0187]
四对引物探针存在背景gdna的双反应参数信息如下:
[0188][0189]
注:und表示未检测到信号值。
[0190]
实施例3标准曲线最低拷贝点的选取
[0191]
在对已进行的实验结果分析可知,在标准曲线低拷贝进行反应时产生的误差较大如图4-1中红绿箭头所示间距(理论上红绿箭头所示间距应该相等,但在低拷贝数时,扩增效率明显降低),考虑增大最低点拷贝数。
[0192]
引物/探针d1在存在10拷贝点和去除10拷贝点后标准曲线如图4-2和图4-3所示,其中,红色标记表示标准品、蓝色标记表示待测样品、绿色标记表示待测样品。数据如下:
[0193][0194][0195]
拷贝数点的数据会影响整条标准曲线的r2和扩增效率。当去掉10拷贝点数据时,整条标曲的扩增效率达到标准。考虑后续将最低拷贝数10拷贝增加为50拷贝。
[0196]
实施例4不同浓度引物taqman qpcr测试d1引物探针
[0197]
在实验过程中,引物的用量是0.9μm,探针的用量是0.25μm。考虑改变引物探针的使用量是否可以优化扩增效率,故对d1引物探针使用不同浓度进行实验检测。不同浓度引物d1实验数据如图5。
[0198]
d1引物在不同引物浓度下的参数信息如下:
[0199][0200]
d1引物在不同浓度引物条件下r2达标,但仅在低浓度条件下扩增效率较为理想。
[0201]
实施例5不同背景gdna浓度条件下对低浓度引物d1测试
[0202]
通过实验可知在低浓度引物的用量时,可以有效的提高扩增效率。除了改变引物浓度,rnasep的反应对实验的干扰不可忽视。降低背景gdna的用量可以提高反应的扩增效率。在低浓度引物条件下检测不同浓度背景gdna对反应的影响,标准曲线如图6所示。d1引物在不同背景gdna浓度下的参数信息如下:
[0203][0204]
可见在50ng背景gdna条件下,使用一半d1引物浓度时,r2和扩增效率可以很好的满足实验标准。
[0205]
实施例6验证实验
[0206]
1、标曲的验证实验
[0207]
通过实验检测可知d1引物在50ng背景下,使用半量引物,进行双反应实验时,标曲参数较为理想。故对该条件进行多次实验验证,排除实验的偶然误差,实验结果见图7。
[0208]
引物d1在50ng背景,dna半倍用量下的四次重复实验数据如下:
[0209]
重复次数1234r20.9980.9990.9990.999eff%101.094102.655100.168103.953slope-3.296-3.2599-3.3179-3.2307
[0210]
四次重复实验标曲参数都符合要求,且较为稳定。
[0211]
2、准确度的验证实验
[0212]
通过以上实验数据可知,该taqman检测方法在建立标准曲线时,线性参数都可以满足实验需求。为了进一步验证该实验方案的检测准确性,通过检测预先配制好的不同拷贝数的质量控制品并比对测量值和理论值的差距,来验证该检测方案的准确性,同时确定检测的准确度范围。
[0213]
质控品拷贝数的范围根据实际检测拷贝数值来进行确定,分为定量上限(hloq),高质控(hqc),中高质控(mhqc),中质控(mqc),低质控(lqc)和定量下限(lloq)。各质控品在50ng gdna中对应的拷贝数分别是3.5
×
104,1.75
×
104,3500,700,140和28。质控品的配制
方法如下:
[0214][0215]
配置好的质控品统一进行分装,随测随取。保证指控品的一致性和每次检测实验的独立性。
[0216]
准确性验证实验独立进行5次,实验结果如下表1-5所示:
[0217]
表1.tcr基因标准曲线(线性和扩增效率)结果(cq)
[0218][0219]
表2.标准曲线rnasep精密度验证结果(cq)
[0220][0221]
表3.tcr基因精密度、准确度结果(拷贝数//50ng gdna反应)
[0222][0223]
表4.tcr基因精密度、准确度验证结果(cq)
[0224][0225]
表5.分析人员比对
[0226][0227]
tcr质粒标准品的稀释范围最初设计为10~1
×
107,由于双反应内参基因的影响,灵敏度略有下降,同时在初步的准确度实验探索中,最低点选用1
×
102较为合适,故tcr标准品质粒在1
×
102~1
×
107拷贝/反应范围内稀释。实验结果r2介于0.994~0.999之间,扩增效率为92.3%~101.6%。标曲各浓度点的批内精密度介于0.09%~1.55%之间。批间精密度介于1.09%~3.07%。内参基因rnasep的批内精密度介于0.58%~2.30%,批间精密度为1.18%。线性关系和精密度良好,满足方法学验证要求。
[0228]
tcr定量上限、高、中高、中、低质控、定量下限的批内准确度分别介于85.0%~107.6%、96.8%~119.7%、113.2%~133.0%、105.0%~147.8%、75.5%~99.4%、22.7%~112.2%之间,批间准确度分别为95.6%、107.6%、123.0%、123.1%、89.9%和64.8%。
[0229]
以拷贝数计算,tcr定量上限、高、中高、中、低质控、定量下限的批内精密度分别介于1.5%~6.8%、2.0%~2.4%、2.9%~5.4%、4.5%~16.2%、12.3%~27%、32.1%~96.6%之间,批间精密度分别为9.4%、9.2%、7.4%、16.1%、26.0%和62.2%。
[0230]
实施例7病人血样中的tcr基因拷贝数测定
[0231]
病人为nct03971747临床试验的肝癌症患者。在病人接受对接受afp特异性t tcr(鼠源)自体t细胞回输的第前13天抽取血样作为基线期参照点。在回输细胞后的当天和第
4,7,10,14,21,28天分别抽取血样进行检测。通过对各取样点血样中pbmc基因组dna进行鼠源tcr拷贝数检测,从而反映出afp tcr-t细胞在受试病人体内不同时程的动态扩增情况。在临床试验中,使用本方法,对接受t tcr(鼠源)自体t细胞治疗的病人血样中的tcr基因拷贝数进行定量测定,从而间接衡量tcr-t细胞扩增情况。
[0232]
实验结果如表6和图8所示
[0233]
表6
[0234][0235]
当未检测到信号时,标记为und
[0236]
当ct值>35时,标记为n/a
[0237]
结果表明:病人在接受低剂量afp tcr-t细胞静脉回输后,可以观察到tcr-t细胞在人体内增殖的情况。本方法可检测到较低水平的信号。反映了临床试验中使用低剂量时,改造后的t细胞扩增水平较低。同时也表明该检测方法具有较高灵敏度。
[0238]
实施例8荷瘤小鼠的肿瘤中tcr的拷贝数检测
[0239]
我们也使用本检测法对注射afp tcr(鼠源)-t细胞的荷瘤小鼠的肿瘤组织进行了检测。实验用小鼠选用来自百奥赛图的b-ndg品系小鼠,肿瘤造模通过皮下注射hepg2细胞并生长5天后实现。造模完成后,注射afp tcr-t细胞的第28天,取出实验小鼠体内的肿瘤组织并对其基因组dna进行鼠源tcr基因的检测
[0240]
实验结果如表7所示:
[0241]
表7
[0242][0243]
当未检测到信号时,标记为und
[0244]
当ct值>35时,标记为n/a
[0245]
实验结果表明:注射第28天后,空白、低和中等剂量组中未检测到信号。但在高剂量组中检测到了鼠源tcr的拷贝数,表明注射后的改造t细胞可以浸润靶标实体肿瘤组织发挥效应。
[0246]
小结
[0247]
在使用taqman方法检测tcr拷贝数时,标准曲线的建立推荐使用d1引物。在进行rnasep双反应时,标准曲线的最低拷贝数点使用10、50或100拷贝。具体使用情况视检测结果进行选择。
[0248]
另外,当背景gdna使用量为50ng时,d1引物,探针浓度量引物0.45μm,探针0.125μm。
[0249]
此外,本方法可应用于临床试验中检测,并具有较高灵敏度。
[0250]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。