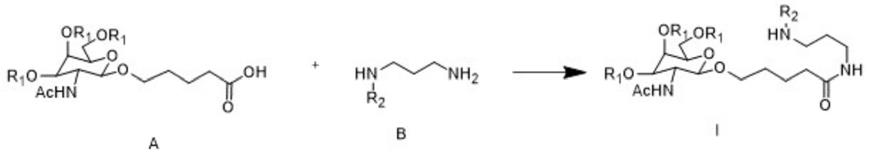
双特异性抗体
1.发明技术领域
2.本发明涉及表现出改善的药学性质的双特异性抗体、包含此类抗体的组合物以及此类抗体和组合物的用途,例如药物用途和治疗用途。
3.序列表
4.本技术与电子形式的序列表一起提交。该序列表的全部内容通过引用并入本文。
5.发明背景
6.血液凝固过程涉及数种蛋白质,这些蛋白质在血管损伤后共同作用以产生血凝块,血凝块防止体液严重流失和/或病原体入侵。导致血凝块形成的事件级联可以通过被称为内源性(接触)和外源性(组织因子)途径的两种途径来启动。每个途径由一系列酶原激活步骤组成,其中新激活的酶催化该系列中下一个酶原的激活,直到凝血酶原转化为凝血酶。凝血酶将纤维蛋白原转化为纤维蛋白网,并激活血小板以形成血小板栓,共同导致形成稳定的血凝块。外源性凝血途径的启动由膜结合组织因子(tf)与低水平循环因子viia(fviia)之间的复合物的形成来介导,膜结合组织因子(tf)因血管壁损伤而暴露。fviia:tf复合物通过激活少量凝血因子ix(fix)和因子x(fx)启动凝血级联。在初始阶段,低浓度的fxa产生微量的凝血酶,该凝血酶可以激活因子xi以及辅因子viii和v。在扩增阶段,装配成促凝血复合物,它们分别通过tenase(fixa、fviiia、ca
2
、磷脂)和凝血酶原酶(fxa、fva、ca
2
、磷脂)复合物显著增强fxa和凝血酶的生成。
7.在血友病a和b(分别为ha和hb)患者中,分别由于功能性fviii和fix的缺失或不足,使得凝血级联的各个步骤出现功能障碍。这导致凝血功能受损和不足,以及可能危及生命的出血,或对内部器官如关节的损伤。
8.重组fviia(rfviia)已被广泛用作旁路剂,用于按需(od)治疗具有抑制物(hwi)的血友病(a和b)患者的出血。rfviia当静脉内(iv)给药时全身半衰期短,为2
‑
3小时,在皮下(sc)给药时生物利用度低。rfviia的短全身半衰期被认为是由于数种机制的参与,包括血浆抑制物抗凝血酶iii(at)(h等人(2010)j.thromb.haemost.9:333
‑
8)和α
‑2‑
巨球蛋白(α2m)引起的抑制以及肾脏清除。rfviia的短全身半衰期和低sc生物利用度使得利用rfviia进行预防性处置具有挑战性。另外,rfviia的低内在活性需要施用更高的rfviia剂量。
9.因此,需要能够支持以较低频率给药和皮下施用进行预防性处置的改进的化合物。
10.roche最近推出了一种双特异性抗体——emicizumab,该抗体适用于通过皮下给药每周一次对ha和具有抑制物的ha(hawi)患者进行常规预防。尽管如此,为了改善和补充血友病患者的医护标准,开发具有替代作用机制的安全、有效的分子仍然是特别感兴趣的领域。
技术实现要素:
11.本发明涉及表现出改善的药学性质的双特异性抗体,尤其涉及可用于治疗患有先
天性和/或获得性凝血病的受试者,例如用于治疗患有具有或不具有抑制物的血友病a或b的患者的双特异性抗体。此外,本发明特别涉及能够结合凝血因子vii(fvii(a))和trem样转录物1(tlt
‑
1)的双特异性抗体。
12.在一方面,本发明的双特异性抗体包含(i)结合fvii(a)的第一抗原结合位点,和(ii)结合tlt
‑
1的第二抗原结合位点。
13.在本发明的一个方面,所述双特异性抗体延长内源性fviia的活性循环半衰期而不损失内源性fviia活性,并通过将其选择性地定位于活化的血小板来刺激内源性fviia活性。
14.在本发明的实施方案中,所述双特异性抗体包含fc区。该fc区介导双特异性抗体的循环,从而延长其在循环中的半衰期。
15.在本发明的实施方案中,所述第一抗原结合位点在竞争性elisa测定中与任何一种包含如下所示的轻链可变域(vl)和重链可变域(vh)的抗fvii(a)抗体竞争结合fvii(a):
16.·
mab0522(vl:seq id no:846和vh:seq id no:850),
17.·
fab0883(vl:seq id no:814和vh:seq id no:818),
18.·
mab0005(vl:seq id no:750和vh:seq id no:754),
19.·
mab0004(vl:seq id no:14和vh:seq id no:18),
20.·
mab0013(vl:seq id no:46和vh:seq id no:50),
21.·
mab0018(vl:seq id no:62和vh:seq id no:66),
22.·
mab0544(vl:seq id no:694和vh:seq id no:698),
23.·
mab0552(vl:seq id no:702和vh:seq id no:706),
24.·
mab0001(vl:seq id no:710和vh:seq id no:714),
25.·
mab0007(vl:seq id no:718和vh:seq id no:722),
26.·
mab0578(vl:seq id no:726和vh:seq id no:730),
27.·
mab0701(vl:seq id no:734和vh:seq id no:738),和
28.·
mab0587(vl:seq id no:742和vh:seq id no:746)。
29.在本发明进一步的实施方案中,所述双特异性抗体的第一抗原结合位点能够结合包含fvii(a)(seq id no:1)的氨基酸残基h115、t130、v131和r392的表位。
30.在本发明的一个方面,将所述双特异性抗体配制成包含本发明的双特异性抗体和药学上可接受的载体的药物制剂。
31.在本发明的一个方面,所述双特异性抗体经肠胃外施用,例如静脉内、肌肉内或皮下施用。在本发明的一个方面,所述双特异性抗体允许预防性处置患有先天性和/或获得性凝血病如血友病a、血友病b、具有抑制物的血友病a或具有抑制物的血友病b的受试者。因此,所述双特异性抗体被设计为提供针对出血的止血覆盖。在本发明的一个方面,所述双特异性抗体被设计为例如适合每周一次、每月一次或频率更低的给药。
32.用本发明的双特异性抗体进行医学治疗可以提供许多优点,例如注射之间的持续时间更长、给药更方便和注射之间可能改善的止血保护。因此,本文所述的双特异性抗体可能对患有具有或不具有抑制物的血友病a或b的个体的生活质量具有重大影响。
33.序列表简述
34.表1是抗体及其相应vl和vl结构域序列的对应seq id no的概览。重链恒定域的类
型如表2a中所定义(“m”表示鼠igg1恒定域)。
35.表2a是用于重组表达二价抗体、单价(oa)抗体和双特异性抗体的不同形式的概览。列出了对应于第一重链(hc
‑
1)和第二重链(hc
‑
2,或对于oa抗体为截短的重链(trhc))的seq id no。轻链恒定域在所有情况下均为对应于seq id no:12的人κ。
36.表2b是本发明的鼠抗fvii(a)抗体的概览。克隆名称、完全鼠(杂交瘤衍生的,重组表达的mab0765除外)抗体的缩写与相应鼠/人嵌合变体(鼠可变域、人igg4 s228p恒定域)之间的对应关系。
37.表2c是鼠和人源化11f2谱系中的抗体的概览。
38.表2d是抗tlt
‑
1mab0012谱系的抗体的概览。
39.表1:
40.41.42.43.[0044][0045]
表2a:
[0046]
表2b:
[0047]
[0048][0049]
表2c:
[0050]
抗体可变域恒定域mab0005鼠vl/vhmmab0048鼠vl/vhafab0076鼠vl/vhgmab0077(oa)鼠vl/vhemab0705(oa)人源化vl/vhffab0883人源化vl/vhgmab0865人源化vl/vhbmab0522人源化vl/vhk
[0051]
表2d:
[0052]
抗体可变域恒定域mab0012鼠vl/vhmmab0082鼠vl c41a/vh t61aamab1076人源化vl/vhamab0524人源化vl/vhj
[0053]
在本发明中,重组产生的抗体均在人igg4背景中表达,并且均含有标准铰链稳定化置换s228p(eu编号)。在一些变体中,重链的c末端赖氨酸(k447,在体内迅速裂解;参见cai等人,biotechnol.bioeng.2011vol.108,pp 404
‑
412)被省略(称为delta
‑
lys)。额外的置换根据表2a被引入重链恒定域中,以确保双特异性和单价抗体中所需的链配对(duobody突变f405l r409k(labrijn等人.pnas 2013,vol.110,pp.5145
–
5150)和杵臼突变(参见carter等人.j.imm.methods 2001,vol.248,pp.7
‑
15)t366w(杵)和t366s l368a y407v(臼)),或延长体内半衰期(yte突变,m252y s254t t256e(dall'acqua等人.j.biol.chem.2006,vol.18,pp.23514
‑
23524))。本发明的所有重组产生的抗体都具有人κ轻链恒定域(seq id no:12)。
[0054]
发明详述
[0055]
本发明涉及表现出改善的药学性质的抗体组合物的设计和用途。具体而言,涉及能够结合凝血fvii(a)和tlt
‑
1的双特异性抗体。
[0056]
抗体
[0057]
本文中的术语“抗体”是指自免疫球蛋白序列衍生的蛋白质,其能够与抗原或其一部分结合。术语抗体包括但不限于任何类别(或同种型)的全长抗体,即iga、igd、ige、igg、igm和/或igy。
[0058]
对治疗性抗体特别有意义的是igg亚类,根据其重链恒定区的序列,其在人类中被被分为4个亚类:igg1、igg2、igg3和igg4。根据其序列组成的差异,轻链可被分为两种类型:
κ和λ链。igg分子由两条通过两个或更多个二硫键相互连接的重链和两条各自通过二硫键连接至重链的轻链组成。igg重链可包含一个重链可变域(v
h
)和最多三个重链恒定(c
h
)域:c
h
1、c
h
2和c
h
3。轻链可包含轻链可变域(v
l
)和轻链恒定域(c
l
)。v
h
和v
l
区可进一步细分为超变区,被称为互补决定区(cdr),其中散布有更保守的区域,被称为框架区(fr)。vh和vl域通常由三个cdr和四个fr组成,它们从氨基末端到羧基末端按以下顺序排列:fr1,cdr1,fr2,cdr2,fr3,cdr3,fr4。含有高变区(cdr)的重链和轻链可变域构成能够与抗原相互作用的结构,而抗体的恒定区可以介导抗体与fc受体和经典补体系统的c1复合物的第一组分c1q的结合。
[0059]
术语“抗原结合位点”或“结合部分”是指允许抗原结合的抗体部分。
[0060]
术语抗体的“抗原结合片段”是指抗体的片段,其保留如本文所述的结合其同源抗原如fvii(a)、tlt
‑
1或另一种靶分子的能力。抗原结合片段的实例包括(但不限于)fab、fab'、fab2、fab'2、fv、单链fv(scfv)或单个v
h
或v
l
结构域。
[0061]
如本文所用的术语“单臂抗体”是指由抗体重链、缺少fab区的截短重链和单条轻链组成的特定类型的单价抗体片段。
[0062]
如本文所用的术语“单特异性”抗体是指能够与一种特定表位结合的抗体(包括但不限于二价抗体)。
[0063]
本文中的术语“双特异性抗体”和“biab”是指能够与两种不同抗原如fvii(a)和tlt
‑
1或相同抗原上的两种不同表位结合的抗体。
[0064]
本发明的双特异性抗体衍生自抗体或其抗原结合片段。本发明的双特异性抗体可以是抗体和抗体的抗原结合片段例如fab、fab'、fab2、fab'2或scfv的融合物或缀合物。本发明的双特异性抗体也可以是抗体片段的融合物或缀合物。衍生自抗体和抗体片段的双特异性抗体的众多分子形式是本领域已知的,参见,例如(spiess等人:molecular immunology 67,(2015),pp.95
–
106)和(brinkmann和kontermann:mabs,9(2017),pp182
–
212)。
[0065]
双特异性抗体可以通过本领域描述的多种方式制备,参见,例如(spiess等人:molecular immunology 67,(2015),pp.95
–
106)和(brinkmann和kontermann:mabs,9(2017),pp 182
–
212)。例如,所需的重链配对可以通过工程改造fc区的二聚化界面以促进异二聚化来实现。其中一个实例是所谓的杵臼(knob
‑
in
‑
hole)突变,其中空间上庞大的侧链(杵)被引入一个fc中,该fc被相对fc上的空间上较小的侧链(臼)匹配,从而产生促进异二聚化的空间互补性。用于工程构建异二聚化fc界面的其他方法是静电互补、与非igg异二聚化结构域融合或利用人igg4的自然fab
‑
臂交换现象在体外进行异二聚化。异二聚化的双特异性抗体的实例在文献中有充分描述,例如(klein c等人;mabs.2012 4,pp 653
–
663)。必须特别注意异二聚体抗体中的轻链。通过使用共同的轻链可以实现lc与hc的正确配对。lc/hc界面的工程化可用来促进异二聚化或轻链交叉工程化,如crossmabs。在轻度还原条件下,在体外从含有适当突变的两个单独igg重装配抗体也可用来产生双特异性抗体(例如,labrijn等人,pnas,110(2013),pp 5145
‑
5150)。还报道了自然fab
‑
臂交换方法以确保正确的轻链配对。
[0066]
如本文所用的术语“多特异性”抗体是指能够与两种或更多种不同抗原或相同抗原上的两种或更多种不同表位结合的抗体。因此,多特异性抗体包括双特异性抗体。
[0067]
本发明的抗体可以与本领域已知的其他抗体和抗体片段组合,产生双特异性、三特异性或多特异性抗体分子。
[0068]
在一方面,本发明的抗体是嵌合抗体、人抗体或人源化抗体。这样的抗体可以通过使用例如合适的抗体展示或免疫平台或本领域已知的其他合适的平台或方法来产生。
[0069]
此外,如果抗体含有恒定区,则该恒定区或其部分也来源于人种系免疫球蛋白序列。本发明的人抗体可包括不是由人种系免疫球蛋白序列编码的氨基酸残基(例如,通过体外随机或位点特异性诱变或通过体内体细胞突变引入的突变)。
[0070]
人抗体可以从基于人种系序列的选择而建立的、用天然和合成序列多样性进一步多样化的序列文库中分离。人抗体可以通过人淋巴细胞的体外免疫及随后用eb病毒转化该淋巴细胞来制备。人抗体可以通过本领域已知的重组方法产生。
[0071]
如本文所用的,术语“人源化抗体”是指含有来源于非人免疫球蛋白的序列(cdr区或其部分)的人/非人抗体。因此,人源化抗体是这样的人免疫球蛋白(接受体抗体),其中至少来自该接受体的高变区的残基被来自非人类物种如小鼠、大鼠、兔或非人灵长类动物的抗体(供体抗体)的高变区的残基所替代,其具有所需的特异性、亲和力、序列组成和功能性。在一些情况下,人免疫球蛋白的框架(fr)残基被相应的非人类残基所替代。这类修饰的一个实例是引入一个或多个所谓的回复突变,该回复突变一般是来源于供体抗体的氨基酸残基。抗体的人源化可采用本领域技术人员已知的重组技术进行(参见,例如,antibody engineering,methods in molecular biology,vol.248,由benny k.lo编著)。对轻链和重链可变域均适合的人类接受体框架可通过例如序列或结构同源性来鉴定。或者,例如,可基于对结构、生物物理学和生物化学性质的了解使用固定的接受体框架。该接受体框架可以是种系衍生的或衍生自成熟的抗体序列。来自供体抗体的cdr区可以通过cdr移植进行转移。可通过确定关键框架位置来进一步在例如亲和力、功能性和生物物理学性质方面优化cdr移植的人源化抗体,在该关键框架位置处再次引入(回复突变)来自供体抗体的氨基酸残基对人源化抗体的性质具有有利影响。除了来源于供体抗体的回复突变外,还可通过在cdr或框架区中引入种系残基、消除免疫原性表位、定点诱变、亲和力成熟等对人源化抗体进行工程化。此外,人源化抗体可包含在接受体抗体或供体抗体中未发现的残基。进行这些修饰以进一步改善抗体性能。人源化抗体也可任选地包含免疫球蛋白恒定区的至少一部分(fc),一般是人免疫球蛋白的相应部分。
[0072]
如本文所用的,术语“嵌合抗体”是指包含来源于两个或更多个物种的抗体的部分的抗体。例如,编码这类抗体的基因包括编码源自两个不同物种的可变域的基因和编码源自两个不同物种的恒定域的基因。例如,编码小鼠单克隆抗体可变域的基因可以连接至编码人源抗体恒定域的基因。
[0073]
抗体或其片段可按照其互补决定区(cdr)来定义。术语“互补决定区”在本文中使用时是指参与抗原结合的氨基酸残基通常位于其中的抗体区域。cdr可被鉴定为在抗体可变域之间具有最高可变性的区域。数据库如kabat数据库可用于cdr鉴定,例如,cdr被定义为包含轻链可变域的氨基酸残基24
‑
34(l1)、50
‑
56(l2)和89
‑
97(l3)以及重链可变域的31
‑
35(h1)、50
‑
65(h2)和95
‑
102(h3);(kabat等人.1991;sequences of proteins of immunological interest,第五版,u.s.department of health and human services,nih公开号91
‑
3242)。通常,该区域中氨基酸残基的编号通过kabat等人(同上)描述的方法进
行。本文中诸如“kabat位置”、“kabat残基”和“根据kabat”等短语是指用于重链可变域或轻链可变域的这一编号体系。通过使用kabat编号体系,肽的实际线性氨基酸序列可含有较少的或额外的氨基酸,这对应于可变域的框架(fr)或cdr的缩短或向其中的插入。例如,重链可变域可包含在cdr h2的残基52后的氨基酸插入(根据kabat的残基52a、52b和52c)以及在重链fr残基82后插入的残基(例如,根据kabat的残基82a、82b和82c等)。可通过将抗体序列的同源性区域与“标准的”kabat编号的序列进行比对,来确定给定抗体的残基的kabat编号。仅在具体说明时才根据kabat编号,否则根据指定的seq id no,编号是连续的。
[0074]
术语“框架区”或“fr”残基是指如本文定义的不在cdr内的那些v
h
或v
l
氨基酸残基。
[0075]
本发明的抗体可包含来自本文公开的一种或多种特异性抗体的cdr区。
[0076]
术语“抗原”(ag)是指用于对免疫活性脊椎动物进行免疫以产生识别该ag的抗体(ab)的分子实体。在本文中,ag被更广泛地称谓,并且通常旨在包括被ab识别的靶分子。
[0077]
本发明包括本发明的抗体或其抗原结合片段的变体,其可以在本文公开的各个序列中包含1、2、3、4或5个氨基酸置换和/或缺失和/或插入。
[0078]“置换”变体优选地涉及将一个或多个氨基酸替换为相同数目的氨基酸。
[0079]
如本文所用的术语“表位”在“抗原结合多肽”如抗体(ab)与其相应抗原(ag)之间的分子相互作用的背景下来定义。通常,“表位”是指在ag上的、与ab结合的区或区域,即与ab物理接触的区或区域。在本发明中,表位使用x射线衍生的晶体结构来确定,定义了ab如fab片段与其ag之间的复合物的空间坐标。除非另有说明或与上下文相矛盾,否则术语表位在本文中被定义为ag(在此为fvii(a)或tlt
‑
1)残基,其特征在于具有在与fab中的重原子相距的距离内的重原子(即非氢原子)。
[0080]
如果在氨基酸水平上描述的,例如由x射线结构确定的表位含有相同的一组氨基酸残基,则这些表位被称为是相同的。如果表位共有至少一个氨基酸残基,则这些表位被称为是重叠的。如果表位没有共有氨基酸残基,则这些表位被称为是不同的(独特的)。
[0081]
术语“互补位”的定义通过反转视角,来源于以上对“表位”的定义。因此,术语“互补位”是指在抗体或其片段上与抗原结合的区或区域,即与抗原物理接触的区或区域。除非另有说明或与上下文相矛盾,否则术语互补位在本文中被定义为ab残基,其特征在于具有在与fvii(a)或tlt
‑
1中的重原子相距的距离内的重原子(即非氢原子)。
[0082]
抗原上的表位可以包含一个或多个热点残基,即对于与同源抗体的相互作用特别重要的残基,并且其中由所述热点残基的侧链介导的相互作用显著有助于用于抗体/抗原相互作用的结合能(peng等人,pnas 111(2014),e2656
‑
e2665)。可以通过测试其中单个表位残基已经被置换为例如丙氨酸的抗原变体与同源抗体的结合,来鉴定热点残基。如果用丙氨酸置换表位残基对与抗体的结合具有强烈影响,则所述表位残基被认为是热点残基,因此对于抗体与抗原的结合特别重要。
[0083]
与相同抗原结合的抗体可就其同时与其共同抗原结合的能力进行表征,并且可以经历“竞争结合”/“分箱(binning)”。在该语境下,术语“分箱”是指对与相同抗原结合的抗体进行分组的方法。抗体的“分箱”可以基于在以标准技术为基础的试验中两种抗体与其共同抗原的竞争结合。使用参考抗体来定义抗体的“箱元”。如果第二抗体不能与参考抗体同时与抗原结合,则称第二抗体与参考抗体属于同一“箱元”。在这种情况下,参考抗体和第二抗体竞争性地结合抗原的相同部分,因此被划归为“竞争抗体”。如果第二抗体能够与参考
抗体同时与抗原结合,则称第二抗体属于不同的“箱元”。在这种情况下,参考抗体和第二抗体不会竞争性地结合抗原的相同部分,因此被划归为“非竞争抗体”。
[0084]
用于确定抗体是否与本文公开的抗fvii(a)或抗tlt
‑
1抗体竞争结合的竞争测定是本领域已知的。示例性的竞争测定包括免疫测定(例如,elisa测定、ria测定)、表面等离子体共振分析(例如,使用biacore
tm
仪器)、生物层干涉测量法和流式细胞术。
[0085]
通常,竞争测定涉及使用与固体表面结合或在细胞表面上表达的抗原、测试fvii
‑
或fviia结合抗体和参考抗体。参考抗体被标记,而测试抗体未被标记。通过测定在测试抗体的存在下与固体表面或细胞结合的经标记参考抗体的量来测量竞争性抑制。通常,测试抗体过量存在(例如,1、5、10、20、100、1000、10000或100000倍)。在竞争测定中被鉴定为具有竞争性的抗体(即,竞争抗体)包括与参考抗体结合相同表位或重叠表位的抗体,以及结合与参考抗体所结合的表位足够接近以发生空间位阻的相邻表位的抗体。
[0086]
在示例性竞争测定中,使用市售试剂对参考抗fvii或抗fviia抗体进行生物素化。将生物素化的参考抗体与测试抗体或未标记的参考抗体(自竞争对照)的系列稀释液混合,得到各种摩尔比(例如,1、5、10、20、100、1000、10000或100000倍)的测试抗体(或未标记的参考抗体)与标记的参考抗体的混合物。将该抗体混合物加至fvii或fviia多肽包被的elisa板上。然后洗板,并将辣根过氧化物酶(hrp)
‑
链霉亲和素加至板上作为检测试剂。在加入本领域已知的显色底物(例如,tmb(3,3',5,5'
‑
四甲基联苯胺)或abts(2,2"
‑
连氮
‑
二
‑
(3
‑
乙基苯并噻唑啉
‑6‑
磺酸盐))后检测与靶抗原结合的经标记参考抗体的量。光密度读取(od单位)使用分光计(例如,m2分光计(molecular devices))进行。对应于0%抑制的响应(od单位)从没有任何竞争抗体的孔确定。对应于100%抑制的响应(od单位),即测定背景,从没有任何经标记的参考抗体或测试抗体的孔确定。每种浓度下测试抗体(或未标记的参考抗体)对fvii或fviia的标记参考抗体的抑制百分比计算如下:%抑制=(1
‑
(od单位
‑
100%抑制)/(0%抑制
‑
100%抑制))*100。
[0087]
本领域技术人员将会理解,可以进行类似的测定来确定两种或更多种抗tlt
‑
1抗体是否共有结合区、箱元并且/或者竞争性结合抗原。本领域技术人员还将理解,可以使用本领域已知的各种检测系统进行竞争测定。
[0088]
如果过量的一种抗体(例如,1、5、10、20、100、1000、10000或100000倍)抑制另一种抗体的结合,如在竞争性结合测定中测量的,例如抑制至少50%、75%、90%、95%或99%,则测试抗体与参考抗体竞争结合抗原。
[0089]
除非另有说明,否则使用如上所述以及在实施例7和实施例32中提供的竞争性elisa测定来确定竞争。
[0090]
术语“结合亲和力”在本文中用作两种分子(例如抗体或其片段和抗原)之间的非共价相互作用的强度的度量。术语“结合亲和力”用来描述单价相互作用。通过测定平衡解离常数(k
d
),可以对两种分子(例如抗体或其片段和抗原)之间通过单价相互作用的结合亲和力进行定量。可以通过测量复合物形成和解离的动力学,例如通过如实施例6和16中进行的表面等离子体共振(spr)或本领域已知的其他方法来确定k
d
。与单价复合物的结合和解离相对应的速率常数分别被称为结合速率常数k
a
(或k
结合
)和解离速率常数k
d
(或k
解离
)。通过方程式k
d
=k
d
/k
a
,将k
d
与k
a
和k
d
相关联。
[0091]
按照上面的定义,通过比较单个抗体/抗原复合物的k
d
值,可以比较与不同的分子相互作用有关的结合亲和力,例如比较不同抗体对给定抗原的结合亲和力。
[0092]
本发明抗体对其靶标的k
d
可以小于1pm,例如小于10pm,例如小于100pm,例如小于200pm,例如小于400pm,例如小于600pm,例如小于1nm,例如小于5nm,例如小于10nm,例如小于20nm,例如小于50nm,例如小于100nm,例如小于200nm,例如小于400nm,例如小于600nm,例如小于800nm。
[0093]
在一个这样的实施方案中,所述抗体是包含抗fvii(a)臂和第二抗tlt
‑
1臂的双特异性抗体,所述抗fvii(a)臂对fviia的k
d
小于1pm,例如小于10pm,例如小于100pm,例如小于200pm,例如小于400pm,例如小于600pm,例如小于1nm,例如小于5nm,例如小于10nm,例如小于20nm,例如小于50nm,例如小于100nm,例如小于200nm,例如小于400nm,例如小于600nm,例如小于800nm,并且所述第二抗tlt
‑
1臂对tlt
‑
1的k
d
小于1pm,例如小于10pm,例如小于100pm,例如小于200pm,例如小于400pm,例如小于600pm,例如小于1nm,例如小于5nm,例如小于10nm,例如小于20nm,例如小于50nm,例如小于100nm,例如小于200nm,例如小于400nm,例如小于600nm,例如小于800nm。
[0094]
本领域所知的术语“同一性”是指通过比较序列而确定的两种或更多种多肽的序列之间的关系。在本领域中,“同一性”还表示多肽之间的序列相关性程度,如根据两个或更多个氨基酸残基的残基串之间的匹配数所确定的。“同一性”衡量通过特定数学模型或计算机程序(即“算法”)得到的具有空位对齐(如果有的话)的两个或更多个序列之间与较小者相同匹配的百分比。通过已知方法可以容易地计算相关多肽的同一性。在本发明中,使用来自emboss
‑
6.6.0的needleman(needleman等人,j.mol.biol.1970;48:443
‑
453)确定相似性和同一性,其中对于空位打开和延伸分别使用参数10和0.5(gapopen=10,gapextend=0.5)。
[0095]
抗体的片段可结晶区(“fc区”/“fc域”)是包含铰链和恒定c
h
2和c
h
3结构域的抗体c末端区。
[0096]
本发明的抗体可包含可以具有野生型氨基酸序列的fc区,或者它可包含调节抗体效应子功能的氨基酸置换,参见例如(wang等人:protein cell.9(2018),pp.63
‑
73)。具有修饰的效应子功能的fc变体的具体实例是与fcγ受体的结合已经降低的变体。这样的变体的一个具体实例是包含置换l234a、l235e、g237a、a330s和p331s(根据eu索引的残基编号)的igg1,其对某些fcγ受体和clq的亲和力降低。
[0097]
双特异性分子
[0098]
本文中的术语“双特异性分子”是指能够结合不同靶标如fvii(a)和tlt
‑
1的分子。该双特异性分子的结合部分可以衍生自抗体,或者可以是非抗体来源的。双特异性分子的一个特定实例是双特异性抗体。
[0099]
在本发明的一个方面,所述双特异性分子包含能够结合因子vii(a)的第一抗原结合位点和能够结合trem样转录物1(tlt
‑
1)的第二抗原结合位点。
[0100]
本发明的双特异性分子可包含非抗体衍生的结合部分,也被称为替代支架。本发明的双特异性分子可以是替代支架的融合物或缀合物。本发明的双特异性分子可以是抗体和替代支架的融合物或缀合物。本发明的双特异性分子也可以是抗体片段和替代支架的融合物或缀合物。
[0101]
大量和多种替代支架是本领域已知的,参见,例如(simeon和chen:protein cell 9(2018),pp.3
–
14)、(和kolmar:microbial cell factories(2018),pp.17
‑
32)和(nygren和skerra:journal of immunological methods 290(2004),pp 3
–
28)。
[0102]
替代支架的具体实例是adnectins、affilins、anticalins、avimers、atrimers、fn3支架、fynomers、obodies、kringle结构域、kunitz结构域、knottins、affibodies、darpins、双环肽和cys
‑
knots。
[0103]
因子vii(a)
[0104]
本文中的术语“因子vii”和“fvii”是指凝血因子vii的酶原。本文中的术语“因子viia”和“fviia”是指活化的凝血因子vii,其为丝氨酸蛋白酶。本文中的术语“因子vii(a)”和“fvii(a)”包括未切割的酶原——因子vii(fvii),以及被切割并因此活化的蛋白酶——因子viia(fviia)。本文中的术语“因子vii(a)”和“fvii(a)”包括可能存在的fvii(a)的天然等位基因变体。seq id no:1中提供了一种野生型人因子vii(a)序列。
[0105]
野生型人凝血因子vii(a)(seq id no.1):
[0106][0107]
野生型fvii(a)由406个氨基酸残基组成,并且由四个结构域组成。存在n末端富含γ
‑
羧基谷氨酸(gla)的结构域,其中10个谷氨酸残基(在上面的序列中以粗体突出显示)可以被γ
‑
羧化。gla结构域之后是两个表皮生长因子(egf)样结构域和c末端丝氨酸蛋白酶结构域。fvii和fviia都存在于循环中,但fviia仅以低丰度存在(约占总fvii(a)池的1%;morrissey jh,broze jr gj.tissue factor and the initiation and regulation(tfpi)of coagulation.于:marder vj,aird wc,bennett js,schulman s,white ii gc编.hemostasis and thrombosis:basic principles and clinical practice.第6版.wolters kluwer&lippincott williams&wilkins:philadelphia;2013.p.163
–
78)。fvii可以通过残基arg152与ile153之间的蛋白水解裂解被激活为fviia,从而产生由轻链和重链组成的双链fviia分子。fviia中的两条链通过二硫键栓系。轻链包含gla和egf样结构域,而重链包含蛋白酶结构域。fviia需要与其细胞表面辅因子组织因子(tf)结合才能达到其全部生物活性。
[0108]
预测的全长食蟹猴(macaca fascicularis)fvii同种型x1由406个氨基酸组成,
invest 2009;119:1489
‑
3824)。最近表明,tlt
‑
1也结合von willebrand因子(doerr a等人,international society of thrombosis and haemostasis 2019的摘要pb359)。提示stlt
‑
1通过抑制白细胞活化和调节血小板
‑
嗜中性粒细胞串扰在与脓毒症相关的出血中起作用(derive,j immunol 2012,188:5585
–
5592)。
[0118]
就本发明而言,tlt
‑
1可以来自任何脊椎动物,如任何哺乳动物,如啮齿动物(如小鼠、大鼠或豚鼠)、兔类动物(如兔)、偶蹄动物(如猪、牛、绵羊或骆驼)或灵长类动物(如猴子或人类)。tlt
‑
1优选地是人tlt
‑
1。tlt
‑
1可以从产生功能性tlt
‑
1蛋白的任何天然存在的基因型或等位基因翻译而来。一种人tlt
‑
1的非限制性实例是seq id no:2的多肽序列。
[0119]
tlt
‑
1抗体的靶分子可以是本文所述的任何tlt
‑
1分子。
[0120]
抗fvii(a)抗体
[0121]
本文中的术语“抗fvii(a)抗体”是指以fvii(a)作为其靶标的抗体。抗fvii(a)抗体能够结合本文所述的fvii(a)分子;包括但不限于在人血浆中发现的内源性fvii(a),外源性fvii(a),如重组野生型人fvii(a),以及在动物血浆中,例如在兔、小鼠、大鼠、狗或猴子中发现的内源性fvii(a)。
[0122]“抗fvii(a)抗体”可以是以fvii(a)作为其靶标的单克隆、单特异性抗体。单特异性抗fvii(a)抗体通常包含两个相同的结合fvii(a)的抗原结合位点;非限制性实例是单克隆igg4抗fvii(a)抗体。
[0123]
合适的抗fvii(a)抗体包括但不限于表3中所示的任何一种抗fvii(a)抗体。
[0124]
表3:
[0125][0126]
抗fvii(a)抗体可能能够与表3中所示的任何一种抗体竞争结合fvii(a)。抗fvii(a)抗体是否与表3中所示的任何一种抗体竞争结合fvii(a),可以使用公知的方法(即,竞争性结合测定),如表面等离子体共振(spr)、elisa或流式细胞术来确定。实施例7描述了如何使用竞争性elisa确定与fvii(a)的竞争性结合。
[0127]
在一个实施方案中,抗fvii(a)抗体以高亲和力结合fvii(a)。抗fvii(a)抗体对其靶标的k
d
可以小于1pm,例如小于10pm,例如小于100pm,例如小于200pm,例如小于400pm,例如小于600pm,例如小于1nm,例如小于5nm,例如小于10nm,例如小于20nm,例如小于50nm,例如小于100nm,例如小于200nm,例如小于400nm,例如小于600nm,例如小于800nm。在体内,高亲和力抗fvii(a)抗体通过与fvii(a)形成复合物来降低fvii(a)的清除。因此,它延长了fvii(a)的半衰期,并使其在循环中积累。以这种方式,该抗体可以提供升高的稳态fvii(a)浓度。
[0128]
在一个实施方案中,抗fvii(a)抗体不干扰fvii(a)的生物学功能。在一个实施方案中,抗fvii(a)抗体不阻止内源性fvii被激活为fviia。例如,抗fvii(a)抗体不干扰fvii在与tf结合时转化为fviia(即自动激活)的能力(如实施例12中所述)。另外优选的是,抗fvii(a)抗体不阻止fvii(a)与组织因子(tf)形成所谓的起始复合物,并以依赖于或不依赖于tf的方式激活因子x(fx)(如实施例10中所述)。在一个实施方案中,抗fvii(a)抗体不与fvii(a)底物或辅因子竞争。然而,抗fvii(a)抗体可能与fviia的抑制物如抗凝血酶(at)和
α
‑2‑
巨球蛋白竞争(如实施例11中所述)。
[0129]
抗tlt
‑
1抗体
[0130]
本文中的术语“抗tlt
‑
1抗体”是指以tlt
‑
1作为其靶标的抗体。抗tlt
‑
1抗体能够与本文所述的tlt
‑
1分子结合。“tlt
‑
1抗体”可以是单克隆、单特异性抗体。
[0131]
合适的抗tlt
‑
1抗体包括但不限于表4中所示的抗tlt
‑
1抗体。
[0132]
表4:
[0133][0134][0135]
抗tlt
‑
1抗体可能能够与表4中所示的任何一种抗体竞争结合tlt
‑
1。抗tlt
‑
1抗体是否与表4中所示的任何一种抗体竞争结合tlt
‑
1,可以使用公知的方法(即,竞争性结合测定),如表面等离子体共振(spr)、elisa或流式细胞术来确定。可以使用竞争性elisa确定与tlt
‑
1的竞争性结合。实施例32描述了如何使用竞争性elisa确定与tlt
‑
1的竞争性结合。
[0136]
抗tlt
‑
1抗体对其靶标的k
d
可以小于1pm,例如小于10pm,例如小于100pm,例如小于200pm,例如小于400pm,例如小于600pm,例如小于1nm,例如小于5nm,例如小于10nm,例如小于20nm,例如小于50nm,例如小于100nm,例如小于200nm,例如小于400nm,例如小于600nm,例如小于800nm。
[0137]
优选地,抗tlt
‑
1抗体不干扰tlt
‑
1的功能,尤其是不抑制血小板聚集。
[0138]
在一个优选实施方案中,抗tlt
‑
1抗体能够结合tlt
‑
1而不干扰血小板聚集。
[0139]
在另一个优选实施方案中,抗tlt
‑
1抗体能够结合tlt
‑
1而不与纤维蛋白原竞争结合tlt
‑
1。
[0140]
在另一个优选实施方案中,tlt
‑
1抗体不干扰tlt
‑
1的脱落。
[0141]
优选地,抗tlt
‑
1抗体不结合tlt
‑
1以外的其他任何在骨髓细胞上表达的触发受体(trem)或静息或活化血小板上的其他任何受体,或者对其表现出很低的亲和力。
[0142]
在一个实施方案中,抗tlt
‑
1抗体与tlt
‑
1的茎结合。
[0143]
双特异性抗fvii(a)/抗tlt
‑
1抗体
[0144]
本发明的双特异性抗体包含能够结合fvii(a)的第一抗原结合位点和能够结合tlt
‑
1的第二抗原结合位点。
[0145]
抗fvii(a)抗原结合位点
[0146]
在一方面,本发明的双特异性抗体包含能够结合fvii(a)的第一抗原结合位点。
[0147]
在本发明的一些实施方案中,所述双特异性抗体的第一抗原结合位点与表3中确定的任何一种抗fvii(a)抗体竞争结合fvii(a);具有与表3中确定的任何一种抗体相同的表位;具有与表3中确定的任何一种抗体相同的cdr区;并且具有与表3中确定的任何一种抗体相同的vl和vh区。
[0148]
抗tlt
‑
1抗原结合位点
[0149]
在一方面,本发明的双特异性抗体包含能够结合tlt
‑
1的第二抗原结合位点。
[0150]
在本发明的一些实施方案中,所述双特异性抗体的第二抗原结合位点与表4中确定的任何一种抗tlt
‑
1抗体竞争结合tlt
‑
1;具有与表4中确定的任何一种抗体相同的表位;具有与表4中确定的任何一种抗体相同的cdr区;并且具有与表4中确定的任何一种抗体相同的vl和vh区。
[0151]
修饰的效应子功能
[0152]
本发明的双特异性抗体可包含可以具有野生型氨基酸序列的fc区,或者它可包含调节抗体效应子功能的氨基酸置换,参见例如(wang等人:protein cell.9(2018),pp.63
‑
73)。具有修饰的效应子功能的fc变体的具体实例是与fcγ受体的结合已经降低的变体。这样的变体的一个具体实例是包含置换l234a、l235e、g237a、a330s和p331s(根据eu索引的残基编号)的igg1,其对某些fcγ受体和clq的亲和力降低。
[0153]
本发明的双特异性抗体的所需性质是长体内半衰期。包含fc区的双特异性抗体可通过fcrn受体再循环和被拯救,这继而可导致所需的长半衰期。对于缺乏fc区的本发明的双特异性抗体,可以通过其他手段延长半衰期。用于获得延长的多肽和抗体半衰期的不同方法和原理是本领域已知的,参见例如kontermann:expert opinion on biological therapy,16(2016),pp.903
‑
915和其中的参考文献。
[0154]
除了多肽和抗体的基于fc的半衰期延长之外,与白蛋白或白蛋白变体融合或缀合也已被证明可有效延长半衰期。另一种方法是附接聚合物,如xten或peg(插入参考文献)。此外,通过附接白蛋白结合部分可以获得延长的体内半衰期,参见例如tan等人:current pharmaceutical design 24(2018),pp.4932
‑
4946;kontermann:expert opinion on biological therapy,16(2016),pp.903
‑
915和kontermann:current opinion in biotechnology 22(2011),pp 868
–
876。
[0155]
功能特征
[0156]
通过与fvii(a)结合,本发明的双特异性抗体可以延长循环中存在的fviia的活性循环半衰期;通过与tlt
‑
1结合,所述双特异性抗体和结合的fvii(a)被定向到活化血小板的表面。这继而导致fviia在活化血小板上的积累增加,从而增强了血管损伤部位的fviia促凝活性。因此,本文所述的双特异性抗体能够赋予内源性fvii(a)池改善的药代动力学(pk)和药效学(pd)性质。
[0157]
在人类中,已知施用的重组fviia的活性半衰期约为2
‑
3小时。重组fviia的短半衰
期被认为是由于数种机制的参与,包括抗凝血酶iii(at)引起的抑制、α
‑2‑
巨球蛋白(α2m)引起的抑制和肾脏清除。相信类似的机制适用于内源性fviia,从而赋予它类似的短半衰期。
[0158]
为了延长fviia的活性半衰期,包括内源性fviia的半衰期,本文所述的双特异性抗体旨在借助其抗fvii臂或所谓的“第一抗原结合位点”拦截这些清除机制中的一种或多种,而不会丧失内源性fviia活性。biab:fviia复合物的fc部分将在内体中通过与fcrn结合介导该复合物的再循环并使其免于降解。此外,所述双特异性抗体的高亲和力抗fvii臂凭借与游离内源性fviia的大小相比增加的biab:fviia复合物的分子大小来保护内源性fviia免于α2m抑制和肾脏清除。所述双特异性抗体的抗tlt
‑
1臂选择性地将作用延长的内源性fviia定位至活化的血小板。fviia向活化血小板的这种定位加强了fviia活性,而不会增加其对at抑制的敏感性。
[0159]
本发明的双特异性抗体可以增加内源性或外源性fvii(a)的平均停留时间(mrt)。优选地,所述双特异性抗体能够在体内增强fvii(a)的活性。
[0160]
平均停留时间
[0161]
平均停留时间(mrt)是分子在体内停留而可用于治疗活性的平均时间。mrt根据方程式1作为稳态分布体积(vss)除以全身清除率(cl)的函数计算得出。
[0162]
mrt=vss/cl
ꢀꢀ
方程式1
[0163]
结果以时间表示。根据方程式2,mrt与有效血浆半衰期(t
1/2
)相关。
[0164]
mrt=ln(2)*t
1/2
ꢀꢀ
方程式2
[0165]
抗体增加fvii(a)的mrt的能力可以通过公知的方法来确定,例如在pharmacokinetic and pharmacodynamic data analysis:concepts&applications(gabrielsson和weiner)中所描述的那些方法。例如,通过向实验动物,例如小鼠、大鼠或猴子进行静脉内或皮下给药后,分析fvii(a)的血浆浓度或活性谱。抗体增加fvii(a)的功能性mrt的能力可以通过分析fvii(a)的血浆活性谱来确定,如采用例如但不限于实施例8中描述的fviia活性测定等试验所测量的。
[0166]
例如,抗体增加fvii(a)的mrt和功能性mrt的能力可以如实施例9和18所述确定。
[0167]
在一些实施方案中,与在不存在本发明抗体的情况下施用fvii(a)(单独的fvii(a)多肽)相比,本发明的双特异性抗体能够将fvii(a)的mrt提高至少2倍、至少3倍、至少5倍、至少10倍、至少20倍、至少30倍或至少40倍。
[0168]
在一些实施方案中,与在不存在本发明的双特异性抗体的情况下施用fvii(a)相比,如采用实施例8中描述的fviia活性测定所测量的,本发明的双特异性抗体能够将fvii(a)的功能性mrt提高至少2倍、至少3倍、至少5倍、至少10倍、至少20倍、至少30倍或至少40倍。
[0169]
内源性fviia的积累
[0170]
例如,本发明的双特异性抗体增加循环内源性功能活性fviia水平的能力可以通过在将抗体施用于实验动物例如小鼠、大鼠或猴子之前和之后测量内源性fviia的水平来确定,所述水平采用例如但不限于实施例8中描述的fviia活性测定的试验来测量。
[0171]
例如,抗体增加循环内源性功能活性fviia水平的能力可以如实施例27和28所述确定。
[0172]
在一些实施方案中,与不存在施用的双特异性抗体时循环内源性fviia的水平相比,本发明的双特异性抗体能够将循环内源性fviia的水平提高至少2倍、至少4倍、至少10倍、至少20倍、至少40倍、至少80倍、至少160倍、至少320倍、至少640倍。
[0173]
不依赖于tlt
‑
1和tf的凝血酶生成
[0174]
在一方面,本发明的双特异性抗体能够维持或增加因子viia生成凝血酶的不依赖于tlt
‑
1和tf的能力。
[0175]
抗体增加fvii(a)多肽的凝血酶生成的能力可以通过本领域公知的方法来确定,例如,如实施例5中描述的凝血酶生成测定。在该测定中,在磷脂、25nm fviia和浓度接近添加的fviia饱和的抗体的存在下,在血友病a诱导的人血浆中测量凝血酶生成。根据例如通过实施例6中举例说明的spr所测量的针对fviia
‑
抗体相互作用确定的解离常数,当>90%的fviia被抗体结合时,接近饱和。基于在存在和不存在抗体时峰值凝血酶形成之比,抗体被分类为刺激性(>120%)、抑制性(<90%)或中性(90
‑
120%)。
[0176]
在一些实施方案中,与不存在抗体时的fvii(a)相比,如在凝血酶生成测定中所测量的,本发明的双特异性抗体能够维持(中性)/增加(刺激性)因子vii(a)多肽生成凝血酶的能力。
[0177]
在一些实施方案中,与不存在抗体时的fvii(a)相比,如在凝血酶生成测定中所测量的,本发明的双特异性抗体能够将因子vii(a)生成凝血酶的能力增加至少20%。
[0178]
抗凝血酶和/或α
‑2‑
巨球蛋白引起的抑制
[0179]
在一方面,本发明的双特异性抗体能够降低fviia对抗凝血酶(at)和/或α
‑2‑
巨球蛋白引起的抑制的敏感性。
[0180]
抗体降低抗凝血酶(at)和/或α
‑2‑
巨球蛋白对fviia的抑制的能力可以通过本领域公知的方法,例如实施例5和11中描述的方法来确定。
[0181]
在一些实施方案中,与不存在抗体时对fviia的抑制相比,本发明的双特异性抗体能够降低抗凝血酶(at)和/或α
‑2‑
巨球蛋白对fviia的抑制。
[0182]
tlt
‑
1依赖性fxa生成(刺激活性测定)
[0183]
在一方面,本发明的双特异性抗体能够维持或增加fviia多肽在含有tlt
‑
1的促凝血膜表面的存在下促进fx活化的能力。
[0184]
本发明的双特异性抗体增加fviia多肽促进fx活化的能力的能力可以通过本领域公知的方法来确定,例如,如实施例21中描述的tlt
‑
1依赖性刺激活性测定。在该测定中,在fx(150nm)、fviia(2.5nm)、含有tlt
‑
1的磷脂膜(4nm)和抗fvii(a)/抗tlt
‑
1双特异性抗体的存在下测量fx活化。双特异性抗体的所谓刺激活性(表示为增加倍数)是相对于在不存在双特异性抗体的情况下由fviia生成的量,在100nm双特异性抗体的存在下生成的fxa的量。
[0185]
在一些实施方案中,本发明的双特异性抗体的刺激活性是至少2倍、至少5倍、至少10倍、至少20倍、至少30倍、至少40倍、至少60倍、至少80倍、至少100倍或至少150倍。
[0186]
tlt
‑
1依赖性全血凝块形成
[0187]
在一方面,本发明的双特异性抗体能够在血友病a状况下促进与治疗有效浓度的重组fviia相似或更好的凝块形成。
[0188]
双特异性抗体改善全血凝块形成的能力可以通过本领域公知的方法来确定,例如,如实施例29中描述的凝血弹性描记术测定。在该测定中,如实施例27、28和29所述,在重
复施用双特异性抗体后,在人血友病a诱导的全血中测量凝块形成,向该全血中添加双特异性抗体以及fvii、fviia和fviia:at,它们的浓度模拟相应内源性因子的体内稳态血浆水平。通过添加par1激动剂肽sfllrn和钙来诱导凝血。将这些条件下的凝血时间与在不存在抗体的情况下通过添加25nm fviia达到的凝血时间进行比较。
[0189]
在一些实施方案中,本发明的双特异性抗体能够将人血友病a诱导的全血中的凝血时间缩短至与通过添加25nm fviia达到的水平相似或更低的水平。在一些实施方案中,本发明的双特异性抗体能够将人血友病a诱导的全血中的凝血时间缩短至与通过添加2nm fviia、4nm fviia、6nm fviia、8nm fviia、10nm fviia、12nm fviia、16nm fviia或20nm fviia达到的水平相似或更低的水平。
[0190]
药物制剂
[0191]
在一方面,本发明提供了包含本文所述双特异性抗体的组合物和制剂。例如,本发明提供了包含与药学上可接受的载体一起配制的双特异性抗体的药物组合物。
[0192]
在本发明的实施方案中,所述药物制剂包含以80mg/ml至200mg/ml,如100
‑
180mg/ml的浓度存在的双特异性抗体,并且其中所述制剂的ph为2.0至10.0。该制剂可以进一步包含缓冲体系、防腐剂、张度剂、螯合剂、稳定剂或表面活性剂及其各种组合中的一种或多种。防腐剂、等渗剂、螯合剂、稳定剂和表面活性剂在药物组合物中的使用是本领域技术人员公知的。可参考remington:the science and practice of pharmacy,第19版,1995。
[0193]
在一个实施方案中,所述药物制剂是水性制剂。这样的制剂一般是溶液或悬浮液,但也可以包括胶体、分散体、乳液和多相物质。术语“水性制剂”被定义为包含至少50%w/w水的制剂。类似地,术语“水溶液”被定义为包含至少50%w/w水的溶液,而术语“水性悬浮液”被定义为包含至少50%w/w水的悬浮液。
[0194]
在另一个实施方案中,所述药物制剂是冷冻干燥的制剂,在使用前医师或患者向其中添加溶剂和/或稀释剂。
[0195]
在进一步的方面,所述药物制剂包含如本文所述的fvii(a)多肽双特异性抗体的水溶液和缓冲液,其中该抗体以1mg/ml或以上的浓度存在,并且其中所述制剂的ph为约2.0至约10.0。
[0196]
本发明的组合物可以肠胃外施用,如静脉内施用,如肌肉内施用,如皮下施用;优选皮下施用。本发明的组合物可以预防性地施用。
[0197]
本发明的药物组合物可以用来治疗患有凝血病的受试者。如本文所用的,术语“受试者”包括患有凝血病的任何人类患者,或非人类脊椎动物。
[0198]
医药用途
[0199]
如本文所用的,术语“治疗”是指对任何有需要的人类或其他动物受试者的医药治疗。所述受试者预期已经经历了由执业医师进行的体格检查,该执业医师已经给出了初步或明确的诊断,该诊断指明所述特定治疗的使用对所述人类或其他动物受试者的健康是有益的。根据受试者健康的现状,所述治疗的时间安排和目的可随个体而异。还考虑到本发明的促凝血化合物的防止性或预防性给药,其中预防被定义为延迟或规避疾病或病症的一种或多种症状的表现或加重。因此,所述治疗可以是预防性的、姑息性的、对症的(“按需的”)和/或治愈性的。
[0200]
就本发明而言,预防性的、姑息性的和/或对症的治疗可代表本发明的单独的方
面。
[0201]
导致出血倾向增加的凝血病可由正常凝血级联的任意促凝血组分的任何定性或定量缺乏或纤维蛋白溶解的任何上调引起。这类凝血病可以是先天性的和/或获得性的和/或医源性的,并且由本领域技术人员确定。
[0202]
先天性低凝血病(hypocoagulopathies)的非限制性实例是血友病a、血友病b、因子vii缺乏、因子x缺乏、因子xi缺乏、von willebrand病和血小板减少症,如glanzmann血小板机能不全和bernard
‑
soulier综合征。
[0203]
获得性凝血病的非限制性实例是由维生素k缺乏引起的丝氨酸蛋白酶缺乏;这样的维生素k缺乏可能由维生素k拮抗剂如华法林的施用引起。获得性凝血病也可能在大面积创伤后发生。在这种情况下也称为“血性恶性循环”,其特征在于血液稀释(稀释性血小板减少症和凝血因子的稀释)、低体温、凝血因子的消耗和代谢紊乱(酸中毒)。补液疗法和增加的纤维蛋白溶解可加剧这种情况。所述出血可能来自身体的任何部分。
[0204]
具有“抑制物”(即抗因子viii的同种抗体)的血友病a和具有“抑制物”(即抗因子ix的同种抗体)的血友病b是部分先天性和部分获得性的凝血病的非限制性实例。
[0205]
医源性凝血病的非限制性实例是由过度的和/或不当的补液疗法诱发的凝血病,例如可由输血诱发的凝血病。
[0206]
在本发明的一个优选实施方案中,出血与血友病a有关。在本发明的另一个优选实施方案中,出血与血友病b有关。在另一个优选实施方案中,出血与具有获得性抑制物的血友病a或b有关。在另一个优选实施方案中,出血与fvii缺乏有关。在另一个优选实施方案中,出血与glanzmann血小板机能不全有关。在另一个实施方案中,出血与von willebrand病有关。在另一个实施方案中,出血与严重组织损伤有关。在另一个实施方案中,出血与严重创伤有关。在另一个实施方案中,出血与手术有关。在另一个实施方案中,出血与出血性胃炎和/或肠炎有关。在另一个实施方案中,出血是血崩,如在胎盘早剥中。在另一个实施方案中,出血发生在机械性止血的可能性受限的器官中,如颅内、耳内或眼内地。在另一个实施方案中,出血与抗凝治疗有关。
[0207]
在进一步的实施方案中,出血可能与血小板减少症有关。在患有血小板减少症的个体中,本文所述的双特异性抗体可以与血小板共同施用。
[0208]
给药途径
[0209]
本文所述的双特异性抗体可适用于肠胃外给药,优选静脉内和/或皮下给药。皮下给药是优选的给药途径。
[0210]
给药方案
[0211]
本文所述的双特异性抗体的生物利用度和半衰期使它们成为对患有获得性和/或先天性凝血病的受试者进行预防性皮下处置的特别有吸引力的药物。本文所述的双特异性抗体可以每周一次,如每两周一次,优选每月一次施用于患有获得性和/或先天性凝血病但未出血的受试者。本文所述的双特异性抗体可以在手术前施用于患有凝血病并且应该进行侵入性操作如手术的受试者。本文所述的双特异性抗体可以施用于患有凝血病并且正在接受侵入性操作如手术的受试者。
[0212]
本文所述的双特异性抗体还可以与外源性fviia,如血浆衍生的或重组产生的fviia共同施用,以用于按需或预防性处置患有凝血病或正在经历出血事件的受试者。
[0213]
施用于患有凝血病的受试者的剂量将取决于给药途径,无论是预防性给药还是按需给药,以及个体差异。皮下给药需要比静脉内给药更大的剂量。
[0214]
在本发明的实施方案中,所述双特异性抗体以1.0至30.0nmol/kg的剂量皮下施用。
[0215]
除非在本说明书中另有说明,否则以单数形式呈现的术语也包括复数情况。
[0216]
实施方案列表
[0217]
通过以下本发明实施方案的非限制性列表进一步描述本发明:
[0218]
1.双特异性抗体,其包含
[0219]
(i)能够结合因子vii(a)的第一抗原结合位点,和
[0220]
(ii)能够结合trem样转录物1(tlt
‑
1)的第二抗原结合位点。
[0221]
2.根据实施方案1所述的双特异性抗体,其中所述第一抗原结合位点与表3的任何一种抗fvii(a)抗体竞争结合fvii(a):
[0222][0223]
3.根据实施方案1所述的双特异性抗体,其中所述抗体在如实施例7中所述的竞争性elisa测定中竞争。
[0224]
4.根据实施方案1所述的双特异性抗体,其中所述第一抗原结合位点能够结合包含fvii(a)(seq id no:1)的氨基酸残基h115、t130、v131和r392的表位。
[0225]
5.根据实施方案1所述的双特异性抗体,其中所述第一抗原结合位点能够结合包含fvii(a)(seq id no:1)的氨基酸残基h115、t130、v131和r392中的一个或多个的表位。
[0226]
6.根据实施方案1所述的双特异性抗体,其中所述第一抗原结合位点能够结合包
含fvii(a)(seq id no:1)的以下氨基酸残基的表位:r113、c114、h115、e116、g117、y118、s119、l120、t130、v131、n184、t185、p251、v252、v253、q388、m391和r392。
[0227]
7.根据实施方案1所述的双特异性抗体,其中所述第一抗原结合位点能够结合包含fvii(a)(seq id no:1)的以下氨基酸残基中的一个或多个的表位:r113、c114、h115、e116、g117、y118、s119、l120、t130、v131、n184、t185、p251、v252、v253、q388、m391和r392。
[0228]
8.根据实施方案1所述的双特异性抗体,其中所述第一抗原结合位点包含:
[0229]
·
由seq id no:847表示的cdrl1,其具有0、1、2或3个氨基酸置换
[0230]
·
由seq id no:848表示的cdrl2,其具有0、1、2或3个氨基酸置换
[0231]
·
由seq id no:849表示的cdrl3,其具有0、1或2个氨基酸置换
[0232]
·
由seq id no:851表示的cdrh1,其具有0或1个氨基酸置换
[0233]
·
由seq id no:852表示的cdrh2,其具有0或1个氨基酸置换
[0234]
·
由seq id no:853表示的cdrl3,其具有0、1、2和3个氨基酸置换。
[0235]
9.根据实施方案1所述的双特异性抗体,其中所述第一抗原结合位点包含:
[0236]
·
由seq id no:847表示的cdrl1,
[0237]
·
由seq id no:848表示的cdrl2,
[0238]
·
由seq id no:849表示的cdrl3,
[0239]
·
由seq id no:851表示的cdrh1,
[0240]
·
由seq id no:852表示的cdrh2,和
[0241]
·
由seq id no:853表示的cdrh3。
[0242]
10.根据实施方案1所述的双特异性抗体,其中所述第一抗原结合位点包含根据表13或表14中列出的抗体的重链可变域和轻链可变域序列,其中亲和力(k
d
)为1nm或更低。
[0243]
11.根据实施方案1所述的双特异性抗体,其中所述第一抗原结合位点包含根据表13或表14中列出的抗体的重链可变域和轻链可变域序列,其中亲和力(k
d
)为5nm或更低。
[0244]
12.根据实施方案1所述的双特异性抗体,其中所述第一抗原结合位点包含根据表13或表14中列出的抗体的重链可变域和轻链可变域序列,其中亲和力(k
d
)为10nm或更低。
[0245]
13.根据实施方案1所述的双特异性抗体,其中所述第一抗原结合位点包含根据表13或表14中列出的抗体的重链可变域和轻链可变域序列,其中亲和力(k
d
)为25nm或更低。
[0246]
14.根据前述实施方案中任一项所述的双特异性抗体,其中所述抗体对fvii(a)的亲和力(k
d
)小于1pm,例如小于10pm,例如小于100pm,例如小于200pm,例如小于400pm,例如小于600pm,例如小于1nm,例如小于5nm,例如小于10nm,例如小于20nm,例如小于50nm,例如小于100nm,例如小于200nm,例如小于400nm,例如小于600nm,例如小于800nm。
[0247]
15.根据实施方案1所述的双特异性抗体,其中所述第一抗原结合位点包含由seq id no:846表示的轻链可变域和由seq id no:850表示的重链可变域。
[0248]
16.根据实施方案15所述的双特异性抗体,其中所述轻链可变域和/或重链可变域序列具有1、2、3、4、5、6、7、8、9、10、11或12个氨基酸置换。
[0249]
17.根据实施方案1所述的双特异性抗体,其中所述第二抗原结合位点与表4的任何一种抗tlt
‑
1抗体竞争结合tlt
‑
1:
[0250][0251][0252]
18.根据实施方案17所述的双特异性抗体,其中所述抗体在如实施例32中所述的竞争性elisa测定中竞争。
[0253]
19.根据实施方案1所述的双特异性抗体,其中所述第二抗原结合位点能够结合包含tlt
‑
1(seq id no:13)的以下氨基酸残基的表位:k8、i9、g10、s11、l12、a13、n15、a16、f17、s18、d19、p20、a21。
[0254]
20.根据实施方案1所述的双特异性抗体,其中所述第二抗原结合位点包含:
[0255]
·
由seq id no:855表示的cdrl1,其具有0、1、2或3个氨基酸置换
[0256]
·
由seq id no:856表示的cdrl2,其具有0、1或2个氨基酸置换
[0257]
·
由seq id no:857表示的cdrl3,其具有0、1或2个氨基酸置换
[0258]
·
由seq id no:859表示的cdrh1,其具有0或1个氨基酸置换
[0259]
·
由seq id no:860表示的cdrh2,其具有0、1、2或3个氨基酸置换
[0260]
·
由seq id no:861表示的cdrh3,其具有0或1个氨基酸置换
[0261]
21.根据实施方案1所述的双特异性抗体,其中所述第二抗原结合位点包含:
[0262]
·
由seq id no:855表示的cdrl1,
[0263]
·
由seq id no:856表示的cdrl2,
[0264]
·
由seq id no:857表示的cdrl3,
[0265]
·
由seq id no:859表示的cdrh1,
[0266]
·
由seq id no:860表示的cdrh2,
[0267]
·
由seq id no:861表示的cdrh3。
[0268]
22.根据实施方案1所述的双特异性抗体,其中所述第二抗原结合位点包含:
[0269]
·
由seq id no:871表示的cdrl1,
[0270]
·
由seq id no:872表示的cdrl2,
[0271]
·
由seq id no:873表示的cdrl3,
[0272]
·
由seq id no:875表示的cdrh1,
[0273]
·
由seq id no:876表示的cdrh2,和
[0274]
·
由seq id no:877表示的cdrh3。
[0275]
23.根据实施方案1所述的双特异性抗体,其中所述第二抗原结合位点包含:
[0276]
·
由seq id no:879表示的cdrl1,
[0277]
·
由seq id no:880表示的cdrl2,
[0278]
·
由seq id no:881表示的cdrl3,
[0279]
·
由seq id no:883表示的cdrh1,
[0280]
·
由seq id no:884表示的cdrh2,和
[0281]
·
由seq id no:885表示的cdrh3。
[0282]
24.根据实施方案1所述的双特异性抗体,其中所述第二抗原结合位点包含:
[0283]
·
由seq id no:895表示的cdrl1,
[0284]
·
由seq id no:896表示的cdrl2,
[0285]
·
由seq id no:897表示的cdrl3,
[0286]
·
由seq id no:899表示的cdrh1,
[0287]
·
由seq id no:900表示的cdrh2,和
[0288]
·
由seq id no:901表示的cdrh3。
[0289]
25.根据实施方案1所述的双特异性抗体,其中所述第二抗原结合位点被包含于由seq id no:854表示的轻链可变域和由seq id no:858表示的重链可变域中。
[0290]
26.根据实施方案25所述的双特异性抗体,其中所述轻链可变域和/或重链可变域序列具有1、2、3、4、5、6、7、8、9、10、11或12个氨基酸置换。
[0291]
27.根据前述实施方案中任一项所述的双特异性抗体,其中所述抗体对tlt
‑
1的亲和力(k
d
)小于1pm,例如小于10pm,例如小于100pm,例如小于200pm,例如小于400pm,例如小于600pm,例如小于1nm,例如小于5nm,例如小于10nm,例如小于20nm,例如小于50nm,例如小于100nm,例如小于200nm,例如小于400nm,例如小于600nm,例如小于800nm。
[0292]
28.根据实施方案1所述的双特异性抗体,其中所述第一抗原结合位点包含由seq id no:846表示的轻链可变域和由seq id no:850表示的重链可变域,并且其中所述第二抗原结合位点被包含于由seq id no:854表示的轻链可变域和由seq id no:858表示的重链可变域中。
[0293]
29.根据前述实施方案中任一项所述的双特异性抗体,其中所述抗体包含fc区。
[0294]
30.根据实施方案29所述的双特异性抗体,其中所述fc区是igg1的fc区的fc变体,其包含置换l234a、l235e、g237a、a330s和p331s。
[0295]
31.根据前述实施方案中任一项所述的双特异性抗体,其中所述抗体是抗体的抗原结合片段的融合物或缀合物。
[0296]
32.根据实施方案31所述的双特异性抗体,其中所述结合片段中的一种或多种选自fab、fab'、fab2、fab'2和scfv。
[0297]
33.根据前述实施方案中任一项所述的双特异性抗体,其中所述抗体是多特异性抗体。
[0298]
34.根据实施方案1所述的双特异性抗体,其中所述第一抗原结合位点包含由seq id no:846表示的第一轻链可变域和由seq id no:850表示的第一重链可变域,并且其中所述第二抗原结合位点被包含于由seq id no:854表示的第二轻链可变域和由seq id no:858表示的第二重链可变域中,并且其中连接至第一和第二重链可变域的重链恒定域分别由seq id no:5和4表示,并且其中连接至第一和第二轻链可变域的轻链恒定域均由seq id no:12表示。
[0299]
35.根据实施方案1所述的双特异性抗体,其中所述第一抗原结合位点包含由seq id no:846表示的第一轻链可变域和由seq id no:850表示的第一重链可变域,并且其中所述第二抗原结合位点被包含于由seq id no:854表示的第二轻链可变域和由seq id no:858表示的第二重链可变域中,并且其中连接至第一和第二重链可变域的重链恒定域分别由seq id no:943和942表示,并且其中连接至第一和第二轻链可变域的轻链恒定域均由seq id no:12表示。
[0300]
36.根据实施方案1所述的双特异性抗体,其中所述第一抗原结合位点包含由seq id no:846表示的第一轻链可变域和由seq id no:850表示的第一重链可变域,并且其中所述第二抗原结合位点被包含于由seq id no:854表示的第二轻链可变域和由seq id no:858表示的第二重链可变域中,并且其中连接至第一和第二重链可变域的重链恒定域分别由seq id no:7和6表示,并且其中连接至第一和第二轻链可变域的轻链恒定域均由seq id no:12表示。
[0301]
37.根据实施方案1所述的双特异性抗体,其中所述第一抗原结合位点包含由seq id no:846表示的第一轻链可变域和由seq id no:850表示的第一重链可变域,并且其中所述第二抗原结合位点被包含于由seq id no:854表示的第二轻链可变域和由seq id no:858表示的第二重链可变域中,并且其中连接至第一和第二重链可变域的重链恒定域分别由seq id no:4和5表示,并且其中连接至第一和第二轻链可变域的轻链恒定域均由seq id no:12表示。
[0302]
38.根据实施方案1所述的双特异性抗体,其中所述第一抗原结合位点包含由seq id no:846表示的第一轻链可变域和由seq id no:850表示的第一重链可变域,并且其中所述第二抗原结合位点被包含于由seq id no:854表示的第二轻链可变域和由seq id no:858表示的第二重链可变域中,并且其中连接至第一和第二重链可变域的重链恒定域分别由seq id no:942和943表示,并且其中连接至第一和第二轻链可变域的轻链恒定域均由seq id no:12表示。
[0303]
39.根据实施方案1所述的双特异性抗体,其中所述第一抗原结合位点包含由seq id no:846表示的第一轻链可变域和由seq id no:850表示的第一重链可变域,并且其中所述第二抗原结合位点被包含于由seq id no:854表示的第二轻链可变域和由seq id no:858表示的第二重链可变域中,并且其中连接至第一和第二重链可变域的重链恒定域分别由seq id no:6和7表示,并且其中连接至第一和第二轻链可变域的轻链恒定域均由seq id no:12表示。
[0304]
40.根据实施方案1所述的双特异性抗体,其中所述抗体与表5中所列的一种或多种双特异性抗体(其中恒定域缩写根据表2a来定义)竞争结合fvii(a)并竞争结合tlt
‑
1:
[0305]
表5:
[0306][0307]
[0308]
41.根据实施方案38所述的双特异性抗体,其中所述抗体在竞争性elisa中与表5中所列的一种或多种双特异性抗体竞争结合fvii(a)并竞争结合tlt
‑
1。
[0309]
42.根据实施方案38所述的双特异性抗体,其中所述抗体在如实施例7和实施例32中所述的竞争性elisa测定中竞争。
[0310]
43.根据实施方案1所述的双特异性抗体,其中所述第一抗原结合位点能够结合包含fvii(a)(seq id no:1)的氨基酸残基h115、t130、v131和r392的表位,并且其中所述第二抗原结合位点能够结合包含tlt
‑
1(seq id no:13)的以下氨基酸残基的表位:k8、i9、g10、s11、l12、a13、n15、a16、f17、s18、d19、p20、a21。
[0311]
44.根据实施方案1所述的双特异性抗体,其中所述第一抗原结合位点包含:
[0312]
·
由氨基酸残基(seq id no:847)表示的cdrl1,其具有0、1、2或3个氨基酸置换
[0313]
·
由氨基酸残基(seq id no:848)表示的cdrl2,其具有0、1、2或3个氨基酸置换
[0314]
·
由氨基酸残基(seq id no:849)表示的cdrl3,其具有0、1或2个氨基酸置换
[0315]
·
由氨基酸残基(seq id no:851)表示的cdrh1,
[0316]
·
由氨基酸残基(seq id no:852)表示的cdrh2,其具有0或1个氨基酸置换
[0317]
·
由氨基酸残基(seq id no:853)表示的cdrh3,其具有0、1、2和3个氨基酸置换,并且
[0318]
其中所述第二抗原结合位点包含:
[0319]
·
由seq id no:855表示的cdrl1,其具有0、1、2或3个氨基酸置换
[0320]
·
由seq id no:856表示的cdrl2,其具有0、1或2个氨基酸置换
[0321]
·
由seq id no:857表示的cdrl3,其具有0、1或2个氨基酸置换
[0322]
·
由seq id no:859表示的cdrh1,其具有0或1个氨基酸置换
[0323]
·
由seq id no:860表示的cdrh2,其具有0、1、2或3个氨基酸置换
[0324]
·
由seq id no:861表示的cdrh3,其具有0或1个氨基酸置换。
[0325]
45.根据前述实施方案中任一项所述的双特异性抗体,其中如使用实施例8中所述的fviia活性测定所测量的,所述抗体增加fvii(a)的功能性mrt。
[0326]
46.根据实施方案41所述的双特异性抗体,其中与在不存在本发明的双特异性抗体的情况下施用fvii(a)相比,所述抗体将fvii(a)的功能性mrt提高至少2倍、至少3倍、至少5倍、至少10倍、至少20倍、至少30倍或至少40倍。
[0327]
47.根据前述实施方案中任一项所述的双特异性抗体,其中与在不存在施用的双特异性抗体的情况下循环内源性fviia的水平相比,如根据实施例27和28所确定的,所述抗体能够增加循环内源性功能活性fviia的水平。
[0328]
48.根据实施方案45所述的双特异性抗体,其中所述抗体将循环内源性功能活性fviia的水平提高至少2倍、至少4倍、至少10倍、至少20倍、至少40倍、至少80倍、至少160倍、至少320倍、至少640倍。
[0329]
49.根据前述实施方案中任一项所述的双特异性抗体,其中如通过实施例21中所述的刺激活性测定所确定的,所述抗体能够提高fviia多肽促进fx活化的能力。
[0330]
50.根据实施方案43所述的双特异性抗体,其中所述刺激活性为至少2倍、至少5倍、至少10倍、至少20倍、至少30倍、至少40倍、至少60倍、至少80倍、至少100倍或至少150倍。
[0331]
51.药物制剂,其包含根据前述实施方案中任一项所述的双特异性抗体和药学上可接受的载体。
[0332]
52.根据实施方案1
‑
48所述的双特异性抗体,其中根据实施方案49的药物制剂通过皮下给药来施用。
[0333]
53.根据实施方案1
‑
48所述的双特异性抗体或根据实施方案49所述的药物制剂,其用作药物。
[0334]
54.根据实施方案1
‑
48和50
‑
51中任一项所述的双特异性抗体或根据实施方案49所述的药物制剂,其用于治疗凝血病,其中所述凝血病是先天性的和/或获得性的。
[0335]
55.根据实施方案52所述的双特异性抗体,其中所述凝血病选自具有或不具有抑制物的血友病a,或具有或不具有抑制物的血友病b,fvii(a)缺乏和glanzmann血小板机能不全。
[0336]
56.根据实施方案1
‑
48和50
‑
51所述的用于治疗出血的双特异性抗体,其中所述出血与先天性或获得性血友病a、先天性或获得性血友病b、具有抑制物的血友病a、具有抑制物的血友病b或因子vii(a)缺乏相关。
[0337]
57.根据实施方案1
‑
48中任一项所述的用途,其中根据实施方案49的所述双特异性抗体或药物制剂经肠胃外施用,如静脉内、肌肉内或皮下施用。
实施例
[0338]
实施例1:使用杂交瘤技术产生抗fvii(a)小鼠单克隆抗体
[0339]
单克隆抗体通过用公开号为wo07/115953的国际专利申请中描述的fviia q64c
‑
stf(1
‑
219)g109c二硫键连接的复合物对nmrcf1小鼠(charles river)进行免疫来制备。给小鼠初始皮下注射在fca(弗氏完全佐剂)中的20μg,然后用20μg抗原在ifa(弗氏不完全佐剂)中进行加强腹膜内注射。无菌取出脾脏,并将其分散成单细胞悬浮液。使用电融合将脾细胞与x63ag8.653骨髓瘤细胞融合。将细胞接种在微量滴定板中并在37℃、5%co2下培养。含有用于选择的hat(sigma)的组织培养基(rpmi 1640 10%胎牛血清)更换两次。在生长10天后,使用以下方案通过elisa筛选鉴定产生特异性抗体的杂交瘤克隆。将nunc maxisorb板用fviia q64c
‑
stf(1
‑
219)g109c二硫键连接的复合物或fviia(如thim等人(1988)biochemistry 27:7785
‑
7793和persson等人(1996)febs lett 385:241
‑
243所述表达并纯化的)包被,50μl/孔,1μg/ml(含有5mm cacl2的hepes缓冲液),并在4℃下孵育过夜。将板洗涤5次并在洗涤缓冲液(hepes缓冲液,5mm cacl2,0.05%吐温20)中封闭15分钟。将50μl上清液转移到每个孔中并孵育1小时。将板洗涤5次并加入50μl hrp标记的山羊抗小鼠(fcγ片段特异性;jackson,工作稀释度1/10000)。将板孵育1小时,洗涤5次,并用50μl tmb(即用型tmb one;kem
‑
en
‑
tec)显色10分钟。通过加入50μl 4m h3po4终止反应,并在fluostar optima酶标仪中在450和620nm处读取。
[0340]
通过有限稀释将产生阳性结果的杂交瘤细胞亚克隆至少两次,以确保单克隆性。使用标准蛋白a纯化进行抗体纯化。
[0341]
将产生用于pk研究的抗体的杂交瘤细胞放大到t瓶或摇瓶中,在rpmi1640 10%fbs培养基中。通过离心收获条件培养基,并通过蛋白a亲和色谱法纯化抗体,随后脱盐。
[0342]
实施例2:小鼠抗fvii(a)抗体的克隆和测序
[0343]
本实施例描述了编码抗fvii(a)抗体可变域的鼠重链(hc)和轻链(lc)cdna序列的克隆和测序。使用来自qiagen的rneasy
‑
mini试剂盒从杂交瘤细胞中提取总rna,并用其作为cdna合成的模板。使用来自clontech的smarter race cdna扩增试剂盒在5
’‑
race反应中合成cdna。使用phusion hot start聚合酶(finnzymes)和作为正向引物包含在smarter
tm
race试剂盒中的通用引物混合物(upm),通过pcr进行hc的可变域(称为vh)和lc的可变域(称为vl)序列的后续靶标扩增。用于vh扩增的反向引物的序列是5’agctgggaaggtgtgcacac 3’。用于vl扩增的反向引物的序列是5’gctctagactaacactcattcctgttgaagctcttg 3’。
[0344]
将pcr产物通过凝胶电泳进行分离,使用来自ge healthcare bio
‑
sciences的gfx pcr dna&gel band purification试剂盒进行提取,并使用zero blunt topo pcr cloning试剂盒和化学感受态top10大肠杆菌(invitrogen)进行克隆以供测序。在德国马丁雷德(martinsried)的mwg biotech处使用m13uni(
‑
21)/m13rev(
‑
29)测序引物进行测序。所有试剂盒和试剂均按照制造商的说明书使用。
[0345]
实施例3:二价抗体、单价抗体(oa抗体)和抗体fab片段的重组表达
[0346]
基本上按照制造商的说明书,使用hek293悬浮细胞(293expi,invitrogen)的瞬时转染来表达二价抗体、单价抗体(单臂被称为oa抗体)和抗体fab片段。293expi细胞在补充有1%p/s(gibco目录号15140
‑
122)的expi293f表达培养基(invitrogen,目录号a1435104)中每3
‑
4天进行一次传代培养。使用expifectamine以250
‑
300万个/ml的细胞密度转染expi293f细胞。对于每升expi293f细胞,通过将总共1mg质粒dna稀释到50ml optimem(gibco,目录号51985
‑
026,稀释液a)中并将2.7ml expifectamine稀释到50ml optimem(稀释液b)中进行转染。二价抗体通过共转染vh
‑
ch1
‑
ch2
‑
ch3(hc)和vl
‑
cl(lc)质粒(1:1比例)产生,而对于fab片段,质粒是vh
‑
ch1和lc(1:1比例)。为了产生oa抗体,用以下三种质粒转染细胞:hc质粒、lc质粒和编码截短hc(trhc)的第三种质粒。oa
‑
抗体的hc包含臼突变(t366s、l368a、y407v),而trhc包含杵(t366w)突变,但杵和臼也可以颠倒。杵/臼突变在国际专利ep0979281b1中描述,并被引入以优化所需异源二聚体的形成,即hc与trhc的配对,并抑制不需要的同源二聚体的形成,即trhc与trhc和hc与hc的配对。将稀释液a和b混合并在室温下孵育10
‑
20分钟。之后将转染混合物添加至expi293f细胞,并将细胞在轨道旋转(85
‑
125rpm)下在潮湿培养箱中于37℃孵育。转染后一天,向转染的细胞补充5ml expifectamine 293转染增强剂(transfection enhancer)1和50ml expifectamine 293转染增强剂2。在转染后4
‑
5天通过离心然后过滤收获细胞培养上清液。
[0347]
二价和单价抗体通过本领域技术人员已知的标准蛋白a亲和色谱法,以及必要时额外的纯化步骤,如凝胶过滤或离子交换色谱法来纯化。使用识别fab的κ链的亲和树脂通过亲和色谱法纯化fab片段。
[0348]
实施例4:通过体外装配制备双特异性抗体和oa抗体
[0349]
通过体外装配制备的双特异性抗体
[0350]
双特异性抗体通过两种亲本抗体的体外装配而生成,方法类似于labrijn等人,pnas 2013,vol.110,pp.5145
–
5150描述的方法,被称为技术(genmab)。而不是labrijn等人使用的lgg1亚型。本发明中使用igg4。在75mm 2
‑
巯基乙胺(2
‑
mea)的存在下,交换反应在30℃下进行4小时。所得双特异性抗体通过离子交换色谱法纯化,以将残留
的亲本抗体与双特异性抗体分离。在本实施例中,第一种亲本抗体(抗fvii(a))的重链恒定区是igg4 s228p f405l r409k,而第二种亲本抗体(抗tlt
‑
1)的重链恒定区是igg4 s228p(均使用eu编号)。轻链恒定域是人κ。这两种亲本抗体如实施例3所述生成。双特异性抗fvii(a)/抗tlt
‑
1抗体也可以由一组亲本抗体装配而成,其中抗fvii(a)抗体的恒定域是igg4 s228p,而抗tlt
‑
1抗体的恒定域是igg4 s228p f405l r409k。
[0351]
通过体外装配制备的单价抗体
[0352]
单价抗体通过如上文针对双特异性抗体所述的体外装配而生成,不同之处在于(1)不是将两种抗体组合形成双特异性抗体,而是将抗体和trhc二聚体组合形成单价抗体。在本实施例中,trhc为igg4 s228p f405l r409k,而hc为igg4 s228p(均使用eu编号)。轻链恒定域是人κ。通常,臂交换反应用20
‑
50%摩尔过量的trhc二聚体进行,以使反应混合物中二价抗体的量减至最少。单价抗体通过大小排阻色谱法纯化,视需要任选地补充额外的纯化步骤,如离子交换色谱法。
[0353]
实施例5:在功能测定中对抗fviia(a)的体外表征
[0354]
为了促进内源性fviia的积累并使其发挥其促凝血活性,本发明的抗fvii(a)抗体应优选不损害fviia的活性,类似地优选不促进fviia被其主要血浆抑制物抗凝血酶的灭活(h等人(2011)j thromb haemost 9:333
–
338)。为了探索这些方面,使用以下描述的测定在体外测定了抗fvii(a)抗体对fviia的促凝血活性和抗凝血酶对fviia的灭活的影响。
[0355]
抗fvii(a)抗体对血友病a诱导的人血浆中生成凝血酶的影响
[0356]
二价或单价抗fvii(a)抗体对凝血酶生成的影响在96孔设置下在高岭土触发的凝血酶生成测定(tgt)中进行测量。简而言之,通过添加抗hfviii抗体4f30(在公开号为wo2012/035050的国际专利申请中描述)至37.5μg/ml的终浓度来制备血友病a诱导的血浆。将终浓度为10μm的磷脂(rossix)加入血友病a血浆中,并在37℃下孵育15分钟。将纯化的抗体(100nm)和fviia(25nm)添加到混合物中,并在室温下孵育10分钟。抗fvii(a)抗体如实施例1、2和3所述产生。通过添加10μl高岭土(haemonetics),然后添加10μl fiia fluca
‑
kit(thrombinoscope bv)进行触发,并在envision多标记阅读器上测量荧光(在390nm激发并在460nm发射)两小时。
[0357]
凝血酶生成实验(thrombogram)被计算为所测得的荧光的一阶导数。峰值凝血酶高度被计算为凝血酶生成实验中的最大值。随后通过将观察到的峰高除以与在不存在抗体时对25nm fviia所观察到的值相对应的峰高,对其进行归一化并表示为百分比。基于此,抗体被分类为刺激性(>120%)、抑制性(<90%)或中性(90%
‑
120%)。如表6所示,鉴定了所有类别的抗体。优选的抗体在tgt测定中是刺激性的或中性的。
[0358]
抗fvii(a)抗体对血浆衍生的抗凝血酶引起的fviia灭活的影响
[0359]
通过将fviia(200nm)与低分子量肝素(依诺肝素,12μm)和抗体(200
‑
1000nm)在50mm hepes,100mm nacl,10mm cacl2,0.1%peg8000,1mg/ml bsa(ph 7.3)中孵育10分钟,测量在二价或单价抗fvii(a)抗体的存在下,血浆衍生的抗凝血酶(at)对fviia的抑制。然后加入at(5μm),并在10、20、30、40、60和80分钟的时间点将样品转移到新的微量滴定板上,其中在1mm s
‑
2288显色底物(chromogenix)、200nm可溶性组织因子(stf;如freskgard等人(1996)protein sci 5:1531
‑
1540所述产生)和聚凝胺(0.5mg/ml)的存在下,在spectramax
仪器(molecular devices)中在405nm处测量残留活性5分钟。用缓冲液代替at的样品提供了未受抑制的fviia的活性。
[0360]
残余酰胺分解(amidolytic)活性被确定为相对于不存在抑制剂时的活性的时间的函数。通过将数据拟合到单相衰减模型来估计抑制常数(kinh)。存在fvii(a)
‑
抗体时的kinh值与不存在抗体时测定的值相比的百分比被称为kinh%,并在表6中针对每种抗体进行了报告。
[0361]
估计的kinh%<60%的抗体被归类为保护fviia免于at抑制。估计的60%≤kinh%≤150%的抗体被归类为中性,而估计的kinh%>150%的抗体被归类为加速at对fviia的抑制。如表6中所报告的,鉴定了来自所有三个类别的抗体。优选的抗体是中性的或保护fviia免于at抑制。
[0362]
在测试的抗体中,发现包括11f2(mab005和mab0048,分别对应于完全鼠和鼠/人嵌合体)在内的一部分抗体具有如上所述的所需体外性质。
[0363]
表6.如实施例2所述的凝血酶生成(tgt)和抗凝血酶(at)抑制测定中抗fvii(a)抗体的功能表征。
[0364][0365]
实施例6:抗体与fviia结合的spr分析以及ph和钙的影响
[0366]
通过表面等离子体共振(biacore t200)探测来自实施例5的抗体与fviia的结合。使用标准胺偶合化学试剂盒在cm4传感器芯片(均由ge healthcare提供)上固定抗鼠igg
(由ge healthcare提供)。以10μl/min的流速注射纯化的根据表7的抗fvii(a)抗体(0.25nm)1分钟。随后,以30μl/min的流速注射5、15、45和135nm fviia 7分钟,以允许与抗fvii(a)抗体结合,随后进行9分钟缓冲液注射以允许从抗fvii(a)抗体上解离。通过将10xhbs
‑
p缓冲液(由ge healthcare提供)稀释10倍并补充1mg/ml bsa和5mm cacl2以得到10mm hepes,150mm nacl,0.05%v/v聚山梨醇酯20(p20),ph 7.4,5mm cacl2,1mg/ml牛血清白蛋白(bsa)来制备运行缓冲液。该运行缓冲液还用于稀释抗fvii(a)抗体和fvii样品。使用由10mm gly
‑
hcl ph 1.7组成的再生缓冲液(由ge healthcare提供)实现芯片的再生。使用由制造商(biacore ab,uppsala,瑞典)提供的biaevaluation 4.1,根据1:1模型分析结合数据。分析导致表7中报告的结合常数,证明了若干抗体与fviia的高亲和力结合,包括11f2(mab005和mab0048,分别对应于完全鼠和鼠/人嵌合体)。
[0367]
表7抗fvii(a)抗体与fviia的相互作用的估计结合常数,如通过根据实施例6的表面等离子体共振(spr)分析所确定的。
[0368][0369]
ph和cacl2对来自实施例5的所选抗体与fviia和cfviia
‑
嵌合体的结合的影响在37℃下通过表面等离子体共振(biacore t200)进行探测。cfviia
‑
嵌合体序列在标题为发明详述的部分中指出,并且如实施例16和26中概述的那样表达。使用标准胺偶合化学试剂盒在cm4传感器芯片(均由ge healthcare提供)上固定抗鼠igg(由ge healthcare提供)。以10μl/min的流速注射1.2nm的fviia和0.5nm的4f9(与fviia egf1结构域结合的nn内部抗fvii鼠ab)的预平衡混合物1分钟。随后,以30μl/min的流速注射540、180、60、20、6.66、2.22、0.74、0.25nm的抗fvii(a)抗体7分钟以允许与fviia结合,随后进行9分钟缓冲液注射以允许从fviia上解离。制备了两种运行缓冲液。缓冲液1的制备方法是将10x hbs
‑
p (由ge healthcare提供)稀释10倍并补充1mg/ml bsa和5mm cacl2以得到10mm hepes,150mm nacl,0.05%v/v聚山梨醇酯20,ph7.4,5mm cacl2,1mg/ml牛血清白蛋白(bsa)。缓冲液2的
制备方法是将10x hbs
‑
p (由ge healthcare提供)稀释10倍并补充1mg/ml bsa、5μm cacl2并将ph调节至6.0(使用4m hcl调节),以得到10mm hepes,150mm nacl,0.05%v/v聚山梨醇酯20,ph 6.0,5μm cacl2,1mg/ml牛血清白蛋白(bsa)。fviia、抗fvii抗体4f9和抗fvii(a)抗体分别在这两种运行缓冲液中稀释。使用由10mm gly
‑
hcl ph 1.7组成的再生缓冲液(由ge healthcare提供)实现芯片的再生。使用由制造商(biacore ab,uppsala,瑞典)提供的biaevaluation 4.1,根据1:1模型分析结合数据。分析导致在表7b中报告的结合常数,证明fviia与抗fvii(a)抗体之间保留的高亲和力结合。
[0370]
表7b fviia和抗fvii(a)抗体在两种不同缓冲液中的相互作用的估计结合常数和相差倍数,如通过根据实施例6的表面等离子体共振(spr)分析所确定的。
[0371][0372]
实施例7:在竞争性elisa中鉴定与mab0005(11f2)竞争结合fvii(a)的抗体
[0373]
为了确定来自实施例5的具有所需体外性质的抗fvii(a)抗体是否与mab0005(11f2)及其衍生抗体竞争结合fviia(a),使用相应的fab片段fab0076进行了竞争研究。fviia、h
‑
d
‑
phe
‑
phe
‑
arg氯甲酮(ffr
‑
cmk;bachem,瑞士)活性位点抑制的fviia(fviiai;参见实施例9)在稀释缓冲液(20mm hepes,5mm cacl2,150mm nacl,ph 7.2)中以125ng/ml的浓度在nunc maxisorp板上于4℃固定过夜。将板洗涤并在洗涤缓冲液(20mm hepes,5mm cacl2,150mm nacl,0.5ml/l吐温20,ph 7.2)中封闭15分钟。使用标准生物素化试剂盒(ez
‑
link,thermo),根据制造商的说明对11f2
‑
fab0076进行生物素化。对于竞争研究,最终固定浓度为10ng/ml的生物素化fab0076与一系列稀释的抗fviia(a)抗体组合,以在稀释缓冲液中得到100mg/ml至9.5ng/ml范围内的终浓度。将混合物加入板的孔中并使其孵育1小时。然后洗涤板并加入hrp标记的链霉亲和素
‑
hrpo(在稀释缓冲液中1:2000;kirkegaard&perry labs)并孵育1小时。最后,将板洗涤并用tmb one(kementec)显色10分钟。通过加入h3po4(4m)终止反应,并在fluostar optima酶标仪中在450nm处读板,减去在620nm处测得的背景信号。除非另有说明,否则所有孵育均在室温下进行,并且使用洗涤缓冲液洗板5次。
[0374]
根据测得的信号(od单位),在任何给定抗体浓度下的竞争如下计算
[0375]
%抑制=(1
‑
(od单位
‑
100%抑制)/(0%抑制
‑
100%抑制))*100其中0%抑制是由不含任何竞争性抗fvii(a)抗体的孔中的信号确定的,100%抑制被确定为来自不含生物素化fab0076的孔的信号(即对应于测定背景)。如果在高达10000倍过量的生物素化fab0076下检测抗体浓度时观察到至少50%的抑制(%抑制),则认为抗体与11f2(mab0005)竞争结合fvii(a)。结果总结在表8中。
[0376]
表8与11f2
‑
fab0076(mab0005)竞争结合fvii(a)。如实施例7所述,使用50%的截
断值将抗体分类为竞争者或非竞争者。
[0377][0378][0379]
实施例8:fviia活性测定
[0380]
基本上如morissey jh等人,blood,1993;81:734
‑
44所述,使用来自viia
‑
rtf试剂盒(diagnostica stago)的试剂测量fviia活性。该测定在来自instrumentation laboratory的acltop500自动化凝血仪上进行。在测定中是40μl稀释的动物血浆样品、校准品(针对国际who参考物校准的重组fviia(rfviia)参考材料)或质量控制(qc)样品,其与40μl缺乏fvii的血浆和40μl可溶性组织因子(stf)及磷脂混合。加入体积为40μl的25mm cacl2以启动反应,并通过仪器测量凝血时间。将样品和qc凝血时间与rfviia校准曲线进行比较,血浆浓度与稀释的样品相同,以减轻血浆的干扰。校准曲线范围为5
‑
1000miu/ml,并使用三次多项式方程拟合。qc和样品结果由acltop500仪器上的软件计算。使用给药化合物的比活性(iu/pmol)将以iu/ml为单位的结果转换为nm。
[0381]
实施例9:与抗fvii(a)抗体共同配制的重组fviia在大鼠中的药代动力学
[0382]
将来自实施例5的具有所需体外性质的单克隆抗fvii(a)抗体与20nmol/kg人fviia在共同制剂中静脉内给药至雄性sprague dawley大鼠。fviia与抗体的摩尔比为1:1或1:5,如表9所示。在实验过程中,允许动物自由进食和饮水。使用如实施例8所述的fviia活性测定来测量fviia血浆活性。
[0383]
使用winnonlin通过非房室方法进行药代动力学分析。从数据计算平均停留时间(mrt)。结果在表9中给出。
[0384]
在来自实施例5的具有所需性质的抗体中,mab0005(11f2)和mab0001(11f26)赋予人fviia最长的平均停留时间,分别为7.9和7.5小时,而与之相比,游离人fviia的游离平均停留时间为1.1小时(见表9)。mab0005和mab0001(mab0759)是高亲和力抗体(实施例6),表现出竞争结合fviia(实施例7)。
[0385]
表9在与所示抗体以1:1或1:5的摩尔比静脉内给予20nmol/kg fviia后,在sprague dawley大鼠中fviia血浆活性的平均停留时间(mrt)。媒介物表示fviia与缓冲液而不是与抗体联合施用。
[0386]
抗fvii(a)抗体fviia:抗体的摩尔比mrt(h)媒介物n.a.1.1mab00051:57.9
mab00071:13.9mab00181:51.1mab00041:53.6mab00011:17.5mab05871:14.0mab05781:14.2
[0387]
实施例10:11f2抗fvii(a)抗体对游离或tf复合的fviia激活fx的影响
[0388]
优选地,本发明的抗fvii(a)抗体不应干扰fviia在膜表面上的药理作用或凝血的启动,即fviia
‑
tf复合物对fx的激活。为了探索这些方面,分别在不存在或存在脂化tf的情况下测定11f2对fviia的tf非依赖性和tf依赖性蛋白水解活性的影响。使用单臂单价抗体形式以避免由于两个fviia分子同时结合到正常二价抗体上而产生的亲合力效应。
[0389]
在磷脂膜的存在下,11f2抗体对fviia激活fx的影响
[0390]
在含有10nm fviia、0或200nm抗体(见表10)和25μm 25:75磷脂酰丝氨酸:磷脂酰胆碱囊泡(haematologic technologies inc.)的测定缓冲液(50mm hepes,100mm nacl,10mm cacl2,ph 7.3,0.1%peg8000,和1mg/ml bsa)中进行活性测定。通过添加0
‑
300nm人血浆衍生因子x(fx)启动反应,并使其在96孔板中以100μl的总反应体积在室温下孵育20分钟(n=2)。孵育后,通过加入50μl猝灭缓冲液(50mm hepes,100mm nacl,10mm cacl2,80mm edta,ph7.3)来猝灭反应,随后加入50μl 1mm s
‑
2765显色底物(chromogenix)水溶液。使用spectramax微孔板分光光度计,作为10分钟内在405nm处线性吸光度增加的斜率,测量生成的fxa对显色底物的转化。通过将测得的斜率与用已知量的血浆衍生人fxa在类似条件下生成的斜率相关联,可以估计以摩尔为基础的fxa生成的初始速率。使用graphpad prism,通过数据与michaelis
‑
menten方程(v=kcat*[fx]*[fviia
‑
tf]/(km [fx]))的非线性曲线拟合来估计酶动力学参数。
[0391]
如表10所示,在磷脂囊泡的存在下,单价11f2不影响游离fviia激活fx的速率。
[0392]
在tf的存在下,11f2抗体对fviia激活fx的影响
[0393]
如smith和morrissey(2005)j.thromb.haemost.,2:1155
‑
1162所述,在含有100pm fviia、0或200nm抗体(见表10)和2pm并入25:75磷脂酰丝氨酸:磷脂酰胆碱(ps:pc)囊泡中的大肠杆菌衍生tf片段1
‑
244的测定缓冲液(50mm hepes,100mm nacl,10mm cacl2,ph 7.3,0.1%peg8000,和1mg/ml bsa)中进行活性测定。通过添加0
‑
30nm人血浆衍生因子x(fx)启动反应,并使其在96孔板中以100μl的总反应体积在室温下孵育20分钟(n=2)。孵育后,如上文所述猝灭反应并对fxa进行定量。
[0394]
如表10所示,单价11f2(mab0077(oa))不影响fviia/tf复合物激活fx的速率。
[0395]
表10根据实施方案10,200nm单价形式的11f2对fviia
‑
tf复合物激活fx的动力学参数的影响。显示为平均值
±
sd(n=3)的参数通过拟合michaelis
‑
menten方程来估计。k
cat
/k
m
相对于不存在抗体时测定的值而显示。
[0396][0397]
实施例11:11f2抗体对血浆抑制物抑制fviia的影响
[0398]
fviia在循环中表现出相对较短的半衰期,部分原因是它被丰富的血浆抑制物抗凝血酶(at)灭活。类似地,动物研究表明另一种血浆抑制物——α
‑2‑
巨球蛋白与fviia的失活有关。使用纯化的血浆衍生抑制物,研究了单价11f2抗体对这些抑制物灭活fviia的影响。
[0399]
11f2抗体对抗凝血酶抑制fviia的影响
[0400]
在单价11f2抗体(mab0048、mab0077(oa))的存在下,用人血浆衍生的at抑制fviia在伪一阶条件下进行。该测定在室温下在含有200nm fviia、12μm低分子量肝素(依诺肝素,欧洲药典参考,代码e0180000,批次5.0,id 00ck18)和0或1000nm抗体的测定缓冲液(50mm hepes,100mm nacl,10mm cacl2,0.1%peg8000,1mg/ml bsa,ph 7.3)中以200μl体积进行。预孵育10分钟后,通过添加5μm at(抗凝血酶iii,baxter,lot vnb1m007;在肝素
‑
琼脂糖凝胶柱上再纯化以去除制剂中的血清白蛋白)启动反应。在选定的时间点,将10μl等分试样转移到含有0.5mg/ml聚凝胺(海美溴铵,sigma,目录号h9268,批次slbc8683v)、200nm stf和1mm s
‑
2288(chromogenix)的200μl总体积中以猝灭反应,并用stf使fviia饱和,这允许测量来自在405nm处监测5分钟的显色底物水解的残留fviia活性。残留的酰胺分解活性被确定为减去空白后的线性进程曲线的斜率,随后使用graphpad prism软件将这些曲线拟合到一阶指数衰减函数,以获得该反应的伪一阶速率常数(kapp)。通过将kapp除以at浓度来估计表观二阶速率常数(kinh)。
[0401]
从该分析中,发现在单价11f2(mab0077(oa))的存在下fviia的抑制速率为133
±
10m
‑1s
‑1,相比之下,游离fviia的抑制为124
±
7m
‑1s
‑1。
[0402]
11f2抗体对α
‑2‑
巨球蛋白抑制fviia的影响
[0403]
在伪一阶条件下,在0或1000nm单价11f2抗体(mab0077(oa))的存在下,用人血浆衍生的α
‑2‑
巨球蛋白抑制fviia。该测定在室温下在含有200nm fviia和0或1000nm抗体的测定缓冲液(50mm hepes,100mm nacl,5mm cacl2,0.1%peg8000,0.01%吐温80,ph 7.3)中以100μl体积进行。通过添加0或1000nm根据banbula等人(2005)j.biochem.,138:527
‑
537所述从人血浆中纯化的α
‑2‑
巨球蛋白来启动反应。在选定的时间点,将10μl等分试样转移到含有200nm stf和1mm s
‑
2288(chromogenix)的190μl缓冲液(50mm hepes,100mm nacl,5mm cacl2,0.1%peg8000,1mg/ml bsa,ph7.3)中,这允许测量来自在405nm处监测5
分钟的显色底物水解的残留fviia活性。残留的酰胺分解活性被确定为减去空白后的线性进程曲线的斜率,随后使用graphpad prism软件将这些曲线拟合到一阶指数衰减函数,以获得该反应的伪一阶速率常数(kapp)。通过将kapp除以α
‑2‑
巨球蛋白浓度来估计表观二阶速率常数(kinh)。
[0404]
在不存在抗体的情况下,发现α
‑2‑
巨球蛋白抑制fviia的表观二级速率常数为475
±
21m
‑1s
‑1。然而,在单价11f2抗体(mab0077(oa))的存在下,在最后一个时间点125分钟之前未观察到对fviia的明显抑制。从这些研究可以得出以下结论:11f2不影响抗凝血酶对fviia的抑制,而是保护fviia免于α
‑2‑
巨球蛋白的抑制。
[0405]
实施例12:11f2抗体对fvii自动激活的影响
[0406]
在血管损伤后,内源性fvii与其辅因子组织因子(tf)以高亲和力结合,后者暴露在血管内皮周围的细胞上。在此过程中,fvii通过有限的蛋白水解转化为fviia。激活被认为是由于tf介导的fviia
‑
fvii反式激活(也称为自动激活)的结果而发生的。为了确定11f2抗体对fvii自动激活的影响,在脂化tf、fvii、限制浓度的fviia和单价11f2抗体的存在下测量fvii的激活。
[0407]
在含有2nm fviia、145nm fvii、0或200nm单价11f2抗体(mab0077(oa))的测定缓冲液(50mm hepes,100mm nacl,5mm cacl2,ph7.3,含有0.1%peg8000和1mg/ml bsa)中进行活性测量。如smith和morrissey(2005)j.thromb.haemost.,2:1155
‑
1162所述,通过添加并入25:75ps:pc囊泡中的2nm脂化的大肠杆菌衍生的tf片段1
‑
244来启动反应。总反应体积为100μl。在选定的时间点(通常为5、10、15、20、30、40、50和60分钟),根据以下描述的子采样程序对生成的fviia进行定量。
[0408]
通过子采样对fviia的定量——在选定的时间点,通过将10μl样品转移至含有0.1%peg8000、1mg/ml bsa和215nm可溶性组织因子(stf)的140μl 50mm hepes、100mm nacl、5mm edta中对其进行猝灭。收集所有样品后,通过添加60mm cacl2中的50μl s
‑
2288(4mm)测量fviia显色活性。使用spectramax酶标仪,以10分钟内405nm处线性吸光度增加的斜率来测量生成的fviia对显色底物的转化。通过将测得的斜率与采用已知量的fviia在类似条件下生成的斜率相关联,可以估计fviia的摩尔浓度。
[0409]
发现fviia自动激活是tf依赖性的,并且从表11中测得的fviia活性表明不会因单价11f2抗体的存在而受损。
[0410]
表11:在不存在或存在200nm单价11f2抗体mab0077(oa)的情况下,根据实施方案12的tf介导的fviia自动激活
[0411][0412]
实施例13:与活性位点抑制的fviia和可溶性组织因子复合的11f2
‑
fab0076的晶体结构
[0413]
为了确定fvii(a)上被鼠抗体11f2识别的表位,使用根据kirchhofer.d.等人,proteins structure function and genetics.(1995),22,419
‑
425所述的悬滴法,使相应的fab片段(fab0076)与h
‑
d
‑
phe
‑
phe
‑
arg氯甲酮(ffr
‑
cmk;bachem,瑞士)活性位点抑制的fviia(fviiai)和可溶性组织因子片段1
‑
219(stf)复合结晶。
[0414]
结晶
[0415]
在18℃下使用悬滴蒸汽扩散技术生长以1:1摩尔比与fviiai/stf复合物混合的fab0076的晶体。将1μl 4.6mg/ml蛋白质复合物在10mm hepes、50mm nacl、5mm cacl2(ph7.0)中的蛋白质溶液与作为沉淀物剂的0.5μl 100mm柠檬酸钠(ph 6.2)和20%peg6000混合,并在18℃的温度下在1ml沉淀剂溶液上孵育,以获得复合物的晶体。
[0416]
衍射数据采集
[0417]
在液氮中快速冷却之前,将晶体在由75mm柠檬酸钠(ph 6.2)、15%peg 6000、4%甘油、4%乙二醇、4.5%蔗糖和1%葡萄糖组成的溶液中冷冻保护。使用来自mar research的marccd225检测器,在max
‑
lab(lund,瑞典)光束线i911
‑
3处以100k采集衍射数据。使用来自xds包的程序进行数据的自动索引、积分和缩放(衍射数据统计信息总结在表12中)。
[0418]
结构确定和精修
[0419]
使用如在程序套件phenix中实施的phaser,以蛋白质数据库条目1yy8的a和b链以及蛋白质数据库条目3ela通过分子替换确定结构。不对称单元含有两个fab:fviiai/stf复合物。该模型使用phenix精修和coot中的手动重建步骤进行精修。精修统计信息见表12。
[0420]
表12:来自活性位点抑制的fviia、可溶性组织因子(stf)和fab0076之间的复合物的x射线结晶结构测定的数据采集和精修统计信息。最高分辨率shell的统计信息显示在括号中。
[0421]
[0422][0423]
发现表位(被定义为fviiai中具有在与fab0076中的非氢原子相距小于或等于的距离内的非氢原子的残基)包括根据seq id no:1的以下残基:
[0424]
r113
[0425]
c114
[0426]
h115
[0427]
e116
[0428]
g117
[0429]
y118
[0430]
s119
[0431]
l120
[0432]
t130
[0433]
v131
[0434]
n184
[0435]
t185
[0436]
i186
[0437]
p251
[0438]
v252
[0439]
e265
[0440]
m391
[0441]
r392
[0442]
e394
[0443]
发现互补位(被定义为fab0076中具有在与fviiai中的非氢原子相距小于或等于的距离内的非氢原子的残基)包括根据seqid no:64的以下轻链残基:
[0444]
q27
[0445]
g28
[0446]
s30
[0447]
d31
[0448]
y32
[0449]
k49
[0450]
y50
[0451]
q53
[0452]
h92
[0453]
s93
[0454]
f94
[0455]
和根据seqid no:63的重链残基:
[0456]
d32
[0457]
y54
[0458]
n59
[0459]
n101
[0460]
y102
[0461]
y103
[0462]
g104
[0463]
n105。
[0464]
实施例14:人源化鼠11f2
[0465]
为了对分别具有对应于seq id no.754和seq id no.750的vh和vl结构域序列的鼠抗体11f2(mab0005)进行人源化,同时保留其对fvii(a)的高结合亲和力,我们组合了来
自相对于人种系的序列同一性的信息、fab0076(实施例12)与活性位点抑制的fviia(实施例9)之间的复合物的晶体结构以及体外结合数据。在开始时,我们使用blast算法在人类种系数据库中搜索与11f2的鼠可变域序列具有高度序列同一性的人类vh、vl和vj序列(对于重链(hc)和轻链(lc)两者)。对于hc的vh,具有最高序列同一性的序列是:ighv4
‑
30
‑
4*01、ighv4
‑
28*01、ighv4
‑
28*06和ighv459*01,而对于hc的vj区段,排名前列的种系是:ighj5*01、ighj4*01。对于lc,vl的排名前列序列是:igkv6d
‑
41*01和igkv3
‑
11*01,对于vj区段:igkj2*01和igkj2*02(表12)。接下来,将人种系与鼠vh和vl序列之间的差异映射到fab0076/fviia复合物的晶体结构上。预期与表位中的残基相距大于或等于的距离的鼠可变域中的残基对结合亲和力没有或几乎没有影响,并被交换为相应的人种系氨基酸实体。另外,构成互补位的残基被认为在不影响亲和力的情况下进行置换更有问题,因此保留了鼠氨基酸实体。鉴定了可能影响结合亲和力的结合界面附近的残基子集。通过将表位远端的残基突变为来自种系比对的人氨基酸实体而生成人源化变体。此外,靠近互补位的残基在一个子集中突变为人类实体,以使变体尽可能接近人类种系。该组中包括将鼠cdr移植到hc和lc的完全人种系上的变体。根据表13,从初始分析生成了12个lc和13个hc并配对成23个变体。
[0466]
使用bio
‑
layer干涉测量法(fortebio)测量人源化抗体与fviia(表13中列出)的结合亲和力。所有步骤均在运行缓冲液(20mm hepes缓冲液(ph 7.4),150mm nacl,5mm cacl2,0.03%吐温20,1mg/ml不含igg的bsa)中在30℃下进行。在抗人吸头(ahc,fortebio)上以10ug/ml的浓度捕获抗体3分钟。然后进行3分钟的孵育以建立基线。在此之后,使用四种不同浓度的fviia(25nm、50nm、100nm和200nm)监测缔合3分钟,随后解离3分钟。使用fortebio数据分析软件分析传感图。fortebio数据用于排名,而绝对亲和力值可能与通过spr确定的值有偏差(实施例6,表7)。
[0467]
表12:用于鼠11f2人源化的人种系序列。括号中的数字反映了fab0076的鼠可变域与指定的人种系序列之间的同一性((n/m)表示总共m个位置中的n个相同位置)
[0468][0469][0470]
表13:鼠11f2
‑
mab0048的第一轮人源化中vh和vl的配对,及相应抗体对fviia的测量亲和力(如本文所述测定)。对于一些变体,没有测量到结合(nb)。
[0471][0472][0473]
鉴定了来自第一轮人源化的具有与亲本鼠抗体同等或更高亲和力的变体,并且将
发现保留或提高结合亲和力的那些突变用于设计第二轮变体。从这组突变中,通过在已经具有所需亲和力的人源化hc和lc之上插入尽可能多的这些突变来生成第二轮变体。从该分析设计了19个vh序列(对应于seq id no:314、514、522、530、538、546、554、562、570、578、586、594、602、610、618、626、634、642和650)和25个vl序列(对应于seq id no:310、318、326、334、342、350、358、366、374、382、390、398、406、414、422、430、438、446、454、462、470、478、486、494和502),并通过将所有vl与vl相组合进行实验测试,产生总共475种组合。如上所述,使用bio
‑
layer干涉测量法(fortebio)测量所得475种人源化抗体与fviia结合的解离常数(kd)值。表14中列出了测得的kd值。
[0474]
表14.鼠11f2抗fvii(a)抗体的人源化变体的解离常数值(m,nb表示无结合)。抗体由它们各自的vh和vl seq id no来定义。
[0475][0476][0477]
表14(续)
[0478][0479][0480]
表14(续)
[0481][0482]
人源化11f2变体的spr分析
[0483]
通过如实施例6中详述的spr分析确定所选人源化11f2变体的亲和力。测得的解离常数在表15中列出,并且显示变体与人fviia的保留的高亲和力结合。
[0484]
表15.单价形式的人源化11f2抗体和biab与fviia的相互作用的估计结合常数(k
d
),如根据实施例6通过表面等离子体共振(spr)分析所确定的。
[0485]
抗fvii(a)抗体k
d
(m)mab0077(oa)4.1e
‑
11mab0099(oa)1.2e
‑
10mab0138(oa)1.3e
‑
10mab0140(oa)8.3e
‑
11mab0141(oa)7.8e
‑
11mab0142(oa)1.0e
‑
09mab0143(oa)7.9e
‑
11
mab0705(oa)5.05e
‑
11mab0706(oa)5.42e
‑
11mab0707(oa)1.06e
‑
10mab0709(oa)1.04e
‑
10mab0710(oa)1.28e
‑
10biab00010.06e
‑
09biab0245600e
‑
09
[0486]
人源化11f2变体的功能表征
[0487]
如实施例5中所详述的那样确定所选人源化11f2变体对fviia活性和抗凝血酶抑制敏感性的影响。结果在表16中列出,并显示人源化变体保留了关于这些参数的所需性质。
[0488]
表16.抗fvii(a)抗体在如实施例5所述的凝血酶生成(tgt)和抗凝血酶(at)
‑
抑制测定中的功能表征。
[0489][0490]
与人源化11f2变体共同配制的fviia在大鼠中的药代动力学
[0491]
如实施例9中所详述的那样,将人源化11f2变体家族在与20nmol/kg fviia的共同制剂中静脉内给予雄性sprague dawley大鼠。
[0492]
结果在表17中给出,并且显示数种人源化11f2变体赋予fviia与亲本抗体相同的
长半衰期。
[0493]
表17:在与抗体以不同摩尔比静脉内给予20nmol/kg fviia后,在sprague dawley大鼠中fviia血浆活性的平均停留时间(mrt)。值为平均值
±
sd,n=3。n.a.:不适用
[0494]
抗fvii(a)抗体fviia:抗体的摩尔比mrt(h)媒介物n.a.1.1mab00051:57.9mab0077(oa)1:111
±
0.2mab0099(oa)1:17.7
±
0.4mab0137(oa)1:17.0mab0139(oa)1:12.7mab0140(oa)1:17.7mab0141(oa)1:17.7mab0705(oa)1:17.7
±
0.4mab0706(oa)1:17.3
±
0.3mab0707(oa)1:16.4
±
1.0mab0709(oa)1:15.9
±
0.4mab0710(oa)1:15.7
±
0.3
[0495]
实施例15:与活性位点抑制的fviia和可溶性组织因子复合的11f2fab0883的结晶和表位作图
[0496]
为了确定fvii(a)上被人源化11f2即mab0705(oa)和mab0842(oa)识别的表位,根据kirchhofer.d.等人,proteins structure function and genetics.(1995),22,419
‑
425所述,使用悬滴法将相应的fab片段fab0883与h
‑
d
‑
phe
‑
phe
‑
arg氯甲酮(ffr
‑
cmk;bachem,瑞士)活性位点抑制的fviia(fviiai)和可溶性组织因子片段1
‑
219(stf)复合地结晶。
[0497]
结晶
[0498]
在18℃下使用坐滴蒸汽扩散技术生长fab与fviiai/stf复合的sec纯化复合物的晶体。将360nl蛋白质复合物(4.5mg/ml)在20mm hepes、150mm nacl、0.1mm cacl2(ph7.4)中的蛋白质溶液与360nl含有0.15m cscl和15%(w/v)聚乙二醇3350和360nl水的沉淀剂溶液混合,并与80μl沉淀剂溶液平衡。晶体在6周内生长。
[0499]
衍射数据采集
[0500]
在液氮中快速冷却之前,将晶体在由0.15m cscl、15%(w/v)乙二醇3350和20%(v/v)甘油组成的溶液中冷冻保护。在配备有dectris pilatus1m检测器的rigaku frx旋转阳极发生器上以100k采集衍射数据。使用来自xds包的程序进行数据缩减(衍射数据统计信息总结在表18中)。
[0501]
结构确定和精修
[0502]
所有晶体学计算均使用phenix晶体学程序套件进行。使用phaser程序,以如实施例13所述获得的复合物结构的坐标作为搜索模型,通过分子替换确定结构。不对称单元含有四个fab:fviiai/stf复合物。使用coot和phenix精修进行手动重建的迭代循环产生了最终模型(表18)。
[0503]
表18:来自活性位点抑制的fviia、可溶性组织因子(stf)和fab0883之间的复合物的x射线结构测定的数据采集和精修统计信息。最高分辨率shell的统计信息显示在括号中。
[0504]
[0505][0506]
表位作图
[0507]
如果晶体中全部四个独立确定的fviia分子都具有位于与fab中的非氢原子相距
小于或等于的距离内的所述残基的非氢原子,则认为该残基是表位的一部分。因此,发现表位包含根据seq id no:1的以下残基:
[0508]
r113
[0509]
c114
[0510]
h115
[0511]
e116
[0512]
g117
[0513]
y118
[0514]
s119
[0515]
l120
[0516]
t130
[0517]
v131
[0518]
n184
[0519]
t185
[0520]
p251
[0521]
v252
[0522]
v253
[0523]
q388
[0524]
m391
[0525]
r392
[0526]
互补位确定
[0527]
如果晶体中全部四个独立确定的fab分子都具有位于与fviia中的非氢原子相距小于或等于的距离内的所述残基的非氢原子,则认为该残基是互补位的一部分。发现互补位包含以下轻链残基(根据seq id no:814):
[0528]
q27
[0529]
g28
[0530]
y32
[0531]
y50
[0532]
h92
[0533]
s93
[0534]
f94
[0535]
和重链残基(根据seq id no:818):
[0536]
d32
[0537]
y54
[0538]
y103
[0539]
n105
[0540]
实施例16:使用spr对11f2 mab0842(oa)的热点分析fviia的丙氨酸变体的表达
[0541]
用qmcf技术生成hfvii丙氨酸变体,qmcf技术是一种稳定的游离表达系统(icosagen)。在co2振摇培养箱中的e125烧瓶中,在qmix1培养基(1l=1:1cd
‑
cho和sfm ii
(nvo11514701) 10ml pen/strep(gibco,15140
‑
122) 2ml嘌呤霉素(gibco,a11138
‑
03))中培养choebnalt85细胞。在转染当天,使用电穿孔(bio
‑
rad gene pulser xcell电穿孔系统,300v,900μf,4mm比色皿)用2μg hfvii变体编码质粒和50μg鲑精dna转染1
×
10e7个choebnalt85细胞。转染一天后,通过将细胞转移到qmix2培养基(1l=1:1cd
‑
cho和sfm ii(nvo11514701) 10ml pen/strep(gibco,15140
‑
122) 1ml k
‑
维生素(k.vit 13a 01311) 14ml g418(gibco,10131
‑
027))来开始g418选择。g418选择10
‑
14天后,细胞达到>95%活力(vi
‑
cell xr细胞计数器)。在2
×
e1000烧瓶中将细胞分成0.4
×
10e6个细胞/ml至2
×
250ml qmix2。3
‑
4天后,细胞达到约4
‑5×
10e6个细胞/ml的密度。通过添加20%cho cd efficient feed b(gibco a10240) 6mm glutamax(gibco,35050)启动表达。开始4天后,再加入10%cho cd efficient feed b 6mm glutamax。在开始后第6天,收获培养物并离心(200g,5分钟)。收集上清液并加入15mm hepes(gibco,15630)和5mm cacl2(sigma,21115)。使用0.22μm瓶顶过滤器(corning,cls430049)对上清液进行过滤除菌。
[0542]
cfviia
‑
嵌合体(22017
‑
051)的表达和纯化
[0543]
使用如上所概述的类似表达系统生成cfviia
‑
嵌合体。如实施例26所述,使用通过将内部抗fvii(a)抗体(f1a2)偶联至琼脂糖珠而制备的亲和柱从培养基中纯化酶原cfvii
‑
嵌合体。抗fvii(a)抗体f1a2以ca 依赖性方式与fvii(a)的gla结构域结合。使用人fixa激活酶原cfvii
‑
嵌合体,并使用f1a2亲和纯化重新纯化,以获得最终的cfvi嵌合体。
[0544]
热点分析
[0545]
使用单价人源化抗体mab0842(oa)的热点分析通过在25℃下使用表面等离子体共振(biacore t200)与一组19个fvii(a)变体的结合研究来进行。使用标准胺偶合化学试剂盒在cm4上传感器芯片(均由ge healthcare提供)上固定25μg/ml的靶向fvii(a)gla结构域的抗fvii(a)抗体(nn内部ab 4f6(nielsen al等人,pnas 114(47)12454
‑
12459,2017))。在细胞培养上清液(如上所述)中的根据表19的fvii(a)变体在运行缓冲液中稀释,并以10μl/min的流速注射1分钟,以达到5
‑
55ru的捕获水平。每个fvii(a)变体都被固定化的抗fvii(a)gla ab捕获。随后,将540nm(3倍稀释)的mab0842(oa)以30μl/min的流速注射7min,以允许与捕获的fvii(a)变体结合,随后进行9min的缓冲液注射,从而使单臂抗fvii(a)抗体解离。通过将10xhbs
‑
p缓冲液(由ge healthcare提供)稀释10倍并补充1mg/ml bsa和5mm cacl2以得到10mm hepes、150mm nacl、0.05%v/v聚山梨醇酯20(ph7.4)、5mm cacl2、1mg/ml牛血清白蛋白(bsa)来制备运行缓冲液。该运行缓冲液还用于稀释抗fvii(a)抗体和fvii(a)样品。使用10mm hepes、150mm nacl、20mm edta、0.05v/v聚山梨醇酯20(ph7.4)实现芯片的再生。使用由制造商(biacore ab,uppsala,瑞典)提供的biaevaluation 4.1,根据1:1动力学模型和稳态分析来分析结合数据。只要可能,就报告来自1:1动力学拟合模型的ka、kd和kd值。对于4个fvii(a)变体,报告了使用稳态拟合模型的kd值。另外,报告了所有fvii(a)变体的捕获信号。如果氨基酸残基被丙氨酸置换导致亲和力相对于野生型降低十(10)倍或更多,则该氨基酸残基被认为是热点残基。基于表19中提供的数据得出以下结论:氨基酸残基h115、t130、v131和r392是热点。
[0546]
表19.fvii(a)变体与单价人源化抗体mab0842(oa)的结合相互作用,如根据实施方案16通过表面等离子体共振(spr)分析所确定的。
[0547][0548][0549]
实施例18:与人源化11f2抗体共同配制的重组fviia在食蟹猴中的药代动力学
[0550]
在食蟹猴研究中,在静脉内或皮下施用单独的重组fviia(rfviia)或与单价单臂11f2 mab0705(oa)的1:3摩尔比共同制剂后估计fviia血浆活性
‑
时间曲线。将制剂作为5.4nmol/kg fviia(包括用于共同制剂的16.2nmol/kg mab0705(oa))的单剂量施用,并在三周时间内抽取血样。
[0551]
在实验过程中,动物按照当地卫生当局的标准程序进行饲养和处理,并允许自由获取饲料和水。fviia血浆活性使用如实施例8所述的fviia活性测定来测量。内源性食蟹猴fviia在给药前低于lloq(0.1nm),因此可以忽略。
[0552]
fviia血浆活性
‑
时间曲线的药代动力学分析使用phoenix winnonlin 6.4通过非
房室方法进行。从数据估计了以下参数:清除率(cl)、平均停留时间(mrt)和sc生物利用度(f)。参数在表20中列出,并显示与不存在抗体时的fviia相比,通过与mab0705(oa)共同配制,在静脉内和皮下施用后,fviia活性均显著延长。
[0553]
表20:在食蟹猴研究中,在静脉内或皮下施用5.4nmol/kg单独的fviia或与mab0705(oa)的1:3摩尔比共同制剂后,fviia血浆活性的清除率(cl)、平均停留时间(mrt)和sc生物利用度(f)。值为平均值(sd),n=3。
[0554][0555]
实施例19:鼠抗tlt
‑
1抗体mab0012的人源化和优化
[0556]
人源化
[0557]
使用wo2012/117091中公开的鼠抗人tlt
‑
1抗体mab0082作为人源化过程的起点。mab0082通过以下方式衍生自mab0012:并入两个点突变——vl中的c41a和vh中的t61a,以分别去除vl的fr1中未配对的半胱氨酸和vh的cdr2中的n
‑
糖基化位点。人源化过程基于本领域技术人员已知的标准分子生物学方法。
[0558]
简而言之,基于imgt数据库中定义的vh3_74/jh1序列,将mab0082 cdrh1、cdrh2和cdrh3序列移植到人种系序列上。此外,将三个vh3_74/jh1人氨基酸置换引入到移植的cdrh2序列中以进一步人源化该cdr序列:p62d、l64v和d66g。为了获得与mab0082相当的结合亲和力,向vl序列的位置s49g、d62p和r98s处引入三个回复突变。关于vl的人源化,将mab0082 cdrl1、cdrl2和cdrl3序列移植到基于如imgt数据库中定义的vkii_a23/jk2序列的人种系序列上。vl序列在cdr1中包含潜在的脱酰胺热点(ng基序)。在该位置使用饱和诱变,发现ng基序可以被n33q置换消除,而不损害对tlt
‑
1的亲和力。
[0559]
mab0082的最终人源化和优化变体被称为mab1076,对应于seq id no:934(vl)和938(vh)。
[0560]
人源化tlt1变体的spr分析
[0561]
在25℃下通过表面等离子体共振(biacoret200)探测stlt1(对应于seq id no:3,在c末端添加了六个组氨酸残基)与来自(实施例4)的biab的结合。使用标准胺偶合化学将抗人igg固定在cm5传感器芯片(均由ge healthcare提供)上。根据表21的纯化biab(1nm)以10μl/min的流速注射1分钟。随后,0至60μm的stlt1以30μl/min的流速注射3分钟以允许与biab结合,随后进行3分钟缓冲液注射以允许从biab上解离。通过将10xhbs
‑
p缓冲液(由ge healthcare提供)稀释10倍并补充1mg/ml bsa和5mm cacl2以得到10mm hepes、150mm nacl、0.05%v/v聚山梨醇酯20(ph7.4)、5mm cacl2、1mg/ml牛血清白蛋白(bsa)来制备运行缓冲液。该运行缓冲液还用于稀释biab和stlt1样品。使用由3m mgcl2组成的推荐再生缓冲液(由ge healthcare提供)实现芯片的再生。使用由制造商(biacore ab,uppsala,瑞典)提供的biaevaluation 4.1,根据1:1模型分析结合数据。分析导致表21中报告的结合常数,证
明了biab对stlt1结合的亲和力范围从2.9nm至320nm。
[0562]
表21.stltl与biab的相互作用的估计结合常数,如根据实施方案x通过表面等离子体共振(spr)分析所确定的。
[0563][0564]
实施例20:hz
‑
tlt1和tlt
‑
1肽复合物制品的晶体结构
[0565]
用于与tlt
‑
1茎肽复合结晶的fab片段包含对应于mab1076的vl和vh结构域序列(分别为seq id no:854和858)、人igg4 ch1结构域和具有单点突变(g157c)的人κcl。g到c的置换在fab片段的恒定域中,即远离抗原结合位点,并且对与tlt
‑
1的结合没有影响。通过本领域技术人员已知的标准肽合成方法制备37
‑
聚体茎肽eeeeethkigslaenafsdpagsanplepsqdeksip(seq id no:13),其对应于seq id no:2的残基111
‑
147。将fab和茎肽在hepes缓冲液(20mm hepes(ph 7.3),150mm nacl)中以1:2摩尔比混合。在用hepes缓冲液洗脱的superdex 200柱上使用凝胶过滤分离1:1fab:肽复合物,随后浓缩至约11mg/ml并用于结晶。
[0566]
结晶
[0567]
在18℃下使用坐滴蒸汽扩散技术生长凝胶过滤的1:1摩尔fab/肽复合物的晶体。将150nl 10.8mg/ml fab:肽复合物在20mm hepes(ph 7.3)和150mm nacl中的蛋白质溶液与作为沉淀剂的50nl 1m licl、0.1m柠檬酸钠
‑
柠檬酸(ph 4)和20%(w/v)peg 6000混合,并在60μl沉淀剂上孵育。
[0568]
衍射数据采集
[0569]
在液氮中快速冷却之前,通过向结晶滴中加入1μl加有20%乙二醇的沉淀剂来冷冻保护晶体。使用来自dectris的eiger 16m混合像素探测器,在max iv同步加速器(lund,瑞典)的biomax光束线处以100k采集衍射数据。使用来自xds包的程序进行数据的自动索引、积分和缩放(衍射数据统计信息总结在表22中)。
[0570]
结构确定和精修
[0571]
根据matthews系数分析判断,不对称单元含有两个fab:肽复合物。通过分子替换确定结构。使用在程序套件phenix中实施的phaser,以蛋白质数据库条目5kmv的h和l链作为定位两个fab的搜索模型。这些是使用coot用正确的氨基酸序列构建、之后使用phenix精修进行精修的模型。在差异电子密度图中清楚地看到来自肽的氨基酸7至21,并且可以使用coot手动建立模型。该模型进一步使用phenix精修和coot中的手动重建的步骤进行精修。精修统计信息见表22。
[0572]
表22.数据采集和精修统计信息
[0573]
[0574][0575]
最高分辨率shell的统计信息显示在括号中。
[0576]
fab/肽复合物的表位和互补位
[0577]
表位被定义为具有以下特征的tlt
‑
1茎
‑
肽中的残基:在不对称单元中的两个复合物中,具有在与fab中的重原子相距的距离内的重原子(即非氢原子)。类似地,互补位被定义为具有以下特征的fab片段中的残基:在不对称单元中的两个复合物中,具有在与tlt
‑
1茎
‑
肽中的重原子相距的距离内的重原子,发现表位包含来自根据seq id no:13的37aa tlt
‑
1肽的以下残基:
[0578]
k8
[0579]
i9
[0580]
g10
[0581]
s11
[0582]
l12
[0583]
a13
[0584]
n15
[0585]
a16
[0586]
f17
[0587]
s18
[0588]
d19
[0589]
p20
[0590]
a21
[0591]
对应于seq id no:2和3的k118、i119、g120、s121、l122、a123、n125、a126、f127、s128、d129、p130和a131)。
[0592]
互补位包含来自重链可变域(seq id no:938)的以下残基:
[0593]
v2
[0594]
f27
[0595]
r31
[0596]
y32
[0597]
w33
[0598]
e50
[0599]
t57
[0600]
n59
[0601]
s98
[0602]
g99
[0603]
v100
[0604]
t102
[0605]
s103
[0606]
以及来自轻链可变域(seq id no:934)的以下残基:
[0607]
h31
[0608]
y37
[0609]
h39
[0610]
y54
[0611]
f60
[0612]
s61
[0613]
s96
[0614]
t97
[0615]
v99
[0616]
y101
[0617]
实施例21:亲和力对抗fvii(a)/抗
‑
tlt
‑
1双特异性抗体刺激活性的影响
[0618]
为了确定亲和力对双特异性抗体活性的影响,来自11f2 mab0005(参见实施例14)和mab0012(参见实施例19)的人源化并且对fviia和tlt
‑
1分别具有不同亲和力的许多抗fvii(a)和抗tlt
‑
1mab如wo2011/023785所述,在使用脂化tlt
‑
1的fxa生成测定中以双特异性形式进行测试。
[0619]
第一步,在并入10:90磷脂酰丝氨酸:磷脂酰胆碱囊泡中的4nm重组tlt
‑
1(wo2011023785)、2.5nm fviia和0至300nm浓度系列的双特异性抗体(biab)的存在下测量fx活化。在室温下在测定缓冲液(50mm hepes,100mm nacl,10mm cacl2,ph 7.3 1mg/ml bsa和0.1%peg8000)中预孵育10分钟后,加入150nm血浆衍生的fx(haematologic technologies)以得到50μl的总体积,并允许进行激活20分钟。然后通过添加25μl猝灭缓冲液(50mm hepes,100mm nacl,80mm edta,ph7.3)终止激活,并根据其水解0.5mm s
‑
2765(chromogenix)显色底物的能力量化生成的fxa(以25μl体积作为2mm贮备液加入),在spectramax plus384酶标仪中在405nm处跟踪5分钟。根据线性吸光度增加的斜率,通过减去不存在biab时的背景活性并除以该测定中的fviia浓度,计算浓度为100nm的每种biab的归一化活性(a
biab
)。
[0620]
第二步,用测定缓冲液和一系列浓度为0至80nm的fviia代替biab进行相同的测定。该测定中减去背景的fxa生成与fviia浓度之间的线性关系的斜率提供了游离fviia在所用测定条件下的比活性的量度(a
fviia
)。
[0621]
基于测得的活性,将100nm的每种biab的刺激活性计算为a
biab
/a
fviia
的比率。刺激活性提供了在添加100nm biab后由fviia引起的生成fxa增加倍数的量度。
[0622]
刺激活性在表23中提供,并且显示了biab刺激对分别结合fviia和tlt
‑
1的强度(表示为解离常数(kd)值)的依赖性。在测试的biab中,biab0001表现出最高的刺激活性。
[0623]
表23:如实施例21所述,在fx、fviia和脂化tlt
‑
1的存在下,双特异性抗体的刺激活性。对于每种双特异性抗体,列出了测得的刺激活性(平均值
±
sd,n=2)以及分别与fviia和tlt
‑
1相互作用的解离常数。
[0624][0625][0626]
实施例22:表位定位对抗fvii(a)/抗tlt
‑
1双特异性抗体刺激活性的影响
[0627]
为了确定表位定位对双特异性抗体活性的影响,在如实施例21中进行的fxa生成测定中以双特异性形式测试了许多分别与tlt
‑
1和fviia上的不同表位结合的抗tlt
‑
1和抗
fviia mab。
[0628]
结果在表24中提供,并且显示了biab刺激活性对表位定位的依赖性。具体而言,与抗fviia mab mab0865组合的抗tlt
‑
1mab mab1076、mab0023、mab0051和mab0062表现出相当的刺激活性。
[0629]
表24如实施例22所述,在fx、fviia和脂化tlt
‑
1的存在下,双特异性抗体的刺激活性。对于每种双特异性抗体,列出了测得的刺激活性(平均值
±
sd,n=2)以及分别与fviia和tlt
‑
1相互作用的解离常数。
[0630][0631]
实施例23:人igg的抗原测定(loci)
[0632]
通过发光氧通道免疫测定(loci)测量食蟹猴血浆中人igg(higg)的存在。简而言之,loci试剂包括两种乳胶珠试剂(供体和受体珠)和针对higg的生物素化单克隆抗体(biosite,目录号afc4249)。用链霉亲和素包被含有光敏染料的供体珠试剂。第二珠试剂——受体珠——与内部针对higg的单克隆抗体(0421)缀合,这构成了夹心结构。在测定过程中,三种反应物与血浆中的higg组合形成珠
‑
聚集体免疫复合物。该复合物的激发从供体珠中释放出单线态氧分子,该分子被引导到受体珠中并触发化学发光反应。然后在envision酶标仪中测量。产生的光量(以每秒的计数(cps)报告)与higg的浓度成比例。将样品在测定缓冲液中稀释至少100倍,并基于添加到1%食蟹猴血浆中的higg准备校准曲线。
[0633]
实施例24:fvii(a)的抗原测定(loci)
[0634]
包括fvii酶原、fviia和fviia:抗凝血酶(fviia:at)复合物在内的fvii(a)抗原通过如实施例23所述的loci测定进行测量,不同之处在于fvii(a)的测定由用内部抗fvii(a)抗体(4f9)和内部生物素化抗fvii(a)单克隆抗体(4f7)包被的受体珠组成。将样品在测定缓冲液中稀释至少100倍,并通过将已知量的人rfviia添加到测定缓冲液中准备校准曲线。
[0635]
实施例25:fviia:at(抗凝血酶)的抗原测定(eia)
[0636]
fviia:at(抗凝血酶)复合物通过使用如h等人,j thromb haemost 2011;9:333
–
8所述的酶免疫测定(eia)来测量。与n末端egf结构域结合并且不阻断抗凝血酶结合的单克隆抗fviia抗体(dako denmark a/s,glostrup,丹麦,产品代码o9572)用于捕获fviia:at复合物。预先形成的人fviia和食蟹猴抗凝血酶的复合物(fviia:at)通过在10μm低分子量肝素(依诺肝素)的存在下孵育fviia与2倍摩尔过量的抗凝血酶来制备。在室温下孵育过夜后fviia的残留酰胺分解活性(参见实施例11)经证实低于初始fviia活性的10%。该复合物用于构建eia校准曲线。多克隆抗人抗凝血酶抗体过氧化物酶缀合物用于检
测(siemens healthcare diagnostics aps,ballerup,丹麦,产品代码owmg15)。加入tmb,进行显色直至足够显色,通过加入h2so4终止,在吸光度酶标仪(biotek)上测量450nm处的吸光度,以650nm作为参考。颜色强度与fviia:at的浓度成比例。
[0637]
实施例26:人fviia、fvii(酶原)和fviia:at(抗凝血酶)复合物的制备
[0638]
人fviia(活化fvii)的制备
[0639]
除非另有说明,否则重组人活化fvii(fviia)如thim等人(1988)biochemistry 27:7785
‑
7793和persson等人(1996)febs lett 385:241
‑
243所述制备。
[0640]
人fvii(酶原fvii)的制备
[0641]
在cho细胞中产生的重组人fvii通过如thim等人(1988)biochemistry 27:7785
‑
7793所述的单步钙依赖性亲和色谱法纯化。纯化后,将酶原fvii透析到10mm mes、100mm nacl、10mm cacl2(ph6.0)缓冲液中。通过在1mm显色底物s
‑
2288和200nm stf的存在下测量酰胺分解活性来确定制品中活化fvii(fviia)的水平(参见实施例11)。通过将其与用已知浓度的fviia准备的标准曲线相关联,可以将测得的活性转化为酶原fvii制品中fviia的摩尔浓度。
[0642]
人fviia:at(抗凝血酶)复合物的制备
[0643]
fviia:at(抗凝血酶)复合物通过在4℃下孵育等摩尔浓度的人重组fviia、人血浆衍生的at(baxter)和低分子量肝素(依诺肝素钠)16小时来制备。为了去除污染的辅料,at在使用前通过应用氯化钠梯度在肝素sepharose 6fast flow(ge healthcare)柱上重新纯化。通过超滤将洗脱的at向上浓缩,以在含有50%甘油的10mm hepes、25mm nacl(ph7.3)中得到最终制品。fviia:at复合物在4℃下在20mm mes、100mm nacl、1mm edta(ph5.5)中通过sec色谱法纯化,以使复合物稳定性最大化。制品中fviia的残留水平如上所述测定。为了使复合物分解最小化,将制品分装储存在
‑
80℃下,并在使用前立即解冻并保存在冰上。
[0644]
实施例27:抗fvii(a)/抗tlt
‑
1biab在食蟹猴中的单剂量药代动力学biab0001和相应的yte变体biab0352(其中将额外的三个半衰期延长置换(m252y、s254t和t256e)引入重链恒定域中)以3.0、9.49或30nmol/kg静脉内给药或以9.49nmol/kg皮下(sc)给药于食蟹猴。每组由两只猴子(一只雄性和一只雌性)组成。在给药前以及对于iv组在给药后0.5h、2.5h、6h、12h、24h、48h、72h及第8、10和15天取1ml柠檬酸钠稳定的血样。对于sc组,在给药前和给药后0.5h、3h、6h、12h、16h、24h、30h、38h、48h、54h、72h、78h、96h、120h及第8、10和15天采集血样。血样以2000g离心10分钟,取出血浆,分成等份并储存在
‑
80℃直至分析higg(参见实施例23)、总fvii(a)抗原(参见实施例24)、fviia活性(参见实施例8)和fviia:at复合物(实施例25)。使用phoenix winnonlin 6.4通过非房室方法进行higg的浓度与时间曲线的药代动力学(pk)分析。下列pk参数显示在表24中:半衰期(t1/2)、清除率(cl)、分布体积(vz)、平均停留时间(mrt)和sc生物利用度(f)。
[0645]
表24.基于来自食蟹猴的血浆样品分析的具有和不具有yte突变的biab的pk参数。*
[0646][0647][0648]
*)每条线代表来自一只食蟹猴的数据,**)cl用于iv给药组,cl/f用于sc组。f对应于sc生物利用度。
[0649]
在用biab0001或相应的yte
‑
变体biab0352给药的猴子中观察到内源性fvii(a)的积累。表25显示了fvii(a)抗原、fviia活性和fvii:at的给药前水平以及在给药后72至240小时之间测得的平均累积水平。观察到fvii(a)抗原、fviia活性和fviia:at的抗体剂量依赖性积累。fvii(a)抗原相对于给药前水平增加了多达3倍,而fviia和fviia:at增加了多达5倍。数据表明,单剂量的具有yte突变的biab0001或biab0352的静脉内或皮下给药导致内源性fvii(a)抗原、fviia活性和fviia:at复合物在体内积累。
[0650]
表25:在向食蟹猴单次静脉内或皮下施用具有或不具有yte突变的biab后,fvii(a)抗原、fviia和fviia:at的积累。
[0651]
[0652][0653]
*)数据是来自每组n=2只动物和来自iv组的3个时间点和来自sc组的6个时间点的测量值的平均值和sd。对于所有16只动物,给药前的值基于一个时间点(给药前)。
[0654]
实施例28:单价11f2抗fvii(a)抗体mab0705(oa)在食蟹猴中的单剂量和多剂量药代动力学
[0655]
通过向食蟹猴施用单价11f2抗fvii(a)抗体mab0705(oa),然后测量血浆样品中的fvii抗原、fviia活性和fviia:at,分析fvii、fviia和fviia:at的体内积累。两只大约2.5kg的雄性食蟹猴在隐静脉、头静脉或尾的侧尾静脉中静脉内给予40nmol/kg mab0705(oa),而3只雄性食蟹猴每隔一天在大腿(左大腿和右大腿交替进行)皮下(sc)给予20nmol/kg的单臂抗fviia抗体(即抗体在第1、3、5、7、9、11、13和15天给药)。在给药后长达21天的时间点,从头静脉或股静脉采集血液加至3.8%柠檬酸三钠中。
[0656]
将血液以2300g离心10分钟,将血浆等分并储存在
‑
80℃直至分析higg(参见实施例23)、总fvii(a)抗原(参见实施例24)、fviia活性(参见实施例8)和fviia:at复合物(参见实施例25)。使用phoenix winnonlin 6.4通过非房室方法进行浓度与时间曲线的pk分析。静脉内给药的pk参数显示在表26中。单次静脉内给药后,单臂抗体的半衰期(t1/2)平均为116小时(4.8天)。皮下施用的抗体的估计半衰期为181
±
20小时(n=3的平均值和sd)。抗体在两周给药期间积累,在初始给药后336至366小时之间的时间点导致1179
±
140nm的最大水平(来自n=3只动物和3个时间点的数据的平均值和sd)。
[0657]
表26.在食蟹猴中以40nmol/kg静脉内施用的mab0705(oa)的pk参数。
[0658][0659]
mab0705(oa)的单次静脉内或重复皮下给药导致内源性fvii(a)的积累。40nmol/kg的单次静脉内剂量后的总fvii(a)抗原、fviia:at和fviia在表27中示出。在第7
‑
14天,总
fvii抗原从给药前的7.0nm增加到35.0
±
4.7nm。同样,fviia从低于检测限(0.009nm)增加到2.3
±
0.7nm,fviia:at在第7
‑
14天从1.0增加到6.3
±
0.8nm。如通过从总fvii(a)抗原中减去fviia和fviia:at所计算的,施用40nmol/kh单臂抗体后的酶原fvii水平为26.4nm。
[0660]
表27.在给药后第7
‑
14天测得的40nmol/kg mab0705(oa)单次静脉内剂量后的fvii(a)水平。
[0661]
fvii(a)给药前水平(nm)稳态浓度(nm)总fvii(a)抗原7.035.0
±
4.7fviia:at1.06.3
±
0.8fviia<0.0092.3
±
0.7
[0662]
多次皮下给药后总fvii(a)、fviia和fviia:at的稳态水平在表28中示出。在第12
‑
21天,总fvii(a)抗原从给药前的6.5
±
1.5nm增加到36.9
±
9.8nm。同样,fviia在第12
‑
21天从低于检测限(0.009nm)增加到3.9
±
1.6nm,而fviia:at在第12
‑
21天从1.0
±
0.3增加到9.1
±
0.6nm。通过从总fvii(a)抗原中减去fviia和fviia:at计算出的稳态酶原fvii水平为24nm。
[0663]
数据表明,单臂抗fvii(a)抗体mab0705(oa)的施用导致内源性fvii(a)、fviia和fviia:at在体内的积累。单臂抗fvii(a)抗体的清除率(0.42
‑
0.49ml/kg
×
kg,表26)与biab0001在静脉内给药后的清除率相当(0.33
–
0.64ml/kg
×
kg,实施例27,表24)。因此,预期在重复施用单臂抗fvii(a)抗体后测得的fvii(a)抗原、fviia和fviia:at的稳态水平代表将在重复施用具有相同fvii(a)结合臂的biab后在稳态下达到的水平。
[0664]
表28.在初始给药后第12
‑
21天测得的,在20nmol/kg mab0705(oa)重复皮下给药后的fvii(a)稳态水平。
[0665]
fvii(a)给药前水平(nm)稳态浓度(nm)总fvii(a)抗原6.5
±
1.536.9
±
9.8fviia:at1.0
±
0.39.1
±
0.6fviia<0.0093.9
±
1.6
[0666]
实施例29:在添加抗fvii(a)/抗tlt
‑
1biab0001以及稳态水平的酶原fvii、fviia和fviia:at的人全血中,在血友病a样状况下的凝血弹性描记术
[0667]
双特异性抗fvii(a)/抗tlt
‑
1抗体biab0001(其中亲本抗fvii(a)是mab0865并且亲本抗tlt
‑
1抗体是mab1076)的效果和来自实施例28的酶原fvii、fviia和fviia:at的累积水平,在血友病a样状况下在人全血中通过凝血弹性描记术进行评价,并且与添加到血液中的rfviia的效果进行比较。原则上如viuff d等人,thromb res 2010;126:144
–
9所述,使用仪器(凝血弹性图(thrombelastograph)凝血分析仪,haemoscope corp.)进行凝血弹性描记术分析。来自健康供体的柠檬酸盐稳定的全血与0.1mg/ml中和抗fviii绵羊多克隆抗体(haematological technologies inc,目录号pahfviii
‑
s
‑
c)和5μg/ml中和抗tf小鼠单克隆抗体(1f44,内部制备)一起孵育30分钟。将在hbs/bsa缓冲液(20mm hepes,140mm nacl,ph7.4,2%bsa)中的最终血浆浓度为100nm的biab0001与rfviia(novonovo nordisk,最终血浆浓度为3.9nm)、酶原fvii(如实施例26中制备,最终血浆浓度为24nm)和fviia:at复合物(如实施例26中制备,最终血浆浓度为9nm)混合,并添加到血液样
品中。fviia:at的预稀释液在冷的20mm mes、100mm nacl、1mm edta(ph5.5) 2%bsa中制备,并在开始测定前立即加入到剩余的蛋白质中。fvii酶原和fviia:at制品含有痕量fviia,因此加入相应较低量的fviia以补偿这一点和供体血液中fviia的预期血浆浓度(0.1nm,morissey jh等人blood,1993;81:734
‑
44)。同样,加入的酶原fvii的量补偿供体血液中10nm酶原fviia的预期血浆浓度。单独的样品含有25nm rfviia,对应于向患有血友病a的人类受试者施用90μg/kg rfviia后的理论最大血浆浓度(lindley cm等人clin pharmacol ther 1994;55:638
‑
48)。对照包括单独的biab和没有biab的fvii/fviia/fviia:at混合物。通过添加par1激动剂肽sfllrn(tocris biosciences目录号3497)至终浓度为30μm和gpvi激动剂惊厥蛋白(convulxin)(5
‑
diagnostics,目录号5d
‑
1192
‑
50ug)至终浓度为10ng/ml,最大程度地激活血小板。将20μl体积的在20mm hepes(ph 7.4)中的0.2m cacl2加入teg杯中,然后加入340μl血样,并立即开始分析。通过软件(分析软件,版本4.1.73)计算被定义为达到teg迹线2mm振幅的时间的凝血时间(r
‑
时间)。来自4个供体的数据在表29中示出。通过中和fviii诱导血友病a样状况后,凝血时间从正常血液中的290
±
12s延迟至3506
±
1561s。添加25nm rfviia导致模拟血友病a血液的凝血时间缩短至694
±
158s。向血液中添加100nm biab导致凝血时间适度缩短至2198
±
712s,这最有可能是由于血液中内源性fviia的作用增强。添加稳态水平的fvii/fviia/fviia:at将凝血时间缩短至1440
±
275s。组合100nm biab和稳态水平的fvii/fviia/fviia:at将凝血时间缩短至495
±
39s,即达到与添加25nm fviia后的凝血时间相当或略低的水平。数据表明,biab增强了fvii/fviia/fviia:at的累积水平的影响,导致凝血时间缩短类似于或略好于使用治疗有效浓度的rfviia实现的凝血时间缩短。
[0668]
表29.在具有或不具有稳态水平的fvii/fviia/fviia:at的人全血中,biab0001(100nm)的效果的凝血弹性描记术分析。
[0669][0670]
实施例30:在添加具有不同tlt
‑
1亲和力的双特异性抗fvii(a)/抗tlt
‑
1抗体和稳态水平的酶原fvii、fviia和fviia:at的人全血中,在血友病a样状况下的凝血弹性描记术
[0671]
在本实施例中,测试了以下对tlt
‑
1具有不同亲和力的双特异性抗fvii(a)/抗tlt
‑
1抗体:
[0672][0673][0674]
如实施例29所述,通过凝血弹性描记术评价浓度为100nm的双特异性抗体。凝血时间(r
‑
时间)在表30中列出。通过添加抗fviii抗体诱导血友病a(ha)后,凝血时间从340秒延迟到5433秒。对tlt
‑
1具有最高亲和力的biab(biab0001)的存在将凝血时间缩短至2465秒,即超过其他三种单独的biab所观察到的凝血时间缩短:biab0015将凝血时间缩短至3645秒;
‑
biab0090缩短至4335秒,biab0095缩短至4110秒。同样,biab与稳态水平的fvii、fviia和fvii:at的组合对于biab0001(缩短至540秒)比其他三种biab导致更显著的凝血时间缩短;即,对于biab0015缩短至1100秒,对于biab0090缩短至1040秒,对于biab0095缩短至815秒。数据表明,对tlt
‑
1具有最高亲和力(即最低kd)的biab0001在缩短凝血时间方面最有效。
[0675]
表30:在具有或不具有稳态水平的fvii/fviia/fviia:at的人全血中,biab0001、biab0015或biab0090(各100nm)的效果的凝血弹性描记术分析。
[0676][0677]
[0678]
实施例31:抗fvii(a)/抗tlt
‑
1双特异性抗体biab001在缺乏fviii的转基因人tlt
‑
1小鼠的尾静脉横切模型中的体内效果
[0679]
使用转基因fviii敲除(即血友病a)、鼠tlt
‑
1敲除、人类敲入小鼠中的尾静脉横切(tvt)模型,确定抗fvii(a)/抗tlt
‑
1双特异性抗体biab0001的体内功效。由于抗fvii(a)不识别鼠fvii(a),因此biab与人fviia、fvii、fvii:at共同施用,以在小鼠中提供这些组分的目标血浆水平(分别为3.8、26.2和9.0nm),从而根据实施例28模拟它们的预期临床稳态血浆水平。biab的浓度为40或100nm。简言之,将小鼠用异氟烷麻醉并置于加热垫上,加热垫被设置为将动物的体温保持在37℃,并将其尾巴浸入盐水(37℃)中。损伤前5分钟在右尾侧静脉进行给药。在该tvt模型(johansen等人,haemophilia,2016,625
‑
31)中,横切侧静脉。如果在10、20或30分钟时出血停止,则将尾巴从盐水中取出,并用盐水湿润的纱布拭子轻轻擦拭伤口。40分钟后通过对盐水中血红蛋白的量进行定量来确定总失血量。在施用后40分钟,从眼眶神经丛采集血样加到3.8%柠檬酸三钠中。将血液以4000g离心5分钟,将血浆等分,并储存在
‑
80℃直到分析higg(参见实施例23)、总fvii(a)抗原(参见实施例24)和fviia活性(参见实施例8)。
[0680]
如表31所示,与单独的biab或没有biab给予的fvii(a)相比,fviia和biab的所有组合导致失血量显著减少。对于所有组合,治疗后45分钟测得的血小板计数与在媒介物组中观察到的相当。
[0681]
总之,这些数据证明了在预期稳态水平的fviia、fvii和fvii:at的存在下,biab0001的显著体内止血作用。
[0682]
表31.在施用所示biab0001、fviia、fvii和fviia:at的组合的fviii敲除/鼠tlt
‑
1敲除/人tlt
‑
1敲入小鼠中,尾静脉横切(tvt)后的失血量。施用的剂量、预期的和测得的血浆浓度以及确定的失血量以平均值
±
sem(n=10)显示。使用单向anova,随后使用dunnett多重比较检验,发现第3
‑
5组的失血量与第1组和第2组有显著差异。总fvii(a)抗原浓度(根据实施方案23测量)在标记为“fvii”的行中列出,数值用星号标记。
[0683][0684]
虽然本文已经阐述并描述了本发明的某些特征,但是本领域普通技术人员现在将会想到许多修改、替换、改变和等同方案。因此,应当理解,意欲以所附权利要求书涵盖所有这些落入本发明真正范围内的修改和改变。
[0685]
实施例32:在竞争性elisa中鉴定与抗tlt
‑
1mab1076竞争结合tlt
‑
1的抗体
[0686]
用于竞争实验的fab片段(抗tlt
‑
1fab)包含对应于mab1076的vh和vl结构域序列(分别为seq id no:938和934)、人igg4 ch1结构域和具有单点突变(g157c)的人κcl。g到c的置换在fab片段的恒定域中,即远离抗原结合位点,并且对与tlt
‑
1的结合没有影响(参见实施例20)。如wo2011/023785所述,重组体作为tlt
‑
1产生。抗tlt
‑
1fab使用标准方法进行生物素化,包括根据制造商的说明使用生物素化试剂盒(ez
‑
link,thermo)。
[0687]
为了确定抗tlt
‑
1抗体是否与抗tlt
‑
1fab及其衍生抗体竞争结合tlt
‑
1,进行了竞争研究。重组tlt
‑
1在稀释缓冲液(20mm hepes,5mm cacl2,150mm nacl,ph7.2)中在nunc maxisorp板中于4℃固定过夜。将板洗涤并在洗涤缓冲液(20mm hepes,5mm cacl2,150mm nacl,0.5ml/l吐温20,ph7.2)中封闭15分钟。对于竞争研究,最终固定浓度的生物素化抗tlt
‑
1fab与一系列稀释的抗tlt
‑
1抗体组合,在稀释缓冲液中得到0到最高100mg/ml范围内的终浓度。将混合物加入板的孔中并孵育1小时。然后将板洗涤并加入hrp标记的链霉亲和素
‑
hrpo(在稀释缓冲液中1:2000;kirkegaard&perry labs)并孵育1小时。最后,将板洗涤并用tmb one(kementec)显色10分钟。通过加入h3po4(4m)终止反应,并在fluostar optima中在450nm处读板,减去在620nm处测得的背景信号。除非另有说明,否则所有孵育均在室温下进行,并且使用洗涤缓冲液洗板5次。
[0688]
将要固定在nunc maxisorp板上的重组tlt
‑
1的浓度以及与用于竞争研究的竞争抗体混合的生物素化抗tlt
‑
1fab的固定浓度通过两种组分的单独滴定来确定,目的是提供足够的信号以允许检测竞争抗体的竞争(即信号降低)。用于固定的tlt
‑
1的浓度通常在0
‑
1mg/ml的范围内,如125ng/ml。生物素化抗tlt
‑
1fab的浓度通常在0
‑
1mg/ml的范围内,如10ng/ml。
[0689]
根据测得的信号(od单位),在任何给定抗体浓度下的竞争如下计算
[0690]
%抑制=(1
‑
(od单位
‑
100%抑制)/(0%抑制
‑
100%抑制))*100其中0%抑制是由不含任何竞争性抗tlt
‑
1抗体的孔中的信号确定的,100%抑制被确定为来自不含生物素化抗tlt
‑
1fab的孔的信号(即对应于测定背景)。如果在高达10000倍过量的生物素化抗tlt
‑
1fab下检测抗体浓度时观察到至少50%的抑制(%抑制),则认为抗体与抗tlt
‑
1fab竞争结合tlt
‑
1。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。