1.本发明涉及一种流感病毒小分子抑制剂,属于药物化学技术领域。
背景技术:
2.流感病毒属于正粘病毒科,可以引起急性呼吸道传染病。根据核蛋白和基质蛋白抗原性的不同,流感病毒可分为a、b、c、d四种型别。其中a型流感病毒可以感染包括人、禽、猪、马等在内的多种动物。除h1/h2/h3亚型流感病毒可造成季节性流感或流感大流行外,多种亚型(h5、h6、h7、h9、h10)流感病毒均已出现感染人的病例,给人类生命健康造成了巨大的威胁。
3.据世界卫生组织估计季节性流感病毒在全球范围内,每年可导致多达65万例死亡和300~500万例严重感染。世界卫生组织建议将每年接种流感疫苗作为预防流感的最有效方法。然而,由于流感病毒容易发生变异,而季节性流感疫苗的年度病毒选择基于提前的预测。如果出现预测毒株和当季流行毒株不够匹配的情况,就会影响疫苗效力。此外,为新出现的流感病毒生产配套的疫苗,大约需要6个月,在此期间,人群仍然容易受到感染。
4.除流感疫苗外,烷胺类药物、神经氨酸酶抑制剂以及核酸内切酶活性抑制剂等流感病毒特异性药物也可以有效的治疗流感病毒感染。然而,流感病毒易于变异的特性使得耐药问题日益严重。据ncbi流感病毒数据库显示,近期分离的h3亚型流感病毒株均含有耐烷胺类药物相关氨基酸突变。神经氨酸酶类抑制剂的耐药突变也逐年递增,因此开发新型抗流感病毒药物成为当务之急。
技术实现要素:
5.本发明的目的是提供一种流感病毒小分子抑制剂。
6.本发明涉及的流感病毒小分子抑制剂为普拉曲沙(pralatrexate),fda已批准药物,其结构式如式ⅰ所示(分子式为c
23
h
23
n7o5,分子量为477.47,cas号为146464-95-1),目前作为二氢叶酸还原酶抑制剂,用于复发性恶性淋巴瘤、外周t细胞淋巴瘤的治疗。
[0007][0008]
本发明提供了式ⅰ所示化合物在下述1)或2)中的应用:
[0009]
1)抑制流感病毒;
[0010]
2)治疗或/和预防流行性感冒。
[0011]
本发明还提供了式ⅰ所示化合物在制备下述1)或2)的产品中的应用:
[0012]
1)流感病毒抑制剂,
[0013]
2)治疗或/和预防流行性感冒的药物。
[0014]
以式ⅰ所示化合物为活性成分的下述1)或2)的产品:
[0015]
1)流感病毒抑制剂;
[0016]
2)治疗或/和预防流行性感冒的药物。
[0017]
本发明中,所述流感病毒为a型流感病毒。
[0018]
本发明中,所述流行性感冒由a型流感病毒引起。
[0019]
本发明中,所述a型流感病毒具体为h1n1、h5n1或h5n6亚型流感病毒。
[0020]
本发明中,所述流感病毒抑制剂和所述治疗或/和预防流行性感冒的药物,除含有式ⅰ所示的化合物外,还可含有适宜的载体或赋形剂。
[0021]
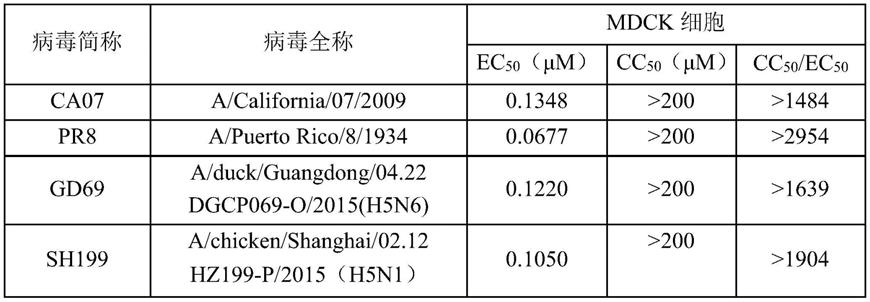
实验证明,式ⅰ所示化合物对a型流感病毒具有抑制作用,其中,实验测得式ⅰ所示化合物对两种h1n1亚型流感病毒株a/california/07/2009(简称ca07,文献记载:antigenic and genetic characteristics of swine-origin 2009a(h1n1)influenza viruses circulating in humans,science,2009,325(5937),197-201)和a/puerto rico/8/1934(h1n1)(简称pr8,文献记载:synthetic generation of influenza vaccine viruses for rapid response to pandemics,2013,sci transl med 5(185),185ra68)的ec
50
分别为0.1348和0.0677μm;对a/duck/guangdong/04.22dgcp069-o/2015(h5n6,clade-2.3.4.4)(简称gd69,文献记载:quan c,wang q,zhang j,zhao m,dai q,huang t,et al.avian influenza a viruses among occupationally exposed populations,china,2014
–
2016.emerg infect dis.2019;25(12):2215-2225.https://dx.doi.org/10.3201/eid2512.190261)的ec
50
为0.1220μm;对a/chicken/shanghai/02.12hz199-p/2015(h5n1,clade 2.3.2.1c)(简称sh199,文献记载:quan c,wang q,zhang j,zhao m,dai q,huang t,et al.avian influenza a viruses among occupationally exposed populations,china,2014
–
2016.emerg infect dis.2019;25(12):2215-2225.https://dx.doi.org/10.3201/eid2512.190261)的ec
50
为0.1050μm。
[0022]
综上所述,式ⅰ所示化合物对h1n1、h5n6和h5n1亚型流感病毒均具有显著抑制作用,初步显示出式ⅰ所示化合物具有广谱的抗a型流感病毒潜力。
[0023]
实验证明,式ⅰ所示化合物对细胞的毒性较小,对mdck细胞的cc
50
均大于200μm,cc
50
/ec
50
比值(即选择性指数si)>200,可作为安全有效的抗流感病毒药物。
附图说明
[0024]
图1为普拉曲沙对流感病毒的抑制活性。
[0025]
图2为普拉曲沙对mdck细胞活力的影响。
具体实施方式
[0026]
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
[0027]
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0028]
实施例1、普拉曲沙的抑制功效评价
[0029]
一、细胞水平多浓度梯度实验评价普拉曲沙对h1n1流感病毒的抑制作用
[0030]
1、在dmem培养基中加入双抗(青霉素和链霉素)和tpck(终浓度为2μg/ml)配制成维持液,并用此维持液稀释流感病毒,使得流感病毒滴度为100tcid
50
/25μl维持液。
[0031]
2、将普拉曲沙用100%dmso溶解并配制成40mm母液,再用步骤1配制的维持液将母液5倍梯度逐级稀释为不同浓度(100μm、20μm、4μm、0.8μm、0.16μm、0.032μm、0.0064μm、0.00128μm、0.000256μm、0.0000512μm)的待测溶液,每个浓度体积为50ul。待测溶液中dmso的终浓度为0.02%(体积百分含量),同时设置采用0.02%dmso作为替代待测溶液的阴性对照组。
[0032]
3、将mdck细胞(购自中国科学院细胞库)接种于96孔板中,置于37℃,5%co2培养箱孵育过夜,待其长至90%~100%密度时,弃掉培养上清,pbs清洗2遍。
[0033]
4、取步骤3的96孔板,将步骤1配置的体系加至孔内,置于37℃,5%co2培养箱孵育1h后,弃去,将步骤2配置的体系加至孔内,置于37℃,5%co2培养箱孵育20h。
[0034]
5、取步骤4的96孔板,吸弃培养上清,加入固定液(3体积份乙醇 2体积份丙酮置于-20℃冰箱保存)100μl/孔,室温固定细胞10min后吸弃固定液,pbst洗2遍,每孔加入100μl含有5%(质量百分含量)脱脂奶粉的pbs,37℃孵育1h。弃之,加入100μl按1:5000稀释的抗a型流感病毒np蛋白抗体(100083-a,influenza a 7307,r&d),37℃孵育1h。pbst洗5遍,每次5min,每孔加入100μl按1:5000稀释的辣根酶标记羊抗鼠igg二抗(be0102-100,goat anti-mouse igg(h&l)-hrp conjugated羊抗鼠二抗,easybio),37℃孵育1h。pbst洗5遍,每次5min,然后加入100μl tmb显色液。显色10min后,加入100μl 2m hcl。取受试样品,在multiskan fc型酶标仪上检测,读取od
450
数值,数据用graphpad处理,计算出抑制剂的ec
50
(半数最大效应浓度,即药效实验中能引起50%最大效应时的受试物浓度)。
[0035]
结果如图1所示,式ⅰ所示化合物对a/california/07/2009和a/puerto rico/8/1934(h1n1)的ec
50
分别为0.1348和0.0677μm;对a/duck/guangdong/04.22dgcp069-o/2015(h5n6,clade-2.3.4.4)和a/chicken/shanghai/02.12hz199-p/2015(h5n1,clade 2.3.2.1c)的ec
50
分别为0.1220μm和0.1050μm。
[0036]
二、抑制剂对细胞毒性评价实验
[0037]
1、将普拉曲沙用100%dmso溶解配制成40mm的母液,再用含双抗(青霉素和链霉素)的dmem培养液5倍梯度稀释为不同终浓度(200μm、40μm、8μm、1.6μm、0.32μm、0.064μm、0.0128μm、0.003μm、0.0005μm和0.0001μm)的待测溶液,待测溶液中dmso的终浓度为0.5%(体积百分含量)。
[0038]
2、将mdck细胞(购自中国科学院细胞库)接种于96孔板中,置于37℃,5%co2培养箱孵育过夜24h,待其长至90%~100%密度时,弃掉培养上清,pbs清洗2遍。
[0039]
3、配置反应体系:在100μl dmem培养液中加入不同浓度的待测溶液,每个浓度设置3个复孔。同时设置采用0.5%dmso作为替代待测溶液的阴性对照组,设置采用dmem培养液替代待测溶液的空白对照组。
[0040]
4、取步骤2的96孔板,将步骤3配置的体系加至孔内,置于37℃,5%co2培养箱孵育24h后,弃掉培养上清,使用pbs洗2遍,每孔加入100μl dmem培养液和10μl cck-8试剂(日本同仁公司),置于37℃,5%co2培养箱里孵育1~3h,取受试样品,在multiskan fc型酶标仪
上检测,读取od
450
读数。数据用graphpad prism5软件进行处理,绘制出药物对mdck细胞的细胞活力评价曲线,并计算出抑制剂的cc
50
(半数细胞毒性浓度,即在细胞毒性实验中导致50%的细胞发生病变时的受试物浓度)。
[0041]
结果如图2所示,可以看出,普拉曲沙对细胞的毒性较小,对mdck细胞的cc
50
均大于200μm,cc
50
/ec
50
比值(即选择性指数si)>200,可作为安全有效的抗流感病毒药物。
[0042]
由上述ec
50
的测定值,计算cc
50
/ec
50
值,如表1中所示。
[0043]
表1普拉曲沙对a型流感病毒的抑制活性和对mdck细胞活力评价
[0044][0045]
上述实验结果可知,cc
50
/ec
50
比值(即选择性指数si)>200,说明普拉曲沙在不伤害细胞的情况下对流感病毒具有抑制作用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
