使用cea cd3双特异性抗体和wnt信号传导抑制剂的癌症治疗
技术领域
1.本发明涉及癌症治疗,尤其涉及使用cea cd3双特异性抗体和wnt信号传导抑制剂的癌症治疗。
背景技术:
2.t细胞活化性双特异性抗体是一类新型的癌症治疗剂,它们被设计成使细胞毒性t细胞对抗肿瘤细胞。这种抗体与t细胞上的cd3以及与肿瘤细胞上表达的抗原的同时结合将迫使肿瘤细胞与t细胞之间产生短暂的相互作用,从而引起t细胞活化和随后的肿瘤细胞裂解。
3.t细胞双特异性抗体赛必妥单抗(cibisatamab)(rg7802、ro6958688、 cea
‑
tcb)是一种新型的t细胞活化性双特异性抗体,靶向肿瘤细胞上的癌胚抗原(cea)和t细胞上的cd3,它能使t细胞独立于其t细胞受体特异性而重定向到在细胞表面处表达cea糖蛋白的肿瘤细胞(bacac等人, oncoimmunology.2016;5(8):1
–
30)。t细胞重定向双特异性抗体的一个主要优点是它们不依赖于新抗原负荷而介导t细胞对癌细胞的识别。cea在许多结直肠癌(crc)的细胞表面上过表达,因此赛必妥单抗是一种有前景的免疫治疗剂,用于非高突变的微卫星稳定(mss)crc。
4.赛必妥单抗具有用于t细胞上的cd3ε链的单个结合位点,以及调节对具有中等至高cea细胞表面表达的癌细胞的结合亲合力的两个cea结合位点(bacac等人,clin cancer res.2016;22(13):3286
–
97)。这避免了靶向在生理上存在于某些组织中的具有低cea表达水平的健康上皮细胞。赛必妥单抗与癌细胞表面上的cea以及t细胞上的cd3结合触发t细胞活化、细胞因子分泌和细胞毒性颗粒释放。赛必妥单抗在患有表达cea的转移性crc且在至少两个先前的化疗方案中失败的患者中的i期试验显示了抗肿瘤活性,其中放射性缩小分别出现在用单一疗法治疗或与pd
‑
l1抑制性抗体组合治疗的患者的11%(4/36)和50%(5/10)中(argil
é
s等人,annoncol.2017年6月1日;28(增刊3):mdx302.003
‑
mdx302.003;tabernero等人, j clin oncol.2017年5月20日;35(增刊15):3002)。基于这些结果,cea是用于mss crc的免疫疗法的最有前景的靶抗原之一。尽管该剂量递增试验中的一些患者用低于最终推荐剂量的剂量进行治疗,但反应率仍然表明肿瘤亚组对治疗具有抗性。
5.因此,期望增加对赛必妥单抗和其他靶向cea的免疫治疗剂(特别是 cea cd3双特异性抗体)的反应率和/或其治疗功效。
具体实施方式
6.已经使用采用外周血单核细胞的杀伤测定法在体外研究了赛必妥单抗活性在crc细胞系中的分子机制(bacac等人,clin cancer res. 2016;22(13):3286
–
97)。这将cea表达鉴定为赛必妥单抗敏感性的主要决定因素,因为只有表达中等至高cea水平的细胞系才对t细胞介导的杀伤敏感。
7.使用源自患者的结直肠癌类器官(pdo),发明人已发现通过用wnt 信号传导抑制
剂治疗可以增加癌细胞上的cea表达,因此通过将cea cd3 双特异性抗体(诸如赛必妥单抗)与wnt信号传导抑制剂组合可以增加对这些抗体的反应率和/或这些抗体的治疗功效。
8.因此,在第一个方面,本发明提供了一种用于治疗个体的癌症的ceacd3双特异性抗体,其中所述治疗包括将所述cea cd3双特异性抗体与 wnt信号传导抑制剂组合施用。
9.在另一个方面,本发明提供了cea cd3双特异性抗体在制造用于治疗个体的癌症的药物中的用途,其中所述治疗包括将所述cea cd3双特异性抗体与wnt信号传导抑制剂组合施用。
10.在又一个方面,本发明提供了一种用于治疗个体的癌症的方法,其包括向所述个体施用cea cd3双特异性抗体和wnt信号传导抑制剂。
11.在一个方面,本发明还提供了一种药盒,其包括含有cea cd3双特异性抗体的第一药物和含有wnt信号传导抑制剂的第二药物,并且任选地还包括包装说明书,所述包装说明书包括将所述第一药物与所述第二药物组合施用以治疗个体的癌症的说明。
12.上文和本文所述的cea cd3双特异性抗体、方法、用途或药盒可以单独地或组合地结合下文描述的任何特征(除非上下文另有说明)。
13.本文的cea cd3双特异性抗体是特异性地结合cd3和cea的双特异性抗体。特别有用的cea cd3双特异性抗体描述于例如pct公开号wo 2014/131712和wo 2017/055389(各自全文以引用方式并入本文)中。
14.术语“双特异性”意指该抗体能够特异性地结合至少两种独特的抗原决定簇。典型地,双特异性抗体包含两个抗原结合位点,这两个抗原结合位点中的每一个对不同的抗原决定簇具有特异性。在某些方面,该双特异性抗体能够同时结合两种抗原决定簇,特别是在两种独特细胞上表达的两种抗原决定簇。
15.如本文所用,术语“抗原决定簇”与“抗原”和“表位”同义,是指多肽大分子上的位点(例如一段连续的氨基酸或由非连续氨基酸的不同区域组成的构象构型),抗原结合部分与所述位点结合,从而形成抗原结合部分
‑
抗原复合物。有用的抗原决定簇可以在例如肿瘤细胞的表面上、病毒感染细胞的表面上、其他患病细胞的表面上、免疫细胞的表面上、血清中的游离物和/或细胞外基质(ecm)中找到。
16.如本文所用,术语“抗原结合部分”是指特异性地结合抗原决定簇的多肽分子。在一个方面,抗原结合部分能够将其所附接的实体(例如第二抗原结合部分)引导至靶位点,例如引导至携带抗原决定簇的特定类型的肿瘤细胞。在另一个方面,抗原结合部分能够通过其靶抗原(例如t细胞受体复合物抗原)激活信号传导。抗原结合部分包括如本文进一步定义的抗体及其片段。特定的抗原结合部分包括抗体的抗原结合结构域,其包含抗体重链可变区和抗体轻链可变区。在某些方面,所述抗原结合部分可以包含如本文进一步定义的和本领域已知的抗体恒定区。可用的重链恒定区包括以下五种同种型中的任一种:α、δ、ε、γ或μ。可用的轻链恒定区包括以下两种同种型中的任一种:κ和λ。
17.所谓“特异性地结合”,意指结合对于抗原具有选择性,并且可以与不需要的或非特异性的相互作用区分开。抗原结合部分与特定抗原决定簇结合的能力可以通过酶联免疫吸附测定(elisa)或本领域技术人员熟悉的其他技术(例如表面等离子体共振(spr)技术(例如在biacore仪器上分析)(liljeblad等人,glyco j 17,323
‑
329(2000))以及传统的结合测定 (heeley,endocr res 28,217
‑
229(2002))来测量。在一个方面,抗原结合部分与不
相关蛋白质的结合程度小于该抗原结合部分与抗原的结合程度的约 10%,如例如通过spr所测得的。在某些方面,与抗原结合的抗原结合部分,或包含该抗原结合部分的抗体具有以下解离常数(k
d
):≤1μm、≤ 100nm、≤10nm、≤1nm、≤0.1nm、≤0.01nm或≤0.001nm(例如10
‑8m 或更小,例如从10
‑8m至10
‑
13
m,例如从10
‑9m至10
‑
13
m)。
[0018]“亲和力”是指分子(例如,受体)的单个结合位点与其结合配偶体 (例如,配体)之间的非共价相互作用的总和的强度。除非另外指明,否则如本文所用,“结合亲和力”是指固有结合亲和力,该固有结合亲和力反映了结合对的成员(例如,抗原结合部分与抗原,或者受体与其配体)之间的1:1相互作用。分子x对其配偶体y的亲和力通常可以用解离常数(k
d
) 来表示,该解离常数是解离速率常数与缔合速率常数(分别为k
off
和k
on
)之比。因此,等效亲和力可以包括不同的速率常数,只要速率常数之比保持相同即可。亲和力可以通过本领域中已知的完善确立的方法(包括本文所述的那些方法)来测量。用于测量亲和力的特定方法是表面等离子体共振 (spr)。
[0019]
除非另外指明,否则“cd3”是指来自任何脊椎动物来源的任何天然cd3,该脊椎动物来源包括哺乳动物诸如灵长类动物(例如人)、非人灵长类动物(例如食蟹猴)和啮齿动物(例如小鼠和大鼠)。该术语涵盖“全长”的未加工cd3,以及由细胞中的加工所产生的任何形式的cd3。该术语还涵盖cd3的天然存在的变体,例如剪接变体或等位基因变体。在一个方面, cd3是人cd3,特别是人cd3的ε亚基(cd3ε)。人cd3ε的氨基酸序列以uniprot(www.uniprot.org)登录号p07766(144版)或ncbi (www.ncbi.nlm.nih.gov/)refseq np_000724.1示出。还可参见seq id no: 34。食蟹猴[macaca fascicularis]cd3ε的氨基酸序列以ncbi genbank号 bab71849.1示出。还可参见seq id no:35。
[0020]
除非另外指明,否则“癌胚抗原”或“cea”(也称为癌胚抗原相关细胞粘附分子5(ceacam5))是指来自任何脊椎动物来源的任何天然cea,该脊椎动物来源包括哺乳动物诸如灵长类动物(例如人)、非人灵长类动物 (例如食蟹猴)和啮齿动物(例如小鼠和大鼠)。该术语涵盖“全长”的未加工cea,以及由细胞中的加工所产生的任何形式的cea。该术语还涵盖 cea的天然存在的变体,例如剪接变体或等位基因变体。在一个方面, cea是人cea。人cea的氨基酸序列以uniprot(www.uniprot.org)登录号p06731或ncbi(www.ncbi.nlm.nih.gov/)refseq np_004354.2示出。在一个方面,cea是细胞膜结合的cea。在一个方面,cea是在细胞(例如癌细胞)的表面上表达的cea。
[0021]
如本文所用,关于fab分子等的术语“第一”、“第二”或“第三”在每种类型的部分多于一种时用于方便区分。除非明确说明,否则使用这些术语并不旨在赋予所述双特异性抗体特定的次序或取向。
[0022]
如本文所用,术语“价”表示在抗体中存在指定数目的抗原结合位点。因此,术语“与抗原单价结合”表示在抗体中存在对抗原具有特异性的一个 (并且不超过一个)抗原结合位点。
[0023]
本文的术语“抗体”以最广泛的含义使用,并且涵盖各种抗体结构,其包括但不限于单克隆抗体、多克隆抗体、多特异性抗体(例如,双特异性抗体)和抗体片段,只要它们表现出期望的抗原结合活性即可。
[0024]
术语“全长抗体”、“完整抗体”和“完全抗体”在本文中可互换使用,是指具有与天然抗体结构基本上相似的结构的抗体。
[0025]“抗体片段”是指除了完整抗体以外的分子,其包含完整抗体的与该完整抗体所结合的抗原相结合的一部分。抗体片段的示例包括但不限于fv、 fab、fab'、fab
’‑
sh、f(ab')2,双体抗体、线性抗体、单链抗体分子(例如 scfv),以及单结构域抗体。关于某些抗体片段的综述,参见hudson等人, nat med 9,129
‑
134(2003)。关于scfv片段的综述,参见例如pl
ü
ckthun,载于the pharmacology of monoclonal antibodies,第113卷,rosenburg和 moore编辑,springer
‑
verlag,new york,第269至第315页(1994);还可参见wo 93/16185;以及美国专利号5,571,894和5,587,458。对于包含挽救受体结合表位残基并且具有延长的体内半衰期的fab片段和f(ab')2片段的讨论,参见美国专利号5,869,046。双体抗体是具有两个抗原结合位点的抗体片段,其可以是二价或双特异性的。参见例如,ep 404,097;wo 1993/01161;hudson等人,nat med 9,129
‑
134(2003);以及hollinger等人, proc natl acad sci usa 90,6444
‑
6448(1993)。三体抗体和四体抗体在hudson 等人,nat med 9,129
‑
134(2003)中也有所描述。单结构域抗体是包含抗体的全部或部分重链可变结构域或者抗体的全部或部分轻链可变结构域的抗体片段。在某些方面,单结构域抗体是人单结构域抗体(domantis,inc., waltham,ma;参见例如美国专利号6,248,516b1)。抗体片段可以通过各种技术制备,这些技术包括但不限于完整抗体的蛋白水解消化,以及由重组宿主细胞(例如大肠杆菌(e.coli)或噬菌体)产生,如本文所述。
[0026]
术语“可变区”或“可变结构域”是指抗体重链或轻链的参与抗体与抗原结合的结构域。天然抗体的重链和轻链的可变结构域(分别为vh和vl)通常具有相似的结构,其中每个结构域包含四个保守框架区(fr)和三个高变区(hvr)。参见例如,kindt等人,kuby immunology,第6版,w.h. freeman and co.,第91页(2007)。单个vh或vl结构域可以足以赋予抗原结合特异性。如本文所用,与可变区序列有关的“kabat编号”是指由 kabat等人,sequences of proteins of immunological interest,第5版,publichealth service,national institutes of health,bethesda,md(1991)提出的编号系统。
[0027]
如本文所用,重链和轻链的所有恒定区和恒定结构域的氨基酸位置根据kabat等人,sequences of proteins of immunological interest,第5版, public health service,national institutes of health,bethesda,md(1991)中描述的kabat编号系统进行编号,并且在本文中被称为“根据kabat编号”或“kabat编号”。具体地讲,将kabat编号系统(参见kabat等人,sequencesof proteins of immunological interest,第5版,public health service,nationalinstitutes of health,bethesda,md(1991)的第647页至第660页)用于κ和λ同种型的轻链恒定结构域cl,并且将kabat eu索引编号系统(参见第661 页至第723页)用于重链恒定结构域(ch1、铰链、ch2和ch3),这在本文中通过在此种情况下称为“根据kabat eu索引编号”来进一步阐明。
[0028]
如本文所用,术语“高变区”或“hvr”是指抗体可变结构域中在序列上高变并且确定抗原结合特异性的各个区域,例如“互补决定区”(“cdr”)。一般来讲,抗体包含六个cdr;三个在vh中(hcdr1、hcdr2、 hcdr3),并且三个在vl中(lcdr1、lcdr2、lcdr3)。本文中的示例性cdr包括:
[0029]
(a)出现在以下氨基酸残基处的高可变环:26至32(l1)、50至52 (l2)、91至96(l3)、26至32(h1)、53至55(h2)和96至101 (h3)(chothia和lesk,j.mol.biol.196:901
‑
917(1987));
[0030]
(b)出现在以下氨基酸残基处的cdr:24至34(l1)、50至56(l2)、 89至97(l3)、31至35b(h1)、50至65(h2)和95至102(h3) (kabat等人,sequences of proteins of immunological interest,第5版, public health service,national institutes of health,bethesda,md(1991));以及
[0031]
(c)出现在以下氨基酸残基处的抗原接触点:27c至36(l1)、46至55 (l2)、89至96(l3)、30至35b(h1)、47至58(h2),以及93至 101(h3)(maccallum等人,j.mol.biol.262:732
‑
745(1996))。
[0032]
除非另外指明,否则cdr根据出处同上的kabat等人所述的方法确定。本领域的技术人员将理解,cdr名称也可以根据出处同上的chothia所述的方法、出处同上的mccallum所述的方法或者任何其他在科学上接受的命名系统来确定。
[0033]“框架”或“fr”是指除高变区(hvr)残基之外的可变结构域残基。可变结构域的fr通常由以下四个fr结构域组成:fr1、fr2、fr3和fr4。因此,hvr序列和fr序列通常在vh(或vl)中以如下次序出现:fr1
‑ꢀ
h1(l1)
‑
fr2
‑
h2(l2)
‑
fr3
‑
h3(l3)
‑
fr4。
[0034]
抗体或免疫球蛋白的“类”是指其重链具有的恒定结构域或恒定区的类型。存在五大类抗体:iga、igd、ige、igg和igm,并且这些抗体中的一些可以进一步分为亚类(同种型),例如igg1、igg2、igg3、igg4、iga1和iga2。对应于不同类别的免疫球蛋白的重链恒定结构域分别称为α、δ、ε、γ和μ。
[0035]“fab分子”是指由免疫球蛋白的重链(“fab重链”)的vh和ch1结构域以及轻链(“fab轻链”)的vl和cl结构域组成的蛋白质。
[0036]
所谓“交叉”fab分子(也称为“crossfab”),意指以下fab分子:其中 fab重链和轻链的可变结构域或恒定结构域发生交换(即互相替换),即交叉fab分子包含由轻链可变结构域vl和重链恒定结构域1ch1组成的肽链 (vl
‑
ch1,在n端至c端方向),以及由重链可变结构域vh和轻链恒定结构域cl组成的肽链(vh
‑
cl,在n端至c端方向)。为清楚起见,在其中fab轻链的可变结构域和fab重链的可变结构域发生交换的交叉fab分子中,包含重链恒定结构域1ch1的肽链在本文中称为(交叉)fab分子的“重链”。相反地,在其中fab轻链的恒定结构域和fab重链的恒定结构域发生交换的交叉fab分子中,包含重链可变结构域vh的肽链在本文中称为 (交叉)fab分子的“重链”。
[0037]
与之相比,所谓“常规”fab分子,意指处于其天然形式的fab分子,即,包含由重链可变结构域和恒定结构域组成的重链(vh
‑
ch1,在n端至c端方向),以及由轻链可变结构域和恒定结构域组成的轻链(vl
‑
cl,在n 端至c端方向)。
[0038]
术语“免疫球蛋白分子”是指具有天然存在的抗体的结构的蛋白质。例如,igg类免疫球蛋白是约150,000道尔顿的异四聚体糖蛋白,其由通过二硫键键合的两条轻链和两条重链组成。从n端到c端,每条重链具有可变结构域(vh)(也称为可变重链结构域或重链可变区),接着是三个恒定结构域(ch1、ch2和ch3)(也称为重链恒定区)。类似地,从n端到 c端,每条轻链具有可变结构域(vl)(也称为轻链可变结构域或轻链可变区),接着是一个恒定轻链(cl)结构域(也称为轻链恒定区)。免疫球蛋白的重链可以归类为以下五种类型之一:α(iga)、δ(igd)、ε (ige)、γ(igg)或μ(igm),它们中的一些可以进一步分为多个亚型,例如γ1(igg1)、γ2(igg2)、γ3(igg3)、γ4(igg4)、α1(iga1)和α
2 (iga2)。免疫球蛋白的轻链可以基于其恒定结构域的氨基酸序列而归类为以下两种类型之一:κ和λ。免疫球蛋白实质上由
通过免疫球蛋白铰链区连接的两个fab分子和一个fc结构域组成。
[0039]
本文的术语“fc结构域”或“fc区”用于定义免疫球蛋白重链的c端区,该c端区含有恒定区的至少一部分。该术语包括天然序列fc区和变体fc 区。尽管igg重链fc区的边界可能略有不同,但是人igg重链fc区通常被定义为从cys226或从pro230延伸至该重链的羧基端。然而,由宿主细胞产生的抗体可以经历对来自重链c端的一个或更多个(特别是一个或两个) 氨基酸的翻译后切割。因此,由宿主细胞通过表达编码全长重链的特定核酸分子所产生的抗体可以包括全长重链,或者该抗体可以包括全长重链的经切割变体。这可能是重链的最后两个c端氨基酸为甘氨酸(g446)和赖氨酸(k447,根据kabat eu索引编号)时的情况。因此,fc区的c端赖氨酸(lys447)或者c端甘氨酸(gly446)和赖氨酸(k447)可能存在,也可能不存在。除非本文另外指明,否则fc区或恒定区中氨基酸残基的编号是根据eu编号系统(也称为eu索引)来编号的,如在kabat等人, sequences of proteins of immunological interest,第5版,public health service, national institutes of health,bethesda,md,1991(还可参见上文)中所述。如本文所用,fc结构域的“亚基”是指形成二聚fc结构域的两种多肽中的一种,即包含免疫球蛋白重链的c端恒定区的多肽,该多肽能够稳定自缔合。例如,igg fc结构域的亚基包含igg ch2恒定结构域和igg ch3恒定结构域。
[0040]“促进fc结构域的第一亚基和第二亚基缔合的修饰”是对肽骨架的操纵或fc结构域亚基的翻译后修饰,其减少或防止包含fc结构域亚基的多肽与相同多肽缔合以形成同源二聚体。如本文所用,“促进缔合的修饰”特别包括对期望缔合的两个fc结构域亚基(即fc结构域的第一亚基和第二亚基) 中的每一者进行的单独修饰,其中所述修饰彼此互补以促进这两个fc结构域亚基的缔合。例如,促进缔合的修饰可以改变所述fc结构域亚基中的一者或两者的结构或电荷,以便分别使它们的缔合在空间上或静电上有利。因此,(异源)二聚化发生在包含第一fc结构域亚基的多肽与包含第二fc 结构域亚基的多肽之间,这在融合至每个亚基的另外组分(例如抗原结合部分)不相同的意义上可能是不同的。在一些方面,所述促进缔合的修饰包括fc结构域中的氨基酸突变,特别是氨基酸取代。在一个特定方面,所述促进缔合的修饰在fc结构域的两个亚基中的每个亚基中包含单独的氨基酸突变,特别是氨基酸取代。
[0041]
术语“效应子功能”是指可归因于抗体的fc区、随着抗体同种型的变化而变化的那些生物活性。抗体效应子功能的示例包括:c1q结合和补体依赖性细胞毒性(cdc)、fc受体结合、抗体依赖性细胞介导的细胞毒性 (adcc)、抗体依赖性细胞吞噬作用(adcp)、细胞因子分泌、免疫复合物介导的抗原呈递细胞的抗原摄取、下调细胞表面受体(例如b细胞受体),以及b细胞活化。
[0042]
相对于参考多肽序列的“氨基酸序列同一性百分比(%)”被定义为在比对候选序列与参考多肽序列并且引入空位(如果必要的话)以实现最大的序列同一性百分比之后,并且在不考虑将任何保守取代作为序列同一性的组成部分的情况下,候选序列中的氨基酸残基与参考多肽序列中的氨基酸残基相同的百分比。用于确定氨基酸序列同一性百分比的比对可以通过本领域技术范围内的各种方式来实现,例如使用公众可获得的计算机软件,诸如blast、blast
‑
2、clustal w、megalign(dnastar)软件或fasta程序包。本领域技术人员可以确定用于比对序列的适当参数,包括在所比较的序列的全长上实现最大比对所需的任何
算法。然而,出于本文的目的,使用fasta程序包第36.3.8c版或更高版本的ggsearch程序,用 blosum50比较矩阵产生氨基酸序列同一性百分比的值。fasta程序包由以下文献创作:w.r.pearson和d.j.lipman(1988),“improved tools forbiological sequence analysis”,pnas 85:2444
‑
2448;w.r.pearson(1996)
ꢀ“
effective protein sequence comparison”meth.enzymol.266:227
‑
258;以及 pearson等人,(1997)genomics 46:24
‑
36,并且可公开地从 http://fasta.bioch.virginia.edu/fasta_www2/fasta_down.shtml获得。替代性地,可以使用可在http://fasta.bioch.virginia.edu/fasta_www2/index.cgi处访问的公共服务器来比较这些序列,其中使用ggsearch(全局蛋白质:蛋白质)程序和默认选项(blosum50;开放:
‑
10;延伸:
‑
2;ktup=2)来确保执行全局而非局部比对。在输出比对标头中给出氨基酸同一性百分比。
[0043]“活化性fc受体”是这样的fc受体:其在被抗体的fc结构域接合后引发刺激携带该受体的细胞执行效应子功能的信号传导事件。人活化性fc受体包括fcγriiia(cd16a)、fcγri(cd64)、fcγriia(cd32)和fcαri (cd89)。
[0044]“降低的结合”(例如降低的与fc受体的结合)是指对相应相互作用的亲和力降低,如例如通过spr测量的。为清楚起见,该术语还包括将亲和力降低至零(或低于分析方法的检测极限),即完全消除相互作用。相反地,“增加的结合”是指对相应相互作用的结合亲和力增加。
[0045]
所谓“融合”,意指组分(例如fab分子和fc结构域亚基)直接地或经由一个或更多个肽接头通过肽键链接。
[0046]
cea cd3双特异性抗体包含特异性地结合cd3的第一抗原结合部分,以及特异性地结合cea的第二抗原结合部分。
[0047]
在一个方面,所述第一抗原结合部分包含重链可变区和轻链可变区,所述重链可变区包含seq id no:1的重链cdr(hcdr)1、seq id no:2 的hcdr2和seq id no:3的hcdr3;所述轻链可变区包含seq id no:4 的轻链cdr(lcdr)1、seq id no:5的lcdr2和seq id no:6的 lcdr3。
[0048]
在一个方面,所述第二抗原结合部分包含下述重链可变区和轻链可变区,所述重链可变区包含seq id no:9的重链cdr(hcdr)1、seq idno:10的hcdr2和seq id no:11的hcdr3,所述轻链可变区包含seqid no:12的轻链cdr(lcdr)1、seq id no:13的lcdr2和seq idno:14的lcdr3;或者(ii)下述重链可变区和轻链可变区,所述重链可变区包含seq id no:17的重链cdr(hcdr)1、seq id no:18的hcdr2和 seq id no:19的hcdr3,所述轻链可变区包含seq id no:20的轻链cdr (lcdr)1、seq id no:21的lcdr2和seq id no:22的lcdr3。
[0049]
在一个特定方面,所述cea cd3双特异性抗体包含:
[0050]
(i)第一抗原结合部分,所述第一抗原结合部分特异性地结合cd3并且包含重链可变区和轻链可变区,所述重链可变区包含seq id no:1的重链 cdr(hcdr)1、seq id no:2的hcdr2和seq id no:3的hcdr3;所述轻链可变区包含seq id no:4的轻链cdr(lcdr)1、seq id no:5的 lcdr2和seq id no:6的lcdr3;以及
[0051]
(ii)第二抗原结合部分,所述第二抗原结合部分特异性地结合cea并且包含下述重链可变区和轻链可变区,所述重链可变区包含seq id no:9的重链cdr(hcdr)1、seq id no:10的hcdr2和seq id no:11的 hcdr3,所述轻链可变区包含seq id no:12的轻链cdr
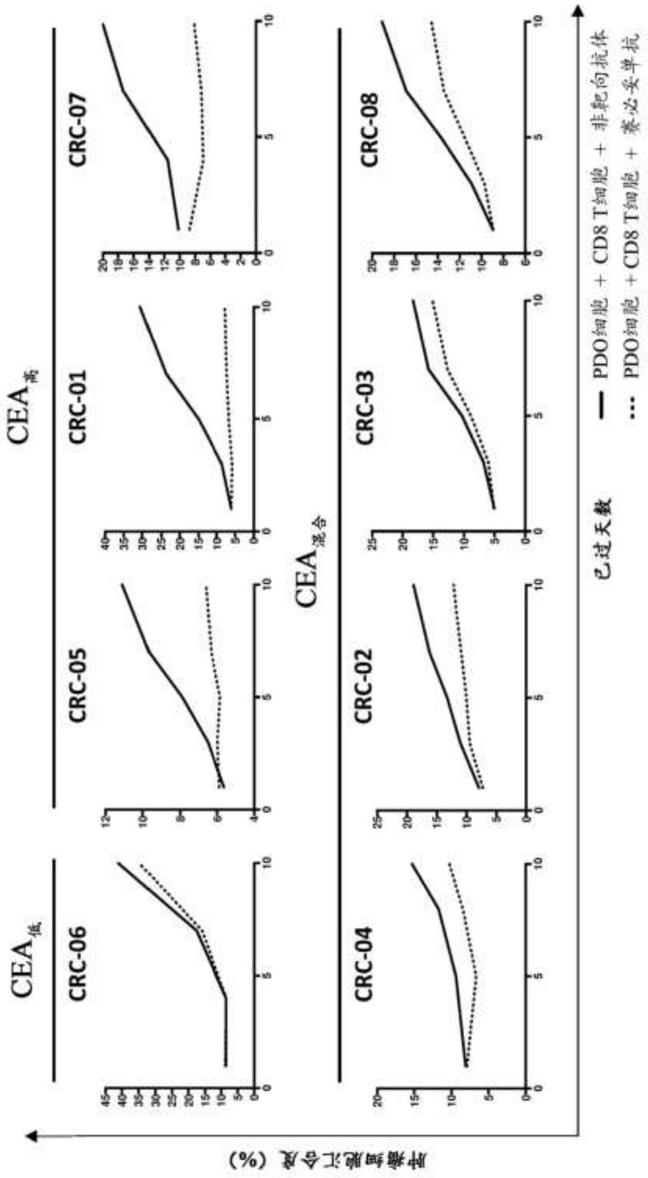
(lcdr)1、 seq id no:13的lcdr2和seq id no:14的lcdr3;或者(ii)下述重链可变区和轻链可变区,所述重链可变区包含seq id no:17的重链cdr (hcdr)1、seq id no:18的hcdr2和seq id no:19的hcdr3,所述轻链可变区包含seq id no:20的轻链cdr(lcdr)1、seq id no:21的 lcdr2和seq id no:22的lcdr3。
[0052]
在一个方面,所述第一抗原结合部分包含下述重链可变区序列和轻链可变区序列:所述重链可变区序列与seq id no:7的氨基酸序列具有至少约 95%、96%、97%、98%、99%或100%的同一性,所述轻链可变区序列与 seq id no:8的氨基酸序列具有至少约95%、96%、97%、98%、99%或100%的同一性。
[0053]
在一个方面,所述第一抗原结合部分包含seq id no:7的重链可变区序列和seq id no:8的轻链可变区序列。
[0054]
在一个方面,所述第二抗原结合部分包含下述重链可变区序列和轻链可变区序列:所述重链可变区序列与seq id no:15的氨基酸序列具有至少约95%、96%、97%、98%、99%或100%的同一性,并且所述轻链可变区序列与seq id no:16的氨基酸序列具有至少约95%、96%、97%、98%、99%或100%的同一性,或(ii)下述重链可变区序列和轻链可变区序列,所述重链可变区序列与seq id no:23的氨基酸序列具有至少约95%、96%、97%、 98%、99%或100%的同一性,并且所述轻链可变区序列与seq id no:24的氨基酸序列具有至少约95%、96%、97%、98%、99%或100%的同一性。
[0055]
在一个方面,所述第二抗原结合部分包含seq id no:15的重链可变区序列和seq id no:16的轻链可变区序列;或(ii)seq id no:23的重链可变区序列和seq id no:24的轻链可变区序列。
[0056]
在一些方面,所述第一抗原结合部分和/或所述第二抗原结合部分是 fab分子。在一些方面,所述第一抗原结合部分是交叉fab分子,其中fab 轻链和fab重链的可变区或恒定区发生交换。在此类方面,第二抗原结合部分优选地是常规的fab分子。
[0057]
在其中所述双特异性抗体的第一抗原结合部分和第二抗原结合部分都是fab分子的一些方面,并且在所述抗原结合部分之一(特别是第一抗原结合部分)中,fab轻链和fab重链的可变结构域vl和vh互相替换,
[0058]
i)在所述第一抗原结合部分的恒定结构域cl中,位置124处的氨基酸被带正电荷的氨基酸取代(根据kabat编号),并且其中在所述第一抗原结合部分的恒定结构域ch1中,位置147处的氨基酸或位置213处的氨基酸被带负电荷的氨基酸取代(根据kabat eu索引编号);或者
[0059]
ii)在所述第二抗原结合部分的恒定结构域cl中,位置124处的氨基酸被带正电荷的氨基酸取代(根据kabat编号),并且其中在所述第二抗原结合部分的恒定结构域ch1中,位置147处的氨基酸或位置213处的氨基酸被带负电荷的氨基酸取代(根据kabat eu索引编号)。
[0060]
所述双特异性抗体不包含在i)和ii)中提及的两种修饰。具有vh/vl交换的抗原结合部分的恒定结构域cl和ch1不互相替换(即保持未交换)。
[0061]
在一个更具体的方面,
[0062]
i)在所述第一抗原结合部分的恒定结构域cl中,位置124处的氨基酸独立地被赖氨酸(k)、精氨酸(r)或组氨酸(h)取代(根据kabat编号),并且在所述第一抗原结合部分的
恒定结构域ch1中,位置147处的氨基酸或位置213处的氨基酸独立地被谷氨酸(e)或天冬氨酸(d)取代 (根据kabat eu索引编号);或者
[0063]
ii)在所述第二抗原结合部分的恒定结构域cl中,位置124处的氨基酸独立地被赖氨酸(k)、精氨酸(r)或组氨酸(h)取代(根据kabat编号),并且在所述第二抗原结合部分的恒定结构域ch1中,位置147处的氨基酸或位置213处的氨基酸独立地被谷氨酸(e)或天冬氨酸(d)取代 (根据kabat eu索引编号)。
[0064]
在一个这样的方面,在所述第二抗原结合部分的恒定结构域cl中,位置124处的氨基酸独立地被赖氨酸(k)、精氨酸(r)或组氨酸(h)取代(根据kabat编号),并且在所述第二抗原结合部分的恒定结构域ch1 中,位置147处的氨基酸或位置213处的氨基酸独立地被谷氨酸(e)或天冬氨酸(d)取代(根据kabat eu索引编号)。
[0065]
在另一个方面,在所述第二抗原结合部分的恒定结构域cl中,位置124处的氨基酸独立地被赖氨酸(k)、精氨酸(r)或组氨酸(h)取代 (根据kabat编号),并且在所述第二抗原结合部分的恒定结构域ch1中,位置147处的氨基酸独立地被谷氨酸(e)或天冬氨酸(d)取代(根据 kabat eu索引编号)。
[0066]
在一个特定方面,在所述第二抗原结合部分的恒定结构域cl中,位置 124处的氨基酸独立地被赖氨酸(k)、精氨酸(r)或组氨酸(h)取代 (根据kabat编号)并且位置123处的氨基酸独立地被赖氨酸(k)、精氨酸(r)或组氨酸(h)取代(根据kabat编号),并且在所述第二抗原结合部分的恒定结构域ch1中,位置147处的氨基酸独立地被谷氨酸(e)或天冬氨酸(d)取代(根据kabat eu索引编号)并且位置213处的氨基酸独立地被谷氨酸(e)或天冬氨酸(d)取代(根据kabat eu索引编号)。
[0067]
在一个更特定的方面,在所述第二抗原结合部分的恒定结构域cl中,位置124处的氨基酸被赖氨酸(k)取代(根据kabat编号)并且位置123 处的氨基酸被赖氨酸(k)取代(根据kabat编号),并且在所述第二抗原结合部分的恒定结构域ch1中,位置147处的氨基酸被谷氨酸(e)取代 (根据kabat eu索引编号)并且位置213处的氨基酸被谷氨酸(e)取代 (根据kabat eu索引编号)。
[0068]
在一个甚至更特定的方面,在所述第二抗原结合部分的恒定结构域cl 中,位置124处的氨基酸被赖氨酸(k)取代(根据kabat编号)并且位置 123处的氨基酸被精氨酸(r)取代(根据kabat编号),并且在所述第二抗原结合部分的恒定结构域ch1中,位置147处的氨基酸被谷氨酸(e)取代(根据kabat eu索引编号)并且位置213处的氨基酸被谷氨酸(e)取代 (根据kabat eu索引编号)。
[0069]
在特定方面,如果根据上述方面的氨基酸取代在所述第二抗原结合部分的恒定结构域cl和恒定结构域ch1中进行,则所述第二抗原结合部分的恒定结构域cl是κ同种型。
[0070]
在一些方面,所述第一抗原结合部分和所述第二抗原结合部分彼此融合,任选地经由肽接头融合。
[0071]
在一些方面,所述第一抗原结合部分和所述第二抗原结合部分各自是 fab分子并且(i)所述第二抗原结合部分在所述fab重链的c端处融合至所述第一抗原结合部分的所述fab重链的n端,或(ii)所述第一抗原结合部分在所述fab重链的c端处融合至所述第二抗原结合部分的所述fab重链的n 端。
[0072]
在一些方面,cea cd3双特异性抗体提供了与cd3的单价结合。
[0073]
在特定方面,cea cd3双特异性抗体包含特异性地结合cd3的单个抗原结合部分,以及特异性地结合cea的两个抗原结合部分。因此,在一些方面,cea cd3双特异性抗体包含特异性地结合cea的第三抗原结合部分。在一些方面,所述第三抗原部分与所述第一抗原结合部分相同(例如也是 fab分子并且包含相同的氨基酸序列)。
[0074]
在特定方面,cea cd3双特异性抗体还包含fc结构域,该fc结构域包含第一亚基和第二亚基。在一个方面,所述fc结构域是igg fc结构域。在一个特定方面,所述fc结构域是igg
1 fc结构域。在另一个方面,所述 fc结构域是igg
4 fc结构域。在一个更具体的方面,所述fc结构域是在位置s228(kabat eu索引编号)处包含氨基酸取代(特别是氨基酸取代 s228p)的igg
4 fc结构域。该氨基酸取代减少了igg4抗体的体内fab臂交换(参见stubenrauch等人,drug metabolism and disposition 38,84
‑
91 (2010))。在另一个特定方面,所述fc结构域是人fc结构域。在一个特别优选的方面,所述fc结构域是人igg
1 fc结构域。人igg
1 fc区的示例性序列以seq id no:33给出。
[0075]
在其中所述第一抗原结合部分、所述第二抗原结合部分和(如果存在的话)所述第三抗原结合部分各自是fab分子的一些方面,(a)(i)所述第二抗原结合部分在所述fab重链的c端处融合至所述第一抗原结合部分的所述fab重链的n端,并且所述第一抗原结合部分在所述fab重链的c端处融合至所述fc结构域的第一亚基的n端,或(ii)所述第一抗原结合部分在所述fab重链的c端处融合至所述第二抗原结合部分的所述fab重链的n端,并且所述第二抗原结合部分在所述fab重链的c端处融合至所述fc结构域的第一亚基的n端;并且(b)所述第三抗原结合部分(如果存在的话)在所述fab重链的c端处融合至所述fc结构域的第二亚基的n端。
[0076]
在特定方面,所述fc结构域包含促进所述fc结构域的第一亚基和第二亚基缔合的修饰。人igg fc结构域的两个亚基之间最广泛的蛋白质间相互作用位点在ch3结构域中。因此,在一个方面,所述修饰在所述fc结构域的ch3结构域中。
[0077]
在一个具体方面,所述促进所述fc结构域的第一亚基和第二亚基缔合的修饰是所谓的“杵臼结构”修饰,其包括所述fc结构域的两个亚基中的一个亚基中的“杵”修饰和所述fc结构域的两个亚基中的另一个亚基中的“臼”修饰。杵臼结构技术描述于例如以下文献中:us 5,731,168;us 7,695,936; ridgway等人,prot eng 9,617
‑
621(1996),以及carter,j immunol meth 248, 7
‑
15(2001)。一般来讲,该方法涉及在第一多肽的界面处引入凸起(“杵”) 并且在第二多肽的界面中引入相应的空腔(“臼”),使得所述凸起可以定位在所述空腔中,以便促进异源二聚体的形成并且阻碍同源二聚体的形成。凸起是通过用较大侧链(例如酪氨酸或色氨酸)替换来自第一多肽的界面的小氨基酸侧链而构建的。具有与凸起相同或相似大小的补偿空腔是通过用较小的氨基酸侧链(例如丙氨酸或苏氨酸)替换大氨基酸侧链而在第二多肽的界面中创建的。
[0078]
因此,在一些方面,所述fc结构域的第一亚基的ch3结构域中的氨基酸残基被具有较大侧链体积的氨基酸残基替换,从而在第一亚基的ch3结构域内产生凸起,所述凸起可定位在第二亚基的ch3结构域内的空腔中,并且所述fc结构域的第二亚基的ch3结构域中的氨基酸残基被具有较小侧链体积的氨基酸残基替换,从而在第二亚基的ch3结构域内产生空腔,第一亚基的ch3结构域内的所述凸起可定位在所述空腔内。优选地,所述具有较大侧链体积的氨基酸残基选自由精氨酸(r)、苯丙氨酸(f)、酪氨酸(y)和色氨酸(w)组成的组。优选
地,所述具有较小侧链体积的氨基酸残基选自由丙氨酸(a)、丝氨酸(s)、苏氨酸(t)和缬氨酸(v)组成的组。所述凸起和空腔可以通过改变编码所述多肽的核酸(例如通过位点特异性诱变或通过肽合成)来制备。
[0079]
在一个具体的这种方面,在所述fc结构域的第一亚基中,位置366处的苏氨酸残基被色氨酸残基取代(t366w)替换,并且在所述fc结构域的第二亚基中,位置407处的酪氨酸残基被缬氨酸残基替换(y407v)并且任选地,位置366处的苏氨酸残基被丝氨酸残基替换(t366s),并且位置 368处的亮氨酸残基被丙氨酸残基替换(l368a)(根据kabat eu索引编号)。在另一个方面,在所述fc结构域的第一亚基中,除此之外,位置 354处的丝氨酸残基被半胱氨酸残基替换(s354c)或位置356处的谷氨酸残基被半胱氨酸残基替换(e356c)(特别是位置354处的丝氨酸残基被半胱氨酸残基替换),并且在所述fc结构域的第二亚基中,除此之外,位置 349处的酪氨酸残基被半胱氨酸残基替换(y349c)(根据kabat eu索引编号)。在一个优选方面,所述fc结构域的第一亚基包含氨基酸取代s354c 和t366w,并且所述fc结构域的第二亚基包含氨基酸取代y349c、t366s、 l368a和y407v(根据kabat eu索引编号)。
[0080]
在一些方面,所述fc结构域包含降低与fc受体的结合和/或效应子功能的一个或更多个氨基酸取代。
[0081]
在一个特定方面,所述fc受体是fcγ受体。在一个方面,所述fc受体是人fc受体。在一个方面,所述fc受体是活化性fc受体。在一个具体方面,所述fc受体是活化性人fcγ受体,更具体地是人fcγriiia、fcγri或 fcγriia,最具体地是人fcγriiia。在一个方面,所述效应子功能是选自由以下项组成的组中的一种或多种:补体依赖性细胞毒性(cdc)、抗体依赖性细胞介导的细胞毒性(adcc)、抗体依赖性细胞吞噬作用(adcp) 和细胞因子分泌。在一个特定方面,效应子功能是adcc。
[0082]
典型地,相同的一个或更多个氨基酸取代存在于所述fc结构域的两个亚基中的每个亚基中。在一个方面,所述一个或更多个氨基酸取代降低了所述fc结构域对fc受体的结合亲和力。在一个方面,所述一个或更多个氨基酸取代将所述fc结构域对fc受体的结合亲和力降低至最多1/2、最多1/5 或最多1/10。
[0083]
在一个方面,所述fc结构域在选自包括e233、l234、l235、n297、 p331和p329(根据kabat eu索引编号)的组的位置处包含氨基酸取代。在一个更具体的方面,所述fc结构域在选自包括l234、l235和p329(根据 kabat eu索引编号)的组的位置处包含氨基酸取代。在一些方面,所述fc 结构域包含氨基酸取代l234a和l235a(根据kabat eu索引编号)。在一个这样的方面,所述fc结构域是igg
1 fc结构域,特别是人igg
1 fc结构域。在一个方面,所述fc结构域在位置p329处包含氨基酸取代。在一个更具体的方面,所述氨基酸取代是p329a或p329g,特别是p329g(根据kabat eu索引编号)。在一个方面,所述fc结构域在位置p329处包含氨基酸取代,并且在选自e233、l234、l235、n297和p331(根据kabat eu索引编号)的位置处包含另外的氨基酸取代。在一个更具体的方面,所述另外的氨基酸取代是e233p、l234a、l235a、l235e、n297a、n297d或p331s。在特定方面,所述fc结构域在位置p329、l234和l235(根据kabat eu索引编号)处包含氨基酸取代。在更特定的方面,所述fc结构域包含氨基酸突变l234a、l235a和p329g(“p329g lala”、“pglala”或“lalapg”)。具体地讲,在优选的方面,所述fc结构域的每个亚基包含氨基酸取代l234a、l235a和p329g(kabat eu索引编号),即在所述fc 结构域的第一亚基和第二亚基中的每一者中,位置234处的亮氨酸残基被丙氨
酸残基替换(l234a),位置235处的亮氨酸残基被丙氨酸残基替换 (l235a),并且位置329处的脯氨酸残基被甘氨酸残基替换(p329g) (根据kabat eu索引编号)。在一个这样的方面,所述fc结构域是igg
1 fc结构域,特别是人igg
1 fc结构域。
[0084]
在一个优选方面,所述cea cd3双特异性抗体包含:
[0085]
(i)第一抗原结合部分,所述第一抗原结合部分特异性地结合cd3并且包含重链可变区和轻链可变区,所述重链可变区包含seq id no:1的重链 cdr(hcdr)1、seq id no:2的hcdr2和seq id no:3的hcdr3;所述轻链可变区包含seq id no:4的轻链cdr(lcdr)1、seq id no:5的 lcdr2和seq id no:6的lcdr3,其中所述第一抗原结合部分是交叉fab 分子,其中fab轻链和fab重链的可变区或恒定区(特别是恒定区)发生交换;
[0086]
(ii)第二抗原结合部分和第三抗原结合部分,所述第二抗原结合部分和所述第三抗原结合部分特异性地结合cea并且包含重链可变区和轻链可变区,所述重链可变区包含seq id no:9的重链cdr(hcdr)1、seq id no:10的hcdr2和seq id no:11的hcdr3;所述轻链可变区包含seq id no:12的轻链cdr(lcdr)1、seq id no:13的lcdr2和seq id no:14的lcdr3,其中所述第二抗原结合部分和所述第三抗原结合部分各自是fab分子,特别是常规的fab分子;
[0087]
(iii)fc结构域,所述fc结构域包含第一亚基和第二亚基,
[0088]
其中所述第二抗原结合部分在所述fab重链的c端处融合至所述第一抗原结合部分的所述fab重链的n端,并且所述第一抗原结合部分在所述fab 重链的c端处融合至所述fc结构域的所述第一亚基的n端,并且其中所述第三抗原结合部分在所述fab重链的c端处融合至所述fc结构域的所述第二亚基的n端。
[0089]
在一个方面,所述第一抗原结合部分包含下述重链可变区序列和轻链可变区序列:所述重链可变区序列与seq id no:7的氨基酸序列具有至少约 95%、96%、97%、98%、99%或100%的同一性,所述轻链可变区序列与 seq id no:8的氨基酸序列具有至少约95%、96%、97%、98%、99%或100%的同一性。
[0090]
在一个方面,所述第一抗原结合部分包含seq id no:7的重链可变区序列和seq id no:8的轻链可变区序列。
[0091]
在一个方面,所述第二抗原结合部分和所述第三抗原结合部分包含下述重链可变区序列和轻链可变区序列:所述重链可变区序列与seq id no: 15的氨基酸序列具有至少约95%、96%、97%、98%、99%或100%的同一性,所述轻链可变区序列与seq id no:16的氨基酸序列具有至少约95%、96%、 97%、98%、99%或100%的同一性。
[0092]
在一个方面,所述第二抗原结合部分和所述第三抗原结合部分包含 seq id no:15的重链可变区和seq id no:16的轻链可变区。
[0093]
根据上述方面的fc结构域可以单独地或组合地结合上文关于fc结构域描述的所有特征。
[0094]
在一个方面,所述抗原结合部分和所述fc区通过肽接头(特别是通过如以seq id no:27和seq id no:28所示的肽接头)彼此融合。在一个方面,所述cea cd3双特异性抗体包含以下多肽:包含的序列与seq id no: 25的序列具有至少80%、85%、90%、95%、96%、97%、98%或99%的同一性的多肽(特别是两种多肽);包含的序列与seq id no:26的序列具有至少80%、85%、90%、95%、96%、97%、98%或99%的同一性的多肽;包含的序列与
seq id no:27的序列具有至少80%、85%、90%、95%、96%、 97%、98%或99%的同一性的多肽;以及包含的序列与seq id no:28的序列具有至少80%、85%、90%、95%、96%、97%、98%或99%的同一性的多肽。
[0095]
在一个特别优选的方面,所述cea cd3双特异性抗体包含以下多肽:包含seq id no:25的序列的多肽(特别是两种多肽)、包含seq id no: 26的序列的多肽、包含seq id no:27的序列的多肽,以及包含seq id no: 28的序列的多肽。
[0096]
在一个特别优选的方面,所述cea cd3双特异性抗体是赛必妥单抗 (who药物信息(关于药用物质的国际非专利名称),inn推荐名:列表 80,2018,第32卷,第3期,第438页)。
[0097]
在一个方面,所述cea cd3双特异性抗体包含:
[0098]
(i)第一抗原结合部分,所述第一抗原结合部分特异性地结合cd3并且包含重链可变区和轻链可变区,所述重链可变区包含seq id no:1的重链 cdr(hcdr)1、seq id no:2的hcdr2和seq id no:3的hcdr3;所述轻链可变区包含seq id no:4的轻链cdr(lcdr)1、seq id no:5的 lcdr2和seq id no:6的lcdr3,其中所述第一抗原结合部分是交叉fab 分子,其中fab轻链和fab重链的可变区或恒定区(特别是可变区)发生交换;
[0099]
(ii)第二抗原结合部分和第三抗原结合部分,所述第二抗原结合部分和所述第三抗原结合部分特异性地结合cea并且包含重链可变区和轻链可变区,所述重链可变区包含seq id no:17的重链cdr(hcdr)1、seq id no:18的hcdr2和seq id no:19的hcdr3;所述轻链可变区包含seq id no:20的轻链cdr(lcdr)1、seq id no:21的lcdr2和seq id no:22的lcdr3,其中所述第二抗原结合部分和所述第三抗原结合部分各自是fab分子,特别是常规的fab分子;
[0100]
(iii)fc结构域,所述fc结构域由能够稳定缔合的第一亚基和第二亚基组成,
[0101]
其中所述第二抗原结合部分在所述fab重链的c端处融合至所述第一抗原结合部分的所述fab重链的n端,并且所述第一抗原结合部分在所述fab 重链的c端处融合至所述fc结构域的所述第一亚基的n端,并且其中所述第三抗原结合部分在所述fab重链的c端处融合至所述fc结构域的所述第二亚基的n端。
[0102]
在一个方面,所述第一抗原结合部分包含下述重链可变区序列和轻链可变区序列:所述重链可变区序列与seq id no:7的氨基酸序列具有至少约 95%、96%、97%、98%、99%或100%的同一性,所述轻链可变区序列与 seq id no:8的氨基酸序列具有至少约95%、96%、97%、98%、99%或100%的同一性。
[0103]
在一个方面,所述第一抗原结合部分包含seq id no:7的重链可变区序列和seq id no:8的轻链可变区序列。
[0104]
在一个方面,所述第二抗原结合部分和所述第三抗原结合部分包含下述重链可变区序列和轻链可变区序列:所述重链可变区序列与seq id no: 23的氨基酸序列具有至少约95%、96%、97%、98%、99%或100%的同一性,所述轻链可变区序列与seq id no:24的氨基酸序列具有至少约95%、96%、 97%、98%、99%或100%的同一性。在一个方面,所述第二抗原结合部分和所述第三抗原结合部分包含seq id no:23的重链可变区和seq id no:24 的轻链可变区。
[0105]
根据上述方面的fc结构域可以单独地或组合地结合上文关于fc结构域描述的所有特征。
[0106]
在一个方面,所述抗原结合部分和所述fc区通过肽接头(特别是通过如以seq id no:30和seq id no:31所示的肽接头)彼此融合。
[0107]
在一个方面,在(ii)下的所述第二fab分子和所述第三fab分子的恒定结构域cl中,位置124处的氨基酸被赖氨酸(k)取代(根据kabat编号) 并且位置123处的氨基酸被赖氨酸(k)或精氨酸(r)(特别是被精氨酸(r))取代(根据kabat编号),并且在(ii)下的所述第二fab分子和所述第三fab分子的恒定结构域ch1中,位置147处的氨基酸被谷氨酸(e)取代(根据kabat eu索引编号)并且位置213处的氨基酸被谷氨酸(e)取代 (根据kabat eu索引编号)。
[0108]
在一个方面,所述双特异性抗体包含以下多肽:包含的序列与seq idno:29的序列具有至少80%、85%、90%、95%、96%、97%、98%或99%的同一性的多肽;包含的序列与seq id no:30的序列具有至少80%、85%、 90%、95%、96%、97%、98%或99%的同一性的多肽;包含的序列与seqid no:31的序列具有至少80%、85%、90%、95%、96%、97%、98%或99%的同一性的多肽;以及包含的序列与seq id no:32的序列具有至少80%、 85%、90%、95%、96%、97%、98%或99%的同一性的多肽(特别是两种多肽)。
[0109]
在一个方面,所述双特异性抗体包含以下多肽:包含seq id no:29的序列的多肽、包含seq id no:30的序列的多肽、包含seq id no:31的序列的多肽,以及包含seq id no:32的序列的多肽(特别是两种多肽)。
[0110]
技术人员将获知的其他cea cd3双特异性抗体也被考虑用于本发明。
[0111]
在一个方面,所述cea cd3双特异性抗体是medi565(amg211, mt111)。
[0112]
本文的cea cd3双特异性抗体与wnt信号传导抑制剂组合使用。
[0113]
术语“wnt信号传导抑制剂”是指抑制通过wnt通路,特别是wnt/β
‑
连环蛋白通路,也称为经典wnt通路的信号传导的分子。wnt/β
‑
连环蛋白信号传导通路导致β
‑
连环蛋白在细胞质中积累,并且最终转位到细胞核中,以充当属于tcf/lef(t细胞因子/淋巴增强因子)家族的转录因子的转录共激活因子。
[0114]
一直以来,wnt/β
‑
连环蛋白通路与许多肿瘤类型(包括结直肠癌)的发展相关联。
[0115]
它需要wnt配体与卷曲蛋白(fz)受体以及lrp5/6共受体(低密度脂蛋白受体相关蛋白质5/6)结合,以经由β
‑
连环蛋白核转位来启动细胞内信号传导。β
‑
连环蛋白是一种高度不稳定的蛋白质,其细胞质的存在受到严格控制。在没有wnt配体的情况下,细胞质β
‑
连环蛋白被所谓的降解复合物靶向。该复合物由腺瘤性结肠息肉病(apc)肿瘤抑制因子、支架蛋白质axin、两种激酶ck1α(酪蛋白激酶1α)和gsk
‑
3β(糖原合酶激酶3 β)组成。最后两种组分能够将β
‑
连环蛋白在其n端的几个丝氨酸残基和苏氨酸残基上磷酸化。磷酸化的β
‑
连环蛋白随后被β
‑
转导蛋白识别(β
‑
转导蛋白是泛素连接酶复合物的一部分),从而导致β
‑
连环蛋白的多泛素化和蛋白酶体降解。wnt配体结合到与lrp5/6相关联的卷曲蛋白受体诱导蓬乱蛋白(dvl)磷酸化,其随后募集axin,从而将降解复合物解构并且实现β
‑
连环蛋白稳定和随后的核转位。在细胞核中,β
‑
连环蛋白可以结合转录因子的tcf/lef(t细胞因子/淋巴增强因子)家族的成员,并且募集转录kat3共激活因子p300和/或cbp(creb结合蛋白质)以转录wnt靶基因并引起染色质修饰(duchartre等人,critical reviews in oncology/hematology 2016,99,141
‑
149,以引用方式全文并入本文)。
[0116]
wnt信号传导抑制剂可以是靶向参与wnt信号传导的一种或多种蛋白质并且抑制
wnt信号传导通路的活性的分子,其中抑制wnt信号传导通路的活性例如通过抑制这种蛋白质与wnt信号传导通路的其他组分之间的相互作用、促进这种蛋白质的降解或者抑制这种蛋白质的功能(例如酶功能) 来实现。示例性的抑制位点包括但不限于卷曲蛋白受体、dvl蛋白质、β
‑ꢀ
连环蛋白降解复合物(包括例如gsk
‑
3β)、核β
‑
连环蛋白,以及蛋白质丝氨酸o
‑
棕榈油酰基转移酶(porcupine)和端锚聚合酶这两种酶。
[0117]
回顾了wnt信号传导的抑制剂,例如在duchartre等人,critical reviewsin oncology/hematology 2016,99,141
‑
149,或tran等人,protein science 2017,26,650
‑
661(以引用方式全文并入本文)中。
[0118]
在一个方面,本文的wnt信号传导抑制剂是wnt/β
‑
连环蛋白信号传导抑制剂。在一个方面,所述wnt信号传导抑制剂是人wnt信号传导通路 (特别是人wnt/β
‑
连环蛋白信号传导通路)的抑制剂。
[0119]
在一个方面,所述wnt信号传导抑制剂抑制了参与wnt/β
‑
连环蛋白信号传导的两种或更多种蛋白质的相互作用。在一个方面,所述wnt信号传导抑制剂促进了参与wnt/β
‑
连环蛋白信号传导的一种或多种蛋白质的降解。在一个方面,所述wnt信号传导抑制剂抑制了参与wnt/β
‑
连环蛋白信号传导的一种或多种蛋白质的功能。在一个方面,所述wnt信号传导抑制剂靶向(例如特异性地结合)wnt信号传导通路(特别是wnt/β
‑
连环蛋白通路) 的组分,所述组分选自由卷曲蛋白(fz)、蓬乱蛋白(dvl)、蛋白质丝氨酸o
‑
棕榈油酰基转移酶、端锚聚合酶、糖原合酶激酶3β(gsk
‑
3β)组成的组。
[0120]
在一个方面,所述wnt信号传导抑制剂是端锚聚合酶抑制剂。端锚聚合酶1和2(分别是tnks/artd5和tnks2/artd5)是parp(聚adp
‑ꢀ
核糖聚合酶)蛋白质,其参与包括wnt信号传导在内的一系列细胞功能。 tnks和tnks2通常使破坏复合物的两个组分axin1和axin2发生par 基化,从而促进它们的泛素化和蛋白酶体降解,这些事件使活性β
‑
连环蛋白的总量最小化。抑制tnks/tnks2使axin降解最小化、稳定破坏复合物并且阻遏wnt信号传导(elliott等人,med chem comm.2015,6,1687
‑ꢀ
1692(以引用方式全文并入本文)。
[0121]
在一个具体方面,所述wnt信号传导抑制剂是如elliott等人,med chem comm.2015,6,1687
‑
1692中所述的端锚聚合酶抑制剂,特别是如本文所述的化合物21。化合物21的结构如下所示,其中r1是me,并且r2是 ch2
‑
n
‑
(4
‑
nme2)
‑
哌啶:
[0122][0123]
在另一个具体方面,所述wnt信号传导抑制剂是如huang等人,nature 2009,461,614
‑
620(以引用方式全文并入本文)中所述的端锚聚合酶抑制剂,特别是xav
‑
939(cas号284028
‑
89
‑
3)。
[0124]
在另一个具体方面,所述wnt信号传导抑制剂是如chen等人,nat chem biol 2009,5(2),100
‑
107(以引用方式全文并入本文)中所述的端锚聚合酶抑制剂,特别是iwr
‑
1。iwr
‑
1的结构如下所示:
[0125][0126]
在另一个具体方面,所述wnt信号传导抑制剂是如mcgonigle等人, oncotarget 2015,6,41307
‑
41323(以引用方式全文并入本文)中所述的端锚聚合酶抑制剂,特别是e7449(cas号1140964
‑
99
‑
3)。
[0127]
在另一个具体方面,所述wnt信号传导抑制剂是如waaler等人, cancer res 2012,72,2822
‑
2832(以引用方式全文并入本文)中所述的端锚聚合酶抑制剂,特别是jw55(cas号664993
‑
53
‑
7)。
[0128]
在一个方面,所述wnt信号传导抑制剂是蛋白质丝氨酸o
‑
棕榈油酰基转移酶抑制剂。蛋白质丝氨酸o
‑
棕榈油酰基转移酶是膜结合的o
‑
乙酰转移酶(mboat)家族的成员,负责wnt的脂质修饰和分泌(duchartre等人, critical reviews in oncology/hematology 2016,99,141
‑
149)。
[0129]
在一个具体方面,所述wnt信号传导抑制剂是蛋白质丝氨酸o
‑
棕榈油酰基转移酶抑制剂lgk974(cas号1243244
‑
14
‑
5;liu等人,proc natl acad sci usa 2013,110,20224
‑
20229,以引用方式全文并入本文)。 lgk974的结构如下所示:
[0130][0131]
在另一个具体方面,所述wnt信号传导抑制剂是如madan等人,oncogene 2016,35,2197
‑
2207(以引用方式全文并入本文)中所述的蛋白质丝氨酸o
‑
棕榈油酰基转移酶抑制剂,特别是etc
‑
1922159(etc
‑
159;cas 号1638250
‑
96
‑
0)。
[0132]
在另一个具体方面,所述wnt信号传导抑制剂是如madan等人, kindney int 2016,89,1062
‑
1074(以引用方式全文并入本文)中所述的蛋白质丝氨酸o
‑
棕榈油酰基转移酶抑制剂,特别是wnt
‑
c59(cas号1243243
‑ꢀ
89
‑
1)。
[0133]
在另一个具体方面,所述wnt信号传导抑制剂是如wang等人,j medchem 2013,56,2700
‑
2704(以引用方式全文并入本文)中所述的蛋白质丝氨酸o
‑
棕榈油酰基转移酶抑制剂,特别是iwp
‑
l6(cas号1427782
‑
89
‑
5)或 iwp
‑
2(cas号686770
‑
61
‑
6)。
[0134]
在一个方面,所述wnt信号传导抑制剂是dvl(蓬乱蛋白)抑制剂,特别是dvl的pdz
结构域的抑制剂。dvl的pdz结构域在dvl
‑
卷曲蛋白受体相互作用和wnt信号的细胞内转导中起到重要的作用。
[0135]
在一个具体方面,所述wnt信号传导抑制剂是如shan等人, biochemistry 2005,44,15495
‑
15503(以引用方式全文并入本文)中所述的 dvl抑制剂,特别是nsc668036(cas号144678
‑
63
‑
7)。
[0136]
在另一个具体方面,所述wnt信号传导抑制剂是如grandy等人,j biolchem 2009,284,16256
‑
16263(以引用方式全文并入本文)中所述的dvl抑制剂,特别是3289
‑
8625(cas号294891
‑
81
‑
9)。
[0137]
在另一个具体方面,所述wnt信号传导抑制剂是如shan等人,chembiol drug des 2012,79,376
‑
383(以引用方式全文并入本文)中所述的dvl 抑制剂,特别是j01
‑
017a。
[0138]
在另一个具体方面,所述wnt信号传导抑制剂是如choi等人,bioorg med chem 2016,24,3259
‑
3266(以引用方式全文并入本文)中所述的dvl 抑制剂,特别是bmd4702(cas号335206
‑
54
‑
7)。
[0139]
在一个方面,所述wnt信号传导抑制剂是卷曲蛋白抑制剂。wnt信号传导是由分泌的wnt分子与其受体卷曲蛋白结合而启动的。
[0140]
在一个方面,所述wnt信号传导抑制剂是一种特异性地结合一种或多种卷曲蛋白受体的抗体,特别是单克隆抗体。在一个特定方面,所述wnt 信号传导抑制剂是万替妥单抗(vantictumab)(omp
‑
18r5)。
[0141]
在一个方面,所述wnt信号传导抑制剂包含卷曲蛋白受体的配体结合结构域。在一个方面,所述wnt信号传导抑制剂是包含人卷曲蛋白8受体的细胞外配体结合结构域和人igg1 fc结构域的融合蛋白质。在一个特定方面,wnt信号传导抑制剂是ipafricept(omp
‑
54f28)。
[0142]
技术人员将获知的其他wnt信号传导抑制剂也被考虑用于本发明。
[0143]
术语“癌症”是指哺乳动物中通常以细胞增殖未经调节为特征的生理状况。癌症的示例包括但不限于癌、淋巴瘤、母细胞瘤、肉瘤和白血病。此类癌症的更具体示例包括鳞状细胞癌、肺癌(包括小细胞肺癌、非小细胞肺癌、肺腺癌、肺非鳞状细胞癌和肺鳞状细胞癌)、腹膜癌、肝细胞癌、胃癌或胃部癌症(包括胃肠道癌)、胰腺癌(包括转移性胰腺癌)、胶质母细胞瘤、宫颈癌、卵巢癌、肝癌、膀胱癌、肝细胞瘤、乳腺癌(包括局部晚期、复发性或转移性her
‑
2阴性乳腺癌和局部复发性或转移性her2 阳性乳腺癌)、结肠癌、结直肠癌、子宫内膜癌或子宫癌、唾液腺癌、肾癌或肾脏癌症、肝癌、前列腺癌、外阴癌、甲状腺癌、肝细胞癌和各种类型的头颈癌,以及b细胞淋巴瘤(包括低级别/滤泡性非霍奇金淋巴瘤 (nhl)、小淋巴细胞性(sl)nhl、中级别/滤泡性nhl、中级别弥散性 nhl、高级别免疫原性nhl、高级别淋巴母细胞性nhl、高级别小非裂解细胞性nhl、巨大肿块nhl、套细胞淋巴瘤、aids相关淋巴瘤和华氏巨球蛋白血症)、慢性淋巴细胞性白血病(cll)、急性淋巴细胞白血病 (all)、毛细胞白血病、慢性粒细胞性白血病和移植后的淋巴增生性疾病(ptld),以及与斑痣性错构瘤病、水肿(诸如与脑肿瘤有关的水肿) 和梅格斯综合征(meigs'syndrome)相关联的异常血管增生。
[0144]
在本发明的cea cd3双特异性抗体、方法、用途和药盒的一些方面,癌症是实体瘤癌症。所谓“实体瘤癌症”,意指形成位于患者体内特定位置处的离散肿瘤块(也包括肿瘤转移)的恶性肿瘤,诸如肉瘤或癌(与例如血液癌症(诸如白血病)相反,后者通常不形成实体
瘤)。实体瘤癌症的非限制性示例包括膀胱癌、脑癌、头颈癌、胰腺癌、肺癌、乳腺癌、卵巢癌、子宫癌、宫颈癌、子宫内膜癌、食道癌、结肠癌、结直肠癌、直肠癌、胃癌、前列腺癌、皮肤癌、鳞状细胞癌、骨癌、肝癌和肾癌。本发明上下文中考虑的其他实体瘤癌症包括但不限于位于以下部位中的赘生物:腹部、骨骼、乳腺、消化系统、肝脏、胰腺、腹膜、内分泌腺(肾上腺、甲状旁腺、垂体、睾丸、卵巢、胸腺、甲状腺)、眼、头颈部、神经系统(中枢神经系统和外周神经系统)、淋巴系统、骨盆、皮肤、软组织、肌肉、脾脏、胸腔区以及泌尿生殖系统。还包括癌前病症或病变和癌症转移。
[0145]
在一些方面,癌症是cea阳性癌症。所谓“cea阳性癌症”或“表达cea 的癌症”,意指以癌细胞上表达或过表达cea为特征的癌症。cea的表达可以例如通过免疫组织化学(ihc)或流式细胞术测定法来测定。在一个方面,癌症表达cea。在一个方面,如使用对cea具有特异性的抗体通过免疫组织化学(ihc)测定的,癌症在至少20%、优选地至少50%或至少80%的肿瘤细胞中表达cea。
[0146]
在一些方面,患者中的癌细胞表达pd
‑
l1。pd
‑
l1的表达可以通过ihc 或流式细胞术测定法来测定。
[0147]
在一些方面,癌症是结肠癌、肺癌、卵巢癌、胃癌、膀胱癌、胰腺癌、子宫内膜癌、乳腺癌、肾癌、食道癌、前列腺癌或本文所述的其他癌症。
[0148]
在特定方面,癌症是选自由结直肠癌、肺癌、胰腺癌、乳腺癌和胃癌组成的组的癌症。在一个优选的方面,癌症是结直肠癌(crc)。在一个方面,结直肠癌是转移性结直肠癌(mcrc)。在一个方面,结直肠癌是微卫星稳定(mss)结直肠癌。在一个方面,结直肠癌是微卫星稳定的转移性结直肠癌(mss mcrc)。
[0149]
本文中的“患者”、“受试者”或“个体”是正在经历或已经历过癌症的一种或多种体征、症状或其他指标的有资格接受治疗的任何单个人类受试者。在一些方面,患者患有癌症或已被诊断患有癌症。在一些方面,患者患有局部晚期或转移性癌症,或者已被诊断患有局部晚期或转移性癌症。患者可能先前已用cea cd3双特异性抗体或另一种药物治疗过,或者没有这样治疗过。在特定方面,患者之前没有用cea cd3双特异性抗体治疗过。在开始cea cd3双特异性抗体疗法之前,患者可能已用包括一种或多种除 cea cd3双特异性抗体之外的药物的疗法治疗过。
[0150]
如本文所用,“治疗”(及其语法变体)是指试图改变所治疗个体的疾病的自然病程,并且可以执行以用于预防或可以在临床病理学过程中执行的临床干预措施。期望的治疗效果包括但不限于预防疾病的发生或复发、减轻症状、削弱疾病的任何直接或间接病理学后果、预防转移、降低疾病进展的速率、改善或减轻疾病状态,以及缓解或改善预后。
[0151]
cea cd3双特异性抗体和wnt信号传导抑制剂以有效量施用。
[0152]
药剂(例如药物组合物)的“有效量”是指能够以必需的剂量在必需的时段内有效地实现期望的治疗或预防结果的量。
[0153]
在一个方面,所述cea cd3双特异性抗体的施用导致t细胞,特别是细胞毒性t细胞的活化,特别是在癌症部位处(例如在实体瘤癌症内)。所述活化可以包括t细胞增殖、t细胞分化、t细胞分泌细胞因子、从t细胞释放细胞毒性效应分子、t细胞的细胞毒性活性,以及t细胞表达活化标记物。在一个方面,所述cea cd3双特异性抗体的施用导致t细胞,特别是癌症部位处(例如在实体瘤癌症内)的细胞毒性t细胞的数量增加。
[0154]
在一个方面,所述wnt信号传导抑制剂的施用导致癌症引起的cea表达增加。在一个方面,所述增加是癌细胞上的cea表达水平(每个细胞表达的cea分子的数量)增加。在一个方面,所述增加是表达cea的癌细胞的数量(或百分比)增加。cea的表达可以例如通过免疫组织化学(ihc) 或流式细胞术测定法,或者通过cea mrna的定量(例如通过rt
‑
pcr) 来测定。
[0155]
在上文和此处所述的cea cd3双特异性抗体、方法、用途或药盒的一些方面,所述cea cd3双特异性抗体和所述wnt抑制剂的治疗或施用可以导致个体中的反应。在一些方面,该反应可以是完全反应。在一些方面,该反应可以是治疗停止后的持续反应。在一些方面,该反应可以是在治疗停止后持续的完全反应。在其他方面,该反应可以是部分反应。在一些方面,该反应可以是在治疗停止后持续的部分反应。在一些方面,与单独的 cea cd3双特异性抗体(即没有wnt信号传导抑制剂)的治疗或施用相比,该反应可以得到改善。
[0156]
在一些方面,与用单独的cea cd3双特异性抗体(即没有wnt信号传导抑制剂)治疗的相应患者群体相比,所述cea cd3双特异性抗体和所述 wnt抑制剂的治疗或施用可以增加患者群体中的反应率。
[0157]
本发明的组合疗法包括施用cea cd3双特异性抗体和wnt信号传导抑制剂。
[0158]
如本文所用,“组合”(及其语法变体)涵盖了根据本发明的cea cd3 双特异性抗体和wnt信号传导抑制剂的组合,其中所述cea cd3双特异性抗体和所述wnt信号传导抑制剂在相同或不同的容器中、在相同或不同的药物制剂中、一起施用或分开施用、同时施用或按顺序(以任何次序)施用,以及通过相同或不同的途径施用,前提是所述cea cd3双特异性抗体和所述wnt信号传导抑制剂可以同时在体内发挥其生物学作用。例如,将根据本发明的cea cd3双特异性抗体和wnt信号传导抑制剂“组合”可以意指首先在特定的药物制剂中施用所述cea cd3双特异性抗体,之后在另一种药物制剂中施用所述wnt信号传导抑制剂,或将次序颠倒。
[0159]
所述cea cd3双特异性抗体和所述wnt信号传导抑制剂可以以本领域已知的任何合适的方式施用。在一个方面,所述cea cd3双特异性抗体和 wnt信号传导抑制剂按顺序(在不同时间)施用。在另一个方面,所述 cea cd3双特异性抗体和wnt信号传导抑制剂同时(在相同时间)施用。不希望受理论的束缚,在所述cea cd3双特异性抗体之前和/或与之同时施用所述wnt信号传导抑制剂可能是有利的。在一些方面,所述cea cd3双特异性抗体处于与所述wnt信号传导抑制剂分离的组合物中。在一些方面,所述cea cd3双特异性抗体处于与所述wnt信号传导抑制剂相同的组合物中。
[0160]
所述cea cd3双特异性抗体和所述wnt信号传导抑制剂可以通过任何合适的途径施用,并且可以通过相同的施用途径或不同的施用途径施用。在一些方面,所述cea cd3双特异性抗体通过静脉内、肌肉内、皮下、局部、口服、经皮、腹膜内、眶内、植入、吸入、鞘内、心室内或鼻内的方式施用。在一个特定方面,所述cea cd3双特异性抗体静脉内施用。在一些方面,所述wnt信号传导抑制剂通过静脉内、肌肉内、皮下、局部、口服、经皮、腹膜内、眶内、植入、吸入、鞘内、心室内或鼻内的方式施用。可以施用有效量的所述cea cd3双特异性抗体和所述wnt信号传导抑制剂来预防或治疗疾病。所述cea cd3双特异性抗体和/或所述wnt信号传导抑制剂的适当的施用途径和剂量可以基于以下各项来确定:待治疗的疾病类型、所述cea cd3双特异性抗体和所述wnt信号传导抑制剂的类型、疾病的严重性和进程、个体的
临床状况、个体的临床病史和对治疗的反应,以及主治医师的判断。给药可以通过任何合适的途径进行,例如通过注射,诸如静脉内或皮下注射,部分取决于施用是短暂的还是长期的。本文考虑了各种给药时间安排,包括但不限于在各个时间点处的单次或多次施用、推注施用,以及脉冲输注。所述cea cd3双特异性抗体和所述wnt信号传导抑制剂适宜一次性地或在一系列治疗中施用于患者。
[0161]
本发明的组合可以单独使用或连同其他药剂一起用于治疗。例如,本发明的组合可以与至少一种附加治疗剂共同施用。在某些方面,另外的治疗剂是抗癌剂,例如化疗剂、肿瘤细胞增殖抑制剂或肿瘤细胞凋亡激活剂。在一个特定方面,另外的治疗剂是pd
‑
l1结合拮抗剂,诸如阿替利珠单抗 (atezolizumab)。
[0162]
在上文和此处所述的cea cd3双特异性抗体、方法、用途或药盒的一些方面,治疗还包括施用pd
‑
l1结合拮抗剂,特别是阿替利珠单抗。
[0163]
本发明的组合还可以与放射疗法结合。
[0164]
本文提供的药盒典型地包括一个或更多个容器,以及在容器上或与容器相关联的标签或包装说明书。合适的容器包括例如瓶子、小瓶、注射器、静脉注射(iv)溶液袋,等等。所述容器可以由多种材料(诸如玻璃或塑料)形成。所述容器容纳组合物,该组合物本身或与另一种组合物组合能够有效地用于治疗、预防和/或诊断病症,并且所述容器可以具有无菌进入口(例如,所述容器可以是具有能够被皮下注射针刺穿的塞子的静脉注射溶液袋或小瓶)。所述组合物中的至少一种活性剂是将用于本发明的组合中的cea cd3双特异性抗体。另一种活性剂是将用于本发明的组合中的 wnt信号传导抑制剂,其可以与所述双特异性抗体在相同的组合物和容器中,或者可以在不同的组合物和容器中提供。该标签或包装说明书指出所述化合物用于治疗所选择的病症,诸如癌症。
[0165]
在一个方面,本发明提供了旨在用于治疗癌症的药盒,其包括在相同的容器或分开的容器中的(a)cea cd3双特异性抗体和(b)wnt信号传导抑制剂,并且任选地还包括(c)包装说明书,所述包装说明书包括指导使用所述组合治疗作为治疗癌症的方法的印刷说明。此外,该药盒可以包括(a)其中装有组合物的第一容器,其中所述组合物包含cea cd3双特异性抗体;(b) 其中装有组合物的第二容器,其中所述组合物包含wnt信号传导抑制剂;以及任选地(c)其中装有组合物的第三容器,其中所述组合物包含另外的细胞毒性剂或其他治疗剂。在一个方面,另外的治疗剂是pd
‑
l1结合拮抗剂,特别是阿替利珠单抗。本发明的这些方面的药盒可以还包括包装说明书,所述包装说明书指出所述组合物可以用于治疗癌症。替代性地或除此之外,所述药盒可以还包括第三(或第四)容器,所述容器装有药用缓冲液,诸如抑菌性注射用水(bwfi)、磷酸盐缓冲盐水、林格氏溶液和葡萄糖溶液。所述药盒可以还包括从商业和用户的角度所需的其他物质,包括其他缓冲液、稀释剂、滤器、针头和注射器。
附图说明
[0166]
图1.具有不同细胞表面cea表达水平的八种源自患者的结直肠癌类器官(pdo)系的生长曲线,这些类器官系在共培养10天期间用赛必妥单抗或非靶向对照抗体处理。每种pdo与来自三个不同同种异体供体的t细胞以2:1的效应物:靶标(e:t)比培养,并示出了平均值。
[0167]
图2.(a)在图1的测定终点,将八种pdo的每一者中的cea
高
细胞的分数与使用赛必妥单抗相比使用非靶标对照抗体所实现的生长减少进行比较。 (b)针对所有pdo的生长减少与cea
高
细胞分数的相关性分析。示出了线性回归线以及显著性检验的皮尔森相关系数和p值。
[0168]
图3.两种结直肠癌类器官系在进行和未进行端锚聚合酶抑制剂处理的情况下的细胞表面cea表达。
[0169]
图4.结直肠癌类器官系在cd8 t细胞和赛必妥单抗或非靶向对照抗体的存在下且有或没有2μm端锚聚合酶抑制剂(作为预处理或连续处理提供) 的情况下培养时,在7天内的生长状况。
[0170]
图5.结直肠癌类器官系在cd8 t细胞和赛必妥单抗或非靶向对照抗体的存在下且有或没有10μm端锚聚合酶抑制剂(作为预处理提供)的情况下培养时,在7天内的生长状况。
[0171]
实施例
[0172]
以下是本发明的方法和组合物的实施例。应当理解,在给出以上提供的一般描述的情况下,可以实践各种其他方面。
[0173]
实施例1.同种异体t细胞共培养测定中pdo的赛必妥单抗敏感性
[0174]
最近开发的方案允许来自crc活检的癌细胞(即所谓的源自患者的类器官(pdo))扩增和长期增殖(sato等人,gastroenterology. 2011;141(5):1762
–
72)。已提出pdo与通常在数十年前建立并且已在塑料上的长期培养期间发生了变化的癌细胞系相比,更好地代表患者肿瘤的生物学特征。从患者快速产生模型系统的能力进一步使得能够将疾病分期和既往治疗史与正在对其进行新药临床试验的患者的相应信息进行匹配。
[0175]
为了评估源自患者的结直肠癌类器官(pdo)对赛必妥单抗免疫疗法的敏感性,生成了具有不同细胞表面cea表达水平的八种源自患者的结直肠癌类器官系,并且在与同种异体cd8 t细胞共培养10天期间用赛必妥单抗 (20nm)或非靶向对照抗体(20nm)处理。通过磁珠分选从同种异体的健康供体外周血单核细胞(pbmc)分离cd8 t细胞,并且用il2和 cd3/cd28珠在体外扩增7天至14天。然后将带gfp标签的crc pdo细胞接种在96孔板中,次日添加t细胞,并且每2至3天在自动化96孔板荧光显微镜上对共培养物进行成像。测试了2:1和5:1的效应物:靶标(e:t)比,并且选择2:1的e:t用于后续实验,因为它有效地阻遏了cea
高
pdo crc
‑
01的生长,并且在用作阴性对照的非靶向抗体(dp47
‑
tcb)的存在下未示出活性。包括在没有任何抗体的情况下与cd8 t细胞共培养作为另外的对照,以使得能够鉴定同种异体反应性供体t细胞。从分析中排除了其中t细胞显示同种异体反应性(只在十次实验中的不到一次实验中观察到)的共培养物,并且重复测定,直到用来自3个独立的同种异体供体的cd8 t细胞测试了每个 pdo系为止。
[0176]
测试了八个pdo系:三个cea
高
pdo(即主要包含cea
高
细胞;crc
‑
01、 crc
‑
05、crc
‑
07)、四个具有混合cea表达的pdo(即包含cea
高
和cea
低
这两种细胞的大亚群;crc
‑
02、crc
‑
03、crc
‑
04、crc
‑
08)和一个cea 低
pdo(即主要包含cea
低
细胞;crc
‑
06)。
[0177]
全部三个cea
高
pdo对用cd8 t细胞和赛必妥单抗处理都高度敏感,而主要是cea
低
pdo crc
‑
06在这些实验条件下显示出抗性,正如预期的那样(图1)。我们的测定评估了赛必妥单抗在7天至10天的时段内的影响,并且在cea
高
pdo中示出了89%至100%的生长抑制。这证实了在该测定中赛必妥单抗将t细胞重定向至抗原阳性细胞的高效性。
[0178]
我们接下来测试了具有混合cea表达的四个pdo。尽管用赛必妥单抗和t细胞进行治疗,这些pdo的每一者仍继续增殖,与对照相比,癌细胞生长速率仅有中等程度的降低(图1和图2a)。因此,具有混合cea表达的pdo仅对这种cea靶向免疫疗法显示出部分反应。对在每个pdo中所实现的生长减少与cea
高
癌细胞的分数的皮尔森相关性分析显示,在类器官系中显示高cea表达的细胞的百分比与其对赛必妥单抗的敏感性之间存在强烈且显著的相关性(r=0.9152,95%ci:0.593至0.9848;p=0.0014;图2b)。
[0179]
这证实了在细胞表面上均匀表达高水平cea的类器官对赛必妥单抗敏感,主要具有cea低细胞的类器官具有抗性,而具有双峰/混合cea表达的类器官仅显示有限的敏感性。
[0180]
实施例2.两种结直肠癌类器官系在进行和未进行wnt信号传导抑制剂处理的情况下的细胞表面cea表达。
[0181]
我们对来自3个pdo的cea
高
细胞和cea
低
细胞进行了流式分选,并且进行了rna表达分析,以研究调节cea表达和产生异质性的机制。我们应用了基因集富集分析(gsea)(subramanian等人,proc natl acad sci u s a. 2005/09/30.2005年10月25日;102(43):15545
–
50)来鉴定与cea基因表达水平相关联的潜在分子通路。wnt/β
‑
连环蛋白信号传导是在多重测试校正后显著富集的特征,并且在cea
低
群体中上调(数据未示出)。wnt/β
‑
连环蛋白信号传导通路在大多数crc中以遗传方式激活,最常见的是通过apc 肿瘤抑制基因的突变和杂合性丧失,不太常见的是通过wnt信号传导的其他调节因子(诸如rnf43或在β
‑
连环蛋白/ctnnb1本身中)的突变 (network cga,nature.2012年7月18日;487(7407):330
–
7;giannakis等人, nat genet.2014年12月;46(12):1264
–
6)。高wnt/β
‑
连环蛋白通路活性和缺乏cea表达是肠道干细胞所处的肠隐窝底部的特征(jothy等人,am j pathol.1993年7月;143(1):250
–
7;barker等人,nat rev mol cell biol.2013年 12月11日;15:19)。此外,高wnt/β
‑
连环蛋白通路活性也是结肠癌干细胞的一个特征(de sousa等人,clin cancer res.2011年2月15日;17(4):647lp
‑ꢀ
653)。
[0182]
我们研究了wnt/β
‑
连环蛋白通路的药理性抑制是否会如这些数据所预测的那样增强cea表达。将具有混合cea表达的两个pdo系用wnt信号传导抑制剂处理,该抑制剂为端锚聚合酶抑制剂化合物21,其通过稳定β
‑
连环蛋白破坏复合物来抑制下游的wnt/β
‑
连环蛋白通路(elliott等人,medchem comm.2015;6(9):1687
–
92;mariotti等人,br j pharmacol. 2017;174(24):4611
–
36)。所述wnt信号传导抑制剂增加了两个pdo中的 cea表达和cea
高
亚群(图3)。
[0183]
用另一种wnt信号传导抑制剂,即蛋白质丝氨酸o
‑
棕榈油酰基转移酶抑制剂lgk
‑
974,也观察到具有混合cea表达的pdo中的cea表达和cea
高
亚群增加,该抑制剂阻止wnt配体分泌并因此阻止自分泌性和旁分泌性wnt 受体活化(结果未示出)。
[0184]
这些结果证实了wnt/β
‑
连环蛋白信号传导作为crc pdo中的cea表达调节剂的作用。
[0185]
实施例3.赛必妥单抗与端锚聚合酶抑制剂的组合疗法
[0186]
我们研究了当用赛必妥单抗和端锚聚合酶抑制剂化合物21的组合处理时,具有混合cea表达的两个pdo系(在相比于上述实施例1延长培养后的crc
‑
08和crc
‑
06)的生长。
[0187]
在cd8 t细胞和20nm赛必妥单抗或非靶向对照抗体(dp47
‑
tcb)的存在下在7天内对pdo进行培养。进行共培养,条件为:a)在没有端锚聚合酶抑制剂的情况下,b)在用端锚聚
合酶抑制剂预处理48小时后,在添加 t细胞时去除该抑制剂,或者c)在用端锚聚合酶抑制剂预处理48小时后,在添加t细胞以便连续暴露于端锚聚合酶抑制剂时补充该抑制剂。图4示出了2μm端锚聚合酶抑制剂浓度的结果,并且图5示出了10μm端锚聚合酶抑制剂浓度的结果(在整个测定持续过程中连续施用10μm端锚聚合酶抑制剂对癌细胞是有毒的,并且数据未示出)。在添加t细胞和抗体后7天,通过显微镜法追踪gfp标记的结直肠癌类器官培养物的汇合度。从非靶向对照存在下的接种密度到第7天的生长被定义为100%。cd8 t细胞是从同种异体健康供体细胞产生的,方式为:提取外周血单核细胞,之后用il
‑
2 珠和cd3珠刺激并且体外扩增。一式三份进行实验,并且显示的结果是平均值。误差棒代表一个标准偏差。这些数据证实,端锚聚合酶抑制剂治疗以剂量和时间依赖性方式增加了结直肠癌球体培养物对赛必妥单抗的敏感性。
[0188]
实施例4.材料和方法
[0189]
人类样品和细胞系
[0190]
从prospect c试验和prospect r试验获得来自已用至少两条在先化疗线治疗过的转移性结直肠癌的成像引导的核心活检(首席研究者:d. cunningham,英国伦理委员会批准号分别为:12/lo/0914和14/lo/1812)。从format试验获得来自未经治疗的原发性结直肠癌的一份内窥镜活检 (首席研究者:n.starling,英国伦理委员会批准号13/lo/1274)。试验在英国皇家马斯登医院进行,所有患者在被纳入试验前均提供了书面知情同意书。从当地血库获得来自健康供体的匿名血沉棕黄层(英国伦理委员会批准号06/q1206/106),或者从提供书面知情同意书的个人,通过在barts 癌症研究所的癌症生物库方案中的改善结果获得所述匿名血沉棕黄层(首席研究者:t.powles,英国伦理委员会批准号:13/em/0327)。dld
‑
1细胞系和mkn
‑
45细胞系从美国典型培养物保藏中心(american type culturecollection)获得,并且保存在补充有10%fbs、1x glutamax和100单位/ml 青霉素/链霉素的rpmi 1640培养基(thermo fisher)中。
[0191]
产生源自患者的类器官
[0192]
直接由核心活检建立来自crc
‑
01、crc
‑
02和crc
‑
06的pdo培养物,方式为:粗切,随后包埋在生长因子减少的matrigel(corning)中。极小的活检片段获自crc
‑
03、crc
‑
04、crc
‑
05、crc
‑
07和crc
‑
08,这些片段首先由英国癌症研究所(英国内政部许可证号pd498ff8d)肿瘤分析部门皮下移植或者在雌性cd1裸鼠的肾包膜下移植。一旦肿瘤生长,就将小鼠挑选出来,取出肿瘤,置于gentlemax octo解离器中使用人肿瘤解离试剂盒(miltenyi biotec)解离。使用小鼠细胞剔除试剂盒(miltenyi biotec) 磁性去除小鼠细胞,并且将经纯化的人肿瘤细胞包埋到生长因子减少的 matrigel中。使用高级dmem/f12培养基,如文献所述(sato等人, gastroenterology.2011;141(5):1762
–
72)在matrigel中扩增pdo,该培养基补充有1x glutamax、100单位/ml青霉素/链霉素、1x b27、1x n2、10mmhepes(全部来自thermo fisher)、1mm n
‑
乙酰半胱氨酸、10mm烟酰胺、10μm sb202190、10nm胃泌素、10μm y27632(sigma aldrich)、10 nm前列腺素e2、500nm a
‑
83
‑
01、100ng/ml wnt3a(biotechne)、50 ng/ml egf(merck)、1μg/ml r
‑
spondin、100ng/ml noggin和100ng/mlfgf10(peprotech)。在matrigel基质中连续生长至少2个月(最少12代) 之后,pdo首先用egfp加标签(见下文),然后在含有2%matrigel且具有20%胎牛血清(fbs)、1x glutamax、100单位/ml青霉素/链霉素的 dmem/f12(sigma aldrich)中适应生长。将pdo培
养物保持在这些条件下,并且根据需要用于t细胞共培养测定和facs分析。对每个pdo系进行了结肠癌驱动基因的遗传分析,这些分析与在匹配的肿瘤活检中鉴定的突变相同。
[0193]
用核egfp标记pdo
[0194]
通过引入带egfp标签的组蛋白2b构建体(plko.1
‑
lv
‑
h2b
‑
gfp)来标记pdo的细胞核(beronja等人,nat med.2010年7月;16(7):821
–
7),以使得能够通过自动化显微镜法进行细胞定量。为了产生病毒,将hek
‑ꢀ
293t细胞置于补充有10%fbs、1xglutamax和100单位/ml青霉素/链霉素的dmem中培养。通过使用transit
‑
293转染试剂(mirus),用质粒混合物过夜转染来生产慢病毒颗粒,该混合物含有9μg的plko.1
‑
lv
‑
h2b
‑
gfp、 2.25μg的pspax2包装质粒(didier trono馈赠;addgene质粒编号12260; http://n2t.net/addgene:12260;rrid:addgene_12260)和0.75μg的pmd2.g 包膜质粒(didier trono馈赠;addgene质粒编号12259;http://n2t.net/addgene:12259;rrid:addgene_12259)。次日更换细胞培养基, 24小时后收获病毒,并且在使用前使其通过0.45μm滤器。对于慢病毒转导,从matrigel中的培养物收获pdo,并且使用tryple express(thermofisher)将其解离成单细胞,然后沉淀。将沉淀重悬于添加了病毒和1nm聚凝胺的培养基(sigma aldrich)中,并且以300g离心1小时。在更换培养基之前,将样品重悬并且铺板于培养物中,维持介于6小时至过夜之间的一段时间。在恢复和扩增后,通过流式细胞术对egfp阳性细胞进行分选,并且在使用前进一步扩增。
[0195]
通过流式细胞术进行的表面cea表达分析
[0196]
使用无酶细胞解离缓冲液(thermo fisher)收获细胞系,并且使用 tryple express(gibco)收获pdo。取2
×
105个细胞用20nm人抗人cea 抗体ch1a1a(roche)和25μg/ml的r
‑
藻红蛋白偶联的二抗affinipuref(ab')2片段山羊抗人igg(fcγ片段特异性)(stratech)染色。包括 draq7(biostatus)染色以排除死细胞。在sony sh800流式细胞仪上分析 cea表达。门边界设定在具有混合cea表达的pdo中的高cea群体与低 cea群体之间的谷处,并且在所有样品中使用相同的门。计算每个pdo的 cea
高
群体和cea
低
群体的百分比以及平均荧光强度(mfi)。
[0197]
从外周血单核细胞扩增cd8 t细胞
[0198]
根据制造商的方案(ge healthcare),用ficoll
‑
paque从血沉棕黄层中分离外周血单核细胞(pbmc)。用人cd8 dynabeads flowcomp(thermofisher)从pbmc中分离cd8 t细胞。通过流式细胞术评估cd8 t细胞的纯度(alexa fluor 488抗人cd8,sony biotechnology),并且仅仅将具有至少90% cd8阳性细胞的群体用于用cd3/cd28 dynabeads人t细胞激活剂试剂盒 (thermo fisher)在补充有10%fbs(biosera)、1x glutamax、100单位青霉素/链霉素和30u/ml il
‑
2(sigma aldrich)的rpmi 1640中按照制造商的方案扩增。
[0199]
pdo和cd8 t细胞的共培养
[0200]
用tryple express收获pdo,并且用含有10%fbs的dmem/f12 ham 培养基(sigma aldrich)中和。将细胞通过70μm滤器过滤,计数并且重悬于补充有10%fbs(biosera)、1xglutamax和100单位青霉素
‑
链霉素的无酚红rpmi培养基(thermo fisher)中。在第0天,在96孔板(corning特殊光学微孔板(special optics microplate))的每孔中铺板5000个肿瘤细胞。在第1天,将cd8 t细胞与20nm赛必妥单抗或20nm非靶向阴性对照抗体dp47
‑
tcb
(均由roche提供)以指定的效应物:靶标(e:t)比添加。还包括没有cd8 t细胞和没有抗体的肿瘤细胞作为对照。所有条件均一式三份铺板,并且在8个pdo的每一者上测试了至少3个不同的健康供体。
[0201]
通过免疫荧光显微镜法评估癌细胞生长
[0202]
在10天的时段内,在celigo成像细胞仪(nexcelom bioscience)上使用gfp汇合度应用程序,每48至72小时对gfp汇合度进行定量。gfp汇合度分析能够在多个时间点追踪gfp阳性pdo细胞的生长,而不会错误地计数共培养物中的t细胞。汇合度分析还优于细胞核计数,后者在高癌细胞密度区域(诸如pdo中心)产生不准确的结果。汇合度分析优于测量球体直径的主要优点是甚至能够追踪显示高度可变形状的pdo的生长。用来自三名不同的健康献血者的cd8 t细胞产生生长曲线。生长减少百分比是在pdo显示生长迟缓(这可能是由于生长培养基耗尽)之前,根据介于第 7天至第9天之间读取的读数计算的。为了计算生长减少百分比,减去第1 天的汇合度,并且将终点处用dp47
‑
tcb对照抗体处理的孔中的汇合度设定为100%。
[0203]
wnt/β
‑
连环蛋白通路抑制测定
[0204]
将105个pdo细胞/孔接种在12孔板中,并且使其附着过夜。更换培养基,用以下物质将细胞处理3天:dmso对照或10μm端锚聚合酶抑制剂 (化合物21)(elliott等人,med chem comm.2015;6(9):1687
–
92)或10 μm蛋白质丝氨酸o
‑
棕榈油酰基转移酶抑制剂(lgk
‑
974,selleckchem)。使用tryple express收获细胞,用ch1a1a一抗和r
‑
藻红蛋白偶联的二抗对cea染色,并且如上所述通过facs进行分析。
[0205]
统计分析
[0206]
使用graphpad prism软件进行皮尔森相关性分析和配对t检验。所有p 值都是双尾的。使用gsea软件v3.0,采用5000个基因集排列和hallmarksv6.2基因集集合进行基因集富集分析(subramanian等人,proc natl acadsci u s a.2005/09/30.2005年10月25日;102(43):15545
–
50)。
[0207]
***
[0208]
尽管为了清楚理解的目的先前已通过举例说明和实施例相当详细地描述了本发明,但是这些描述和实施例不应理解为限制本发明的范围。本文引用的所有专利和科学文献的公开内容均全文以引用方式明确地并入。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。