一种基于edar基因表达量检测猪无毛性状的方法及其应用
技术领域
1.本发明涉及基因检测及育种技术领域,具体涉及一种基于edar 基因表达量检测猪无毛性状的方法及其应用。
技术背景
2.人类对遗传性脱发和稀发十分关注,毛囊形态结构和功能的稳定是毛发周期正常的关键。毛发的形成起源于胚胎期毛囊形态学的发育,但人类毛囊样本,特别是胚胎期毛囊样本的紧缺性和伦理性,制约了对胚胎期毛囊基板形态学和发育机制的深入研究。猪在医学上具有重要意义,猪与人类遗传同源性非常高,其基因组与人的基因组相似、复杂程度和染色体组成也较为一致。因此,猪作为医学研究的理想模式动物,用来研究人类医学问题。
3.无毛猪具有毛囊发育不全的特征,其躯体被毛稀疏,因此,可以以无毛猪作为研究人类毛发领域疾病的动物模型。但在无毛猪培育过程中,由于毛囊发育过程主要在胚胎期,而现有育种方法通常是采用对猪胚胎的性状进行判定从而指导种猪的配种选育,但此时猪胚胎的毛囊中毛干并未伸出皮肤表层,凭肉眼无法直接判定该猪胚胎是否为无毛猪。目前的解决方法主要是通过对猪胚胎皮肤组织脱水固定形态,再进行组织形态学观测来判定。现有方法存在猪胚胎皮肤组织难脱水固定,实验操作复杂,耗时长等缺点。因此为了筛选可作医学研究动物模型的无毛猪,需要有一种简单、方便、有效的区分正常和无毛猪性状的分子标记,以实现对无毛猪的精准鉴定。因此需要对影响猪毛囊发育的相关基因及其表达进行研究,目前尚无相关研究报道。
4.外胚层发育不全基因受体(ectodysplasin a receptor,edar) 属于肿瘤坏死因子家族的受体,edar及其配体eda可以影响毛发基板的形成和发育,调控毛囊细胞的分化过程来影响动物毛囊的生长。但尚无将edar用于检测猪的无毛性状,更没有将edar作为分子标记物用于辅助无毛猪筛选育种的报道。
技术实现要素:
5.为了解决以上问题,本发明提出一种基于edar基因表达量检测猪无毛性状的方法及其应用。
6.本发明提供了一种基于edar基因表达量检测猪无毛性状的方法,通过采集猪胚胎背部皮肤组织,通过pcr定量检测edar基因表达量, edar基因表达量低于3的判定为无毛猪。
7.进一步,所述猪胚胎为怀孕母猪妊娠天数达到41天时进行流产获得的。
8.进一步,所述pcr定量检测edar基因表达量的步骤为:
9.s1、皮肤样本mrna提取:将猪胚胎背部皮肤组织在液氮中进行研磨至粉状,称取组织样50
‑
100mg加入1ml trizol,然后进行匀浆处理,利用三氯甲烷、异丙醇、75%乙醇,无rnase水分别对组织中的蛋白质、dna及无机盐进行洗脱去除并对rna沉淀浓缩获得皮肤样本mrna;
10.s2、皮肤样本mrna纯化及反转录:利用nanodrop2000仪器对s1获得的皮肤样本mrna浓度及纯度进行检测,利用1%琼脂糖凝胶对rna完整性进行检测,利用反转录试剂盒进行rna的纯化和反转录;
11.s3、edar引物设计:
12.在ncbi数据库中获取edar基因的mrna序列信息,利用软件设计引物。
13.s4、edar基因表达量检测:
14.使用roche荧光定量试剂盒对edar进行pcr扩增,利用rochelightcycler480荧光定量仪对edar表达量进行检测;将测出的edar荧光信号ct值(循环数)转化成edar表达量,转化公式如下:
15.edar表达量=2
‑△△
ct
;
16.s5、结果判定
17.对上述edar基因表达量用graphpadprism软件进行作图,当edar基因表达量低于3的判定为无毛猪。
18.本发明提供的基于edar基因表达量检测猪无毛性状的方法可用于辅助无毛猪筛选育种。
19.本发明同时提供了一种无毛猪纯合体的培育方法,所述无毛猪纯合体为edar纯合敲除猪,其培育方法包括如下步骤:
20.步骤一:利用在线工具crisprdesigntool设计并选择针对猪edar基因的向导rnas,即sgrna,选择打靶效率最高的sgrna进行下一步的载体构建;
21.步骤二:以px330质粒为基础构建基因编辑载体,利用构建好的载体px330
‑
u6
‑
grna用于细胞转染;
22.步骤三:将构建好的载体与pcag
‑
gfp质粒共转染猪胎儿成纤维细胞,利用流式细胞分选仪筛选出转基因阳性的供核体细胞单克隆,用于下一步体细胞核移植;
23.步骤四:将筛选出来的单细胞克隆作为供核体细胞,进行体细胞核移植,获得重构胚胎,将状态良好的重构胚胎移植到同期发情的受体母猪输卵管内,移植3天左右b超诊断受体母猪妊娠状况,调整妊娠母猪的饲养管理,确保基因编辑猪的顺利出生;
24.步骤五:刚出生的基因编辑猪为f0代edar杂合子敲除猪,将f0代edar杂合子敲除猪与野生型猪进行交配,获得f1代仔猪,从中筛选出基因阳性的f1代edar杂合子敲除猪并饲养至发情,选择来自同一只f0且基因型一致的f1代edar杂合子敲除猪自交,对获得的f2代edar敲除猪进行基因型鉴定,将f2代edar敲除猪中的无毛猪纯合体进行自交,f3代即可获得稳定的无毛猪纯合体。从f0代edar杂合子敲除猪到获得f2代无毛猪纯合体需要18个月左右。
25.本发明提供的无毛猪纯合体可应用于医学和科研领域。
26.本发明的有益效果如下:
27.1、候选基因筛选精准,提供了重要的动物模型:本发明的试验群体是先期发现的少量大白无毛猪,通过对41天同窝有毛和无毛的猪胚胎皮肤毛囊进行转录组表达测序,组织和细胞水平检测,筛选出影响毛囊基板生长的候选基因edar,通过对无毛性状的分析研究,为人类遗传性脱发疾病研究提供重要借鉴和动物模型。
28.2、提供了一种无毛性状的分子标记:本发明首次报道了edar影响猪毛囊基板形
成的遗传机制,通过本发明提供的edar分子标记可对无毛猪进行选育纯化,也可对遗传性无毛症进行鉴定。
29.3、提供了可供研究使用的大白猪无毛试验群体:本发明的试验群体是先期发现的少量大白无毛猪,通过对发现的大白猪无毛个体进行了扩群,为开展毛囊发育和模型动物的研究提供了具有价值的实验材料。为人类遗传性脱发,无发等疾病研究提供重要的猪无毛品系动物模型。
30.4、集成多学科技术对猪无毛性状进行遗传解析,结果更为准确:本发明整合了多组学思想进行交叉验证分析,涉及多种学科,包括到细胞学、分子生物学、统计基因组学、生物信息学和计算机学等多个领域对猪无毛性状进行遗传解析,得到了更为准确的结果,也减少了假阳性的存在,在解析无毛性状遗传机理的同时为复杂性状的研究提供新的思路。
附图说明
31.图1为实施例1胚胎期41天有毛与无毛胚胎猪单位毛囊计数对比图;
32.图2为edar在猪胚胎不同时期皮肤组织中检测图;
33.图3为edar在猪成纤维细胞中表达检测图;
34.图4为实施例2的三步法pcr参数设置图;
35.图5为edar在有毛猪和无毛猪皮肤中表达量的检测图;
36.图6为edar纯合敲除猪培育过程示意图。
具体实施方式
37.以下结合实施例对本发明作进一步说明。
38.实施例1:筛选与无毛性状相关的基因edar
39.本发明的试验群体是先期发现的少量大白无毛猪(发现地址:河北省衡水市安平县,发现人:中国农业大学动物科技学院丁向东副研究员)
40.edar筛选的具体实施方式:
41.s1、无毛猪选配计划:选取正常公猪与无毛母猪配种,在怀孕母猪妊娠天数达到41天进行剖腹产,取出猪胚胎采集两份胚胎背部2cmx 2cm大小组织块,然后分离皮肤组织并进行消毒。其中一份放入液氮中进行rna保存,一份放入多聚甲醛中用于后期表型鉴定。
42.s2、表型鉴定:表型鉴定采用苏木精伊红(he)染色进行毛囊计数统计。以妊娠41天仔猪皮肤组织为研究对象(无毛和正常猪毛囊对比最为明显),测量单位面积毛囊数。在背部相同部位检测囊数,将单位面积内毛干数小于等于3根(平均数 标准差)的猪判定为无毛猪,多于等于6根(平均数
‑
标准差)的为正常猪。同时将背部组织进行横切,通过he染色观察,横切he用来观察单位面积毛囊数的多少,从而进行辅助无毛性状判定(图1)。
43.s3、mrna测序及候选基因筛选:皮肤毛囊相关基因表达检测采用二代高通量测序技术mrna转录组测序(交于诺禾致源生物有限公司),其中无毛及有毛仔猪皮肤组织各三份。采用病例对照家系分析对影响猪无毛性状性状进行转录组测序(mrna),筛选与目标性状显著关联,与猪胚胎期毛囊发育相关的候选基因。筛选得到edar, bmpr1b等基因与动物的毛囊发育有关,可能是大白猪无毛性状的潜在候选基因(表1)。
44.表1 猪胚胎时期毛囊基板发生、发育关键候选基因
45.[0046][0047]
go功能分析发现差异基因在细胞成分,分子功能和生物过程等方面显著富集皮肤及表皮发育,表皮细胞和表皮层相关细胞的分化等毛囊发育过程。kegg通路分析发现部分差异基因注释在wnt,bmp等通路中,存在于这些通路的重要差异基因可作为猪胚胎时期毛囊基板发生、发育关键的候选基因,如下:
[0048]
go分析注释与毛囊发育相关条目8个:组织发育:frzb,wnt9b, dsg3,krt80,dkk4,fgfr2,edar,bmp3,bmpr1b;动物器官发育: edar,bmpr1b,dkk4,bmp3;表皮发育:dsg2,edar,fgfr2,dkk4, sox21,krt80;皮肤发育:itgb4,edar,dkk4,dsg3,fgfr2;表皮细胞分化:wnt9b,frzb,dsg3,krt80;器官形态学发育:wnt3,itgb4, wnt9b,frzb,fgf1,acta2;表皮层细胞分化:dsg2,krt80,dsg3;解剖学形态发育过程:edar,itgb4,dusp2,bmpr1b;
[0049]
kegg分析注释与毛囊发育相关通路4个:wnt信号通路:fgfr2, wnt3,edar,dkk4;bmp信号通路:wnt3,fgfr2,bmpr1b,grem2, tbx18,frzb;毛囊发育:fgf1,dsc2,edar,fgfr2,dkk4,dsg1, hoxc12,foxi3;调控干细胞多能性的信号通路:fgfr2,wnt3,myf5, fgfr4,bmpr1b,wnt9b。
[0050]
s4、edar表达量在不同时期皮肤组织中检测:
[0051]
对筛选出来的edar基因进一步在组织水平和细胞水平上验证发现,edar在组织水
平上主要高表达在有毛猪的毛囊基板中,而在无毛猪中没有表达(图2a),图2a为edar在猪妊娠41天组织水平蛋白表达及部位的免疫荧光图,其中白色光点为edar在皮肤组织中的表达,虚线为表皮与真皮分界线,虚线圈为毛囊基板,可以看到edar在有毛猪毛囊基板中高表达;说明edar对毛囊基板的发育过程起到了重要的调控影响,其低表达可能会导致无毛性状的形成。
[0052]
其中,所述edar基因的序列表如seqidno:1所示。
[0053]
其次我们利用不同时期的mrna转录组测序对edar在不同时期的表达量进行检测,结果显示:edar在e41特异性高表达在皮肤组织中,而在无毛猪中edar一直都是低表达(图2b)。图2b为edar在猪不同时期(妊娠39,41,45,52,60)mrna表达检测折线图,其中黑色折线为有毛猪,灰色折线为无毛猪,可以观测到edar在妊娠41天,在有毛猪中特异性高表达,且与无毛猪表达差异极显著(***代表p值小于0.001)。此外我们利用共表达网络分析对我们的结果进一步验证,精确定位edar表达和作用的部位。
[0054]
s5、edar表达量在毛囊基板相关细胞系检测:
[0055]
在细胞水平,利用毛囊基板形成的关键细胞亚群,成纤维细胞对edar影响无毛性状的遗传机制进一步分析。结果显示:当edar基因mrna和蛋白表达量被抑制后,导致成纤维细胞增殖能力减弱,且通过定量pcr、westernblot、免疫荧光等分析手段发现,edar通过其表达量变化调控细胞增殖能力,从而影响毛囊基板的增殖聚集和形成过程(图3a,3b)。图3a为edar表达量促进及抑制后,在猪妊娠41天细胞水平的蛋白表达检测;图3b为edar表达抑制后对猪成纤维细胞增殖影响;其中白色光点为edu(一种反应细胞增殖能力的荧光染料),edu白色光点越多代表增殖能力越强,可以看到edar表达量被抑制后,导致成纤维细胞的增殖能力减弱(edu白色光点减少)。
[0056]
综上我们发现本发明所述的edar基因在毛囊形态发育过程中特异性高表达并且在有毛和无毛猪中差异显著,说明本发明所述的edar基因在毛囊形态发育过程中发挥重要功能。
[0057]
实施例2验证猪皮肤中edar基因表达量与无毛表型之间的联系(实验验证edar定量数值与无毛性状之间的关系)
[0058]
s1、无毛猪配种计划:选取正常公猪与无毛母猪配种,在怀孕母猪妊娠天数达到41天进行剖腹产,取出猪胚胎采集两份胚胎背部2cmx2cm大小组织块,然后分离皮肤组织并进行消毒。将样品放入液氮中进行rna保存。
[0059]
s2、皮肤样本mrna提取:在液氮中将组织块进行研磨至粉状,称取组织样50
‑
100mg加入1mltrizol,然后进行匀浆处理。利用氯仿(三氯甲烷)、异丙醇、75%乙醇,无rnase水(需要用depc处理水配制)分别对组织中的蛋白质,dna及无机盐进行洗脱去除并对rna沉淀浓缩。
[0060]
s3、皮肤样本mrna纯化及反转录:利用nanodrop2000仪器对mrna浓度及纯度进行检测,利用1%琼脂糖凝胶对rna完整性就行检测。利用takara公司的反转录试剂盒(货号:aa047)进行rna的纯化和反转录
[0061]
a.rna纯化:在冰上将如下成分依次加入配制反应混合液,为保证每个反应管中的反应液均一性和准确性,可按反应数 2的总量进行配制mastermix,然后再将总反应液进行平均分装至每个反应管中,最后按照试验设计加入所需的rna样品。
[0062]
10微升总rna纯化体系:
[0063][0064]
*:室温反应时,可以延长至30分钟。
[0065]
b.rna反转录:在冰上将如下成分依次加入配制反应混合液,为保证每个反应管中的反应液均一性和准确性,可按反应数 2的总量进行配制mastermix,然后再将总反应液进行平均分装至每个反应管中,每个反应管10ul,混合完成后立即进行反转录反应。
[0066]
20微升rna反转录体系:
[0067][0068]
s4、edar引物设计:
[0069]
在ncbi数据库(https://www.ncbi.nlm.nih.gov/)中获取edar基因的mrna序列信息(xm_013995872.2),利用软件primerpremier5.0软件及ncbi在线软件primer设计。扩增持家基因gapdh的引物同上方法进行设计,并交由上海生工生物工程有限公司合成。
[0070]
引物序列信息如下:
[0071][0072]
s5、edar基因表达量检测:
[0073]
使用roche荧光定量试剂盒对edar进行pcr扩增,利用rochelightcycler480荧光定量仪对edar表达量进行检测;将测出的edar荧光信号ct值(循环数)转化成edar表达量,转化公式如下:
[0074]
edar表达量=2
‑△△
ct
;
[0075]
操作步骤如下:
[0076]
20微升定量pcr反应体系:
[0077][0078]
(a)引物浓度在0.2
‑
1微摩尔范围内为宜,本反应起始浓度使用 0.5微摩尔;(b)在20μl反应体系中,使用纯化的cdna(20纳克) 作为模板
‑
如果使用不纯的模板,可酌情减少模板体积(不超过2微升),同时可通过延长预变性时间(10分钟)以降低体系中模板杂质对pcr反应的影响;(c)加样过程中要尽量降低误差,建议使用10 微升反应体系;(d)试验中设置阴性对照,即以pcr水替代模板,以排除模板污染带来的假阳性结果;(e)按照pcr反应需要量来配制混合液,混匀后离心分加到各孔中,减少加样误差;(f)上机:以封板膜封板;1500g离心pcr多孔板2分钟;将板放入480 仪器进行检测,pcr程序按图4的三步法pcr参数进行设置。
[0079]
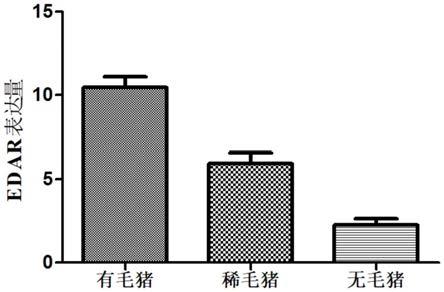
对获得的edar基因表达量用graphpad prism软件进行作图(见图5),当edar基因表达量(fpkm值)低于3的判定为无毛猪,edar 表达量高于9(fpkm值)判定为有毛猪,edar基因表达量(fpkm值) 大于3小于9的判定为稀毛猪。
[0080]
为了验证猪皮肤中edar基因表达量与无毛表型之间的联系,我们挑选edar基因高表达个体(个体1、2、3)、低表达个体(个体4、 5、6)、中表达个体(个体7、8、9)猪皮肤组织各三头进行表型鉴定(见表2)。其中3个edar基因高表达个体edar表达量均高于9,平均值为10.45,而3个低表达个体edar基因表达量均小于3,平均值为2.25。表型鉴定采用苏木精伊红(he)染色,以妊娠41天仔猪皮肤组织为研究对象,测量单位面积毛囊数。在背部相同部位检测囊数,将单位面积内毛干数小于等于3根(平均数 标准差)的猪判定为无毛猪,多于等于6根(平均数
‑
标准差)的为正常猪,edar 基因表达量(fpkm值)大于3小于9的为稀毛猪。通过对背部组织横切和he染色观察发现,edar基因高表达组中单位面积毛囊数均多于等于13根,平均值为14.33,远远高于有毛猪单位面积毛囊数大于6根的标准。同时edar基因低表达组中单位面积毛囊数均小于等于2,平均值为1.67,远远低于无毛猪单位面积毛囊数小于3根的标准。此外稀毛猪组中edar平均表达量为5.92,介于有毛猪和无毛猪 edar表达量之间(大于3,小于9),单位面积毛囊数平均值为4.67,介于有毛猪和无毛猪单位毛囊判定标准之间(大于3,小于6)。通过对表型鉴定,我们发现edar基因表达量的高低影响猪的毛囊数,从而导致无毛性状的产生。
[0081]
表2 edar基因表达量与无毛表型之间联系的鉴定试验
[0082][0083][0084]
实施例3通过基因编辑edar敲除猪培育无毛猪纯合体
[0085]
利用crispr/cas9基因敲除技术对无毛猪进行基因编辑,通过对 edar敲除验证edar对毛囊基板形成的分子机制及毛囊表型影响。并收集edar敲入猪毛囊表型数据,分析验证edar是影响毛囊基板形成并导致无毛性状产生的功能基因。
[0086]
s1、向导rna的设计:本专利中将采用麻省理工学院张峰教授开发的在线工具crispr design tool设计并选择针对猪edar基因的向导rnas。选择评分较高的4条sgrna进行效率筛选。
[0087]
s2高效向导rna筛选:利用ambion公司的mmessage、mmachine、 megascript试剂盒分别体外合成cas9 mrna以及4条sgrnas,将4 条sgrnas分别与cas9 mrna共注射mii期猪卵母细胞,孤雌激活后置于pzm3胚胎培养液中培养,对获得的单个囊胚进行靶位点基因型分析(pcr、酶切和测序),分析不同sgrnas的打靶效率和打靶模式。选择打靶效率最高的sgrna进行下一步的载体构建。
[0088]
s3、载体构建:本专利所需的基因编辑载体以px330质粒为基础构建。具体方法是:将上述步骤筛选得到的sgrna,分别合成sgrna 序列以及其反向互补链,并添加bbsi酶切接头,然后对两条序列进行磷酸化处理。接着用如下条件退火:37℃30min,95℃5min,然后以5℃/min的速度降温到25℃。稀释250倍后用于连接载体。用bbsi 酶切处理px330载体并切胶回收。用回收得到的px330载体和磷酸化并退火后的oligo建立t4dnaligase连接体系,连接产物转化大肠杆菌感受态,挑取菌落进行pcr扩增,并提取质粒,测序验证连接正确与否。构建好的载体px330
‑
u6
‑
grna可用于细胞转染。
[0089]
s4、供核体细胞的筛选:将构建好的载体与pcag
‑
gfp质粒共转染猪胎儿成纤维细胞,利用流式细胞分选仪,根据gfp荧光的强度分选转染成功的单细胞克隆至96孔板中,对单细胞克隆进行继代培养,并利用pcr、酶切和测序的方法对edar靶位点进行基因型分析,筛选出转基因阳性的单细胞克隆,用于下一步体细胞核移植
[0090]
s5、体细胞核移植,胚胎移植:选择上一步筛选出来的单细胞克隆作为供核体细胞,进行体细胞核移植获得重构胚胎,直流电脉冲诱导融合并激活,16h后将状态良好的重构胚胎移植到同期发情的受体母猪输卵管内,术后3d左右b超诊断受体母猪妊娠状况,调整妊娠母猪的饲养管理,确保基因编辑猪的顺利出生。
[0091]
s6、edar敲除猪纯合体制备:刚出生的基因编辑猪为f0代edar 杂合子敲除猪,需要进行配种获得纯和敲除猪。将f0代edar杂合子敲除猪(founder),与野生型猪(wt)进行交配,获得f1代仔猪,从中筛选出基因阳性的f1代edar杂合子敲除猪(ko/ )并饲养至发情,选择来自同一只f0且基因型一致的f1代edar杂合子敲除猪(ko/ )自交,对获得的f2代edar敲除猪进行基因型鉴定。鉴定方法为:仔猪出生后,在每只仔猪的耳缘处取下一小片组织,提取基因组dna,针对edar基因突变位点进行pcr、酶切和测序,鉴定仔猪的edar基因是否导入受体仔猪中。在确认之后,对不同时期edar基因表达量及毛囊关键基因表达量进行荧光定量pcr和western blot蛋白检测。
[0092]
理论上,f2代敲除猪中25%为纯合子(ko/ko),50%为杂合子 (ko/ ),25%为野生型( / )(图6),预期从f0代edar杂合子敲除猪到获得f2代edar纯合敲除猪(即无毛猪纯合体)需要18个月左右;将f2代edar纯合敲除猪进行自交,f3代即可获得稳定的无毛猪纯合体。所述无毛猪纯合体可用于与毛发相关的医学和科研领域。
[0093]
根据本发明的实施例,通过对待测猪进行前面所述的edar分子标记的检测,以便确定待测猪的无毛性状,由此利用本发明的edar 基因对猪进行辅助育种,能够有效的选择出能稳定遗传的无毛性状的母猪,进而能够实现短时间、低成本、高准确性的选育品种优良的疾病模型猪,其次也可以作为鉴定导致遗传性无毛症产生的分子标记,进一步还可以应用于哺乳动物的毛发发育研究。
[0094]
对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。不应将权利要求中的任何附图标记视为限制所涉及的权利要求。
[0095]
此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。