1.本发明属于分子生物学和生物技术领域,具体涉及一种草莓白粉病抗性基因及其应用。
背景技术:
2.草莓白粉病是由羽衣草单囊壳侵染所引起的,菌丝主要分布于叶片两面、叶柄、花、花梗和果实。草莓白粉病具有侵染草莓植株所用时间短,与植株建立寄生关系所需时间短,侵染植株的频率高等特点。草莓白粉病发生过程中主要影响因素有:草莓植株的生长状态和生长环境。植株生长状态不同,白粉病菌侵染效果也不同,研究表明在新叶上的侵染效率要远高于老叶。一般情况下,当环境中相对湿度达80%以上,温度在15~25℃时,草莓植株极易感染白粉病。
3.myb转录因子是植物中数量最多的一类转录因子之一,含有由51
‑
52个氨基酸为一个重复组成的高度保守的dna结合域,大多数的myb蛋白在n端含有一个myb结构域,由一段氨基酸残基组成。根据其结构域数量,将myb家族分为四大类,包括1r
‑
myb、 r2r3
‑
myb、3r
‑
myb和4r
‑
myb蛋白。
4.myb转录因子在植物的生长发育和调控中起到重要作用,它们组成了转录因子的一个大家族,其功能研究在模式植物拟南芥中进展较快,而草莓中myb转录因子家族的功能只有部分得到解析。目前研究表明,myb46主要在调节木质素合成中起作用,仅在拟南芥和小麦中发现参与调节病害(vicente et al.,2011;zheng et al.,2019),但草莓myb46编码区序列与拟南芥atmyb16的相识度为45.81%,与小麦tumyb46相识度为43.96%;草莓myb46 氨基酸序列与拟南芥atmyb16的相识度为41.03%,与小麦tumyb46相识度为40.78%(实施例1)。因此,与拟南芥、小麦myb46的编码区和氨基酸序列相比,草莓myb46与拟南芥、小麦myb46的相识度很低,很难基于拟南芥和小麦myb46的功能对草莓的功能进行预测和分析。因此,草莓myb46是否参与白粉病等病害的调控?草莓中myb46调节病害机理与上述作物是否相同仍不清楚,因此需要将草莓myb46在草莓中进行功能分析,才能对其功能进行准确判断。
5.大量的研究表明,培育和种植抗病品种是防治草莓白粉病最经济、有效和安全可靠的途径,而品种的抗病性鉴定、抗源的筛选和抗病新基因挖掘是提高草莓抗病性研究的基础。传统杂交育种耗时长、工作量大,物理、化学、生物等诱变手段很难做到精确定点突变。因此挖掘草莓抗白粉病基因,分析其抗病机理,对于培养抗白粉病草莓新品种具有重要意义。
技术实现要素:
6.本发明提供一种草莓白粉病抗性基因及其应用,所述的一种草莓白粉病抗性基因 fvmyb46编码氨基酸序列如序列1所示,所述fvmyb46基因编码区核苷酸序列如序列2所示。
7.本发明提供利用rnai沉默fvmyb46基因增强了草莓对白粉病菌的抗性。
8.本发明涉及fvmyb46基因通过负调控pals基因的表达来增强草莓对白粉病菌的抗病性。
9.本发明的技术问题可通过如下技术方案解决:
10.(1)草莓fvmyb46基因的克隆,并选取其中335bp片段进行干扰载体构建。
11.提取草莓叶片中的总rna,然后将rna反转录成cdna;
12.以cdna为模板,针对fvmyb46基因的保守区段,设计两对特定引物myb46
‑
rnai
‑
f1 和myb46
‑
rnai
‑
r1,在上游引物myb46
‑
rnai
‑
f1上引入xba1酶切位点,下游引 myb46
‑
rnai
‑
r1上引入sal1酶切位点;myb46
‑
rnai
‑
f2和myb46
‑
rnai
‑
r2,在上游引物myb46
‑
rnai
‑
f2上引入kpn1酶切位点,下游引物myb46
‑
rnai
‑
r2上引入sac1酶切位点;pcr扩增得到引入相应酶切位点的fvmyb46基因的正反向片段;
13.其中,所述的特定引物是:
14.myb46
‑
rnai
‑
f1:5
’‑
cgctctagatggtctcaaattgcagcacg
‑3’
15.myb46
‑
rnai
‑
r1:5
’‑
cgcgtcgacgttgtagtacccgccatgct
‑3’
16.myb46
‑
rnai
‑
f2:5
’‑
cgcggtaccgttgtagtacccgccatgct
‑3’
17.myb46
‑
rnai
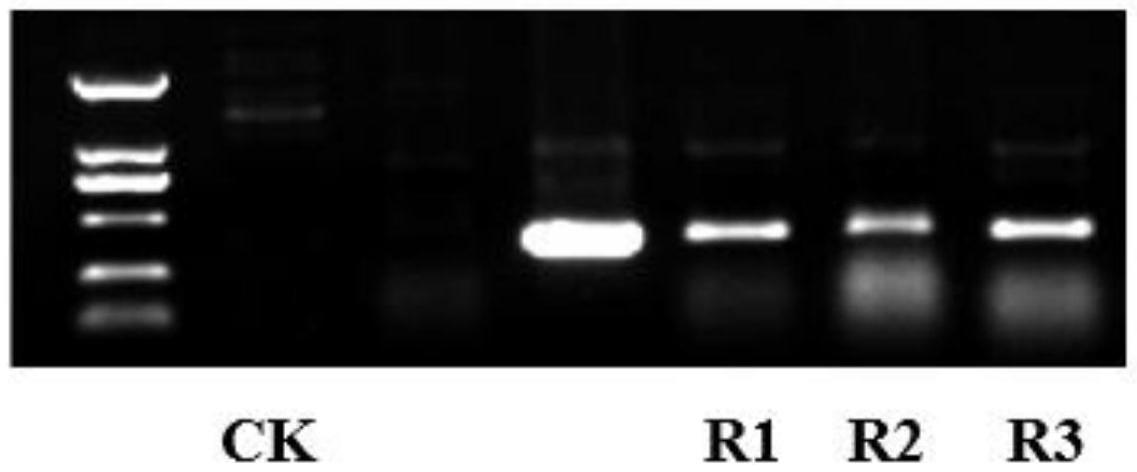
‑
r2:5
’‑
cgcgagctctggtctcaaattgcagcacg
‑3’
18.注:myb46
‑
rnai
‑
f1、myb46
‑
rnai
‑
r1、myb46
‑
rnai
‑
f2和myb46
‑
rnai
‑
r2引物序列中前九个碱基,即cgctctaga、cgcgtcgac、cgcggtacc和cgcgagctc,是保护碱基和酶切位点,是为构建载体而人为引入的碱基,不属于fvmyb46基因序列。
19.(2)rnai干扰载体构建:
20.(a)以重组质粒pmd
‑
t
‑
fvmyb46为模板,以myb46
‑
rnai
‑
f1和myb46
‑
rnai
‑
r1 为引物,将fvmyb46基因正向片段克隆到pri101
‑
rnai载体上;
21.(b)测序正确后,再以myb46
‑
rnai
‑
f2和myb46
‑
rnai
‑
r2为引物,将fvmyb46 基因反向片段克隆到成功连接正向片段的pri101
‑
rnai载体上,命名为rnai
‑
fvmyb46。
22.(3)遗传转化、转基因草莓的培育:提取构建完成的rnai干扰载体rnai
‑
fvmyb46 质粒dna,用冻融法转入农杆菌,用叶盘法遗传转化草莓,分子检测获得阳性转基因植株,上述所述的草莓为二倍体森林草莓ruegen。
23.(4)白粉病鉴定:选取沈阳农业大学草莓试验基地自然发病的草莓白粉病菌株,使用喷雾法接种,孢子悬浮液浓度为1
×
106个/ml,分别接种对照以及rnai
‑
fvmyb46转基因草莓叶片,采用台盼蓝染色的方法鉴定叶片受损情况,发现fvmyb46基因负调控草莓白粉病的抗性。
24.(5)fvmyb46蛋白对fvpals基因的调控:通过酵母单杂实验和萤火虫荧光素酶实验发现,fvmyb46负调控pals基因的表达来增强草莓对白粉病的抗病性。
25.本发明的有益效果:
26.1.本发明通过功能分析揭示降低草莓fvmyb46的表达能显著提高草莓对白粉病菌的抗性,为将来通过基因编辑创制抗白粉病草莓新种质奠定了基础。
27.2.本发明首次发现fvmyb46通过负调控pals基因的调控白粉病抗性。
附图说明
28.图1为fvmyb46基因编码区序列的扩增结果。
29.图2为转基因植株pcr鉴定电泳图;
30.其中,m:dl2000 marker;转基因植株及对照植株标注如图所示。
31.图3rnai
‑
fvmyb46转基因植株中fvmyb46基因相对表达量
32.图4为rnai干扰fvmyb46转基因植株表型。
33.图5fvmyb46干扰草莓植株白粉病菌的接种及台盼蓝染色观察。
34.图6草莓fvpals成员fvpal1.1和fvpal1.2基因表达分析。
35.图7酵母单杂交分析fvmyb46对fvpal1.1的调控。
36.图8萤火虫荧光报告试验分析fvmyb46对fvpal1.1和fvpal1.2的调控。
具体实施方式
37.为了进一步阐明本发明而不是限制本发明,以下结合实施例加以说明。下述实施例中所述实验方法,如无特殊说明,均为常规方法。所述试剂盒生物材料如无特殊说明均可从商业途径获得。
38.实施例1:草莓fvmyb46基因的克隆及与拟南芥、小麦myb46序列的比较分析
39.(1)草莓fvmyb46基因的克隆
40.以二倍体森林草莓
‘
ruegen’为试材,材料在温室大棚中生长。
41.rna提取:用ctab法进行试验材料的总rna提取,整个操作过程按照ctab法rna 提取流程,然后再以该总rna为模板反转录得到cdna第一链。
42.基因的克隆:以反转录的果实cdna第一链为模板,利用引物fvmyb46
‑
f和 fvmyb46
‑
r进行pcr扩增,回收pcr产物,获得1008bp的目的片段如图1所示。
43.fvmyb46
‑
f:gctctagaatgaggaagccggaacccta;
44.fvmyb46
‑
r:cgggatcctcaactctggtagtcaagtaaag。
45.胶回收目的片段之后,将其连接到pmd18
‑
t载体(购自takara公司),后转化大肠杆菌感受态细胞top10(购自北京天根生物技术有限公司),筛选阳性单菌落,提取质粒,测序序列2所示。
46.(2)草莓fvmyb46基因与拟南芥、小麦myb46序列比较分析
47.草莓myb46编码区序列与拟南芥atmyb16的相识度为45.81%,与小麦tumyb46相识度为43.96%;草莓myb46氨基酸序列与拟南芥atmyb16的相识度为41.03%,与小麦 tumyb46相识度为40.78%。
48.实施例2:rnai干扰fvmyb46转化森林草莓及其基因功能鉴定
49.1.植物干扰表达载体rnai
‑
fvmyb46的构建。
50.(1)利用primer primer 5.0软件分析设计引物并扩增fvmyb46正反片段
51.myb46
‑
rnai
‑
f1:5
’‑
cgctctagatggtctcaaattgcagcacg
‑3’
52.myb46
‑
rnai
‑
r1:5
’‑
cgcgtcgacgttgtagtacccgccatgct
‑3’
53.myb46
‑
rnai
‑
f2:5
’‑
cgcggtaccgttgtagtacccgccatgct
‑3’
54.myb46
‑
rnai
‑
r2:5
’‑
cgcgagctctggtctcaaattgcagcacg
‑3’
55.(2)以pmd
‑
t
‑
fvmyb46为模板,进行pcr反应;
56.pcr反应体系为:取1μl pmd
‑
t
‑
fvmyb46质粒加入ex taq酶0.2μl,10
×
ex buffer 2μl, dntps(2.5mmol
·
l
‑
1)1.6μl,正反向引物各0.5μl,最后用水补足到20μl;
57.pcr反应程序:95 5min;95℃30s,58℃30s,72℃90s,35个循环;72℃延伸7min,4℃保存;产物进行琼脂糖凝胶电泳;
58.(3)使用核酸纯化试剂盒(takara公司)进行回收。
59.(4)回收后,使用xbaⅰ和salⅰ限制性内切酶将回收的pcr产物与pri101
‑
rnai载体上分别酶切,酶切后再次进行纯化回收,之后再载体进行连接。
60.pcr反应体系为:取7μl回收的pcr产物,1μl t
4 dna连接酶,10
×
t
4 dna连接酶buffer 1μl,t4载体1μl;
61.pcr反应程序:16℃连接16h;
62.(5)进行大肠杆菌转化,在含amp(60μg
·
ml
‑1)的lb培养基平板上,37℃培养12
‑
16h。挑取单个白色克隆,分别涂布于新的含有amp(60μg
·
ml
‑1)的lb培养基平板上(二转),37℃培养12
‑
16h,之后进行菌落pcr扩增。将验证正确的菌株培养后,送苏州金唯智公司测序,测序正确,命名为rnai
‑
fvmyb46
‑
正。
63.(6)以myb46
‑
rnai
‑
f2和myb46
‑
rnai
‑
r2为引物,以pmd
‑
t
‑
fvmyb46为模板,进行pcr反应,使用kpnⅰ和sacⅰ限制性内切酶将回收的pcr产物与rnai
‑
fvmyb46
‑ꢀ
正载体分别酶切,酶切后再次进行纯化回收,之后经载体连接,载体连接完成后,进行大肠杆菌转化、菌落pcr验证、重组质粒提取,提取之后标注好名称,交由生工生物有限公司进行检验,使用dnaman软件进行分析,分析结果正确后即获得rnai
‑
fvmyb46重组载体。
64.2.rnai干扰fvmyb46转化森林草莓及其基因功能鉴定
65.(1)农杆菌的转化
66.将rnai
‑
fvmyb46质粒导入农杆菌gv3101中,具体操作步骤如下:
67.(a)从超低温冰箱中取出两管gv3101农杆菌感受态,放置在冰上,静置3min,打开水浴锅,将温度设置为37℃,吸取rnai
‑
fvmyb46质粒10μl加入农杆菌感受态中,冰上静置10min。
68.(b)静置完成后,放入液氮中,快速冷冻1min。
69.(c)冷冻结束后,将其快速放入37℃水浴锅中,热激5min。
70.(d)热激完成后,转移到冰上静置2min。在超净工作台中,向离心管中加入900μl yep 液体培养基(配方见附录),用封口膜将离心管管口密封,放置在28℃恒温震荡培养箱中,震荡培养5h,培养箱设置为180rpm/min。
71.(e)震荡培养结束后,离心5min收集菌体,离心机设置转速为5000rpm/min。
72.(f)在超净工作台中,保留100μl上清液,将菌体悬浮起来,混合均匀后涂到yep固体培养基(配方见附录)上,倒置于28℃恒温培养箱培养中培养2
‑
3d。待其长出饱满单菌落,对其进行pcr验证。
73.(2)农杆菌介导草莓遗传转化
74.(a)侵染菌液的制备
75.取灭菌的150ml三角瓶,加入50ml yep液体培养基、400μl利福平(25mg/l)和25μl 卡那霉素(100mg/l),瓶身标注名称,加入验证正确的菌体,放置在28℃恒温震荡培养箱内,充分震荡培养8
‑
12h,直到菌液颜色变成橙色,并且浑浊无杂质。留下2ml菌液,重新加入50ml yep液体培养基,继续放在28℃恒温震荡培养箱培养5h左右,使用分光光度计测量其od600在0.5左右,此时可以收集菌体,将菌体转移到50ml离心管中,设置离心机转速为
5500rpm/min,然后离心5min,在超级工作台中倒掉上清液,用灭菌后的 ms悬浮液重新悬浮菌体,使用分光光度计测定其od600在0.4
‑
0.6之间,此时将悬浮液放置在一旁备用。
76.(b)侵染外植体
77.剪取颜色绿,状态良好的二倍体
‘
ruegen’组培草莓苗叶片,修剪为2
‑
4mm的小方块,修剪好的外植体迅速放入液体共培养中,避免萎蔫,叶片全部修剪完毕后,将液体共培养倒掉,把叶片转移到灭菌的100ml小三角瓶中,在配制好的悬浮液中加入乙酰丁香酮,上下颠倒混匀后倒入小三角瓶中(此过程要迅速),浸泡外植体8min,每2min摇晃震荡一次,使菌液充分接触外植体伤口。浸泡完成后,倒掉菌液,用镊子将叶片转移到滤纸上,吸干菌液,将叶片叶背朝上,均匀放置在固体共培养基(添加滤纸)上。
78.(c)外植体的培养
79.固体共培养:放置在黑暗条件下,温度设置为22
‑
25℃,培养3d。
80.推迟培养:固体共培养培养3d后,更换到推迟培养基上,反转叶片使其叶背朝下,均匀的铺在推迟培养基上,放置在黑暗条件下,温度22
‑
25℃,培养4d。
81.选择培养:推迟培养基培养4d后,换到选择培养基上,叶背朝下,均匀的铺在选择培养基上,放置在黑暗条件下,温度22
‑
25℃,直到观察到外植体长出饱满黄绿色愈伤之后,将有愈伤的外植体转移到光下,温度22
‑
25℃,促进外植体抽生不定芽。
82.分化培养:当选择培养基中不定芽长成小植株后,标注好株系名称,将小植株转移到分化培养基中进行分化培养,使其数量快速增多。
83.(3)pcr鉴定及基因功能初步鉴定:
84.(a)待抗性苗长至7
‑
8片叶,提取草莓转基因植株幼嫩叶片dna(ctab法),以清水和
‘
ruegen’草莓植株作为阴性对照,rnai
‑
fvmyb46质粒作为阳性对照,经pcr扩增和琼脂糖凝胶电泳检验,结果如图2所示,转基因植株出现了315bp片段,而对照植株没有,说明草莓fvmyb46沉默载体成功导入草莓中。
85.(b)待抗性苗长至7
‑
8片叶,提取草莓转基因植株幼嫩叶片rna,进行rt
‑
pcr检测目的基因是否转入
86.上游引物:5'
‑
gccggaaccctatgctgtaa
‑
3',
87.下游引物:5'
‑
gatccaacgaagcctgcaac
‑
3',
88.结果如图3所示,从图3可见,转基因植株出现了350bp片段,而对照植株没有,说明草莓fvmyb46沉默载体成功导入草莓中。
89.(4)对转基因草莓表型观察
90.通过观察发现,转基因植株与对照植株相比,植株茎颜色相比于对照更红(图5),但花、叶片大小和株高均无明显变化(图4)。
91.实施例3:fvmyb46干扰草莓植株白粉病菌的接种及台盼蓝染色观察
92.选取沈阳农业大学草莓试验基地自然发病的草莓白粉病叶片,去除表面杂质,用小号毛刷将白粉病孢子刷入干净的无菌水中,使用血球计数板计算孢子悬浮液浓度为1
×
106个/ml,使用手持型喷雾器将孢子悬浮液均匀喷洒在对照以及rnai
‑
fvmyb46三个株系的转基因草莓叶片上,保证叶片表面布满孢子悬浮液,接种后至于人工气候培养箱中,保持夜晚温度 18摄氏度,白天温度25摄氏度左右,相对湿度85%。10d后观察植株状况如下图5所示。相比于对照rnai
‑
fvmyb46三个株系的转基因草莓叶片上白粉病菌孢子不明显,之后采
用台盼蓝染色的方法观察对照以及rnai
‑
fvmyb46三个株系的转基因草莓叶片受损情况,发现相比于对照rnai
‑
fvmyb46三个株系的转基因草莓叶片蓝色较浅,说明叶片受损伤没有对照严重,以上结果表明fvmyb46基因负调控草莓白粉病的抗性。
93.实施例4:fvmyb46蛋白对fvpals基因的调控分析
94.1.草莓fvpals成员fvpal1.1和fvpal1.2基因表达分析
95.为了验证fvmyb46对fvpal1.1和fvpal1.2的调控作用,通过实时荧光定量pcr对 fvpal1.1及fvpal1.2基因在对照植株以及干扰转基因植株中的表达量进行测定。相比于对照,fvpal1.1和fvpal1.2基因在干扰转基因植株中,相对表达量均升高(图6)。在接种白粉病菌之后,fvpal1.1和fvpal1.2基因的表达量相比于对照都升高(图6)。以上实验说明, fvmyb46负调控fvpal1.1和fvpal1.2的表达,并且fvpal1.1和fvpal1.2受白粉病诱导。
96.2.酵母单杂交分析fvmyb46对fvpal1.1的调控
97.为了验证fvmyb46是否能够结合到fvpal1.1的启动子上,进行了酵母单杂交试验。先将pabai
‑
profvpal1.1导入酵母细胞中,在sd/
‑
ura培养基上培养,筛选出aba浓度 150ug/l。之后将pgad424
‑
fvmyb46载体导入pabai
‑
pro pal1.1载体构建的酵母感受态中,完成两次酵母转化的酵母菌在150ug/l aba的sd/
‑
leu培养基上能够生长。发现在加有aba的sd/
‑
leu培养基上,作为阴性对照的pgad424空载不能生长,而导入 pgad424
‑
fvmyb46的酵母细胞可以正常生长(图7),结果表明fvmyb46本身能够结合到fvpal1.1的启动子上,从而增强植株对白粉病的抗性。
98.3.萤火虫荧光报告试验分析fvmyb46对fvpal1.1和fvpal1.2的调控
99.fvmyb46可以结合到fvpal1.1的启动子上,为了进一步验证,fvmyb46与pals的调控关系,利用烟草的瞬时表达技术进一步分析fvmyb46对pals基因表达的影响。将 pri101
‑
an
‑
fvmyb46作为本试验中的效应子。同时将pgreenii0800
‑
luc
‑
profvpal1.1和pgreenii0800
‑
luc
‑
profvpal1.2,作为本试验中的报告子,结果表明: pgreenii0800
‑
luc pri101空载体组合作为阴性对照荧光信号弱,fvmyb46转录因子与 profvpal1.1启动子参与的组合荧光较弱,没有fvmyb46转录因子参与的组合荧光较强(图 8)。说明fvmyb46转录因子负调控fvpal1.1基因的表达。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。