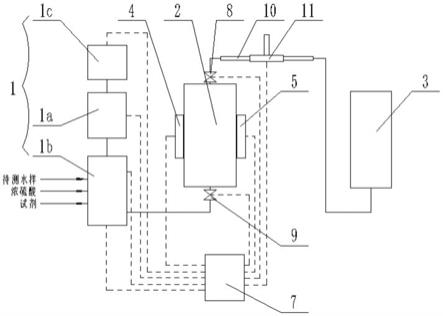
1.本发明涉及一种鉴别农田土壤曲霉菌群体产黄曲霉毒素能力的方法。
背景技术:
2.黄曲霉毒素是毒性最强的一类真菌毒素,极易污染花生、玉米、大米等农产品,从而威胁食品安全与产业健康发展。黄曲霉毒素主要由黄曲霉等曲霉属真菌产生,是由农产品在收获时从田间携带的产毒真菌,在储藏、运输等环节条件适宜时产生。黄曲霉等产毒真菌也被认为是土传病原物。因此,及时鉴别农田土壤中曲霉菌群体产黄曲霉毒素的能力,对从源头防控黄曲霉毒素污染具有重要意义。
3.然而,如何鉴别农田土壤曲霉菌群体产黄曲霉毒素的能力?这一直是本领域世界性难题。
4.综合国内外近二十年研究进展,已有黄曲霉菌株产毒力鉴定方法的报道,但是该方法仅能鉴别单个菌株的产毒力,如果要鉴别土壤中黄曲霉毒素产毒菌群体的产毒力,一方面需要把土壤中所有产毒菌株分离鉴定出来,另一方面还要研究清楚每一菌株在土壤中的丰度,这样做显然费时、费工,而且由于培养基条件与土壤条件迥然不同,结果也很难代表真实情况。
5.针对上述难题,发明人团队经过十多年攻关研究,构建了我国黄曲霉毒素产毒菌株库、菌株产毒力数据库、强产毒菌株蛋白质抗体库,建立了发掘黄曲霉毒素产毒菌产毒力标识性分子的方法,并进一步利用该方法,发明了一种鉴别农田土壤曲霉菌群体产黄曲霉毒素能力的方法。
技术实现要素:
6.本发明针对现有技术存在的不足,提供一种鉴别农田土壤曲霉菌群体产黄曲霉毒素能力的方法及其应用。其用于高效鉴别农田土壤曲霉菌群体产黄曲霉毒素能力,在农业生产中实用、且容易推广应用。
7.为解决上述技术问题,本发明所采用的技术方案为:
8.一种鉴别农田土壤曲霉菌群体产黄曲霉毒素能力的方法,包括以下步骤:
9.步骤a:利用黄曲霉强产毒力菌株采用下述方法获得黄曲霉菌株产毒力指示分子,黄曲霉毒素产毒菌产毒力指示分子的测定浓度与黄曲霉菌株产毒力成正相关,所述的获得方法为:取黄曲霉强产毒力菌株,培养获得菌株培养物和胞外分泌蛋白质混合物;然后将菌株培养物细胞破碎,获得胞内蛋白质混合物;将上述胞外分泌蛋白质混合物和胞内蛋白质混合物合并,加入碳二亚胺偶联获得黄曲霉抗原;
10.将上述黄曲霉抗原免疫试验动物,获得纳米抗体库或单克隆抗体库;
11.获得不同产毒力的黄曲霉菌株的蛋白质合并溶液,利用上述步骤获得的抗体库中的抗体,检测不同产毒力的黄曲霉菌株的蛋白质,获得系列检测信号;
12.找出检测信号与上述黄曲霉菌株产毒力呈现正相关的纳米抗体,即黄曲霉菌株产
毒力指示分子抗体,与黄曲霉菌株产毒力指示分子抗体对应的蛋白质即发掘出的黄曲霉菌株产毒力指示分子。
13.步骤b:待鉴别农田土壤样品培养,稀释,获得待鉴别农田土壤样品的待测液;
14.具体可为:称量待鉴别农田土壤样品,转移至无菌水中,室温震荡至均匀,制成待测样品均匀分散液,取10
‑
1000μl样品分散液加在含6
‑
600ml常规沙氏液体培养基中,置于 15
‑
35℃下200
±
50rpm震荡培养,培养6
‑
24h后取样,形成待鉴别农田土壤样品的待测液。
15.步骤c:采用间接非竞争双抗体夹心法鉴别别农田土壤曲霉菌群体产黄曲霉毒素能力,步骤包括:
16.(1)待鉴别农田土壤样品的待测液加入到孔底包被有黄曲霉毒素产毒菌产毒力指示分子的纳米抗体或单克隆抗体的酶标板孔中,反应,洗板;
17.(2)加入黄曲霉毒素产毒菌产毒力指示分子的多克隆抗体反应,洗板;
18.(3)加入与黄曲霉毒素产毒菌产毒力指示分子aft
‑
yjfz01的多克隆抗体发生结合反应的辣根过氧化物酶标记抗体,反应,洗板;
19.(4)加入显色液、终止液,酶标仪读取结果;基于结果鉴别农田土壤曲霉菌群体产黄曲霉毒素能力。
20.具体地,所述的黄曲霉毒素产毒菌产毒力指示分子的多克隆抗体可为黄曲霉毒素产毒菌产毒力指示分子兔源多克隆抗体,所述的辣根过氧化物酶标记抗体为辣根过氧化物酶标记羊抗兔抗体。
21.步骤为:
22.将步骤a得到的黄曲霉毒素产毒菌产毒力指示分子的纳米抗体或单克隆抗体溶解在常规的elisa包被缓冲液中,形成0.2
‑
8.0μg/ml的包被液,加入至酶标板中(以200μl/ 孔),4℃放置过夜或者37℃放置不少于2h后,去除上述酶标板中包被液,再用elisa 常规洗液洗涤酶标板;然后,以浓度不低于1%的脱脂奶粉作为封闭液,每孔加300μl,放置室温或37℃封闭不少于1h后,再弃去封闭液,再用elisa常规洗液洗涤酶标板;
23.然后以ph接近中性的常规磷酸盐缓冲液将上述待测液体适当稀释,加入到酶标板孔中 (每孔加入200μl),放置室温或37℃封闭不少于1h后,弃去液体,再用elisa常规洗液洗涤酶标板;
24.然后,以ph接近中性的常规磷酸盐缓冲液将黄曲霉毒素产毒菌产毒力指示分子兔源抗体适当稀释,加入到酶标板孔中(每孔加入200μl),放置室温或37℃封闭不少于1h 后,弃去液体,再用elisa常规洗液洗涤酶标板;
25.然后,以ph接近中性的常规磷酸盐缓冲液将商业化的辣根过氧化物酶标记羊抗兔抗体稀释,加入到酶标板孔中(每孔加入200μl),放置室温或37℃封闭不少于1h后,弃去液体,再用elisa常规洗液洗涤酶标板;
26.然后,先后加入elisa常规的显色液、终止液,最后通过酶标仪读取结果,;基于结果鉴别农田土壤曲霉菌群体产黄曲霉毒素能力。
27.进一步地,基于步骤a获得的黄曲霉菌株产毒力指示分子,配制系列浓度梯度的黄曲霉菌株产毒力指示分子的溶液,替换步骤c的(2)中的待鉴别农田土壤样品液,制作标准曲线,结合酶标仪结果,来评价鉴别农田土壤曲霉菌群体产黄曲霉毒素能力,评估黄曲霉毒素田间污染风险,即通过测定花生等农作物根际土壤曲霉菌群体产黄曲霉毒素能力,如果
测定发现土壤曲霉菌群体产黄曲霉毒素能力较强,则说明黄曲霉毒素污染风险较大,应及时采取风控措施,以减轻污染风险。上述方案中,步骤(c)中上述产毒力指示分子的纳米抗体或单克隆抗体通过如下方案获得:利用产毒力指示分子作为免疫抗原,免疫羊驼或者balb/c 鼠,再利用已知常规的纳米抗体或鼠源单克隆抗体制备技术方案即可研制获得。
28.上述产毒力指示分子兔源抗体通过如下方案获得:利用产毒力指示分子作为免疫抗原,免疫新西兰大白兔等试验兔,再利用已知常规的兔多克隆抗体制备技术方案即可研制获得。
29.按上述方案,步骤(c)中所述的基于结果鉴别农田土壤曲霉菌群体产黄曲霉毒素能力包括:(1)用于评价黄曲霉毒素污染防控剂在田间的应用效果:通过测定应用防控剂的处理和未应用防控剂的对照处理之间土壤曲霉菌群体产黄曲霉毒素能力,比较二者差异,分析防控剂的防控效果,;应用防控剂处理的土壤曲霉菌群体产黄曲霉毒素能力比未应用防控剂对照处理的土壤曲霉菌群体产黄曲霉毒素能力越弱,则说明黄曲霉毒素污染防控剂在田间的应用效果越好,和分析不同用量防控剂的防控效果,分析防控剂的防控用量;;
30.或(2)用于评估农田土壤曲霉菌群体的相对产素力,即通过比较多个农田土壤样品的鉴别结果,横向比较农田土壤曲霉菌群体的相对产素力。
31.产毒力指示分子含量越高,则土壤曲霉菌群体产黄曲霉毒素能力越强,则说明产后花生等农作物受黄曲霉毒素污染风险越高;反之,上述结果中,产毒力指示分子含量越低,则土壤曲霉菌群体。
32.按上述方案,步骤(a)中所述的黄曲霉强产毒力菌株是通过常规方法从自然界分离、鉴定获得,其产毒力经ny/t 2311—2013标准方法鉴定结果不小于10μg/kg。
33.按上述方案,步骤(a)中所述的黄曲霉强产毒力菌株培养中采用的培养基为察氏培养基或者其他可供黄曲霉正常生长的营养物,培养时间不少于12h,培养的环境温度为15~ 35℃。
34.按上述方案,步骤(a)中所述的菌株培养物细胞破碎是通过常规液氮研磨或者细胞破碎仪等方法。
35.按上述方案,步骤(a)中所述的适量碳二亚胺是指每1.0ml合并的胞外分泌蛋白质混合物和胞内蛋白质混合物中,加入碳二亚胺量为0.005~0.1g。
36.按上述方案,步骤(a)中所述的偶联反应指在15~37℃反应2~6h,在4~10℃反应过夜。
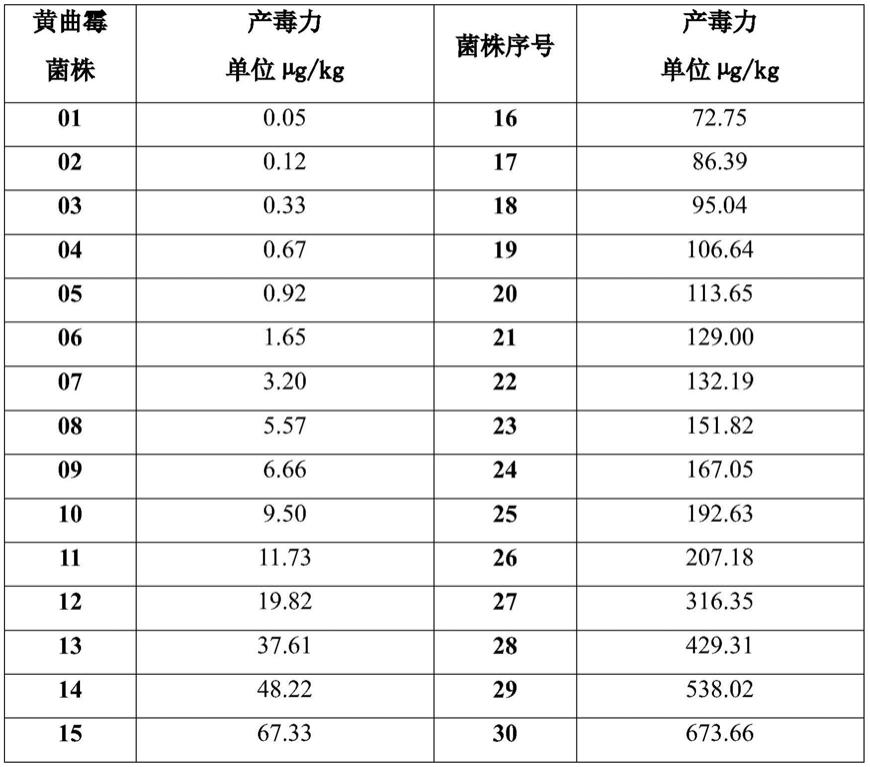
37.按上述方案,步骤(a)中所述的检测不同产毒力的黄曲霉菌株的蛋白质是指采用常规的western blot技术流程,即将不同产毒力的黄曲霉菌株的蛋白质移至硝酸纤维素膜上,再利用上述抗体库中抗体,经直接方法或者间接方法检测,或者采用具有类似功效的其他技术流程。
38.按上述方案,所述的不同产毒力的黄曲霉菌株是通过常规方法从自然界分离、鉴定获得,或者通过人工改造获得,不少于3株,其产毒力经ny/t 2311—2013标准方法鉴定结果呈现为高、中、低至少3个层次。
39.按上述方案,上述直接方法是指将上述抗体库中抗体通过常规方法与信号材料偶联,再与上述移至硝酸纤维素膜上的相应蛋白质发生免疫结合反应。
40.按上述方案,上述间接方法是指将上述抗体库中抗体先与上述移至硝酸纤维素膜
上的相应蛋白质发生免疫结合反应,然后再利用第二抗体与信号材料偶联物与上述结合到硝酸纤维素膜上的抗体发生免疫结合反应。
41.按上述方案,所述的信号材料是辣根过氧化物酶或者是胶体金或者是荧光材料或者是具有类似功效的其他材料。
42.按上述方案,所述的检测信号是显色反应信号或者是斑点信号或者是荧光信号。
43.按上述方案,步骤a中:以产毒黄曲霉菌株的细胞裂解液为原料,获得与黄曲霉菌株产毒力指示分子抗体对应的蛋白质即黄曲霉菌株产毒力指示分子,具体可通过蛋白质电泳法或者免疫亲和纯化法获得黄曲霉菌株产毒力指示分子。
44.具体地,可通过已知常规的载体材料对目标蛋白质对应的黄曲霉菌株产毒力指示分子抗体进行固定化,再利用免疫亲和法,通过目标蛋白质对应的抗体的特异性捕获作用,富集纯化出产毒力指示分子。
45.所述的免疫亲和法是将黄曲霉菌株产毒力指示分子抗体,经常规方法固定到载体材料上,利用其与相应黄曲霉菌株产毒力指示分子特异性免疫反应原理,经常规的上样、淋洗、洗脱流程,从黄曲霉产毒菌株培养物中捕获黄曲霉菌株产毒力指示分子。载体材料可为凝胶或者氨基硅胶微球或者是羧基化磁珠或者是具有类似功效的其他载体材料。
46.黄曲霉菌株产毒力是衡量菌株产生黄曲霉毒素能力的指标,菌株产毒力越强,表明该菌株在相同时间和培养条件下能够产生黄曲霉毒素的量越多。本发明利用黄曲霉强产毒力菌株经有效方法获得黄曲霉菌株产毒力指示分子,基于依此获得的黄曲霉毒素产毒菌的产毒力指示分子,利用黄曲霉毒素产毒菌产毒力指示分子的测定浓度与黄曲霉菌株产毒力成正相关的特征,结合黄曲霉菌株产毒力指示分子的纳米抗体或单克隆抗体以及产毒力指示分子兔源抗体组建的elisa方法为检测手段,以土壤样品为对象,通过检测土壤样品,来评价鉴别农田土壤曲霉菌群体产黄曲霉毒素能力,检测出土壤样品中产毒力指示分子的含量越高,则说明该土壤曲霉菌群体产黄曲霉毒素能力越强。
47.本发明有益效果在于:
48.1.可用于评价黄曲霉毒素污染防控剂田间使用效果,2.可用于评价田间黄曲霉毒素污染风险,3可用于有效鉴别土壤曲霉菌群体产黄曲霉毒素能力,4.易操作,实用性强,容易推广应用。
具体实施方式
49.实施例1自然界黄曲霉菌株分离、鉴定与产毒力鉴定
50.从福建、广东、江西、江苏、安徽、湖北、四川、山东、河南、河北、辽宁等花生产地取得花生样品及其相应土壤样品,将这些样品磨碎后,各称取10.0g,分别加入到90ml灭菌水中,用涡旋震荡器充分混匀5min,获得土壤和花生待分离黄曲霉菌株的样品稀释液。
51.从海南和湖北分别取得霉变的可可豆和霉变的鸡蛋壳样品,将这些样品称取不超过1.0 g,分别加入到9ml灭菌水中,用涡旋震荡器充分混匀5min,获得可可豆和鸡蛋壳待分离黄曲霉菌株的样品稀释液。
52.各取上述系列的样品稀释液50μl,分别加在dg
‑
18培养基平板上,用涂布棒涂布均匀,再放置在恒温培养箱中28
±
1℃黑暗培养5d,然后从其中挑取长有黄绿色孢子的菌落,再接种到曲霉素琼脂培养基,即afpa培养基平板上,28
±
1℃纯化培养3
‑
5天,直至长出单菌
落。
53.将上述长出单菌落的afpa培养基背面呈亮橘红色的菌株初步鉴定为黄曲霉菌或寄生曲霉菌。然后从afpa培养基上挑取少许上述橘红色的菌丝块到dg
‑
18培养基上,28
±
1℃黑暗培养5
‑
7天,直至得到黄绿色孢子,再经常规提取其dna,最后经常规分子生物学鉴定方法确认黄曲霉菌株。
54.采用ny/t 2311—2013标准方法对上述确认的黄曲霉菌株进行产毒力鉴定,其中部分鉴定结果见如下表1。
55.表1从花生、土壤、可可豆、鸡蛋壳等自然界分离获得的黄曲霉菌株产毒力鉴定结果
[0056][0057]
实施例2黄曲霉抗原制备
[0058]
如下将以随机选取的黄曲霉菌株11和22制备黄曲霉抗原11
‑
22为例,描述混合菌株制备黄曲霉抗原的过程;以随机选取的黄曲霉菌株29制备黄曲霉抗原29为例,描述单个菌株制备黄曲霉抗原的过程。
[0059]
1、黄曲霉抗原11
‑
22的制备
[0060]
按照如下配方配置察氏培养基:3%(w/v)蔗糖,0.3%(w/v)nano3,0.1%(w/v) k2hpo4,0.05%(w/v)mgso4·
7h2o,0.05%(w/v)kcl,0.001%(w/v)feso4,ph6.5。此察氏培养基中加入琼脂,至琼脂最终质量体积浓度为2%,配置获得察氏琼脂培养基。从黄曲霉菌株库中随机选取3株,即上述表1中黄曲霉菌株11和22,分别独立接种在上述察氏琼脂培养基
上,28℃培养10天左右,待长满黄绿色孢子时,用生理盐水冲洗并分别收集黄曲霉菌株11、22和29的孢子,分别重悬于含3.7%福尔马林的0.01mol/l ph 7.4常规 pbs溶液中,于4℃放置24h,再于4℃4000rpm/min离心10min,去除上清,用生理盐水洗涤6次以去除福尔马林,最后用0.01mol/l ph 7.4常规pbs溶液重悬孢子,并用血球计数板于显微镜下计数备用,从而分别获得了黄曲霉菌株11和22的孢子液。
[0061]
取上述等量的黄曲霉菌株11和22的孢子,混合后加至10ml上述察氏培养基中,使孢子终浓度为5
×
105个/ml,于28℃200rpm/min培养5天后,将培养液用灭菌滤纸过滤,收集混合菌丝,获得黄曲霉菌株11和22的混合培养物;收集胞外分泌液,获得胞外分泌蛋白质混合物。
[0062]
将上述黄曲霉菌株11和22的混合菌丝经灭菌水洗涤3次后,重悬于含3.7%福尔马林的0.01mol/l ph 7.4常规pbs缓冲液中,4℃过夜。随后,用液氮研磨上述混合菌丝,称重混合菌丝粉末,然后转移至约3ml的0.01mol/l ph 7.4常规pbs中,再在高压均质机 ats1500以100bar均质,再用1000bar均质4次,以充分裂解黄曲霉细胞,制得黄曲霉菌株11和22的混合细胞裂解液,从而获得黄曲霉菌株11和22的胞内蛋白质混合物。
[0063]
再然后将上述胞外分泌蛋白质混合物和胞内蛋白质混合物合并,每1.0ml合并的胞外分泌蛋白质混合物和胞内蛋白质混合物中,加入碳二亚胺量为0.005g,室温搅拌孵育1 h,再于4℃孵育过夜,最终制备得到黄曲霉抗原11
‑
22,分装后,于
‑
20℃冷冻保存备用。
[0064]
2、黄曲霉抗原29的制备
[0065]
取上述黄曲霉菌株29的孢子,加至10ml上述察氏培养基中,使孢子终浓度为5
×
105个/ml,于28℃200rpm/min培养5天后,将培养液用灭菌滤纸过滤,收集菌丝,获得黄曲霉菌株29的混合培养物;收集胞外分泌液,获得胞外分泌蛋白质混合物。
[0066]
将上述黄曲霉菌株29的菌丝经灭菌水洗涤3次后,重悬于含3.7%福尔马林的0.01 mol/l ph 7.4常规pbs缓冲液中,4℃过夜。随后,用液氮研磨上述菌丝,称重菌丝粉末,然后转移至约3ml的0.01mol/l ph 7.4常规pbs中,再在高压均质机ats1500以100bar 均质,再用1000bar均质4次,以充分裂解黄曲霉细胞,制得黄曲霉菌株29的细胞裂解液,从而获得黄曲霉菌株29的胞内蛋白质混合物。
[0067]
再然后将上述胞外分泌蛋白质混合物和胞内蛋白质混合物合并,每1.0ml合并的胞外分泌蛋白质混合物和胞内蛋白质混合物中,加入碳二亚胺量为0.1g,室温搅拌孵育1h,再于4℃孵育过夜,最终制备得到黄曲霉抗原29,分装后,于
‑
20℃冷冻保存备用。
[0068]
实施例3黄曲霉抗体库制备:
[0069]
如下将以黄曲霉抗原11
‑
22免疫羊驼为例,描述黄曲霉纳米抗体库构建过程,以黄曲霉抗原29免疫balb/c为例,描述黄曲霉单克隆抗体库构建过程
[0070]
1、黄曲霉纳米抗体库的构建
[0071]
将上述黄曲霉抗原11
‑
22和弗氏完全佐剂等体积混合乳化,通过背部皮下或皮内多点注射方式免疫羊驼,之后每隔2
‑
4周加强免疫1次,加强免疫时用弗氏不完全佐剂替换弗氏完全佐剂。采用常规elisa流程监测免疫效果,至羊驼血清效价不再上升后,随后对免疫羊驼的静脉取血、提取总rna、合成cdna、vhh基因的扩增、vhh基因片段的回收、 vhh基因与双酶切处理的pcantab 5e(his)载体的连接、连接产物电转化、构建纳米抗体基因库以及纳米抗体基因库的拯救等操作按照专利文献cn103866401a的方法完成,最终获得拯救后的
纳米抗体基因库。
[0072]
将上述黄曲霉抗原11
‑
22按8μg/孔、2μg/孔、0.5μg/孔、0.1μg/孔的梯度固定在 96孔酶标板等固相载体上,按照专利文献cn103866401a的方法对上述拯救后的纳米抗体基因库进行2
‑
4次淘选,再用黄曲霉抗原11
‑
22和间接非竞争elisa鉴定每一噬菌体克隆产生的抗体,阳性结果对应的噬菌体为噬菌体阳性克隆,获得的所有噬菌体阳性克隆即构成了黄曲霉纳米抗体库。
[0073]
2、黄曲霉单克隆抗体库的构建
[0074]
将上述黄曲霉抗原29和弗氏完全佐剂等体积混合乳化,通过背部皮下或皮内多点注射方式balb/c鼠,之后每隔2
‑
4周加强免疫1次,加强免疫时用弗氏不完全佐剂替换弗氏完全佐剂。采用常规elisa流程监测免疫效果,至balb/c鼠血清效价不再上升后,随后分离免疫小鼠脾细胞、脾细胞与鼠源骨髓瘤细胞sp2/0融合、半固体培养基对杂交瘤细胞的选择性培养操作参考专利文献cn103849604a的方法完成,待半固体培养基上长出针尖白色斑点后,将白色斑点分别挑取到内置杂交瘤常规培养基的96孔培养板,从而获得单克隆杂交瘤资源库。
[0075]
参考专利文献cn103849604a的方法获取上述单克隆杂交瘤培养上清即单克隆抗体,将上述黄曲霉抗原29按8μg/孔、2μg/孔、0.5μg/孔、0.1μg/孔的梯度固定在96孔酶标板等固相载体上,再用间接非竞争elisa程序鉴定每一单克隆抗体,从中获得的所有阳性单克隆抗体即构成了黄曲霉单克隆抗体库。
[0076]
实施例4利用纳米抗体库发掘黄曲霉菌株产毒力指示分子
[0077]
根据黄曲霉菌株产毒力由弱到强,从上述表1中选择了黄曲霉菌株04、13、19、26、 30为几株代表性菌株,作为被检测菌株,按照上述黄曲霉抗原制备方法,依次制备得到黄曲霉菌株04、13、19、26、30的蛋白质合并溶液。
[0078]
将上述5株黄曲霉菌的蛋白质合并溶液均调为0.8mg/ml,依次加入到96孔酶标板,每孔100μl,另在同一酶标板上包被1%ova和3%bsa作为对照,4℃包被过夜。
[0079]
将上述包被液去除,用常规pbst洗涤3次后,加入5%(w/v)脱脂奶粉封闭液300 μl,于37℃封闭2h。
[0080]
去除上述封闭液,用常规pbst洗涤3次后,每孔加入200nmol/l上述黄曲霉纳米抗体库中的系列纳米抗体溶液100μl,37℃温浴反应1h。
[0081]
去除上述纳米抗体反应液,用常规pbst洗涤3次后,每孔加入100μl商品化的鼠抗 ha标签抗体(1:5000),37℃温浴反应1h。所述ha标签是指氨基酸序列为 ypydvpdya的小肽。
[0082]
去除上述鼠抗ha标签抗体反应液,用常规pbst洗涤3次后,每孔加入100μl辣根过氧化物酶标记羊抗鼠igg抗体(1:10000),37℃温浴反应1h。
[0083]
去除上述辣根过氧化物酶标记羊抗鼠igg抗体反应液,用常规pbst洗涤6次后,加入100μl常规tmb显色液,37℃反应15min,酶标仪测定od
450 nm
值,即获得系列纳米抗体与5株黄曲霉菌的蛋白质合并溶液免疫反应后的检测信号。
[0084]
上述检测信号数据中,从众多黄曲霉纳米抗体中至少发现其中≥1个纳米抗体的检测信号与上述5株被检测黄曲霉菌株产毒力呈现正相关,将其中2个这样的纳米抗体分别命名为 nbpo08、nbpo59,nbpo08识别的黄曲霉蛋白质命名为yjpo08,nbpo59识别的黄曲霉蛋白质命名为yjpo59,此yjpo08和yjpo59即为发掘出的黄曲霉菌株产毒力指示分子。
[0085]
采用western blot等方法可以得到同样的效果。
[0086]
实施例5黄曲霉菌株产毒力指示分子的捕获与鉴定
[0087]
以上述抗体nbpo08捕获产毒力指示分子yjpo08为例进行描述。
[0088]
按照专利文献cn103869065a的方法流程,利用上述抗体nbpo08替代文献中抗体,依次制备获得黄曲霉菌株产毒力指示分子yjpo08的免疫亲和柱。
[0089]
利用强产毒力的黄曲霉菌株制备蛋白质合并溶液,以上述表1中黄曲霉菌株30为例,将上述黄曲霉菌株30的细胞裂解液经灭菌纱布过滤后,将滤液依次上样超过50ml到上述免疫亲和柱,用足量常规pbs淋洗后,再用3个1ml ph 2.2的甘氨酸缓冲液洗脱,同一亲和柱的3次洗脱液合并后调节ph接近7.0,超滤离心方法去除水和各种离子,最后再用纯水或常规pbs溶液复溶留存在超滤离心管内的蛋白质,即可分别获得免疫亲和纯化后的黄曲霉菌株产毒力指示分子yjpo08。
[0090]
通过常规的蛋白质质谱方法鉴定上述纯化后黄曲霉菌株产毒力指示分子,结果表明黄曲霉菌株产毒力指示分子yjpo08中至少含有qqvsgk肽段。
[0091]
实施例6产毒力指示分子纳米抗体和单克隆抗体的制备
[0092]
以产毒力指示分子yjpo08为例描述,其纳米抗体可以直接采用实施例4中筛选获得nbpo08,也可以产毒力指示分子yjpo08作为免疫抗原和淘选抗原,采用实施例3中的技术方案重新制备。
[0093]
以下yjpo08为例,描述产毒力指示分子单克隆抗体的制备。
[0094]
将上述获得的yjpo08直接用作抗原,以浓度不低于0.1mg/ml的溶液与弗氏完全佐剂等体积混合乳化,通过背部皮下或皮内多点注射方式balb/c鼠,之后每隔2
‑
4周加强免疫 1次,加强免疫时用弗氏不完全佐剂替换弗氏完全佐剂。采用常规elisa流程监测免疫效果,至balb/c鼠血清效价不再上升后,随后分离免疫小鼠脾细胞、脾细胞与鼠源骨髓瘤细胞sp2/0融合、半固体培养基对杂交瘤细胞的选择性培养操作按照专利文献cn103849604a 的方法完成,待半固体培养基上长出针尖白色斑点后,将白色斑点分别挑取到内置杂交瘤常规培养基的96孔培养板,从而获得单克隆杂交瘤资源库。
[0095]
参考专利文献cn103849604a的方法获取上述单克隆杂交瘤培养上清即单克隆抗体,将上述yjpo08按8μg/孔、2μg/孔、0.5μg/孔、0.1μg/孔的梯度固定在96孔酶标板等固相载体上,再用间接非竞争elisa程序鉴定每一单克隆抗体,从中获得的阳性单克隆抗体,即为产毒力指示分子yjpo08的单克隆抗体。
[0096]
实施例7产毒力指示分子兔源抗体的制备
[0097]
以下yjpo08为例,描述产毒力指示分子兔源抗体的制备。
[0098]
将上述获得的yjpo08直接用作抗原,以浓度不低于0.1mg/ml的溶液与弗氏完全佐剂等体积混合乳化,通过背部皮下或皮内多点注射方式新西兰大白兔,之后每隔2
‑
4周加强免疫1次,加强免疫时用弗氏不完全佐剂替换弗氏完全佐剂。采用常规elisa流程监测免疫效果,至免疫动物血清效价不再上升后,通过常规方法制备获得免疫动物的血清,即为产毒力指示分子yjpo08的兔源抗体。
[0099]
实施例8土壤曲霉菌群体产黄曲霉毒素能力的鉴别方法
[0100]
以yjpo08为例,描述农田土壤曲霉菌群体产黄曲霉毒素能力的鉴别方法。
[0101]
第一步,待测土壤样品制备。称量待测土壤样品10.0g,转移至90ml无菌水中,室温
震荡至均匀,制成土壤样品稀释液。取50μl土壤稀释液加在含30ml沙氏液体培养基中,置于28℃下200rpm震荡培养,培养24h后取样,形成待测液体。
[0102]
第二步,检测并计算土壤样品中产毒力指示分子yjpo08的含量。将产毒力指示分子的纳米抗体或单克隆抗体溶解在常规的elisa包被缓冲液中,形成0.2
‑
8.0μg/ml的包被液,再以200μl/孔加入至96孔酶标板中,4℃放置过夜或者37℃放置2h后,去除上述酶标板中包被液,再用elisa常规洗液洗涤酶标板;然后,以浓度5%的脱脂奶粉作为封闭液,每孔加300μl,放置室温或37℃封闭不少于1h后,再弃去封闭液,再用elisa常规洗液洗涤酶标板;然后以ph接近中性的常规磷酸盐缓冲液将上述待测液体适当稀释,再每孔加入200μl,或者每孔加入200μl系列浓度的产毒力指示分子溶液,放置室温或 37℃封闭不少于1h后,弃去液体,再用elisa常规洗液洗涤酶标板;然后,以ph接近中性的常规磷酸盐缓冲液将产毒力指示分子兔源抗体适当稀释,再每孔加入200μl,放置室温或37℃封闭不少于1h后,弃去液体,再用elisa常规洗液洗涤酶标板;然后,以 ph接近中性的常规磷酸盐缓冲液将商业化的辣根过氧化物酶标记羊抗兔抗体按说明稀释,再每孔加入200μl,放置室温或37℃封闭不少于1h后,弃去液体,再用elisa常规洗液洗涤酶标板;然后,先后加入elisa常规的显色液、终止液,最后通过酶标仪读取并计算土壤产毒力指示分子含量结果。研究结果表明,该方法定量检测yjpo08的灵敏度达0.3 ng/ml,添加回收率超过82%,板内变异系数<4%,板间的变异系数为<6%,操作简便,结果准确可靠。
[0103]
第三步,农田土壤曲霉菌群体产黄曲霉毒素能力的鉴别。应用上述定量检测产毒力指示分子含量的技术方案,如果土壤中产毒力指示分子含量越高,则说明土壤曲霉菌群体产黄曲霉毒素能力较强;反之,如果土壤中产毒力指示分子含量越低,则说明土壤曲霉菌群体产黄曲霉毒素能力较弱。
[0104]
实施例9、用于鉴别农田土壤曲霉菌群体产黄曲霉毒素能力
[0105]
以下针期的花生农田土壤为例,从江西、河南、辽宁等花生产区各取得3份花生土壤样品,采用本发明技术方案鉴别后发现,三地花生土壤中曲霉菌群体产黄曲霉毒素能力呈现显著差异,由强到弱次序为:江西、河南、辽宁。
[0106]
实施例10、用于评价黄曲霉毒素污染防控剂田间使用效果
[0107]
以花生黄曲霉毒素田间防控试验为例,采用了河北金土生物生产的花生黄曲霉毒素微生物防控制剂,设置了3种使用剂量的处理以及未使用该防控制剂的对照处理。所述3种使用剂量依次为每亩使用4kg、1kg、0.5kg,使用方式为花生播种时跟随常规基肥一起播到地里。在花生收获前,采集各处理的花生根际土壤,再采用本发明技术方案,通过测定土壤中产毒力指示分子含量鉴别土壤中曲霉菌群体产黄曲霉毒素的能力,评价试验结果表明,施4 kg/亩处理的产毒力与对照相比下降了93%,表明防控效果非常理想;施1kg/亩处理的产毒力与对照相比下降了57%,表明仍有显著防控效果,但效果次于施4kg/亩处理;施0.5kg/ 亩处理的产毒力与对照相比下降了17%,表明防控效果已经很差。由此证明,本发明技术方案可以用于高效评价黄曲霉毒素污染防控剂田间使用效果。
[0108]
实施例11、用于评价田间黄曲霉毒素污染风险
[0109]
以实施例9下针期花生农田土壤测定结果为例:从江西、河南、辽宁等花生产区各取得 3份花生土壤样品,采用本发明技术方案鉴别后发现,三地花生土壤中曲霉菌群体产黄曲霉毒素能力呈现显著差异,由强到弱次序为:江西、河南、辽宁,这一结果表明:江西供
测定的农田土壤中花生受黄曲霉毒素污染风险最高,应在生产后期加以高度关注并及时采取针对性防控措施,而辽宁的供测定的农田土壤中花生受黄曲霉毒素污染风险最低。由此证明,本发明技术方案可以用于高效评价田间黄曲霉毒素污染风险。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。