一种猪伪狂犬ge基因缺失灭活疫苗及其生产方法
技术领域
1.本发明属于生物医药中疫苗的制备技术领域,具体涉及一种猪伪狂犬ge基因缺失灭活疫苗及其规模化生产方法,尤其涉及一种安全性高、免疫效果好且保存期长的猪伪狂犬ge基因缺失灭活疫苗及其规模化生产方法。
背景技术:
2.伪狂犬病是由伪狂犬病毒(pseudorabies virus,prv)引起的多种家畜和野生动物的急性传染病。prv属疱疹病毒科、疱疹病毒亚科,水痘病毒属,具有神经嗜性但对温度、ph值均有较强抵抗力,但对消毒剂较为敏感。prv可感染除人和无尾猿以外的哺乳动物,猪是该病的主要宿主和传染来源,对猪可呈爆发性流行,引起妊娠母猪流产、死胎,公猪不育,新生仔猪的大量死亡,育肥猪呼吸困难、增长停滞等,是危害全球养猪业的重大传染病之一。
3.目前,疫苗免疫是控制猪场prv疫情的主要手段,其中由于猪prv基因缺失(尤其是ge基因缺失)灭活疫苗具有安全、免疫效果好、且能够对目前流行的猪伪狂犬病提供保护,并可用相应的elisa试剂盒区别免疫猪和野毒感染猪等优点,而被广泛生产和应用。例如专利文献cn107267466a(以下称文献1)公开一种大规模生产猪伪狂犬病灭活疫苗的方法,其利用ge基因缺失的猪伪狂犬病毒变异株xf
‑
1株(ge基因缺失株,cn106497890a),并通过以下步骤规模化制备得到猪伪狂犬ge基因缺失灭活疫苗:(1)猪伪狂犬病病毒xf
‑
1株的制备;(2)猪伪狂犬病病毒的纯化;和(3)将高纯度的猪伪狂犬病毒灭活,经检验合格后,再与疫苗佐剂乳化,并且该文献1证明了其制备的猪伪狂犬ge基因缺失灭活疫苗对仔猪具有良好的免疫保护效果。然而该文献1制备的猪伪狂犬ge基因缺失灭活疫苗的免疫保护效果仍有不足,具体表现在:1)在一次免疫(有效病毒含量为10
7.0
tcid
50
/头份(2ml))后14天和35天检测的平均中和抗体水平(分别为1:9.6和1:45.2)较低;2)在一次免疫(有效病毒含量为10
7.0
tcid
50
/头份(2ml))后35天的攻毒实验中虽然免疫组的实验猪未出现死亡情况,但仍有2/5的实验猪出现发热(>41℃)、精神沉郁、咳嗽、呼吸困难等临床表现。另外该文献1生产过程中使用具有毒性的甲醛作为灭活剂,且采用先浓缩纯化后灭活的生产顺序,其生产的疫苗存在潜在的安全风险。
4.童武等人利用猪伪狂犬js
‑
2012株的ge和gi双基因缺失的毒株(js
‑
2012
‑△
gi/ge)作为疫苗毒株(猪伪狂犬病基因缺失灭活疫苗(js
‑
2012
‑△
gi/ge株)的制备及免疫效力评价,中国动物传染病学报,2016,24(6):12
‑
18,以下称文献2)也制备一种猪伪狂犬基因缺失灭活疫苗,并证明该灭活疫苗能够有效抵抗伪狂犬病毒变异株(js
‑
2012株)及经典伪狂犬病毒强毒株(sc株)的攻击。然而该文献2制备的猪伪狂犬基因缺失灭活疫苗的免疫保护效果和安全性方面均有不足,具体表现在:1)疫苗接种后会出现个别仔猪短暂性厌食;2)在一次免疫(2ml/头份)的攻毒试验中,有2头猪d3天开始发病,表现精神沉郁、厌食和身体持续性颤栗,其余3头猪有发热(>41℃),保护率仅为60%;2)在二次免疫(每次2ml/头份)的攻毒试验中,虽然保护率为100%,但是实验猪出现发热(超过40.5℃持续4天)。
5.因此,依然很有必要开发免疫效果更好的猪伪狂犬基因缺失灭活疫苗,对于有效控制伪狂犬疫情及伪狂犬净化具有重要意义。
技术实现要素:
6.针对现有技术中存在的一个或多个问题,本发明一个方面提供安全性高、免疫效果好、保存期长的猪伪狂犬ge基因缺失灭活疫苗及其规模化生产方法。具体技术方案如下所示。
7.本发明的一个方面提供一种猪伪狂犬ge基因缺失灭活疫苗的生产方法,其包括向悬浮培养的bhk
‑
21细胞中接种猪伪狂犬毒株js
‑
2012株的ge基因缺失毒株js
‑
2012δge种毒获得病毒液,和对获得的病毒液进行澄清、先灭活后浓缩纯化以及乳化配苗处理生产获得猪伪狂犬ge基因缺失灭活疫苗;其中所述灭活处理中采用bei作为灭活剂。
8.上述生产方法中,所述灭活处理的具体操作为:向经澄清的病毒液中加入bei,使bei的终浓度为0.002~0.004mol/l,待温度升至30~35℃时开始计时,灭活24~35小时,期间每隔60~120分钟搅拌一次,计时结束后,使用终浓度为2%~4%的硫代硫酸钠阻断灭活。
9.上述生产方法中,所述js
‑
2012δge种毒的获得方式为:在bhk
‑
21悬浮细胞中连续悬浮培养毒株js
‑
2012δge至传代12代次以上获得;其中所述培养的条件为:在36.5℃
±
0.5℃,ph值6.5~7.5,搅拌转速80rpm~150rpm,溶解氧浓度30%~60%下培养至细胞活率小于50%或培养48~60小时。
10.上述生产方法中,所述悬浮培养的bhk
‑
21细胞的密度为1.8~3.0
×
106个/ml。
11.上述生产方法中,所述获得病毒液的具体操作为:按体积百分比为0.5%~1%向悬浮培养的bhk
‑
21细胞中接种js
‑
2012δge种毒,在36.5℃
±
0.5℃,ph值6.5~7.5,搅拌转速80rpm~150rpm,溶解氧浓度30%~60%下悬浮培养,待细胞活率小于50%时或培养48~60小时收获病毒液。
12.上述生产方法中,对病毒液进行澄清、先灭活后浓缩纯化以及乳化配苗处理的具体操作为:
13.澄清:将获得的病毒液用已灭菌澄清过滤器(0.45μm)预处理病毒液或用连续流离心机离心,获得病毒澄清液;
14.灭活:向病毒澄清液中加入bei作为灭活剂,使bei的终浓度为0.002~0.004mol/l,待温度升至30~35℃时开始计时,灭活24~35小时,期间每隔60~120分钟搅拌一次,计时结束后,使用终浓度为2%~4%的硫代硫酸钠阻断灭活,获得灭活病毒液;
15.浓缩纯化:用450kd~550kd的中空纤维柱或膜包系统将灭活病毒液进行5~10倍浓缩,再用等体积pbs进行洗滤,取浓缩并洗滤后的病毒液,加入体积浓度为9%~13%的peg6000后于3~5℃振荡2~6h后静置过夜,经高速冷冻离心(4℃,6000~10000r/min离心20~40min)后,弃掉离心上清,将沉淀用pbs(ph为7.2~7.4,浓度为0.04mol/l)按浓缩后体积重悬,获得配苗用病毒抗原液;
16.乳化配苗:将配苗用病毒抗原液作为水相,加入油相中进行混合乳化操作,分装获得猪伪狂犬ge基因缺失灭活疫苗。
17.上述生产方法中,在乳化配苗步骤中,所述油相为isa201佐剂,所述油相和水相按
照质量比为1:1或者按照体积比为54:46的比例配比。
18.本发明另一方面提供一种猪伪狂犬ge基因缺失灭活疫苗,其由上述的生产方法获得,配苗用病毒抗原液中病毒含量为10
7.0
tcid
50
/0.1ml以上,所述猪伪狂犬ge基因缺失灭活疫苗在2~8℃条件下的保存期为18个月以上。
19.上述猪伪狂犬ge基因缺失灭活疫苗使用的疫苗株为毒株js
‑
2012δge,制苗中使用的灭活剂为bei。
20.基于以上技术方案提供的猪伪狂犬ge基因缺失灭活疫苗的生产方法首先采用悬浮培养工艺获得病毒接种用细胞以大规模生产病毒液,随后对病毒液进行澄清、灭活、浓缩纯化和乳化配苗等操作生产得到安全、免疫效力高、且保存期长的猪伪狂犬ge基因缺失灭活疫苗。采用悬浮培养工艺悬浮培养bhk
‑
21细胞可以快速得到大量的悬浮细胞用于猪伪狂犬ge基因缺失病毒种毒接种以生产病毒抗原。对病毒液进行灭活处理中选择使用bei作为灭活剂,相对于在灭活疫苗制备中常规使用的甲醛和β
‑
丙内酯灭活剂,bei更可以有效对猪伪狂犬ge基因缺失株js
‑
2012δge的病毒液灭活,为后续配制的疫苗的安全性提供保证,减少或避免免疫后副反应。利用中空纤维柱或膜包系统和peg协同对病毒液进行浓缩纯化后,可以去除病毒液中绝大部分杂蛋白(去除率达到98%以上),并且获得的病毒抗原液仍保持较高的病毒抗原含量,可达到10
7.5
tcid
50
/0.1ml以上,满足生产高滴度的猪伪狂犬ge基因缺失灭活疫苗的要求。另一方面,对病毒液先进行灭活处理后进行浓缩纯化处理的操作顺序可以在浓缩纯化步骤中尽可能除尽病毒液灭活时使用的灭活剂以及产生的沉淀,相对于先浓缩纯化后灭活的工艺顺序提高了生产效率。经实施例证明,本发明采用猪伪狂犬ge基因缺失株js
‑
2012δge作为种毒生产病毒液,随后经病毒液澄清、先灭活后浓缩纯化以及乳化配苗处理生产的猪伪狂犬ge基因缺失灭活疫苗具有免疫效果好(一次免疫(2ml/头份)后14天、21天和28天检测的平均中和抗体水平分别约为1:40、1:64和1:96)、安全性高(疫苗接种后不会出现猪伪狂犬临床症状)和保存期长(在2~8℃条件下的保存期为18个月以上,远远长于市场上已有的猪伪狂犬ge基因缺失灭活疫苗的有效期(2~8℃保存12个月))的特点,可以用于预防猪伪狂犬病的大规模蔓延。
附图说明
21.图1为bhk
‑
21悬浮细胞培养的正常细胞的照片(a)和经猪伪狂犬ge基因缺失病毒感染后的bhk
‑
21细胞的照片(b);
22.图2为不同灭活温度(30℃和35℃)和不同灭活剂浓度(0.002mol/l、0.003mol/l和0.004mol/l的bei)条件下对猪伪狂犬ge基因缺失病毒液的灭活动力曲线,其中a
‑
f幅分别表示30℃下bei浓度0.002mol/l、30℃下bei浓度0.003mol/l、30℃下bei浓度0.004mol/l、35℃下bei浓度0.002mol/l、35℃下bei浓度0.003mol/l、35℃下bei浓度0.004mol/l条件下的灭活动力曲线;
23.图3为中空纤维浓缩的病毒液的sds
‑
page蛋白电泳胶图;
24.图4为peg6000纯化的病毒液的sds
‑
page蛋白电泳胶图;
25.图5为peg6000纯化后的病毒液的透射电镜照片;
26.图6为仔猪经一次免疫猪伪狂犬ge基因缺失灭活疫苗后血清prv中和抗体水平和抗体合格率随时间的变化情况,其中柱状图表示抗体合格率,曲线表示血清prv中和抗体水
平;
27.图7为仔猪经两次免疫猪伪狂犬ge基因缺失灭活疫苗后血清prv中和抗体水平和抗体合格率随时间的变化情况,其中柱状图表示抗体合格率,曲线表示血清prv中和抗体水平。
具体实施方式
28.针对现有技术中规模化生产的猪伪狂犬基因缺失灭活疫苗的免疫保护效果和安全性仍有不足的缺陷,本发明旨在提供一种安全性和免疫保护效果更好的且能够规模化生产的猪伪狂犬ge基因缺失灭活疫苗。在本发明提供的猪伪狂犬ge基因缺失灭活疫苗的规模化生产方法中,主要利用生物反应器大规模悬浮培养bhk
‑
21细胞,并接种猪伪狂犬ge基因缺失病毒种毒js
‑
2012δge,通过设置接种和培养参数使猪伪狂犬ge基因缺失病毒大量繁殖,从而获得高滴度的猪伪狂犬ge基因缺失病毒液,病毒液经澄清、采用二乙烯亚胺(bei)进行灭活、中空纤维柱或膜包系统和peg协同浓缩纯化和乳化配苗等操作得到猪伪狂犬ge基因缺失灭活疫苗。本发明提供的方法通过对抗原灭活和纯化浓缩等工艺条件进行优化设计,不仅能够实现规模化稳定生产猪伪狂犬ge基因缺失灭活疫苗的目的,更重要的是可以获得一种更加安全且免疫保护效果更好(一次免疫(2ml/头份)后14天、21天和28天检测的平均中和抗体水平分别约为1:40、1:64和1:96)的猪伪狂犬ge基因缺失灭活疫苗,其免疫仔猪后诱导的平均中和抗体效价水平明显高于上述文献1公开的猪伪狂犬ge基因缺失灭活疫苗免疫后诱导的水平。在免疫攻毒实验中不会引起实验猪出现>40.5℃的发热、精神沉郁、咳嗽、呼吸困难等临床猪伪狂犬病症状,其免疫攻毒保护效果明显优于上述文献2制备的猪伪狂犬基因缺失灭活疫苗。并且疫苗的免疫保护效果也优于市售同类产品,且相对于市场上已有的猪伪狂犬ge基因缺失灭活疫苗,还具有较长的保存期(2~8℃条件下的保存期为18个月以上)。
29.以下结合具体实施例,对本发明进一步阐述。应当理解的是,具体实施例仅用于进一步说明本发明,而不是用于限制本发明的内容。
30.下述实施例中所用方法如无特别说明均为常规方法。具体步骤可参见:《分子克隆实验指南》(《molecular cloning:a laboratory manual》sambrook,j.,russell,david w.,molecular cloning:a laboratory manual,3rd edition,2001,ny,cold spring harbor)。
31.实施例中描述到的各种生物材料的取得途径仅是提供一种实验获取的途径以达到具体公开的目的,不应成为对本发明生物材料来源的限制。事实上,所用到的生物材料的来源是广泛的,任何不违反法律和道德伦理能够获取的生物材料都可以按照实施例中的提示替换使用。
32.实施例中涉及的序列均用已有技术合成。
33.实施例1:规模化生产制备猪伪狂犬ge基因缺失病毒的病毒液
34.该实施例选用猪伪狂犬野毒js
‑
2012株(上述文献2),并按照该文献2公开的方法构建该野毒株的仅缺失ge基因的基因缺失疫苗株,命名为js
‑
2012δge株,然后制备该ge基因缺失疫苗株js
‑
2012δge株的生产用种毒,并将该种毒接种于由生物反应器大规模悬浮培养的bhk
‑
21细胞中规模化生产制备猪伪狂犬ge基因缺失病毒的病毒液,具体包括以下步
骤。
35.1.1)js
‑
2012δge株生产用种毒的制备
36.从液氮中取出一支冻存的bhk
‑
21悬浮细胞株(保存于金宇保灵生物药品有限公司),36℃~37℃快速融化,1000rpm离心5分钟,弃上清液,加入含0.5%~2%(v/v)新生牛血清的bhk
‑
21培养基,控制细胞培养温度36℃~37℃,ph 6.5~7.5,搅拌转速80rpm~150rpm,溶解氧浓度30%~60%悬浮培养,如图1中a幅所示,示出了正常悬浮培养的bhk
‑
21细胞的照片。当bhk
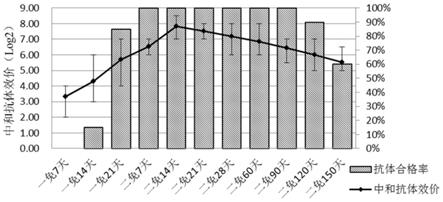
‑
21悬浮细胞数达到1.8~3.0
×
106个/ml时,将ge基因缺失疫苗株js
‑
2012δge株毒种按维持液(配方为:含1%新生牛血清的b21
‑
jy培养基,下同)0.5%~1%(v/v)接种悬浮bhk
‑
21细胞,设定培养参数(ph 6.5~7.5,搅拌转速80rpm~150rpm,溶解氧浓度30%~60%)在36.5℃
±
0.5℃下悬浮培养,如图1中b幅所示,示出了接种ge基因缺失疫苗株js
‑
2012δge株毒种的bhk
‑
21细胞的培养照片。显微镜下观察,细胞活率小于50%时或培养48~60小时收获病毒液,取样检测tcid
50
。按照上述方法连续传代培养19代,对每代次收获的病毒液进行检测的tcid
50
值如下表1所示,其中只示出了f5
‑
f19代次病毒液的tcid
50
检测结果。
37.病毒含量(tcid
50
测定):
38.将js
‑
2012δge株毒种用维持液作10倍系列稀释,取10
‑5、10
‑6、10
‑7、10
‑
8 4个稀释度,每个稀释度分别接种96孔细胞培养板,每孔100μl,每个稀释度接种4孔,然后每孔补加100μl细胞液,同时设正常细胞对照4孔,每孔100μl细胞液,再补加100μl维持液,置36.5℃
±
0.5℃、含5%co2的培养箱中培养72~120小时,显微镜下观察细胞病变,记录各稀释度细胞病变孔数,按照reed
‑
muench法计算tcid
50
。每0.1ml毒液病毒含量应不低于10
7.00
tcid
50
。
39.表1:js
‑
2012δge株经bhk
‑
21悬浮细胞悬浮培养的各代次病毒液tcid
50
情况
[0040][0041]
由上表1可知,本发明构建的ge基因缺失疫苗株js
‑
2012δge株在悬浮培养的bhk
‑
21细胞中可以稳定大量增殖,并与传统猪伪狂犬ge基因缺失疫苗株接种bhk
‑
21贴壁细胞所培养的病毒生长特性以及病毒含量能达到相当水平,因此本发明构建的ge基因缺失疫苗株js
‑
2012δge株对bhk
‑
21悬浮细胞具有良好的敏感性,通过对连续传代19代的病毒液的tcid
50
的检测结果表明,从f12开始收获的病毒液病毒含量稳定,并且均能达到10
7.00
tcid
50
/0.1ml以上的病毒含量,因此以下实施例选择确定ge基因缺失疫苗株js
‑
2012δge株在悬浮培养的bhk
‑
21细胞中连续传代12代次以后的病毒液作为生产用种毒,当利用bhk
‑
21悬浮细胞培养该种毒48~60小时或细胞活力为50%左右(优选小于50%)时收获病毒液,病毒液中病毒含量可达10
7.00
tcid
50
/0.1ml以上。
[0042]
1.2)bhk
‑
21悬浮细胞的生物反应器大规模培养
[0043]
将50l细胞密度为1.8~3.0
×
106个/ml的bhk
‑
21细胞悬液,接种于500l生物反应器中,补加含0.5%~2%(v/v)新生牛血清的bhk
‑
21培养基450l,控制细胞培养温度36℃~37℃,ph 6.5~7.5,搅拌转速80rpm~150rpm,溶解氧浓度30%~60%,反应器参数设定四路气体,分别为洁净空气、氧气、氮气和co2,根据培养时间、细胞密度和ph值,设定不同气体参数范围。细胞培养48h后取样计数,当细胞密度为1.8~3.0
×
106个/ml时用于病毒培养或转入500l反应器中扩大培养,否则继续培养至所需细胞密度(细胞密度为1.8~3.0
×
106个/ml)。
[0044]
将500l细胞密度为1.8~3.0
×
106个/ml的bhk
‑
21细胞悬液,接种于5000l生物反应器中,补加含0.5%~2%(v/v)新生牛血清的bhk
‑
21培养基4500l,控制细胞培养温度36℃~37℃,ph 6.5~7.5,搅拌转速80rpm~150rpm,溶解氧浓度30%~60%,反应器参数设
定四路气体,分别为洁净空气、氧气、氮气和co2,根据培养时间、细胞密度和ph值,设定不同气体参数范围。细胞培养48h后取样计数,当细胞密度为1.8~3.0
×
106个/ml时用于病毒培养,否则继续培养至所需细胞密度(细胞密度为1.8~3.0
×
106个/ml)。
[0045]
1.3)规模化生产制备猪伪狂犬ge基因缺失病毒的病毒液
[0046]
当上述步骤1.2)生物反应器大规模培养的bhk
‑
21悬浮细胞数达到1.8~3.0
×
106个/ml时,将步骤1.1)制备的ge基因缺失疫苗株js
‑
2012δge株的生产用种毒按维持液0.5%~1%(v/v)接种悬浮bhk
‑
21细胞,设定培养参数(ph 6.5~7.5,搅拌转速80rpm~150rpm,溶解氧浓度30%~60%)在36.5℃
±
0.5℃下悬浮培养,显微镜下观察,细胞活率小于50%时或培养48~60小时收获病毒液,取样检测tcid
50
。每0.1ml毒液病毒含量应不低于10
7.00
tcid
50
,用于以下实施例中制备猪伪狂犬ge基因缺失灭活疫苗。
[0047]
实施例2:规模化生产猪伪狂犬ge基因缺失灭活疫苗的方法
[0048]
该实施例利用上述实施例1制备的猪伪狂犬ge基因缺失病毒液规模化生产猪伪狂犬ge基因缺失灭活疫苗,具体还包括以下步骤。
[0049]
2.1)病毒液灭活
[0050]
i)灭活剂的确定
[0051]
该实验中分别利用在制备灭活疫苗中常规使用的灭活剂:甲醛、bei和β
‑
丙内酯对实施例1制备的病毒液进行灭活,以从中选择确定合适的灭活剂,上述三种灭活剂的灭活方法分别为:
[0052]
2.1.1)甲醛灭活:向经澄清的实施例1制备的猪伪狂犬ge基因缺失病毒液中加入终浓度分别为0.05%(v/v)、0.08%(v/v)、0.1%(v/v)、0.3%(v/v)、0.5%(v/v)、0.8%(v/v)的甲醛溶液,37℃灭活48h,检测经甲醛灭活后的病毒液的感染性。如下表2所示,示出了实施例1制备的猪伪狂犬ge基因缺失病毒液经不同浓度的甲醛溶液灭活后连续传代3代病毒的感染性情况,显然可见0.05%~0.5%(v/v)浓度的甲醛溶液并不能实现对js
‑
2012δge病毒液灭活的目的,经灭活后的病毒液仍具有可检测的感染性,当用其制备疫苗时会导致潜在的疫苗接种安全风险,这与上述文献1公开的方法中使用终浓度为0.4%(v/v)的甲醛溶液灭活以及上述文献2公开的方法中使用终浓度为0.15%或0.2%甲醛溶液灭活均能够实现符合《中国兽药典》相关要求的灭活目标不同,这可能是由于基因改造后的不同毒株(文献1为猪伪狂犬xf
‑
1株的ge基因缺失毒株,文献2为猪伪狂犬js
‑
2012株的ge和gi基因缺失毒株,本技术为猪伪狂犬js
‑
2012株的ge基因缺失毒株)对甲醛灭活剂的耐受性不同引起的。由表2也可知,当采用较高浓度的甲醛溶液(0.8%(v/v))时才能实现对猪伪狂犬ge基因缺失js
‑
2012δge株病毒液灭活的目的,经灭活后的病毒液不具有可检测的感染性,符合《中国兽药典》相关要求,但是由于甲醛溶液本身具有毒性,使用高浓度的甲醛溶液对病毒液进行灭活可能依然会导致潜在的疫苗安全性问题。
[0053]
表2:甲醛灭活检验结果(温度为37℃条件下进行)
[0054][0055]
备注:“—”表示无cpe,“ ”表示有cpe。
[0056]
2.1.2)bei灭活:
[0057]
1)本实验利用bea按2%~4%(w/v)的量加至0.1~0.2mol/l氢氧化钠溶液中,置37℃水浴中,每10~15分钟震摇1次,作用30~60分钟,即环化为二乙烯亚胺(bei)。经无菌过滤后备用。
[0058]
2)将除菌过滤的bei溶液加入经澄清的病毒液(bei的终浓度分别为0.002mol/l、0.003mol/l和0.004mol/l)充分搅匀后倒罐,待温度升至30℃时开始计时,灭活24~35小时,期间每隔60~120分钟搅拌一次。
[0059]
3)灭活阻断:计时结束后将过滤除菌的20%~50%硫代硫酸钠溶液加入灭活病毒液中,使其硫代硫酸钠的终浓度为2%~4%,充分混匀后,同时取样进行灭活检验。
[0060]
检验结果如下表3所示,为使用bei对实施例1制备的病毒液进行灭活后病毒液的感染性检验结果,明显可见使用的三种浓度的bei均能够实现对猪伪狂犬ge基因缺失病毒液的符合《中国兽药典》相关要求的灭活的目的,经灭活后的病毒液均不具有可检测到的感染性。
[0061]
表3:bei灭活检验结果(温度为30℃条件下进行)
[0062][0063]
备注:表中“—”表示无cpe,“ ”表示有cpe。
[0064]
2.1.3)β
‑
丙内酯灭活:向经澄清的实施例1制备的猪伪狂犬ge基因缺失病毒液中分别按照1:500(v/v)、1:1000(v/v)、1:4000(v/v)、1:8000(v/v)加入β
‑
丙内酯,置2~8℃灭活3天,病毒灭活到期后,分别进行病毒灭活检验。
[0065]
检验结果如下表4所示,为使用不同浓度的β
‑
丙内酯对实施例1制备的病毒液进行灭活后病毒液的感染性检验结果,明显可见使用的四种浓度的β
‑
丙内酯均不能够实现对猪
伪狂犬ge基因缺失病毒液的符合《中国兽药典》相关要求的灭活的目的,经灭活后的病毒液均具有可检测到的感染性,即β
‑
丙内酯并不能用于对猪伪狂犬ge基因缺失js
‑
2012δge株病毒液进行灭活处理。
[0066]
表4:β
‑
丙内酯灭活检验结果(温度为2
‑
8℃条件下进行)
[0067][0068]
备注:表中浓度比例为β
‑
丙内酯:抗原,“—”表示无cpe,“ ”表示有cpe。
[0069]
综上所述,虽然甲醛、bei和β
‑
丙内酯三种灭活剂是生产灭活疫苗中常用的灭活剂,但是针对本发明中生产猪伪狂犬ge基因缺失灭活疫苗时,甲醛和β
‑
丙内酯并不适合用于对猪伪狂犬ge基因缺失js
‑
2012δge株病毒液进行灭活,其中使用甲醛时需要高浓度的甲醛溶液灭活时才能够实现符合《中国兽药典》相关要求的灭活目的,但是由于甲醛本身具有毒性的缺陷,高浓度的甲醛溶液进行灭活时会导致生产的灭活疫苗具有潜在的安全性问题,而使用β
‑
丙内酯进行灭活时,无法对病毒液实现符合《中国兽药典》相关要求的灭活目的。因此本发明在规模化生产猪伪狂犬ge基因缺失灭活疫苗时,确定使用bei对病毒液进行灭活处理。
[0070]
ii)灭活剂浓度、灭活时间和灭活温度的确定
[0071]
该实验使用bei作为灭活剂对猪伪狂犬ge基因缺失病毒液进行灭活,确定bei的适合浓度、灭活时间和灭活温度,具体操作为:取实施例1制备的猪伪狂犬ge基因缺失病毒液2400ml,分成6瓶,每瓶400ml。每3瓶一组,分成2组(a组(a1、a2和a3)、b组(b1、b2和b3))。各组分别加入已制备好的bei灭活剂,使bei终浓度分别是0.002mol/l、0.003mol/l和0.004mol/l。充分混匀后每组各取1瓶置35℃恒温摇床灭活,每组另1瓶置30℃恒温摇床灭活。两温度条件下灭活的各组病毒液,分别在灭活开始后每隔1小时取样,每隔60min摇匀一次,直到第30小时,每次取样10.0ml,对每次取样的病毒液检测tcid
50
,并以检测的tcid
50
为纵坐标,以时间为横坐标分别制作a1、a2、a3、b1、b2和b3组病毒液的灭活动力曲线。灭活完成后,对各组经灭活后的病毒液进行感染性检验。
[0072]
结果如图2和表5所示,其中图2中a
‑
f幅分别表示a1组(30℃下bei浓度0.002mol/l)、a2组(30℃下bei浓度0.003mol/l)、a3组(30℃下bei浓度0.004mol/l)、b1组(35℃下bei浓度0.002mol/l)、b2组(35℃下bei浓度0.003mol/l)、b3组(35℃下bei浓度0.004mol/l)的灭活动力曲线,并在图中示出了各组灭活动力曲线对应的回归方程,表5表示的是各组病毒液经灭活后的感染性检验结果。由各组的灭活动力曲线的回归方程可知,a1组t
99
时间(即病毒灭活99%所需的时间)为24.9小时;a2组t
99
时间为21.46小时,a3组t
99
时间为14.19小时;b1组t
99
时间为23.85小时,b2组t
99
时间为20.15小时;b3组t
99
时间为13.45小时。
[0073]
表5:a1、a2、a3、b1、b2和b3组病毒液经灭活后感染性检验结果
[0074][0075]
备注:
“‑”
表示无cpe,“ ”表示有cpe。
[0076]
综上结果,可见在35℃条件下,猪伪狂犬ge基因缺失病毒液灭活99%所需的时间t
99
值分别为23.85h、20.15h、13.45h;在30℃条件下,猪伪狂犬ge基因缺失病毒液灭活99%所需的时间t
99
值分别为24.90h、21.46h、14.19h;显然35℃条件下进行病毒灭活比30℃条件下灭活时间缩短1~2小时。但考虑到灭活温度越高对病毒的免疫原性破坏越大,因此确定猪伪狂犬ge基因缺失病毒液灭活温度优选为约30℃。并且不同浓度灭活剂的作用下均可有效灭活病毒液,考虑到大生产进行病毒灭活时往往需要加大灭活剂用量并加倍延长灭活时间以确保灭活效果,因此结合猪伪狂犬灭活疫苗生产实际,本发明确定病毒灭活温度为约30℃,灭活剂(bei)终浓度为0.002~0.004mol/l,灭活时间为24~35小时。分别使用实验室生产的3批猪伪狂犬ge基因缺失病毒抗原(病毒含量均为≥10
7.0
tcid
50
/0.1ml),采用以上优化好的灭活工艺参数进行病毒灭活,均能实现符合《中国兽药典》相关要求的灭活目的,证明本发明的灭活工艺参数能够确保灭活效果,保证疫苗安全性。
[0077]
2.2)病毒液纯化浓缩
[0078]
该实验利用实施例1制备的猪伪狂犬ge基因缺失病毒液确定本发明对猪伪狂犬ge基因缺失病毒液的纯化浓缩工艺参数,具体包括以下操作。
[0079]
2.2.1)病毒液浓缩孔径确定
[0080]
将实施例1中制备的猪伪狂犬ge基因缺失病毒抗原(病毒含量为10
7.0
tcid
50
/0.1ml)通过连续流离心机6000rpm/min离心,弃去沉淀,将离心后病毒上清液分别通过300kd、500kd和750kd的中空纤维或膜包系统进行切向流过滤浓缩,控制进口压力≤0.1mpa,控制透过端流速为1l/min,跨膜压差≤0.1mpa,浓缩倍数达到5倍时,使用pbs(0.04mol/l,ph值7.2~7.4)以1l/min的流速连续流加至浓缩罐内以pbs溶液进行洗滤操作。洗滤结束后,继续浓缩,使用pbs(0.04mol/l,ph值7.2~7.4)流经中空纤维柱或膜包至浓缩罐内达到最终浓缩倍数为10倍。分别测定不同孔径的中空纤维超滤浓缩过程中的原液样、离心后样、透过液、洗滤液(3次)、10倍浓缩液的病毒含量和蛋白去除率。
[0081]
结果如下表6和表7所示,对比浓缩前样、透过液和10倍浓缩液的病毒含量和浓缩所用时间以及蛋白去除率,750kd孔径的透过液中检测到了10
2.50
tcid
50
/0.1ml的病毒含量,而300kd孔径的浓缩时间远高于其他两种孔径,且蛋白去除率只有80.72%,因此选择确定500kd左右孔径中空纤维或膜包系统对病毒液进行浓缩,在浓缩的透过液中不能检测到病毒存在,并且相对于300kd孔径中空纤维或膜包系统的浓缩时间相对要短很多,且能够清除93.32%的蛋白。
[0082]
表6:不同孔径超滤浓缩tcid
50
检测数据(10
n tcid
50
/0.1ml)
[0083][0084]
表7:不同孔径超滤浓缩蛋白含量检测(凯氏定氮法)
[0085][0086]
2.2.2)病毒液纯化用peg浓度确定
[0087]
向上述步骤2.2.1)由500kd孔径浓缩获得的10倍浓缩液中分别加入6%、7%、8%、
……
、14%的peg6000,搅拌4h,4℃过夜;将病毒液加入离心桶内10000rpm离心30min;离心桶内上清液弃去,加入pbs(0.04mol/l,ph值7.2~7.4),用匀浆器重悬,补加缓冲液至浓缩后体积。分别测定各浓度peg6000处理的病毒液中抗原病毒含量和蛋白去除率。结果如下表8和表9所示。
[0088]
表8:不同浓度peg6000纯化tcid
50
检测数据(10
n tcid
50
/0.1ml)
[0089][0090]
表9:不同浓度peg6000纯化蛋白含量检测(凯氏定氮法)
[0091][0092]
由上表8和表9结果可知,使用浓度为9%~13%的peg6000纯化浓缩病毒液后的抗原病毒含量和蛋白去除率均优于其他浓度,并且使用浓度为9%~13%的peg6000纯化浓缩病毒液后的病毒含量与纯化前基本一致,蛋白去除率均可以达到70%以上,甚至能够达到80%以上。因此在本发明的生产猪伪狂犬ge基因缺失灭活疫苗的方法中,确定使用浓度为9%~13%的peg6000对经过500kd左右孔径中空纤维或膜包系统浓缩的病毒液进行纯化,并用pbs(0.04mol/l,ph值7.2~7.4)重悬至纯化前体积。
[0093]
2.2.3)浓缩纯化工艺效果验证
[0094]
分别取实施例1制备的三批次猪伪狂犬ge基因缺失病毒液,用上述步骤2.2.1)和2.2.2)确定的浓缩和纯化工艺对以上三批次的病毒液进行纯化浓缩,取原液样、离心后样、透过液、洗滤液(3次)、10倍浓缩液、peg上清液和peg纯化样,测定病毒含量、蛋白含量,并进行sds
‑
page蛋白电泳检测,对浓缩纯化后的病毒液中抗原进行透射电镜观察。结果如下表10、表11和表12以及图3至图5所示,其中图3为中空纤维浓缩后样品的sds
‑
page蛋白电泳检测结果,m表示蛋白marker(5
‑
250kda)、泳道1表示原液、泳道2表示原液离心后、泳道3表示10倍浓缩液;图4为病毒浓缩液经peg6000纯化后样品的sds
‑
page蛋白电泳检测结果,m表示蛋白marker(5
‑
250kda)、泳道1表示原液,、泳道2表示10倍浓缩后、泳道3~7表示peg纯化后;图5为浓缩纯化后的病毒液中抗原的透射电镜照片。
[0095]
表10:三批次猪伪狂犬ge基因缺失病毒液浓缩纯化试验tcid
50
检测数据(10
n tcid
50
/0.1ml)
[0096][0097]
表11:三批次猪伪狂犬ge基因缺失病毒液浓缩纯化试验蛋白含量检测(凯氏定氮法)结果(μg/ml)
[0098][0099]
表12:三批次猪伪狂犬ge基因缺失病毒液浓缩纯化蛋白清除率(μg/ml)
[0100][0101]
由上表10可知,由实施例1制备的猪伪狂犬ge基因缺失病毒液的病毒含量均在10
7.00
tcid
50
/0.1ml以上,并且经过浓缩纯化后的病毒含量也均在10
7.00
tcid
50
/0.1ml以上,表明浓缩纯化步骤不会导致病毒液中病毒含量的明显损失。由上表11和表12以及图3至图5可知,猪伪狂犬ge基因缺失病毒液经高速离心虽然去除了大部分的细胞碎片,但是蛋白含量去除率仅在5%~7%,而在后续浓缩步骤中中空纤维超滤可以去除92%左右的蛋白和水,但是由于体积缩小10倍,浓缩的抗原蛋白含量依然很高,为保证生产更安全的抗原,后续利用peg纯化技术进一步清除了浓缩后抗原中70%~80%的蛋白。因此以上三步浓缩纯化工艺对抗原蛋白的总清除率(恢复至纯化步骤离心前体积)可达98%以上,较好地保证了由其制备的疫苗的安全性。
[0102]
综上结果,本发明在规模化生产猪伪狂犬ge基因缺失灭活疫苗时,可以采用以下工艺对猪伪狂犬ge基因缺失病毒液进行浓缩纯化:病毒液经高速离心后采用500kd左右(例如450~550kd)孔径中空纤维或膜包系统进行超滤浓缩,以及使用浓度为9%~13%的peg6000进行纯化,这种浓缩纯化方法经证明不会明显降低病毒液中病毒含量,仍能保持在10
7.00
tcid
50
/0.1ml以上,并且杂蛋白含量减少98%以上。
[0103]
在本发明的规模化生产猪伪狂犬ge基因缺失灭活疫苗的方法中,在实施例1制备的猪伪狂犬ge基因缺失病毒液的基础上首先按照上述步骤2.1)的方法对病毒液进行灭活处理,然后再按照上述浓缩纯化工艺条件对灭活后的病毒液进行浓缩纯化处理,然后再利用浓缩纯化后的病毒液进行以下乳化配苗步骤,其中先对病毒液进行灭活处理,再对灭活后的病毒液进行浓缩纯化处理具有以下优点:(1)由于病毒液灭活时加入的灭活剂对疫苗安全性存在一定风险,因此先灭活后纯化的操作种使用peg6000纯化后利用pbs置换可以将病毒液中大部分灭活剂去除,能够保证疫苗的安全性:(2)如先对病毒液进行纯化浓缩再灭活,在灭活的过程中会产生少许沉淀,需要再次离心才能去除,因此会造成工艺步骤增加,工艺步骤的增加还可能造成抗原损失,同时也会影响疫苗乳化的质量。因此本发明规模化生产猪伪狂犬ge基因缺失灭活疫苗时,先对病毒液进行灭活处理,再对灭活后的病毒液进行浓缩纯化处理,并且经高效液相色谱方法对经灭活后的病毒液的浓缩纯化液中的抗原含量进行检测的结果也表明,浓缩纯化步骤也不会明显降低灭活后的病毒液中的抗原含量,仍能保持在10
7.00
tcid
50
/0.1ml以上。
[0104]
2.3)乳化配苗
[0105]
该实验选择使用法国赛彼科isa201佐剂(购于赛彼科(上海)特殊化学品有限公司)与上述浓缩纯化后的病毒液(按配苗要求稀释)进行乳化配苗,具体操作为将灭活后经浓缩纯化的抗原液(按照配苗要求进行稀释,使最终配制的疫苗中抗原含量为10
7.00
tcid
50
/头份(2ml))作为水相备用,按照质量比为1:1或者按照体积比为54:46将法国赛彼科isa201佐剂(油佐剂)与水相配比,首先将佐剂进料到乳化缸中,在搅拌条件下,将水相缓慢进料到乳化缸中,搅拌至水相与佐剂充分混合,乳化获得双相油乳剂疫苗,疫苗物理性状和安全性(无菌检验)均符合《中国兽药典》规定的质量要求后定量分装,加盖密封、贴签,制备得到猪伪狂犬ge基因缺失灭活疫苗。其中对获得的双相油乳剂疫苗进行物理性状检验和无菌检验的结果如下表13所示。
[0106]
表13:无菌检验及物理性状检验结果
[0107][0108]
实施例3:猪伪狂犬ge基因缺失灭活疫苗的安全性评价
[0109]
该实施例采用试验动物小白鼠和豚鼠以及本动物(仔猪和怀孕母猪)对上述实施例2规模化生产3批次猪伪狂犬ge基因缺失灭活疫苗的安全性进行评价,具体包括以下操作。
[0110]
3.1)基于试验动物小白鼠和豚鼠的疫苗安全性评价
[0111]
用体重350~450g的豚鼠(购自北京市昌扬西山养殖场)2只,各皮下注射疫苗2m1;用体重18~22g小鼠(购自斯贝福(北京)生物技术有限公司)5只,各皮下注射疫苗0.5m1。持续观察7日,均不应出现因注射疫苗引起的死亡或明显的局部反应或全身不良反应。结果如下表14所示,可见小白鼠和豚鼠均未出现局部不良反应、全身不良反应,全部试验动物健康存活。
[0112]
表14:3批猪伪狂犬ge基因缺失灭活疫苗的试验动物安全试验
[0113][0114]
3.2)基于本动物(仔猪和怀孕母猪)的疫苗安全性评价
[0115]
3.2.1)该实验分别对3~5周龄的健康易感仔猪(prv中和抗体效价不高于1:4)(购自呼和浩特市土默特左旗国营种猪场)进行单剂量2ml(1头份)、单剂量重复、超剂量4ml(2头份)接种(颈部肌肉注射),持续观察14日,结果如下表15所示。
[0116]
根据表15记载的结果,可见单剂量接种和单剂量重复接种的仔猪均未出现猪伪狂犬症状或由疫苗引起的临床异常反应;超剂量接种的仔猪中除个别仔猪注射后8小时出现体温一过性升高外,其他仔猪均未出现猪伪狂犬症状或由疫苗引起的临床异常反应。
[0117]
表15:仔猪的安全性评价
[0118][0119]
3.2.2)该实验分别对生产前40天的健康怀孕母猪(prv中和抗体效价不高于1:4)(购自呼和浩特市土默特左旗国营种猪场)进行单剂量2ml(1头份)、单剂量重复、超剂量4ml(2头份)接种(颈部肌肉注射),观察母猪接种后是否发生异常猪伪狂病症状或由疫苗引起的临床异常反应,并观察母猪是否发生流产以及产仔情况,结果如下表16所示。
[0120]
根据表16记载的结果,可见单剂量接种、单剂量重复和超剂量接种的健康怀孕母猪均未出现猪伪狂犬症状或由疫苗引起的临床异常反应,也未出现母猪流产情况,除个别母猪产仔中出现一头弱仔外,其他母猪的产仔情况均正常。
[0121]
表16:怀孕母猪安全性评价
[0122][0123][0124]
综上安全性评价结果表明,本发明规模化生产的猪伪狂犬ge基因缺失灭活疫苗是安全可靠的,注射后不会产生潜在的安全性问题。
[0125]
实施例4:猪伪狂犬ge基因缺失灭活疫苗的免疫效力、最低免疫剂量、免疫持续期
评价
[0126]
该实施例采用3~5周龄健康易感仔猪对上述实施例2制备的多个批次的猪伪狂犬ge基因缺失灭活疫苗的免疫效力、最低免疫剂量和免疫持续期进行评价,具体包括以下操作。
[0127]
4.1)猪伪狂犬ge基因缺失灭活疫苗的免疫效力评价
[0128]
4.1.1)试验动物:3~5周龄健康易感仔猪(prv中和抗体效价不高于1:4)共计20头,随机分为四组(组1、2、3、4),每组5头;
[0129]
4.1.2)使用上述实施例2制备的3批次的猪伪狂犬ge基因缺失灭活疫苗分别对组1、2、3的5头仔猪进行首次免疫(10
7.00
tcid
50
/头份(2ml),颈部肌肉注射),首次免疫后21天同样方法进行二次免疫(10
7.00
tcid
50
/头份),作为免疫组;组4为空白对照组,不注射疫苗;
[0130]
4.1.3)二免后7日对免疫组和空白对照组仔猪采血,用细胞中和试验方法进行抗体滴度测定,并在仔猪二免后7日(采血后)进行效检攻毒(攻毒用毒株为js
‑
2012野生毒株,攻毒用病毒含量为10
6.00
tcid
50
/ml,滴鼻2ml,下同);病毒含量保护试验,攻毒后连续观察14日,并统计发病保护情况。
[0131]
细胞中和试验方法进行的抗体滴度测定结果显示:免疫组(组1、2、3)仔猪在二免后抗体水平显著升高,血清中和抗体在二免7日达到1:128~1:512,血清gb抗体在二免7日达到1:512~1:4096(gb抗体检测使用猪伪狂犬gb抗体elisa检测试剂盒,购自idexx公司),血清ge抗体全部阴性。攻毒后连续观察14日的结果如下表17所示,其中根据猪伪狂犬病发病标准,空白对照组全部仔猪日体温>40.5℃持续超过3日,并且伴有呼吸困难和精神沉郁等神经症状,且出现2/5死亡,结合解剖器官病变情况全部判为发病;而免疫组仔猪体温均正常(不超过40.5℃),进食和精神良好,未出现猪伪狂犬典型症状,3批疫苗效力检验攻毒保护效果良好,保护率100%。说明该疫苗效力符合标准,满足免疫预防猪伪狂犬病的要求。
[0132]
表17:仔猪攻毒保护情况
[0133][0134]
4.2)猪伪狂犬ge基因缺失灭活疫苗的最低免疫剂量评价
[0135]
4.2.1)试验动物:3~5周龄健康易感仔猪(prv中和抗体效价不高于1:4)共计25头,随机分为5组,每组5头;
[0136]
4.2.2)使用上述实施例2制备的猪伪狂犬ge基因缺失灭活疫苗(10
7.00
tcid
50
/头份(2ml))按照4个剂量组(2.0ml、1.0ml、0.5ml、0.25ml)分别对4组仔猪进行首次免疫(颈部肌肉注射),首次免疫后21天同样剂量进行二次免疫,作为免疫组;剩下1组为对照组,不注射疫苗;
[0137]
4.2.3)二免后7日对免疫组和对照组进行效检攻毒保护试验,攻毒后连续观察14日,并统计发病保护情况。
[0138]
免疫攻毒保护试验结果如下表18所示,可见2.0ml、1.0ml和0.5ml剂量组保护率均为100%;而0.25ml剂量组保护率为80%。对照组5/5发病。表明本发明提供的猪伪狂犬ge基因缺失灭活疫苗的免疫剂量与攻毒保护存在一定的平行关系,当免疫剂量为0.25ml以上时,攻毒保护率在80%以上,且当免疫剂量为0.5ml以上时,攻毒保护率实现100%。因此,为保证疫苗的免疫效果,确定本发明提供的猪伪狂犬ge基因缺失灭活疫苗的最小免疫剂量为0.5ml。
[0139]
4.3)猪伪狂犬ge基因缺失灭活疫苗的免疫持续期评价
[0140]
4.3.1)一次免疫的免疫持续期评价(一免组)
[0141]
1)试验动物:3~5周龄健康易感仔猪(prv中和抗体效价不高于1:4)共计10头,随机分为2组,免疫组和对照组各5头;
[0142]
2)使用上述实施例2制备的猪伪狂犬ge基因缺失灭活疫苗对免疫组仔猪进行免疫(10
7.00
tcid
50
/头份(2ml),颈部肌肉注射);对照组不注射疫苗;
[0143]
3)免疫后7日、14日、21日、28日、60日、90日、120日分别对免疫组和对照组仔猪采血分离血清进行prv中和抗体检测,其中免疫组仔猪的血清prv中和抗体检测结果如图6所示,对照组仔猪的血清prv中和抗体效价均不高于1:4。
[0144]
根据图6所示的结果可见,免疫组仔猪在免疫本发明提供的猪伪狂犬ge基因缺失灭活疫苗后7日、14日、21日、28日的血清prv中和抗体效价即分别达到约1:11、1:40、1:64和1:96的高水平效价,在一免后120天的血清prv中和抗体效价仍保持在1:16以上的水平,并且在免疫后21日、28日的抗体合格率达到100%,免疫90天后仍然能够保持40%以上的抗体合格率。通常情况下,疫苗免疫后14日至28日左右的血清中和抗体效价水平是评价疫苗免疫保护效果的最佳时期,根据图6所示结果,在免疫本发明提供的猪伪狂犬ge基因缺失灭活疫苗后14日、21日、28日的血清prv中和抗体效价分别达到1:40、1:64和1:96,显著高于上述文献1公开的猪伪狂犬ge基因缺失灭活疫苗的免疫保护效果(免疫后14日和35日的血清prv中和抗体效价水平分别为1:9.6和1:45.2),因此本发明提供的猪伪狂犬ge基因缺失灭活疫苗相对于上述文献1提供的猪伪狂犬ge基因缺失灭活疫苗具有更好的免疫效力,对猪更够提供更佳的免疫保护效果。
[0145]
4.3.2)二次免疫的免疫持续期评价(二免组)
[0146]
1)试验动物:3~5周龄健康易感仔猪(prv中和抗体效价不高于1:4)共计16头,随机分为4组,分别为a免疫组5头,b免疫组5头,a对照组3头和b对照组3头;
[0147]
2)使用上述实施例2制备的猪伪狂犬ge基因缺失灭活疫苗对a和b免疫组仔猪进行首次免疫(10
7.00
tcid
50
/头份(2ml),颈部肌肉注射),首次免疫后21日同样方法加强免疫一次;a对照组和b对照组不注射疫苗;
[0148]
3)首次免疫后7日、14日和二次免疫后7日、14日、21日、28日、60日、90日、120日对a免疫组和a对照组仔猪采血分离血清进行prv中和抗体检测,并于二次免疫后120日进行攻毒试验;首次免疫后7日、14日和二次免疫后7日、14日、21日、28日、60日、90日、120日、150日分别对b免疫组和b对照组仔猪采血分离血清进行prv中和抗体检测,并于二次免疫后150日进行攻毒试验。其中b免疫组仔猪的血清prv中和抗体检测结果如图7所示,a免疫组仔猪的血清prv中和抗体检测结果与b组免疫组仔猪在首次免疫后7日、14日和二次免疫后7日、14日、21日、28日、60日、90日、120日采集血清检测的结果相当(结果未示出),a对照组和b对照
组仔猪的血清prv中和抗体效价均不高于1:4。
[0149]
根据图7所示的结果可知,当使用本发明提供的猪伪狂犬ge基因缺失灭活疫苗对仔猪进行二次免疫时,二免后7日、14日、21日、28日的血清prv中和抗体效价水平分别达到约1:90、1:256、1:180、1:128,并且持续到二免后120日和150日的血清中和抗体效价水平仍高达约1:64和1:45;从二免后7日一直持续到二免后90日,抗体合格率均保持在100%的水平,并且持续到二免后150日的抗体合格率也高达为60%。对a免疫组和b免疫组的攻毒试验结果表明,二免后120日的攻毒保护率为100%,并且对免疫后仔猪攻毒后不会出现发热(>40.5℃)、精神沉郁、咳嗽、呼吸困难等猪伪狂犬病临床表现,而二免后150日的攻毒保护率不低于80%,结合对免疫仔猪的血清prv中和抗体效价水平的检测,当血清prv中和抗体效价不低于1:45时,能够实现对猪很好的保护效果(攻毒保护率在80%以上)。综上结果,表明本发明提供的猪伪狂犬ge基因缺失灭活疫苗具有良好的免疫保护效力和免疫原性,能够有效激发血清prv中和抗体水平,并且相对于单次免疫,两次免疫的保护效果最佳,免疫持续期在4个月以上。
[0150]
4.4)本发明提供的猪伪狂犬ge基因缺失灭活疫苗与市售同类型猪伪狂犬灭活疫苗a和疫苗b(均为市售ge基因缺失灭活疫苗)的安全性和免疫效力比较
[0151]
1)试验动物:3~5周龄健康易感仔猪(prv中和抗体效价不高于1:4)共计20头,随机分为4组,本发明提供的猪伪狂犬ge基因缺失灭活疫苗组(本疫苗组)、疫苗a组、疫苗b组和对照组各5头;
[0152]
2)使用本发明提供的猪伪狂犬ge基因缺失灭活疫苗、疫苗a、疫苗b分别对本疫苗组、疫苗a组、疫苗b组仔猪进行接种(颈部肌肉注射2ml),21日后加强免疫一次;对照组仔猪不注射疫苗;
[0153]
3)二免后7日分别对各组仔猪进行攻毒试验,统计发病保护情况。
[0154]
结果如下表18所示,可见本发明提供的疫苗对猪的保护率为100%,而疫苗b的保护率为80%,疫苗a的保护率仅为60%,对照组仔猪全部发病,表明本发明提供的猪伪狂犬ge基因缺失灭活疫苗的免疫效力优于市售同类产品。
[0155]
表18:仔猪攻毒保护情况
[0156][0157]
实施例5:猪伪狂犬ge基因缺失灭活疫苗的保存期评价
[0158]
该实施例对实施例2制备的3批次(分别为s2101、s2102和s2103批次)猪伪狂犬ge基因缺失灭活疫苗的保存期进行评价,包括对在2~8℃条件下保存3、6、9、12、15、18和21个月的疫苗进行物理性状检验、无菌检验和装量检查,并对保存18个月和21个月的疫苗样品进行安全检验和效力检验,具体包括以下操作。
[0159]
5.1)疫苗的物理性状检验、无菌检验和装量检查
[0160]
1)剂型:3批次疫苗在2~8℃条件下保存3、6、9、12、15、18和21个月的样品均为水包油包水型,对于每种样品,吸取少量疫苗滴于冷水表面,均呈云雾状扩散;
[0161]
2)稳定性:分别吸取3批次疫苗在2~8℃条件下保存3、6、9、12、15、18和21个月的疫苗样品10.0ml加入离心管中,以3000r/min离心15分钟,管底析出的水相均不超过0.5ml;
[0162]
3)按现行《中国兽药典》附录测定各疫苗样品的黏度,均符合规定;
[0163]
4)按现行《中国兽药典》附录进行装量检查,均符合规定;
[0164]
5)按现行《中国兽药典》附录进行无菌检验,各疫苗样品均无菌生长。
[0165]
5.2)疫苗的安全检验
[0166]
该实验使用的疫苗样品为s2101、s2102和s2103批次疫苗在2~8℃条件下保存18个月和21个月的样品,进行以下小动物检验和本动物检验。
[0167]
1)小动物检验:用体重350~450g的豚鼠2只,各皮下注射疫苗2m1;用体重18~22g小鼠5只,各皮下注射疫苗0.5m1。持续观察7日,均不应出现因注射疫苗引起的死亡或明显的局部反应或全身不良反应;
[0168]
2)本动物检验:用3~5周龄健康易感仔猪(prv血清中和抗体效价不高于1:4)2头,每头猪两侧颈部肌肉注射疫苗4.0ml(2头份),每侧2.0ml,持续观察14日,均不应出现因注射疫苗引起的猪伪狂犬病症状,或死亡或明显的局部反应或全身不良反应。
[0169]
安全检验结果如下表19和20所示,可见3批疫苗在2~8℃保存18个月和21个月的疫苗安全性检验均合格。
[0170]
表19:保存不同时间3批疫苗小动物安全性检验结果
[0171][0172]
表20:保存不同时间3批疫苗本动物安全检验结果
[0173]
[0174]
5.3)疫苗的免疫效力检验
[0175]
该实验使用的疫苗样品为s2101、s2102和s2103批次疫苗在2~8℃条件下保存18个月和21个月的样品,进行以下免疫效力检验。
[0176]
用3~5周龄健康易感仔猪(prv血清中和抗体效价不高于1:4)10头,随机分为2组,每组5头猪。免疫组每头猪颈部肌肉注射疫苗2.0ml,一免后21日以同样剂量、同样接种方法加强免疫一次,对照组不接种疫苗。二免后7日采血分离血清进行prv中和抗体检测,并于二免后7日连同对照组进行攻毒。攻毒后连续观察14日,对照组猪应至少4/5发病且至少死亡1头,免疫组猪至少4/5保护。血清prv中和抗体检测结果如下表21所示,攻毒试验结果如下表22所示。
[0177]
表21:3批次疫苗在2~8℃保存18个月和21个月后免疫3~5周龄健康易感仔猪的效力和有效期
[0178][0179]
表22:疫苗保存期效力检验攻毒试验结果
[0180][0181]
由上表21和表22可知,3批疫苗在2~8℃保存18个月后通过两次免疫的方式免疫3~5周龄健康易感仔猪时,二免后7天的血清prv中和抗体水平均不低于1:45,免疫后攻毒保护率为100%;而3批疫苗在2~8℃保存21个月后通过两次免疫的方式免疫3~5周龄健康易感仔猪时,二免后7天的血清prv中和抗体水平满足4/5不低于1:45,免疫后攻毒保护率为80%。表明本发明提供的猪伪狂犬ge基因缺失灭活疫苗在2~8℃保存18个月后仍然能够实现对猪的100%免疫保护,而在2~8℃保存21个月后能够实现对猪的80%的保护,因此确认本发明提供的猪伪狂犬ge基因缺失灭活疫苗在2~8℃保存条件下的保存期为18个月,但保
存21个月的疫苗仍然可用。
[0182]
最后应说明的是:以上所述仅为本发明的优选实施例,并不用于限制本发明。尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。