释放抗氧化剂的玻璃体替代物以及其用途
1.相关申请的交叉引用
2.本技术要求2019年2月8日提交的美国临时申请号62/803,419、2019年10月25日提交的美国临时申请号62/926,267以及2019年12月6日提交的美国临时申请号62/944,679的优先权权益,所述临时申请的公开内容各自以全文引用的方式并入本文中。
技术领域
3.本公开涉及玻璃体替代物,并且更具体地说涉及包含凝胶和抗氧化剂的玻璃体替代物。
背景技术:
4.玻璃体液为晶状体与视网膜之间的脆弱透明组织,占据眼睛体积的80%。玻璃体充当眼睛的机械缓冲垫,吸收冲击并且保护晶状体和视网膜(swindle
‑
reilly ke等biomaterials and regenerative medicine in ophthalmology.woodhead publishing.2016)。然而,玻璃体随年龄增长而变性,这妨碍其充当减震器并且引起并发症,诸如视网膜裂孔或脱离(los li等invest ophthalmol vis sci.2003;44:2828
‑
2833)。除机械功能外,天然玻璃体还具有其他化学功能,值得注意的是它在氧稳态中的作用。玻璃体切除操作与用包括硅酮油的替代物替换均破坏此氧稳态,从而对眼内组织造成氧化损害。特别地,对晶状体的氧化损害导致白内障形成,多达95%的患者在玻璃体切除术之后在24个月内需要白内障摘除术(feng h,adelman ra.clin ophthalmol.2014;8:1957
‑
1965)。当前的金标准硅酮油与其他实验性玻璃体替代物均未解决此问题。
5.尽管关于用于递送治疗可用化合物的玻璃体替代物的研究已取得进展,但仍然缺乏安全并且有效的材料。这些需要和其他需要通过本公开得到满足。
技术实现要素:
6.根据本公开的一个或多个目的,如本文中具体化和广泛描述的,本公开在一个方面中涉及一种包含所公开的玻璃体替代组合物的眼科组合物,其中玻璃体替代组合物包含所公开的凝胶、水凝胶或粒子以及治疗剂,其中治疗剂为所公开的抗氧化剂;使用所公开的玻璃体替代物治疗眼科病症的方法;以及制备包含含有hema、pegda和/或pegma的残基的聚合物的所公开的水凝胶的方法。
7.因此,在一个方面中,提供了一种包含凝胶和至少一种抗氧化剂的玻璃体替代物,其中玻璃体替代物通过具有小于1的损耗角正切(即,损耗模量与储能模量的比率)(例如损耗角正切在0.1至0.5范围内的损耗角正切)以及约1.33至约1.34的折射率来定义。
8.在一些实施方案中,玻璃体替代物具有在0.1pa至约1000pa,例如1pa至约100pa范围内的储能模量。在一些实施方案中,玻璃体替代物具有在约0.01pa至约1000pa,例如约0.1pa至约100pa或0.1pa至约50pa范围内的损耗模量。
9.在一些实施方案中,玻璃体替代物具有约1.331至约1.339,例如约1.334至约
1.337的折射率。
10.在一些实施方案中,凝胶包括水凝胶。在一些实施方案中,玻璃体替代物包含按重量计大于90%的水,例如按重量计大于95%的水。
11.在一些实施方案中,水凝胶包含聚合物组合物。在一些实施方案中,聚合物组合物可包含一个或多个选自以下的残基:乙烯醇残基、丙烯酸酯或甲基丙烯酸酯残基、丙烯酰胺残基、来源于官能化聚乙二醇的残基或它们的组合。在一些实施方案中,聚合物组合物可包含一个或多个选自以下的残基:丙烯酰胺、n
‑
鸟氨酸丙烯酰胺、n
‑
(2
‑
羟丙基)丙烯酰胺、丙烯酸羟乙酯、甲基丙烯酸羟乙酯、聚乙二醇丙烯酸酯、聚乙二醇甲基丙烯酸酯、n
‑
乙烯基吡咯烷酮、n
‑
苯基丙烯酰胺、二甲氨基丙基甲基丙烯酰胺、丙烯酸、苯甲基甲基丙烯酰胺、甲基硫乙基丙烯酰胺或它们的组合。
12.在一些实施方案中,聚合物组合物包含一个或多个选自以下的残基:聚(乙二醇)二丙烯酸酯(pegda)、聚(乙二醇)甲基丙烯酸酯(pegma)、甲基丙烯酸2
‑
羟乙酯(hema)或它们的组合。在一些实施方案中,聚合物组合物包含pegma:pegda共聚物。在一些实施方案中,聚合物组合物包含pegma:pegda:hema共聚物。
13.在一些实施方案中,水凝胶加载有至少一种抗氧化剂。在其他实施方案中,玻璃体替代物还包含粒子,例如纳米粒子。在一些实施方案中,粒子包含壳聚糖、明胶、海藻酸盐或它们的组合。在一些实施方案中,粒子包封至少一种抗氧化剂。
14.在一些实施方案中,至少一种抗氧化剂可包括:抗坏血酸或其衍生物;n
‑
乙酰半胱氨酸;谷胱甘肽;n
‑
亚硒酸;亚硒酸钠;l
‑
肉毒碱;β胡萝卜素;维生素e;维生素c;黄体素;玉米黄素;锌化合物;铜化合物;ω
‑
3脂肪酸(诸如dha或epa);α类脂酸或它们的组合。
15.在一些实施方案中,至少一种抗氧化剂可包括:α硫辛酸、抗坏血酸、核黄素、谷胱甘肽、牛磺酸、尿酸、酪氨酸、转铁蛋白、硒、锌、超氧化物歧化酶、谷胱甘肽过氧化物酶、过氧化氢酶、色素上皮源性因子(pedf)、它们的衍生物或它们的组合。
16.在一些实施方案中,本公开的玻璃体替代物可还包含如本文所描述的一种或多种其他治疗剂。在一些实施方案中,一种或多种其他治疗剂可包括抗vegf剂、β
‑
肾上腺素能拮抗剂、缩瞳剂、碳酸酐酶抑制剂、前列腺素、血清素能剂、毒蕈碱、多巴胺能激动剂、肾上腺素能激动剂、抗血管生成剂、抗感染剂、类固醇、非类固醇消炎药、生长因子、免疫抑制剂、抗过敏剂或它们的组合。
17.在另一方面中,提供了一种用于治疗有需要的受试者的眼睛中的眼科病症的方法,所述方法包括向受试者的眼睛中注射治疗有效量的如本文所描述的玻璃体替代物。在一些实施方案中,眼科病症可包括黄斑变性、视网膜裂孔或增生性视网膜病变。在一些实施方案中,受试者已被诊断为患有白内障或处于发展白内障的风险中。在一些实施方案中,在玻璃体切除术之后施用玻璃体替代物。
18.在检查以下图式和具体实施方式后,本公开的其他系统、方法、特征以及优点对本领域技术人员来说可为显而易见的或变得显而易见。所有此类其他系统、方法、特征以及优点旨在包括在此说明书内、在本公开的范围内并且受随附权利要求保护。此外,所描述的实施方案的所有任选和优选的特征和修改型式在本文教示的本公开的所有方面中均为可用的。此外,附属权利要求的个别特征以及所描述的实施方案的所有任选和优选特征和修改型式为可组合的并且彼此可互换。
附图说明
19.参考以下图式,可更好地理解本公开的许多方面。图式中的组分不一定为按比例绘制的,而是在清楚说明本公开的原理时进行强调。此外,在图式中,在若干视图中相似参考数字指定对应部分。
20.图1示出了制备和使用所公开的phema/pva水凝胶玻璃体替代物的示意图。
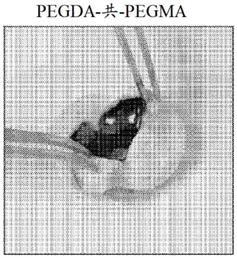
21.图2a至图2e示出了与所公开的hema:pegma:pegda水凝胶玻璃体替代物有关的代表图和数据。图2a公开了加载于注射器中的水凝胶。图2b示出了表明在用小号针头注射之后所公开的水凝胶保留其凝胶样坚实度的代表图。图2c示出了水凝胶夹在平行板几何构造与测试台之间的流变测试设备。使用填充有磷酸盐缓冲盐水的增湿室(仅以一半示出)来防止水凝胶样品在测试期间脱水。图2d示出了展示粘弹性的代表性流变学数据。图2e示出了从所公开的明胶
‑
海藻酸盐粒子释放的抗坏血酸的代表性数据,所述代表性数据展示持续释放并且在>30天时浓度维持在约2mm。hema:甲基丙烯酸2
‑
羟乙酯;pegda:聚(乙二醇)二丙烯酸酯;以及pegma:聚(乙二醇)甲基丙烯酸酯。
22.图3a至图3b分别示出了水凝胶玻璃体替代物以及具有氧梯度的玻璃体液以及年龄增长对玻璃体的影响的示意图。图3a示出了含有纳米包封的抗坏血酸的剪切稀化水凝胶玻璃体替代物的示意图。图3b示出了由胶原蛋白纤维网状结构和透明质酸组成的玻璃体液的示意图。天然玻璃体建立代谢活性视网膜和睫状体附近的氧水平高而晶状体附近的氧水平低的内部氧梯度。然而,玻璃体相随年龄增长而分离,从而以物理与化学两种方式破坏它在眼睛中的保护功能。归因于玻璃体变性的一些并发症包括视网膜脱离、视网膜裂孔以及白内障形成。
23.图4示出了所公开的明胶
‑
海藻酸盐物品的抗坏血酸释放的代表性数据,所述代表性数据展示爆发释放并且浓度维持在约2mm。
24.图5示出了代表性所公开水凝胶的抗坏血酸释放的代表性数据。合成了pegma水凝胶(20ml,5%v/v,mw 500),然后在室温下浸没在维生素c溶液(50ml,100mm)中持续12h。将水凝胶放置于透析管中并且浸没在磷酸盐缓冲盐水(pbs,70ml)中。在预定时间,在265nm下测量pbs的吸光度以计算pegma水凝胶的维生素c释放浓度。数据表明释放的维生素c的浓度在第一天内达到峰值50mm,然后在后续数天快速减少至接近零。
25.图6示出了通过21号针头注射所公开的水凝胶的加载维生素c的明胶
‑
海藻酸盐粒子的维生素c释放的代表性数据。然后将水凝胶/粒子混合物浸没在pbs中并且如上文所述测定pbs中维生素c的浓度。结果显示维生素c的释放中的小尖峰(与以上纯水凝胶的释放相比),随后为如图所示的一段时间的持续维生素c释放。
26.图7示出了与抗坏血酸钠溶液的降解有关的代表性数据。数据显示在37℃下在恒定搅拌下2mm抗坏血酸钠溶液的代表性降解型态(n=3)以及聚丙烯酰胺水凝胶的抗坏血酸钠释放型态(n=3)。含有抗坏血酸钠的聚合物溶液在18小时内凝胶化。然而,不含抗坏血酸钠的聚合物溶液消耗两倍长的时间进行凝胶化。
27.图8示出了就与在时间0时2mm抗坏血酸钠溶液的浓度(所述浓度为1.4mm)相比历时3天从聚丙烯酰胺凝胶释放的抗坏血酸钠的百分比来说,所公开的聚丙烯酰胺凝胶的抗坏血酸钠释放的代表性数据。到第一天结束时抗坏血酸钠似乎完全释放。第三天的药物释放百分比似乎降低,这归因于抗坏血酸钠的降解。
28.图9示出了所公开的壳聚糖粒子组合物的抗坏血酸钠释放的代表性数据。在室温下在搅拌(回转式振荡器)下进行研究。形成壳聚糖粒子之后的后续洗涤步骤可能使粒子中加载的抗坏血酸钠的实际量减少。数据显示与聚丙烯酰胺水凝胶的释放型态相比的持续释放,并且甚至在7天之后抗坏血酸钠仍持续释放。
29.图10a至图10d示出了代表性所公开水凝胶的代表性流变数据(n=3)。图10a示出了在振幅扫描实验中获得的代表性数据,所述代表性数据表明水凝胶的线性粘弹区低于10%应变。图10d示出了在频率扫描实验中获得的代表性数据,所述代表性数据表明水凝胶具有与天然人玻璃体类似的储能模量(g')和损耗模量(g”)。图10c示出了在剪切速率渐变实验中获得的代表性数据,所述代表性数据表明两种水凝胶均具有剪切稀化特性。图10d示出了在交替振动步骤应变实验中获得的代表性数据,所述代表性数据进一步表明两种水凝胶在经历大变形之后均可恢复其凝胶样特性。这些结果表明可使用配备有小号针头的注射器将水凝胶注射至玻璃体腔中。
30.图11示出了针对所公开的水凝胶所获得的透射率数据。水凝胶与天然人玻璃体一样透明(n=3)。天然玻璃体透射90%的300与900nm之间的光并且在此范围以下不透射。在可见和红外光谱内,水凝胶的透明度等于或高于90%。在紫外区域中水凝胶的透射率降低,在230nm下降至零。
31.图12示出了针对所公开的水凝胶所获得的代表性傅里叶转换红外(“ftir”)光谱数据。ftir数据显示pegda和pegda
‑
共
‑
pegma水凝胶的成功合成。在两种水凝胶光谱中均分别在2850、1730以及945cm
‑1处发现了亚甲基(
‑
ch2
‑
)、羰基(c=o)以及醚(c
‑
o
‑
c)基。仅在pegda
‑
共
‑
pegma水凝胶光谱中发现了分别在3740和1520cm
‑1处的醇基(
‑
oh)和甲基(
‑
ch3),而在pegda光谱中未发现,证实合成了适当的水凝胶。
32.图13a至图13b示出了在如所指示的不同条件下的代表性所公开水凝胶的代表性稳定性数据。图13a示出了针对所公开的pegda水凝胶所获得的稳定性数据。图13b示出了针对所公开的pegda
‑
共
‑
pegma水凝胶所获得的稳定性数据。数据表明在dpbs、溶菌酶或胰蛋白酶溶液中水凝胶的水含量在至少28天内不变(n=3)。这表明水凝胶在酶溶液中为稳定的并且可用作中期至长期玻璃体替代物。
33.图14a至图14b示出了如所指示相较于时间剩余的维生素c以及从所公开的代表性水凝胶释放的维生素c的量的代表性数据。图14a示出了如所指示相较于时间,所公开的代表性水凝胶中剩余的维生素c的量。图14b示出了如所指示相较于时间,从所公开的代表性水凝胶释放的维生素c的量。数据表明在头8小时内维生素c快速降解或从水凝胶释放(n=3)。在7天之后浓度接近零。
34.图15a至图15b示出了暴露于如所指示的代表性所公开水凝胶的不同细胞类型的代表性体外细胞毒性数据。图15a示出了相较于仅培养基对照暴露于如所指示的代表性所公开水凝胶的arpe
‑
19细胞的代表性体外细胞毒性数据。图15b示出了相较于仅培养基对照暴露于如所指示的代表性所公开水凝胶的lec细胞的代表性体外细胞毒性数据。数据表明两种水凝胶对arpe
‑
19和lec显示极小体外细胞毒性。与对照相比,过氧化氢处理显著降低lec的细胞活力。然而,与对照相比,在过氧化氢处理情况下arpe
‑
19的细胞活力相等或更大。不拥有共同字母的平均值为显著不同的(p<0.001,n=8)。arpe
‑
19细胞为人视网膜色素上皮细胞系并且在实施例中进一步描述。lec细胞为永生化人晶状体上皮细胞系并且在实
施例中进一步描述。
35.图16示出了与包含维生素c的所公开的水凝胶针对反应性氧物质(ros)的保护作用有关的代表性数据。水凝胶和维生素c的存在对降低arpe
‑
19和lec中的ros活性具有协同作用。与对照相比,过氧化氢处理未增加arpe
‑
19中的ros活性,但在lec中在统计学上增加ros活性。不拥有共同字母的平均值为显著不同的(p<0.001,n=8)。
36.图17a至图17c示出了所注射的猪眼的代表图。如图所示,pegda和pegda
‑
共
‑
pegma水凝胶可注射至猪眼的玻璃体腔中并且似乎与天然玻璃体类似。所用的猪眼如实施例中所描述。
37.图18示出了如所指示包括涂有海藻酸盐、壳聚糖和/或明胶的加载抗坏血酸的壳聚糖粒子的代表性所公开粒子的抗坏血酸释放的代表性数据。图中的图例使用以下缩写来详细描述粒子的组成:vc表示维生素c;ch表示壳聚糖;al表示海藻酸盐;ge表示明胶;并且“gxxx”表示谷胱甘肽,并且浓度(μm)由如图所示的数字“xxx”指示。如实施例中所描述来制备粒子。
38.图19示出了图18中的数据,但其中维生素c浓度针对第0天的浓度进行了规范化。
39.图20示出了来自不含其他添加剂、作为涂有海藻酸盐和壳聚糖的粒子而稳定化或具有谷胱甘肽作为添加剂的pegda和pegda
‑
共
‑
pegma水凝胶的抗坏血酸的稳定性的代表性数据。图中的图例使用以下缩写来详细描述组成:vc表示维生素c;ch表示壳聚糖;al表示海藻酸盐;pedga表示聚(乙二醇)二丙烯酸酯;pegma表示聚(乙二醇)甲基丙烯酸酯;并且“gxxx”表示谷胱甘肽,并且浓度(μm)由如图所示的数字“xxx”指示。如实施例中所描述来制备粒子。
40.图21a示出了证实以200
‑
400μm的浓度存在的过氧化氢杀死lec但未杀死apre
‑
19细胞的代表性数据。图21b示出了表明在玻璃体液中所发现的生理浓度(1000
‑
2000μm)下维生素c对lec和arpe
‑
19细胞具毒性的代表性数据。
41.图22示出了所建议的维生素c在玻璃体液中的浓度梯度。
42.图23a示出了证实低浓度的维生素c可降低由过氧化氢诱导的ros活性(但仅在短时间内如此)的代表性数据。图23b示出了证实lec的ros活性在添加过氧化氢的情况下有所增加但当用1000μm的维生素c处理24小时时保持类似于对照的代表性数据。图23c表明apre
‑
19的ros活性在添加过氧化氢的情况下未改变并且当用1000μm的维生素c处理24小时时未回到正常对照水平。
43.图24示出了证实将维生素c包封在水凝胶或粒子中稍微改善其稳定性的代表性数据。壳聚糖
‑
海藻酸盐
‑
壳聚糖粒子提供了对维生素c的最佳保护。标记物比误差线更大(n=4)。vc:维生素c;pegda:聚(乙二醇)二丙烯酸酯;pegma:聚(乙二醇)甲基丙烯酸酯;ch:壳聚糖;al:海藻酸盐;ge:明胶。
44.图25示出了证实谷胱甘肽(g)以浓度依赖性方式有效改善维生素c剩余持续至少15天的代表性数据。
45.图26示出了证实谷胱甘肽甚至在10000μm的高浓度下也对lec和arpe
‑
19细胞无毒性的代表性数据。
46.本公开的其他优点可部分列于以下描述中,并且由所述描述部分可为显而易见的,或可从本公开的实践中学习。借助于随附权利要求书中特别指出的元素和组合可实现
和达成本公开的优点。应了解,前述一般描述与以下具体实施方式均仅为示例性和说明性的,并且不限制如所要求的公开内容。
具体实施方式
47.受益于前述描述中呈现的教示和相关图式,所公开的组合物和方法所属领域技术人员将想到本文所公开的许多修改型式和其他实施方案。因此,应了解,本公开不限于所公开的特定实施方案并且修改型式和其他实施方案旨在包括在随附权利要求书的范围内。熟练技工将识别本文所描述的方面的许多变化型式和更改型式。这些变化型式和更改型式旨在包括在本公开的教示中并且由本文的权利要求书涵盖。
48.虽然本文采用特定术语,但它们仅以通用和描述性意义使用并且不用于限制的目的。
49.如在阅读本公开后对本领域技术人员来说可为显而易见的,本文描述和说明的个别实施方案中的每一者的离散组分和特征可在不背离本公开的范围或精神的情况下容易地与其他若干实施方案中的任一者的特征分开或组合。
50.任何所叙述的方法均可按所叙述的事件顺序或按逻辑上可能的任何其他顺序来进行。换句话说,除非另外明确陈述,否则本文阐述的任何方法或方面决不旨在被视为要求其步骤按特定顺序进行。因此,在权利要求或描述中未特定地将方法权利要求陈述为步骤限于特定顺序的情况下,决不旨在在任何方面推断出顺序。这适用于用于解释的任何可能的非表述基础,包括关于步骤排列或操作流程的逻辑要素、来源于语法组织或标点的普遍含义或本说明书中描述的方面的数目或类型。
51.本文提到的所有出版物以引用的方式并入本文中以公开和描述与所述出版物结合引用的方法和/或材料。本文所论述的出版物仅仅由于其公开内容在本技术提交日期之前而提供。不应将本文中的任何内容视为承认本发明由于现有发明而无权先于此类出版物。另外,本文所提供的公布日期可不同于实际公布日期,实际公布日期可能需要独立确认。
52.虽然本公开的方面可在特定法定类别(诸如系统法定类别)中进行描述和要求,但这仅是为了方便,并且本领域技术人员将了解,本公开的每个方面可在任何法定类别中进行描述和要求。
53.还应了解,本文所用的术语仅用于描述特定方面的目的并且不旨在具限制性。除非另外定义,否则本文所用的所有技术和科学术语具有与所公开的组合物和方法所属领域技术人员通常所理解相同的含义。还可了解,诸如常用辞典中所定义的那些术语应解释为具有与它们在本说明书和相关领域的情形中的含义一致的含义,并且除非本文明确定义,否则不应在理想化或过度正式的意义上进行解释。
54.在描述本公开的各个方面之前,提供以下定义并且除非另外指出,否则应使用以下定义。其他术语可在本公开中在别处进行定义。
55.定义
56.如本文所用,“包含”应解释为指明在提到时存在所陈述的特征、整体、步骤或组分,但不排除存在或增加一个或多个特征、整体、步骤或组分或它们的组。此外,术语“通过”、“包含(comprising/comprises/comprised of)”、“包括(including/includes/
included)”、“涉及(involving/involves/involved)”以及“诸如”中的每一者以其开放非限制性意义使用并且可互换使用。另外,术语“包含”旨在包括由术语“实质上由
……
组成”和“由
……
组成”涵盖的实例和方面。类似地,术语“实质上由
……
组成”旨在包括由术语“由
……
组成涵盖的实例。
57.如本说明书和随附权利要求书中所用,除非上下文另外明确指示,否则单数形式“一个(或一种)(a/an)”和“所述”包括复数指示物。因此,举例来说,提到“水凝胶”、“hema单体”或“聚合物”包括但不限于两种或更多种此类水凝胶、hema单体或聚合物等。
58.应注意,在本文中可以范围模式表述比率、浓度、量以及其他数值数据。还可了解,各个范围的终点明显既与另一终点有关又独立于另一终点。还应了解,存在许多本文所公开的值,并且每个值在本文中除所述值本身之外还公开为“约”所述特定值。举例来说,如果公开了值“10”,那么也公开了“约10”。范围在本文中可表述为从“约”一个特定值和/或到“约”另一特定值。类似地,当通过使用先行词“约”以近似值来表示值时,可了解特定值形成另一方面。举例来说,如果公开了值“约10”,那么也公开了“10”。
59.当表述范围时,另一方面包括从一个特定值和/或到另一特定值。举例来说,在所陈述的范围包括限值中的一者或两者的情况下,排除包括限值的那些范围中的任一者或两者的范围也包括在本公开中,例如短语“x至y”包括
‘
x’至
‘
y’的范围以及大于
‘
x’并且小于
‘
y’的范围。范围还可以上限表示,例如
‘
约x、y、z或更小’并且应解释为包括
‘
约x’、
‘
约y’以及
‘
约z’的特定范围以及
‘
小于x’、小于y’以及
‘
小于z’的范围。同样地,短语
‘
约x、y、z或更大’应解释为包括
‘
约x’、
‘
约y’以及
‘
约z’的特定范围以及
‘
大于x’、大于y’以及
‘
大于z’的范围。此外,短语“约
‘
x’至
‘
y
’”
(其中
‘
x’和
‘
y’为数值)包括“约
‘
x’至约
‘
y
’”
。
60.应了解,此类范围模式是为方便和简洁而使用,并且因此,应以灵活方式解释为不仅包括明确叙述为范围的限值的数值,而且包括所述范围内涵盖的所有个别数值或子范围,如同明确地叙述每个数值和子范围一般。为了说明,“约0.1%至5%”的数值范围应解释为不仅包括明确叙述的约0.1%至约5%的值,而且包括所指示范围内的个别值(例如约1%、约2%、约3%以及约4%)和子范围(例如约0.5%至约1.1%;约5%至约2.4%;约0.5%至约3.2%以及约0.5%至约4.4%以及其他可能的子范围)。
61.如本文所用,术语“约”、“大致”、“等于或约为”以及“基本上”意味着所讨论的量或值可为精确值或提供与权利要求中所叙述或本文所教示等效的结果或效果的值。换句话说,应了解量、尺寸、表达式、参数以及其他量和特征不为并且不需要为确切的,而是按需要可为接近的和/或更大或更小,从而反映容许量、换算系数、舍入、测量误差等,以及本领域技术人员已知的使得获得等效结果或效果的其他因素。在一些情况下,提供等效结果或效果的值不能合理确定。在此类情况下,通常应了解,除非另外指出或推出,否则如本文所用,“约”和“等于或约为”意指指示
±
10%变化的标称值。一般来说,量、尺寸、表达式、参数或其他量或特征为“约”、“大致”或“等于或约为”,无论是否明确陈述为此类。应了解,除非另外特别陈述,否则在定量值之前使用“约”、“大致”或“等于或约为”的情况下,所述参数还包括特定定量值本身。
62.如本说明书和最终的权利要求中所用,化学物质的残基是指特定反应流程或后续制剂或化学产品中的化学物质的所得产物的部分,与所述部分是否实际上从所述化学物质获得无关。因此,聚酯中的乙二醇残基是指聚酯中的一个或多个
‑
och2ch2o
‑
单元,与乙二醇
ophthalmol.2010,149,32
‑
36)。当前,没有能够局部释放抗氧化剂以预防这些疾病和手术并发症的治疗方法。科学挑战为防止所递送的抗氧化剂发生降解以及维持局部释放。为解决此挑战,本文公开了用于充当药物递送储集器以实现抗氧化剂在眼睛内部的局部化和持续递送的永久性可注射玻璃体替代物的组合物和方法。通过将治疗剂递送至晶状体和其他眼部结构,在玻璃体切除术后可显著改善眼部健康和功能而不依赖于患者依从性。
83.已知玻璃体液的年龄相关变性为视网膜脱离和其他威胁视觉的眼部病变的主要危险因素。视网膜脱离引起视网膜细胞死亡和部分失明;若不快速修复它们会扩散,最终导致完全失明。这通常通过平坦部玻璃体切除术来进行处理,在平坦部玻璃体切除术中将天然玻璃体手术移除并且替换为需要随后在二级手术程序中移除的暂时替代物。此程序的成功常常需要患者脸朝下卧床长达两周以防止视网膜脱离并且在>95%的患者中在两年内导致白内障形成。白内障摘除术为具有附加费用、疼痛以及降低的视敏度的另一手术程序(c.j.siegfried等,invest ophthalmol vis sci.2017,58,4003
‑
4014;brodie fl等,clin ophthalmol,2016 10:955
‑
60;以及chang js,smiddy we,ophthalmology,2014 121(9):1720
‑
6)。
84.已知最常用的长期玻璃体替代物硅酮油引起若干引起失明的眼部疾病和并发症,包括白内障、眼内压(iop)升高(青光眼的一种危险因素)、视网膜变性以及脉络膜厚度降低。硅酮油乳化引起增生性玻璃体视网膜病变、继发性青光眼以及角膜病。硅酮油还使得不可能进行基于超声波的视网膜脱离的诊断。另外,根据视网膜裂孔的位置,患者可能会经受不舒服的手术后定位,从而导致不良依从性和进一步的视网膜脱离。不能依从的患者(常常为年长或残疾的)放弃手术或接受更具侵入性的治疗,诸如巩膜扣带术,从而导致其他并发症(brodie fl等,clin ophthalmol,2016 10:955
‑
60)。因此,必须在若干个月内移除硅酮油,此后眼睛充满液体房水(chang js,smiddy we,ophthalmology,2014 121(9):1720
‑
6)。
85.一个主要挑战为玻璃体切除术本身使得白内障、高眼压以及开角型青光眼的发生率增加(federman jl,schubert hd,ophthalmology,1988 95(7):870
‑
6)。这些疾病是由手术之后玻璃体空腔中的氧含量增加引起的氧化损害引起的。晶状体和周围区域通常为缺氧的,并且需要高浓度的抗坏血酸(维生素c)来消耗氧。在玻璃体切除术之后,因为氧转运增加速率超过了抗坏血酸产生速率,稳态氧梯度被破坏,从而导致白内障和青光眼。移除玻璃体之后房水外流的变化以及对小梁网的氧化损害也可能会引起iop升高,从而导致开角型青光眼(c.j.siegfried等,invest ophthalmol vis sci.2017,58,4003
‑
4014)。这些疾病引起对视觉的严重威胁,并且最近甚至将失明与玻璃体切除术相关联,然而尚未探索替代治疗策略。天然玻璃体的凝胶样性质减慢氧扩散,然而在年龄相关液化病况中,或在移除之后,眼睛中存在增加的氧以及消耗的抗坏血酸水平(n.m.holekamp,am j ophthalmol.2010,149,32
‑
36)。水凝胶玻璃体替代物可通过与用于预防氧化损害的液体或气体替代物相比更有效地阻滞眼内氧转运来缓和这些问题,并且可消除对手术后患者定位的需要。合并抗氧化剂(诸如抗坏血酸)具有进一步缓和氧化损害的潜能,从而潜在地预防由玻璃体切除术引起的白内障或青光眼。
86.另一重要的未解决挑战为没有永久性玻璃体替代物为当前可获得的。自从1994年fda批准硅酮油作为玻璃体替代物以来,没有新的替代物引入市场。存在替换气体和油替代物的重要临床需要,这将移除对手术后定位的需要,减少威胁视觉的并发症,并且消除对用
于替代物移除的二级手术的需要。最大的需要是在次级视网膜脱离的案例中。由于硅酮油和气体比水密度低,再次接近视网膜依赖于患者定位,需要颠倒的患者体位(头朝下)持续长达两周。硅酮油还诱导屈光不正并且增加发展白内障和青光眼的风险(federman jl,schubert hd,ophthalmology,1988 95(7):870
‑
6;以及shah ma等,pak j ophthalmol,2017 33(2):74
‑
8)。
87.当前玻璃体替代物不具有天然玻璃体的粘弹性和物理化学性质。克服此困难将使得能够用满足由天然玻璃体凝胶赋予的性质的玻璃体替代物更好地治疗视网膜脱离。使用水凝胶还具有消除对手术后患者定位的需要的潜能,从而改善患者依从性和视网膜重再附着结果。当前,仅估计18
‑
33%的患者依从手术后定位(brodie fl等,clin ophthalmol,10:955
‑
60,2016),并且一些患者在身体上不能依从。材料的膨胀性质可适合于施加轻微渗透压以在不依赖于患者依从性的情况下再附着视网膜。另外,归因于减少的来自视网膜的对流氧转运,简单地在眼部空腔中具有完整凝胶即可在手术之后帮助保护晶状体(n.m.holekamp,am j ophthalmol.2010,149,32
‑
36)。发展永久性玻璃体替代物将还消除对用于移除的第二手术程序(以及附加费用)的需要(federman jl,schubert hd,ophthalmology,1988 95(7):870
‑
6)。
88.眼科组合物
89.在各个方面中,本公开涉及一种包含所公开的玻璃体替代组合物的眼科组合物,其中玻璃体替代组合物包含具有本文所描述的物理性质的凝胶以及治疗剂。在另一方面中,本公开涉及一种包含所公开的玻璃体替代组合物的眼科组合物,其中玻璃体替代组合物包含具有本文所描述的物理性质的凝胶以及治疗剂,其中治疗剂为所公开的抗氧化剂。
90.玻璃体替代物
91.在各个方面中,本公开提供了一种包含凝胶和至少一种抗氧化剂的玻璃体替代物,其中玻璃体替代物具有基本上模拟人或另一动物的天然玻璃体液的相同性质的物理性质。在一些方面中,通过具有小于1的损耗角正切(例如在约0.1至约0.5范围内的损耗角正切)以及约1.33至约1.34的折射率(例如约1.331至约1.339或约1.334至约1.337的折射率)来定义所公开的玻璃体替代物。在其他实施方案中,通过具有小于约1.4的折射率来定义玻璃体替代物。
92.在一些方面中,所公开的玻璃体替代物可具有约0.1pa至约1000pa,例如约1pa至约100pa的储能模量。在一些方面中,所公开的玻璃体替代物可具有约0.01pa至约1000pa,例如约0.1pa至约100pa或约0.1pa至约50pa的损耗模量。
93.在一些方面中,玻璃体替代物可具有约1.005g/cm3至约1.009g/cm3范围内的密度。
94.在一些方面中,玻璃体替代物在可见光范围内的电磁辐射中具有约75%至约100%的透明度。在一些实施方案中,玻璃体替代物对近红外范围内的电磁辐射来说为至少部分透明的。在一些实施方案中,玻璃体替代物对紫外或红外范围内的电磁辐射来说为至少部分透明的。在一些实施方案中,玻璃体替代物对紫外或红外范围内的电磁辐射来说为不透明的。
95.在一些实施方案中,玻璃体替代物可展示剪切稀化,即在剪切速率情况下显示粘度基本降低。
96.在一些实施方案中,通过在约0.1x106cm2/s至约50x106cm2/s,例如约1x106cm2/s至
约5x106cm2/s或约2x106cm2/s至约4x106cm2/s范围内的扩散速率来定义玻璃体替代物。
97.在一些方面中,如玻璃体替代物中所用的凝胶包括水凝胶。在一些方面中,以玻璃体替代物中所有组分的总重量计,玻璃体替代物具有按重量计大于90%,例如按重量计大于95%的水含量。
98.在各个方面中,所公开的玻璃体替代物包含水凝胶。在一些实施方案中,水凝胶包含聚合物组合物,例如均聚物、共聚物或它们的组合。在一些情况下,水凝胶包含共聚物。在一些方面中,共聚物可在注射后可逆地剪切稀化以重新形成具有与天然玻璃体液类似的光学和机械性质的内聚性水凝胶。在其他实施方案中,可替代地通过其他技术(诸如二硫键合、热转化或自组装)在注射后形成水凝胶。在其他方面中,可就膨胀性质对所公开的水凝胶进行定制。在注射之前,为了改善生物相容性,可经由透析对所公开的水凝胶进行纯化以移除毒性单体。
99.在一些实施方案中,如在所公开的玻璃体替代物中所发现的水凝胶包含一种或多种亲水性聚合物。亲水性聚合物可定义为在水中具有至少0.1wt%溶解度,例如具有至少0.5wt%溶解度的聚合物。在一些实施方案中,亲水性聚合物在水中具有至少1mg/ml的溶解度。
100.在一些实施方案中,聚合物组合物包含一个或多个乙烯醇残基。在一些实施方案中,聚合物组合物包含一个或多个丙烯酰胺残基。在一些实施方案中,聚合物组合物可包含一个或多个选自聚乙二醇衍生物或官能化聚乙二醇的残基。在一些实施方案中,聚合物组合物可包含一个或多个丙烯酸酯残基或一个或多个甲基丙烯酸酯残基。在一些实施方案中,聚合物组合物可包含一个或多个选自以下的残基:丙烯酰胺、n
‑
鸟氨酸丙烯酰胺、n
‑
(2
‑
羟丙基)丙烯酰胺、丙烯酸羟乙酯、甲基丙烯酸羟乙酯、聚乙二醇丙烯酸酯、聚乙二醇甲基丙烯酸酯、n
‑
乙烯基吡咯烷酮、n
‑
苯基丙烯酰胺、二甲氨基丙基甲基丙烯酰胺、丙烯酸、苯甲基甲基丙烯酰胺、甲基硫乙基丙烯酰胺或它们的组合。
101.在一些方面中,所公开的玻璃体替代物为包含共聚物的水凝胶。如本文所描述共聚物可包含来源于hema、pegda和/或pegma的残基。
102.在一些方面中,所公开的水凝胶包含使用以下中的一者或多者制备的聚合物:甲基丙烯酸2
‑
羟乙酯(hema)和/或聚(乙二醇)甲基丙烯酸酯(pegma)。聚合物hema已成功用于眼科装置,诸如隐形眼镜;然而,先前尚未探索hema作为玻璃体替代物,因为它被评估为预成形的非可注射植入物。不希望受特定理论约束,相信将hema与其他亲水性单体或聚合物(诸如pegma)掺混在一起可增加凝胶的透明度和可定制膨胀性质。
103.在其他方面中,所公开的水凝胶包含利用以下单体中的一者或多者制备的共聚物:甲基丙烯酸2
‑
羟乙酯(hema)和/或聚(乙二醇)甲基丙烯酸酯(pegma)。在另一方面中,可利用交联剂(例如聚(乙二醇)二丙烯酸酯(pegda)交联剂)制备共聚物。
104.在另一方面中,可通过hema、pegma以及pegda的自由基聚合制备所公开的水凝胶。简单来说,hema:pegma共聚物水凝胶可在水中聚合并且与pegda交联。使用过硫酸铵和n,n,n
′
,n
′‑
四甲基乙二胺来起始和催化反应。在一个特定方面中,可合成8.5:6.3:1摩尔比的hema:pegma(mw 360):pegda(mw 575)并且产生透明软凝胶,所述透明软凝胶如通过注射之前和之后的储能模量(g')和损耗模量(g")所证实,发生剪切稀化并且容易通过小号针头注射而不损害粘弹性(例如参见实施例2)。在一些情况下,所公开的水凝胶的所公开制备方法
包括如本文在实施例中所描述、如公布的方案(a.zellander等,plos one.2014,9,e96709)中、公布的方案的修改型式中所描述的步骤,包括本文所描述的那些步骤,以及其符合本公开的精神和范围的方法优化型式。
105.在各个方面中,所公开的水凝胶为包含一个或多个pegda残基的聚合物。可使用所描述的方法形成包含含有一个或多个pegda残基的聚合物的所公开的水凝胶,在所描述的方法中使用浓度大于或等于约1wt%并且小于或等于约5wt%的pegda单体进行聚合。在另一方面中,可使用所描述的方法形成包含含有一个或多个pegda残基的聚合物的所公开的水凝胶,在所描述的方法中使用浓度大于或等于约1wt%并且小于或等于约4wt%的pegda单体进行聚合。在另一方面中,可使用所描述的方法形成包含含有一个或多个pegda残基的聚合物的所公开的水凝胶,在所描述的方法中使用浓度大于或等于约1.5wt%并且小于或等于约4wt%的pegda单体进行聚合。在另一方面中,可使用所描述的方法形成包含含有一个或多个pegda残基的聚合物的所公开的水凝胶,在所描述的方法中使用浓度大于或等于约1.5wt%并且小于或等于约3.5wt%的pegda单体进行聚合。在甚至另一方面中,可使用所描述的方法形成包含含有一个或多个pegda残基的聚合物的所公开的水凝胶,在所描述的方法中使用浓度大于或等于约2wt%并且小于或等于约3wt%的pegda单体进行聚合。在其他实施方案中,可使用所描述的方法形成包含含有一个或多个pegda残基的聚合物组合物的所公开的水凝胶,在所描述的方法中使用浓度在约0.5wt%至约10wt%,例如约1wt%至约5wt%范围内的pegda单体进行聚合。
106.在一些实施方案中,一个或多个pedga残基各自可独立地具有约100至约10000的分子量。在一些实施方案中,一个或多个pegda残基各自可具有约100至约1000的分子量。在一些实施方案中,一个或多个pegda残基各自具有约100至约1000、约200至约1000、约300至约1000、约400至约1000、约500至约1000、约600至约1000、约700至约1000、约800至约1000、约900至约1000、约100至约900、约200至约900、约300至约900、约400至约900、约500至约900、约600至约900、约700至约900、约800至约900、约100至约800、约200至约800、约300至约800、约400至约800、约500至约800、约600至约800、约700至约800、约100至约700、约200至约700、约300至约700、约400至约700、约500至约700、约600至约700、约100至约600、约200至约600、约300至约600、约400至约600、约500至约600、约100至约500、约200至约500、约300至约500、约400至约500、约100至约400、约200至约400、约300至约400、约100至300、约200至300或约100至200的分子量。
107.在各个方面中,所公开的水凝胶为包含一个或多个pegma残基的聚合物。可使用所描述的方法形成包含含有一个或多个pegma残基的聚合物的所公开的水凝胶,在所描述的方法中使用浓度大于或等于约3wt%并且小于或等于约8wt%的pegma单体进行聚合。在另一方面中,可使用所描述的方法形成包含含有一个或多个pegma残基的聚合物的所公开的水凝胶,在所描述的方法中使用浓度大于或等于约4wt%并且小于或等于约8wt%的pegma单体进行聚合。在另一方面中,可使用所描述的方法形成包含含有一个或多个pegma残基的聚合物的所公开的水凝胶,在所描述的方法中使用浓度大于或等于约5wt%并且小于或等于约8wt%的pegma单体进行聚合。在另一方面中,可使用所描述的方法形成包含含有一个或多个pegma残基的聚合物的所公开的水凝胶,在所描述的方法中使用浓度大于或等于约5wt%并且小于或等于约7wt%的pegma单体进行聚合。在甚至另一方面中,可使用所描述的
方法形成包含含有一个或多个pegma残基的聚合物的所公开的水凝胶,在所描述的方法中使用浓度大于或等于约5.5wt%并且小于或等于约7.5wt%的pegma单体进行聚合。在另一方面中,可使用所描述的方法形成包含含有一个或多个pegma残基的聚合物的所公开的水凝胶,在所描述的方法中使用浓度大于或等于约6wt%并且小于或等于约7wt%的pegma单体进行聚合。在其他实施方案中,可使用所描述的方法形成包含含有一个或多个pegma残基的聚合物组合物的所公开的水凝胶,在所描述的方法中使用浓度在约0.5wt%至约10wt%,例如约1wt%至约5wt%范围内的pegma单体进行聚合。
108.在一些实施方案中,一个或多个pegma残基可各自独立地具有约100至约8000,例如约100至约4000的分子量。在一些实施方案中,一个或多个pegma残基各自具有约100至约500的分子量。在一些实施方案中,一个或多个pegma残基各自具有约100至约500、约150至约500、约200至约500、约250至约500、约280至约500、约300至约500、约380至约500、约400至约500、约450至约500、约100至约450、约150至约450、约200至约450、约250至约450、约280至约450、约300至约450、约380至约450、约400至约450、约100至约400、约150至约400、约200至约400、约250至约400、约280至约400、约300至约400、约380至约400、约100至约380、约150至约380、约200至约380、约250至约380、约280至约380、约300至约380、约100至约300、约150至约300、约200至约300、约250至约300、约280至约300、约100至约280、约150至约280、约200至约280、约250至约280、约100至约250、约150至约250、约200至约250、约100至200、约150至200或约100至150的分子量。
109.在各个方面中,所公开的水凝胶为包含pegda和pegma残基的共聚物。可使用所描述的方法形成包含含有pegda和pegma残基的聚合物的所公开的水凝胶,在所描述的方法中使用各自浓度大于或等于约2.5wt%并且小于或等于约4wt%的pegda和pegma单体进行聚合。在另一方面中,可使用所描述的方法形成包含含有pegda和pegma残基的聚合物的所公开的水凝胶,在所描述的方法中使用各自浓度大于或等于约3wt%并且小于或等于约3.8wt%的pegda和pegma单体进行聚合。在一些情况下,前述共聚物可包含hema,其中在聚合反应中hema以约0.1wt%至约1.0wt%的浓度存在。
110.在各个方面中,所公开的水凝胶可包含由一个或多个甲基丙烯酸2
‑
羟乙酯(hema)残基和一个或多个丙烯酰胺残基;一个或多个hema残基和一个或多个聚(乙二醇)甲基丙烯酸酯(pegma)残基;一个或多个hema残基和一个或多个甲基丙烯酸残基;一个或多个hema残基和一个或多个聚(乙烯醇)(pva)残基;或一个或多个pva和一个或多个丙烯酰胺残基形成的聚合物。在一些实施方案中,所公开的水凝胶可进一步由二硫化物交联剂(诸如二丙烯酰基胱胺)形成。
111.为了改善生物相容性,可用去离子水对凝胶进行透析。在透析之后,可将制剂注射或冷冻干燥以便在室温下以干燥形式储存。可将冷冻干燥的聚合物在水溶液,包括在生理ph值(包括但不限于约7.4的ph值)下的平衡盐溶液中再水化。在各个方面中,用于再水化的水溶液可包含药学上可接受的缓冲液。对于眼内分析,凝胶可为灭菌的并且将在注射后在眼睛中自组装(uesugi k等,invest ophthalmol vis sci,2017 58(10):4068
‑
75;以及k.e.swindle,p.d.hamilton,n.ravi,j.biomed.mater.res.a.2008,87,656
‑
665)。
112.在各个方面中,本文所公开的水凝胶可在存在或不存在所公开的抗氧化剂的情况下在约15分钟至约72小时的时间内凝胶化。在另一方面中,凝胶时间可为约30分钟至约24
links”antioxidants 2020,9,7,doi:10,3390/antiox901007中可见此类浓度的代表性实例。
121.在另一方面中,硫醇抗氧化剂可选自谷胱甘肽(gsh)、氧化型谷胱甘肽或氧化谷胱甘肽(gssg)、n
‑
乙酰半胱氨酸、硫辛酸、2
‑
氧代
‑
噻唑啶
‑4‑
羧酸、半胱氨酸、谷氨酰基半胱氨酸、乙硫醇、1,4
‑
丁硫醇、2
‑
巯基乙基醚、季戊四醇硫代丙酸酯和乙酸酯、聚乙二醇巯基乙酸酯和甲基巯基乙酸酯、烯丙硫醇、2
‑
巯基乙醇、3
‑
巯基丙醇、4
‑
巯基丁醇、1
‑
硫代甘油、硫代赤藓糖醇、2,3
‑
二巯基丙醇、季戊四醇单(二;三)硫代丙酸酯或乙酸酯、硫代乙醇酸、硫代乙酸、3
‑
巯基丙酸、硫代乳酸、硫代苹果酸、硫代琥珀酸、硫代水杨酸、硫代苯甲酸以及它们的相应水溶性盐、糠基硫醇、2
‑
巯基苯并咪唑、2
‑
巯基苯并噁唑、2
‑
巯基
‑3‑
吡啶酚、二甲氨基丙硫醇、2
‑
巯基乙胺、2
‑
正丁氨基乙硫醇;前述物质的衍生物;以及前述物质的混合物或它们与另一所公开抗氧化剂的组合。
122.在另一方面中,硫醇抗氧化剂可选自n
‑
乙酰半胱氨酸、硫辛酸、2
‑
氧代
‑
噻唑啶
‑4‑
羧酸、半胱氨酸、谷氨酰基半胱氨酸以及它们的混合物。
123.在另一方面中,硫醇抗氧化剂可选自gsh、gsh的眼科上可接受的盐、gssg、gssg的眼科上可接受的盐、它们的前体以及它们的混合物。在另一方面中,硫醇抗氧化剂可选自gsh、gssg、它们的眼科上可接受的盐以及它们的混合物。在另一方面中,硫醇抗氧化剂可选自gsh、gssg以及它们的混合物。在甚至另一方面中,硫醇抗氧化剂包括gsh。
124.在另一方面中,抗氧化剂的眼科上可接受的盐中所包括的眼科上可接受的阴离子包括氯离子、溴离子、碘离子、硫酸根、硫酸氢根、磷酸根、酸式磷酸根、硝酸根、乙酸根、马来酸根、富马酸根、草酸根、乳酸根、酒石酸根、柠檬酸根、葡糖酸根、蔗糖酸根、对甲苯磺酸根等。可用作抗氧化剂的眼科上可接受的衍生物包括酯、酸等。
125.在其他方面中,存在于所公开的玻璃体替代物中的抗氧化剂可为选自以下的剂中的一者或多者:抗坏血酸、抗坏血酸钠、抗坏血酸钾、抗坏血酸钙、抗坏血酸镁、抗坏血酸锌、抗坏血酸与c2至c20直链、分支链、饱和和不饱和脂肪酸的6
‑
o
‑
酯:抗坏血酸6
‑
o
‑
月桂酰酯、抗坏血酸6
‑
o
‑
肉豆蔻酰酯、抗坏血酸6
‑
o
‑
油酰酯、抗坏血酸6
‑
o
‑
棕榈酰酯、抗坏血酸6
‑
o
‑
亚油酰酯、抗坏血酸6
‑
o
‑
硬脂酰酯;抗坏血酸与d或dl
‑
α
‑
生育酚半琥珀酸酯的6
‑
o
‑
酯;抗坏血酸与还原型谷胱甘肽和d或dl
‑
α
‑
生育酚的6
‑
o
‑
酯;还原型谷胱甘肽和还原型谷胱甘肽与d或dl
‑
α
‑
生育酚的谷胱甘肽酯;d和dl
‑
生育酚(α、β、γ、δ异构体)和前述生育酚异构体的乙酸酯、半琥珀酸酯、烟酸酯以及琥珀酸酯
‑
peg酯(tpgs)衍生物;超氧化物歧化酶;β
‑
胡萝卜素;褪黑素;反式白藜芦醇;trolox;辅酶q;过氧化氢酶;各种过氧化物酶;半胱氨酸、半胱氨酸与乙醇的酯、半胱氨酸与乙醇的酯的盐酸盐、半胱氨酸与乙醇的酯的抗坏血酸盐、半胱氨酸与乙醇的酯的d或dl
‑
α
‑
生育酚
‑
半琥珀酸盐、半胱氨酸与d或dl
‑
α
‑
生育酚的酯、n
‑
乙酰半胱氨酸、n
‑
乙酰半胱氨酸的na盐、k盐、ca盐、mg盐、zn盐、n
‑
乙酰半胱氨酸与乙醇或d或dl
‑
α
‑
生育酚的酯;l
‑
肉毒碱;l
‑
肉毒碱乙酸盐;视黄醛;维甲酸;噻吗洛尔;黄体素;甲状腺素;吡咯并喹诺酮;普罗布考;卡托普利;甲碘酸去铁铵mn 3;尿酸;异抗坏血酸和其盐;α
‑
类脂酸;番茄红素;虾青素;玉米黄素;阿魏酸;槲皮素;丁香酚和异丁香酚;前列腺素;拉坦前列素(latanoprost)、比马前列素(bimatoprost)、曲伏前列素(travoprost);(
‑
)
‑
表儿茶素;(
‑
)
‑
表没食子儿茶素没食子酸盐;丁基化羟基甲苯;丁基化羟基茴香醚;rutinal;非瑟酮(fisetin);亚硫酸盐和亚硫酸氢盐(na、k、ca、mg)。在一些实施方案中,抗氧化剂可包括l
‑
抗坏血酸、抗坏血酸6
‑
棕榈酸酯或它们的组合。
126.在一些方面中,存在于所公开的玻璃体替代物中的抗氧化剂可包括出于所有目的以全文引用的方式并入本文中的macan,a.等“therapeutic perspective of vitamin c and its derivatives”antioxidants 2019,8,247,doi:10.3390/antiox8080247中所描述的抗坏血酸衍生物中的一者或多者。
127.在各个方面中,抗氧化剂可以约0.001ng/ml至约100mg/ml;约0.001ng/ml至约10mg/ml;约0.001ng/ml至约1mg/ml;约0.01ng/ml至约100mg/ml;约0.01ng/ml至约10mg/ml;约0.01ng/ml至约1mg/ml;约0.1ng/ml至约100mg/ml;约0.1ng/ml至约10mg/ml;约0.1ng/ml至约1mg/ml;约1ng/ml至约100mg/ml;约1ng/ml至约10mg/ml;或前述范围内的子范围的浓度存在于所公开的玻璃体替代物中。
128.在另一方面中,抗坏血酸或其适合的盐可以约0.001ng/ml至约1mg/ml的浓度存在于所公开的玻璃体替代物中。在另一方面中,抗坏血酸或其适合的盐可以约1μg/ml至约1000μg/ml的浓度存在于所公开的玻璃体替代物中。在另一方面中,抗坏血酸或其适合的盐可以约100μg/ml至约1000μg/ml的浓度存在于所公开的玻璃体替代物中。在甚至另一方面中,抗坏血酸或其适合的盐可以约200μg/ml至约800μg/ml的浓度存在于所公开的玻璃体替代物中。在另一方面中,抗坏血酸或其适合的盐可以约300μg/ml至约700μg/ml的浓度存在于所公开的玻璃体替代物中。在另一方面中,抗坏血酸或其适合的盐或衍生物可以约0.1mm至约5mm,例如0.1mm至约1mm的浓度存在于所公开的玻璃体替代物中。
129.在另一方面中,生育酚或其衍生物可以约0.001ng/ml至约1mg/ml的浓度存在于所公开的玻璃体替代物中。在另一方面中,生育酚或其衍生物可以约1μg/ml至约200μg/ml的浓度存在于所公开的玻璃体替代物中。在另一方面中,生育酚或其衍生物可以约1μg/ml至约100μg/ml的浓度存在于所公开的玻璃体替代物中。在甚至另一方面中,生育酚或其衍生物可以约5μg/ml至约75μg/ml的浓度存在于所公开的玻璃体替代物中。在另一方面中,生育酚或其衍生物可以约5μg/ml至约50μg/ml的浓度存在于所公开的玻璃体替代物中。
130.在另一方面中,谷胱甘肽(例如还原型谷胱甘肽)或其衍生物可以约0.001ng/ml至约1mg/ml的浓度存在于所公开的玻璃体替代物中。在另一方面中,谷胱甘肽(例如还原型谷胱甘肽)或其衍生物可以约1μg/ml至约200μg/ml的浓度存在于所公开的玻璃体替代物中。在另一方面中,谷胱甘肽(例如还原型谷胱甘肽)或其衍生物可以约1μg/ml至约100μg/ml的浓度存在于所公开的玻璃体替代物中。在甚至另一方面中,谷胱甘肽(例如还原型谷胱甘肽)或其衍生物可以约5μg/ml至约75μg/ml的浓度存在于所公开的玻璃体替代物中。在另一方面中,谷胱甘肽(例如还原型谷胱甘肽)或其衍生物可以约5μg/ml至约50μg/ml的浓度存在于所公开的玻璃体替代物中。在一些方面中,谷胱甘肽(例如还原型谷胱甘肽)或其衍生物可以约0.1mm至约100mm、约0.05mm至约10mm、约1mm至约10mm、约2mm至10mm、约2mm至约4mm或约4mm至约10mm的浓度存在于所公开的玻璃体替代物中。在一些方面中,谷胱甘肽(例如还原型谷胱甘肽)或其衍生物可以约1mm、约2mm、约4mm、约10mm或更大的浓度存在于所公开的玻璃体替代物中。
131.在另一方面中,褪黑素或其衍生物可以约0.001ng/ml至约1mg/ml的浓度存在于所公开的玻璃体替代物中。在另一方面中,生育酚或其衍生物可以约1pg/ml至约200pg/ml的浓度存在于所公开的玻璃体替代物中。在另一方面中,生育酚或其衍生物可以约1pg/ml至
约100pg/ml的浓度存在于所公开的玻璃体替代物中。在甚至另一方面中,生育酚或其衍生物可以约5pg/ml至约75pg/ml的浓度存在于所公开的玻璃体替代物中。在另一方面中,生育酚或其衍生物可以约5pg/ml至约50pg/ml的浓度存在于所公开的玻璃体替代物中。
132.在一些方面中,可使用抗坏血酸作为抗氧化剂。抗坏血酸具有若干所需特征。它在玻璃体液中以明显高水平存在(与血液中的50
‑
60μm相比为2mm;参见y.b.shui等,arch ophthalmol.2009,127,475
‑
482)。抗坏血酸溶液具有与在玻璃体中组合发现的所有其他抗氧化剂相同的效应,暗示抗坏血酸的有效抗氧化效应(chen
‑
roetling j等,biochem biophys res commun,2018 503(1):152
‑
6)。它还解释了房水中75%的抗氧化潜能(c.j.siegfried等,invest ophthalmol vis sci.2017,58,4003
‑
4014)。虽然还存在其他影响白内障的因素,但抗坏血酸似乎为可控制、调控晶状体表面的氧以防止白内障的重要组分。
133.为在注射之前保护抗氧化剂并且为控制释放,可将抗坏血酸包封,然后在注射之前与玻璃体替代物掺混(图3)。包封抗坏血酸的纳米粒子可持续释放约0.001mm至约100mm的浓度以复制在玻璃体中发现的水平。本文公开了多重加载抗坏血酸的纳米粒子和水凝胶制剂。包封策略可促成抗氧化剂的快速初始释放,这可为在玻璃体切除术期间和之后立即保护眼组织所需的,随后受控释放以维持抗坏血酸浓度持续约1个月直至眼睛中的抗氧化剂水平通过睫状体得到恢复(sebag j,the vitreous:structure,function,and pathobiology,1989)。
134.在各个方面中,在眼内注射之前可利用包封在快速溶解的天然聚合物(诸如明胶和海藻酸盐)中(lee em等,j nanomat,2014 124:236)来保护和稳定抗氧化剂。或者,为防止抗坏血酸氧化,可将edta合并至所公开的水凝胶组合物中。将edta用于眼用制剂中(rao mvl等,j sci food agricul,1959 10(8):436
‑
41),逆转通过眼部酶(诸如硫氧还蛋白还原酶)进行的氧化(may jm等,j biol chem,1997 272:22607
‑
10),或抗坏血酸视黄醇的稳定化(das n等,eur j pharm sci,201041(5):571
‑
88)。如果抗坏血酸在防止晶状体受到氧化应激方面为无效的,那么可评估其他抗氧化剂,诸如谷胱甘肽,谷胱甘肽在晶状体中为高度浓缩的(wang
‑
su st等,invest ophthalmol vis sci,44:4829
‑
36,2003);或已知保护眼睛健康的维生素a、维生素e或黄体素(chew ey,ophthalmology,2012 119(11):2282
‑
9;以及zhang j等,biomacromolecules,2016 17(11):3648
‑
58)。
135.在各个方面中,可将抗氧化剂包封于粒子(诸如明胶
‑
海藻酸盐纳米粒子)中,所述粒子可使用油包水乳化技术加以修改来制备(lee em等,j nanomat,2014:124236,2014)。简单来说,可将海藻酸盐和明胶以1:2重量比以0.075g/ml溶解于加热的水中,并且可将抗坏血酸添加至溶液中。可将溶液逐滴添加至快速搅拌的玉米油中持续30min。可使粒子在丙酮中沉淀,然后在1%戊二醛中交联以减慢治疗剂释放。然后可使用离心收集粒子并且用蒸馏水洗涤。可通过操纵明胶:海藻酸盐之间的比率、聚合物浓度、交联剂浓度以及抗坏血酸加载来控制药物释放型态和粒度。已合成在200nm至1.5μm尺寸范围内的由壳聚糖、海藻酸盐
‑
壳聚糖、明胶以及明胶
‑
海藻酸盐组成的粒子,所述粒子持续释放若干天至若干周。
136.可通过使用uv
‑
vis光谱在265nm下测量吸光度或使用适当的分析系统(例如可商购获得的试剂盒,诸如可购自sigma
‑
aldrich corporation,st.louis,missouri的抗坏血酸分析试剂盒mak074或抗坏血酸分析试剂盒ii mak075)来证实抗坏血酸加载。可通过在37
℃下在振荡下在磷酸盐缓冲盐水中孵育来评估抗坏血酸从粒子和复合凝胶释放的速率。可在1、6、12以及24小时之后,然后在第3天、第5天、第7天、第14天、第21天以及第28天将洗脱剂移除并且替换为新鲜盐水。代表性数据显示初始爆发释放,随后持续释放至少7天(图4)。
137.在一些方面中,存在于所公开的玻璃体替代物中的抗氧化剂可包括抗坏血酸与谷胱甘肽(例如还原型谷胱甘肽(gsh)或其衍生物)的组合。与其他方法相比,在本文所公开的玻璃体替代物中进一步添加谷胱甘肽与抗坏血酸可改善抗坏血酸的稳定性。在一些方面中,谷胱甘肽(诸如还原型谷胱甘肽(gsh))可以约0.01mm至约100mm、约0.05mm至约10mm、约1mm至约10mm,例如约2mm至约10mm、约4mm至约10mm、约1mm至约4mm、约2mm至约4mm或约4mm至约10mm的浓度与抗坏血酸组合存在于所公开的玻璃体替代物中。在一些方面中,谷胱甘肽(诸如还原型谷胱甘肽(gsh))可以约1mm、约2mm、约3mm、约4mm、约10mm或更大的浓度与抗坏血酸组合存在于所公开的玻璃体替代物中。在一些实施方案中,抗坏血酸或其适合的盐或衍生物可以约0.1mm至约5mm,例如约0.1至约1mm的浓度存在于所公开的玻璃体替代物中(当与谷胱甘肽组合使用时)。在一些实施方案中,抗坏血酸或其适合的盐或衍生物可以约0.1mm、约0.2mm、约0.3mm、约0.4mm、约0.5mm、约0.6mm、约0.7mm、约0.8mm、约0.9mm或更大的浓度存在于所公开的玻璃体替代物中(当与谷胱甘肽组合使用时)。
138.其他治疗剂
139.在一些实施方案中,如本公开中所描述的玻璃体替代物可还包含一种或多种其他治疗剂。
140.如本文所用,“治疗剂”是指一种或多种治疗剂、活性成分或可用于治疗眼睛的医学疾患或癌症的物质。治疗剂为典型地眼科上可接受的并且以当将本文所公开的组合物放置于眼睛中时不引起有害反应的形式提供。如本文中所论述,治疗剂可以生物活性形式从所公开的组合物释放。举例来说,当从系统释放至眼睛中时治疗剂可保留其三维结构。
141.还应了解,如本文所用,术语“治疗剂”包括当向有机体(人或非人动物)施用时通过局部和/或全身性作用诱导所需药理学、免疫原性和/或生理学效应的任何合成或天然存在的物质的生物活性化合物或组合物。因此,所述术语涵盖传统上被认为是药物、疫苗以及生物药物的那些化合物或化学品,包括诸如蛋白质、肽、激素、核酸、基因构建体等分子。在诸如merck index(第14版)、physicians'desk reference(第64版)以及the pharmacological basis of therapeutics(第12版)等熟知参考文献中描述了治疗剂的实例,并且它们包括但不限于药剂;维生素;矿物质补充物;用于治疗、预防、诊断、治愈或缓和疾病或病害的物质;影响身体的结构或功能的物质,或在已放置于生理环境中之后变得具生物活性或活性更大的前药。举例来说,术语“治疗剂”包括用于所有主要治疗区域的化合物或组合物,包括但不限于佐剂;抗感染剂,诸如抗生素和抗病毒剂;止痛剂和止痛剂组合、减食欲剂、消炎剂、抗癫痫剂、局部和全身麻醉剂、安眠药、镇静剂、抗精神病剂、神经安定剂、抗抑郁剂、抗焦虑剂、拮抗剂、神经元阻断剂、抗胆碱能剂和类胆碱作用剂、抗毒蕈碱剂和毒蕈碱剂、抗肾上腺素能药、抗心律失常剂、抗高血压剂、激素以及营养物、抗关节炎药、平喘剂、抗惊厥剂、抗组织胺、止恶心药、抗肿瘤药、止痒剂、退热剂;解痉药、心血管制剂(包括钙离子通道阻断剂、β
‑
阻断剂、β
‑
激动剂以及抗心律失常药)、抗高血压剂、利尿剂、血管扩张剂;中枢神经系统刺激剂;咳嗽和感冒制剂;去充血剂;诊断剂;激素;骨骼生长刺激剂和骨骼吸收抑制剂;免疫抑制剂;肌肉松弛药;精神刺激剂;镇静剂;镇定剂;蛋白质、肽以及
它们的片段(天然存在的、化学合成的或重组产生的);以及核酸分子(两个或更多个核苷酸(核糖核苷酸(rna)或脱氧核糖核苷酸(dna))的聚合形式,包括双链与单链分子、基因构建体、表达载体、反义分子等)、小分子(例如多柔比星)以及其他生物活性大分子,诸如蛋白质和酶。所述剂可为用于医学(包括兽医学)应用和农业(诸如植物)以及其他领域的生物活性剂。术语治疗剂还包括但不限于药剂;维生素;矿物质补充物;用于治疗、预防、诊断、治愈或缓和疾病或病害的物质;或影响身体的结构或功能的物质;或在已放置于预定生理环境中之后变得具生物活性或活性更大的前药。
142.在一些实施方案中,治疗剂可包括可用于治疗眼科病症或眼病的剂,诸如:β
‑
阻断剂,包括噻吗洛尔(timolol)、倍他洛尔(betaxolol)、左旋倍他洛尔以及卡替洛尔(carteolol);缩瞳剂,包括匹鲁卡品(pilocarpine);碳酸酐酶抑制剂;血清素能剂;毒蕈碱;多巴胺能激动剂;肾上腺素能激动剂,包括阿可乐定(apraclonidine)和溴莫尼定(brimonidine);抗血管生成剂;抗感染剂,包括喹诺酮(诸如环丙沙星(ciprofloxacin))和氨基糖苷(诸如妥布霉素(tobramycin)和庆大霉素(gentamicin));非类固醇和类固醇消炎剂,诸如舒洛芬(suprofen)、双氯芬酸(diclofenac)、酮咯酸(ketorolac)、利美索龙(rimexolone)以及四氢皮质醇;生长因子,诸如egf;免疫抑制剂;以及抗过敏性剂,包括奥洛他定(olopatadine);前列腺素,诸如拉坦前列素;15
‑
酮基拉坦前列素;曲伏前列素;以及异丙基乌诺前列酮(unoprostone isopropyl)。
143.在一些实施方案中,治疗剂选自由以下组成的组:消炎剂、钙调磷酸酶抑制剂、抗生素、烟碱乙酰胆碱受体激动剂以及抗淋巴管生成剂。在一些实施方案中,消炎剂可为环孢菌素。在一些实施方案中,钙调磷酸酶抑制剂可为伏环孢素(voclosporin)。在一些实施方案中,抗生素可选自由以下组成的组:阿米卡星(amikacin)、庆大霉素、卡那霉素(kanamycin)、新霉素(neomycin)、奈替米星(netilmicin)、链霉素(streptomycin)、妥布霉素、替考拉宁(teicoplanin)、万古霉素(vancomycin)、阿奇霉素(azithromycin)、克拉霉素(clarithromycin)、地红霉素(dirithromycin)、红霉素(erythromycin)、罗红霉素(roxithromycin)、醋竹桃霉素、阿莫西林(amoxicillin)、安比西林(ampicillin)、阿洛西林(azlocillin)、卡本西林(carbenicillin)、氯唑西林(cloxacillin)、双氯西林(dicloxacillin)、氟氯西林(flucloxacillin)、美洛西林(mezlocillin)、萘夫西林(nafcillin)、青霉素(penicillin)、哌拉西林(piperacillin)、替卡西林(ticarcillin)、杆菌肽素、粘菌素、多粘菌素b、环丙沙星、依诺沙星(enoxacin)、加替沙星(gatifloxacin)、洛氟沙星(levofloxacin)、洛美沙星(lomefloxacin)、莫西沙星(moxifloxacin)、诺氟沙星(norfloxacin)、氧氟沙星(ofloxacin)、曲氟沙星(trovafloxacin)、磺胺米隆(mafenide)、磺乙酰胺、磺胺甲二唑(sulfamethizole)、柳氮磺胺吡啶(sulfasalazine)、磺胺异噁唑、曲美普林(trimethoprim)、复方磺胺甲噁唑(cotrimoxazole)、地美环素(demeclocycline)、多西环素(doxycycline)、米诺环素(minocycline)、氧四环素(oxytetracycline)以及四环素(tetracycline)。在一些实施方案中,烟碱乙酰胆碱受体激动剂可为匹鲁卡品、阿托品(atropine)、烟碱、地棘蛙素、洛贝林(lobeline)或吡虫啉(imidacloprid)中的任一者。在一些实施方案中,抗淋巴管生成剂可为血管内皮生长因子c(vegf
‑
c)抗体、vegf
‑
d抗体或vegf
‑
3抗体。
144.在一些方面中,治疗剂可选自:β
‑
阻断剂,包括左旋布诺洛尔(levobunolol)
(betagan)、噻吗洛尔(betimol、timoptic)、倍他洛尔(betoptic)以及美替洛尔(metipranolol)(optipranolol);α
‑
激动剂,诸如阿可乐定(iopidine)和溴莫尼定(alphagan);碳酸酐酶抑制剂,诸如乙酰唑胺、醋甲唑胺(methazolamide)、多佐胺(dorzolamide)(trusopt)以及布林唑胺(brinzolamide)(azopt);前列腺素或前列腺素类似物,诸如拉坦前列素(xalatan)、比马前列素(lumigan)以及曲伏前列素(travatan);缩瞳剂或胆碱能剂,诸如匹鲁卡品(isopto carpine、pilopine)以及卡巴胆碱(carbachol)(isopto carbachol);肾上腺素化合物,诸如地匹福林(dipivefrin)(propine);弗斯可林(forskolin);或神经保护化合物,诸如溴莫尼定和美金刚(memantine);类固醇衍生物,诸如2
‑
甲氧雌二醇或其类似物或衍生物;或抗生素。
145.术语“vegf”是指诱导血管生成或血管生成过程,包括但不限于增加的渗透性的血管内皮生长因子。如本文所用,术语“vegf”包括通过例如vegf
‑
a/vpf基因的替代剪接产生的vegf(也称为血管渗透因子(vpf)和vegf
‑
a)的各种亚型,包括vegf121、vegf165以及vegf189。另外,如本文所用,术语“vegf”包括通过同源vefg受体(即vegfr)起作用以诱导血管生成或血管生成过程的vegf相关血管生成因子,诸如pigf(胎盘生长因子)、vegf
‑
b、vegf
‑
c、vegf
‑
d以及vegf
‑
e。术语“vegf”包括结合至vegf受体(诸如vegfr
‑
1(flt
‑
1)、vegfr
‑
2(kdr/flk
‑
1)或vegfr
‑
3(flt
‑
4))的生长因子类别的任何成员。术语“vegf”可用于指“vegf”多肽或“vegf”编码基因或核酸。
146.术语“抗vegf剂”是指降低或部分或完全抑制vegf的活性或产生的剂。抗vegf剂可直接或间接降低或抑制特定vegf(诸如vegf165)的活性或产生。此外,“抗vegf剂”包括作用于vegf配位体或其同源受体以便降低或抑制vegf相关受体信号的剂。“抗vegf剂”的非限制性实例包括靶向vegf核酸的反义分子、核酶或rnai;抗vegf适体、针对vegf本身或其受体的抗vegf抗体或防止vegf结合至其同源受体的可溶性vegf受体诱饵;靶向同源vegf受体(vegfr)核酸的反义分子、核酶或rnai;结合至同源vegfr受体的抗vegfr适体或抗vegfr抗体;以及vegfr酪氨酸激酶抑制剂。
147.在一些实施方案中,治疗剂可包括抗vegf剂。抗vegf剂的代表性实例包括雷珠单抗、贝伐单抗、阿柏西普、kh902 vegf受体
‑
fc、融合蛋白、2c3抗体、ora102、哌加他尼(pegaptanib)、贝伐西尼(bevasiranib)、sirna
‑
027、紫花前胡素(decursin)、紫花前胡醇(decursinol)、鬼臼苦素(picropodophyllin)、没药甾酮(guggulsterone)、plg101、类花生酸lxa4、ptk787、帕唑帕尼、阿西替尼、cddo
‑
me、cddo
‑
imm、紫草素、β
‑
羟基异戊酰紫草素、神经节糖苷gm3、dc101抗体、mab25抗体、mab73抗体、4a5抗体、4e10抗体、5f12抗体、va01抗体、bl2抗体、vegf相关蛋白质、sflt01、sflt02、肽b3、tg100801、索拉非尼(sorafenib)、g6
‑
31抗体、融合抗体以及结合至vegf的表位的抗体。可用于本发明方法中的抗vegf剂的其他非限制性实例包括特异性结合于人血管内皮生长因子
‑
a(vegf
‑
a)、人血管内皮生长因子
‑
b(vegf
‑
b)、人血管内皮生长因子
‑
c(vegf
‑
c)、人血管内皮生长因子
‑
d(vegf
‑
d)以及人血管内皮生长因子
‑
e(vegf
‑
e)中的一者或多者的物质以及结合至vegf的表位的抗体。
148.在各个方面中,抗vegf剂为抗体雷珠单抗或其药学上可接受的盐。雷珠单抗以商标lucentis可商购获得。在另一实施方案中,抗vegf剂为抗体贝伐单抗或其药学上可接受的盐。贝伐单抗以商标avastin可商购获得。在另一实施方案中,抗vegf剂为阿柏西普或其药学上可接受的盐。阿柏西普以商标eylea可商购获得。在一个实施方案中,抗vegf剂为哌
加他尼或其药学上可接受的盐。哌加他尼以商标macugen可商购获得。在另一实施方案中,抗vegf剂为结合至vegf的表位,诸如vegf
‑
a、vegf
‑
b、vegf
‑
c、vegf
‑
d或vegf
‑
e的表位的抗体或抗体片段。在一些实施方案中,vegf拮抗剂结合至vegf的表位使得vegf和vegfr的结合受到抑制。在一个实施方案中,表位涵盖所展示的vegf的三维结构的组分,使得表位暴露于折叠的vegf分子的表面。在一个实施方案中,表位为来自vegf的线性氨基酸序列。
149.在各个方面中,治疗剂可包括阻断或抑制vegf介导的活性的剂,例如一种或多种vegf反义核酸。本公开提供了与编码vegf的基因或cdna或其部分反义的包含至少六个核苷酸的核酸的治疗性或预防性用途。如本文所用,vegf“反义”核酸是指能够借助于一定序列互补性杂交至编码vegf的rna(优选mrna)的一部分的核酸。反义核酸可与编码vegf的mrna的编码和/或非编码区域互补。此类反义核酸具有如防止vegf表达的化合物的功效,并且可用于治疗糖尿病。本公开的反义核酸为双链或单链寡核苷酸、rna或dna或其修饰型式或衍生物,并且可直接施用至细胞,或通过外源性的所引入的序列的转录在细胞内产生。
150.vegf反义核酸具有至少六个核苷酸并且优选为在6至约50个寡核苷酸范围内的寡核苷酸。在特定方面中,寡核苷酸为至少10个核苷酸、至少15个核苷酸、至少100个核苷酸或至少200个核苷酸。寡核苷酸可为dna或rna或其嵌合混合物或衍生物或修饰型式并且可为单链或双链的。此外,反义分子可为作为核酸模拟物的聚合物,诸如pna、吗啉基寡核苷酸以及lna。反义分子的其他类型包括短双链rna(称为sirna)和短发夹rna以及长dsrna(>50bp,但通常≧500bp)。
151.在各个方面中,治疗剂可包含被设计成催化裂解编码vegf的基因mrna转录物,从而阻止靶基因mrna的翻译并且因此阻止基因产物的表达的一种或多种核酶分子。
152.核酶为能够催化rna的特异性裂解的酶促rna分子。核酶作用的机制涉及核酶分子序列特异性杂交至互补靶rna,随后为内切核苷酸裂解事件。核酶分子的组合物必须包括与靶基因mrna互补的一个或多个序列并且必须包括负责mrna裂解的熟知催化序列。对于此序列,参见例如美国专利号5,093,246。虽然在位点特异性识别序列处裂解mrna的核酶可用于破坏编码vegf的mrna,但使用锤头状核酶为优选的。锤头状核酶在由与靶mrna形成互补碱基对的侧接区域指示的位置裂解mrna。唯一要求为靶mrna具有以下具有两个碱基的序列:5
′‑
ug
‑3′
。锤头状核酶的构建和制备为本领域中熟知的。本公开的核酶还包括rna内切核糖核酸酶(在下文中为“cech型核酶”),诸如天然存在于嗜热四膜虫(tetrahymena thermophila)中的rna内切核糖核酸酶(称为ivs,或l
‑
19ivs rna)。cech型核酶具有八碱基对活性位点,在发生靶rna裂解之后所述八碱基对活性位点杂交至靶rna序列。本公开涵盖靶向存在于编码vegf的基因中的八碱基对活性位点序列的那些cech型核酶。
153.在其他方面中,治疗剂可包括抑制vegf的抗体,诸如贝伐单抗或雷珠单抗。在其他方面中,治疗剂可包括抑制vegf活性的剂,诸如由vegf刺激的酪氨酸激酶,其实例包括但不限于拉帕替尼、舒尼替尼、索拉非尼、阿西替尼以及帕唑帕尼。
154.术语“抗ras剂”或“抗肾素血管紧张素系统剂”是指降低或部分或完全抑制肾素血管紧张素系统(ras)的分子的活性或产生的剂。“抗ras”或“抗肾素血管紧张素系统”分子的非限制性实例为血管紧张素转化酶(ace)抑制剂、血管紧张素受体阻断剂以及肾素抑制剂中的一者或多者。
155.在一些实施方案中,治疗剂可包括肾素血管紧张素系统(ras)抑制剂。在一些实施
方案中,肾素血管紧张素系统(ras)抑制剂为血管紧张素转化酶(ace)抑制剂、血管紧张素受体阻断剂以及肾素抑制剂中的一者或多者。
156.可用于本发明中的血管紧张素转化酶(ace)抑制剂的非限制性实例包括但不限于:阿拉普利(alacepril)、alatriopril、阿速普利钙(altiopril calcium)、安可维尼(ancovenin)、贝那普利(benazepril)、贝那普利盐酸盐(benazepril hydrochloride)、贝那普利拉(benazeprilat)、贝那普利(benzazepril)、苯甲酰基卡托普利(benzoylcaptopril)、卡托普利(captopril)、卡托普利半胱氨酸、卡托普利谷胱甘肽、施瑞普利(ceranapril)、瑟蓝普利(ceranopril)、西罗普利(ceronapril)、西拉普利(cilazapril)、西拉普利拉(cilazaprilat)、converstatin、地拉普利(delapril)、地拉普利二酸、依那普利(enalapril)、依那普利拉(enalaprilat)、依那吉仑(enalkiren)、依那普利(enapril)、表卡托普利(epicaptopril)、甲羟米辛(foroxymithine)、fosfenopril、福森普利(fosenopril)、福森普利钠、福辛普利(fosinopril)、福辛普利钠、福辛普利拉(fosinoprilat)、福辛普利酸、格里考普利(glycopril)、血啡肽
‑
4(hemorphin
‑
4)、伊曲普利(idapril)、咪达普利(imidapril)、吲哚普利(indolapril)、吲哚普利拉(indolaprilat)、赖苯普利(libenzapril)、赖诺普利(lisinopril)、枸杞环八肽a(lyciumin a)、枸杞环八肽b、密散普利(mixanpril)、莫西普利(moexipril)、莫西普利拉(moexiprilat)、莫维普利(moveltipril)、胞壁色因a(muracein a)、胞壁色因b、胞壁色因c、喷托普利(pentopril)、培哚普利(perindopril)、培哚普利拉(perindoprilat)、匹伏普利(pivalopril)、匹伏普利(pivopril)、喹那普利(quinapril)、喹那普利盐酸盐、喹那普利拉(quinaprilat)、雷米普利(ramipril)、雷米普利拉(ramiprilat)、螺普利(spirapril)、螺普利盐酸盐、螺普利拉(spiraprilat)、spiropril、螺普利盐酸盐、替莫普利(temocapril)、替莫普利盐酸盐、替普罗肽(teprotide)、群多普利(trandolapril)、群多普利拉(trandolaprilat)、乌替普利(utibapril)、扎普利(zabicipril)、扎普利拉(zabiciprilat)、佐芬普利(zofenopril)、佐芬普利拉(zofenoprilat)、其药学上可接受的盐以及它们的混合物。
157.可用于本发明中的血管紧张素受体阻断剂的非限制性实例包括但不限于:艾比沙坦(irbesartan)(以全文引用的方式并入本文中的美国专利号5,270,317)、坎地沙坦(candesartan)(以全文引用的方式并入本文中的美国专利号5,196,444和5,705,517)、缬沙坦(valsartan)(以全文引用的方式并入本文中的美国专利号5,399,578)以及氯沙坦(losartan)(以全文引用的方式并入本文中的美国专利号5,138,069)。
158.可用作治疗剂的肾素抑制剂的非限制性实例包括但不限于:阿利吉仑(aliskiren)、地特吉仑(ditekiren)、依那吉仑、瑞米吉仑(remikiren)、特拉吉仑(terlakiren)、环丙吉仑(ciprokiren)以及扎吉仑(zankiren)、其药学上可接受的盐以及它们的混合物。
159.术语“类固醇”是指属于以下说明性化合物家族或与以下说明性化合物家族有关的化合物:皮质类固醇、矿物类固醇(mineralicosteroid)以及性类固醇(包括例如潜在地雄激素性或雌激素性或抗雄激素性以及抗雌激素性分子)。这些物质中包括例如泼尼松(prednisone)、泼尼松龙(prednisolone)、甲基泼尼松龙、曲安西龙(triamcinolone)、氟新诺龙(fluocinolone)、醛固酮、螺甾内酯、达那唑(danazol)(或者称为optina)以及其他物
质。在一些实施方案中,治疗剂可包括类固醇。
160.术语“过氧化物酶体增殖物激活受体γ剂”或“ppar
‑
γ剂”或“pparg剂”或“ppar
‑
γ剂”是指直接或间接作用于过氧化物酶体增殖物激活受体的剂。此剂还可影响ppar
‑
α“ppara”活性。
161.在一些实施方案中,治疗剂可包括巨噬细胞极化的调节剂。说明性巨噬细胞极化调节剂包括过氧化物酶体增殖物激活受体γ(ppar
‑
g)调节剂包括例如激动剂、部分激动剂、拮抗剂或组合ppar
‑
γ/α激动剂。在一些实施方案中,治疗剂可包括pparγ调节剂,包括作为完全激动剂或部分激动剂的pparγ调节剂。在一些实施方案中,pparγ调节剂为噻唑烷二酮(tzd或格列酮(glitazone))的药物类别的成员。举非限制性实例来说,pparγ调节剂可为罗格列酮(rosiglitazone)(avandia)、吡格列酮(pioglitazone)(actos)、曲格列酮(troglitazone)(rezulin)、萘格列酮(netoglitazone)、利格列酮(rivoglitazone)、噻格列酮(ciglitazone)、罗丹宁(rhodanine)中的一者或多者。在一些实施方案中,pparγ调节剂为艾比沙坦和替米沙坦(telmesartan)中的一者或多者。在一些实施方案中,pparγ调节剂为非类固醇消炎药(nsaid,诸如布洛芬(ibuprofen))或吲哚。已知抑制剂包括实验剂gw
‑
9662。pparγ调节剂的其他实例描述于wipo公布号wo/1999/063983、wo/2001/000579、nat rev immunol.2011年10月25日;11(11):750
‑
61中或为使用wo/2002/068386的方法鉴定的剂,所述出版物的内容以全文引用的方式并入本文中。
162.在一些实施方案中,pparγ调节剂为“双”或“平衡”或“全”ppar调节剂。在一些实施方案中,pparγ调节剂为格列扎(glitazar),格列扎结合两种或更多种ppar同种型,例如莫格列扎(muraglitazar)(pargluva)和替格列扎(tesaglitazar)(galida)以及阿格列扎(aleglitazar)。
163.在一些实施方案中,治疗剂可包括如bianchi等(1995年3月).molecular medicine(cambridge,mass.)1(3):254
‑
266中所描的塞马莫德(semapimod)(cni
‑
1493),所述参考文献的内容以全文引用的方式并入本文中。
164.在一些实施方案中,治疗剂可包括移行抑制因子(mif)抑制剂。wipo公布号wo 2003/104203、wo 2007/070961、wo 2009/117706以及美国专利号7,732,146和7,632,505以及7,294,753 7,294,753中描述了说明性mif抑制剂,所述专利的内容以全文引用的方式并入本文中。在一些实施方案中,mif抑制剂为(s,r)
‑3‑
(4
‑
羟基苯基)
‑
4,5
‑
二氢
‑5‑
异噁唑乙酸甲酯(iso
‑
1)、异噁唑啉、p425(j.biol.chem.,287,30653
‑
30663))、环氧楝树二酮或维生素e。
165.在一些实施方案中,治疗剂可包括如例如美国专利和专利公布号:美国专利号7,799,824、美国专利号8,067,415、us 2007/0197590、us 2006/0069123、us 2006/0058289以及us 2007/0037794中所描述的趋化因子受体2(ccr2)抑制剂,所述专利的内容以全文引用的方式并入本文中。在一些实施方案中,ccr2)抑制剂为马拉韦罗(maraviroc)、赛尼克韦罗(cenicriviroc)、cd192、ccx872、ccx140、2
‑
((异丙基氨基羰基)氨基)
‑
n
‑
(2
‑
((顺
‑2‑
((4
‑
(甲硫基)苯甲酰基)氨基)
‑
环己基)氨基)
‑2‑
氧代乙基)
‑5‑
(三氟甲基)
‑
苯甲酰胺、维立韦罗(vicriviroc)、sch351125、tak779、teijin、rs
‑
504393、化合物2、化合物14或化合物19(plos one 7(3):e32864)。
166.在一些实施方案中,治疗剂可包括调节自噬、微自噬、线粒体自噬或其他形式的自
噬的剂。在一些实施方案中,治疗剂可包括西罗莫司(sirolimus)、他克莫司(tacrolimis)、雷帕霉素(rapamycin)、依维莫司(everolimus)、巴菲霉素(bafilomycin)、氯喹、羟氯喹、spautin
‑
1、二甲双胍、哌立福辛(perifosine)、白藜芦醇、曲古霉素(trichostatin)、丙戊酸、z
‑
vad
‑
fmk或本领域技术人员已知的其他物质。不希望受理论限制,调节自噬、微自噬、线粒体自噬或其他形式的自噬的剂可改变细胞内组分(例如但不限于细胞器、线粒体、内质网、脂质或其他组分)的再循环。另外不希望受理论约束,此剂可能通过或可能不通过微管相关蛋白1a/1b
‑
轻链3(lc3)起作用。
167.在一些实施方案中,治疗剂可包括用于治疗癌症的剂,即癌症药物或抗癌剂。示例性癌症药物可选自给予受试者的抗代谢物抗癌剂和抗有丝分裂抗癌剂以及它们的组合。可将各种抗代谢物和抗有丝分裂抗癌剂(包括单一此类剂或此类剂的组合)用于本文所描述的方法和组合物中。
168.抗代谢抗癌剂典型地在结构上类似于参与癌细胞的正常代谢过程(诸如核酸和蛋白质的合成)的天然代谢产物。然而,抗代谢物与天然代谢产物的不同足以使得它们妨碍癌细胞的代谢过程。在细胞中,抗代谢物被误认为是与它们类似的代谢产物,并且以类似于正常化合物的方式由细胞加工。“诱饵”代谢产物的存在阻止细胞执行生命机能并且细胞不能生长和存活。举例来说,抗代谢物可通过将这些欺骗性核苷酸取代至细胞dna中,由此破坏细胞分裂,或通过抑制关键细胞酶(这阻止dna的复制)来发挥细胞毒性活性。
169.因此,在一个方面中,抗代谢物抗癌剂为核苷酸或核苷酸类似物。在某些方面中,举例来说,在存在或不存在连接的糖部分的情况下,抗代谢物剂可包括嘌呤(例如鸟嘌呤或腺苷)或其类似物,或嘧啶(胞苷或胸苷)或其类似物。
170.适合用于本公开中的抗代谢物抗癌剂可总体上根据它们影响的代谢过程进行归类,并且可包括但不限于叶酸、嘧啶、嘌呤以及胞苷的类似物和衍生物。因此,在一个方面中,一种或多种抗代谢物剂选自由以下组成的组:胞苷类似物、叶酸类似物、嘌呤类似物、嘧啶类似物以及它们的组合。
171.在一个特定方面中,举例来说,抗代谢物剂为胞苷类似物。根据此方面,举例来说,胞苷类似物可选自由以下组成的组:阿糖胞苷(胞嘧啶阿拉伯糖苷)、阿扎胞苷(5
‑
氮杂胞苷)以及它们的盐、类似物以及衍生物。
172.在另一特定方面中,举例来说,抗代谢物剂为叶酸类似物。叶酸类似物或抗叶酸剂通常通过抑制二氢叶酸还原酶(dhfr)(一种参与核苷酸形成的酶)来发挥功能;当此酶被阻断时,不形成核苷酸,从而破坏dna复制和细胞分裂。根据某些方面,举例来说,叶酸类似物可选自由以下组成的组:二甲叶酸、甲氨蝶呤(氨甲蝶呤)、培美曲塞(pemetrexed)、蝶罗呤、雷替曲塞(raltitrexed)、三甲曲沙(trimetrexate)以及它们的盐、类似物以及衍生物。
173.在另一特定方面中,举例来说,抗代谢物剂为嘌呤类似物。基于嘌呤的抗代谢物剂通过抑制dna合成,例如通过干扰含嘌呤核苷酸、腺嘌呤以及鸟嘌呤的制备(这阻止dna合成并且由此阻止细胞分裂)来发挥功能。还可在dna合成期间将嘌呤类似物合并至dna分子本身中,这可妨碍细胞分裂。根据某些方面,举例来说,嘌呤类似物可选自由以下组成的组:阿昔洛韦(acyclovir)、别嘌呤醇、2
‑
氨基腺苷、阿糖腺苷(ara
‑
a)、阿扎胞苷(azacitidine)、硫唑嘌呤(azathiprine)、8
‑
氮杂
‑
腺苷、8
‑
氟
‑
腺苷、8
‑
甲氧基
‑
腺苷、8
‑
氧代
‑
腺苷、克拉屈滨(cladribine)、脱氧柯福霉素(deoxycoformycin)、氟达拉滨(fludarabine)、更昔洛韦
(gancylovir)、8
‑
氮杂
‑
鸟苷、8
‑
氟
‑
鸟苷、8
‑
甲氧基
‑
鸟苷、8
‑
氧代
‑
鸟苷、鸟苷二磷酸、鸟苷二磷酸
‑
β
‑
l
‑2‑
氨基海藻糖、鸟苷二磷酸
‑
d
‑
阿拉伯糖、鸟苷二磷酸
‑2‑
氟代海藻糖、鸟苷二磷酸海藻糖、巯基嘌呤(6
‑
mp)、喷司他汀(pentostatin)、硫咪嘌呤、硫鸟嘌呤(6
‑
tg)以及它们的盐、类似物以及衍生物。
174.在另一特定方面中,举例来说,抗代谢物剂为嘧啶类似物。与上文所论述的嘌呤类似物类似,基于嘧啶的抗代谢物剂阻断含嘧啶核苷酸(dna中的胞嘧啶和胸腺嘧啶;rna中的胞嘧啶和尿嘧啶)的合成。通过充当“诱饵”,基于嘧啶的化合物可阻止核苷酸的制备,和/或可合并至正在生长的dna链中并且导致其终止。根据某些方面,举例来说,嘧啶类似物可选自由以下组成的组:环胞苷、阿扎胞苷、6
‑
氮尿苷、溴尿嘧啶(例如5
‑
溴尿嘧啶)、卡培他滨(capecitabine)、卡莫氟(carmofur)、氯尿嘧啶(例如5
‑
氯尿嘧啶)、阿糖胞苷(胞嘧啶阿拉伯糖苷)、胞嘧啶、双脱氧尿苷、3
′‑
叠氮基
‑3′‑
脱氧胸苷、3
′‑
双脱氧胞苷
‑2′‑
烯、3
′‑
脱氧
‑3′‑
脱氧胸苷
‑2′‑
烯、二氢尿嘧啶、脱氧氟尿苷、依诺他滨(enocitabine)、氟尿苷、5
‑
氟胞嘧啶、2
‑
氟脱氧胞苷、3
‑
氟
‑3′‑
脱氧胸苷、氟尿嘧啶(例如5
‑
氟尿嘧啶(也称为5
‑
fu)、吉西他滨(gemcitabine)、5
‑
甲基胞嘧啶、5
‑
丙炔基胞嘧啶、5
‑
丙炔基胸腺嘧啶、5
‑
丙炔基尿嘧啶、胸腺嘧啶、尿嘧啶、尿苷以及它们的盐、类似物以及衍生物。在一个方面中,嘧啶类似物不为5
‑
氟尿嘧啶。在另一方面中,嘧啶类似物为吉西他滨或其盐。
175.在某些方面中,抗代谢物剂选自由以下组成的组:5
‑
氟尿嘧啶、卡培他滨、6
‑
巯基嘌呤、甲氨蝶呤、吉西他滨、阿糖胞苷、氟达拉滨、培美曲塞以及它们的盐、类似物、衍生物以及组合。在其他方面中,抗代谢物剂选自由以下组成的组:卡培他滨、6
‑
巯基嘌呤、甲氨蝶呤、吉西他滨、阿糖胞苷、氟达拉滨、培美曲塞以及它们的盐、类似物、衍生物以及组合。在一个特定方面中,抗代谢物剂不为5
‑
氟尿嘧啶。在一个特别优选的方面中,抗代谢物剂为吉西他滨或其盐(例如吉西他滨盐酸盐)。
176.其他抗代谢物抗癌剂可选自但不限于由以下组成的组:阿卡西费酸(acanthifolic acid)、氨基噻二唑、布喹那钠(brequinar sodium)、ciba
‑
geigy cgp
‑
30694、环戊基胞嘧啶、阿糖胞苷磷酸盐硬脂酸盐、阿糖胞苷结合物、lilly dathf、merrel dow ddfc、地扎鸟嘌呤(dezaguanine)、双脱氧胞苷、双脱氧鸟苷、戴度克斯(didox)、yoshitomi dmdc、wellcome ehna、merck&co.ex
‑
015、法扎拉滨(fazarabine)、氟达拉滨磷酸盐、n
‑
(2
′‑
呋喃基)
‑5‑
氟尿嘧啶、daiichi seiyaku fo
‑
152、5
‑
fu
‑
纤维蛋白原、异丙基吡咯嗪、lilly ly
‑
188011;lilly ly
‑
264618、莫班明(methobenzaprim)、wellcome mzpes、降亚精胺(norspermidine)、nci nsc
‑
127716、nci nsc
‑
264880、nci nsc
‑
39661、nci nsc
‑
612567、warner
‑
lambert pala、喷司他汀、吡曲克辛(piritrexim)、普卡霉素(plicamycin)、asahi chemical pl
‑
ac、takeda tac
‑
788、噻唑弗林(tiazofurin)、erbamont tif、酪氨酸激酶抑制剂、taiho uft以及尤利西汀(uricytin)等。
177.在一个方面中,抗有丝分裂剂为微管抑制剂或微管稳定剂。一般来说,微管稳定剂(诸如紫杉烷和埃博霉素(epothilones))结合至β
‑
微管链的内部表面,并且通过促进聚合反应的成核和延长阶段并且通过降低微管组装所需的关键微管蛋白亚单元浓度来增强微管组装。不同于阻止微管组装的微管抑制剂(诸如长春花生物碱),微管稳定剂(诸如紫杉烷)减少滞后时间并且显著改变微管蛋白二聚体与微管聚合物之间朝向聚合的动力平衡。因此,在一个方面中,微管稳定剂为紫杉烷或埃博霉素。在另一方面中,微管抑制剂为长春
花生物碱。
178.在一些实施方案中,治疗剂可包括紫杉烷或其衍生物或类似物。紫杉烷可为天然来源的化合物、相关形式,或可为具有抗肿瘤性质的化学合成的化合物或其衍生物。紫杉烷为萜烯家族,包括但不限于帕西他赛(paclitaxel)和多西他赛(docetaxel)萜烯家族主要来源于太平洋紫杉树、短叶紫杉,并且针对某些肿瘤,特别是乳腺和卵巢肿瘤具有活性。在一个方面中,紫杉烷为多西他赛或帕西他赛。帕西他赛为优选紫杉烷并且被视为促进从微管蛋白二聚体组装微管并且通过防止解聚来稳定微管的抗有丝分裂剂。此稳定性引起重要界面和有丝分裂细胞功能所必需的微管网状结构的正常动态再组织的抑制。
179.还包括了多种已知紫杉烷衍生物,包括亲水性衍生物与疏水性衍生物两者。紫杉烷衍生物包括但不限于国际专利申请号wo 99/18113中描述的半乳糖和甘露糖衍生物;wo 99/14209中描述的哌嗪基和其他衍生物;wo 99/09021、wo 98/22451以及美国专利号5,869,680中描述的紫杉烷衍生物;wo 98/28288中描述的6
‑
硫衍生物;美国专利号5,821,263中描述的亚磺酰胺衍生物;脱氧帕西他赛化合物,诸如美国专利号5,440,056中描述的那些脱氧帕西他赛化合物;以及美国专利号5,415,869中描述的紫杉醇衍生物。如上文所提到,还包括帕西他赛的前药,包括但不限于wo 98/58927;wo 98/13059;以及美国专利号5,824,701中描述的那些前药。紫杉烷还可为紫杉烷结合物,诸如帕西他赛
‑
peg、帕西他赛
‑
右旋糖酐、帕西他赛
‑
木糖、多西他赛
‑
peg、多西他赛
‑
右旋糖酐、多西他赛
‑
木糖等。“synthesis and anticancer activity of taxol derivatives,”d.g.i.kingston等,studies in organic chemistry,第26卷,标题为“new trends in natural products chemistry”(1986),atta
‑
ur
‑
rabman,p.w.le quesne编.(elsevier,amsterdam 1986)以及其他参考文献中提到了其他衍生物。这些参考文献中的每一者以全文引用的方式并入本文中。
180.各种紫杉烷可利用本领域技术人员已知的技术容易地制备(还参见wo 94/07882、wo 94/07881、wo 94/07880、wo 94/07876、wo 93/23555、wo 93/10076;美国专利号5,294,637;5,283,253;5,279,949;5,274,137;5,202,448;5,200,534;5,229,529;以及ep 590,267)(所述专利中的每一者以引用的方式并入本文中本文全文),或获自多种商业来源,包括例如sigma
‑
aldrich co.,st.louis,mo。
181.或者,抗有丝分裂剂可为微管抑制剂;在一个优选方面中,微管抑制剂为长春花生物碱。一般来说,长春花生物碱为核纺锤体毒物。在细胞分离之前,在有丝分裂期间当染色体分裂并且开始沿有丝分裂纺锤体的小管朝向其两极中的一者迁移时,长春花生物碱剂起作用。在这些纺锤体毒物作用下,纺锤体因在有丝分裂期间染色体的分散而变得混乱,从而影响细胞繁殖。根据某些方面,举例来说,长春花生物碱选自由以下组成的组:长春花碱、长春新碱、长春地辛(vindesine)、长春瑞滨(vinorelbine)以及它们的盐、类似物以及衍生物。
182.抗有丝分裂剂还可为埃博霉素。一般来说,埃博霉素类别化合物的成员根据类似于紫杉烷的机制稳定微管功能。埃博霉素还可在g2
‑
m过渡阶段引起细胞周期抑制,从而导致细胞毒性和最终的凋亡。适合的埃博霉素包括埃博霉素a、埃博霉素b、埃博霉素c、埃博霉素d、埃博霉素e以及埃博霉素f以及它们的盐、类似物以及衍生物。一种特定埃博霉素类似物为埃博霉素b类似物伊沙匹隆(ixabepilone)(ixempra
tm
)。
183.在某些方面中,抗有丝分裂抗癌剂选自由以下组成的组:紫杉烷、埃博霉素、长春
花生物碱以及它们的盐和组合。因此,举例来说,在一个方面中,抗有丝分裂剂为紫杉烷。更优选地,在此方面中,抗有丝分裂剂为帕西他赛或多西他赛,更优选地为帕西他赛。在另一方面中,抗有丝分裂剂为埃博霉素(例如埃博霉素b类似物)。在另一方面中,抗有丝分裂剂为长春花生物碱。
184.可用于本公开中的癌症药物的实例包括但不限于:沙利度胺(thalidomide);铂配位络合物,诸如顺铂(cisplatin)(cis
‑
ddp)、奥沙利铂(oxaliplatin)以及卡铂(carboplatin);蒽二酮,诸如米托蒽醌(mitoxantrone);取代脲,诸如羟基脲;甲基肼衍生物,诸如丙卡巴肼(procarbazine)(n
‑
甲基肼、mih);肾上腺皮质抑制剂,诸如米托坦(mitotane)(o,p
′‑
ddd)和氨鲁米特(aminoglutethimide);rxr激动剂,诸如蓓萨罗丁(bexarotene);以及酪氨酸激酶抑制剂,诸如舒尼替尼和伊马替尼(imatinib)。其他癌症药物的实例包括烷基化剂、抗代谢物、天然产物、激素以及拮抗剂以及其他剂。括号中指明了替代名称。烷基化剂的实例包括氮芥,诸如二氯甲基二乙胺、环磷酰胺、异环磷酰胺、美法仑(melphalan)沙可来新(sarcolysin))以及氮芥苯丁酸;乙烯亚胺和甲基三聚氰胺,诸如六甲基三聚氰胺和噻替派(thiotepa);烷基磺酸盐,诸如白消安(busulfan);亚硝基脲,诸如卡莫司汀(carmustine)(bcnu)、司莫司汀(semustine)(甲基
‑
ccnu)、洛莫司汀(lomustine)(ccnu)以及链佐星(streptozocin)(链脲佐菌素);dna合成拮抗剂,诸如雌莫司汀磷酸盐(estramustine phosphate);以及三嗪,诸如达卡巴嗪(dacarbazine)(dtic,二甲基
‑
三氮烯基咪唑甲酰胺)以及替莫唑胺(temozolomide)。抗代谢物的实例包括叶酸类似物,诸如甲氨蝶呤(氨甲蝶呤);嘧啶类似物,诸如氟尿嘧啶(5
‑
氟尿嘧啶,5
‑
fu,sfu)、氟尿苷(氟脱氧尿苷,fudr)、阿糖胞苷(胞嘧啶阿拉伯糖苷)以及吉西他滨;嘌呤类似物,诸如巯基嘌呤(6
‑
巯基嘌呤,6
‑
mp)、硫鸟嘌呤(6
‑
硫鸟嘌呤,tg)以及喷司他汀(2
′‑
脱氧柯福霉素、脱氧柯福霉素)、克拉屈滨以及氟达拉滨;以及拓扑异构酶抑制剂,诸如安吖啶(amsacrine)。天然产物的实例包括长春花生物碱,诸如长春花碱(vlb)和长春新碱;紫杉烷,诸如帕西他赛、蛋白质结合帕西他赛(abraxane)以及多西他赛(taxotere);表鬼臼毒素,诸如依托泊苷(etoposide)和替尼泊苷(teniposide);喜树碱,诸如拓扑替康(topotecan)和伊立替康(irinotecan);抗生素,诸如更生霉素(dactinomycin)(放线菌素d)、柔红比星(daunorubicin)(道诺霉素(daunomycin)、红比霉素(rubidomycin))、多柔比星、博来霉素(bleomycin)、丝裂霉素(丝裂霉素c)、伊达比星(idarubicin)、表柔比星(epirubicin);酶,诸如l
‑
天冬酰胺酶;以及生物反应调节物,诸如干扰素α和白细胞介素2。激素和拮抗剂的实例包括促黄体生成激素释放激素激动剂,诸如布舍瑞林(buserelin);肾上腺类固醇,诸如泼尼松和相关制剂;孕酮,诸如羟孕酮己酸盐、甲羟孕酮乙酸盐以及甲地孕酮乙酸盐;雌激素,诸如己烯雌酚和乙炔雌二醇以及相关制剂;雌激素拮抗剂,诸如他莫昔芬(tamoxifen)和阿那曲唑(anastrozole);雄激素,诸如丙酸睾酮和氟甲睾酮以及相关制剂;雄激素拮抗剂,诸如氟他米特(flutamide)和比卡米特(bicalutamide);以及促性腺激素释放激素类似物,诸如亮丙瑞林(leuprolide)。癌症药物的这些和其他实例的替代名称和商标名以及其使用方法(包括给药和施用方案)将为本领域熟练人员已知的。
185.在一些方面中,抗癌剂可包括化学治疗剂。适合的化学治疗剂包括但不限于烷基化剂、抗生素剂、抗代谢剂、激素剂、植物源性剂和它们的合成衍生物、抗血管生成剂、分化诱导剂、细胞生长抑制诱导剂、凋亡诱导剂、细胞毒性剂、影响细胞生物能量学(即影响细胞
atp水平)的剂和调控这些水平的分子/动作、生物剂(例如单克隆抗体、激酶抑制剂以及生长因子和其受体的抑制剂)、基因治疗剂、细胞疗法(例如干细胞)或它们的任何组合。
186.根据这些方面,化学治疗剂选自由以下组成的组:环磷酰胺、氮芥苯丁酸、美法仑、二氯甲基二乙胺、异环磷酰胺、白消安、洛莫司汀、链佐星、替莫唑胺、达卡巴嗪、顺铂、卡铂、奥沙利铂、丙卡巴肼、尿嘧啶氮芥、甲氨蝶呤、培美曲塞、氟达拉滨、阿糖胞苷、氟尿嘧啶、氟尿苷、吉西他滨、卡培他滨、长春花碱、长春新碱、长春瑞滨、依托泊苷、帕西他赛、多西他赛、多柔比星、柔红比星、表柔比星、伊达比星、米托蒽醌、博来霉素、丝裂霉素、羟基脲、拓扑替康、伊立替康、安吖啶、替尼泊苷、埃罗替尼盐酸盐(erlotinib hydrochloride)以及它们的组合。每种可能性代表本发明的一个单独方面。
187.根据某些方面,治疗剂可包括生物药物,特别是抗体。根据一些方面,抗体选自由以下组成的组:西妥昔单抗(cetuximab)、抗cd24抗体、帕尼单抗(panitumumab)以及贝伐单抗。
188.如本公开中所用的治疗剂可包括肽、蛋白质(诸如激素、酶、抗体、单克隆抗体、抗体片段、单克隆抗体片段等)、核酸(诸如适体、sirna、dna、rna、反义核酸等、反义核酸类似物等)、低分子量化合物或高分子量化合物、受体激动剂、受体拮抗剂、部分受体激动剂以及部分受体拮抗剂。
189.其他代表性治疗剂可包括但不限于肽药物、蛋白质药物、脱敏材料、抗原、因子、生长因子、抗感染剂(诸如抗生素、抗微生物剂、抗病毒剂、抗细菌剂、抗寄生虫剂、抗真菌物质以及它们的组合)、抗过敏剂、类固醇、雄激素性类固醇、去充血剂、安眠药、类固醇消炎剂、抗胆碱能剂、拟交感神经药、镇静剂、缩瞳剂、精神激发剂、镇定剂、疫苗、雌激素、促孕剂、体液剂、前列腺素、止痛剂、解痉药、抗疟药、抗组织胺、心脏活性剂、非类固醇消炎剂、抗巴金森症剂(antiparkinsonian agent)、抗阿尔茨海默病剂(anti
‑
alzheimer's agent)、抗高血压剂、β
‑
类肾上腺素阻断剂、α
‑
类肾上腺素阻断剂、营养剂以及苯并菲啶生物碱。治疗剂还可为能够充当刺激剂、镇静剂、安眠药、止痛剂、抗惊厥剂等的物质。
190.其他治疗剂可包括cns活性药物、神经活性药物、炎性和消炎药、肾脏和心血管药物、胃肠道药物、抗赘瘤剂、免疫调节剂、免疫抑制剂、造血剂、生长因子、抗凝剂、血栓溶解剂、抗血小板剂、激素、激素活性剂、激素拮抗剂、维生素、眼用剂、合成剂、抗酸剂、抗哮喘剂、抗胆固醇和抗脂质剂、抗惊厥剂、抗痢疾剂、抗吐剂、抗躁狂剂、抗代谢物剂、抗呕吐剂、抗肥胖剂、解热和止痛剂、抗痉挛剂、抗血栓剂、止咳剂、抗尿酸血症剂、抗心绞痛剂、抗组织胺、食欲抑制剂、生物制剂、脑扩张剂、冠状动脉扩张剂、支气管扩张剂、细胞毒性剂、去充血剂、利尿剂、诊断剂、红血球生成剂、祛痰剂、胃肠道镇静剂、高血糖剂、安眠药、降血糖药、泻药、矿物质补充物、溶粘蛋白剂、神经肌肉药物、周边血管扩张剂、精神病治疗剂、刺激剂、甲状腺和抗甲状腺剂、组织生长剂、子宫松弛药、维生素、抗原材料等。其他类别的治疗剂包括goodman和gilman的the pharmacological basis of therapeutics(mcgraw hill)中列举的那些治疗剂以及merck index和the physicians’desk reference(thompson healthcare)中所包括的治疗剂。
191.其他治疗剂包括雄激素抑制剂、多糖、生长因子(例如血管内皮生长因子
‑
vegf)、激素、抗血管生成因子、右美沙芬(dextromethorphan)、右美沙芬氢溴酸盐、诺斯卡品(noscapine)、喷托维林柠檬酸盐(carbetapentane citrate)、氯苯达诺盐酸盐
(chlophedianol hydrochloride)、氯苯吡胺马来酸盐(chlorpheniramine maleate)、苯茚胺酒石酸盐(phenindamine tartrate)、吡拉明马来酸盐(pyrilamine maleate)、多西拉敏琥珀酸盐(doxylamine succinate)、苯托沙敏柠檬酸盐(phenyltoloxamine citrate)、苯福林盐酸盐(phenylephrine hydrochloride)、盐酸苯丙醇胺、伪麻黄素盐酸盐、麻黄碱、可待因磷酸盐(codeine phosphate)、硫酸可待因吗啡、矿物质补充物、消胆胺(cholestryramine)、n
‑
乙酰普鲁卡因酰胺、对乙酰氨基酚、阿司匹林(aspirin)、布洛芬、苯基丙醇胺盐酸盐、咖啡因、愈创甘油醚、氢氧化铝、氢氧化镁、肽、多肽、蛋白质、氨基酸、激素、干扰素、细胞因子以及疫苗。
192.治疗剂的其他实例包括但不限于肽药物、蛋白质药物、脱敏材料、抗原、抗感染剂(诸如抗生素、抗微生物剂、抗病毒剂、抗细菌剂、抗寄生虫剂、抗真菌物质以及它们的组合)、抗过敏剂、雄激素性类固醇、去充血剂、安眠药、类固醇消炎剂、抗胆碱能剂、拟交感神经药、镇静剂、缩瞳剂、精神激发剂、镇定剂、疫苗、雌激素、促孕剂、体液剂、前列腺素、止痛剂、解痉药、抗疟药、抗组织胺、抗增殖剂、抗vegf剂、心脏活性剂、非类固醇消炎剂、抗巴金森症剂、抗高血压剂、β肾上腺素能阻断剂、营养剂以及苯并菲啶生物碱。所述剂还可为能够充当刺激剂、镇静剂、安眠药、止痛剂、抗惊厥剂等的物质。
193.其他代表性治疗剂包括但不限于止痛剂,诸如对乙酰氨基酚、乙酰水杨酸等;麻醉剂,诸如利多卡因(lidocaine)、赛罗卡因(xylocaine)等;减食欲剂,诸如右甲状腺素(dexadrine)、苯二甲吗啉酒石酸盐等;抗关节炎药,诸如甲基泼尼松龙、布洛芬等;平喘药,诸如特布他林硫酸盐(terbutaline sulfate)、茶碱、麻黄碱等;抗生素,诸如磺胺异噁唑、青霉素g、安比西林(ampicillin)、头孢菌素、阿米卡星(amikacin)、庆大霉素、四环素、氯霉素、红霉素、克林霉素(clindamycin)、异烟肼、利福平(rifampin)等;抗真菌剂,诸如两性霉素b、制霉菌素、酮康唑(ketoconazole)等;抗病毒剂,诸如阿昔洛韦(acyclovir)、阿曼他汀(amantadine)等;抗癌剂,诸如环磷酰胺、甲氨蝶呤、依曲替酯(etretinate)、帕西他赛、紫杉醇等;抗凝剂,诸如肝素、华法林(warfarin)等;抗惊厥剂,诸如苯妥英钠(phenyloin sodium)、地西泮(diazepam)等;抗抑郁剂,诸如异卡波肼(isocarboxazid)、阿莫沙平(amoxapine)等;抗组织胺,诸如苯海拉明盐酸盐(diphenhydramine hcl)、氯苯吡胺马来酸盐等;激素,诸如胰岛素、孕酮、雌激素、类皮质激素、糖皮质素、雄激素等;镇定剂,诸如氯丙嗪(thorazine)、地西泮、氯普马嗪盐酸盐(chlorpromazine hcl)、利血平(reserpine)、氯氮卓盐酸盐(chlordiazepoxide hcl)等;解痉药,诸如颠茄生物碱、双环胺盐酸盐等;维生素和矿物质,诸如必需氨基酸、钙、铁、钾、锌、维生素b12等;心血管剂,诸如哌唑嗪盐酸盐(prazosin hcl)、硝化甘油、普萘洛尔盐酸盐(propranolol hcl)、联胺肼盐酸盐、胰脂肪酶、琥珀酸脱氢酶等;肽和蛋白质,诸如lhrh、生长抑素、降钙素、生长激素、胰高血糖素样肽、生长释放因子、血管紧张素、fsh、egf、骨骼形态发生蛋白(bmp)、红细胞生成素(epo)、干扰素、白细胞介素、胶原蛋白、纤维蛋白原、胰岛素、因子viii、因子ix、素、白细胞介素、胶原蛋白、纤维蛋白原、胰岛素、因子viii、因子ix、α
‑
葡糖苷酶、升压素、acth、人血清白蛋白、γ球蛋白、结构蛋白、血液产物蛋白、复合蛋白、酶、抗体、单克隆抗体等;前列腺素;核酸;碳水化合物;脂肪;麻醉剂,诸如吗啡、可待因等,精神治疗剂;抗疟疾剂、l
‑
多巴(l
‑
dopa)、利尿剂,诸如呋塞米(furosemide)、螺内酯等;抗溃疡药物,诸如雷尼替丁盐酸盐(rantidine hcl)、西咪替丁盐酸盐(cimetidine hcl)等。
194.治疗剂还可为免疫调节剂,包括例如细胞因子、白细胞介素、干扰素、群落刺激因子、肿瘤坏死因子等;免疫抑制剂,诸如雷帕霉素、他克莫司(tacrolimus)等;过敏原,诸如猫毛屑、桦树花粉、室内尘螨、青草花粉等;细菌有机体的抗原,诸如肺炎链球菌、流感嗜血杆菌、金黄葡萄球菌、酿脓链球菌、白喉棒杆菌、单核细胞增多性李斯特菌(listeria monocytogenes)、炭疽杆菌、破伤风杆菌、肉毒杆菌、产气荚膜梭菌、脑膜炎奈瑟氏菌(neisseria meningitides)、淋病奈瑟氏菌、变形链球菌、绿脓杆菌、伤寒沙门氏菌、副流感嗜血杆菌、百日咳博德特氏菌(bordetella pertussis)、土拉弗朗西斯氏菌(francisella tularensis)、鼠疫耶尔森氏菌(yersinia pestis)、霍乱弧菌、嗜肺军团菌、结核分枝杆菌、麻风分枝杆菌、梅毒密螺旋体、钩端螺旋体菌(leptspirosis interrogans)、伯氏疏螺旋体(borrelia burgddorferi)、空肠弯曲杆菌等;诸如天花、流感a和b的病毒、呼吸道融合病毒、副流行性感冒、麻疹、hiv、sars、水痘
‑
带状疱疹、单纯性疱疹1和2、巨细胞病毒(cytomeglavirus)、爱泼斯坦
‑
巴尔(epstein
‑
barr)、轮状病毒、鼻病毒、腺病毒、乳头状瘤病毒、脊髓灰质炎病毒、腮腺炎、狂犬病、风疹、柯萨奇病毒(coxsackieviruse)、马脑炎、日本脑炎、黄热病、里夫特裂谷热(rift valley fever)、淋巴细胞性脉络丛脑膜炎、b型肝炎等的抗原;诸如以下此类真菌、原生动物以及寄生虫有机体的抗原:新型隐球菌、荚膜组织胞浆菌、白色念珠菌、热带念珠菌、星形诺卡氏菌(nocardia asteroids)、立克次氏立克次氏体(rickettsia ricketsii)、斑疹伤寒立克次氏体(rickettsia typhi)、肺炎霉浆菌、鹦鹉热衣原体(chlamydia psittaci)、沙眼衣原体、恶性疟原虫、布氏锥虫(trypanasoma brucei)、溶组织内阿米巴(entamoeba histolytica)、刚地弓形虫(toxoplasma gondii)、阴道毛滴虫、曼氏血吸虫(schistosoma mansoni)等。这些抗原可呈整个灭活有机体、肽、蛋白质、糖蛋白、碳水化合物或它们的组合的形式。
195.在另一特定方面中,治疗剂可包括抗生素。抗生素可为例如以下中的一者或多者:阿米卡星、庆大霉素、卡那霉素、新霉素、奈替米星、链霉素、妥布霉素、巴龙霉素(paromomycin)、安莎霉素(ansamycin)、格尔德霉素(geldanamycin)、除莠霉素、碳头孢烯、氯碳头孢、碳青霉烯、厄他培南(ertapenem)、多利培南(doripenem)、亚胺培南(imipenem)/西司他汀(cilastatin)、美罗培南(meropenem)、头孢菌素(第一代)、头孢羟氨苄、头孢唑啉、头孢噻吩(cefalotin/cefalothin)、头孢氨苄、头孢菌素(第二代)、头孢克洛(cefaclor)、头孢孟多(cefamandole)、头孢西丁(cefoxitin)、头孢罗齐(cefprozil)、头孢呋辛(cefuroxime)、头孢菌素(第三代)、头孢克肟、头孢地尼(cefdinir)、头孢妥仑(cefditoren)、头孢哌酮(cefoperazone)、头孢噻肟、头孢泊肟(cefpodoxime)、头孢他啶(ceftazidime)、头孢布烯(ceftibuten)、头孢唑肟(ceftizoxime)、头孢曲松(ceftriaxone)、头孢菌素(第四代)、头孢吡肟(cefepime)、头孢菌素(第五代)、头孢吡普(ceftobiprole)、糖肽、替考拉宁、万古霉素、大环内酯、阿奇霉素、克拉霉素、地红霉素、红霉素、罗红霉素、醋竹桃霉素、泰利霉素(telithromycin)、状观霉素(spectinomycin)、单菌霉素、氨曲南(aztreonam)、青霉素、阿莫西林、安比西林、阿洛西林、卡本西林、氯唑西林、双氯西林、氟氯西林、美洛西林、甲氧西林(meticillin)、萘夫西林、苯唑西林(oxacillin)、青霉素、哌拉西林、替卡西林、多肽、杆菌肽素、粘菌素、多粘菌素b、喹诺酮、环丙沙星、依诺沙星、加替沙星、洛氟沙星、洛美沙星、莫西沙星、诺氟沙星、氧氟沙星、曲氟沙星、磺酰胺、磺胺米隆、普隆托西(prontosil)(过时)、磺乙酰胺、磺胺甲二唑、磺胺二甲异噁唑
(sulfanilimide)(过时)、柳氮磺胺吡啶、磺胺异噁唑、曲美普林、曲美普林
‑
磺胺甲噁唑(复方磺胺甲噁唑)(tmp
‑
smx)、四环素(包括地美环素、多西环素、米诺环素、氧四环素(oxytetracycline)、四环素以及其他物质);胂凡纳明(arsphenamine)、氯霉素、克林霉素、林可霉素(lincomycin)、乙胺丁醇、磷霉素、夫西地酸(fusidic acid)、呋喃唑酮、异烟肼、利奈唑胺(linezolid)、甲硝唑、莫匹罗星(mupirocin)、硝基呋喃妥英(nitrofurantoin)、平板霉素、吡嗪酰胺、奎奴普汀(quinupristin)/达福普汀(dalfopristin)、利福平(美国的利福平)、替硝唑(timidazole)或它们的组合。在一个方面中,治疗剂可为利福平(美国的利福平)与米诺环素的组合。
196.适合作为治疗剂的生长因子包括但不限于转化生长因子
‑
α(“tgf
‑
α”)、转化生长因子(“tgf
‑
β”)、血小板源性生长因子(“pdgf”)、成纤维细胞生长因子(“fgf”)(包括fgf酸性同种型1和2、fgf碱性形式2以及fgf 4、8、9以及10)、神经生长因子(“ngf”)(包括ngf 2.5s、ngf 7.0s以及βngf)和神经营养素、脑源性神经营养因子、软骨源性因子、骨骼生长因子(bgf)、碱性成纤维细胞生长因子、胰岛素样生长因子(igf)、血管内皮生长因子(vegf)、粒细胞群落刺激因子(g
‑
csf)、胰岛素样生长因子(igf)i和ii、肝细胞生长因子、神经胶质神经营养生长因子(gdnf)、干细胞因子(scf)、角质细胞生长因子(kgf)、转化生长因子(tgf)(包括tgfα、β、β1、β2、β3)、骨骼生长因子、骨基质源性生长因子以及骨骼源性生长因子以及它们的混合物。
197.适合作为治疗剂的细胞因子包括但不限于心肌营养素、基质细胞源性因子、巨噬细胞源性趋化因子(mdc)、黑素瘤生长刺激活性因子(mgsa)、巨噬细胞炎性蛋白1α(mip
‑
1α)、巨噬细胞炎性蛋白2、巨噬细胞炎性蛋白3α、巨噬细胞炎性蛋白3β、巨噬细胞炎性蛋白4以及巨噬细胞炎性蛋白5、il
‑
1、il
‑
2、il
‑
3、il
‑
4、il
‑
5、il
‑
6、il
‑
7、il
‑
8、il
‑
9、il
‑
10、il
‑
11、il
‑
12、il
‑
13、tnf
‑
α以及tnf
‑
β。可用于本公开中的免疫球蛋白包括但不限于igg、iga、igm、igd、ige以及它们的混合物。一些优选生长因子包括vegf(血管内皮生长因子)、ngf(神经生长因子)、pdgf
‑
aa、pdgf
‑
bb、pdgf
‑
ab、fgfb、fgfa以及bgf。
198.可用作治疗剂的其他分子包括但不限于生长激素、瘦素、白血病抑制因子(lif)、肿瘤坏死因子α和β、内皮抑素、血小板反应蛋白、成骨蛋白
‑
1、骨形态发生蛋白2和7、骨粘连蛋白、生长调节素样肽、骨钙素、干扰素α、干扰素αa、干扰素β、干扰素γ、干扰素1α以及白细胞介素2、3、4、5、6、7、8、9、10、11、12、13、15、16、17以及18。
199.使用所公开的玻璃体替代物的方法
200.在各个方面中,可使用所公开的玻璃体替代物来治疗眼睛的临床疾患、病症或疾病,即眼科病症,其中所述临床疾患、病症或疾病与不希望的反应性氧物质水平和/或氧不平衡相关,例如与健康受试者相比诸如在玻璃体切除程序之后在眼睛中所发现的氧含量较高。
[0201]“施用”包含本公开的抗氧化剂的所公开的玻璃体替代物可通过熟练技工已知的任何手段来实现。将液体制剂注射至眼睛中经由具有适合规格的注射针头(诸如相对小号的针头,包括但不限于21号、25号、27号、28号、30号、31号或更小号)来实现。固体植入物可经由套管针、针头套管针或本领域中已知的其他方法来施用。参见例如美国专利号7,906,136;美国专利号5,869,079;美国专利号7,625,582。如美国专利号6,699,493;美国专利号6,726,918;美国专利号6,331,313;美国专利号5,824,072;美国专利号5,766,242;美国专
利号5,443,505;美国专利号5,164,188;美国专利号4,997,652;美国专利号4,853,224中所描述,手术植入至眼睛中为本领域中已知的。
[0202]
因此,本公开涉及治疗眼科病症的方法,所述方法包括将所公开的玻璃体替代物施用至有需要的眼睛。在一些方面中,眼睛为存在于人受试者中的眼睛。在其他方面中,眼睛存在于非人受试者中。
[0203]
眼科病症可为急性黄斑神经视网膜病变;白塞氏病(behcet'sdisease);新血管形成,包括脉络膜新血管形成;糖尿病性葡萄膜炎;组织胞浆菌病;感染,诸如真菌或病毒引起的感染;黄斑变性,诸如急性黄斑变性(amd),包括湿性amd、非渗出性amd以及渗出性amd;水肿,诸如黄斑水肿、囊样黄斑水肿以及糖尿病性黄斑水肿;多灶性脉络膜炎;影响后部眼部位点或位置的眼外伤;眼部肿瘤;视网膜病症,诸如视网膜中央静脉阻塞、糖尿病性视网膜病变(包括增生性糖尿病性视网膜病变)、增生性玻璃体视网膜病变(pvr)、视网膜动脉阻塞性疾病、视网膜脱离、葡萄膜炎性视网膜疾病;交感性眼炎;伏格特小柳
‑
原田(vkh)综合征;葡萄膜扩散;由眼部激光治疗引起或受其影响的后部眼部病状;由光动力疗法、光凝术引起或受其影响的后部眼部病状、辐射性视网膜病变、视网膜前膜病症、视网膜分支静脉阻塞、前部缺血性视神经病变、非视网膜病变糖尿病性视网膜功能障碍、色素性视网膜炎、癌症以及青光眼。在某些情况下,眼科病症为湿性年龄相关性黄斑变性(湿性amd)、癌症、新血管形成、黄斑水肿或水肿。在另一特定方面中,眼科病症为湿性年龄相关性黄斑变性(湿性amd)。
[0204]
在各个方面中,为治疗眼科病症而进行注射可为注射至眼睛的玻璃体腔。在一些情况下,注射为玻璃体内注射、结膜下注射、特农囊下注射、眼球后注射或脉络膜上腔注射。
[0205]“眼部区域”或“眼部位点”意指眼球(眼珠)的任何区域,包括眼睛的前段和后段,并且通常包括但不限于存在于眼珠中的任何功能性(例如用于视觉)或结构性组织,或部分或完全位衬于眼珠内部或外部的组织或细胞层。眼部区域中眼珠的区域的特定实例包括但不限于前房、后房、玻璃体空腔、脉络膜、脉络膜上空间、结膜、结膜下空间、巩膜上空间、角膜内空间、视网膜下空间、亚特农氏囊下空间、角膜上空间、巩膜、平坦部、手术诱导的无血管区域、黄斑以及视网膜。
[0206]“眼科病症”可意指影响或累及眼睛或眼睛的部分或区域中的一者的疾病、病痛或疾患。概括地讲,眼睛包括眼珠(包括角膜)以及构成眼珠的其他组织和流体、眼周肌肉(诸如斜肌和直肌)以及眼珠内或眼珠附近的视神经的一部分。
[0207]“青光眼”意指原发性、继发性和/或先天性青光眼。原发性青光眼可包括开角型和闭角型青光眼。继发性青光眼可作为多种其他疾患(诸如损伤、炎症、色素分散、血管病以及糖尿病)的并发症存在。青光眼的压力增加引起失明,因为它在视神经进入眼睛处对视神经构成损害。因此,在一个非限制性实施方案中,通过降低反应性氧物质stc
‑
1或代表增加量的stc
‑
1的msc可用于治疗青光眼并且预防或延迟失明发作。
[0208]
与眼部病状有关的“炎症介导的”意指可受益于用消炎剂治疗的任何眼部疾患,并且意指包括但不限于葡萄膜炎、黄斑水肿、急性黄斑变性、视网膜脱离、眼部肿瘤、真菌或病毒感染、多灶性脉络膜炎、糖尿病性视网膜病变、葡萄膜炎、增生性玻璃体视网膜病变(pvr)、交感性眼炎、伏格特
‑
小柳
‑
原田(vkh)综合征、组织胞浆菌病以及葡萄膜扩散。
[0209]
与眼部病状有关的“损伤”或“损害”为可互换的并且指由炎性介导的疾患(诸如炎症)引起的细胞和形态学表现和症状以及由除炎症外的手段引起的组织损伤(诸如化学损
伤,包括化学灼伤)以及由感染(包括但不限于细菌、病毒或真菌感染)引起的损伤。
[0210]“眼内”意指在眼组织内或在眼组织下。眼内施用药物递送系统包括将药物递送系统施用至特农氏囊下、结膜下、脉络膜上、视网膜下、玻璃体内、前房以及类似位置。眼内施用药物递送系统排除将药物递送系统施用至表面、全身、肌肉内、皮下、腹膜内以及类似位置。
[0211]“黄斑变性”是指黄斑发生变性或损失功能活性的许多病症和疾患中的任一者。变性或功能活性损失可因例如细胞死亡、细胞增殖降低、正常生物功能损失或前述各项的组合而产生。黄斑变性可导致和/或表现为黄斑的细胞和/或细胞外基质的结构完整性的改变、正常细胞和/或细胞外基质架构的改变和/或黄斑细胞的功能损失。细胞可为通常存在于黄斑中或黄斑附近的任何细胞类型,包括rpe细胞、光感受器以及毛细血管内皮细胞。年龄相关性黄斑变性或armd为主要黄斑变性相关疾患,但许多其他黄斑变性相关疾患为已知的,包括但不限于贝斯特黄斑营养不良(best macular dystrophy)、斯塔加特黄斑营养不良(stargardt macular dystrophy)、索斯比眼底营养不良(sorsby fundus dystrophy)、mallatia leventinese、多恩蜂窝状视网膜营养不良(doyne honeycomb retinal dystrophy)以及rpe模式营养不良。年龄相关性黄斑变性(amd)被描述为“干性”或“湿性”。湿性渗出性新生血管形式的amd影响患有amd的那些患者中的约10
‑
20%,并且特征为视网膜色素上皮细胞(rpe)下或视网膜色素上皮细胞中的异常血管生长,导致出血、渗出、瘢痕化或浆液性视网膜脱离。百分之八十至九十的amd患者具有以视网膜色素上皮细胞萎缩和黄斑光感受器损失为特征的干性形式。脉络膜小疣可能存在或可能不存在于黄斑中。还可能会存在黄斑中解释视力下降的视网膜色素上皮细胞的区域萎缩。目前没有针对任何形式的amd的治疗手段,不过在减轻湿性amd中已使用光动力学疗法以及特别是抗vegf疗法获得了一些成功。
[0212]“脉络膜小疣”为rpe下方随年龄增长而聚集的碎屑样物质。使用眼底镜眼部检查来观测脉络膜小疣。正常眼睛可具有不含脉络膜小疣的黄斑,然而在视网膜外周脉络膜小疣可能很丰富。在不存在任何黄斑视觉损失的情况下,黄斑中存在软脉络膜小疣被视为amd的早期阶段。脉络膜小疣含有多种脂质、多糖和糖胺聚糖以及若干蛋白质、改性蛋白质或蛋白质加合物。不存在普遍接受的解决脉络膜小疣形成并且由此管理amd的进展性的治疗方法。
[0213]“眼部新血管形成”(onv)在本文中用于指脉络膜新血管形成或视网膜新血管形成,或两者。
[0214]“视网膜新血管形成”(rnv)是指例如在视网膜表面上视网膜血管的异常发育、增殖和/或生长。
[0215]“视网膜下新血管形成”(srnvm)是指视网膜表面下方血管的异常发育、增殖和/或生长。
[0216]“角膜”是指形成眼睛纤维膜的前部部分的透明结构。它由五个层组成,这五个层具体地说为:1)与结膜相连的前部角膜上皮;2)前界层(鲍曼氏层(bowman's layer));3)固有质或基质层;4)后界层(德斯密氏膜(descemet's membrane));以及5)前房或皮肤角质层的内皮。
[0217]“视网膜”是指包围玻璃体并且后部与视神经相连的眼球最内层。视网膜由包括以
下的层组成:1)内界膜;2)神经纤维层;3)神经节细胞层;4)内网状层;5)内核层;6)外网状层;7)外核层;8)外界膜;以及9)视杆视锥层。
[0218]“视网膜变性”是指视网膜和/或视网膜色素上皮细胞的任何遗传性或获得性变性。非限制性实例包括色素性视网膜炎、贝斯特氏病(best's disease)、rpe模式营养不良以及年龄相关性黄斑变性。
[0219]
在各个方面中,治疗眼科病症的方法可包括治疗各种眼部视网膜疾病或疾患,包括以下疾病:黄斑病变/视网膜变性:黄斑变性,包括年龄相关性黄斑变性(armd),诸如非渗出性年龄相关性黄斑变性和渗出性年龄相关性黄斑变性;脉络膜新血管形成;视网膜病变,包括糖尿病性视网膜病变、急性和慢性黄斑神经视网膜病变、中心性浆液性脉络膜视网膜病变;以及黄斑水肿,包括囊样黄斑水肿和糖尿病性黄斑水肿。葡萄膜炎/视网膜炎/脉络膜炎:急性多灶性鳞状色素上皮病变、白塞氏病、鸟枪弹样视网膜脉络膜病变、感染性(梅毒、莱姆病(lyme disease)、结核病、弓形体病)、葡萄膜炎(包括中间葡萄膜炎(睫状体平坦部炎)和前葡萄膜炎)、多灶性脉络膜炎、多发性一过性白点综合征(mewds)、眼结节病、后巩膜炎、匐行性脉络膜炎、视网膜下纤维化、葡萄膜炎综合征以及伏格特
‑
小柳
‑
原田综合征。血管疾病/渗出性疾病:视网膜动脉阻塞性疾病、视网膜中央静脉阻塞、弥散性血管内凝血病、视网膜分支静脉阻塞、高血压眼底改变、眼缺血综合征、视网膜动脉微动脉瘤、寇茨氏病(coats disease)、旁中心凹毛细血管扩张、半侧性视网膜静脉阻塞、视乳头静脉炎、视网膜中央动脉阻塞、视网膜分支动脉阻塞、颈动脉疾病(cad)、霜样树枝状视网膜血管炎、镰状细胞视网膜病变和其他血红蛋白病变、血管样条纹、家族性渗出性玻璃体视网膜病变、伊尔斯氏病(eales disease),外伤/手术疾病:交感性眼炎、葡萄膜炎性视网膜疾病、视网膜脱离、外伤、激光、pdt、光凝术、手术期间灌注不足、辐射性视网膜病变、骨髓移植视网膜病变。增生性病症:增生性玻璃体视网膜病变和视网膜前膜、增生性糖尿病性视网膜病变。感染性病症:眼组织胞浆菌病、眼弓蛔虫病、眼组织胞浆菌病综合征(ohs)、眼内炎、弓形体病、与hiv感染相关的视网膜疾病、与hiv感染相关的脉络膜疾病、与hiv感染相关的葡萄膜炎性疾病、病毒视网膜炎、急性视网膜坏死、进行性外部视网膜坏死、真菌视网膜疾病、眼梅毒、眼结核病、弥漫性单侧亚急性视神经视网膜炎以及蝇蛆病。遗传性病症:色素性视网膜炎、具有相关视网膜营养不良的全身性病症、先天性静止性夜盲、视锥细胞营养不良、斯塔加特氏病和眼底黄色斑点症、贝斯特氏病、视网膜色素上皮细胞的模式营养不良、x连锁视网膜劈裂、索斯比氏眼底营养不良、良性同心黄斑病变、别蒂氏结晶营养不良(bietti's crystalline dystrophy)、弹性纤维性假黄瘤。视网膜裂孔/裂洞:视网膜脱离、黄斑裂洞、巨大视网膜裂孔。肿瘤:与肿瘤相关的视网膜疾病、先天性rpe肥厚、后葡萄膜黑素瘤、脉络膜血管瘤、脉络膜骨瘤、脉络膜转移、视网膜和视网膜色素上皮细胞组合错构瘤、成视网膜细胞瘤、眼底血管增生肿瘤、视网膜星形细胞瘤、眼内淋巴瘤。其他:点状内层脉络膜病变、急性后部多灶性鳞状色素上皮病变、近视性视网膜变性、急性视网膜色素上皮炎等。
[0220]
前部眼部病状为影响或累及前部(即在眼睛前面)眼部区域或位点,诸如眼周肌肉、眼睑或定位在晶状体囊或睫状肌的后壁之前的眼珠组织或流体的疾病、病痛或疾患。因此,前部眼部病状主要影响或累及结膜、角膜、前房、虹膜、后房(在虹膜后面但在晶状体囊后壁的前面)、晶状体或晶状体囊以及使前部眼部区域或位点血管化或支配前部眼部区域或位点的血管和神经。
[0221]
因此,前部眼部病状可包括诸如以下的疾病、病痛或疾患:无晶状体;假晶状体;散光;眼睑痉挛;白内障;结膜疾病;结膜炎,包括但不限于特应性角膜结膜炎;角膜损伤,包括但不限于,对角膜基质区域的损伤;角膜疾病;角膜溃疡;干眼综合征;眼睑疾病;泪器疾病;泪管阻塞;近视;老花眼;瞳孔病症;屈光性病症以及斜视。青光眼也可被视为前部眼部病状,因为青光眼治疗的临床目标可为降低眼睛前房中的水性流体的高血压(即降低眼内压)。
[0222]
可根据本发明治疗的眼睛的其他疾病或病症包括但不限于眼瘢痕性类天疱疮(ocp)、史蒂文斯约翰逊综合征(stevens johnson syndrome)以及白内障。
[0223]
后部眼部病状为主要影响或累及后部眼部区域或位点,诸如脉络膜或巩膜(在穿过晶状体囊后壁的平面后部的位置)、玻璃体、玻璃体腔、视网膜、视神经(即视盘)以及使后部眼部区域或位点血管化或支配后部眼部区域或位点的血管和神经的疾病、病痛或疾患。因此,后部眼部病状可包括诸如以下的疾病、病痛或疾患:急性黄斑神经视网膜病变;白塞氏病;脉络膜新血管形成;糖尿病性视网膜病变;葡萄膜炎;眼组织胞浆菌病;感染,诸如真菌或病毒引起的感染;黄斑变性,诸如急性黄斑变性、非渗出性年龄相关性黄斑变性以及渗出性年龄相关性黄斑变性;水肿,诸如黄斑水肿、囊样黄斑水肿以及糖尿病性黄斑水肿;多灶性脉络膜炎;影响后部眼部位点或位置的眼外伤;眼肿瘤;视网膜病症,诸如视网膜中央静脉阻塞、糖尿病性视网膜病变(包括增生性糖尿病性视网膜病变)、增生性玻璃体视网膜病变(pvr)、视网膜动脉或静脉闭塞性疾病、视网膜脱离、葡萄膜炎性视网膜疾病;交感性眼炎;伏格特
‑
小柳
‑
原田(vkh)综合征;葡萄膜扩散;由眼部激光治疗引起或受其影响的后部眼部病状;由光动力疗法、光凝术引起或受其影响的后部眼部病状、辐射性视网膜病变、视网膜前膜病症、视网膜分支静脉阻塞、前部缺血性视神经病变、非视网膜病变糖尿病性视网膜功能障碍、色素性视网膜炎以及青光眼。青光眼可被视为后部眼部病状,因为治疗目标为防止归因于视网膜神经节细胞或视网膜神经纤维的损害或损失的视觉损失或减少视觉损失发生(即神经保护)。
[0224]
在一些实施方案中,眼部病症为由例如虹膜炎、结膜炎、季节性过敏性结膜炎、急性和慢性眼内炎、前葡萄膜炎、与全身性疾病相关的葡萄膜炎、后段葡萄膜炎、脉络膜视网膜炎、睫状体平坦部炎、伪装综合征(包括眼淋巴瘤)、类天疱疮、巩膜炎、角膜炎、重度眼过敏反应、角膜擦伤以及血房水屏障破坏引起的眼部炎症。在另一实施方案中,眼部病症为由例如屈光性角膜切除术、白内障移除手术、人工晶状体移植、玻璃体切除术、角膜移植、多种形式的薄层角膜切除术(dsek等)以及放射状角膜切除术引起的手术后眼部炎症。
[0225]
在特定实施方案中,可将所公开的玻璃体替代物用于治疗视网膜裂孔。在其他实施方案中,可将所公开的玻璃体替代物用于治疗增生性视网膜病变。
[0226]
在另一方面中,所述方法为玻璃体切除术的辅助疗法。换句话说,本公开涉及治疗眼科病症的方法,所述方法包括在玻璃体切除术之后将所公开的玻璃体替代物施用至眼睛。
[0227]
由前述内容,可看出本文的方面非常适合于达到上文与显而易见并且为结构所固有的其他优点一起阐述的所有目的和目标。
[0228]
虽然对特定元件和步骤彼此结合进行了论述,但应了解,本文所提供的任何元件和/或步骤被考虑为可与任何其他元件和/或步骤组合,与是否明确提供所述元件和/或步
骤无关,同时仍在本文所提供的范围内。
[0229]
可了解,某些特征和子组合具有功效并且可在不提到其他特征和子组合的情况下采用。这由权利要求书涵盖并且在权利要求书的范围内。
[0230]
由于可在不背离范围的情况下进行许多可能的方面,应了解,本文在随附图式和具体实施方式中阐述或示出的所有主题应解释为说明性的并且不具限制意义。
[0231]
还应了解,本文所用的术语仅用于描述特定方面的目的,并且不旨在具限制性。熟练技工将识别本文所描述的方面的许多变化型式和更改型式。这些变化型式和更改型式旨在包括在本公开的教示中并且由本文的权利要求书涵盖。
[0232]
现已总体上描述了本公开的方面,以下实施例描述了本公开的一些其他方面。虽然结合以下实施例和对应文本和图式描述了本公开的方面,但不意欲将本公开的方面限于此描述。相反地,意欲涵盖本公开的精神和范围内所包括的所有替代、修改以及等效型式。
[0233]
实施例
[0234]
提出以下实施例,以便为本领域一般技术人员提供如何制备和评估本文所要求的化合物、组合物、物品、装置和/或方法的完整公开和描述,并且旨在单纯地例示本公开,并且不旨在限制本发明人视为其公开内容的范围。已努力确保关于数字(例如量、温度等)的准确性,但应考虑一些误差和偏差。除非另外指示,否则部分为重量份,温度为℃或等于周围温度,并且压力等于或接近大气压。
[0235]
实施例1.聚(hema
‑
共
‑
bac)/pva水凝胶作为玻璃体替代物.
[0236]
在pva溶液中使用bac使hema交联。经由使用过硫酸铵作为催化剂并且四甲基乙二胺作为加速剂进行自由基聚合来合成含有含不同百分比的hema和pva(按重量计100%hema至100%pva)以及bac(相对于hema 1
‑
5%摩尔比)的水/乙醇的组合物。使用组织磨碎器将凝胶均质化并且在剧烈搅拌和n2鼓泡下使用1,4
‑
二硫苏糖醇(dtt)(相对于交联剂bac 10倍摩尔比)还原成液体。将还原的凝胶调节至ph 4,并且使用透析管在蒸馏水中洗涤(ph 4,n2鼓泡,20倍凝胶体积)3天以移除未反应的单体。使透析的聚合物溶液在10倍过量体积的甲醇中沉淀。将沉淀物冻干24小时。在37℃下将冷冻干燥的聚合物在杜尔贝科氏磷酸盐缓冲盐水中复原并且在增湿的腔室中氧化以重新形成水凝胶。
[0237]
图1示出了合成原位凝胶聚(hema
‑
共
‑
bac)/pva水凝胶的过程。在存在pva的情况下使hema和bac共聚合之后,使用dtt将水凝胶还原为液体。二硫化物交联允许水凝胶液化以便彻底纯化以及通过小号针头注射。此半互相渗透水凝胶类似于天然玻璃体液的微观结构,其中交联的聚(hema
‑
共
‑
bac)充当刚性胶原蛋白样纤维网状结构,并且分散于聚(hema
‑
共
‑
bac)网状结构中的亲水性pva聚合物链模拟天然玻璃体液中的膨胀透明质酸分子,从而提供使眼壁后房膨胀的填塞效应。此可注射水凝胶使用简单,其使用可无缝整合至当前手术玻璃体切除术程序中。
[0238]
实施例2.代表性所公开水凝胶的制备.
[0239]
根据对所公布方案(zellander a等plos one.2014;9:e96709)的修改,通过甲基丙烯酸2
‑
羟乙酯(hema)、聚(乙二醇)甲基丙烯酸酯(pegma)以及聚(乙二醇)二丙烯酸酯(pegda)的自由基聚合来制备水凝胶。简单来说,使hema:pegma:pegda共聚物水凝胶在水中聚合。使用过硫酸铵和n,n,n’,n
’‑
四甲基乙二胺来起始和催化反应。如先前所描述(comunian ta等food res int.2013;52:373
‑
37)将在眼睛中的浓度比在血液中高50倍
(holekamp nm.am j ophthalmol.2010;149:32
‑
36)的抗氧化剂抗坏血酸包封于明胶
‑
海藻酸盐粒子中。简单来说,将斯潘80(span 80)添加至抗坏血酸溶液中以与玉米油形成乳液。将明胶和海藻酸盐溶解于水中并且在搅拌下缓慢添加至水:油乳液中持续30min。将混合物调节至ph 4.4并且在4℃下储存12h。在不同剪切速率下测量水凝胶的粘度以使用kinexus ultra 流变仪(malvern instruments ltd,worcestershire,uk)测定其剪切稀化能力。使用协同ht多模式微板读板仪(biotek,winooski,vt)在265nm波长下测定从包封粒子释放的抗坏血酸。
[0240]
实施例3.包含pegma的代表性所公开水凝胶的表征.
[0241]
合成hema:pegma:pegda的初步制剂并且产生透明软凝胶,所述透明软凝胶如由注射之前和之后的储能模量(g')和损耗模量(g”)所证实,发生剪切稀化并且容易通过小号针头注射而不损害粘弹性(图2d至图2e)。水凝胶在可见光谱中具有>90%的透明度并且uv透射减少。抗坏血酸的包封成功延长了它的稳定性和释放型态。粒子释放2mm(眼睛中的正常浓度;holekamp nm.am j ophthalmol.2010;149:32
‑
36)的抗坏血酸持续超过30天(图2e)并且可在注射期间与水凝胶合并。
[0242]
合成了pegma水凝胶(20ml,5%v/v,mw 500),然后在室温下浸没在维生素c溶液(50ml,100mm)中持续12h。将水凝胶放置于透析管中并且浸没在磷酸盐缓冲盐水(pbs,70ml)中。在预定时间,在265nm下测量pbs的吸光度以计算pegma水凝胶的维生素c释放浓度。如图5中所示,释放的维生素c的浓度在第一天内达到峰值50mm,然后在后续数天快速减少至接近零。在另一实验中,通过21号针头为加载维生素c的明胶
‑
海藻酸盐粒子注射水凝胶。然后将水凝胶/粒子混合物浸没在pbs中并且如上文所述测定pbs中维生素c的浓度。结果显示维生素c的释放中的小尖峰(与以上纯水凝胶的释放相比),随后为如图6中所示的一段时间的维生素c持续释放。
[0243]
实施例4.代表性所公开聚丙烯酰胺凝胶的制备和表征.
[0244]
图7示出了在37℃下在恒定搅拌下2mm抗坏血酸钠溶液的降解型态(n=3)以及聚丙烯酰胺水凝胶的抗坏血酸钠释放型态(n=3)。如先前所描述在测量之前稀释20倍的2mm抗坏血酸钠的pbs溶液的浓度随时间推移显示指数样下降(注意,y轴是基于对数刻度绘制)。另外,它在时间0时的浓度为1.4mm,不为制备时的2mm,因为在制备溶液时与开始实验时之间存在滞后时间。此滞后时间(约36小时)是归因于聚丙烯酰胺水凝胶的凝胶化时间推迟。含有抗坏血酸钠的聚合物溶液在18小时内凝胶化。然而,不含抗坏血酸钠的聚合物溶液消耗两倍长的时间进行凝胶化。
[0245]
在存在或不存在抗坏血酸钠的情况下将凝胶化的聚丙烯酰胺水凝胶(1ml)浸没在10ml的pbs中。在预定时间,获得pbs溶液的1ml等分试样,并且将1ml新鲜pbs添加至每个样品中以维持漏槽条件(sink condition)(10倍体积的饱和溶液,例如水凝胶)。在不进行稀释的情况下对1ml等分试样进行测量,因为抗坏血酸钠浓度已在标准曲线的线性区域内。
[0246]
不含抗坏血酸钠的水凝胶的吸光度读数随时间推移而增加。因为未添加抗坏血酸钠至这些水凝胶中,所以吸光度增加可归因于聚合物小块从水凝胶中浸出从而引起uv光干扰。含有抗坏血酸钠的水凝胶可能具有相同效应。可将不含抗坏血酸钠的水凝胶的吸光度读数从含有抗坏血酸钠的水凝胶中扣除,以获得归因于不同浓度的抗坏血酸钠的真实吸光度读数。
publishing limited,2016;以及k.e.swindle,p.d.hamilton,n.ravi,j.biomed.mater.res.a.2008,87,656
‑
665)。代表性数据(图2d)证实了产生具有这些性质的凝胶的能力。
[0255]
在各个方面中,所公开的水凝胶具有类似于玻璃体液的性质:折射率(1.336
±
0.002),模量(g’10
‑
20pa,g”1
‑
10pa;同前),以及透光率(>90%)。应使粒度最小化(优选<300nm)以防止视觉受损。
[0256]
可使用晶状体上皮细胞(lec)和人视网膜色素上皮(arpe
‑
19)细胞评估所公开的水凝胶制剂(在存在和不存在纳米粒子的情况下)的体外细胞毒性。可使用标准比色3
‑
(4,5
‑
二甲基噻唑
‑2‑
基)
‑
2,5
‑
二苯基四唑溴化物盐(mtt)分析。简单来说,将细胞以5x104个细胞/ml的密度接种于24
‑
孔板中持续24小时以实现汇合。可将细胞与凝胶一起孵育24
‑
48小时。可将mtt试剂添加至每个孔中并且可添加hoechst33342染色剂以目视观察细胞核。可在读板仪上在针对mtt染色的570nm和针对核染色的460
‑
490nm下读取板,并且可以占未处理的对照的百分比的形式计算细胞活力。还可使用标准活/死活力分析来验证mtt分析的结果。
[0257]
在各个方面中,如通过t检验所测定,所公开的水凝胶具有不显著不同于阴性对照的细胞活力(p<0.05)。相信所公开的水凝胶不与任何明显细胞毒性相关。
[0258]
为评估水凝胶玻璃体替代物(在存在和不存在纳米粒子的情况下)的无害性以及其缓和晶状体中的氧化应激的能力,可将原代lec在转移小室(transwell)中培养(chandler hl等,mol vis,2007 13:677
‑
91)。转移小室的使用允许lec不进行直接接触的情况下暴露于玻璃体替代物,更接近地反映体内环境。使用原代lec可允许在不诱导在永生化细胞系情况下所观测的变形性改变的情况下维持主要上皮特征(wang
‑
su st等,invest ophthalmol vis sci,2003 44:4829
‑
36)。因此,原代lec具有有限总体倍增,并且在对治疗的急性反应的研究中为最有益的。为评估治疗的更长期作用,可进行使用整个晶状体的并行实验。整个晶状体具有完整晶状体囊并且保留了晶状体纤维;这可准确地将体内氧化应激物的效应模型化(kamiya t,zigler js,exp eye res,1996 63:425
‑
31)。此外,可直接在替代物顶部培养整个晶状体,这与在体内可观测到的类似。
[0259]
为评估包含抗氧化剂的所公开的水凝胶与硅酮油相比防止氧化的能力,可使所培养的lec和整个晶状体暴露于已知诱导氧化应激并且在玻璃体切除术后促进白内障形成的环境刺激(即紫外辐射、过氧化氢、过氧化物条件)。可在存在测试材料的情况下孵育应激细胞并且可使用mtt分析评估细胞活力。可使用标准二氯荧光素(dcf)分析测定反应性氧物质的产生。用于定量玻璃体替代物的抗白内障性质的其他结果度量方法包括测定谷胱甘肽(gsh)浓度(harding jj,biochem j,117:957
‑
60,1979)、谷胱甘肽还原酶(gr)活性(linetsky md等,biochim biophys acta,1724:181
‑
93,2005)、蛋白质结合的gsh、过氧化氢酶活性(beers rf,sizer iw,j biol chem,195:133
‑
40,1952)、na
‑
k
‑
atp酶活性(akagawa k,tsukada y,j neurochem,32:269
‑
71,1979)以及抗坏血酸盐浓度(okamura m,clin chim acta,103:259
‑
68,1980)。
[0260]
在各个方面中,所公开的水凝胶显示反应性氧物质显著减少以及如通过anova所测定与对照(未处理的和硅酮油)相比针对抗白内障性质的分析测量的显著差异(p<0.05)。可定量抗氧化活性,并且可直接测量抗坏血酸盐浓度(同前)。
[0261]
可在兔玻璃体切除术模型中对玻璃体替代物的安全性和功效进行评估。所有研究使用iacuc批准的方案进行并且遵守视觉和眼科研究协会关于眼科和视觉研究中的动物使用的声明(the association for research in vision and ophthalmology(arvo)statement for the use of animals in ophthalmic and vision research)。可使用用于评估玻璃体替代物的标准动物模型荷兰黑带兔来评估玻璃体替代物(del amo em,urtti a,exp eye res,137:111
‑
24,2015)。在购买之后,使兔子适应大学实验室动物资源研究室(university laboratory animal resources facility)的环境5
‑
7天。可将兔子分成3个处理组以评估以下假设:与硅酮油相比凝胶制剂将防止损害,并且抗氧化剂的合并防止对晶状体和视网膜的氧化损害。在平坦部玻璃体切除术之后,可将一只眼睛中的玻璃体替换为水凝胶玻璃体替代物(n=6)、含有加载抗氧化剂的纳米粒子的水凝胶(n=6)或硅酮油阳性对照(n=6;例如方法参见del amo em,urtti a,exp eye res,137:111
‑
24,2015;以及k.e.swindle
‑
reilly,m.shah,p.d.hamilton,t.a.eskin,s.kaushal,n.ravi,invest.ophthalmol.vis.sci.2009,50,4840
‑
4846)。每个兔子的对侧眼充当未处理的对照。可在每个测试组中评估相等数目的雄兔和雌兔以解释生物变异性。在玻璃体切除术之后可如下文详细描述对兔子监测60天,然后人道地进行安乐死。可收获眼球用于组织病理学评估。
[0262]
在玻璃体切除术之前,所有兔子可经历彻底散瞳眼科检查,包括iop测量(tonovet)、裂隙灯活组织镜检(kowa sl
‑
15)以及间接检眼镜检查(heine omega 500)。另外,可进行视网膜电流图(erg)、视网膜检影验光(welch allyn)以及oct(envisu)。可取得前段和眼底照片。手术后,兔子可在手术后第一天、第一周然后每周接受如上文的彻底眼科检查直到研究结束。可使用改良的哈克特
‑
麦当劳评分系统(hackett
‑
mcdonald scoring system)(hackett rb,mcdonald to,dermatotoxicology,1996)客观地定量经由裂隙灯活组织镜检鉴定的任何临床上明显的前段变化(例如结膜充血、房水闪辉、虹膜充血、角膜透明度下降)。可使用针对后葡萄膜炎的努森布拉特评分系统(nussenblatt scoring system)(sen hn等,ophthalmology,118(4):768
‑
71,2011)定量后段变化(包括玻璃体混浊)或视网膜变化。可在中点(手术后1个月)和研究结束时重复进行erg、视网膜检影验光以及oct。
[0263]
在将兔子麻醉之后,可将一只眼睛的眼睑用聚维酮碘拭抹3次。使用手术显微镜(zeiss),可将23号套针放置于角膜缘后2.0mm处2点钟和10点钟位置。然后可在通过角膜上的隐形眼镜直接可视化下进行玻璃体切除术。可使用反吹刷(back
‑
flush brush)进行空气流体交换。此时,可将实验玻璃体替代物或硅酮油注射至眼睛中。手术结束时,可移除套针。不需要用缝合线紧固巩膜切口,因为伤口为自动密封的。此程序模拟在人患者中进行的程序。手术后处理方案包括止痛剂用于疼痛控制以及表面药物用于防止手术相关炎症和手术后感染。
[0264]
可从整个眼睛的子集获得新鲜组织以定量抗氧化剂标记物。在解剖之后,可将整个晶状体称重并且冷冻直至进一步分析。可将所有晶状体在无菌盐水中均质化并且离心。可使用透明上清液进行所有后续实验。如上文所描述,可对抗氧化活性(例如gsh浓度、cat活性)进行定量。可测定晶状体、房水以及玻璃体腔内流体中的抗坏血酸盐的浓度(okamura m,clin chim acta,103:259
‑
68,1980)。可对组织的子集进行苏木精和曙红(h&e)以及免疫
荧光分析。可将组织样品立即固定于4%多聚甲醛中。肉眼检查之后,可解剖前段与后段杯,并且可将子集包埋于石蜡中用于组织学和免疫组织化学分析以研究形态和视网膜层厚度,同时可将剩余组织冷冻用于其他分析。可从每个眼睛的后段和前段获得三个连续切片并且由兽医学组织学家用h&e染色。可使用临床评分针对白内障和氧化损害对晶状体和视网膜病变进行评估,并且病理学家将考察切片。可针对gfap和cd68对视网膜切片进行评估以评估小胶质细胞活化以及因毒性造成的细胞死亡。还将使用erg、折射以及总体形态学来监测视网膜健康。当rpe细胞对过量氧化应激作出反应时,它们产生tunel阳性细胞(sen hn等,ophthalmology,118(4):768
‑
71,2011)。其他分析可包括针对用于评估氧化应激的标记物对视网膜和晶状体染色(例如tnf
‑
α、il
‑1‑
β、tunel;方法参见kim b等,sci rep,7:14336,2017)。
[0265]
在各个方面中,所公开的水凝胶显示体内正常erg、组织学以及iop;极小炎症和细胞毒性;以及与硅酮油对照相比对晶状体和视网膜的更小氧化损害。用于评估与硅酮油和未处理对照相比的统计显著性的可定量度量手段可包括erg变化、iop、小胶质细胞、视网膜层厚度、组织病理学、折射、白内障评级以及裂隙灯观测得分。
[0266]
形成了包埋有抗氧化剂释放粒子的剪切稀化水凝胶作为新颖玻璃体替代物,所述新颖玻璃体替代物可替换天然玻璃体液的物理与化学功能两者。由此玻璃体替代物维持天然氧梯度具有预防玻璃体切除术后白内障形成的潜能,从而显著降低患者和护理提供者进行其他治疗的成本。
[0267]
实施例7.所公开的水凝胶作为用于抗氧化剂释放的玻璃体替代物.
[0268]
实验切片
‑
材料.从sigma
‑
aldrich(st.louis,mo,usa)购得聚(乙二醇)甲基丙烯酸酯(pegma,平均分子量(mw)360)、聚(乙二醇)二丙烯酸酯(pegda,平均mw 250、575以及700)、n,n,n
′
,n
′‑
四甲基乙二胺(temed)、过硫酸铵(aps)以及杜尔贝科氏磷酸盐缓冲盐水(dpbs)并且未进一步纯化即使用。从monomer polymer&dajac labs(ambler,pa,usa)购得甲基丙烯酸2
‑
羟乙酯(hema)。从thermo fisher scientific(waltham,ma,usa)购得分子量截止值(mwco)为6
‑
8kda和12
‑
14kda的透析管、杜尔贝科氏改良伊格尔/营养混合物f
‑
12汉氏培养基(dulbecco’s modified eagle’s/nutrient mixture f
‑
12ham’s medium,dme/f
‑
12)、杜尔贝科氏改良伊格尔培养基(dmem)、不含酚红、胎牛血清(fcs)、青霉素
‑
链霉素(pen strep)、胰蛋白酶、溶菌酶的dmem以及过氧化氢并且按收到时的原样使用。从美国典型培养物保藏中心(american type culture collection)(manassas,va,usa)购得rpe(arpe
‑
19atcc crl
‑
2302)。lec细胞为永生化人晶状体上皮细胞系,即永生化sra 01/04人lec。通过用含有sv40.33的大t抗原的质粒载体dna转染人晶状体上皮细胞来产生细胞系(n.ibaraki等,exp eye res.1998,67,577
‑
585)。从promega(madison,wi,usa)购得celltiter
‑
glo发光细胞活力分析材料。从cayman chemical(ann arbor,michigan,usa)购得二氯荧光素(2,7
‑
二氯二氢荧光素双乙酸盐,dcf)。
[0269]
所公开的水凝胶的制备.在去离子水(ph 7.4)中合成hema、pegda以及pegma的多个共聚物并且基于透明度和机械性质进行筛选(表1)。如先前所公布加以修改通过自由基聚合来形成水凝胶。
[31]
简单来说,将hema、pegma以及pegda单体溶解于去离子水中并且用氮气充分吹扫以移除可能过早终止反应的氧分子。分别以1:200和1:800v/v添加aps水溶液(10%w/v)和temed作为自由基引发剂和加速剂。
[32]
允许溶液聚合12小时。在透析管(12
‑
14kda mwco)中用去离子水将水凝胶纯化7天以移除未反应的单体和低分子量聚合物链。形成了两种优化制剂,即pegda和pegda
‑
共
‑
pegma水凝胶(表1)。
[0270]
表1.实施例6
‑
水凝胶制剂.
[0271][0272]
流变学测定.在测量之前,将所有水凝胶样品浸没于dpbs中持续7天以达到平衡膨胀。将样品注射至kinexus ultra 流变仪(malvern instruments ltd,worcestershire,uk)的石英测试台上。将20
‑
mm平行板几何构造下放至水凝胶样品上达到1mm的工作间隙,所述工作间隙以经确定提供几何构造与水凝胶之间的良好接触而不损害样品(零法向力)。将测试台设定为37℃并且使填充有dpbs的增湿室附着在几何构造和测试台周围以模拟体内条件并且防止样品脱水(图2a至图2c)。以0.1hz的频率和0.1至1000%范围内的幅度进行振幅扫描测试。以0.01至1hz的频率范围进行应变振幅为1%(被发现在线性粘弹区内)的频率扫描测试以测定水凝胶的储能模量(g’)和损耗模量(g”)。通过使剪切速率从0.01增加至1000s
‑1来评估剪切粘度。以0.1hz的固定频率和10%、700%以及1000%的应变对水凝胶施加交替振动步骤应变,每次应变间隔100s(h.wang等,adv.sci.2018,5,1800711)。
[0273]
水凝胶表征.通过在60℃烘箱中干燥已知量的水膨胀性水凝胶直至未检测到重量变化来测定每种水凝胶制剂的平衡水含量。使用折射仪(sper scientific,scottsdale,
az)测定水凝胶的折射率。使用varian cary 50uv
‑
可见分光光度计(agilent technologies,santa clara,ca,usa)在230至900nm范围内的波长下测量水凝胶的透射率。将dpbs用作空白。使用thermo nicolet nexus 870ftir光谱仪(thermo fisher scientific,waltham,ma,usa)收集pegda和pegda
‑
共
‑
pegma水凝胶的傅里叶变换红外光谱(ftir)。
[0274]
水凝胶稳定性.将水凝胶与dpbs、溶菌酶(10,000u ml
‑1)或胰蛋白酶(0.25%)在37℃下一起孵育长达4周(s.santhanam等,acta biomater.2016,43,327
‑
337)。将dpbs、溶菌酶或胰蛋白酶(每者1ml)添加至pegda或pegda
‑
共
‑
pegma水凝胶(0.5g)中。在预定时间(0、1、4、7、14、21以及28天),将水凝胶冻干并且称重。通过给定公式测定水凝胶样品的重量稳定性:
[0275][0276]
其中w0为湿润水凝胶在时间0时的初始重量并且w
t
为凝胶在时间t(天)时的重量。
[0277]
维生素c加载、稳定性以及释放.将水凝胶放置于低分子量截止值透析管(mwco 6
‑
8kda)中并且浸没于维生素c溶液(2.2mm,新制备并且每天更换)中持续72小时。人玻璃体中维生素c的浓度为2mm(n.m.holekamp,am j ophthalmol.2010,149,32
‑
36)。选择2.2mm的维生素c浓度作为加载浓度以解释维生素c的快速降解。为测定维生素c在水凝胶中的稳定性,使加载维生素c的水凝胶保持在37℃下。在预定时间(0分钟和30分钟、1小时、2小时、4小时、8小时以及12小时、1天、2天、3天、4天以及7天),使用协同ht多模式微板读板仪(biotek,winooski,vt)在265nm波长下测定水凝胶中剩余的维生素c,与具有空白水凝胶作为背景读数的已知浓度的标准溶液相比较。为测定维生素c释放,如上文所述为水凝胶加载维生素c溶液(1%w/v)。选择1%w/v或5.7mm的浓度进行释放研究,因为加载浓度越低产生的所释放的维生素c的浓度越低,所述浓度太低而不能可靠地检测。将加载维生素c的水凝胶(每个样品4ml)放置于透析管(mwco 6
‑
8kda)中并且浸没在dpbs(100ml)中。在如上文所描述的预定时间,抽取dpbs溶液(1ml)以测定所释放的维生素c的浓度,并且添加新鲜dpbs(1ml)以维持漏槽条件。
[0278]
细胞活力和ros活性分析.在37℃下在5%co2增湿氛围中,将arpe
‑
19和lec于分别补充有10%fcs和1%pen strep的dmem/f
‑
12和dmem中以1x104个细胞/孔接种于96
‑
孔板中持续24h。将水凝胶浸没在70%乙醇中持续1小时以灭菌,用去离子水冲洗3次,每次持续1小时以移除残余乙醇,并且将水凝胶浓度为10%w/v的含有不含血清和不含酚红的dmem的孔混合(j.chang等,j mater chem b.2015,3,1097
‑
1105;y.tao等,acta biomater.2013,9,5022
‑
5030;m.annaka等,biomacromolecules.2011,12,4011
‑
4021;以及s.lamponi等,j.biomater.sci.polym.ed.2012,23,555
‑
575)。将每个孔中的培养基移除并且将含有/不含水凝胶(100μl)以及含有/不含维生素c(2.2mm)的培养基添加至每个孔中并且孵育24小时。将过氧化氢(10μl,200μm最终浓度)添加至一半的孔中,并且将dpbs(10μl)添加至剩余的孔中作为对照(a.heckelen等,acta ophthalmol scand.2004,82,564
‑
568;以及h.s.lee等,invest.ophthalmol.vis.sci.2017,58,1196
‑
1207)。将孔板孵育30分钟。根据制造商的方案进行celltiter
‑
glo发光细胞活力分析。简单来说,将孔板平衡至室温持续30分钟。将celltiter
‑
glo试剂(100μl)添加至每个孔中,并且使用回转式振荡器将内容物混合10分
钟。将孔板在室温下孵育10分钟,然后使用协同ht多模式微板读板仪测量发光信号。使用dcf检测ros活性。简单来说,将dcf(100μl,20μm最终浓度)添加至每个孔中,并且将内容物在室温下孵育30分钟(y.ou等,chem biol interact.2009,179,103
‑
109)。使用tecan m200读板仪(switzerland)使用分别为485和525nm的激发和发射波长测量荧光信号。
[0279]
玻璃体内水凝胶注射.将来自六月龄猪(sioux
‑
preme packing co.,sioux city,ia)的猪眼球在包装在冰里的盐水溶液中装运过夜。从眼睛移除眼外组织。使用15号平端套管穿过筛板形成孔口,通过所述孔口移除玻璃体。使用22号或30号皮下注射针头将水凝胶(4ml)注射至玻璃体腔中。将眼球横切以评估玻璃体腔内部的水凝胶的外观。
[0280]
统计分析.数据以平均值
±
标准误差(se)表示。使用minitab软件(版本18.1;minitab,inc.,state college,pa)实施统计分析。使用单因素anova加上使用图基检验的事后成对比较来分析流变数据、水凝胶稳定性数据以及arpe
‑
19和lec的细胞活力和ros活性。零假设说明用于每个测试的组之间没有差异。统计显著性使用0.05的α值。
[0281]
结果
‑
实施例6的所公开的水凝胶.流变实验显示pegda和pegda
‑
共
‑
pegma水凝胶的类似于天然组织的粘弹性质(n.k.tram,k.e.swindle
‑
reilly,front.bioeng.biotechnol.2018,6;以及a.schulz等,transl vis sci technol.2019,8,56)。两种水凝胶的线性粘弹区经测定低于10%应变(图10a)。储能模量(g’)和损耗模量(g”)分别表示粘弹性材料的弹性和粘性性质。虽然两种模量均降低超过10%应变,但损耗模量变得大于储能模量,表明水凝胶变得更像液体。因此,后续频率扫描实验中使用1%的应变。pegda水凝胶的模量在统计学上大于pegda
‑
共
‑
pegma水凝胶和人玻璃体液(g’pegda
=7.02
±
0.33pa>g’pegda
‑
共
‑
pegma
=3.16
±
0.22pa≈g’人玻璃体
=2.368
±
0.17pa,p<0.0001;g”pegda
=0.859
±
0.038pa>g”pegda
‑
共
‑
pegma
=0.378
±
0.011pa≈g”人玻璃体
=0.482
±
0.024pa,p<0.0001)。两种水凝胶的储能模量(g')和损耗模量(g")处于与天然人玻璃体相同的数量级(图10b)。人玻璃体的储能模量在1pa至7pa范围内,而其损耗模量在0.3pa至1pa范围内(同前)。pegda水凝胶的储能和损耗模量在统计学上大于天然人玻璃体,储能模量在5至11pa范围内并且损耗模量在约0.9pa左右。pegda
‑
共
‑
pegma水凝胶的储能和损耗模量不在统计学上不同于所报告的人玻璃体的性质,储能模量在2至7pa范围内并且损耗模量在约0.4pa左右。随着剪切速率增加两种水凝胶均变得粘性更小,从而展示可有利于注射的剪切稀化特性(图10c)。交替振动步骤应变实验进一步表明,在经历引起水凝胶剪切稀化的高应变(g”>g’)之后,两种水凝胶均在更低应变下快速恢复其凝胶样特性(图10d)。
[0282]
在可见光波长内水凝胶具有可接受的透明度(90%以上)(图11)。pegda
‑
共
‑
pegma水凝胶比pegda水凝胶更透明,但两种水凝胶均具有与天然人玻璃体类似的光学性质(e.a.boettner,j.r.wolter,invest ophthalmol vis sci.1962,1,776
‑
783)。在230nm下水凝胶的透射率在紫外区快速下降至零。每种水凝胶制剂还具有与人玻璃体类似的折射率,人玻璃体的折射率为1.3349(b.p.gloor,the cv mosby co.,st.louis.1987,246
‑
267)。pegda水凝胶的折射率为1.3350
±
0.0002,并且pegda
‑
共
‑
pegma水凝胶的折射率为1.3359
±
0.0002。这些优良光学性质可能是归因于水凝胶的高水含量。pegda和pegda
‑
共
‑
pegma水凝胶的平衡水含量分别为97.53
±
0.06%和96.91
±
0.01%。
[0283]
ftir显示pegda和pegda
‑
共
‑
pegma水凝胶的成功合成(图12)。在两种水凝胶光谱
中均分别在2850、1730以及945cm
‑1处发现了亚甲基(
‑
ch2
‑
)、羰基(c=o)以及醚(c
‑
o
‑
c)基。pegda
‑
共
‑
pegma水凝胶光谱显示存在分别在3740和1520cm
‑1处的醇(
‑
oh)和甲基(
‑
ch3)基团。pegda光谱中未出现这些峰,证实合成了适当的水凝胶。
[0284]
发现水凝胶在与酶溶液一起孵育之后为稳定的(图13a至图13b)。对于两种水凝胶,在37℃下在dpbs、溶菌酶或胰蛋白酶溶液中水凝胶重量至少28天在统计学上未改变(p>0.05)。
[0285]
在维生素c稳定性实验中,加载有维生素c的水凝胶显示维生素c的快速降解(图14a)。维生素c的首次快速下降发生在头8小时内,从2mm降至约1.6mm。此后,在7天之后水凝胶内部的维生素c浓度降至0.03mm。在维生素c释放实验中,维生素c的快速释放也发生在头8小时期间(图14b)。在头12小时之后维生素c浓度逐渐降低并且在7天之后接近零。
[0286]
celltiter
‑
glo发光细胞活力分析表明水凝胶在体外对arpe
‑
19或lec不具毒性(图15a至图15b)。在含有水凝胶的培养基中培养的细胞的活力不在统计学上不同于含有普通培养基的对照。当与对照相比时,用于引入ros的过氧化氢使lec的活力降低,对于arpe
‑
19细胞来说降低得较少。与未处理的组相比,用过氧化氢处理的arpe
‑
19细胞的活力大致相同或甚至更高。相比之下,用过氧化氢处理的lec的活力在统计学上低于未进行过氧化氢处理的lec,表明在这些培养条件下,与arpe
‑
19细胞相比,晶状体细胞对氧化损害更敏感。
[0287]
dcf分析显示水凝胶和维生素c针对arpe
‑
19和lec的ros的保护作用(图16)。当与对照相比时,在存在pegda或pegda
‑
共
‑
pegma水凝胶的情况下ros活性在统计学上降低并且在添加维生素c的情况下进一步降低。再次,过氧化氢处理不影响arpe
‑
19细胞的ros活性。相比之下,与对照相比,在添加氧化氢的情况下lec的ros活性增加。这些结果表明相对于更具ros敏感性的lec,arpe
‑
19细胞为适当的对照。
[0288]
将水凝胶成功离体注射至猪眼的玻璃体腔中(图17)。所注射的水凝胶为透明的并且具有与天然玻璃体类似的坚实度和外观。
[0289]
实施例8.用于改善水凝胶玻璃体替代物中的维生素c稳定性的物理和化学方法
[0290]
归因于溶液中维生素c典型地在不到一周内快速降解,在水凝胶玻璃体替代物中检验了用于稳定维生素c的物理(包封于多层粒子中)与化学方法(与谷胱甘肽混合)两者。
[0291]
通过自由基聚合制备聚(乙二醇)甲基丙烯酸酯(pegma)与聚(乙二醇)二丙烯酸酯(pegda)的共聚物并且加载维生素c(2mm)。为制备物理保护的维生素c,使壳聚糖(1mg/ml)与三聚磷酸钠(1.75mg/ml)交联,加载维生素c(10%w/v),并且涂布海藻酸盐(1mg/ml)和壳聚糖的交替层。为在化学上保护维生素c,替代地添加谷胱甘肽溶液(1、2、4或10mm)以在化学上再循环维生素c。在37℃下将粒子溶液或化学稳定的维生素c溶液在水凝胶中孵育。在预定时间(0、1、2、3、4、7、8、9、11以及14天),使用微板读板仪在波长265下测定与含有空白粒子和谷胱甘肽溶液作为背景读数的已知浓度的标准溶液相比的剩余维生素c。
[0292]
如图20中所示,pedga和pedga
‑
共
‑
pegma水凝胶为可注射的并且看起来与天然玻璃体液类似。到第5天仅含有维生素c(不含水凝胶)的溶液快速降解至0%。水凝胶和粒子对维生素c提供一些保护,在仅7天之后引起降解。谷胱甘肽作为添加剂提供最长的稳定化,当谷胱甘肽浓度大于4mm时,在14天之后剩余70%的维生素c。空白水凝胶、粒子以及谷胱甘肽溶液不妨碍维生素c的吸光度读数。
[0293]
因此,将维生素c与谷胱甘肽组合显著改善维生素c的稳定性持续至少两周。因此,
可证实将谷胱甘肽添加至加载维生素c的水凝胶玻璃体替代物中有效改善所包括的维生素c的稳定性。
[0294]
材料和方法:从sigma
‑
aldrich购得抗坏血酸(vc)、壳聚糖(ch,低分子量)、海藻酸盐(al)、明胶(ge)、谷胱甘肽(glu,st.louis,mo,usa)、三聚磷酸钠(tpp,85%)、乙酸以及杜尔贝科氏磷酸盐缓冲盐水(dpbs)并且未进一步纯化即使用。还从sigma
‑
aldrich(st.louis,mo,usa)购得聚(乙二醇)甲基丙烯酸酯(pegma,平均分子量(mw)360)、聚(乙二醇)二丙烯酸酯(pegda,平均mw 575)、n,n,n
′
,n
′‑
四甲基乙二胺(temed)、过硫酸铵(aps)以及杜尔贝科氏磷酸盐缓冲盐水(dpbs)并且用于制备水凝胶玻璃体替代物。从thermo fisher scientific(waltham,ma,usa)购得分子量截止值(mwco)为6
‑
8kda和12
‑
14kda的透析管、杜尔贝科氏改良伊格尔/营养混合物f
‑
12汉氏培养基(dme/f
‑
12)、杜尔贝科氏改良伊格尔培养基(dmem)、不含酚红、胎牛血清(fcs)、青霉素
‑
链霉素(pen strep)的dmem以及过氧化氢并且按收到时的原样使用。从美国典型培养物保藏中心(manassas,va,usa)购得rpe(arpe
‑
19atcc crl
‑
2302)。永生化sra 01/04人lec最初由dr.venkat n.reddy,university of michigan提供并且由dr.marlyn p.langford,louisiana state university共享。通过用含有sv40.33的大t抗原的质粒载体dna转染人上皮细胞来产生细胞系(参见ibaraki,n.等,exp eye res 1998,67,577
‑
585)。从promega(madison,wi,usa)购得celltiter
‑
glo发光细胞活力分析材料。从cayman chemical(ann arbor,michigan,usa)购得二氯荧光素(2,7
‑
二氯二氢荧光素双乙酸盐,dcf)。
[0295]
壳聚糖/海藻酸盐/明胶粒子的制备:在500rpm下将壳聚糖(sigma
‑
aldrich,低分子量,1mg/ml)溶解于乙酸溶液(1%w/w,500ml)中持续60min。将三聚磷酸钠(1.75mg/ml,500ml)逐滴添加至壳聚糖溶液中持续2
‑
小时以形成纳米粒子(参见liu,w.等,lwt 2017,75
‑
608
‑
615)。经由在21℃下在4000rpm下离心15min来收集纳米粒子。将粒子用去离子水洗涤并且再离心一次。将抗坏血酸(10%w/w,10ml,ph 5.5)添加至粒子中并且在回转式振荡器上使其溶解18小时。将海藻酸钠(fmc biopolymer,protanal ph,1mg/ml,10ml,ph 5.5)添加至抗坏血酸和壳聚糖粒子溶液中并且超声处理30min。将壳聚糖(sigma
‑
aldrich,低分子量,1mg/ml于1%w/w乙酸溶液中,10ml)添加至抗坏血酸
‑
壳聚糖
‑
海藻酸盐粒子中并且超声处理30min。在不同组中,将明胶(bloom 175,1mg/ml 10ml)添加至抗坏血酸
‑
壳聚糖
‑
海藻酸盐粒子中并且超声处理30min。通过在21℃下在4000rpm下离心15min来收集粒子并且冷冻干燥。
[0296]
水凝胶的制备:如先前所公布加以修改通过自由基聚合来形成水凝胶(参见tram,n.k.等,macromolecular bioscience 2019,1900305)。简单来说,将pegma和pegda单体溶解于去离子水中并且用氮气充分吹扫以移除可能过早终止反应的氧分子。分别以1:200和1:800v/v添加aps水溶液(10%w/v)和temed作为自由基引发剂和加速剂。允许溶液聚合12h。在透析管(12
‑
14kda mwco)中用去离子水将水凝胶纯化7天以移除未反应的单体和低分子量聚合物链。形成了两种优化制剂,即pegda(100%pegda,2%wt聚合物)和pegda
‑
共
‑
pegma(50%pegda:50%pegma,3%wt聚合物)水凝胶。
[0297]
维生素c释放研究:所制备的各种溶液为壳聚糖(ch)、壳聚糖
‑
海藻酸盐(ch
‑
al)、壳聚糖
‑
海藻酸盐
‑
壳聚糖(ch
‑
al
‑
ch)、壳聚糖
‑
海藻酸盐
‑
明胶(ch
‑
al
‑
ge)以及浓度为0.1um、1um、10um、100um、1mm、2mm、4mm以及10um的谷胱甘肽(glu)。一个释放研究对在溶液
ch
‑
glu、ch
‑
al
‑
glu、ch
‑
al
‑
ch
‑
glu、ch
‑
al
‑
ge
‑
glu中包封粒子与谷胱甘肽(1mm)的组合以及使用相同成层法包封维生素c与谷胱甘肽两者进行了测试。对于所测试的每种溶液,包括了不含维生素c的对照组以及dpbs中含单独维生素c(1%w/w)的测试组。所测试的所有组均具有2mm的目标维生素c浓度。其他对照组包括仅vc溶液(1%w/w于dpbs中)和仅谷胱甘肽溶液(1%w/w)。在释放研究中将所有溶液保持在37℃下。使用协同ht多模式微板读板仪(biotek,winooski,vt)在265nm波长下测量溶液中剩余的有活力的维生素c的量并且与对照组相比较以测定留在溶液中的有活力的维生素c的量。为测量维生素c的浓度,将含有粒子的溶液在3220rpm下离心5min并且移除溶液(500ul)并且放入96
‑
孔板中,在第0天、第1天、第2天、第3天、第4天、第7天、第8天、第9天、第10天、第11天以及第14天进行测量。两周之后,每隔一天对具有较高维生素c浓度的溶液进行测量,直至维生素c不可检测。对于粒子溶液,将dpbs溶液(500ul)添加回溶液中以维持恒定体积。
[0298]
使用细胞活力分析筛选过氧化氢、维生素c以及谷胱甘肽浓度:在37℃下在5%co2增湿氛围中,将arpe
‑
19和lec于分别补充有10%fcs和1%pen strep的dmem/f
‑
12和dmem中以1x104个细胞/孔接种于96
‑
孔板中持续24h。将每个孔中的培养基移除并且将含有维生素c(2000μm、1000μm、500μm、100μm以及0μm)或谷胱甘肽(10000μm、4000μm、2000μm、1000μm、500μm以及0μm)的各种培养基添加至每个孔中(100μl)并且孵育24小时。在进行活力分析之前30分钟添加(100μl)过氧化氢(600μm、400μm、200μm、100μm、50μm以及0μm)以及特殊情况的维生素c(2000μm)。根据制造商的方案进行celltiter
‑
glo发光细胞活力分析。简单来说,将孔板平衡至室温持续30分钟。将celltiter
‑
glo试剂(100μl)添加至每个孔中,并且使用回转式振荡器将内容物混合10分钟。将孔板在室温下孵育10分钟,然后使用协同ht多模式微板读板仪(biotek,winooski,vt)测量发光信号。
[0299]
使用dcf分析维生素c在降低反应性氧物质(ros)活性中的抗氧化活性:使用二氯荧光素分析测定用维生素c(0、100以及1000μm,持续30分钟或24小时)处理的arpe
‑
19和lec的由过氧化氢诱导的ros活性(200μm持续30分钟)。简单来说,如上文所描述培养lec和arpe
‑
19细胞。将dcf(100μl,20μm最终浓度)添加至每个孔中,并且将内容物在室温下孵育30min(参见ou,y.等chem biol interact.2009,179,103
‑
109)。使用协同ht多模式微板读板仪(biotek,winooski,vt)使用分别为485和525nm的激发和发射波长测量荧光信号。
[0300]
统计分析:数据以平均值
±
标准误差(se)表示。使用minitab软件(版本18.1;minitab,inc.,state college,pa)实施统计分析。使用单因素anova加上使用图基检验的事后成对比较来分析lec和arpe
‑
19细胞的细胞活力和ros活性。零假设说明用于每个测试的组之间没有差异。统计显著性使用0.05的α值。
[0301]
结果:过氧化氢在等于或低于100μm下未影响细胞活力,而在600μm下显著降低lec与arpe
‑
19两者的细胞活力(参见图21a)。中间浓度的h2o2(200μm和400μm)显著降低lec的细胞活力,但对arpe
‑
19没有影响。此结果表明,在这些培养条件下,与arpe
‑
19细胞相比,晶状体细胞对氧化损害更敏感,从而使得相对于更具ros敏感性的lec,arpe
‑
19细胞为适当的对照。维生素c对lec与arpe
‑
19两者的细胞活力具有有害作用(参见图21b)。虽然低浓度维生素c(100μm和500μm)可被认为是无毒的(超过70%细胞活力),但较高浓度(1000μm和2000μm)甚至在暴露时间减少(2000μm,从24小时至30分钟)的情况下也显著降低细胞活力。
[0302]
在生理玻璃体浓度(等于或高于1000μm)下,维生素c对视网膜和晶状体上皮细胞
来说为毒性的。先前研究与所呈现的数据一起印证并且表明在防止氧化损害方面100μm为最佳浓度(参见goyal,m.m.等indian j clin biochem.2009,24,375
‑
380;以及wei,w.等scientific world journal 2014,750634)。结果表明玻璃体核心与玻璃体外层(靠近细胞)之间存在维生素c梯度,这类似于先前在玻璃体液中确定的氧梯度(参见filas,b.a.等invest ophthalmol vis sci.2013,54,6549
‑
6559)。图22中说明了此观点。
[0303]
当以高浓度(1000μm)使用时和/或当与过氧化氢同时孵育时维生素c可降低细胞的ros活性(参见图23a)。与细胞一起孵育24小时的低浓度维生素c(100μm)未有效减少由过氧化氢诱导的ros,由此具有与无维生素c对照相同的ros活性。在用过氧化氢(200μm)处理的lec中ros活性增加1.5倍(参见图23b)。用h2o2和高浓度维生素c(1000μm)处理的lec具有与无h2o2无维生素c对照相同的ros活性。如先前所测定,arpe
‑
19细胞未显著地对由过氧化氢诱导的氧化损害作出反应(参见图23c)。用高浓度与低浓度的维生素c将细胞处理30分钟使ros活性显著降低至15
‑
30%。对于两种细胞,当不用h2o2处理时,在低维生素c浓度(100μm)下,在24小时之后ros活性回到与对照(无维生素c)相同的水平。
[0304]
在3天之后维生素c快速降解至10%(参见图24)。水凝胶使第3天的维生素c剩余提高至20%。将维生素c包封于壳聚糖、壳聚糖
‑
海藻酸盐以及壳聚糖
‑
海藻酸盐
‑
明胶粒子中使剩余百分比增加至30%,其中壳聚糖
‑
海藻酸盐
‑
壳聚糖粒子提供最佳保护,3天之后剩余40%。所有制剂在14天之后均接近0%。
[0305]
与其他物理方法(包封于水凝胶或粒子中)相比,将维生素c与谷胱甘肽混合提供对维生素c的更好的保护。剩余维生素c百分比随所用谷胱甘肽的量的增加而增加(参见图25)。当与高浓度的谷胱甘肽(4
‑
10mm)组合时经过14天剩余超过一半的维生素c。
[0306]
谷胱甘肽甚至在高浓度(10000μm)下也对两种细胞类型均为无毒的,在所有所测试的条件下细胞活力保持在70%以上(参见图26)。在4000μm和10000μm下lec细胞活力降低,但仍保持在70%以上。在谷胱甘肽浓度超过100μm的情况下,arpe
‑
19具有增加的细胞活力。
[0307]
对本领域技术人员来说可为显而易见的是,可在不背离本公开的范围或精神的情况下在本公开中作出各种修改和变化。由本文所公开的本说明书的考虑因素和本公开的实践来看,本公开的其他实施方案对本领域技术人员来说可为显而易见的。本说明书和实施例旨在仅被视为示例性的,本公开的真实范围和精神由以下权利要求书指示。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。