1.本发明涉及血清型判定方法。详细而言,本发明涉及使用质谱分析法来判定特定微生物的血清型或抗原的类型的方法。
背景技术:
2.例如,在日本每年有数千人规模的感染者发生由致病性大肠杆菌所致的食物中毒,幼儿、高龄者中还有死亡的情况。因此,该食物中毒是显示出极其严重的症状的疾病,就确定成为其原因的微生物的血清型而言,对于诊断、治疗、致病性食材的特定等是重要的。
3.微生物的血清型由存在于其细胞表面的抗原的类型(分子结构)而确定。大肠杆菌中基于鞭毛结构的h抗原、基于脂多糖的结构的o抗原(o antigens)等是已知的。脂多糖由脂质和糖链构成,而且该糖链部分由核心多糖和被称为o侧链多糖的部分构成。该o侧链多糖负责o型的抗原性,具有由3至5个单糖组成的基本结构重复4至40次左右的结构。
4.作为试验微生物的血清型的方法,广泛使用了载玻片凝集法、乳胶凝集法(例如,专利文献1)、其它凝集法(例如,专利文献2)、免疫色谱法等,但这些方法是基于全部抗原抗体反应的方法。因此,有时也被称为抗原抗体反应、免疫反应、血清反应。
5.血清型不同即是抗原分子的抗原位点的结构不同。o抗原的类型负责存在于菌体表面的脂多糖的糖链结构,但与蛋白质不同,并非由基因直接编码。然而,由于其依赖于由基因编码的糖链合成酶,因此通过对这些基因进行解析来判定抗原的类型的方法也被实用化。
6.还报道了通过质谱分析来确定大肠杆菌的血清型的技术(非专利文献1)。该文献中,使用基质辅助激光解析串联飞行时间质谱仪(maldi
‑
tof ms),迅速地确定了大肠杆菌的h抗原的类型。该文献的方法利用多肽质量指纹分析,将大肠杆菌鞭毛的蛋白质分解(胰蛋白酶消化)为肽片段,使用maldi
‑
tof ms测定了其质量。
7.另外,还已知通过质谱分析识别微生物的方法(专利文献3)。专利文献3的方法的特征在于,其是对包含微生物的试样进行质谱分析,读取得到的质谱上的标记蛋白质来源的峰的m/z值,基于前述m/z值来判定前述试样是否包含o157、o26或o111的方法,且使用作为前述标记蛋白质的核糖体蛋白s15和核糖体蛋白l25中的至少任一个、酸应激伴侣hdeb和dna结合蛋白h
‑
ns。
8.现有技术文献
9.专利文献
10.专利文献1:日本特开2002
‑
119297号公报
11.专利文献2:日本专利第5142725号公报
12.专利文献3:日本特开2015
‑
184020号公报
13.非专利文献
14.非专利文献1:huixia chui,et al.,journal of clinical microbiology,august2015,volume 53,number 8,pp.2480
‑
2485
技术实现要素:
15.发明要解决的问题
16.如上所述,微生物的血清型试验中,广泛利用了乳胶凝集法等基于抗原抗体反应的方法。这是由于血清型的定义是与特定的抗体反应,因此是合理的。然而,由于一种抗体对应于一种血清型,因此在认为可能存在多种血清型的情况下,必须准备相同数量的种类的抗体。例如,若可能是作为o组的o157、o26、o111、o103、o121、o145和o165这7种中的任一种,则必须使用7种抗体。另外,由于抗体的活性随着时间经过而降低,因此无法长期保存,在可使用状态下预先储存多种抗体会造成巨大的成本。
17.另一方面,基于基因解析的方法不存在抗体的保存性问题。然而,同样也有必要准备与可能的血清型相对应的数量的反应实验。另外,由于抗原的产生是由多个基因作用的结果,因此也有以基因的形式存在而不一定成为该血清型的问题。进而,若没有确定血清型的基因信息则无法进行试验。即,在出现新型的血清型时,直至解析出相关的基因为止无法设计出反应实验。
18.通过质谱分析也确定了大肠杆菌的血清型,但其是针对h抗原的,分析方法也基于解析蛋白质的多肽质量指纹分析。
19.本发明的课题在于提供针对特定微生物的新型的血清型判定方法,所述方法不受在抗原抗体反应、基因解析等间接的方法的情况下常见的上述那样的制约。或者,本发明主要的课题在于提供新型的血清型判定方法,所述方法针对特定微生物,能够避免必须使用多种抗体、多种基因解析用实验等的制约、利用简单的方法就能够获得准确度高的试验结果。
20.用于解决问题的方案
21.本发明人进行了深入研究,结果发现:通过利用质谱分析法对造成抗原性差异的分子结构进行直接解析,从而能解决上述课题,以至完成了本发明。
22.作为本发明,例如可以列举出以下的方式。
23.[1]一种血清型判定方法,其是用于判定微生物的血清型的方法,所述微生物的形成抗原的脂多糖的糖链部分是以由多个单糖的组合构成的基本结构作为一个单元重复多次而成的,所述方法包括以下工序1~工序3:
[0024]
工序1,在通过对由判定对象的微生物待检体得到的包含抗原位点的试样进行质谱分析而得到的波谱中,选择由以等间隔连续地重复检测出的多个峰组成的第1峰组,获得该第1峰组的相邻的各峰之间的m/z值之差作为第1峰组的峰间隔实测m/z值;
[0025]
工序2,对前述第1峰组的峰间隔实测m/z值与针对特定的血清型所对应的该基本结构的另行得到的m/z值进行对照;
[0026]
工序3,根据前述对照工序的结果,将针对与前述第1峰组的峰间隔实测m/z值一致的该基本结构的前述另行得到的m/z值所对应的特定的血清型判定为该微生物的血清型。
[0027]
[2]一种血清型判定装置,其是用于判定微生物的血清型的装置,所述微生物的形成抗原的脂多糖的糖链部分是以由多个单糖的组合构成的基本结构作为一个单元重复多次而成的,所述装置包括以下1~4的装置部:
[0028]
数据获取部1,获取通过对由判定对象的微生物待检体制备的包含抗原位点的试样进行质谱分析而得到的质谱数据;
[0029]
第1峰间隔获取部2,在由前述数据获取部得到的质谱中,选择由以等间隔连续地重复检测出的多个峰组成的第1峰组,获得该第1峰组的相邻的各峰之间的m/z值之差作为第1峰组的峰间隔实测m/z值;
[0030]
数据对照部3,对前述实测m/z值与针对特定的血清型所对应的该基本结构的另行得到的m/z值进行对照;
[0031]
血清型判定部4,将与前述实测m/z值一致的、前述另行得到的m/z值所对应的特定的血清型判定为该微生物的血清型。
[0032]
[3]一种血清型判定程序,其是用于判定微生物的血清型的程序,所述微生物的形成抗原的脂多糖的糖链部分是以由多个单糖的组合构成的基本结构作为一个单元重复多次而成的,所述程序用于执行包括以下步骤1~步骤4的步骤:
[0033]
步骤1,对由判定对象的微生物待检体制备的包含抗原位点的试样进行质谱分析,在由此得到的波谱中,获取以等间隔连续地重复检测出的多个峰的相邻的各峰的间隔作为实测m/z值;
[0034]
步骤2,对前述实测m/z值与针对特定的血清型所对应的该基本结构的另行得到的m/z值进行对照;
[0035]
步骤3,将与前述实测m/z值一致的、前述另行得到的m/z值所对应的特定的血清型判定为该微生物的血清型;
[0036]
步骤4,输出前述已判定的该微生物的血清型。
[0037]
发明的效果
[0038]
根据本发明,在无需进行试验的血清型所对应的抗体、基因解析用的引物等的情况下就能够判定血清型。无论血清型如何都可以利用同样的方法制备试样,无论血清型如何都可以在相同条件下判定血清型。
[0039]
现有方法中对1个待检体进行了多个实验,但根据本发明,血清型的差异表现为质谱分析的波谱差异,因此对1个待检体进行1个测定就可以。另外,现有方法中新型的血清型的情况无法进行分析,但本发明中就能够进行分析,由于观测到了尚未报道的质谱,从而能知晓是新型的血清型。此外,可知:即使现有方法被认为是相同血清型的情况也具有不同的糖链结构。
附图说明
[0040]
图1是大肠杆菌o157来源脂多糖的质谱。
[0041]
图2是在图1的质谱上加入了峰间隔的m/z值的质谱。
[0042]
图3是待检体的质谱。
[0043]
图4是参照待检体a的质谱。
[0044]
图5是参照待检体b的质谱。
[0045]
图6是参照待检体c的质谱。
[0046]
图7是将参照待检体a适用于免疫色谱的结果。
[0047]
图8是将参照待检体b适用于免疫色谱的结果。
[0048]
图9是将参照待检体c适用于免疫色谱的结果。
[0049]
图10是示出本发明的血清型判定系统等方式的流程图。
[0050]
图11是示出本发明的血清型判定程序的方式的流程图。
[0051]
图12是将待检体o111适用于免疫色谱的结果。
[0052]
图13是将待检体o111*适用于免疫色谱的结果。
[0053]
图14是待检体o111的质谱。
[0054]
图15是待检体o111*的质谱。
具体实施方式
[0055]
以下,对本发明进行详细说明。
[0056]
a本发明的血清型判定方法
[0057]
本发明的血清型判定方法(以下称为“本发明判定方法”。)是用于判定微生物的血清型的方法,所述微生物的形成抗原的脂多糖的糖链部分是以由多个单糖的组合构成的基本结构作为一个单元重复多次而成的,包括以下工序1~工序3的工序。
[0058]
工序1,在通过对由判定对象的微生物待检体得到的包含抗原位点的试样进行质谱分析而得到的波谱中,选择由以等间隔连续地重复检测出的多个峰组成的第1峰组,获得该第1峰组的相邻的各峰之间的m/z值之差作为第1峰组的峰间隔实测m/z值;
[0059]
工序2,对前述第1峰组的峰间隔实测m/z值与针对特定的血清型所对应的该基本结构的另行得到的m/z值进行对照;
[0060]
工序3,根据前述对照工序的结果,将针对与前述第1峰组的峰间隔实测m/z值一致的该基本结构的前述另行得到的m/z值所对应的特定的血清型判定为该微生物的血清型。
[0061]
对于本发明成为对象的微生物,以由多个单糖的组合构成的基本结构作为一个单元,具有将该基本结构重复多次的结构的分子,该基本结构可以构成判定对象的微生物的形成抗原的脂多糖的糖链部分。只要是具有这样的结构分子的微生物就没有特别限定。作为具有这样的结构分子的微生物,例如可以包括革兰氏阴性细菌、革兰氏阴性兼性厌氧杆菌、革兰氏阴性好氧杆菌、革兰氏阴性厌氧杆菌、革兰氏阴性球菌。具体而言,可以列举出下述的细菌。
[0062]
·
革兰氏阴性兼性厌氧杆菌
[0063]
大肠杆菌(eshericha coli)、志贺菌属(shigella)、沙门菌属(salmonella)、克雷伯菌属(klebsiella)、变形杆菌属(proteus)、耶尔森氏菌属(yersinia)、霍乱弧菌(v.cholerae)、副溶血性弧菌(vparahaemolyticus)、嗜血菌属(haemophilus)
[0064]
·
革兰氏阴性好氧杆菌
[0065]
假单胞菌属(pseudomonas)、军团菌属(legionella)、鲍特氏菌属(bordetella)、布鲁菌属(brucella)、土拉弗朗西斯菌(francisella tularensis)
[0066]
·
革兰氏阴性厌氧杆菌
[0067]
拟杆菌属(bacteroides)
[0068]
·
革兰氏阴性球菌
[0069]
奈瑟菌属(neisseria)
[0070]
本发明中,特别是对于o组的大肠杆菌是有用的。o抗原大肠杆菌目前已知有约180种,作为致病性的o抗原大肠杆菌,例如可以列举出epec(肠内致病性大肠杆菌)、eaec(肠道集聚性大肠杆菌)、ehec(肠出血性大肠杆菌)、etec(产肠毒素大肠杆菌)、eiec(肠侵袭性埃
希大肠杆菌)、daec(弥漫性粘附性大肠杆菌)、upec(尿道致病性大肠杆菌)mnec(脑膜炎/败血症相关大肠杆菌)。具体而言,作为epec,例如可以列举出o18ac、o20、o25、o26、o28、o44、o55、o86、o91、o111、o114、o119、o125ac、o126、o127、o128、o142、o146、o151、o158、o159、o166。作为etec,例如可以列举出o6、o8、o11、o15、o20、o25、o27、o63、o73、o78、o85、o114、o115、o128、o139、o148、o149、o159、o166、o167、o168、o169、o173。作为eiec,例如可以列举出o6、o28ac、o29、o112ac、o115、o124、o136、o143、o144、o152、o159、o164、o167。作为ehec,例如可以列举出o1、o4、o5、o8、o16、o18、o25、o26、o44、o46、o48、o55、o86、o91、o98、o103、o111ab、o113、o114、o115、o117、o118、o119、o124、o125、o126、o127、o128、o145、o153、o157、o166、o167、o169、o172、o176、o177、o178、o179、o180、o181。作为eaec,例如可以列举出o3、o7、o15、o44、o55、o77、o78、o86、o111、o125、o126、o127、o128、o157。作为upec,例如可以列举出o4、o6、o14、o22、o75、o83。
[0071]
作为微生物或o抗原大肠杆菌的该糖链部分的单糖,例如可列举出可立糖、岩藻糖、n
‑
乙酰岩藻糖胺、葡萄糖、葡萄糖醛酸、n
‑
乙酰葡糖胺、半乳糖、半乳糖醛酸、n
‑
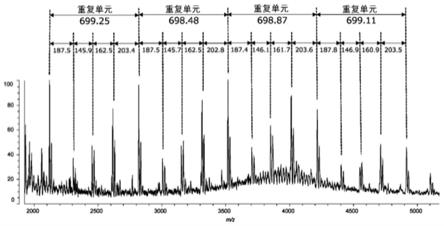
乙酰半乳糖胺、n
‑
乙酰半乳糖醛酸、甘露糖、n
‑
乙酰神经氨酸、n
‑
乙酰奇诺胺、鼠李糖、核糖、6
‑
脱氧塔罗糖、n
‑
乙酰过氧胺、葡糖胺、半乳糖胺、岩藻糖胺、塔罗糖、神经氨酸、半乳糖胺、木酮糖、呋喃核糖、呋喃岩藻糖、苏
‑
戊
‑
酮呋喃糖(threo
‑
pent
‑
ulofuranose)、6
‑
脱氧
‑
l
‑
塔罗吡喃糖、这些糖可以是d体或l体,也可以是异头物(anomers)。
[0072]
a
‑
1关于工序1
[0073]
工序1如下:在通过对由判定对象的微生物待检体得到的包含抗原位点的试样进行质谱分析而得到的质谱中,选择由以等间隔连续地重复检测出的多个峰组成的第1峰组,获得该第1峰组的相邻的各峰之间的m/z值之差作为第1峰组的峰间隔实测m/z值的工序。
[0074]
在实施本发明时,首先由成为判定对象的微生物制备包含有助于抗原性的分子结构部分或其结构部分的试样。该试样取决于接下来的工序的分析方法,但在采用例如maldi
‑
tof ms时,优选以包含抗原位点的分子为主成分的方式制备。此处“主成分”是指在不损害本发明的效果的范围内可以包含其它成分,并非用于限制其它成分的含有,通常是指相对于包含抗原位点的分子的成分整体的含有率占50重量%以上。优选该含有率占70重量%以上,更优选占80重量%以上或90重量%以上。该含有率也可以是100重量%。
[0075]
具体而言,例如在对大肠杆菌的o抗原的类型进行试验时,以有助于抗原性的脂多糖(糖脂质)为主成分的方式利用常规方法而制备。作为常规方法,例如可以列举出苯酚提取法、丙酮沉淀法等,但不限定于这些。或者,脂多糖中有助于抗原性的分子结构部分为o侧链多糖的部分,因此也可以使用酸水解等的方法而使脂质部分断裂而仅获得糖链部分。
[0076]
接着,使用质谱分析装置测定如上述那样得到的试样。该质谱分析装置至少包括电离部和质量分离部,只要是能够测定带电粒子的m/z值的装置就没有特别限定。
[0077]
该电离部中的电离方法没有特别限定,主要的分析对象为糖链,因此从在保持分子结构的状态下容易使其电离的观点出发,期望利用软电离法。作为该电离法,例如可列举出fab(fast atom bombardment:快原子轰击)、maldi(matrix
‑
assisted laser desorption/ionization:基质辅助激光解吸电离法)、esi(electrospray ionization:电喷雾电离法)、pesi(probe electorospray ionization:探针电喷雾电离法)、apci(atmospheric pressure chemical ionizaton:气压化学电离法)、dios(desorption/
ionization on silicon:基于多孔硅的解吸电离)、saldi(surface
‑
assisted laser desorption/ionization:表面辅助激光解吸电离法)。从容易产生有助于分析分子结构的碎片离子的观点出发,可以利用cid(collision
‑
induced dissociation:碰撞诱发的解离法)使通过软电离而产生的带电粒子与稀有气体(he、ne、ar等)等非活性气体分子碰撞。
[0078]
另外,该质量分离部中的质量分离方法也没有限定。例如可以使用磁场型质谱仪、q ms(quadrupole mass spectrometer:四极质谱仪)、it ms(ion trap mass spectrometer:离子阱质谱仪)、tof ms(time
‑
of
‑
flight mass spectrometer:飞行时间型质谱仪)、ft
‑
icr ms(fourie transform
‑
ion cyclotron resonance mass spectrometer:傅立叶变换离子回旋共振质谱仪)、静电场轨道阱(orbitrap)。
[0079]
此外,作为质谱分析装置,可以是上述电离法和质量分离法中任意者的组合。例如可以使用maldi
‑
tof ms(基质辅助激光解吸电离法
‑
飞行时间质谱仪)、esi
‑
tof ms(电喷雾电离法
‑
飞行时间型质谱仪)、apci
‑
tof ms(气压化学电离法
‑
飞行时间型质谱仪)、esi
‑
it ms(电喷雾电离法
‑
离子阱质谱仪)、apci
‑
it ms(气压化学电离法
‑
离子阱质谱仪)、fab
‑
it ms(快原子轰击
‑
离子阱质谱仪)、esi
‑
q ms(电喷雾电离法
‑
四极质谱仪)、pesi
‑
q ms(探针电喷雾电离法
‑
四极质谱仪)、apci
‑
q ms(气压化学电离法
‑
四极质谱仪),但不限定于这些。
[0080]
本发明中的质谱分析装置可以是单聚焦质谱仪,也可以是串联质谱分析(mass spectrometry/mass spectrometry:ms/ms)的装置。也可以使用多阶段串联质谱分析(ms
n
)的装置。
[0081]
另外,本发明中的质谱分析装置也可以包括具有除上述以外的功能的其它装置部。作为该装置部,可列举出色谱仪、显微镜等。因此,本发明中的质谱分析装置包括液相色谱质谱仪(lc/ms)、超临界流体色谱质谱仪(sfc/ms)、成像质谱显微镜等。
[0082]
通常,在质谱分析装置内部,可以在保持原样的分子结构的情况下使试样电离,但通常也一并产生源自试样的分解物的片段离子。直至被电离的试样在装置内被检测出为止也会发生试样的分解(碎片化),但也可能在电离之前、与电离同时发生试样的分解(碎片化)。
[0083]
根据以上情况,可以得到由试样中包含的分子来源的离子的m/z值所对应的多个峰构成的质谱。这些峰包括源自有助于抗原性的分子结构部分的峰。例如,大肠杆菌的o抗原重复了由3至5个单糖构成的单元,因此可观测到多个源自该结构单元的间隔的峰。另外,也可观察到源自构成该单元的单糖的分子量的峰。
[0084]
本发明中,获得源自由多个单糖构成的基本结构的一个单元的峰间隔、即第1峰组的相邻的峰间隔的大小作为m/z的实测值,并对其加以利用。
[0085]
另外,也同样可以利用源自构成该基本结构的单糖的分子量的峰间隔的大小(m/z值)。此处,将在构成第1峰组的各峰之间检测出的由多个单糖分子量来源的峰组成的峰组称为“第2峰组”。
[0086]
a
‑
2关于工序2和工序3
[0087]
工序2是对前述第1峰组的峰间隔实测m/z值与针对特定的血清型所对应的该基本结构的另行得到的m/z值进行对照的工序。工序3是根据前述对照工序的结果,将针对与前述第1峰组的峰间隔实测m/z值一致的该基本结构的前述另行得到的m/z值所对应的特定的血清型判定为该微生物的血清型的工序。
[0088]
本发明中,对于某些特定的血清型,另行预先获得源自由多个单糖构成的基本结构的一个单元位的峰间隔的大小作为m/z的预定值。将这些与通过前述的测定而得到的第1峰组的峰间隔实测m/z值进行对照,可以将一致者确定为该微生物的血清型。
[0089]
进而,也对源自构成前述基本结构的单糖的分子量的峰间隔的大小(m/z)进行对照而能够提高确定血清型的准确度。因此,本发明中,例如可以进一步包括峰间隔实测m/z值与峰间隔预定m/z值进行对照,追加其对照结果作为血清型确定的条件的工序,所述峰间隔实测m/z值是第2峰组的峰与和其相邻的第1峰组的峰或第2峰组的峰的峰间隔实测m/z值,所述峰间隔预定m/z值是针对构成特定的血清型所对应的前述基本结构的单糖的分子量来源的检测峰组的另行得到的峰间隔预定m/z值、或针对构成该基本结构的单糖的分子量来源的峰组通过计算而另行得到的峰间隔预定m/z值。
[0090]
对于针对特定的血清型所对应的该基本结构的另行预先得到的峰间隔预定m/z值,例如在已知有助于抗原性的该基本结构的情况下,可以通过基于其结构进行计算而得到。例如,大肠杆菌o15的o抗原是由半乳糖、乙酰岩藻糖胺和乙酰葡糖胺这3个单糖而构成重复单元,因此是由各自的分子量总和减去因糖苷键而失去3个水分子后的分子量而得到的值。具体而言,成为m/z 552.5(180.155 205.208 221.207
‑3×
18.015=552.53)。
[0091]
另外,也可以计算出峰间隔的大小(m/z值),该峰间隔的大小(m/z值)源自形成基本结构的单糖的分子量,其中,抗原的脂多糖的糖链部分由多个单糖的组合构成。o15的情况,源自半乳糖的m/z 162.1(180.155
‑
18.015=162.140)、源自乙酰岩藻糖胺的m/z 187.2(205.208
‑
18.015=187.193)、源自乙酰葡糖胺的m/z 203.2(221.207
‑
18.015=203.192)。
[0092]
一旦进行计算,则自第2次起就可以利用该计算结果作为该预定值。预先收集该计算结果并创建数据库是有用的。另外,也可以将其他人计算出的值用作该规定值。也可以利用其他人构建的数据库。
[0093]
另外,可以通过使用已知血清型的微生物的方法而获得该预定值。例如,利用使用了抗体的方法等,对于已知血清型的微生物利用与本发明同样的方法获得质谱,可以获得在该质谱上观测到的连续的等间隔的重复峰的其间隔的m/z值。也可以获得源自单糖分子量的峰间隔作为m/z值。可以将这些值作为预定值,作为该血清型的峰间隔而利用。
[0094]
本发明中也包括本发明判定方法,所述方法进一步包括如下工序:对已知血清型的微生物待检体实施前述工序1~工序3,获得在得到的质谱上观测到的连续的等间隔的重复峰的其间隔的m/z值,将上述m/z值用作前述预定值。
[0095]
若一旦测定,则可以重复利用该值。预先收集该测定值并创建数据库是有用的。另外,也可以利用由其他人获得的测定的值或其他人测定而构建的数据库。
[0096]
通过在不进行进一步数值化的情况下直接对质谱彼此进行比较,也能够进行血清型的判定,可以实施本发明判定方法。
[0097]
b本发明的血清型判定装置
[0098]
本发明的血清型判定装置(以下称为“本发明判定装置”。)的特征在于,其为用于判定微生物的血清型的装置,所述微生物的形成抗原的脂多糖的糖链部分是以由多个单糖的组合构成的基本结构作为一个单元重复多次而成的,所述装置包括以下1~4的装置部。
[0099]
数据获取部1,获取通过对由判定对象的微生物待检体制备的包含抗原位点的试样进行质谱分析而得到的质谱数据;
[0100]
第1峰间隔获取部2,在由前述数据获取部得到的质谱中,选择由以等间隔连续地重复检测出的多个峰组成的第1峰组,获得该第1峰组的相邻的各峰之间的m/z值之差作为第1峰组的峰间隔实测m/z值;
[0101]
数据对照部3,对前述实测m/z值与针对特定的血清型所对应的该基本结构的另行得到的m/z值进行对照;
[0102]
血清型判定部4,将与前述实测m/z值一致的、前述另行得到的m/z值所对应的特定的血清型判定为该微生物的血清型。
[0103]
用流程图示出本发明判定装置的方式,例如可以用图10所示。
[0104]
由判定对象的微生物待检体制备的包含抗原位点的试样例如可以如本发明判定方法的前述工序1的项目中说明的那样获得。
[0105]
作为能够对制备的试样进行质谱分析的装置,只要至少包括电离装置和质量分离装置、且包括能够测定带电粒子的m/z的装置就没有特别限定。
[0106]
该电离装置中的电离方法没有特别限定,主要的分析对象为糖链,因此从在保持分子结构的状态下容易使其电离的观点出发,期望利用软电离法,作为该电离法,例如可列举出fab、maldi、esi、pesi、apci、dios、saldi。从容易产生有助于分析分子结构的分析的片段离子的观点出发,可以使用cid。
[0107]
另外,该质量分离装置中的质量分离方法也没有限定。例如可以使用磁场型质谱仪、q ms、it ms、tof ms、ft
‑
icr ms、静电场轨道阱。
[0108]
此外,作为质谱分析装置,可以是上述电离法和质量分离法中任意的组合。例如可以使用maldi
‑
tof ms、esi
‑
tof ms、apci
‑
tof ms、esi
‑
it ms、apci
‑
it ms、fab
‑
it ms、esi
‑
q ms、pesi
‑
q ms、apci
‑
q ms,但不限定于这些。
[0109]
该质谱分析装置可以是单聚焦ms,也可以是ms/ms、ms
n
。另外,也可以进一步包括具有色谱仪、显微镜等的功能的其它手段。因此,该质谱分析装置也可以是lc/ms、sfc/ms、成像质谱显微镜(imaging mass microscopy)等。
[0110]
作为上述1~4的装置部,例如可列举出计算机等信息处理装置,收纳于包括上述装置在内的装置的内部或通过有线或无线与其外部连接。这些装置部中,首先通过数据获取部可以得到由对应于试样中包含的分子的质量和电荷的多个峰构成的质谱。此外,选择在得到的波谱上观测到的由以等间隔连续地重复检测出的多个峰组成的峰组作为第1峰组,第1峰组的相邻的各峰之间、即重复单元的m/z的值的差值可通过第1峰间隔获取部获取为第1峰组的峰间隔实测m/z值。例如,大肠杆菌的o抗原重复了由3至5个单糖构成单元,因此其结构单元成为第1峰组,源自其的峰之间的m/z差值作为实测值而获取。另外,该数据获取部也可以获得源自构成该单元的单糖的分子量的峰的m/z值和峰间隔m/z值。
[0111]
接着,本发明判定装置通过对第1峰组的峰间隔实测m/z值与针对特定的血清型所对应的该基本结构的另行得到的m/z的预定值进行对照的数据对照部而可对前述得到的实测值与另行得到的预定值进行对照。该预定值例如可以与前述同样地获得。此外,该预定值中,通过将与前述得到的实测值一致的预定值的血清型确定为该微生物的血清型的血清型判定部而可判定该微生物的血清型。进而,通过数据对照部,也能够对源自单糖的峰间隔的大小进行对照,而提高确定血清型的准确度。
[0112]
本发明判定装置可以具备以下5和/或6的装置部。
[0113]
数据对照部5,其对峰间隔实测m/z值与峰间隔预定m/z值进行对照,所述峰间隔实测m/z值是通过对在构成前述第1峰组的各峰之间检测出的由多个单糖分子量来源的峰组成的峰组的峰与和其相邻的第1峰组的峰或该单糖分子量来源的峰的峰间隔实测m/z值,所述峰间隔预定m/z值是对于源自构成特定的血清型所对应的上述基本结构的单糖的分子量的检测峰组的另行得到的峰间隔预定m/z值、或针对构成该基本结构的单糖的分子量通过计算另行得到的预定m/z值,
[0114]
血清型判定部6,其能追加其对照结果作为血清型确定的条件。
[0115]
该数据对照部5和血清型判定部6可以分别兼备上述数据对照部3和血清型判定部4,或者也可以是各自独立的装置部。
[0116]
上述1~6的装置部可以彼此独立,也可以是任意组合了2个以上的装置。例如,可以将上述1的装置部与上述2的装置部合并而形成为1个装置部。或者可以将上述1~6全部的装置部形成为1个装置部。
[0117]
本发明判定装置成为对象的微生物和血清型与本发明判定方法成为对象的微生物和血清型同样,且如上所述。
[0118]
c本发明的血清型判定程序
[0119]
本发明的血清型判定程序(以下称为“本发明判定程序”。)是用于判定微生物的血清型的程序,所述微生物的形成抗原的脂多糖的糖链部分是以由多个单糖的组合构成的基本结构作为一个单元重复多次而成的,所述程序用于执行包括以下步骤1~步骤4的步骤。
[0120]
步骤1,对由判定对象的微生物待检体制备的包含抗原位点的试样进行质谱分析,在由此得到的波谱中,获取以等间隔连续地重复检测出的多个峰的相邻的各峰的间隔作为实测m/z值;
[0121]
步骤2,对前述实测m/z值与针对特定的血清型所对应的该基本结构的另行得到的m/z值进行对照;
[0122]
步骤3,将与前述实测m/z值一致的、前述另行得到的m/z值所对应的特定的血清型判定为该微生物的血清型;
[0123]
步骤4,输出前述已判定的该微生物的血清型。
[0124]
本发明判定程序是用于操纵前述的本发明判定装置的程序。
[0125]
本发明判定程序通过使用质谱分析装置、数据处理装置、存储介质、输出装置等硬件资源而具体地实现上述微生物的血清型判定,任选组入前述或除前述以外任意的硬件资源中或装入其中。因此,作为本发明判定程序,也包括固件、中间件、应用软件等任意方式的程序。
[0126]
本发明判定程序中,与本发明判定装置和操作者等的接口相对应的程序通常可以通过本发明判定装置中包含的计算机来执行。也可以通过未包含于本发明判定装置中的计算机来执行。该计算机只要内置有进行计算、数据处理等的处理器、且具备本发明判定装置的操作方面最低限定所需的输入装置和存储介质就没有特别限定,可以是台式或笔记本式,且可以是平板终端、智能手机、可穿戴设备等。
[0127]
用流程图示出本发明判定程序的方式,可以例如图11所示。
[0128]
通过执行步骤1的程序,通过数据处理装置获取在通过质谱分析装置而得到的波谱上观测到的连续的等间隔的重复峰的间隔作为m/z的实测值,该数据根据需要被存储于
适当的存储介质中。另外,在步骤1中,也获取源自构成该单元的单糖的分子量的峰的m/z值和峰间隔m/z值,该数据根据需要被存储于存储介质中。
[0129]
作为上述质谱分析装置所列举的装置如上所述。作为上述数据处理装置,可列举出cpu、mpu等处理器。作为上述适当的存储介质,可以列举出磁记录装置(硬盘等)、光盘(cd、dvd、blu
‑
ray(注册商标)等)、光磁记录介质、半导体存储器(闪速存储器、dram、sram等)等。
[0130]
通过执行步骤2的程序,从而可通过数据处理装置对前述实测值、与特定的血清型所对应的重复峰间隔的另行得到的m/z的预定值进行对照,该数据可根据需要存储于上述那样的适当的存储介质中。此外,通过执行步骤3的程序,从而通过数据处理装置判别在另行得到的预定值中与前述实测值一致的预定值的血清型与该微生物的血清型,该数据可根据需要存储于上述那样的存储介质中。步骤2与3可以并行执行。
[0131]
在步骤2或3中,也组入对源自单糖的峰间隔的大小进行对照的程序,能够提高血清型确定的准确度。
[0132]
通过执行步骤4的程序,从而通过适当的输出装置可输出所确定的该微生物的血清型。上述输出可以在显示器、打印机、适当的存储介质中进行,除此之外也可以借助电气通信线路(例、互联网)在其它计算机中进行。
[0133]
本发明判定程序可以进一步具备以下步骤5和/或步骤6。
[0134]
步骤5,将间隔实测m/z值与峰间隔预定m/z值进行对照,所述峰间隔实测m/z值是在连续的等间隔的重复峰之间检测出的由多个单糖分子量来源的峰组成的峰组的峰与和其相邻的该重复峰或该单糖分子量来源的峰的峰间隔实测m/z值;所述峰间隔预定m/z值是针对源自构成特定的血清型所对应的上述基本结构的单糖的分子量的检测峰组的另行得到的峰间隔预定m/z值、或针对构成该基本结构的单糖的分子量通过计算而另行得到的预定m/z值;
[0135]
步骤6,追加该对照结果作为血清型确定的条件。
[0136]
具体实现该步骤5和步骤6的各步骤的硬件资源分别与步骤2和步骤3同样。
[0137]
步骤1~6的程序可以彼此独立,也可以是任意组合了2个以上。例如,可以将步骤1的程序与步骤2的程序合并成1个程序。或者,也可以将步骤1~6的程序作为1个程序。
[0138]
成为本发明判定程序对象的微生物和血清型与成为本发明判定方法对象的微生物和血清型是相同的,如上所述。
[0139]
实施例
[0140]
以下示出实施例对本发明进行进一步具体地说明,但本发明不限定于下述的实施例。
[0141]
[实施例1]
[0142]
本实施例中,利用maldi
‑
tof ms(岛津制作所株式会社制axima performance)测定大肠杆菌的脂多糖,将等间隔的重复峰的大小与由脂多糖的o抗原位点的分子结构计算出的值进行对照而确定了血清型。
[0143]
作为要确定血清型的试样,从fujifilm wako pure chemical corporation(编号129
‑
05461)购入大肠杆菌o157来源脂多糖。由于购入了明示了来源的标准产品,因此在试验前已知血清型,但即使是未知的情况,操作也完全相同,被认为是未知时进行以下的测
定、数据解析、对照等。
[0144]
将购入的粉末状的大肠杆菌o157来源脂多糖溶解于纯化水中,稀释成0.1mg/ml的浓度(以下记为“o157
‑
lps溶液”。)。使用以1比1混合了纯化水和乙腈的溶剂将2,5
‑
二羟基苯甲酸溶解,并稀释成2.5mg/ml(以下记为“dhb溶液”。)。将o157
‑
lps溶液与dhb溶液等量混合,向质谱分析用靶板上滴加1μl该混合溶液,进行干燥固化,作为质谱分析的试样。将该试样置于靶板上的状态下设置于质谱分析装置(岛津制作所株式会社制axima performance)的试样位置,以正离子模式进行测定。通过该测定而可以得到图1的质谱。
[0145]
得到的质谱(图1)中观察到周期性重复。例如,m/z 2615.49、m/z 3314.61、m/z 4012.15、m/z 4711.87等,它们的间隔为m/z 699.12、m/z 697.54、m/z 699.72,因此几乎为等间隔。另外,这些间隔中也观察到源自构成重复单元的单糖的峰间隔。例如,为m/z 2615.49和m/z 2818.22,其差值为m/z 202.73,因此可认为是一种乙酰己糖胺。由此图2将计算出峰间的差值的一部分结果加入质谱中。
[0146]
接着,在报道了由肠道出血性大肠杆菌所致的食物中毒的致病菌的血清型中,对于o26、o103、o111和o157,利用参考文献(the structures of escherichia coli o
‑
polysaccharide antigens.,fems microbiol.rev.30:382
‑
403.)等,由o抗原的分子结构计算出重复单元的大小。下述表1汇总了它们的计算结果。
[0147]
[表1]
[0148][0149]
也如图2所示,该试样的重复单元约为m/z 699,与表1的o157的值几乎一致。因此,该试样的血清型可确定为o157。另外,图1或图2中,可观察到多个反映出构成重复单元的单糖的峰间隔。例如,图2的m/z 2119.67、m/z 2307.10、m/z 2615.49、m/z 2818.92的峰的间隔为m/z 187.5、m/z 145.9、m/z 162.5、m/z 203.4,与表1的o157中的构成重复单元的糖的分子量(脱水)高度一致。由该结果也可以判定本实施例中的待检体的血清型为o157。
[0150]
[实施例2]
[0151]
本实施例中,通过基质辅助激光解吸电离法
‑
飞行时间质谱分析装置测定大肠杆菌的脂多糖,将该波谱与血清型已知的待检体的波谱进行对比而确定了血清型。
[0152]
作为要确定血清型的试样,从sigma公司(编号l3023)购入大肠杆菌o111来源脂多糖。另外,作为进行对比的血清型已知的试样,从fujifilm wako pure chemical corporation(编号129
‑
05461)购入大肠杆菌o157来源脂多糖,从millipore公司(编号437627)购入大肠杆菌o111来源脂多糖,从fujifilm wako pure chemical corporation(编号126
‑
05471)购入大肠杆菌o103来源脂多糖。由于购入了明示了来源的标准产品,因此在试验前已知血清型,但即使是未知的情况,操作也完全相同,被认为是未知时进行以下的测定、数据解析、对照等。
[0153]
汇总本实施例中使用的试样,如以下的表2所示。
[0154]
[表2]
[0155][0156]
本实施例中,待检体、参照待检体a、参照待检体b和参照待检体c通过基于纯化水的溶解和稀释等而制成0.1mg/ml的浓度。使用以1比1混合了纯化水和乙腈的溶剂将2,5
‑
二羟基苯甲酸溶解,并稀释成2.5mg/ml。分别将前述的4种待检体的溶液与前述的2,5
‑
二羟基苯甲酸的溶液等量混合,将该混合溶液1μl滴加至质谱分析用靶板,进行干燥固化,作为质谱分析的试样。在将这些试样置于靶板上的状态下设置于质谱分析装置(岛津制作所株式会社制axima performance)的试样位置,以离子模式进行测定。通过该测定,如图3所示可以得到待检体的质谱,如图4所示可以得到参照待检体a的质谱,如图5所示可以得到参照待检体b的质谱,另外如图6所示可以得到参照待检体c的质谱。
[0157]
由图3可知,待检体的重复单元的大小为m/z 788。同样地,由图4可知参照待检体a的重复单元为m/z 698,由图5可知参照待检体b的重复单元为m/z 788,由图6可知参照待检体c的重复单元为m/z 1 002。
[0158]
由这些结果证实了:待检体的重复单元的大小与参照待检体b相同。另外,由于重复单元中的源自构成糖的峰间隔也相同,因此待检体与参照待检体b的重复单元部分的结构相同,即,能够判定为相同的血清型。
[0159]
接着,通过作为现有方法的免疫色谱对3个参照待检体进行试验。将该参照待检体a的结果示于图7,将参照待检体b的结果示于图8,将参照待检体c的结果示于图9。由这些结果可知:参照待检体a的血清型为o157、参照待检体b为o111、参照待检体c为o103。
[0160]
根据以上的结果,对质谱和质谱的峰间隔的大小进行比较,结果待检体与参照待检体b为相同的血清型。根据免疫色谱,参照待检体b的血清型为o111。因此,可以判定待检体的血清型为o111。
[0161]
[实施例3]
[0162]
免疫色谱法中被认为是相同血清型的o111,通过本发明判定方法证实了具有不同的o抗原糖链结构。
[0163]
已报告的o111的糖链结构如表3的上半部分所示。
[0164]
[表3]
[0165][0166]
图12和图13是利用免疫色谱法一直以来被认为是o111的结果,试纸均只对o111的条带显色。
[0167]
对图12的大肠杆菌进行质谱分析,结果可以得到图14所示的质谱,观测到788m/z间隔的重复峰。这是结构所预期的峰间隔,判断为o111。
[0168]
另一方面,对图13的大肠杆菌进行质谱分析,结果可以得到图15所示的质谱,此处观测到829m/z间隔的重复峰。判断这不是结构所预期的峰间隔,判断为与表3上半部分所示的o111不同的表3下半部分所示的o111*。
[0169]
如上所述,在免疫色谱法中,o111和o111*均显示出相同的反应(结果),但基于质谱分析法的质谱显示出o抗原糖链的结构不同。根据本发明判定方法,推测出:o111中己糖为2个、乙酰己糖胺为1个,而o111*中己糖为1个、乙酰己糖胺为2个。
[0170]
在免疫色谱法中,可认为o111和o111*显示出同样的结果是由于使用的抗体识别了两者共通结构的部分。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。