心脏传导系统夺获
1.本文的公开内容涉及用于确定例如心房至心室(vfa)心脏疗法对心脏传导系统的夺获的系统、方法和装置。
2.植入式医疗装置(imd),如植入式起搏器、心脏复律器、除颤器或起搏器
‑
心脏复律器
‑
除颤器,为心脏提供治疗性电刺激。imd可以提供起搏以解决心动过缓,或提供起搏或电击以终止心动过速或纤颤等快速性心律失常。在一些情况下,医疗装置可以感测心脏的固有去极化,基于固有去极化(或不存在)检测心律失常,并且如果基于固有去极化检测到心律失常,则控制向心脏递送电刺激。
3.imd还可以提供心脏再同步疗法(crt),这是一种起搏形式。crt涉及向左心室或左右心室两者递送起搏。可以选择向一个或多个心室递送起搏脉冲的时间和位置以改进心室收缩的协调性和效率。
4.除了植入式医疗装置本身之外,用于植入医疗装置的系统还可以包含工作站或其它设备。在一些情况下,设备的这些其它设备辅助医师或其它技术人员将心内引线放置在心脏上或心脏中的特定位置处。在一些情况下,设备向医师提供关于心脏的电活动和心内引线位置的信息。
5.当植入起搏电极时以及在使用这种起搏电极递送起搏疗法期间,确定起搏电极和由此递送的起搏疗法是否已夺获心脏传导系统或其它心脏组织可能具有挑战性。
技术实现要素:
6.本文所描述的说明性系统、装置和方法可以被配置成在植入期间和植入之后的一个或两个期间,辅助用户(例如,医师)确定如心房至心室(vfa)起搏电极等起搏电极以及由此递送的心脏疗法是否已夺获了心脏传导系统,而不是其它心脏组织。进一步地,本文所描述的说明性系统、装置和方法可以被配置成辅助用户(例如,医师)确定患者是否存在a
‑
v阻断(例如,不存在跨a
‑
v结从心房到心室的自然传导)。
7.在一个或多个实施例中,系统、装置和方法可以被描述为无创的。例如,在一些实施例中,系统、装置和方法可能不需要或包含如引线、探针、传感器、导管、植入式电极等植入式装置来监测或获取来自患者的组织的多个心脏信号以用于确定心脏传导系统的夺获(而不是其它心脏组织的夺获)和a
‑
v阻断。替代地,系统、装置和方法可以使用无创进行的电测量,使用例如附接到患者的躯干周围的患者皮肤的多个外部电极。在一个或多个实施例中,系统、装置和方法可以被描述为无创的,因为此类系统、装置和方法可以利用植入式电极来监测电活动以用于确定或评估心脏传导系统夺获和/或a
‑
v阻断。另外,应当理解,在一些实施例中,可以同时使用有创和无创两种设备和过程。
8.可以描述说明性系统、装置和方法涉及心房至心室(vfa)起搏,如将在本文中进一步描述的。vfa起搏可能导致夺获仅心肌而不夺获心脏传导系统。确定心脏传导系统的夺获可以被描述为对于确定或评估递送vfa起搏疗法的引线和/或起搏装置的放置是有用的。在一个实施例中,说明性系统、装置和方法通常可以被描述为包含以等于患者固有a
‑
v延迟的70%的a
‑
v延迟或间期递送起搏,并以约10毫秒(ms)到约20毫秒的步长逐渐减小a
‑
v延迟或
间期,直到预定的最小值为60毫秒。可以测量来自外部电极设备和间期电极设备中的一个或多个的电活动(例如,激活时间、电描记图和心电图),并且可以基于所测量的电活动来确定或生成不同步信息。
9.在不存在心脏传导系统夺获的情况下,由于细胞间传导,较短a
‑
v起搏间期的不同步可能增加。在一个或多个实施例中,如果电不同步值(例如,由从电极设备监测的电活动产生)在初始a
‑
v延迟或间期、起搏时低(例如,激活时间的标准偏差(sdat)小于或等于约25毫秒,平均左心室或胸替代电激活时间(lvat)小于或等于约40毫秒等)并且电不同步值以较短的a
‑
v起搏间期继续保持低位,则可以确定心脏传导系统的夺获。在一个或多个实施例中,如果处于短a
‑
v起搏间期的心电图(ecg)和/或电描记图(egm)与处于较长av起搏间期的ecg和/或egm在qrs形态和/或持续时间中的一个或两个方面类似(例如,紧密匹配、在公差水平内等),则可以确定心脏传导系统的夺获。
10.一个说明性系统可以包含电极设备,所述电极设备包括用于监测来自患者的组织的电活动的多个电极;以及计算设备,所述计算设备包括处理电路系统,并且耦接到所述电极设备。所述计算设备可以被配置成:在以多个诊断性a
‑
v延迟递送心房至心室(vfa)起搏疗法期间使用所述多个电极中的一个或多个电极监测所述患者的心脏的电活动,其中所述多个诊断性a
‑
v延迟中的每个诊断性a
‑
v延迟小于所述患者的固有a
‑
v延迟;并且基于在以所述多个诊断性a
‑
v延迟递送vfa起搏疗法期间的监测到的电活动来确定所述vfa起搏疗法是否已夺获心脏传导系统。
11.一种说明性方法可以包含在以多个诊断性a
‑
v延迟递送心房至心室(vfa)起搏疗法期间使用多个电极中的一个或多个电极监测所述患者的心脏的电活动,其中所述多个诊断性a
‑
v延迟中的每个诊断性a
‑
v延迟小于所述患者的固有a
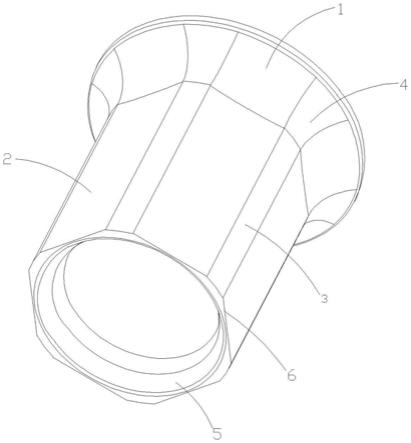
‑
v延迟;并且基于在以所述多个诊断性a
‑
v延迟递送vfa起搏疗法期间的监测到的电活动来确定所述vfa起搏疗法是否已夺获心脏传导系统。
12.一种说明性植入式医疗装置可以包含多个电极,所述多个电极包括:右心房电极,所述右心房电极可定位于右心房内,以向患者的心脏的右心房递送心脏疗法或感测所述右心房的电活动;以及组织刺穿电极,所述组织刺穿电极可穿过右心房心内膜和中心纤维体植入,以向患者的心脏的左心室递送心脏疗法或感测所述左心室的电活动。所述说明性装置可以进一步包含:疗法递送电路,所述疗法递送电路可操作地耦接到所述多个电极以向所述患者的心脏递送心脏疗法;以及感测电路,所述感测电路可操作地耦接到所述多个电极以感测所述患者的心脏的电活动。所述说明性装置可以进一步包含控制器,所述控制器包括可操作地耦接到所述疗法递送电路和所述感测电路的处理电路系统。所述控制器可以被配置成至少使用所述组织刺穿电极以多个诊断性a
‑
v延迟递送心房至心室(vfa)起搏疗法,其中所述多个诊断性a
‑
v延迟中的每个诊断性a
‑
v延迟小于所述患者的固有a
‑
v延迟,在以所述多个诊断性a
‑
v延迟递送vfa起搏疗法期间使用所述多个电极中的一个或多个电极监测所述患者的心脏的电活动,并且基于在以所述多个诊断性a
‑
v延迟递送vfa起搏疗法期间的监测到的电活动来确定所述vfa起搏疗法是否已夺获心脏传导系统。
13.以上概述不旨在描述本公开的每个实施例或每种实施方案。通过结合附图参考以下详细描述和权利要求,更完整的理解将变得显而易见的并且理解。
附图说明
14.图1是包含植入在患者的心脏中的心内医疗装置和定位在患者的心脏的外部的单独的医疗装置的说明性心脏疗法系统的概念图。
15.图2是图1的心内医疗装置和患者的心脏的解剖结构的放大概念图。
16.图3是用于与本文所描述的说明性系统和装置一起使用的示出了各种电极植入位置的左心室的标准17段视图中患者的心脏图的概念图。
17.图4是用于与本文所描述的说明性系统和装置一起使用的具有远侧固定和电极组合件的心内医疗装置的透视图,所述远侧固定和电极组合件包含被实施为环形电极的远侧基于壳体的电极。
18.图5是用于与本文所描述的说明性系统和装置一起使用的另一种说明性心内医疗装置的透视图。
19.图6是可以围封在例如图1
‑
2和4
‑
5的医疗装置的壳体内以提供本文所描述的功能和疗法的说明性电路系统的框图。
20.图7是确定心脏传导系统夺获的说明性方法的框图。
21.图8a
‑
8c是随着减小的a
‑
v延迟或间期的不同步的图,描绘了心脏传导系统夺获、无心脏传导系统夺获和a
‑
v阻断的各种场景。
22.图9是包含电极设备、显示设备和计算设备的说明性系统的图。
23.图10
‑
11是用于测量躯干表面电位的说明性外部电极设备的图。
具体实施方式
24.在说明性实施例的以下详细说明中,对图的附图进行了参考,所述附图形成具体实施例的一部分,且在附图中通过说明方式示出了可以实践的具体实施例。应理解,在不脱离(例如,仍然落入)特此呈现的本公开的范围的情况下,可以利用其它实施例,并且结构范围可以改变。
25.将参考图1
‑
11描述说明性系统、方法和装置。对本领域技术人员来说显而易见的是,一个实施例的元件或过程可以与其它实施例的元件或过程组合使用,并且使用本文所阐述的特征的组合的此类系统、方法和装置的可能实施例不限于图中所示和/或本文描述的特定实施例。进一步地,将认识到本文所描述的实施例可以包含许多不一定按比例示出的元件。仍进一步地,将认识到,本文的过程的时序和各种元件的大小和形状可以被修改但仍然落入本公开的范围内,尽管某些时序、一种或多种形状和/或大小或元件类型,可能优于其它元件。
26.图1描绘了说明性心房至心室(vfa)心脏疗法系统,所述系统可以被配置成与例如本文关于图1
‑
11所描述的系统和方法一起使用。尽管应当理解,本公开可以利用无引线和有引线植入式医疗装置中的一个或两个,但是图1的说明性心脏疗法系统包含无引线心内医疗装置10,所述无引线心内医疗装置可以被配置成用于单腔或双腔疗法并植入在患者的心脏8中。在一些实施例中,装置10可以被配置成用于单腔起搏,并且可以例如在单腔起搏与多腔起搏(例如,双腔或三腔起搏)之间进行切换。如本文中所使用的,“心内”是指被配置成完全植入在患者的心脏内,例如,以提供心脏疗法的装置。示出了植入在患者的心脏8的右心房(ra)的目标植入区域4中的装置10。装置10可以包含将装置10的远端锚定在目标植
入区域4中的心房心内膜上的一个或多个固定构件20。目标植入区域4可以位于希氏束5与冠状窦3之间,并且可以邻近或紧邻三尖瓣6。装置10可以被描述为心房至心室装置,因为装置10可以在通常安置在右心房中的同时可以进行或执行两者之一:感测来自一个或两个心室(例如,右心室、左心室或两个心室,视情况而定)的电活动并向其提供疗法。具体地,装置10可以包含组织刺穿电极,所述组织刺穿电极可以从右心房的科赫三角(triangle of koch)区域通过右心房心内膜和中心纤维体植入在患者的心脏的左心室心肌的基底和/或隔区域中。
27.装置10可以被描述为无引线植入式医疗装置。如本文所使用的,“无引线”是指没有从患者的心脏8延伸出来的引线的装置。进一步地,尽管无引线装置可以具有引线,但引线不会从患者的心脏外部延伸到患者的心脏内部或者不会从患者的心脏内部延伸到患者的心脏外部。一些无引线装置可以穿过静脉引入,但是一旦被植入,所述装置就没有或可以不包含任何经静脉引线,并且可以被配置成在不使用任何经静脉引线的情况下提供心脏疗法。进一步地,当装置的壳体定位于心房中时,具体地,无引线vfa装置不使用引线来可操作地连接到心室中的电极。另外,无引线电极可以耦接到医疗装置的壳体,而无需在电极与壳体之间使用引线。
28.装置10可以包含镖电极组合件12,所述镖电极组合件限定或具有从装置10的远端区域延伸的笔直轴。镖电极组合件12可以放置或者至少被配置成放置为穿过心房肌和中心纤维体并且进入到心室肌14中或沿着心室间隔,而不完全穿透心室心内膜或心外膜表面。镖电极组合件12可以携带或包含轴的远端区域处的电极,使得所述电极可以定位在心室心肌内,以用于感测心室信号并递送心室起搏脉冲(例如,使左心室和/或右心室去极化以引起左心室和/或右心室的收缩)。在一些实例中,在轴的远端区域处的电极是被提供以在用于起搏和感测的双极电极对中使用的阴极电极。虽然如所展示的植入区域4可以使得镖电极组合件12的一个或多个电极能够定位于心室心肌中,但是应认识到,具有本文所公开的各方面的装置可以在适当时被植入在其它位置以进行多腔起搏(例如,双腔或三腔起搏)、伴有多腔感测的单腔起搏、单腔起搏和/或感测,或其它临床疗法和应用。
29.应理解,尽管本文将装置10描述为包含单个镖电极组合件,但是装置10可以包含多于一个镖电极组合件,所述多于一个镖电极组合件放置或被配置成放置为通过心房心肌和中心纤维体并且到心室心肌14中或沿着心室间隔,而不完全通过心室心内膜或心外膜表面。另外,每个镖电极组合件可以在轴的远端区域处或沿轴的其它区域(例如,近侧区域或中心区域)携带或包含多于单个电极。
30.心脏疗法系统2还可以包含单独的医疗装置50(在图1中示意性地描绘),所述单独的医疗装置可以定位在患者的心脏8的外部(例如,皮下)并且可以可操作地耦接到患者的心脏8以向其递送心脏疗法。在一个实例中,单独的医疗装置50可以是血管外icd。在一些实施例中,血管外icd可以包含除颤引线,所述除颤引线包含或携带除颤电极。在除颤引线上的除颤电极与icd的壳体电极之间可以存在疗法载体。进一步地,icd的一个或多个电极也可以用于感测与患者的心脏8有关的电信号。icd可以被配置成递送包含一种或多种除颤或心脏复律电击的电击疗法。例如,如果感测到心律失常,则icd可以通过电引线发送脉冲,以电击心脏并且恢复其正常节律。在一些实例中,icd可以递送电击疗法而无需将电引线放置在心脏内或将电线直接附接到心脏(皮下icd)。可以与本文所描述的系统2一起使用的血管
外皮下icd的实例可以在2016年3月8日发布的美国专利第9,278,229号(reinke等人)中进行描述。
31.在电击疗法(例如,由除颤引线的除颤电极提供的除颤电击)的情况下,单独的医疗装置50(例如,血管外icd)可以包含控制电路,所述控制电路使用疗法递送电路来生成具有多种波形特性(包含前沿电压、倾斜度、所递送的能量、脉冲相位等)中的任何波形特性的除颤电击。疗法递送电路可以例如生成单相、双相或多相波形。另外,疗法递送电路可以生成具有不同量的能量的除颤波形。例如,疗法递送电路可以生成为皮下除颤递送总共大约60
‑
80焦耳(j)之间的能量的除颤波形。
32.单独的医疗装置50可以进一步包含感测电路。感测电路可以被配置成获得通过电极的一种或多种组合感测的电信号,并且处理所获得的信号。感测电路的组件可以包含模拟组件、数字组件或其组合。感测电路可以例如包含一个或多个读出放大器、滤波器、整流器、阈值检测器、模数转换器(adc)等。感测电路可以将感测到的信号转换为数字形式,并且将数字信号提供给控制电路以进行处理和/或分析。例如,感测电路可以放大来自感测电极的信号,并且通过adc将放大的信号转换为多位数字信号,并且然后将数字信号提供给控制电路。在一个或多个实施例中,感测电路还可以将经过处理的信号与阈值进行比较,以检测心房或心室去极化(例如,p波或r波)的存在并且向控制电路指示心房去极化(例如,p波)或心室去极化(例如,r波)的存在。
33.装置10和单独的医疗装置50可以协作以向患者的心脏8提供心脏疗法。例如,装置10和单独的医疗装置50可以用于检测心动过速、监测心动过速和/或提供心动过速相关疗法。例如,装置10可以与单独的医疗装置50进行无线通信,以使用单独的医疗装置50来触发电击疗法。如本文所使用的,“无线”是指在装置10与单独的医疗装置50之间不使用金属导体的操作性耦接或连接。在一个实例中,无线通信可以使用由装置10提供的传导通过患者的组织并且可由单独的医疗装置50检测到的独特、信令或触发电脉冲。在另一个实例中,无线通信可以使用装置10的通信接口(例如,天线)来提供电磁辐射,所述电磁辐射传播通过患者的组织并且可例如使用单独的医疗装置50的通信接口(例如,天线)检测到。
34.图2是图1的心内医疗装置10和患者的心脏8的解剖结构的放大概念图。具体地,装置10被配置成感测电活动和/或递送起搏疗法。心内装置10可以包含壳体30。壳体30可以限定装置10的内部组件(如结合图6总体上所描述的感测电路、疗法递送电路、控制电路、存储器、遥测电路、其它任选的传感器以及电源)所驻留的气密密封内部空腔。壳体30可以包含(例如,由其形成或从其形成)例如钛或钛合金、不锈钢、mp35n(非磁性镍钴铬钼合金)、铂合金或其它生物兼容性金属或金属合金等导电材料。在其它实例中,壳体30可以包含非导电材料(例如,由其形成或从其形成),所述非导电材料包含陶瓷、玻璃、蓝宝石、硅酮、聚氨基甲酸酯、环氧树脂、乙酰基共聚物塑料、聚醚醚酮(peek)、液晶聚合物或其它生物兼容性聚合物。
35.在至少一个实施例中,壳体30可以被描述为在远端区域32与近端区域34之间延伸并且被描述为限定总体上圆柱形的形状,例如以促进导管递送。在其它实施例中,壳体30可以是棱柱形或任何其它形状以执行本文所描述的功能和效用。壳体30可以包含例如限定或定位在近端区域34处的用于在装置10的植入期间与递送工具接合的递送工具接口构件26。
36.壳体30的全部或一部分可以在心脏疗法期间充当感测和/或起搏电极。在所示的
实例中,壳体30包含近侧基于壳体的电极24,所述电极外接壳体30的近侧部分(例如,与远端区域32相比,更靠近近端区域34)。当壳体30(例如,限定导电材料(如钛合金或上文所列的其它实例)、由其形成等时,可以通过非导电材料(如聚对二甲苯、聚氨基甲酸酯、硅酮、环氧树脂或其它生物兼容性聚合物的涂层)对壳体30的部分进行电绝缘,从而使导电材料的一个或多个离散区暴露出来以形成或限定近侧基于壳体的电极24。当壳体30(例如,限定例如陶瓷、玻璃或聚合物材料等非导电材料或由其形成等)时,可以将例如钛、铂、不锈钢或其合金之类的导电涂层或层施加到壳体30的一个或多个离散区,以形成或限定近侧基于壳体的电极24。在其它实例中,近侧基于壳体的电极24可以是安装或组装到壳体30上的组件,如环形电极。近侧基于壳体的电极24可以例如通过导电壳体30或当壳体30是非导电材料时通过电导体电耦接到装置10的内部电路系统。
37.在所示出的实例中,近侧基于壳体的电极24被定位成与壳体远端区域32相比,更靠近壳体近端区域34,并且因此可以被称为近侧基于壳体的电极24。然而,在其它实例中,近侧基于壳体的电极24可以定位于沿壳体30的其它定位处,例如,相对于所示位置更远。
38.在远端区域32处,装置10可以包含远侧固定和电极组合件36,所述远侧固定和电极组合件可以包含一个或多个固定构件20和长度相等或不相等的一个或多个镖电极组合件12。在如所示出的一个此类实例中,单个镖电极组合件12包含向远侧延伸远离壳体远端区域32的轴40,以及在轴40的自由远端区域处或附近的一个或多个电极元件,如尖端电极42。尖端电极42可以具有圆锥形或半球形的远侧尖端,所述远侧尖端具有相对较窄的尖端直径(例如,小于约1毫米(mm)),其用于穿入并且穿过组织层,而无需使用具有尖锐或斜面边缘的尖锐尖端或针状尖端。
39.镖电极组合件12可以被配置成刺穿一个或多个组织层,以将尖端电极42定位于期望的组织层(例如,心室心肌)内。如此,轴40的高度47或长度可以对应于预期的起搏部位深度,并且轴40可以沿其纵向轴线具有相对较高的抗压强度,以在被压向并进入到植入区域4时抵抗在侧向或径向方向上弯曲。如果采用第二镖电极组合件12,则其长度可以不等于预期的起搏部位深度,并且可以被配置成充当用于将起搏能量递送到组织和/或从所述组织感测信号的无关电极。在一个实施例中,可以例如通过向壳体30的近端区域34施加纵向推力而对尖端电极42施加纵向轴向力,以将镖电极组合件12推进到目标植入区域内的组织中。
40.轴40可以被描述为当经受横向或径向力时,在横向或径向方向上是纵向上非压缩的和/或可弹性变形的,以允许例如随着组织运动而暂时弯曲,但是当横向力减小时可返回到其正常笔直定位。因此,包含轴40的镖电极组合件12可以被描述为是弹性的。当轴40没有暴露于任何外力或仅暴露于沿其纵向中心轴线的力时,轴40可以保持如图所示的笔直的线性定位。
41.换句话说,镖电极组合件12的轴40正常可以为笔直的构件并且可以为刚性的。在其它实施例中,轴40可以被描述为是相对坚硬的,但是在侧向方向上仍具有有限的柔性。进一步地,轴40可以是非刚性的,以允许随着心脏运动而发生一些侧向弯曲。然而,在松弛状态下,当未经受到任何外力时,轴40可以维持如图所示的笔直定位,以将尖端电极42与壳体远端区域32间隔开至少轴40的高度或长度47。
42.所述一个或多个固定构件20可以被描述为具有正常弯曲定位的一个或多个“尖
齿”。尖齿可以被保持在递送工具内的向远侧延伸的定位中。在从递送工具释放时向近侧弹性地或有弹性地弯曲回到正常弯曲定位(如图所示)之前,尖齿的远侧尖端可以穿透心脏组织到有限的深度。进一步地,固定构件20可以包含例如发布于2017年6月13日的美国专利第9,675,579号(grubac等人)和发布于2015年9月1日的美国专利第9,119,959号(rys等人)中描述的一个或多个方面。
43.在一些实例中,远侧固定和电极组合件36包含远侧基于壳体的电极22。在使用装置10作为起搏器进行多腔起搏(例如,双腔或三腔起搏)和感测的情况下,尖端电极42可以用作与充当返回阳极电极的近侧基于壳体的电极24配对的阴极电极。可替代地,远侧基于壳体的电极22可以充当与用于感测心室信号并且递送心室起搏脉冲的尖端电极42配对的返回阳极电极。在其它实例中,远侧基于壳体的电极22可以是用于感测心房信号并且将起搏脉冲递送到目标植入区域4中的心房心肌的阴极电极。当远侧基于壳体的电极22充当心房阴极电极时,近侧基于壳体的电极24可以充当与用于心室起搏和感测的尖端电极42配对的返回阳极,并且可以充当与用于心房起搏和感测的远侧基于壳体的电极22配对的返回阳极。
44.如此图示中所示出的,在一些起搏应用中,目标植入区域4沿心房心内膜18,通常在av结15和希氏束5下面。镖电极组合件12可以至少部分地限定轴40的高度47或长度,以穿过目标植入区域4中的心房心内膜18,穿过中心纤维体16,并且进入到心室肌14中而不穿透心室心内膜表面17。当镖电极组合件12的高度47或长度被完全推进到目标植入区域4中时,尖端电极42可以置于心室肌14内,并且远侧基于壳体的电极22可以被定位成紧密接触或极为接近心房心内膜18。在各个实例中,镖电极组合件12可以具有尖端电极42与轴40的总组合高度47或长度,为约3mm到约8mm。轴40的直径可以小于约2mm,并且可以为约1mm或更小,或甚至约0.6mm或更小。
45.装置10可以在壳体30内包含声学和/或运动检测器11。声学或运动检测器11可以可操作地耦接到控制电路80、感测电路86或疗法递送电路84中的一个或多个,如关于图6所描述的。声学和/或运动检测器11可以用于监测机械活动,例如心房机械活动(例如心房收缩)和/或心室机械活动(例如心室收缩)。在一些实施例中,声学和/或运动检测器11可以用于检测右心房机械活动。声学和/或运动检测器11的非限制性实例包含加速度计和麦克风中的一个或两个。在一些实施例中,由声学和/或运动检测器11检测到的机械活动可以用于补充或替代由装置10的电极中的一个或多个电极检测到的电活动。例如,除了近侧基于壳体的电极24之外或作为所述近侧基于壳体的电极的替代方案,可以使用声学和/或运动检测器11。
46.声学和/或运动检测器11还可以用于速率响应检测或提供速率响应性imd。与速率响应有关的各种技术可以在以下进行描述:于1992年10月13日发布的题为“速率响应性心脏起搏器的优化(optimization for rate responsive cardiac pacemaker)”的美国专利第5,154,170号(bennett等人)以及于1996年10月8日发布的题为“用于速率响应性心脏起搏的方法和设备(method and apparatus for rate
‑
responsive cardiac pacing)”的美国专利第5,562,711号(yerich等人)。
47.在各个实施例中,声学和/或运动检测器11可以用作心音(hs)传感器,并且可以被实施为麦克风和/或1轴、2轴或3轴加速度计。在一个实施例中,声学和/或运动传感器11被
实施为安装在壳体30内的压电晶体,所述压电晶体响应于与心音相关的机械运动。可以适于与本公开的技术一起实施的声学传感器的其它实施例的实例可以在美国专利第4,546,777号(groch等人)、美国专利第6,869,404号(schulhauser等人)、美国专利第5,554,177号(kieval等人)以及美国专利第7,035,684号(lee等人)中进行总体描述。
48.换句话说,可以使用各种类型的声学和/或运动传感器11。例如,声学和/或运动传感器11可以被描述为响应于心音中的一种或多种心音的任何植入式或外部传感器,并由此能够产生或生成在时间和幅度上与心音相关的模拟电信号。然后,模拟信号可以由hs感测模块处理(其可以包含数字转换),以获得由hs感测模块或控制电路80导出的hs参数,如幅度或相对时间间期。声学和/或运动传感器11和hs感测模块可以并入能够递送crt或正在优化的另一心脏疗法的imd(例如,装置10)中,或者可以在与另一imd进行有线或无线通信的单独装置中或在如本文所描述的起搏参数优化程序期间所使用的外部编程器或计算机中实施。
49.图3是患者的心脏的二维(2d)心室图300(例如,自上而下的视图),其示出了呈标准17段视图的左心室320以及右心室322。图300限定或包含对应于人体心脏的不同区域的多个区326。如所展示的,将区326数字标记为1到17(例如,其对应于标准的17段人心脏模型,对应于人体心脏的左心室的17段)。图300的区326可以包含基底前区1、基底前隔区2、基底下隔区3、基底下区4、基底下侧区5、基底前侧区6、中前区7、中前隔区8、中下隔区9、中下区10、中下侧区11、中前侧区12、顶前区13、顶隔区14、顶下区15、顶侧区16和顶点区17。还示出了右心室322的下隔和前隔区,以及右束支(rbb)25和左束支(lbb)27。
50.在一些实施例中,本公开的任何组织刺穿电极可以被植入在患者心脏的左心室心肌的基底和/或隔区域中。具体地,组织刺穿电极可以从右心房的科赫三角区域穿过右心房心内膜和中心纤维体植入。一旦被植入,组织刺穿电极就可以定位在例如左心室心肌的基底和/或隔区域之类的目标植入区域4(图1
‑
2)中。参考图300,基底区域包含基底前区1、基底前隔区2、基底下隔区3、基底下区4、中前区7、中前隔区8、中下隔区9和中下区10中的一个或多个。参考图300,隔区域包含基底前隔区2、基底前隔区3、中前隔区8、中下隔区9和顶隔区14中的一个或多个。
51.在一些实施例中,当植入时,组织刺穿电极可以定位于左心室心肌的基底
‑
隔区域中。基底隔区域可以包含基底前隔区2、基底下隔区3、中前隔区8和中下隔区9中的一个或多个。
52.在一些实施例中,当植入时,组织刺穿电极可以定位于左心室肌的高下/后基底隔区域中。左心室心肌的高下/后基底隔区域可以包含基底下隔区3和中下隔区9中的一个或多个区(例如,仅基底下隔区、仅中下隔区或基底下隔区和中下隔区两者)的一部分。例如,高下/后基底隔区域可以包含总体上图示为虚线边界的区域324。如所展示的,虚线边界表示高下/后基底隔区域大约所在的位置,取决于特定应用,其形状或大小可能略有不同。
53.图4是能够递送起搏疗法和/或递送感测心脏信号的装置10的三维透视图。如所展示的,远侧固定和电极组合件36包含被实施为环形电极的远侧基于壳体的电极22。当固定构件20的固定构件尖齿20a、20b和20c与心房组织接合时,远侧基于壳体的电极22可以定位成紧密接触或操作性地接近心房组织。可弹性变形的尖齿20a、20b和20c可以在将装置10递送到植入部位期间向远侧延伸。例如,当从递送工具中推出装置10时,尖齿20a、20b和20c可
以刺穿心房心内膜表面,并且当所述尖齿不再约束在递送工具内时,弯曲回到其正常弯曲定位(如图所示)。当尖齿20a、20b和20c弯曲回到其正常定位时,固定构件20可以将远侧固定构件和电极组合件36拉向心房心内膜表面。当将远侧固定构件和电极组合件36“拉”向心房心内膜时,可以将尖端电极42推进穿过心房肌和中心纤维体并且进入心室肌中。然后,远侧基于壳体的电极22可以被定位成抵靠或邻近心房心内膜表面。
54.远侧基于壳体的电极22可以包含导电材料(如钛、铂、铱或其合金)(例如,由其形成)。在一个实施例中,远侧基于壳体的电极22可以为单个连续环形电极。在其它实例中,远侧基于壳体的电极22的部分可以涂覆有电绝缘涂层,例如聚对二甲苯、聚氨基甲酸酯、硅酮、环氧树脂或其它绝缘涂层,以减小电极的导电表面区。例如,可以涂覆远侧基于壳体的电极22的一个或多个扇区以分离远侧基于壳体的电极22的两个或更多个导电的暴露表面区。例如通过用绝缘涂层覆盖导电区的部分来减小远侧基于壳体的电极22的导电表面区可以增加远侧基于壳体22的电阻抗,并且由此减小在夺获心肌(例如,心房肌组织)的起搏脉冲期间递送的电流。较低的电流消耗可以节省装置10的电源,例如一个或多个可再充电或不可再充电的电池。
55.如上文所描述的,远侧基于壳体的电极22可以被配置成心房阴极电极,所述心房阴极电极用于与作为返回阳极的近侧基于壳体的电极24结合将起搏脉冲递送到植入部位4处的心房组织。电极22和24可以用于感测心房p波,以用于控制心房起搏脉冲(在不存在感测到的p波的情况下递送)以及用于控制使用作为阴极的尖端电极42和作为返回阳极的近侧基于壳体的电极24递送的心房同步心室起搏脉冲。在其它实例中,远侧基于壳体的电极22可以与用于心室起搏和感测的阴极尖端电极42结合用作返回阳极。
56.图5是根据另一个实例的可以被配置成用于确定心脏传导系统夺获、校准起搏疗法和/或递送起搏疗法以进行单腔或多腔心脏疗法(例如,双腔或三腔心脏疗法)的另一个无引线心内医疗装置310的三维透视图。装置310可以包含壳体330,所述壳体具有展示为圆柱形外侧壁的从壳体远端区域332延伸到壳体近端区域334的外侧壁335。壳体330可以围封被配置成执行单腔或多腔心脏疗法的电子电路系统,所述单腔或多腔心脏疗法包含心房和心室心脏电信号感测和对心房腔和心室腔进行起搏。递送工具接口构件326示出在壳体近端区域334上。
57.远侧固定和电极组合件336可以耦接到壳体远端区域332。远侧固定和电极组合件336可以包含耦接到壳体远端区域332的电绝缘性远侧构件372。组织刺穿电极组合件312可以远离壳体远端区域332延伸,并且多个非组织刺穿电极722可以直接耦接到绝缘性远侧构件372。如所示出的,组织刺穿电极组合件312在远离壳体远端区域332的纵向方向上延伸,并且可以与壳体330的纵向中心轴线331同轴。
58.远侧组织刺穿电极组合件312可以包含电绝缘轴340和尖端电极342(例如,组织刺穿电极)。在一些实例中,组织刺穿电极组合件312可以被描述为包含螺旋轴340和远侧阴极尖端电极342的活动固定构件。螺旋轴340可以从轴远端区域343延伸到轴近端区域341,所述轴近端区域可以直接耦接到绝缘性远侧构件372。螺旋轴340可以涂覆有电绝缘材料,例如聚对二甲苯或本文所列的其它实例,以避免沿轴长度感测或刺激心脏组织。
59.如本文所描述的,尖端电极342处于或定位在轴远端区域343处,并且可以充当用于当将尖端电极342推进接近或推进到心室组织中时使用近侧基于壳体的电极324作为返
回阳极来递送心室起搏脉冲并且感测心室电信号的阴极电极。近侧基于壳体的电极324可以是外接壳体330的环形电极,并且可以由纵向侧壁335的未绝缘部分限定。壳体330的不充当电极的其它部分可以用与如上文结合图4的装置10所描述的类似的电绝缘材料涂覆。
60.使用两个或更多个穿透进入lv心肌的组织刺穿电极(例如,任何类型的组织刺穿电极)可以用于更局部的起搏夺获,并且可以减轻心室起搏尖峰,从而影响夺获心房组织。在一些实施例中,多个组织刺穿电极可以包含两个或更多个镖型电极组合件(例如,图4的电极组合件12)、螺旋型电极。多个组织刺穿电极的非限制性实例包含两个镖型电极组合件、具有延伸穿过其中(例如,穿过中心)的镖电极组合件的螺旋电极或者双缠绕螺旋。多个组织刺穿电极也可以用于双极或多极起搏。
61.在一些实施例中,穿透进入lv心肌中的一个或多个组织刺穿电极(例如,任何类型的组织刺穿电极)可以是多极组织刺穿电极。多极组织刺穿电极可以包含一个或多个电活性元件和电分离元件,其可以使得能够从一个或多个组织刺穿电极进行双极或多极起搏。换句话说,每个组织刺穿电极可以包含彼此独立的一个或多个单独电极或电活性段或区域。
62.多个非组织刺穿电极322可以沿绝缘性远侧构件372的外周提供,其位于组织刺穿电极组合件312的外周。绝缘性远侧构件372可以限定装置310的面向远侧的表面338和邻近壳体纵向侧壁335外接装置310的周向表面339。非组织刺穿电极322可以由例如钛、铂、铱或其合金之类的导电材料形成。在所展示的实施例中,六个非组织刺穿电极322沿绝缘性远侧构件372的外周以相等的距离径向间隔开,然而,可以提供两个或更多个非组织刺穿电极322。
63.非组织刺穿电极322可以是离散组件,其各自保持在绝缘性构件372中的相应凹部374内,所述凹部的大小和形状被设计成与非组织刺穿电极322匹配。在其它实例中,非组织刺穿电极322各自可以为安装在绝缘性远侧构件372内或之上的单件式构件的未绝缘暴露部分。单件式构件中不充当电极的中间部分可以通过绝缘性远侧构件372进行绝缘,或者如果所述中间部分暴露于周围环境中,则其可以涂覆有电绝缘涂层,例如聚对二甲苯、聚氨基甲酸酯、硅酮、环氧树脂或其它绝缘涂层。
64.当将组织刺穿电极组合件312推进到心脏组织中时,至少一个非组织刺穿电极322可以被定位成抵靠、紧密接触或操作性地接近心脏组织表面,以递送脉冲和/或感测由患者的心脏产生的心脏电信号。例如,当组织刺穿电极组合件312被推进到心房组织中并且穿过中心纤维体直至远侧尖端电极342被定位成与心室组织(例如,心室肌和/或心室传导系统的部分)直接接触时,非组织刺穿电极322可以被定位成与右心房心内膜组织接触以在心房中进行起搏和感测。
65.非组织刺穿电极322可以耦接到由壳体330围封的本文将关于图6所描述的疗法递送电路和感测电路,以与作为返回阳极的近侧基于壳体的电极324结合共同充当用于递送心房起搏脉冲并感测心房电信号(例如,p波)的阴极电极。可以在控制电路的控制下激活包含在感测电路中的开关电路系统,以将非组织刺穿电极中的一个或多个非组织刺穿电极耦接到心房感测通道。远侧非组织刺穿电极322可以彼此电隔离,使得可以通过包含在疗法递送电路中的开关电路系统来单独选择电极322中的每个单独的电极,以单独地或者以电极322中的两个或更多个电极的组合来充当心房阴极电极。可以在控制电路的控制下激活包
含在疗法递送电路中的开关电路系统,以将非组织刺穿电极322中的一个或多个非组织刺穿电极耦接到心房起搏电路。可以一次选择非组织刺穿电极中的两个或更多个非组织刺穿电极以用作多点心房阴极电极。
66.可以基于心房夺获阈值测试、电极阻抗、心脏电信号中的p波信号强度或其它因素来选择用于心房起搏和/或心房感测的某些非组织刺穿电极322。例如,可以选择用作提供低起搏夺获阈值幅度和相对较高的电极阻抗的最佳组合的阴极电极的单个非组织刺穿电极322或两个或更多个单独的所述非组织刺穿电极的任何组合,以使用来自电源的最小电流消耗来实现可靠的心房起搏。
67.在一些情况下,当组织刺穿电极组合件312将壳体330锚定在植入部位4处时,面向远侧的表面338可以均匀地接触心房心内膜表面。在所述情况下,可以一起选择所有电极322以形成心房阴极。可替代地,电极322中的每隔一个电极可以一起选择以形成具有较高电阻抗的多点心房阴极,所述心房阴极仍沿面向远侧的表面338均匀地分布。可替代地,可以选择沿绝缘性远侧构件372的一侧的一个或多个电极322的子集,以在期望的部位处提供起搏,所述期望的部位由于电极322对受到起搏的心房组织的相对位置而实现最低的起搏夺获阈值。
68.在其它情况下,取决于组织刺穿电极组合件312进入心脏组织的定位和定向,面向远侧的表面338可以相对于邻近的心内膜表面成角度地定向。在此情况下,非组织刺穿电极322中的一个或多个可以被定位成相比于其它非组织刺穿电极322而与邻近的心内膜组织更紧密地接触,所述其它非组织刺穿电极可以成角度地远离心内膜表面。通过沿绝缘性远侧构件372的外周提供多个非组织刺穿电极,组织刺穿电极组合件312和壳体远端区域332相对于心脏表面(例如,右心房心内膜表面)的角度可以不必基本上平行。解剖差异和定位差异可以使面向远侧的表面338相对于心内膜表面成角度或倾斜,然而,沿绝缘性远侧构件372的外周分布的多个非组织刺穿电极322增加了一个或多个电极322与邻近心脏组织之间进行良好接触的可能性,从而使用多个电极322的至少子集来促进可接受的起搏阈值和可靠的心脏事件感测。可能不需要周向地沿绝缘性远侧构件372的整个外周接触或固定。
69.非组织刺穿电极322被展示为各自包含沿面向远侧的表面338延伸的第一部分322a和沿周向表面339延伸的第二部分322b。第一部分322a和第二部分722b可以为连续的暴露表面,使得有源电极表面包裹在绝缘性远侧构件372的外周边缘376周围,所述外周边缘将面向远侧的表面338和周向表面339接合起来。非组织刺穿电极322可以包含沿面向远侧的表面338的电极322中的一个或多个、沿周向表面339的一个或多个电极、各自沿面向远侧的表面338和周向表面339两者延伸的一个或多个电极,或其任何组合。非组织刺穿电极322中的每个非组织刺穿电极的暴露表面可以与相应的面向远侧的表面338和/或周向表面齐平。在其它实例中,非组织刺穿电极322中的每个非组织刺穿电极可以具有从绝缘性远侧构件372凸出的凸起表面。然而,电极322的任何凸起表面可以限定光滑或圆形的非组织刺穿表面。
70.远侧固定和电极组合件336可以密封壳体330的远端区域,并且可以提供将电极322安装在其上的基础。电极322可以被称为基于壳体的电极。电极322可以不由将有源电极部分(如位于延伸远离壳体330的螺旋轴340的远侧尖端处的远侧尖端电极342)延伸远离壳体330的轴或其它延伸部承载。本文呈现的耦接到绝缘性远侧构件的面向远侧的表面和/或
周向表面的非组织刺穿电极的其它实例包含如本文关于图4的装置10所描述的远侧基于壳体的电极22、如本文关于图4的装置10所描述的围绕组合件36周向延伸的远侧基于壳体的电极、纽扣电极、其它基于壳体的电极以及其它周向环形电极。可以提供直接耦接到远侧绝缘性构件的位于中心组织刺穿电极外围的任何非组织刺穿电极,以单独地、共同地或以任何组合的方式用作用于将起搏脉冲递送到邻近心脏组织的阴极电极。当提供环形电极,如远侧基于壳体的电极22和/或周向环形电极时,环形电极的部分可以通过涂层进行电绝缘,以沿绝缘性远侧构件的面向远侧的表面和/或周向表面提供多个分布的非组织刺穿电极。
71.与沿远侧固定和电极组合件336提供的组织刺穿电极相比,上文列出的非组织刺穿电极322和其它实例预期提供更可靠和有效的心房起搏和感测。与心室腔壁相比,心房腔壁相对较薄。组织刺穿心房阴极电极可能会在心房组织内延伸得太深,导致无意间持续或间歇性夺获心室组织。由于在通过物理上更紧密接近心室组织的组织刺穿心房阴极电极接收到的心脏电信号中具有较大信号强度的心室信号,组织刺穿心房阴极电极可能导致干扰感测心房信号。组织刺穿电极组合件312可以牢固地锚定在心室组织中,以使装置310的植入定位稳定,并且提供合理肯定,即尖端电极342在心室组织中进行感测和起搏,同时非组织刺穿电极322在心房中可靠地进行起搏和感测。当装置310植入在目标植入区域4(例如如图1
‑
2关于装置10所示出的)中时,尖端电极342可以到达左心室组织以对左心室进行起搏,而非组织刺穿电极322在右心房中提供起搏和感测。组织刺穿电极组合件312的从面向远侧的表面338起的长度可以处于约4mm到约8mm的范围内以到达左心室组织。在一些情况下,装置310可以通过以下实现四腔起搏:通过目标植入区域4中的非组织刺穿电极322从心房起搏电路83递送心房起搏脉冲以实现双心房(右心房和左心房)夺获,并且通过从目标植入区域4推进到心室组织中的尖端电极342来从心室起搏电路递送心室起搏脉冲以实现双心室(右心室和左心室)夺获。
72.图6是根据一个实例的可以被围封在装置10、310的壳体30、330内或本文所描述的任何其它医疗装置的壳体内以提供感测心脏信号、确定夺获和/或递送起搏疗法的功能的电路系统的框图。单独的医疗装置50(如图1所示)可以包含可以类似方式进行配置的一些或所有相同组件。围封在壳体30、330内的电子电路系统可以包含软件、固件和硬件,所述软件、固件和硬件协作地监测心房和心室的心电信号,确定是否发生了心脏系统夺获,确定何时需要心脏疗法和/或根据编程的疗法模式和脉冲控制参数向患者心脏递送电脉冲。电子电路系统可以包含控制电路80(例如,包含处理电路系统)、存储器82、疗法递送电路84、感测电路86和/或遥测电路88。在一些实例中,装置10、310包含用于产生与患者的一种或多种生理功能、状态或病状相关的信号的一个或多个传感器90。例如,一个或多个传感器90可以包含患者活动传感器,以用于确定对起搏疗法的需要和/或控制起搏速率。进一步地,例如,一个或多个传感器90可以包含用于测量运动的惯性测量单元(例如,加速度计)。进一步地,例如,一个或多个传感器90可以包含声学传感器以监测心音。仍进一步地,例如,一个或多个传感器90可以包含患者活动传感器,其可以包含加速度计。由于如患者活动传感器所指示的活动增加所引起的患者代谢需求的增加可以使用患者活动传感器来确定。换句话说,装置10、310可以包含用于感测来自患者的信号的其它传感器90,以用于确定是否递送和/或控制由疗法递送电路84递送的电刺激疗法。
73.电源98可以按需对包含组件80、82、84、86、88、90中的每一个的装置10、310的电路
系统提供电力。电源98可以包含一个或多个储能装置,如一个或多个可再充电或不可再充电电池。可以从向所属领域的一般技术人员展示的总框图中理解电源98与组件80、82、84、86、88、90中的每一个之间的连接(未示出)。例如,电源98可以耦接到包含在疗法递送电路84中的一个或多个充电电路,以便提供用以对包含在疗法递送电路84中的保持电容器进行充电的电力,所述保持电容器在控制电路80的控制下在适当时候进行放电,以例如根据双腔起搏模式(如ddi(r))来递送起搏脉冲。电源98还可以耦接到感测电路86的组件(如感测放大器、模数转换器、开关电路系统等)、传感器90、遥测电路88和存储器82,以向各种电路提供电力。
74.所示出的功能块表示装置10、310中包含的功能,并且可以包含实施模拟和/或数字电路的任何离散和/或集成电子电路组件,所述模拟和/或数字电路能够产生归因于本文所描述的医疗装置10、310的功能。各个组件可以包含执行一个或多个软件或固件程序的处理电路系统(如专用集成电路(asic)、电子电路、处理器(共享、专用或组)和存储器)、组合逻辑电路、状态机或其它提供所描述的功能的合适的组件或组件的组合。将主要由医疗装置中采用的特定系统架构以及由医疗装置采用的特定检测和疗法递送方法来确定用于实施本文所公开的功能的软件、硬件和/或固件的特定形式。
75.存储器82可以包含任何易失性、非易失性、磁性或电非暂时性计算机可读存储介质,如随机存取存储器(ram)、只读存储器(rom)、非易失性ram(nvram)、电
‑
可擦除可编程rom(eeprom)、闪速存储器或任何其它存储器装置。此外,存储器82可以包含存储指令的非暂时性计算机可读介质,所述指令在由一个或多个处理电路执行时,使控制电路80和/或其它处理电路系统确定心脏传导系统夺获和/或执行单腔、双腔或三腔校准的起搏疗法(例如,单腔或多腔起搏)或归因于装置10、310的其它心脏疗法功能(例如,感测或递送疗法)。存储指令的非暂时性计算机可读介质可以包含上文所列的介质中的任一个。
76.控制电路80可以例如通过数据总线与疗法递送电路84和感测电路86通信,以感测心脏电信号并且响应于感测到的心脏事件(例如,p波和r波,或者其不存在)而控制心脏电刺激疗法的递送。尖端电极42、342、远侧基于壳体的电极22、322和近侧基于壳体的电极24、324可以电耦接到疗法递送电路84以用于将电刺激脉冲递送到患者心脏,并且电耦接到感测电路86以用于感测心脏电信号。
77.感测电路86可以包含心房(a)感测通道87和心室(v)感测通道89。远侧基于壳体的电极22、322和近侧基于壳体的电极24、324可以耦接到心房感测通道87以感测心房信号,例如伴随心房肌去极化的p波。在包含两个或更多个可选择远侧基于壳体的电极的实例中,感测电路86可以包含用于将可用的远侧基于壳体的电极中的一个或多个可用的远侧基于壳体的电极选择性地耦接到包含在心房感测通道87中的心脏事件检测电路系统的开关电路系统。开关电路系统可以包含开关阵列、开关矩阵、多路复用器或适合于将感测电路86的组件选择性地耦接到所选电极的任何其它类型的开关装置。尖端电极42、324和近侧基于壳体的电极24、324可以耦接到心室感测通道89以感测心室信号,例如伴随心室肌去极化的r波。
78.心房感测通道87和心室感测通道89中的每一个可以包含心脏事件检测电路系统,以用于从由相应感测通道接收的心脏电信号中分别检测p波和r波。包含在通道87和89中的每个通道中的心脏事件检测电路系统可以被配置成对从所选电极接收的心脏电信号进行放大、滤波、数字化和整流,以改善用于检测心脏电事件的信号质量。每个通道87和89内的
心脏事件检测电路系统可以包含一个或多个感测放大器、滤波器、整流器、阈值检测器、比较器、模数转换器(adc)、定时器或其它模拟或数字组件。可以例如基于由控制电路80确定的存储在存储器82中和/或由控制电路80和/或感测电路86的硬件、固件和/或软件控制的定时间期和感测阈值,在控制电路80的控制下由每个相应感测通道87和89自动调整心脏事件感测阈值,例如p波感测阈值和r波感测阈值。
79.在基于感测阈值跨越检测心脏电事件时,感测电路86可以产生传递到控制电路80的感测到的事件信号。例如,心房感测通道87可以响应于p波感测阈值交叉而产生p波感测的事件信号。心室感测通道89可以响应于r波感测阈值交叉而产生r波感测的事件信号。控制电路80可以使用感测到的事件信号来设置对用于调度心脏起搏脉冲的基本时间间期进行控制的起搏逃逸间期定时器。取决于特定的编程起搏模式,感测到的事件信号可以触发或抑制起搏脉冲。例如,从心房感测通道87接收到的p波感测的事件信号可以使控制电路80以编程的房室(a
‑
v)起搏间期来抑制经调度的心房起搏脉冲并且调度心室起搏脉冲。如果在a
‑
v起搏间期到期之前感测到r波,则可以抑制心室起搏脉冲。如果a
‑
v起搏间期在控制电路80从心室感测通道89接收到r波感测的事件信号之前截止,则控制电路80可以使用疗法递送电路84递送与感测到的p波同步的经调度心室起搏脉冲。
80.在一些实例中,装置10、310可以被配置成递送多种起搏疗法,包含心动过缓起搏、心脏再同步疗法、电击后起搏和/或心动过速相关疗法(如atp)等。例如,装置10、310可以被配置成检测非窦性心动过速并且递送atp。控制电路80可以确定心脏事件时间间期,例如,从心房感测通道87接收的连续的p波感测的事件信号之间的p
‑
p间期、从心室感测通道89接收的连续的r波感测的事件信号之间的r
‑
r间期,以及在p波感测的事件信号与r波感测的事件信号之间接收的p
‑
r和/或r
‑
p间期。可以将这些间期与心动过速检测间期进行比较,以检测非窦性心动过速。可以基于所检测到的心动过速检测间期的阈值数量,在给定的心腔中检测心动过速。
81.疗法递送电路84可以包含心房起搏电路83和心室起搏电路85。每个起搏电路83、85可以包含充电电路系统、一个或多个电荷存储装置(如一个或多个低电压保持电容器)、输出电容器和/或开关电路系统,所述开关电路系统控制一个或多个保持电容器何时跨输出电容器充电和放电以将起搏脉冲递送到耦接到相应起搏电路83、85的起搏电极向量。尖端电极42、342和近侧基于壳体的电极24、324可以作为双极阴极和阳极对耦接到心室起搏电路85,以例如在由控制电路80设置的用于提供心房同步的心室起搏和基本的较低的心室起搏速率的a
‑
v或v
‑
v起搏间期到期时递送心室起搏脉冲。
82.心房起搏电路83可以耦接到远侧基于壳体的电极22、322和近侧基于壳体的电极24、324以递送心房起搏脉冲。控制电路80可以根据编程的较低起搏速率或根据速率响应性传感器指示的起搏速率进行设置的暂时较低速率来设置一个或多个心房起搏间期。如果在从心房感测通道87接收到p波感测的事件信号之前心房起搏间期截止,则可以控制心房起搏电路以递送心房起搏脉冲。控制电路80响应于递送的心房起搏脉冲而开始a
‑
v起搏间期,以提供同步的多腔起搏(例如,双腔或三腔起搏)。
83.可以由疗法递送电路84根据从控制电路80接收到的控制信号来将心房或心室起搏电路83、85的保持电容器充电到经过编程的起搏电压幅度并且针对经过编程的起搏脉冲宽度使电容器放电。例如,控制电路80中包含的起搏定时电路可以包含可编程数字计数器,
所述可编程数字计数器由控制电路80的微处理器设置以用于控制与各种单腔或多腔起搏(例如,双腔或三腔起搏)模式或抗心动过速起搏序列相关的基本起搏时间间期。控制电路80的微处理器还可以设置可以基于存储在存储器82中的编程值的心脏起搏脉冲的幅度、脉冲宽度、极性或其它特性。
84.可以经由遥测电路88将由控制电路80所利用的用于感测心脏事件并控制起搏疗法递送的控制参数编程到存储器82中,所述遥测电路也可以被描述为通信接口。遥测电路88包含用于使用射频通信或其它通信协议与如编程器或家用监测器等外部装置进行通信的收发器和天线。控制电路80可以使用遥测电路88从外部装置接收下行链路遥测并且将上行链路遥测发送到外部装置。在一些情况下,遥测电路88可以用于向植入患者中的另一医疗装置发射并从所述医疗装置接收通信信号。
85.本文所描述的说明性系统、方法和装置可以用于或被配置成确定心脏传导系统或其它心脏组织(如心肌组织)是否被vfa心脏起搏疗法夺获。图7中描绘了确定心脏传导系统夺获的说明性方法200。通常,可以描述说明性方法200可以用于分析来自心脏组织的内部或外部(例如,来自患者的躯干)的电活动,使用各种诊断性起搏设置来调整vfa心脏起搏疗法,并且然后基于监测到的电活动确定vfa心脏起搏疗法是否已夺获(例如,正在起搏)患者的心脏传导系统。此外,方法200可以能够基于监测到的电活动来确定患者是否存在a
‑
v阻断。
86.如所示出的,方法200可以包含监测电活动202。电活动可以从患者外部测量或从患者内部测量。换句话说,可以从患者身体外部的组织(例如,皮肤)或从患者身体内部的组织(例如,心脏组织)测量电活动。
87.例如,方法200可以包含使用多个外部电极来监测或测量电活动,例如关于图9
‑
11所示和描述的。更具体地,例如,所述多个外部电极可以类似于由电极设备110提供的外部电极,如本文关于图9
‑
11所描述的。在一个实施例中,所述多个外部电极可以是定位在患者躯干周围的背心或束带的一部分或被并入其中。更具体地,所述多个电极可以被描述为以阵列定位的表面电极,所述多个表面电极被配置成定位在患者的躯干的皮肤附近。可以描述的是,当使用多个外部电极时,监测过程202可以提供多个心电图(ecg)、代表患者的心脏的去极化和复极化的信号和/或多个激活时间。
88.进一步地,例如,方法200可以包含使用一个或多个植入式电极来监测或测量电活动,例如关于图1
‑
6所示和描述的。在一个或多个实施例中,植入式电极可以定位在患者的心脏的一个或多个腔室内部,如右心房、左心房、右心室和左心室中的一个或多个。在一个或多个实施例中,植入式电极可以被定位成在心脏组织附近,如心肌、心内膜和心包空间中的一个或多个。电活动可以作为患者的心脏的去极化和复极化的一个或多个电描记图(egm)或电信号来提供。
89.可以使用a
‑
v延迟或间期将vfa心脏疗法递送到左心室,所述a
‑
v延迟或间期是心房事件(例如,起搏去极化或固有去极化)与左心室起搏之间的时间段。应当理解,术语a
‑
v延迟和a
‑
v间期在本文提供的描述中可互换使用。换句话说,a
‑
v间期与a
‑
v延迟相同,并且反之亦然。
90.方法200可以进一步包含提供初始诊断性a
‑
v间期204。诊断性a
‑
v间期可以被描述为被配置成用于在本文关于说明性方法200所描述的过程中使用的所选或确定的间期,以
便确定vfa心脏疗法是否已夺获心脏传导系统和/或患者是否存在a
‑
v阻断。
91.初始诊断性a
‑
v间期可以小于患者的固有a
‑
v间期。患者的固有a
‑
v间期是心房事件(例如,起搏去极化或固有去极化)与固有或自然左心室去极化之间的时间段。初始诊断性a
‑
v间期可以基于患者的固有a
‑
v间期来确定。例如,可以测量或感测患者的固有a
‑
v间期,并且然后可以基于患者的固有a
‑
v间期生成或计算初始诊断性a
‑
v间期。
92.在一个实施例中,初始诊断性a
‑
v间期可以是患者的固有a
‑
v间期的所选百分比。所选百分比可以介于患者的固有a
‑
v间期的约50%与约90%之间。在至少一个实施例中,所选百分比可以是患者的固有a
‑
v间期的70%。例如,如果患者的固有a
‑
v延迟是150毫秒,并且所选百分比是70%,那么新的经修改的诊断性a
‑
v间期可以设置为105毫秒。
93.在另一个实施例中,初始诊断性a
‑
v间期可以是小于患者的固有a
‑
v间期的所选时间段。所选时间段可以比患者的固有a
‑
v间期小约20毫秒(ms)到约50毫秒。例如,如果患者的固有a
‑
v延迟是160毫秒并且所选时间段是30毫秒,则新的经修改的诊断性a
‑
v间期固有a
‑
v间期可以设置为130毫秒。
94.可以使用或根据初始诊断性a
‑
v间期来递送vfa起搏疗法206。应当理解,在递送vfa起搏疗法206期间或同时,说明性方法200可以继续监测或收集电活动202。
95.更具体地,使用初始诊断性a
‑
v间期或延迟的vfa心脏疗法206可以由至少一个电极递送,所述至少一个电极被配置成在仅左心室起搏中的心房感测或心房起搏后对患者的左心室或在双心室起搏中的心房感测或心房起搏后对患者的左心室和右心室进行电刺激(例如,去极化、起搏等)。在一些实施例中,可以在约5秒与约30秒之间的疗法时间段内递送使用初始诊断性a
‑
v间期的vfa起搏疗法。在一些实施例中,使用初始诊断性a
‑
v间期的vfa起搏疗法可以被递送以用于介于约5个心动周期与约30个心动周期之间的疗法数量的心动周期。
96.在至少一个实施例中,电极中的每个电极可以耦接到植入在或接近患者的心脏的一个或多个引线。进一步地,在至少一个实施例中,心脏疗法206可以通过如关于图1
‑
6所示和描述的无引线电极来递送。虽然图1
‑
6中的此类系统和装置是无引线的,但是应当理解,本文所描述的说明性系统、装置和方法可以与任何类型的心脏起搏系统一起使用,包含一个引线、两个引线、三个引线和多于三个引线。进一步地,在至少一个实施例中,说明性装置可以植入在患者的右心房中,并且一个或多个“导线”或短引线可以从装置延伸到心脏组织的另一部分或区域,例如另一腔室(例如,右心室)、不同的隔壁(例如,房间隔)等。如本文所描述的,虽然心脏疗法递送可以被描述为有创的,但说明性系统、装置和方法中的一些说明性系统、装置和方法(如关于图9
‑
11所描述的)可以被描述为无创的。
97.进一步地,一种或多种说明性心脏疗法可以利用包含组织刺穿电极的有引线或无引线植入式心脏装置,所述组织刺穿电极可从右心房的科赫三角区域通过右心房心内膜和中心纤维体植入,以在患者的心脏的左心室心肌的基底和/或隔区域中向左心室提供心脏疗法或感测其电活动,如于2018年3月23日提交的并且题为“vfa心脏疗法(vfa cardiac therapy)”的美国临时专利申请序列号62/647,414以及于2018年8月31日提交的并且题为“自适应vfa心脏疗法(adaptive vfa cardiac therapy)”的美国临时专利申请序列号62/725,763中所描述的,所述美国临时专利申请中的每个美国临时专利申请以全文引用的方式并入本文中。
98.监测到的电活动可以用于生成可以进一步用于确定vfa心脏疗法对心脏传导系统的夺获的夺获信息208,并且任选地确定患者是否存在a
‑
v阻断。可以描述的是,心脏传导系统的夺获,而不是其它心脏组织的夺获,意味着旨在至少使左心室去极化的vfa心脏疗法的起搏电极正在将电起搏递送到电激活的快速传播中,同时具有低程度的跨心室的电激活异质性。心脏传导系统包含包括左束支和右束支的专门的细胞网络,以及一个高度分支的专门的浦肯野纤维网络,有助于电激活跨心室的快速传播,并导致心脏非常同步的动作。心脏传导系统是通过a
‑
v结下降到心室的自然电传导通路的一部分。然而,在传统心室起搏的激活期间,电激活从一个心肌细胞传播到另一个心肌细胞(也被称为“细胞到细胞”)并且速度较慢且不同步,无需任何专门的心脏传导系统参与。
99.在一个实施例中,夺获信息208可以包含在初始a
‑
v诊断性间期以及随后的a
‑
v诊断性间期的vfa起搏疗法期间从监测的电活动产生的电异质性信息(ehi),如将在本文中进一步描述的。ehi可以被描述为代表机械心脏功能和电心脏功能中的至少一种的信息或数据。ehi和其它心脏疗法信息可以在于2013年6月12日提交的并且题为“来自表面ecg电极的电不同步和电激活模式的度量(metrics of electrical dyssynchrony and electrical activation patterns from surface ecg electrodes)”的美国临时专利申请第61/834,133号中描述,所述美国临时专利申请以全文引用的方式并入本文中。
100.电异质性信息(例如,数据)可以被定义为指示心脏的机械同步或不同步和/或心脏的电同步或不同步中的至少一种的信息。换句话说,电异质性信息可以表示患者的心脏的实际机械和/或电功能的替代。在至少一个实施例中,电异质性信息(例如,从基线异质性信息到疗法异质性信息、从第一组异质性信息到第二组疗法异质性信息等)的相对变化可以用于确定代表血流动力学应答变化的替代值(例如,lv压力梯度的急剧变化)。左心室压力通常可以用定位在患者的心脏的左心室中的压力传感器有创地监测。如此,使用电异质性信息来确定代表左心室压力的替代值可以避免使用左心室压力传感器的有创监测。
101.在至少一个实施例中,电异质性信息可以包含使用一些或所有外部电极测量的心室激活时间的标准偏差,例如,本文关于图9
‑
11所描述的电极设备110的外部电极。进一步地,局部或区域电异质性信息可以包含使用定位在躯干的某些解剖区域中的电极测量的激活时间的标准偏差和/或平均值。例如,患者的躯干左侧的外部电极可以用于计算局部或区域左侧电异质性信息。
102.可以使用一种或多种不同的系统和/或方法来生成电异质性信息。例如,电异质性信息可以使用如以下中所描述的阵列或多个表面电极和/或成像系统生成:于2012年11月8日发布的并且标题为“评估心内激活模式和电不同步(assessing inra
‑
cardiac activation patterns and electrical dyssynchrony)”的美国专利申请公开第2012/0283587a1号、于2012年11月8日发布的并且标题为“评估心内激活模式(assessing intra
‑
cardiac activation patterns)”的美国专利申请公开第2012/0284003a1号以及于2012年5月15日发布的并且标题为“用于选择心脏起搏部位的方法和系统(methods and systems for use in selecting cardiac pacing sites)”的美国专利第8,180,428b2号。
103.电异质性信息可以包含一个或多个度量或指标。例如,电异质性的度量或指标之一可以是使用患者的躯干表面上的一些或所有电极测量的激活时间的标准偏差(sdat)。在一些实例中,可以使用模型心脏的表面上的所估计的心脏激活时间来计算sdat。
104.电异质性的另一个度量或指标可以是由定位在患者的左侧附近的外部电极监测的替代电激活时间(lved)的左标准偏差。进一步地,电异质性的另一度量或指标可以包含由定位在患者的左侧附近的外部电极监测的替代电激活时间(lvat)的平均值。lved和lvat可以根据仅由患者的左侧附近的电极测量的电活动来确定(例如,计算、估算等),这些电极可以被称为“左”电极。左电极可以被定义为定位在左心室附近的任何表面电极,所述左心室包含患者的胸骨和脊柱的左侧的区域。在一个实施例中,左电极可以包含胸骨的左侧的所有前电极和脊柱的左侧的所有后电极。在另一个实施例中,左电极可以包含胸骨左侧的所有前电极和所有后电极。在又另一个实施例中,可以基于如使用成像设备(例如,x射线、荧光透视等)确定的心脏的左侧和右侧的轮廓来指定左电极。
105.不同步的另一个说明性度量或指标可以是激活时间(rat)的范围,其可以被计算为最大与最小躯干表面或心脏激活时间之间的差,例如,总体的,或者对于一个区域。rat反映了激活时间的跨度,而sdat给出了激活时间与平均值的离差的估计。sdat还提供了对激活时间的异质性的估计,因为如果激活时间在空间上是异质的,则个体激活时间将更远离平均激活时间,表明心脏的一个或多个区域的激活延迟。在一些实例中,可以使用模型心脏的表面上的所估计的心脏激活时间来计算rat。
106.电异质性信息的另一个说明性度量或指标可以包含定位在躯干或心脏的特定所关注区域内的相关激活时间大于测得的qrs复合波持续时间或表面电极的确定激活时间的某个百分位数(例如,第70个百分位数)的表面电极的百分比的估计值。所关注的区域可以例如是后部、左前部和/或左心室区域。说明性度量或指标可以被称为延迟激活的百分比(plat)。plat可以被描述为提供所关注的区域的百分比的估计,例如,与心脏的左心室区域相关的后部和左前区域,其较晚激活。plat的较大值可以意味着区域的大部分(例如,左心室)的延迟激活,以及通过预激发(例如,左心室的)晚期区域通过crt进行电再同步的潜在益处。在其它实例中,可以为其它区域中的其它电极子集确定plat,如右前区域,以评估右心室中的延迟激活。此外,在一些实例中,可以使用针对整个心脏或心脏的特定区域(例如,左心室或右心室)在模型心脏的表面上所估计的心脏激活时间来计算plat。
107.在一个或多个实施例中,电异质性信息可以包含整体心脏电激活的有利变化的指标,如在以下中描述的:sweeney等人,“在心脏再同步疗法期间使用表面心电图预测左心室反向容积重塑的心室激活分析(analysis of ventricular activation using surface electrocardiography to predict left ventricular reverse volumetric remodeling during cardiac resynchronization therapy)”,《循环(circulation)》,2010年2月9日,121(5):626
‑
34和/或van deursen等人,“心电向量描记法作为一种在犬lbbb心脏中轻松优化心脏再同步疗法的工具(vectorcardiography as a tool for easy optimization of cardiac resynchronization therapy in canine lbbb hearts),”《循环心律失常和电生理学(circulation arrhythmia and electrophysiology)》,2012年6月1日,5(3):544
‑
52。异质性信息还可以包含通过成像或其它系统测量的改善心脏机械功能的测量,以跟踪心脏内植入的引线的运动,如以下中所描述的:ryu等人,“使用3d心脏标测系统的同时进行电和机械标测:用于优化心脏再同步疗法的新颖的方法(simultaneous electrical and mechanical mapping using 3d cardiac mapping system:novel approach for optimal cardiac resynchronization therapy)”,《心血管电生理学杂志》,2010年2月,21(2):219
‑
22;sperzel等人,“使用电解剖标测系统对心室间机械不同步进行术中表征——可行性研究(intraoperative characterization of interventricular mechanical dyssynchrony using electroanatomic mapping system—a feasibility study)”,《介入心脏电生理学杂志》,2012年11月,35(2):189
‑
96和/或题为“用于优化crt疗法的方法(method for optimizaing crt therapy)”并且发布于2009年4月16日的美国专利申请公开第2009/0099619a1号。
108.在一个实施例中,夺获信息208可以包含直接从心脏组织监测或测量的电描记图(egm)信号数据的一个或多个度量或指标和/或包含间接从患者躯干监测或测量的心电图(ecg)信号的一个或多个度量或指标。例如,可以生成和记录qrs形态、qrs、持续时间、去极化期间心室egm上的基准点之间的时间间期(例如,最小振幅与最大振幅的定时之间的差异)、峰到峰振幅、斜率或导数的振幅,以及来自egm和ecg信号中的一个或两个的这些度量或特性中的两个或更多个的组合。
109.说明性方法200可以进一步包含在以先前诊断性a
‑
v间期(在第一次迭代中,其将是过程204提供的初始诊断性a
‑
v间期)递送vfa起搏疗法206期间在电活动已经被监测202之后修改或调整a
‑
v诊断性间期210。
110.在一个实施例中,a
‑
v诊断性间期210可以通过将a
‑
v诊断性间期减小所选量来修改。例如,所选量可以介于约5毫秒与约25毫秒之间。在一个或多个实施例中,所选量可以大于或等于约5毫秒、大于或等于约7毫秒、大于或等于约10毫秒、大于或等于约12毫秒、大于或等于约15毫秒等和/或小于或等于约30毫秒、小于或等于约25毫秒、小于或等于约20毫秒、小于或等于约17毫秒等。因此,如果先前诊断性a
‑
v间期是140毫秒,并且所选量是20毫秒,则经修改或经调整的a
‑
v诊断性间期将为120毫秒。
111.在一个实施例中,a
‑
v诊断性间期210可以通过将a
‑
v诊断性间期减小所选百分比来修改。例如,所选百分比可以介于约2%毫秒与约20%毫秒之间。在一个或多个实施例中,所选百分比可以大于或等于约2%、大于或等于约5%、大于或等于约7%等和/或小于或等于约15%、小于或等于约12%、小于或等于约10%等。因此,如果先前诊断性a
‑
v间期是150毫秒,并且所选百分比是10%,则经修改或经调整的a
‑
v诊断性间期将为135毫秒。
112.方法200然后可以检查经修改的诊断性a
‑
v间期是否小于最小值212。最小值212可以介于约40毫秒与约70毫秒之间。在一个实施例中,最小值212是60毫秒。如果经修改的诊断性a
‑
v间期小于最小值212,则方法200可以继续确定vfa起搏疗法是否已夺获心脏传导系统214和/或确定患者是否存在a
‑
v阻断216,如本文将进一步描述的。
113.如果经修改的诊断性a
‑
v间期不小于最小值212,则方法200可以返回到根据经修改的诊断性a
‑
v间期递送vfa起搏疗法206,在此类vfa起搏疗法期间使用监测到的电活动202生成夺获信息208 208,并且然后修改诊断性a
‑
v间期210。方法200可以在此回路中继续,直到经修改的诊断性a
‑
v间期小于最小值212。
114.因此,方法200可以被描述为将诊断性a
‑
v间期210修改为多个不同的诊断性a
‑
v间期,每个诊断性a
‑
v间期小于患者的固有a
‑
v间期,并且在所述多个不同的诊断性a
‑
v间期中的每个诊断性a
‑
v延迟期间监测电活动202,所述电活动进而可以用于生成夺获信息208。当诊断性a
‑
v间期被修改或减小为等于或低于最小值212时,方法200可以停止或中止使用诊断性a
‑
v间期递送vfa起搏疗法。换句话说,可以描述诊断性a
‑
v间期可以从初始诊断性a
‑
v
间期“扫掠”到最小诊断性a
‑
v间期,并且可以在“扫掠”期间收集夺获数据。
115.方法200然后可以利用在所述多个不同的诊断性a
‑
v间期期间测量的监测到的电活动202和根据此类监测到的电活动生成的夺获信息208中的一个或两者来确定vfa起搏疗法是否已夺获了心脏传导系统214和/或确定患者是否存在a
‑
v阻断216,如将在本文进一步描述的。
116.可以使用各种过程和各种夺获信息来执行确定vfa起搏疗法是否已夺获心脏传导系统214。例如,可以利用包含如ehi等不同步信息的夺获信息。在图8a
‑
8c中描绘了随诊断性a
‑
v间期的减小的不同步的图,其描绘了心脏传导系统夺获、无心脏传导系统夺获和a
‑
v阻断的各种场景。
117.图8a中描绘了两组不同的不同步信息。第一组不同步信息220指示成功夺获心脏传导系统,而第二组不同步信息222指示没有或未成功夺获心脏传导系统。如8a所示,随着诊断性a
‑
v间期的减小(即,沿x轴向右移动),指示成功的心脏传导系统夺获的第一组不同步信息220不增加或减少——替代地,第一组不同步信息220保持相对恒定,例如,在某个预定义公差内(例如, /
‑
5%、 /
‑
10%、 /
‑
3毫秒、 /
‑
5毫秒等)。随着诊断性a
‑
v间期的减小,不同步没有变化可能指示成功的心脏传导系统夺获。
118.相反,随着诊断性a
‑
v间期的减小,指示没有或未成功夺获心脏传导系统的第二组不同步信息222减少并且然后随后增加。简而言之,第二组不同步信息222随时间变化。随着诊断性a
‑
v间期的减小,不同步的变化可以指示未成功或没有夺获心脏传导系统。
119.因此,在没有夺获传导系统的情况下在以较短的a
‑
v间期起搏期间通过增加电异质性或不同步性可以确定不同步的变化,因为心脏的整个激活将通过细胞到细胞的传播发生,这要慢得多。在一些情况下,当存在相当大的局部组织时延时(例如,通过起搏递送与qrs开始之间的间期来测量),不同步的变化可以通过在以较短的a
‑
v间期起搏期间减少电不同步来确定,而不夺获传导系统。
120.因此,如果例如ehi等不同步信息随着诊断性a
‑
v间期减小而变化,则说明性方法200可以确定vfa起搏疗法没有夺获心脏传导系统214。进一步地,并且同样地,如果例如ehi等不同步信息随着诊断性a
‑
v间期减小而保持相对恒定,则说明性方法200可以确定vfa起搏疗法已夺获心脏传导系统214。
121.在图8b中描绘了两组不同的不同步信息,并且第一组不同步信息220和第二组不同步信息224两者均指示心脏传导系统的成功夺获,因为例如所述不同步信息不增加或减少,两组220、224保持相对恒定,等等。然而,第二组不同步信息224高于阈值230,其可以指示a
‑
v阻断。如果利用的不同步度量是激活时间的标准偏差(sdat),则阈值可以介于约20毫秒与25毫秒之间。
122.因此,如果不同步信息保持相对恒定并且在多个不同的诊断性a
‑
v间期内(例如,随着诊断性a
‑
v间期减小)高于所选阈值,则说明性方法200可以确定患者存在a
‑
v阻断。
123.图8c中描绘了两组不同的不同步信息。第一组不同步信息220指示成功夺获心脏传导系统,而第二组不同步信息226指示没有或未成功夺获心脏传导系统。如8c所示,随着诊断性a
‑
v间期的减小(即,沿x轴向右移动),指示成功的心脏传导系统夺获的第一组不同步信息220不增加或减少——替代地,第一组不同步信息220保持相对恒定。如前所述,随着诊断性a
‑
v间期的减小,不同步没有变化可能指示成功的心脏传导系统夺获。
124.相反,随着诊断性a
‑
v间期的减小,指示没有或未成功夺获心脏传导系统的第二组不同步信息226稳定增加。简而言之,第二组不同步信息226随时间变化。随着诊断性a
‑
v间期的减小,不同步的变化可以指示未成功或没有夺获心脏传导系统。
125.可以使用分析和评估egm、ecg信号和/或其部分的各种过程来执行确定vfa起搏疗法是否已夺获心脏传导系统214。例如,夺获信息可以包含心室起搏事件之后的egm和/或ecg信号中的qrs段。可以在所述多个不同的诊断性a
‑
v间期内比较形态和持续时间中的一个或两个,以确定是否发生了vfa起搏疗法成功夺获心脏传导系统。
126.在一个实施例中,在心室起搏事件之后的从起搏的递送时间到某个预定义的时间间期(例如,在递送心房起搏之后的250毫秒)的qrs信号段的形态模板可以在以某个诊断性a
‑
v间期(例如,短av延迟,如60毫秒)起搏期间存储并且在以其它诊断性a
‑
v间期(例如,更长的诊断性a
‑
v间期,如80毫秒、100毫秒、120毫秒等)起搏期间的qrs段的形态类似性可以基于在递送起搏之后的相同时间窗口中的qrs信号段的简单相关性来确定。如果相关系数超过某个阈值(例如,90%),则可以确定形态类似性。也可以使用如相对差异的其它度量来确定电描记图形态或其它特性的类似性。如果相对差异小于某个阈值(例如,5%、10%等),则确定特性的匹配或类似性。如果处于短a
‑
v起搏间期的qrs信号段与处于较长av起搏间期的qrs信号段类似(例如,紧密匹配、在公差水平内等)(例如,就qrs形态和持续时间中的一个或两个而言),则可以确定vfa起搏疗法已成功夺获左心室和右心室中的一个或两个。相反,如果处于短a
‑
v起搏间期的qrs信号段与处于较长av起搏间期的qrs信号段不同(例如,就qrs形态和持续时间中的一个或两个而言),则可以确定vfa起搏疗法未成功夺获左心室和右心室中的一个或两个。
127.如本文所描述的,在所述多个不同的诊断性a
‑
v延迟期间监测电活动并随后从中生成夺获信息的各种方式或过程之一利用多个心电图(ecg)信号(例如,躯干表面电位)。可以使用定位在患者表面或皮肤周围的多个外部电极来测量或监测所述多个ecg信号。ecg信号可以用于确定vfa疗法对心脏传导系统的夺获,例如,由执行vfa心脏再同步疗法(crt)的植入式医疗装置提供。如本文所描述的,因为例如植入式电极可以不用于测量ecg信号,因此ecg信号可以被无创地收集或获得。进一步地,ecg信号可以用于确定心脏电激活时间,其可以用于生成可以用于确定心脏传导系统夺获的各种度量(例如,电异质性信息)。
128.各种说明性系统、方法和图形用户接口可以被配置成使用包含外部电极的电极设备、显示设备和计算设备来无创地辅助用户(例如,医师)评估心脏传导系统夺获和/或心脏疗法的配置(例如,优化)。在图9中描绘了包含电极设备110、计算设备140和远程计算装置160的说明性系统100。
129.如所示出的电极设备110包含多个电极,所述多个电极并入或包含于缠绕在患者114的胸部或躯干周围的带内。电极设备110可操作地耦接到计算设备140(例如,通过一个或有线电连接、无线地等),以将来自电极中的每个电极的电信号提供给计算设备140以进行分析、评估等。说明性电极设备可以在于2014年3月27日提交并于2016年3月26日发布的题为“生物电传感器装置和方法(bioelectric sensor device and methods)”的美国专利第9,320,446号中进行描述。进一步地,将参考图2
‑
3对说明性电极设备110进行更详细的描述。
130.计算设备140和远程计算装置160可以各自分别包含显示设备130、160,所述显示
设备可以被配置成显示和分析数据,例如,电信号(例如,心电图数据)、电激活时间、电异质性信息等。例如,可以分析和评估由电极设备110收集或监测的电信号表示的多个心动周期或心跳中的一个心动周期或一次心跳的一个或多个度量,所述一个或多个度量包含可以与心脏传导系统夺获的确定和a
‑
v阻断的检测有关的激活时间和电异质性信息。更具体地,例如,可以评估单个心动周期的qrs复合波的一个或多个度量,例如qrs开始、qrs偏移、qrs峰值、电异质性信息(ehi)、电激活时间、左心室或胸电激活时间的标准偏差(lved)、激活时间的标准偏差(sdat)、平均左心室或胸替代电激活时间(lvat)、参考最早激活时间、qrs持续时间(例如,qrs开始到qrs偏移之间的间期)、平均左替代和平均右替代激活时间之间的差异、相对或绝对qrs形态、激活时间的较高百分位数与较低百分位数之间的差异(较高百分位数可以是90%、80%、75%、70%等并且较低百分位数可以是10%、15%、20%、25%和30%等)、其它集中趋势的统计量度(例如,中值或众数)、离差(例如,平均偏差、标准偏差、方差、四分位差、范围)等。进一步地,所述一个或多个度量中的每一个可以是位置特定的。例如,一些度量可以根据从围绕患者的所选区域(例如,患者的左侧、患者的右侧等)定位的电极记录或监测的信号来计算。
131.在至少一个实施例中,计算设备140和远程计算装置160中的一个或两个可以是服务器、个人计算机或平板计算机。计算设备140可以被配置成从输入设备142(例如,键盘)接收输入并将输出传输到显示设备130,并且远程计算装置160可以被配置成从输入设备162(例如,触摸屏)接收输入并将输出传输到显示设备170。计算设备140和远程计算装置160中的一个或两个可以包含数据存储器,所述数据存储器可以允许访问处理程序或例程和/或一种或多种其它类型的数据,例如用于分析由电极设备110夺获的多个电信号,用于确定qrs开始、qrs偏移、中值、众数、平均值、峰值或最大值、谷值或最小值,用于确定电激活时间,用于确定vfa起搏疗法是否已夺获心脏传导系统,用于确定患者是否存在a
‑
v阻断,用于驱动图形用户接口,所述图形用户接口被配置成无创地辅助用户配置一个或多个起搏参数或设置,例如起搏率、心室起搏率、a
‑
v间期、v
‑
v间期、起搏脉冲宽度、起搏向量、多点起搏向量(例如,左心室向量四引线)、起搏电压、起搏配置(例如,双心室起搏、仅右心室起搏、仅左心室起搏等),以及心律失常检测和治疗、速率自适应设置和性能等。
132.计算设备140可以操作性地耦接到输入设备142和显示设备130以例如向输入设备142和显示设备130中的每个设备传输数据并从所述设备传输数据,并且远程计算装置160可以操作性地耦接到输入设备162和显示设备170以例如向输入设备162和显示设备170中的每个设备传输数据并从所述设备传输数据。例如,可以使用例如模拟电连接、数字电连接、无线连接、基于总线的连接、基于网络的连接、基于因特网的连接等来将计算设备140和远程计算装置160电耦接到输入设备142、162和显示设备130、170。如本文进一步描述的,用户可以向输入设备142、162提供输入以查看和/或选择与由心脏疗法设备(例如植入式医疗装置)递送的心脏疗法相关的一条或多条心脏传导系统夺获信息、a
‑
v阻断信息和配置信息。
133.尽管如所描绘的,输入设备142是键盘并且输入设备162是触摸屏,但是应理解,输入设备142、162可以包含能够向计算设备140和计算装置160提供输入以执行本文所描述的功能、方法和/或逻辑的任何设备。例如,输入设备142、162可以包含键盘、鼠标、跟踪球、触摸屏(例如,电容式触摸屏、电阻式触摸屏、多点触摸式触摸屏等)等。同样,显示设备130、
170可以包含能够向用户显示信息的任何设备,如图形用户接口132、172,包含电极状态信息、电激活的图形图、外部电极在一个或多个心跳上的多个信号、qrs复合波、各种心脏疗法方案选择区域、各种心脏疗法方案排名、各种起搏参数、电异质性信息(ehi)、文本指令、人体心脏的解剖结构的图形描绘、患者的心脏的图像或图形描绘、一个或多个电极的位置的图形描绘、人体躯干的图形描绘、患者的躯干的图像或图形描绘、植入的电极和/或引线的图形描绘或实际图像等。进一步地,显示设备130、170可以包含液晶显示器、有机发光二极管屏幕、触摸屏、阴极射线管显示器等。
134.由计算设备140和远程计算装置160存储和/或执行的处理程序或例程可以包含用于计算数学、矩阵数学、分解算法、压缩算法(例如,数据压缩算法)、校准算法、图像构造算法、信号处理算法(例如,各种滤波算法、傅立叶变换、快速傅立叶变换等)、标准化算法、比较算法、向量数学或实施本文所描述的一个或多个说明性方法和/或过程的任何其它处理的程序或例程。由计算设备140和远程计算装置160存储和/或使用的数据可以包含例如来自电极设备110的电信号/波形数据(例如,多个qrs复合波)、来自电极设备110的电激活时间、来自声学传感器的心音/信号/波形数据、图形(例如,图形元素、图标、按钮、窗口、对话框、下拉菜单、图形区、图形区域、3d图形等)、图形用户接口、根据本公开所采用的一个或多个处理程序或例程的结果(例如,电信号、电异质性信息等)或用于执行本文所描述的一个和/或多个过程或方法的任何其它数据。
135.在一个或多个实施例中,说明性系统、方法和接口可以使用在可编程计算机(例如,包含例如处理能力、数据存储装置(例如,易失性或非易失性存储器和/或存储元件)、输入装置和输出装置的计算机)上执行的一个或多个计算机程序来实施。本文所描述的程序代码和/或逻辑可以应用于输入数据以执行本文所描述的功能并且产生期望的输出信息。可以将输出信息作为输入应用到本文所描述或将以已知方式应用的一个或多个其它装置和/或方法。
136.可以使用任何可编程语言来提供用于实施本文所描述的系统、方法和/或接口的一个或多个程序,例如适合与计算机系统通信的高级程序和/或面向对象的编程语言。例如,任何此类程序可以存储在可通过在计算机系统(例如,包含处理设备)上运行的用于在合适的设备读取时配置和操作计算机系统以执行本文描述的程序的通用或专用程序读取任何合适的装置上,例如,存储介质。换句话说,至少在一个实施例中,可以使用配置有计算机程序的计算机可读存储介质来实施说明性系统、方法和接口,其中如此配置的存储介质使计算机以具体且预定义的方式进行操作以执行本文所描述的功能。进一步地,在至少一个实施例中,可以将说明性系统、方法和/或接口描述为由在一个或多个非暂时性介质中编码的逻辑(例如,目标代码)来实施,所述逻辑包含用于执行的代码,并且在由处理器或处理电路系统执行时,可操作以执行如本文所描述的方法、过程和/或功能之类的操作。
137.计算设备140和远程计算装置160可以是例如任何固定或移动计算机系统(例如,控制器、微控制器、个人计算机、微型计算机、平板计算机等)。计算设备140和远程计算装置160的确切配置不是限制性的,并且可以使用基本上能够提供合适的计算能力和控制能力(例如,信号分析、数学函数如中值、众数、平均值、最大值确定、最小值确定、斜率确定、最小斜率确定、最大斜率确定、图形处理等)的任何装置。如本文所描述的,数字文件可以是含有可以由本文中所描述的计算设备140和远程计算装置160可读取和/或可写入的数字位(例
如,以二进制、三进制编码)的任何介质(例如,易失性或非易失性存储器、cd
‑
rom、打孔卡、磁性可记录磁带等)。而且,如本文所描述的,用户可读格式的文件可以是可在可由用户读取和/或理解的任何介质(例如,纸、显示器等)上呈现的数据(例如,ascii文本、二进制数、十六进制数、十进制数、图形等)的任何表示形式。
138.鉴于上文,将显而易见的是,可以按照所属领域技术人员已知的任何方式来实施根据本公开的一个或多个实施例中描述的功能。如此,要用于实施本文所描述的过程的计算机语言、计算机系统或任何其它软件/硬件不应限制本文所描述的系统、过程或程序(例如,由此类系统、过程或程序提供的功能)的范围。
139.说明性电极设备110可以被配置成测量患者114的体表电位,并且更确切地说,测量患者114的躯干表面电位。如图2中示出的,说明性电极设备110可以包含外部电极112组或阵列、条带113和接口/放大器电路系统116。电极112可以附接或耦接到条带113,并且条带113可以被配置成缠绕在患者114的躯干周围,使得电极112包围患者的心脏。如进一步所展示的,电极112可以被定位成围绕患者114的周围,包含患者114的躯干的后部、侧部、后侧、前侧和前部位置。
140.说明性电极设备110可以被进一步配置成测量或监测来自至少一个或两个患者114的声音。如图2所示,说明性电极设备110可以包含附接到或耦接到条带113的声学传感器120组或阵列。条带113可以被配置成缠绕在患者114的躯干周围,使得声学传感器120包围患者的心脏。如进一步所展示的,声学传感器120可以被定位成围绕患者114的周围,包含患者114的躯干的后部、侧部、后侧、前侧和前部位置。
141.进一步地,电极112和声学传感器120可以通过有线连接118电连接到接口/放大器电路系统116。接口/放大器电路系统116可以被配置成放大来自电极112和声学传感器120的信号并将信号提供给计算设备140和远程计算装置160中的一个或两个。其它说明性系统可以使用无线连接(例如,作为数据通道)来将由电极112和声学传感器120感测到的信号传输到接口/放大器电路系统116,并且进而传输到计算设备140和远程计算装置160中的一个或两个。在一个或多个实施例中,可以使用例如模拟电连接、数字电连接、无线连接、基于总线的连接、基于网络的连接、基于因特网的连接等来将接口/放大器电路系统116电耦接到计算设备140。
142.尽管在图2的实例中,电极设备110包含条带113,但是在其它实例中,可以采用多种机制中的任何机制,例如胶带或粘合剂,来辅助电极112和声学传感器120的间隔和放置。在一些实例中,条带113可以包含松紧带、胶带条或布。进一步地,在一些实例中,条带113可以是一件衣服(例如,t恤)的一部分或与一件衣服集成在一起。在其它实例中,电极112和声学传感器120可以单独地放置在患者114的躯干上。进一步地,在其它实例中,电极112(例如,布置成阵列)和声学传感器120(例如,也布置成阵列)中的一个或两个可以是贴片、背心和/或将电极112和声学传感器120固定到患者114的躯干的其它方式的部分或定位于其内。仍进一步地,在其它实例中,电极112和声学传感器120中的一个或两个可以是材料的两个部分或两个贴片的一部分或定位于其中。所述两个贴片中的一个贴片可以定位于患者114的躯干的前侧(例如,监测代表患者的心脏的前侧的电信号、测量代表患者的心脏的前侧的替代心脏电激活时间、监测或测量患者的前侧的声音等)并且另一个贴片可以定位于患者114的躯干的后侧(以例如监测代表患者的心脏的后侧的电信号,测量代表患者的心脏的后
侧的替代心脏电激活时间、监测或测量患者的后侧的声音等)。并且仍进一步地,在其它实例中,电极112和声学传感器120中的一个或两个可以布置成从患者114的前侧跨过患者114的左侧延伸到患者114的前侧的顶行和底行。又仍进一步地,在其它实例中,电极112和声学传感器120中的一个或两个可以布置成围绕腋窝区的曲线并且在右胸的电极/传感器密度可以低于其它剩余区域的密度。
143.电极112可以被配置成围绕患者114的心脏并且在信号已经传播穿过患者114的躯干之后记录或监测与心脏的去极化和复极化相关联的电信号。电极112中的每个电极可以以单极配置使用,以感测反映心脏信号的躯干表面电位。接口/放大器电路系统116也可以耦接到可以与用于单极感测的每个电极112组合使用的返回电极或无关电极(未示出)。
144.在一些实例中,在空间上围绕患者的躯干分布的电极112可以有约12个到约50个并且声学传感器120可以有约12个到约50个。其它配置可以具有更多或更少的电极112以及更多或更少的声学传感器120。应当理解,电极112和声学传感器120可以不布置成或分布成一直围绕或完全围绕患者114延伸的阵列。替代地,电极112和声学传感器120可以布置成阵列,所述阵列在患者114的仅一部分或部分周围延伸。例如,电极112和声学传感器120可以分布在患者的前侧、后侧和左侧,其中在右侧(包含患者右侧的后部和前部区域)具有较少或没有电极和声学传感器。
145.计算设备140可以记录和分析由电极112感测的躯干表面电位信号和由声学传感器120感测的声音信号,所述信号被接口/放大器电路系统116放大/调节。计算设备140可以被配置成分析来自电极112的电信号以提供来自患者的心脏的心电图(ecg)信号、信息或数据,如本文将进一步描述的。计算设备140可以被配置成分析来自声学传感器120的电信号以提供来自患者身体和/或植入其中的装置(如左心室辅助装置)的声音信号、信息或数据。
146.另外,计算设备140和远程计算装置160可以被配置成提供图形用户接口132、172,所述图形用户接口描绘了与电极设备110相关的各种信息以及使用电极设备110收集或感测的数据。例如,图形用户接口132、172可以描绘包含使用电极设备110获得的qrs复合波的ecg和包含使用声学传感器120获得的声波的声音数据以及与其相关的其它信息。说明性系统和方法可以无创地使用通过使用电极设备110收集的电信息和使用声学传感器120收集的声音信息来评估患者的心脏健康并且评估和配置向患者递送的心脏疗法。
147.进一步地,电极设备110可以进一步包含参考电极和/或驱动电极,例如所述参考电极和/或驱动电极要定位在患者114的下躯干周围,其可以被系统100进一步使用。例如,电极设备110可以包含三个参考电极,并且可以组合来自三个参考电极的信号以提供参考信号。进一步地,电极设备110可以使用三个尾部参考电极(例如,代替在威尔逊中心电端中使用的标准参考)以通过对三个定位在尾部的参考信号取平均值来获得具有较少噪声的“真实”单极信号。
148.图3展示了包含多个电极112和多个声学传感器120的另一说明性电极设备110,所述多个电极被配置成围绕患者114的心脏并且在信号已经传播穿过患者114的躯干之后记录或监测与心脏的去极化和复极化相关的电信号,所述多个声学传感器被配置成围绕患者114的心脏并且在信号已经传播穿过患者114的躯干之后记录或监测与心脏相关的声音信号。电极设备110可以包含背心114,所述多个电极112和所述多个声学传感器120可以附接在所述背心上或者所述电极112和声学传感器120可以耦接到所述背心。在至少一个实施例
中,所述多个电极112或者所述电极的阵列可以用于收集电信息,例如替代电激活时间。与图2的电极设备110类似,图3的电极设备110可以包含接口/放大器电路系统116,所述接口/放大器电路系统通过有线连接118电耦接到电极112和声学传感器120中的每一个并且被配置成将信号从电极112和声学传感器120传输到计算设备140。如所展示的,电极112和声学传感器120可以分布在患者114的躯干之上,包含例如患者114的躯干的后表面、侧表面、后侧表面、前侧表面和前部位置。
149.背心114可以由织物形成,其中电极112和声学传感器120附接到织物。背心114可以被配置成维持电极112和声学传感器120在患者114的躯干上的定位和间隔。进一步地,背心114可以被标记成辅助确定电极112和声学传感器120在患者114的躯干表面上的位置。在一些实例中,尽管在患者114的躯干周围可以分布有约25个到约256个电极112以及约25个到约256个声学传感器120,但是其它配置可以具有更多或更少的电极112以及更多或更少的声学传感器120。
150.说明性系统和方法可以用于在评估患者的心脏健康和/或评估和配置当前向患者递送的心脏疗法(例如,通过植入式医疗装置,如vfa起搏装置,通过lvad等)向用户提供无创辅助。例如,说明性系统和方法可以用于辅助用户确定一个或多个电极是否已成功夺获一个或两个心室以进行vfa起搏疗法以及患者是否正在经历a
‑
v阻断。进一步地,例如,说明性系统和方法可以用于辅助用户配置和/或调整一个或多个心脏疗法设置,例如优化起搏疗法(例如,仅左心室或左单心室起搏疗法)的a
‑
v间期或延迟和起搏疗法(例如,双心室起搏疗法)的a
‑
v间期或延迟和v
‑
v间期或延迟。
151.进一步地,应当理解,计算设备140和远程计算装置160可以以多种不同的方式操作性地彼此耦接以便进行或执行本文所描述的功能。例如,在所描绘的实施例中,计算装置140可以可操作地无线耦接到远程计算装置160,如其间发出的无线信号线所描绘的。另外,与无线连接相反,计算设备140和远程计算装置160中的一个或多个可以通过一个或有线电连接可操作地耦接。
152.本公开中描述的技术,包含归属于imd 10、装置50、imd 310、计算设备140和计算装置160和/或各种组成组件的技术,可以至少部分地以硬件、软件、固件或其任何组合来实施。例如,这些技术的各个方面可以在一个或多个处理器(包含一个或多个微处理器、dsp、asic、fpga或任何其它等效集成或离散逻辑电路系统,以及此类组件的任何组合)内实施,其体现在编程器中,如医师或患者编程器、刺激器、图像处理装置或其它装置。术语“模块”、“处理器”或“处理电路系统”通常可以指代前述逻辑电路系统单独或与其它逻辑电路系统的组合或任何其它等效的电路系统中的任何电路系统。
153.此类硬件、软件和/或固件可以在同一装置内或在单独的装置内实施,以支持本公开中描述的各种操作和功能。另外,任何所描述的单元、模块或组件可以一起或以离散但可互操作的逻辑装置的形式单独实施。将不同特征描绘为模块或单元旨在突出不同的功能方面,并且不一定暗示此类模块或单元必须由单独的硬件或软件组件来实现。相反,与一个或多个模块或单元相关联的功能可以由单独的硬件或软件组件来执行,或者集成在共用的或单独的硬件或软件组件中。
154.当以软件实施时,归因于本公开中所描述的系统、装置和技术的功能可以体现为如ram、rom、nvram、eeprom、闪速存储器、磁数据存储介质、光学数据存储介质等计算机可读
介质上的指令。可以由处理电路系统和/或一个或多个处理器执行指令以支持本公开中所描述的功能的一个或多个方面。
155.出于所有目的,本文所引用的所有参考文献和出版物均以全文引用的方式明确地并入,除非并入的任何方面与本公开直接矛盾。
156.除非另外指明,本文所使用的所有科学和技术术语具有本领域所普遍使用的意义。本文提供的定义是为了促进对本文中经常使用的某些术语的理解,并不意味着限制本公开的范围。
157.除非另有说明,否则在说明书和权利要求书中使用的所有表示特征尺寸、数量和物理性质的数字都可以理解为被术语“完全”或“约”修饰。因此,除非有相反的指示,否则前述说明书和所附权利要求书中所示的数值参数是近似值,其可以根据本领域的技术人员利用本文公开的教导或例如在实验误差的典型范围内寻求获得的所需性质而变化。
158.通过端点列举的数值范围包含纳入所述范围内的所有数字(例如,1到5包含1、1.5、2、2.75、3、3.80、4和5)以及所述范围内的任何范围。在本文中,术语“至多”或“不大于”一个数字(例如,至多50)包含此数字(例如50),并且术语“不小于”一个数字(例如,不小于5)包含此数字(例如5)。
159.术语“耦接”或“连接”是指元件彼此直接连接(彼此直接接触)或间接连接(在两个元件之间具有一个或多个元件并将其连接)。这两个术语都可以通过“操作性地”和“可操作地”进行修改,它们可以互换使用,以描述耦接或连接配置成允许组件交互以执行至少某些功能(例如,可以将第一医疗装置可操作地耦接到另一医疗装置从而以数据形式发送信息或从中接收数据)。
160.与方向有关的术语,例如“顶部”、“底部”、“侧”和“端”,用于描述部件的相对位置,并不意味着限制所考虑的实施例的方向。例如,被描述为具有“顶部”和“底部”的实施例也包括其沿各种方向旋转的实施例,除非内容清楚地另外指出。
161.提及“一个实施例(one embodiment)”、“一个实施例(an embodiment)”、“某些实施例(certain embodiments)”或“一些实施例(some embodiments)”等意味着结合实施例描述的特定特征、配置、组成或特性包含在本公开的至少一个实施例中。因此,这些短语在各个地方的出现不一定是指本公开的相同实施例。此外,在一个或多个实施例中,可以以任何适合的方式组合特定特征、配置、组成或特性。
162.如本说明书和所附权利要求书中所使用的,除非文中另外明确指明,否则单数形式的“一个(a)”、“一种(an)”以及“所述(the)”包括具有多个指代物的实施例。除非内容另外明确规定,否则如本说明书和所附权利要求书中所使用,术语“或”通常在其意义上用来包含“和/或”。
163.如本文中所使用的,“有”、“具有”、“包括”、“包含”等以其开放式含义使用,并且通常是指“包括但不限于”。将理解的是,“基本上由
……
组成”、“由
……
组成”等被包含在“包含”等中。
164.术语“和/或”是指一个或所有列出的元件或至少两个列出的元件的组合。列表跟随的短语“至少一个”、“包括至少一个”和“一个或多个”指的是列表中的任何一项以及列表中两个或更多个项目的任何组合。
165.说明性实施例
166.实施例1:一种系统,其包括:
167.a.电极设备,所述电极设备包括用于监测来自患者的组织的电活动的多个电极;以及
168.b.计算设备,所述计算设备包括处理电路系统,并且耦接到所述电极设备并且被配置成:
169.i.在以多个诊断性a
‑
v延迟递送心房至心室(vfa)起搏疗法期间使用所述多个电极中的一个或多个电极监测所述患者的心脏的电活动,其中所述多个诊断性a
‑
v延迟中的每个诊断性a
‑
v延迟小于所述患者的固有a
‑
v延迟;并且
170.ii.基于在以所述多个诊断性a
‑
v延迟递送vfa起搏疗法期间的监测到的电活动来确定所述vfa起搏疗法是否已夺获心脏传导系统。
171.实施例2:一种方法,其包括:
172.a.在以多个诊断性a
‑
v延迟递送心房至心室(vfa)起搏疗法期间使用多个电极中的一个或多个电极监测所述患者的心脏的电活动,其中所述多个诊断性a
‑
v延迟中的每个诊断性a
‑
v延迟小于所述患者的固有a
‑
v延迟;以及
173.b.基于在以所述多个诊断性a
‑
v延迟递送vfa起搏疗法期间的监测到的电活动来确定所述vfa起搏疗法是否已夺获心脏传导系统。
174.实施例3:一种植入式医疗装置,其包括:
175.a.多个电极,所述多个电极包括:
176.i.右心房电极,所述右心房电极能够定位于右心房内,以向患者的心脏的所述右心房递送心脏疗法或感测所述右心房的电活动,以及
177.ii.组织刺穿电极,所述组织刺穿电极可穿过右心房心内膜和中心纤维体植入,以向患者的心脏的左心室递送心脏疗法或感测所述左心室的电活动;
178.b.疗法递送电路,所述疗法递送电路可操作地耦接到所述多个电极以向所述患者的心脏递送心脏疗法;
179.c.感测电路,所述感测电路可操作地耦接到所述多个电极以感测所述患者的心脏的电活动;以及
180.d.控制器,所述控制器包括可操作地耦接到所述疗法递送电路和所述感测电路的处理电路系统,所述控制器被配置成:
181.i.至少使用所述组织刺穿电极以多个诊断性a
‑
v延迟递送心房至心室(vfa)起搏疗法,其中所述多个诊断性a
‑
v延迟中的每个诊断性a
‑
v延迟小于所述患者的固有a
‑
v延迟;
182.ii.在以所述多个诊断性a
‑
v延迟递送vfa起搏疗法期间使用所述多个电极中的一个或多个电极监测所述患者的心脏的电活动;并且
183.iii.基于在以所述多个诊断性a
‑
v延迟递送vfa起搏疗法期间的监测到的电活动来确定所述vfa起搏疗法是否已夺获心脏传导系统。
184.实施例4:根据实施例1到3中任一项所述的系统、方法或装置,其中所述系统进一步包括vfa起搏疗法设备,其中所述vfa起搏疗法设备包括组织刺穿电极,所述组织刺穿电极可从右心房的科赫三角区域穿过右心房心内膜和中心纤维体植入,以在所述患者的心脏的左心室心肌的基底和/或隔区中将所述vfa起搏疗法递送到左心室。
185.实施例5:根据实施例1到4中任一项所述的系统、方法或装置,其中所述多个诊断
性a
‑
v延迟中的最长的诊断性a
‑
v延迟小于或等于所述患者的固有a
‑
v延迟的70%。
186.实施例6:根据实施例1到2和4到5中任一项所述的系统或方法,其中所述多个电极包括以阵列定位的多个表面电极,所述多个表面电极被配置成定位在所述患者的躯干的皮肤附近。
187.实施例7:根据实施例1到2和4到6中任一项所述的系统或方法或装置,其中所述计算设备被进一步配置成执行或所述方法进一步包括:基于在以所述多个诊断性a
‑
v延迟递送vfa起搏疗法期间的所述监测到的电活动来生成电异质性信息(ehi),其中基于在以所述多个诊断性a
‑
v延迟递送vfa起搏疗法期间的所述监测到的电活动来确定所述vfa起搏疗法是否已夺获心脏传导系统包括:基于所述ehi确定所述vfa起搏疗法是否已夺获心脏传导系统。
188.实施例8:根据实施例7中任一项所述的系统或方法,其中以多个诊断性a
‑
v延迟递送vfa起搏疗法包括:随时间的推移减小所述诊断性a
‑
v延迟,并且
189.a.其中基于所述ehi确定所述vfa起搏疗法是否已夺获心脏传导系统包括:如果所述ehi随所述a
‑
v延迟的减小而变化,则确定所述vfa起搏疗法未夺获心脏传导系统。
190.实施例9:根据实施例1到2和4到8中任一项所述的系统或方法,其中所述多个电极包括一个或多个植入式电极。
191.实施例10:根据实施例1到9中任一项所述的系统、方法或装置,其中以多个诊断性a
‑
v延迟递送vfa起搏疗法包括:随时间的推移减小所述诊断性a
‑
v延迟,并且
192.a.其中基于在以所述多个诊断性a
‑
v延迟递送vfa起搏疗法期间的所述监测到的电活动来确定所述vfa起搏疗法是否已夺获心脏传导系统包括如果:所述监测到的电活动的心脏信号形态和持续时间中的一个或两个随当前a
‑
v延迟的减小而变化,则确定所述vfa起搏疗法未夺获心脏传导系统。
193.实施例11:根据实施例1到10中任一项所述的系统、方法或装置,其中所述计算设备被进一步配置成基于在以所述多个诊断性a
‑
v延迟递送vfa起搏疗法期间的所述监测到的电活动来确定a
‑
v阻断。
194.实施例12:根据实施例11所述的系统、方法或装置,其中基于在以所述多个诊断性a
‑
v延迟递送vfa起搏疗法期间的所述监测到的电活动来确定a
‑
v阻断:如果满足以下条件,则确定av阻断:
195.a.随着当前a
‑
v延迟的减小,所述监测到的电活动的不同步性、心脏信号形态和心脏信号持续时间中的一个或全部保持一致;并且
196.b.所述监测到的电活动的不同步性、心脏信号形态和心脏信号持续时间中的一个或全部高于所选a
‑
v阻断阈值。
197.本公开是参考说明性实施例提供的,并不意味着被解释为限制性的。如先前所描述的,本领域技术人员将认识到,其它各种说明性应用可以使用如本文所描述的技术来利用本文所描述的设备和方法的有益特性。说明性实施例的各种修改以及本公开的另外的实施例在本说明书将变得显而易见。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。