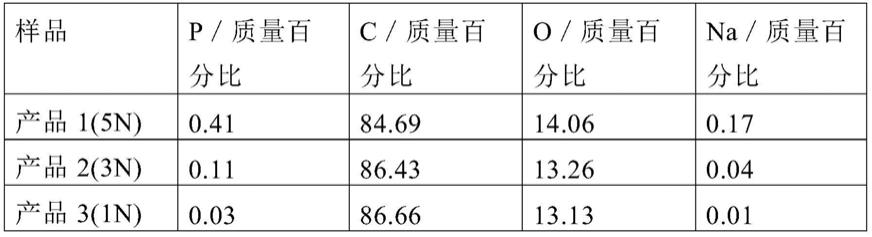
用于治疗癌症的免疫治疗组合
相关申请的交叉引用
1.本技术根据美国法典第35篇第119条第e款(35 u.s.c.
§
119(e))要求2019年2月27日提交的美国临时专利申请号62/811,459、2019年3月28日提交的美国临时专利申请号62/825,487、2019年4月24日提交的美国临时专利申请号62/838,180和2019年8月1日提交的美国临时专利申请号62/881,832的优先权权益,这些临时专利申请的披露内容各自通过援引并入本文。
技术领域
2.本技术(尤其)涉及免疫疗法的领域,并且在一个特定方面涉及癌症免疫疗法,并且涉及通过与t细胞扩增剂组合,任选地进一步与检查点抑制剂组合向患有癌症的个体施用抗癌疫苗(诸如dna新抗原疫苗)而对该个体进行的治疗。
背景技术:
3.癌症是由体细胞中的遗传改变或表观遗传改变引起的遗传病症,并且代表发达国家中最致命的疾病之一。人类中的肿瘤发生是多步骤过程,其涉及最终驱动正常细胞恶性转化的各种遗传变化或表观遗传变化。虽然我们对导致恶性肿瘤的机制的了解持续取得巨大进步,但是驱动癌症发展、生长和扩散的过程的复杂性使得开发新的且有效的治疗特别具有挑战性。
4.癌症治疗的常规方法包括手术、放疗和传统化疗,它们各自具有其自身公知的优点和缺点。最近,已经作为治疗癌症的替代方法探索了治疗性癌症疫苗。治疗性癌症疫苗代表通过刺激或恢复受试者的免疫系统对抗感染和疾病的能力而起作用的一类物质。与预防性或防治性疫苗形成对照,治疗性疫苗用于通过增强身体针对癌症的天然免疫应答来治疗现有癌症并且代表一种类型的免疫疗法。癌症治疗疫苗被设计来激活细胞毒性t细胞并且指导它们识别并抵抗特定类型的癌症或诱导产生与癌细胞表面上的分子结合的抗体。此类分子的一种类型(称为肿瘤相关抗原)是在正常组织中以低水平表达,但在肿瘤组织中以高得多的水平表达的抗原。然而,产生与肿瘤相关抗原结合的有效的治疗性疫苗已被证明是具有挑战性的工作,至少部分是因为疫苗干预必须对抗身体免疫系统,而身体免疫系统受到维持癌症的机制的限制。另外,以基于肿瘤相关抗原的疫苗为基础的治疗方法也可能由于正常的细胞破坏而导致毒性。为了有效,治疗性癌症疫苗不仅必须刺激针对预期靶标的特异性免疫应答,而且必须足够强大来克服癌细胞用于保护它们自身免受杀伤性t细胞攻击的屏障。在过去几年中,在开发涵盖各种平台的治疗性癌症疫苗方面已经做了大量努力。例如,已经在患有乳腺癌、肺癌、黑素瘤、胰腺癌、结直肠癌和肾癌的患者中评价了治疗性疫苗(melero,i.等人,nat rev clin oncol[自然综述:临床肿瘤学],2014,11(9),509
‑
524),但此类治疗性抗癌疫苗只取得了有限的成功。
[0005]
最近,用于治疗癌症的免疫治疗方法已经扩展到针对源自肿瘤中随机体细胞变异的肿瘤特异性新抗原的疫苗接种。针对肿瘤特异性新抗原的疫苗接种可使对中枢和外周耐
受的潜在诱导以及自身免疫的风险降至最低。
[0006]
虽然对免疫介导的肿瘤控制中所涉及的机制的认识持续快速增长,但是将免疫疗法成功地转化到临床中仍然是一项挑战。尽管迄今为止在开发涵盖各种平台的治疗性疫苗方面已经做了大量努力,但是仍然需要鉴定和提供新的且更有效的免疫治疗方法,诸如可以有效地靶向肿瘤特异性抗原并且提供有效且稳健的抗肿瘤应答的疫苗相关治疗形式。因此,本披露力图解决这些和其他需求。
技术实现要素:
[0007]
本披露提供了用于治疗患有癌症的受试者的新的且令人惊讶地有益的免疫治疗方法。更具体地讲,本文提供了用于治疗患有癌症的受试者的方法,该方法包括向该受试者施用:(i)针对来自患者自身肿瘤特异性抗原(称为“新抗原”)的多个新表位的抗癌dna疫苗(“基于新抗原的dna癌症疫苗”),和(ii)有效刺激/扩增t细胞的产生的化合物(即效应t细胞,“t细胞扩增剂”)。
[0008]
再一方面,本披露提供了用于治疗患有癌症的受试者的方法,该方法包括向该受试者施用(i)针对来自肿瘤新抗原的多个新表位的抗癌dna疫苗,(ii)有效刺激/扩增t细胞的产生的化合物,和任选的(iii)检查点抑制剂。
[0009]
在一个或多个实施例中,dna疫苗中包含的新表位作为称为疫苗体(vaccibody)的二聚体蛋白(将在本文中更详细地描述)呈递至免疫系统,即在此类实施例中,疫苗称为疫苗体dna疫苗。wo2004/076489详细描述了称为疫苗体的二聚体蛋白。在wo2011/161244中详细描述了靶向单位(包含在疫苗内并在下文进行描述)。
[0010]
在一个或多个其他实施例中,基于新抗原的dna癌症疫苗包含免疫有效量的dna多核苷酸,该dna多核苷酸包含编码以下的核苷酸序列:(i)靶向单位,(ii)二聚化单位,(iii)第一接头和(iv)抗原单位,其中该抗原单位包含n
‑
1个抗原亚单位(其中n是约3至50的整数),每个亚单位包含癌症新表位序列的至少一部分和第二接头,并且进一步包含最终的癌症新表位序列。在通过援引并入本文的美国专利公开号us 2019/0022202中描述了基于新抗原的代表性dna癌症疫苗,以及制备(即构建和表达)和使用此类疫苗的方法。
[0011]
在一些其他实施例中,基于新抗原的dna癌症疫苗包含免疫有效量的dna多核苷酸,该dna多核苷酸包含编码抗原单位的核苷酸序列。抗原单位包含n
‑
1个抗原亚单位,其中每个亚单位包含癌症新表位序列的至少一部分和接头,并且进一步包含最终的癌症新表位序列,其中n是3至50的整数。
[0012]
在一些其他实施例中,疫苗是包含10至50个新表位、或15至40个新表位、或10至30个新表位、或10至20个新表位的疫苗体dna疫苗。
[0013]
在另一些实施例中,疫苗包含含有编码如上所述的抗原单位的核苷酸序列的dna多核苷酸,其中接头是氨基酸接头。示例性接头包括例如富含甘氨酸/丝氨酸的接头。其他示例性接头包括,例如,标识为seq id no:67
‑
76的接头。
[0014]
支持性实施例中描述了包含vb10.neo pdna构建体vb4011和vb4061的基于新抗原的小鼠示例性dna癌症疫苗。
[0015]
在一些另外的实施例中,疫苗包含人dna多核苷酸序列。在另一些实施例中,疫苗包含如图12提供的dna pvb10.neo质粒骨架序列。
[0016]
在另一些实施例中,t细胞扩增剂当与基于新抗原的dna癌症疫苗组合施用时,有效增强针对疫苗表位的特异性克隆t细胞扩增,超过在不存在t细胞扩增剂的情况下施用基于新抗原的dna癌症疫苗时达到的效果,增强程度高于相加作用。
[0017]
在一个或多个特定实施例中,t细胞扩增剂是白介素
‑
2(例如阿地白介素、脱丙氨酰
‑
1、丝氨酸
‑
125人白介素
‑
2)的前药,其中该白介素
‑
2通过多个聚乙二醇部分的可释放共价附接而改性。在一个或多个另外的实施例中,t细胞扩增剂是白介素
‑
2受体β(il
‑
2rβ)选择性激动剂。
[0018]
在另一些实施例中,t细胞扩增剂是il
‑
2rβ选择性激动剂组合物,多(2,7
‑
(双
‑
甲氧基peg
‑
甲酰胺)(9h
‑
芴
‑9‑
基)甲基n
‑
氨基甲酸酯)白介素
‑
2(在本文中也称为“rslail
‑
2”),其包含式(i)的化合物,其中il
‑
2是白介素
‑
2(例如阿地白介素),
“‑
nh
‑
il
‑
2”表示白介素
‑
2的氨基,每个整数(n)具有约200
‑
300的值;或其药学上可接受的盐形式。在某些实施例中,每条聚乙二醇链中的“n”为约227(即,其中从中心芴基核延伸的每条聚乙二醇链的重均分子量为约10,000道尔顿,使得每个总体支化peg部分的重均分子量为约20,000道尔顿)。
[0019]
在又一些其他实施例中,t细胞扩增剂是(2,7
‑
(双
‑
甲氧基peg
10kd
‑
甲酰胺)(9h
‑
芴
‑9‑
基)甲基n
‑
氨基甲酸酯)
6avg
白介素
‑
2。
[0020]
在该方法的一个或多个实施例中,其中该癌症包括癌性肿瘤,当在临床或临床前环境中评价时,肿瘤中基于新抗原的dna癌症疫苗诱导的t细胞(诸如对每种疫苗编码的新抗原具有反应性的cd4和cd8 t细胞)的数目比单独施用一个或多个剂量的基于新抗原的dna癌症疫苗后测定的此类t细胞的数目增加。
[0021]
在一些实施例中,该癌症是实体癌。
[0022]
在该方法的另一些实施例中,该癌症选自例如由以下组成的组:乳腺癌、卵巢癌、结肠癌、前列腺癌、骨癌、结直肠癌、胃癌、淋巴瘤、恶性黑素瘤、肝癌、小细胞肺癌(sclc)、非小细胞肺癌(nsclc)、胰腺癌、甲状腺癌、肾癌(例如肾细胞癌)、胆管癌、头颈癌(例如头颈部鳞状细胞癌)、脑癌、宫颈癌、上颌窦癌、膀胱癌(例如尿路上皮癌)、食管癌、霍奇金病(hodgkin's disease)以及肾上腺皮质癌等。
[0023]
在一些其他实施例中,该癌症选自局部晚期或转移性黑素瘤、非小细胞肺癌、透明肾细胞癌、尿道上皮癌和头颈部鳞状细胞癌。
[0024]
在一个或多个其他实施例中,该癌症是黑素瘤或结肠癌。
[0025]
为了清楚起见,关于施用顺序,基于新抗原的dna癌症疫苗和t细胞扩增剂,以及任选的检查点抑制剂,可以同时或依次,以任何顺序,并且经由相同和/或不同的施用途径施用。更具体地,组合疗法的治疗组分可以各自在同一天、不同天或两者混合的方式施用(两
种免疫治疗组分在同一天施用,一种免疫治疗组分在不同天施用)。而且,治疗可包括单个治疗周期,或者可包括多个周期,包括一个或多个剂量的基于新抗原的dna癌症疫苗、t细胞扩增剂和任选的检查点抑制剂中的每一种。应当理解的是,治疗可包括单个周期和多个周期的混合,例如将基于新抗原的dna癌症疫苗、t细胞扩增剂和任选的检查点抑制剂中的至少一种施用单个周期,并且将基于新抗原的dna癌症疫苗、t细胞扩增剂和任选的检查点抑制剂中的一种或多种施用多个周期。
[0026]
在一些实施例中,在施用基于新抗原的dna癌症疫苗后施用t细胞扩增剂。
[0027]
在一些更特定的实施例中,在基于新抗原的dna癌症疫苗诱导期之后施用t细胞扩增剂,其中此类诱导期可以跨越一次或多次疫苗施用,例如在给定时间段内的1、2、3、4次或更多次疫苗接种。在一些实施例中,诱导期后的时间是一次或多次疫苗接种后新表位特异性t细胞应答已基本上趋平,即不再显著增加的时间。例如,在一个或多个实施例中,此类时间处于新表位特异性t细胞应答已达到其最大值,或在其最大值的
±
25%以内,或在其最大值的
±
15%以内,或在其最大值的约
±
10%以内的时间范围内。例如,可以在诱导期的最后一次疫苗接种后约3
‑
20天内,或在诱导期的最后一次疫苗接种后约3
‑
15天内,或在诱导期的最后一次疫苗接种后约7
‑
20天内,诸如在约7
‑
15天内或在7
‑
12天内施用t细胞扩增剂。也可考虑其他范围。在一些实施例中,在诱导期的最后一次疫苗施用后至少3天施用t细胞扩增剂。以可替代的方式测量,可以例如在疫苗接种开始后约4
‑
20周内(即在诱导期的第一次疫苗接种后),或在诱导期的第一次疫苗接种后约6
‑
16周内,或在诱导期的第一次疫苗接种后约8
‑
12周内,例如在诱导期的第一次疫苗接种后11周内首先施用t细胞扩增剂。
[0028]
在另一些实施例中,施用包括施用新表位特异性的基于dna的癌症疫苗和t细胞扩增剂中的每一种,以调准或基本上调准新表位特异性的基于dna的癌症疫苗和t细胞扩增剂两者的峰值t细胞应答,从而实现优化的(优选协同的)t细胞应答。
[0029]
在一些其他实施例中,在施用一个或多个剂量的基于新抗原的dna癌症疫苗,例如在1
‑
5个剂量(即,疫苗接种)之后,或在1
‑
4个剂量(疫苗接种)之后,或在1
‑
3个剂量(疫苗接种)之后,或在1
‑
2个剂量(疫苗接种)后的一段时间处施用t细胞扩增剂,例如从而引起特异性t细胞应答的增强。在一些特定实施例中,在2或3次疫苗接种或4次疫苗接种后施用t细胞扩增剂。在一些其他实施例中,在4次疫苗接种后施用t细胞扩增剂。在一些更特定的实施例中,在诱导期的最后一次疫苗接种后1
‑
20天施用t细胞扩增剂。例如,最初在诱导期的最后一次疫苗接种后的第1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天施用t细胞。在一些情况下,疫苗接种期包括4次疫苗接种,并且在第4次疫苗接种后5
‑
10天,例如在第4次疫苗接种后5、6、7、8、9或10天,例如在第7天施用第一剂的t细胞扩增剂。在另一些实施例中,在初始剂量的t细胞扩增剂之后,在同一天或不同天施用疫苗和t细胞扩增剂。在一些特定的实施例中,在初始剂量的t细胞扩增剂之后,在同一天施用疫苗和t细胞扩增剂。
[0030]
在另一些实施例中,如上所述的疫苗诱导期包括一次以上的疫苗接种,在第一次施用后每次后续疫苗接种间隔1周、2周、3周或4周或更长时间。在一些其他实施例中,疫苗接种诱导期包括4次单独的疫苗接种,每次间隔1
‑
8周,或2
‑
8周,或2
‑
6周,或3
‑
8周,或4
‑
8周,或4
‑
6周。例如,在一些特定实施例中,对于前一个、两个或三个或四个剂量而言,疫苗每3周施用一次,随后疫苗接种间隔更长时间,例如每4周,或每5周或每6周,或更长时间。
[0031]
在与前述内容有关的一些实施例中,检查点抑制剂当包含在组合疗法中时,按以
下方式施用一轮或多轮:(i)在施用基于新抗原的dna癌症疫苗的同一天施用,(ii)在施用t细胞扩增剂的同一天施用,(iii)在施用基于新抗原的dna癌症疫苗之后施用,(iv)在施用t细胞扩增剂之后施用,(v)在施用基于新抗原的dna癌症疫苗之后但在施用t细胞扩增剂之前施用。在治疗性组分全部在同一天施用的一些实施例中,示例性的施用顺序是基于新抗原的dna癌症疫苗、t细胞扩增剂,接着是检查点抑制剂。
[0032]
在另外的一些实施例中,检查点抑制剂(cpi),诸如抗pd
‑
1抗体或其他合适的cpi,在治疗过程中施用一次以上。在又一些其他实施例中,检查点抑制剂最初在初始疫苗接种之后和在施用t细胞扩增剂之后施用。在又一些其他实施例中,检查点抑制剂最初在初始疫苗接种之后但在施用t细胞扩增剂之前施用。
[0033]
在一些其他实施例中,检查点抑制剂当包含在组合疗法中时,在基于新抗原的dna癌症疫苗的第一次疫苗接种(即,施用)之前和在t细胞扩增剂的第一次施用之前施用。
[0034]
示例性检查点抑制剂包括例如抗pd
‑
1抗体、抗ctla
‑
4抗体或抗pd
‑
l1抗体。
[0035]
在另外的实施例中,该癌症包括癌性肿瘤并且当与治疗前肿瘤的大小相比时,该方法有效地减小癌性肿瘤的大小。在一些更特定的实施例中,该癌症包括癌性肿瘤,并且当与施用前肿瘤的大小相比时,该方法有效地将癌性肿瘤的大小减小至少约30%(部分应答)、或至少约40%、或至少约50%、或至少约60%、或至少约70%、或至少约80%、或至少约90%,或引起肿瘤完全消退。在该方法的一些其他实施例中,该癌症包括癌性肿瘤,并且该方法有效地引起肿瘤完全消退。
[0036]
在以下描述(包括实例)和权利要求书中阐述了另外的方面和实施例。
附图说明
[0037]
图1提供了示例性vb10.neo pdna小鼠构建体vb4011(seq id no:1)的氨基酸序列,其编码来自b16的10个新表位,其中每个肽被十个氨基酸的接头(ggggs)2(seq id no:33)隔开,如表2所述。
[0038]
图2a
‑
2d说明,如实例1所述,在b16小鼠黑素瘤模型中当与示例性的基于dna的免疫治疗性新抗原疫苗vb10.neo组合施用时,施用t细胞扩增剂诸如rslail
‑
2加强新表位特异性ifn
‑
γt细胞应答。图2a是用对照(vb1026)、单独的疫苗(vb4011)或t细胞扩增剂和疫苗的组合(vb4011 rslail
‑
2)治疗后,b16肿瘤模型中总t细胞应答(ifn
‑
γ 斑点数/106个脾细胞)的图表。图2b是用对照(vb1026)、单独的疫苗(vb4011)或t细胞扩增剂和疫苗的组合(vb4011 rslail
‑
2)治疗后每个脾脏的总t细胞应答(即ifn
‑
γ 斑点数/脾脏)的图表。图2c是用对照(vb1026)、单独的疫苗(vb4011)或t细胞扩增剂和疫苗的组合(vb4011 rslail
‑
2)治疗后,以ifn
‑
γ 斑点数/脾脏表示的总cd8 t细胞应答(使用抗cd4抗体包被的dynabead获得的cd4 t细胞耗竭的脾细胞)的图表。图2d是用对照(vb1026)、单独的疫苗(vb4011)或t细胞扩增剂和疫苗的组合(vb4011 rslail
‑
2)治疗后,以ifn
‑
γ 斑点数/脾脏表示的总cd4 t细胞应答(使用抗cd8抗体包被的dynabead获得的cd8 t细胞耗竭的脾细胞)的图表。如图所示,t细胞扩增剂在小鼠黑素瘤模型中协同加强疫苗诱导的新表位特异性ifn
‑
γt细胞应答。
[0039]
图3a
‑
3d说明,如实例2所述,在ct26小鼠结肠癌模型中当与示例性的基于dna的免疫治疗性新抗原疫苗vb10.neo组合施用时,施用t细胞扩增剂加强新表位特异性ifn
‑
γt细
胞应答。图3a是用对照(vb1026)、单独的疫苗(vb4061)、单独的t细胞扩增剂(rslail
‑
2)或t细胞扩增剂和疫苗的组合(vb4011 rslail
‑
2)治疗后,ct26肿瘤模型中总t细胞应答(ifn
‑
γ 斑点数/106个脾细胞)的图表。图3b是用对照(vb1026)、单独的疫苗(vb4061)、单独的t细胞扩增剂(rslail
‑
2)以及t细胞扩增剂和疫苗的组合(vb4011 rslail
‑
2)治疗后,每个脾脏的总t细胞应答(即ifn
‑
γ 斑点数/脾脏)的图表。图3c是用对照(vb1026)、单独的疫苗(vb4061)、单独的t细胞扩增剂(rslail
‑
2)或t细胞扩增剂和疫苗的组合(vb4011 rslail
‑
2)治疗后,以ifn
‑
γ 斑点数/脾脏表示的总cd8 t细胞应答(使用抗cd4抗体包被的dynabead获得的cd4 t细胞耗竭的脾细胞)的图表。图3d是用对照(vb1026)、单独的疫苗(vb4061)、单独的t细胞扩增剂(rslail
‑
2)或t细胞扩增剂和疫苗的组合(vb4011 rslail
‑
2)治疗后,以ifn
‑
γ 斑点数/脾脏表示的总cd4 t细胞应答(使用抗cd8抗体包被的dynabead获得的cd8 t细胞耗竭的脾细胞)的图表。如图所示,t细胞扩增剂在小鼠结肠癌模型中协同加强疫苗诱导的新表位特异性ifn
‑
γt细胞应答。
[0040]
图4a
‑
4d说明,如实例3所述,在ct26小鼠结肠癌模型中当与示例性的基于dna的免疫治疗性新抗原疫苗vb4061和抗pd
‑
1抗体组合施用时,施用t细胞扩增剂加强新表位特异性ifn
‑
γt细胞应答。图4a是ct26肿瘤细胞注射后5
‑
25天,在ct26小鼠结肠癌模型中施用单独的疫苗(vb4061)、疫苗和抗pd
‑
1抗体的组合(vb4061 抗pd
‑
1抗体),或疫苗、抗pd
‑
1抗体和t细胞扩增剂的组合(vb4061 抗pd
‑
1抗体 rslail
‑
2)后,以肿瘤体积(cm3)表示的肿瘤生长图表。图4b是ct26肿瘤细胞注射后0
‑
49天,施用单独的疫苗(vb4061)、疫苗和抗pd
‑
1抗体的组合(vb4061 抗pd
‑
1抗体),或疫苗、抗pd
‑
1抗体和t细胞扩增剂的组合(vb4061 抗pd
‑
1抗体 rslail
‑
2)后,无肿瘤小鼠(即,从未建立肿瘤的小鼠)的百分比的图表。“无瘤小鼠”(tumor take)是指从未建立肿瘤的小鼠,其不同于建立肿瘤,后来肿瘤消退或清除的小鼠。图4c是ct26肿瘤细胞注射后0
‑
80天,施用单独的疫苗(vb4061)、疫苗和抗pd
‑
1抗体的组合(vb4061 抗pd1抗体),或疫苗、抗pd
‑
1抗体和t细胞扩增剂的组合(vb4061 抗pd
‑
1抗体 rslail
‑
2)后,小鼠的存活%的图表。图4d是ct26肿瘤细胞注射后0
‑
70天,施用单独的疫苗(vb4061)、疫苗和抗pd
‑
1抗体的组合(vb4061 抗pd
‑
1抗体),或疫苗、抗pd
‑
1抗体和t细胞扩增剂的组合(vb4061 抗pd
‑
1抗体 rslail
‑
2)后,用5
×
104个ct26肿瘤再次激发后而未再次治疗的无肿瘤小鼠的百分比的图表。如图所示,通过施用t细胞扩增剂进一步强化了接种个性化dna抗癌疫苗和抗pd1抗体的小鼠中的肿瘤保护。
[0041]
图5a
‑
5c提供了如实例1中进一步描述的在一次或多次施用抗癌疫苗后延期施用t细胞扩增剂的结果。图5a是用对照(vb1026)、第1天施用单独的疫苗(vb4011)或在抗癌疫苗后第11天或第14天施用t细胞扩增剂和疫苗的组合(vb4011 rslail
‑
2)治疗后,b16肿瘤模型中总t细胞应答(ifn
‑
γ 斑点数/脾脏)的图表。在抗癌疫苗后第14天、第18天或第21天和将t细胞扩增剂施用后第7天分析t细胞应答。当在抗癌疫苗后11天施用t细胞扩增剂时观察到最佳应答(最大t细胞应答如箭头所示)。图5b是用对照(vb1026)、第1天和第21天施用单独的疫苗(vb4061)以及在第21天(第2次疫苗接种的同一天)或第24天(第2次疫苗接种后3天)施用t细胞扩增剂和疫苗的组合(vb4061 rslail
‑
2)治疗后,ct26肿瘤模型中总t细胞应答(ifn
‑
γ 斑点数/脾脏)的图表。在施用rslail
‑
2后7天(例如,21 7或24 7)进行elispot。图中的天数是指在elispot中分析脾细胞的时间。(疫苗在第1天施用)。对于vb4061 rslail
‑
2d21,疫苗和rslail
‑
2(第二剂)的施用发生在同一天。对于vb4061 rslail
‑
2d28,
在第二次施用疫苗(第21天)后三天(第24天)施用rslail
‑
2。图5c是经三次施用对照(3x vb1026)、三次施用单独的疫苗(3xvac)、三次施用疫苗且在第三剂疫苗的同一天施用t细胞扩增剂(3xvac rslail
‑
2d35)以及三次施用疫苗且在第三剂疫苗后三天施用t细胞扩增剂(3x vac rslail
‑
2)进行治疗后,b16肿瘤模型中总t细胞应答(ifn
‑
γ 斑点数/脾脏)的图表。该图表明当rslail
‑
2晚至第3次疫苗接种施用时,当天和延期3天之间的差异不再存在。延期施用t细胞扩增剂似乎协同加强特异性t细胞应答。
[0042]
图6a
‑
6c.如实例3所述,第一次施用t细胞扩增剂时的肿瘤负荷似乎预示着应答(肿瘤生长减少)。图6a
‑
6c提供了肿瘤长度(mm)的图表,其中在ct26小鼠结肠癌模型中,在第0、9、18、27天(虚线)当第一次施用时的肿瘤负荷为1
‑
5mm(图6a)、6
‑
10mm(图6b)或>10mm(图6c)时开始施用t细胞扩增剂。另外用疫苗vb4061 抗pd
‑
1抗体(红色、绿色和蓝色图例)或仅用vb4061 抗pd
‑
1抗体(黑色图例)治疗小鼠。图6a和6c中的粉色线对应于第32天的rslail
‑
2。在大量小鼠中观察到完全应答,其中在第一次施用t细胞扩增剂时肿瘤大小<6mm。
[0043]
图7a
‑
7b.如实例3所述,图7a
‑
7b说明在ct26小鼠结肠癌模型中当与示例性的基于dna的免疫治疗性新抗原疫苗vb4061和抗pd
‑
1抗体组合施用时,施用t细胞扩增剂提供了相对小的肿瘤的快速、完全和持久消退以及较大肿瘤的持久稳定。图7a是作为对照的ct26肿瘤细胞注射后0
‑
42天以肿瘤长度(mm)表示的肿瘤生长图表。图7b是ct26肿瘤细胞注射后0
‑
56天,在ct26小鼠结肠癌模型中施用疫苗(vb4061)、抗pd
‑
1抗体和t细胞扩增剂的组合后,以肿瘤长度(mm)表示的肿瘤生长图表。每个图表中的线1
‑
10代表在该时间段内各个小鼠(n=10)的肿瘤长度。
[0044]
图8提供了vb10.neo pdna小鼠构建体vb4061(seq id no:2)的氨基酸序列,其编码来自ct26的20个新表位,其中每个肽被十个氨基酸的富含甘氨酸/丝氨酸的接头(ggggs)2隔开,如表2所述。
[0045]
图9提供了vb4061小鼠构建体中包含的来自ct26的各个新表位的氨基酸序列(seq id no:3
‑
22)。
[0046]
图10提供了vb4011小鼠构建体中包含的来自b16的各个新表位的氨基酸序列(seq id no:23
‑
32)。
[0047]
图11a
‑
d提供了在实例4中描述的整个临床研究中进行的给药和评价的概况。
[0048]
图12提供了完整的pvb10.neo质粒骨架序列,其包括表达产物(seq id no:77)的靶向模块(hmip
‑
1α,核苷酸1143
‑
1421)和二聚化模块(higg3的h1和h4及c
h
3结构域,核苷酸1422
‑
1853)的编码序列。灰色方块是内部sfii克隆位点(核苷酸1854
‑
1866和1869
‑
1881)。斜体序列是侧翼noti/bglii限制性位点(核苷酸1884
‑
1889)。加下划线的序列是富含甘氨酸/丝氨酸的接头(核苷酸1503
‑
1532和1854
‑
1868)。核苷酸编号不包括新抗原模块核苷酸)。
[0049]
图13提供了pvb10.neo质粒图谱。
具体实施方式
[0050]
本披露(尤其)涉及免疫疗法领域,并且在一个特定方面涉及癌症免疫疗法,并且通常涉及通过与t细胞扩增化合物(“t细胞扩增剂”),即能驱动针对疫苗表位的特异性克隆
t细胞扩增的化合物组合,任选地进一步与检查点抑制剂组合向患有癌症的患者施用个性化新抗原dna癌症疫苗而对该患者进行的治疗。定义
[0051]
在描述和要求保护本披露的某些特征时,除非另外指明,否则将依据下述定义使用以下术语。
[0052]
如本说明书中所用,除非上下文另外明确指出,否则单数形式“一”、“一种(个)”和“所述(该)”包括复数指代物。
[0053]
提及范围或子范围意在明确地列举由所公开范围的任两个成员形成的子范围。例如,描述为20至50或10至30的范围将由此明确地包括10至20、20至30、10至50、30至50等的范围。
[0054]“基本上”或“实质上”意指几乎全部地或完全地,例如给定量的约95%或更大。
[0055]
类似地,如本文所使用的“约”或“大约”意指在给定量的加或减5%内。
[0056]
应当理解,无论在什么情况下本文用语言“包含”描述方面时,还提供了关于“由
……
组成”和/或“实质上由
……
组成”描述的其他类似方面。
[0057]
如本文使用的“peg”或“聚乙二醇”意指包括任何水溶性的聚(环氧乙烷)。除非另外指明,否则“peg聚合物”或聚乙二醇是如下物质,其中基本上所有(优选所有)单体亚单位是环氧乙烷亚单位,但是,该聚合物可以含有不同的封端部分或官能团,例如用于缀合的封端部分或官能团。用于在本文所述的部分中使用的peg聚合物典型地将包括以下两种结构之一:
“‑
(ch2ch2o)
n
‑”
或
“‑
(ch2ch2o)
n
‑1ch2ch2‑”
,具体取决于末端的一个或多个氧是否被置换(例如在合成转化期间)。如上所述,对于基于peg的聚合物或基于peg的聚合物缀合物,变量(n)典型地将落在约3至4000的范围内,并且整个peg的末端基团和结构可以变化。t细胞扩增剂rslail
‑
2(下面有更详细地描述)的(n)的优选范围/值,例如关于式(i)、(ii)、(iii)和(iv),包括约200至300和约227。对于(n)的另外的示例性范围是适于提供总重均分子量在约250道尔顿至约90,000道尔顿的范围内的支化聚合物,诸如式(i)、(ii)、(iii)和(iv)中所提供的。(n)的另外的示例性范围是适于提供具有在以下范围内的总重均分子量的支化聚合物,诸如式(i)、(ii)、(iii)和(iv)所提供的聚合物:在选自约1,000道尔顿至约60,000道尔顿的范围内,在约5,000道尔顿至约60,000道尔顿的范围内,在约10,000道尔顿至约55,000道尔顿的范围内,在约15,000道尔顿至约50,000道尔顿的范围内,以及在约20,000道尔顿至约50,000道尔顿的范围内。
[0058]
关于任选地形成聚合物
‑
缀合物的一部分的聚合物的几何形状或总体结构而言的“支化”是指具有从分支点或中心结构特征延伸的两条或更多条聚合物“臂”或“链”的聚合物。在一些实施例中,支化聚合物包含源于中心结构特征的两条聚合物臂或链。
[0059]
共价的“可释放”键联(例如,在与活性部分诸如白介素
‑
2(例如,阿地白介素)共价附接的聚乙二醇的背景下)是在生理条件下通过任何合适的释放机制释放,从而使聚乙二醇聚合物从活性部分释放或脱离的键联。
[0060]
在水溶性聚合物(诸如peg)的情况下,分子量可以表示为数均分子量或重均分子量。除非另外指明,否则所有对分子量的提及本文均指重均分子量。两种分子量测定(数均与重均分子量)均可以使用凝胶渗透色谱法或其他液相色谱技术来测量。也可以使用用于测量分子量值的其他方法,如使用端基分析或测量依数性(colligative property)(例如
凝固点降低、沸点升高或渗透压)来确定数均分子量或使用光散射技术、超速离心法(ultracentrifugation)或粘度测定法来确定重均分子量。peg聚合物典型地是多分散的(即,聚合物的数均分子量和重均分子量不相等),具有优选小于约1.2、更优选小于约1.15、还更优选小于约1.10、再更优选小于约1.05且最优选小于约1.03的低多分散性值。
[0061]
术语“蛋白质”、“多肽”和“肽”在本文中可互换使用,并且是指任何肽连接的氨基酸链,无论长度、共翻译或翻译后修饰如何。
[0062]“药学上可接受的赋形剂”或“药学上可接受的载剂”是指可以包含在本文描述的组合物中并且不会对受试者引起显著不良毒理学作用的组分。
[0063]
如本文使用的术语“患者”或“受试者”是指患有或易于患有通过施用如本文提供的化合物或组合物或组合来预防或治疗的病症(诸如癌症)的活生物体,并且包括人和动物。受试者包括但不限于哺乳动物(例如,鼠类、猿猴、马科、牛科、猪科、犬科、猫科等),并且优选是人。
[0064]“施用”是指使用本领域技术人员已知的各种方法和递送系统中的任一种将治疗剂递送至受试者。示例性的施用途径包括静脉内、肌肉内、皮下、腹膜内、脊柱或其他胃肠外施用途径,例如通过注射或输注。如本文所用的短语“胃肠外施用”意指除了肠施用和局部施用之外,通常通过注射的施用方式,并且包括但不限于静脉内、肌肉内、动脉内、鞘内、淋巴管内、病灶内、囊内、眼眶内、心脏内、皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、脊柱内、硬膜外和胸骨内注射和输注,以及体内电穿孔。治疗剂可以经由非胃肠外途径或口服施用。其他非胃肠外途径包括局部、表皮或粘膜施用途径,例如鼻内、经阴道、经直肠、舌下或局部。一种或多种治疗剂的施用也可以针对每种治疗剂进行,例如,一次、多次和/或在一个或多个延长的时间段内进行。
[0065]“癌症”是指广泛的各种疾病,其特征在于体内异常细胞不受控制地生长。“癌症”或“癌症组织”包括肿瘤,并且如本文所用,涵盖实体瘤以及在体液诸如血液中发现的肿瘤细胞,并且包括转移性癌症。不受调控的细胞分裂和生长导致恶性肿瘤的形成,这些恶性肿瘤可侵袭邻近组织并且还可通过淋巴系统或血流转移至身体的远端部分。转移后,可以说远端肿瘤是“源自”转移前肿瘤的。
[0066]
术语“免疫疗法”是指通过包括诱导、增强、阻抑或以其他方式改变免疫应答的方法治疗受试者。
[0067]
术语“肿瘤新抗原”用于描述与宿主的外显子组相比包含一个或多个突变的任何肿瘤特异性抗原,并且在本文中与术语“癌症新抗原”同义使用。
[0068]
术语“肿瘤新表位”用于肿瘤抗原中的任何免疫原性突变,并且在本文中与术语“癌症新表位”同义使用。
[0069]
如本文所用的“肿瘤新表位序列”是在抗原亚单位中包含新表位的序列,并且与术语“癌症新表位序列”同义使用。
[0070]
如本文所用,“多个”是指3个或更多个给定项。
[0071]
术语“治疗性抗癌疫苗”和“治疗性癌症疫苗”同义地用于描述用于破坏或减少患者体内已经存在的肿瘤细胞数目的疫苗。
[0072]
治疗剂的“治疗有效量”或“治疗有效剂量”是当单独使用或与另一种治疗剂组合使用时,有效地(例如)保护受试者免于疾病(诸如癌症)的发作或促进通过疾病症状的严重
程度降低、无疾病症状期的频率和持续时间的增加、或由于疾病折磨所致的损伤或残疾的预防而证实的疾病消退的药剂的任何量。可以使用熟练的从业人员已知的各种方法诸如在临床试验期间在人受试者中、在预测人体功效的动物模型系统中或通过在体外测定法中测定治疗剂的活性来评价该治疗剂促进疾病消退的能力。例如,参见支持性实例。
[0073]
术语“基本上同源”或“基本上相同”意指特定主题序列(例如突变序列)因一个或多个取代、缺失或添加而不同于参考序列,其净效应不导致该参考序列与该主题序列之间不利的官能差异。出于本文的目的,与给定序列具有大于95%的同源性(同一性)、等效的生物活性(但并非必须是等效强度的生物活性)、以及等效的表达特征的序列被认为是基本上同源的(相同的)。出于确定同源性的目的,应当忽略成熟序列的截短。
[0074]
关于多肽和多核苷酸序列比较,在本文中可使用短语“至少80%的序列同一性”。这种表述是指与相应的参考多肽或相应的参考多核苷酸至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性。优选地,所讨论的多肽和参考多肽在20、30、40、45、50、60、70、80、90、100个或更多个氨基酸的连续链段上或在参考多肽的整个长度上表现出所指出的序列同一性。优选地,所讨论的多核苷酸和参考多核苷酸在60、90、120、135、150、180、210、240、270、300个或更多个核苷酸的连续链段上或在参考多肽的整个长度上表现出所指出的序列同一性。概述
[0075]
在试图解决与当前抗癌疫苗策略相关的至少一些缺点,例如,由于癌性肿瘤本身对t细胞生长能力的阻抑而引起的弱免疫应答时,本文提供了基于施用基于新抗原的个性化dna癌症疫苗和t细胞扩增剂(即,有效驱动针对疫苗表位的特异性克隆t细胞扩增的实体)的组合免疫疗法。
[0076]
il
‑
2通过含有α(il2rα,cd25)、β(il2rβ,cd122)和常见γ链受体(γ
c
,cd132)的受体
‑
信号传导复合物刺激免疫细胞增殖和激活。在高剂量时,il
‑
2与异二聚体il2rβγ受体结合,引起肿瘤杀伤性cd8 记忆效应t(cd8 t)细胞的所需扩增。然而,il
‑
2还以更大的亲和力结合至其异三聚体受体il2rαβγ,其扩增免疫阻抑性cd4 、cd25 调控性t细胞(treg),这可能导致对癌症免疫疗法的不良作用。因此,在试图克服与基于il
‑
2的抗癌疫苗接种策略相关的一个或多个缺点时,本文提供了将针对肿瘤特异性抗原的基于新抗原的dna癌症疫苗与施用t细胞扩增剂组合的治疗方式。在一个或多个优选的实施例中,t细胞扩增剂是il
‑
2rαβ偏向性激动剂。不受理论束缚,已经发现通过利用长效il
‑
2化合物,其中与负责激活免疫阻抑性treg的il2rα亚单位相互作用的区域被掩蔽(即,其活性被阻抑或遏制),例如rslail
‑
2,任选地进一步与检查点抑制剂组合,可以扩增疫苗接种诱导的表位特异性t细胞应答以实现优异的治疗功效,如将从本披露和支持实例中变得显而易见。疫苗
[0077]
本文提供的治疗方法包括施用(i)疫苗,即针对来自肿瘤新抗原的多个新表位的抗癌dna疫苗(“基于新抗原的dna癌症疫苗”),和(ii)有效刺激/扩增t细胞的产生(即效应t细胞,“t细胞扩增剂”)以治疗患有癌症的患者的化合物,任选地与检查点抑制剂组合。
[0078]
本文提供的组合物、组合和方法(尤其)可用于临床应用和临床前应用两者中。如在建立的体内癌症模型中进行的支持性临床前实例中所证明的,与基于新抗原的dna癌症
疫苗组合,任选地进一步与检查点抑制剂组合施用t细胞扩增剂(诸如rslail
‑
2)有效地显著扩增/增强受试者中对疫苗编码的新抗原的t细胞应答,从而提供对抗癌症的强新抗原聚焦的免疫应答。
[0079]
更具体地,所附实例中描述的临床前研究说明,与示例性t细胞扩增剂rslail
‑
2组合施用的示例性的基于新抗原的dna癌症疫苗vb10.neo的组合似乎协同增强新表位特异性t细胞应答,导致新表位特异性t细胞应答的量与单独的vb10.neo相比增加5倍。用vb10.neo与t细胞扩增剂rslail
‑
2组合治疗的小鼠表现出对每种新表位和增加数目的新表位更强烈的应答,证明免疫应答的广度和深度都由于组合疗法而升高。vb10.neo和rslail
‑
2的组合对cd8 t细胞应答产生甚至更大的作用,因为与任一种免疫治疗剂单独施用时相比,该组合引起对更多新表位的新表位特异性cd8 t细胞应答,进一步强化了该组合诱导强烈的新表位特异性cd8 t细胞应答的能力。在治疗性肿瘤模型中,在用vb10.neo、rslail
‑
2和抗pd
‑
1抗体的示例性三重免疫治疗组合(作为包括施用基于新抗原的个性化dna癌症疫苗、t细胞扩增剂和任选的检查点抑制剂的组合疗法的代表)治疗的小鼠中观察到增加数目的完全应答者,进一步证明了组合此类试剂从而激活免疫疗法的非重叠机制并产生对已建立的肿瘤的有效治疗的优点。
[0080]
在美国专利公开号2019/0022202中描述了适用于本文提供的方法的治疗性抗癌新表位疫苗,连同描述其制备和使用的方法,该专利通过援引并入本文。简言之,治疗性新表位疫苗是针对来自肿瘤新抗原的多个新表位的抗癌dna疫苗。个性化dna疫苗中所包含的新表位作为称为疫苗体的二聚体蛋白呈递至免疫系统。在wo2004/076489中详细描述了称为疫苗体的二聚体蛋白,其通过援引并入本文。
[0081]
例如,基于新抗原的dna癌症疫苗可包含免疫有效量的dna多核苷酸,该dna多核苷酸包含编码以下的核苷酸序列:(i)靶向单位(也称为靶向模块),(ii)二聚化单位(也称为二聚化模块),(iii)第一接头和(iv)抗原单位(也称为抗原模块),其中该抗原单位包含n
‑
1个抗原亚单位;n是3至50的整数。每个抗原亚单位包含癌症新表位序列的至少一部分和第二接头。另外,抗原单位进一步包含最终的癌症新表位序列。
[0082]
适用于本发明方法的疫苗设计成通过激活针对新抗原的t细胞引起细胞介导的免疫应答。当t细胞被加工并与mhc分子复合呈递时,t细胞识别新表位。
[0083]
优选地,新抗原疫苗包含编码多肽的dna多核苷酸,该多肽包含三个单位,即靶向单位(或模块)、二聚化单位(或模块)和抗原单位(或模块)。由于二聚化单位,多肽形成称为疫苗体的二聚体蛋白。编码三个单位的基因经基因工程改造以作为一个基因表达。当在体内表达时,多肽/二聚体蛋白靶向抗原呈递细胞(apc),这导致与相同的非靶向抗原相比疫苗效力增强。例如,参见图13,其提供了说明不同功能元件的示例性质粒图谱。
[0084]
在本文所述的疫苗中,抗原单位包含抗原亚单位,其中每个亚单位包含癌症新表位序列或癌症新表位序列的至少一部分。通过对肿瘤dna(或rna)测序并鉴定代表新抗原的肿瘤特异性突变获得新表位序列。因此,获得了特异性靶向所鉴定的肿瘤抗原的个性化新抗原疫苗。
[0085]
在一些实施例中,治疗性抗癌新表位疫苗包含免疫有效量的多核苷酸,该多核苷酸包含编码以下的核苷酸序列:(i)靶向单位,(ii)二聚化单位,(iii)第一接头,(iv)抗原单位,其中抗原单位包含n
‑
1个抗原亚单位,并且每个亚单位包含癌症新表位序列的至少一
部分和第二接头,其中抗原单位进一步包含最终的癌症新表位序列,其中n是3至50的整数。因此,在该实施例中,疫苗包含n个新表位或新表位序列和n
‑
1个第二接头,其中n是3至50的整数(下文提供了另外的示例性子范围)。
[0086]
抗原单位包含多个肿瘤新表位,其中每个新表位与在特定患者的肿瘤新抗原中鉴定的突变相对应。也就是说,所有选择的新抗原对于个体患者而言是独特的和特异性的。突变可以是导致至少一个氨基酸变化的任何突变。例如,突变可以是以下之一:导致氨基酸变化的非同义突变、导致移码并由此在突变后方向上导致完全不同的开放阅读框的突变、其中终止密码子经修饰或缺失产生具有肿瘤特异性新表位的较长蛋白质的通读突变、产生独特的肿瘤特异性蛋白质序列的剪接突变、产生在两种蛋白质的连接处具有肿瘤特异性新表位的嵌合蛋白质的染色体重排。
[0087]
在抗原单位中,除了最后一个肿瘤新表位外,所有的肿瘤新表位均排列在抗原亚单位中,其中每个亚单位由肿瘤新表位序列和第二接头组成,而最后一个亚单位仅包含新表位,即没有第二接头。由于肿瘤新表位序列被第二接头隔开,因此每个新表位以最佳方式呈递至免疫系统。
[0088]
癌症新表位序列优选具有适于mhc分子呈递的长度。因此,在一个优选的实施例中,癌症新表位的长度为7至30个氨基酸。更优选的是具有7至10个氨基酸长度的癌症新表位序列或具有13至30个氨基酸,例如20至30个氨基酸的长度,例如由27个氨基酸组成的癌症新表位序列。优选地,抗原单位中包括多个不同的新表位。因此,优选的方法是在疫苗中包括尽可能多的新表位,从而有效地攻击肿瘤,同时不会由于所需t细胞效应的稀释而损害疫苗激活t细胞对抗新表位的能力。而且,为了确保所有新表位都有效地负载到相同的抗原呈递细胞上,将新表位排列为一条氨基酸链而不是离散的肽。
[0089]
为了制备疫苗,分析肿瘤外显子组以鉴定新抗原并选择最具抗原性的新表位。通常,向疫苗中掺入至少3个新表位,优选至少5个新表位,更优选至少7个新表位,诸如至少10个新表位等,以便能够有效地靶向基本上所有肿瘤细胞。
[0090]
更优选地,疫苗包含至少10个新表位。在另一个优选的实施例中,疫苗包含至少15个新表位,诸如至少20个新表位。例如,疫苗可包含3至50个新表位,或3至30个新表位,或3至20个新表位,或3至15个新表位,诸如3至10个新表位,因此n优选为3至50的整数,诸如3至30,诸如5至25,诸如3至20,诸如3至15,诸如3至10。在一些优选的实施例中,疫苗包含10至20个新表位。
[0091]
例如,抗原单位可以包含每个癌症新表位的一个拷贝,使得当疫苗中包含10个新表位时,可以引发针对10个不同新表位的细胞介导的免疫应答。替代性地,然而如果只鉴定了一些相关的抗原突变,则抗原单位可包含至少一个新表位的至少两个拷贝,以便强化对这些新表位的免疫应答。
[0092]
抗原单位的长度主要由抗原单位中新表位的长度和排列的新表位的数目决定,例如为约21至1500个,优选约30个氨基酸至约1000个氨基酸,更优选约50至约500个氨基酸,诸如约100至约400个氨基酸,约100至约300个氨基酸。
[0093]
新表位可以如下所述在抗原单位中排列,以便增强免疫应答。例如,根据所选择的新表位,抗原亚单位可以在从第一接头到最后一个新表位的方向上以更高抗原性到更低抗原性的顺序排列。替代性地,特别是如果新表位之间的亲水性/疏水性变化很大,则优选疏
水性最强的抗原亚单位基本上位于抗原单位的中间,而亲水性最强的抗原亚单位位于抗原单位的起始和/或末端。替代性地,新表位可以在亲水性新表位和疏水性新表位之间交替排列。优选地,富含gc的新表位被间隔开,从而避免gc簇,优选地富含gc的新表位被至少一个亚单位间隔开。
[0094]
第二接头设计为非免疫原性,并且优选地也是柔性接头,由此尽管抗原单位中存在大量抗原亚单位,但是肿瘤新表位以最佳方式呈递至t细胞。优选地,第二接头的长度为4至20个氨基酸以保护柔性。在另一个优选的实施例中,第二接头的长度为8至20个氨基酸,诸如8至15个氨基酸,例如8至12个氨基酸或诸如10至15个氨基酸。在一个特定实施例中,第二接头的长度为10个氨基酸。
[0095]
例如,在一个具体实施例中,疫苗编码由包含10个新表位的新表位抗原单位组成的蛋白质,其中第二接头的长度为8至20个氨基酸,诸如8至15个氨基酸,例如8至12个氨基酸或诸如10至15个氨基酸。在一个特定实施例中,疫苗编码由包含10个新表位的新表位抗原单位组成的蛋白质,其中第二接头的长度为10个氨基酸。
[0096]
在另一个说明性的实施例中,dna疫苗编码由包含10
‑
20个新表位的新表位抗原单位组成的蛋白质,每个新表位各含27个氨基酸,其中第二接头的长度为10个氨基酸。
[0097]
第二接头优选地在所有抗原亚单位中均是相同的。然而,如果一个或多个新表位包含与接头相似的氨基酸基序,则用不同序列的第二接头取代相邻的第二接头可能是有利的。而且,如果预测新表位
‑
第二接头连接处本身构成表位,则可以使用不同序列的第二接头。第二接头优选是富含丝氨酸
‑
甘氨酸的接头,诸如柔性ggggs(seq id no:34)接头,诸如gggss(seq id no:35)、gggsg(seq id no:36)、ggggs(seq id no:34)或其多种变体,诸如ggggsggggs(seq id no:33)或(ggggs)
m
,(gggss)
m
,(gggsg)
m
,其中m是1至5(例如1、2、3、4或5)、1至4或1至3的整数。在一些优选的实施例中,m为2。在一些其他优选的实施例中,丝氨酸
‑
甘氨酸接头进一步包含至少一个亮氨酸(l),诸如至少2个或至少3个亮氨酸。丝氨酸
‑
甘氨酸接头可以例如包含1、2、3或4个亮氨酸。在一些情况下,丝氨酸
‑
甘氨酸接头包含1个亮氨酸或2个亮氨酸。
[0098]
第二接头的实例包括以下这些:例如,第二接头可以包含以下序列或由以下序列组成:lgggs(seq id no:37)、glggs(seq id no:38)、gglgs(seq id no:39)、gggls(seq id no:40)或ggggl(seq id no:41);替代性地,第二接头可以包含以下序列或由以下序列组成:lggsg(seq id no:42)、glgsg(seq id no:43)、gglsg(seq id no:44)、ggglg(seq id no:45)或gggsl(seq id no:46);或第二接头可以包含以下序列或由以下序列组成:lggss(seq id no:47)、glgss(seq id no:48)、gglss(seq id no:49)、gggls(seq id no:50)或gggsl(seq id no:51)。作为进一步的实例,第二接头可以包含以下序列或由以下序列组成:lglgs(seq id no:52)、glgls(seq id no:53)、gllgs(seq id no:54)、lggls(seq id no:55)或glggl(seq id no:56),或者可以包含以下序列或由以下序列组成:lglsg(seq id no:57)、gllsg(seq id no:58)、gglsl(seq id no:59)、ggllg(seq id no:60)或glgsl(seq id no:61)组成,或者可以包含以下序列或由以下序列组成:lglss(seq id no:62)、glgls(seq id no:63)、gglls(seq id no:64)或glgsl(seq id no:65)。
[0099]
用于新表位抗原单位中将新表位隔开的另外的示例性第二接头包括富含丝氨酸
‑
甘氨酸的接头,诸如以下接头:sggggsgggg(seq id no:67)、gsggggsggg(seq id no:68)、
ggsggggsgg(seq id no:69)、gggsggggsg(seq id no:70)、gggssgggss(seq id no:71)、sgggssgggs(seq id no:72)、ssgggssggg(seq id no:73)、gssgggssgg(seq id no:74)、ggssgggssg(seq id no:75)和gggssgggsg(seq id no:76)。在一些优选的实施例中,第二接头选自seq id no:67至seq id no:76的接头。在一些其他实施例中,第二接头选自seq id no:67至seq id no:76的接头,按照seq id no:67的接头比seq id no:68的接头更优选,以此类推的优先顺序。如上所述,对于各种个性化疫苗,接头可以随构建体而变化,因为在组装构建体的新表位抗原单位时,评价了连接序列。因而,第一优选接头可以用另一候选接头代替,该候选接头排除了类似于在人蛋白质组中发现的序列的连接表位。优选的富含丝氨酸/甘氨酸的接头(例如10个氨基酸的接头)含有6至9个甘氨酸(例如6、7、8或9个)或6至8个甘氨酸。在一些优选的实施例中,接头中所含的剩余非甘氨酸氨基酸是丝氨酸。
[0100]
在美国专利公开号2019/0022202中描述了第二接头的其他说明性序列。
[0101]
优选疫苗的实例包括那些包含至少10个被10个氨基酸的接头隔开的新表位的疫苗,或那些包含至少15个被10个氨基酸的接头隔开的新表位,诸如至少20个被10个氨基酸的接头隔开的新表位的疫苗。
[0102]
如本文所用的术语“靶向单位”是指将多肽/蛋白质与其抗原一起递送至抗原呈递细胞,用于向cd4 t细胞的mhc il类限制性呈递或用于通过mhc i类限制向cd8 t细胞提供交叉呈递的单位。靶向单位通过二聚化单位与抗原单位连接,其中后者处于多肽/二聚体蛋白的cooh端或nh2端。优选抗原单位处于多肽/二聚体蛋白的cooh端。将靶向单位设计为将多肽/二聚体蛋白靶向在相关抗原呈递细胞上表达的表面分子,诸如仅在树突细胞(dc)亚群上表达的分子。
[0103]
apc上的此类靶表面分子的实例是人白细胞抗原(hla)、分化簇14(cd14)、分化簇40(cd40)、趋化因子受体和toll样受体(tlr)。hla是人类中的主要组织相容性复合体(mhc)。toll样受体可以例如包括tlr
‑
2、tlr
‑
4和/或tlr
‑
5。可借助于靶向单位将多肽/二聚体蛋白靶向此类表面分子,这些靶向单位包含例如对cd14、cd40或toll样受体具有特异性的抗体结合区;配体,例如可溶性cd40配体;天然配体如趋化因子,例如rantes或mip
‑
1a;或细菌抗原,例如鞭毛蛋白。
[0104]
说明性的靶向单位对mhc ii类蛋白具有亲和力。因此,在一个实施例中,编码靶向单位的核苷酸序列编码对mhc ii类蛋白具有特异性的抗体可变结构域(vl和vh),这些抗体可变结构域选自由抗hla
‑
dp、抗hla
‑
dr和抗hla
‑
ii组成的组。替代性地,靶向单位对选自由cd40、tlr
‑
2、tlr
‑
4和tlr
‑
5组成的组的表面分子具有亲和力。因此,在一个实施例中,编码靶向单位的核苷酸序列编码对于抗cd40、抗tlr
‑
2、抗tlr
‑
4和抗tlr
‑
5而言具有特异性的抗体可变结构域(vl和vh)。在一个实施例中,编码靶向单位的核苷酸序列编码对tlr
‑
5具有亲和力的鞭毛蛋白。优选地,靶向单位对选自ccr1、ccr3和ccr5的趋化因子受体具有亲和力。更优选地,编码靶向单位的核苷酸序列编码人趋化因子巨噬细胞炎性蛋白
‑
1α即hmip
‑
1α(ld78β),其与抗原呈递细胞(apc)的细胞表面上表达的其同源受体ccr1、ccr3和ccr5结合。参见例如图12,其包括编码具有本文鉴定的靶向单位的vb10.neo蛋白的核苷酸序列(参见,例如核苷酸1143
‑
1421)。
[0105]
如本文所用的术语“二聚化单位”是指抗原单位和靶向单位之间的氨基酸序列。因此,二聚化单位用于连接抗原单位和靶向单位,并促进两个单体多肽二聚化成二聚体蛋白。
此外,二聚化单位还提供多肽/二聚体蛋白的灵活性,以允许靶向单位与抗原呈递细胞(apc)上的表面分子的最佳结合,即使它们位于可变的距离。二聚化单位可以是满足这些要求的任何单位。
[0106]
术语“铰链区”是指二聚体蛋白的促进二聚化的肽序列。铰链区在单位之间起到柔性间隔区的作用,允许两个靶向单位同时与apc上的两个靶分子结合,即使它们以可变的距离表达。铰链区可以是ig来源的,如igg3来源的。铰链区可通过形成共价键(例如二硫键)而有助于二聚化。因此,在一个实施例中,铰链区具有形成一个或多个共价键的能力。共价键可以例如是二硫桥。
[0107]
在优选的实施例中,二聚化单位由通过第三接头与人igg3的ch3结构域连接的铰链外显子h1和h4组成。参见例如图12和其中鉴定的说明性二聚化单位(higg3的h1和h4及c
h
3结构域,核苷酸1422
‑
1853)。
[0108]
二聚化单位可以相对于抗原单位和靶向单位具有任何取向。在一个实施例中,抗原单位处于二聚化单位的cooh末端,而靶向单位处于二聚化单位的n末端。在另一个实施例中,抗原单位处于二聚化单位的n末端,而靶向单位处于二聚化单位的cooh末端。优选抗原单位处于二聚化单位的cooh末端。
[0109]
抗原单位和二聚化单位优选通过第一接头连接。第一接头可包含限制性位点以便促进多核苷酸的构建。在一些情况下,优选第一接头是glggl(seq id no:56)接头或glsgl(seq id no:66)接头。
[0110]
多核苷酸可以进一步包含编码信号肽的核苷酸序列。构建信号肽以允许在用多核苷酸转染的细胞中分泌由所述多核苷酸编码的多肽。可以使用任何合适的信号肽。合适的肽的实例是ig vh信号肽、人tpa信号肽和信号肽。
[0111]
关于多核苷酸序列,多核苷酸典型地包含双链或单链的dna核苷酸序列。优选地,将多核苷酸针对所需物种优化以表达多肽,即优选多核苷酸序列是人密码子优化的。
[0112]
支持性实施例中描述了包含vb10.neo pdna构建体vb4011和vb4061的基于新抗原的小鼠示例性dna癌症疫苗。另外,实例4中描述了示例性的基于人新抗原的dna癌症疫苗。图13中示出了说明性的pvb10.neo质粒图谱。
[0113]
疫苗可以进一步包含药学上可接受的载剂、稀释剂、佐剂或缓冲剂。药学上可接受的载剂、稀释剂和缓冲剂包括但不限于盐水、缓冲盐水、右旋糖、水、甘油、乙醇、无菌等渗水性缓冲剂及其组合。
[0114]
具体而言,对于包含多核苷酸的疫苗,载剂可以包括易于转染细胞的分子和佐剂,并且可以包括包含编码趋化因子或细胞因子的核苷酸序列的质粒以增强免疫应答。
[0115]
疫苗可配制成任何合适的配制品,诸如用于皮内或肌内注射的液体配制品。对于多肽/蛋白质疫苗或多核苷酸疫苗,可以以任何合适的方式施用疫苗,诸如通过皮内、肌内、皮下注射施用,或通过粘膜或上皮施加来施用,诸如鼻内、口服、肠内或向膀胱施用。当疫苗是多核苷酸疫苗时,优选肌内或皮内施用疫苗。在一些实施例中,通过结节内注射施用疫苗。如本文所用,术语“结节内注射”意指将疫苗注射到淋巴结中。t细胞扩增剂
[0116]
本文所述的治疗组合、方法等包括t细胞扩增剂。如上所述,t细胞扩增剂是有效刺激/扩增t细胞的产生的化合物或组合物。优选地,当与基于新抗原的dna癌症疫苗组合施用
时,t细胞扩增剂有效增强针对疫苗表位的特异性克隆t细胞扩增。优选地,t细胞扩增剂有效增强针对疫苗表位的特异性克隆t细胞扩增,超过在不存在t细胞扩增剂的情况下施用基于新抗原的dna癌症疫苗时达到的效果,增强程度高于相加作用,并且该组合不限于此。甚至更优选地,t细胞扩增剂有效地以协同方式增强针对疫苗表位的特异性克隆t细胞扩增,超过在不存在t细胞扩增剂的情况下施用基于新抗原的dna癌症疫苗时达到的效果。
[0117]
说明性t细胞扩增剂包括白介素
‑
2(例如阿地白介素)、白介素
‑
15和干扰素
‑
α,以及抗cd3抗体,例如okt3。在一个或多个特定实施例中,t细胞扩增剂是白介素
‑
2(例如阿地白介素,化学名称脱丙氨酰
‑
1、丝氨酸
‑
125人白介素
‑
2)的前药,其中该白介素
‑
2通过多个聚乙二醇部分的可释放共价附接而改性。在一些特定实施例中,前药在施用后基本上无活性,并且在施用后,聚乙二醇部分缓慢释放以提供生物活性物质,从而避免免疫系统的过度刺激。例如在美国专利号9,861,705中描述了通过共价附接一个或多个聚乙二醇部分而改性的白介素
‑
2部分的缀合物。
[0118]
在一个或多个特定的实施例中,t细胞扩增剂是白介素
‑
2受体β(il
‑
2rβ)选择性激动剂,如例如美国专利号10,101,587中所述,并且在本文中通常称为rslail
‑
2。
[0119]
rslail
‑
2中包含的可释放peg基于如下所示的2,7,9
‑
取代的芴,其中聚(乙二醇)链经由酰胺键联(芴
‑
c(o)
‑
nh~)从芴环上的2
‑
和7
‑
位置延伸,并且经由与经由亚甲基(
‑
ch2‑
)附接至芴环的9
‑
位置的氨基甲酸酯氮原子附接与白介素
‑
2具有可释放的共价附接。在这方面,在一些实施例中,t细胞扩增剂是包含下式所涵盖的化合物的组合物:t细胞扩增剂是包含下式所涵盖的化合物的组合物:其中il
‑
2是白介素
‑
2;或其药学上可接受的盐,其中每个“n”为约3至约4000的整数,或更优选为约200
‑
300的整数。前述组合物通常称为rslail
‑
2或多(2,7
‑
(双
‑
甲氧基peg
‑
甲酰胺)(9h
‑
芴
‑9‑
基)甲基n
‑
氨基甲酸酯)白介素
‑
2。关于前述式,rslail
‑
2是包含式(i)所涵盖的化合物的组合物,即具有如上所示的四、五或六个支化peg部分,即,可释放地共价附接至il
‑
2的氨基基团的2,7
‑
(双
‑
甲氧基peg
‑
甲酰胺)(9h
‑
芴
‑9‑
基)甲基n
‑
氨基甲酸酯部分。在某些优选的实施例中,每条聚乙二醇链中的“n”平均值为约227(即,从中心芴基核心延伸的每个聚乙二醇链的重均分子量为约10,000道尔顿,使得整个支链peg部分的重均分子量为约20,000道尔顿),即,本文中更具体地称为多(2,7
‑
(双
‑
甲氧基peg
10kd
‑
甲酰胺)(9h
‑
芴
‑9‑
基)甲基n
‑
氨基甲酸酯)白介素
‑
2或称为(2,7
‑
(双
‑
甲氧基peg
10kd
‑
甲酰胺)(9h
‑
芴
‑9‑
基)甲基n
‑
氨基甲酸酯)4‑6白介素
‑
2。在一个或多个实施例中,每条聚乙二醇链中的“n”值基本上相同,也就是说,例如,从中心芴基核延伸的两条peg链具有基本上相同的重均分子量。
[0120]
关于上述实施例,多(2,7
‑
(双
‑
甲氧基peg
‑
甲酰胺)(9h
‑
芴
‑9‑
基)甲基n
‑
氨基甲酸酯)白介素
‑
2包括下式所涵盖的化合物:
其中支化peg部分中所包含的每条聚乙烯链的平均分子量为约10,000道尔顿,使得每个支化peg部分的总分子量为约20,000道尔顿。
[0121]
关于其他相关实施例,多(2,7
‑
(双
‑
甲氧基peg
‑
甲酰胺)(9h
‑
芴
‑9‑
基)甲基n
‑
氨基甲酸酯)白介素
‑
2包括下式所涵盖的化合物:其中具有所示结构并可释放地共价附接至il
‑
2部分的支化peg部分的平均数目为6,即(2,7
‑
(双
‑
甲氧基peg
10kd
‑
甲酰胺)(9h
‑
芴
‑9‑
基)甲基n
‑
氨基甲酸酯)白介素
‑
2,在一些情况下也称为落入名称“rslail
‑
2”(可释放的il
‑
2)内。式(i)、(ii)和(iii)所涵盖的t细胞扩增剂化合物和组合物通常命名为“rslail
‑
2”。
[0122]
rslail
‑
2中所包含的可释放peg部分(多个部分)基于具有聚(乙二醇)链的2,7,9
‑
取代的芴,这些聚(乙二醇)链经由酰胺键联(芴
‑
c(o)
‑
nh~)从芴环的2
‑
位和7
‑
位延伸,以提供支化peg。基于芴基的支化peg部分可释放地共价附接到白介素
‑
2部分的氨基基团。白介素
‑
2氨基基团和基于芴基的支化peg部分之间的键联是通过亚甲基基团(
‑
ch2‑
)附接到芴环9位的氨基甲酸酯键联。具有这种一般结构的可释放peg典型地在生理条件下经历β
‑
消除反应,以缓慢释放与il
‑
2共价附接的peg部分。据信peg部分在给药后依次释放。
[0123]
在一个或多个实施例中,il
‑
2rβ偏向性激动剂组合物rslail
‑
2含有不超过10%(基于摩尔量)、并且优选地不超过5%(基于摩尔量)的由下式所涵盖的化合物:
其中il
‑
2是白介素
‑
2(例如,阿地白介素),并且“m”(指与il
‑
2附接的聚乙二醇部分的数目)是选自由1、2、3、7和>7组成的组的整数;或其药学上可接受的盐。
[0124]
在一些实施例中,例如,关于式(i)或式(ii),il
‑
2rβ偏向性激动剂平均具有约六个可释放地附接到il
‑
2的支化聚乙二醇部分。参见例如式(iii)。在一些其他特定实施例中,例如,关于式(i)、式(ii)、式(iii),il
‑
2rβ选择性激动剂通常被认为是无活性的前药,即,其在施用时无活性,并且在施用后凭借聚乙二醇部分在体内的缓慢释放提供附接有比初始施用的缀合物少的peg部分的白介素
‑
2的活性缀合形式。
[0125]
如本文提供的,提及“多(2,7
‑
(双
‑
甲氧基peg
‑
甲酰胺)(9h
‑
芴
‑9‑
基)甲基n
‑
氨基甲酸酯)白介素
‑
2”或“rslail
‑
2”明确地意在涵盖如式(i)、式(ii)和/或式(iii)中阐述的化合物和组合物,包括由式(iv)涵盖的关于式(i)、式(ii)和式(iii)中的任何一个或多个的组合物。
[0126]
如本文所述,将rslail
‑
2认为是il
‑
2rβ偏向性(即选择性)激动剂。例如,在所附实例中提及的rslail
‑
2表现出对il
‑
2rαβ的亲和力相对于il
‑
2降低约60倍,但对il
‑
2rβ的亲和力相对于il
‑
2仅降低约5倍。参见例如pct公开号wo 2018/132496中的实例20,其描述了rslail
‑
2对il
‑
2rα和il
‑
2rβ的结合亲和力。
[0127]
为了确定组合物(诸如上式中描述的)的平均聚乙二醇化程度,典型地通过诸如二辛可宁酸(bca)测定法等方法或通过uv分析来定量蛋白质,以确定样品中蛋白质的摩尔数。然后通过使样品暴露于释放peg部分的条件而释放peg部分,并且然后定量所释放的peg(例如,通过bca或uv)并与蛋白质摩尔数相关以确定平均聚乙二醇化程度。
[0128]
可以将rslail
‑
2认为是无活性的前药,即,其在施用时无活性,而是凭借聚乙二醇部分在体内的缓慢释放,提供有效地在肿瘤部位实现持续浓度的白介素
‑
2的活性缀合形式。
[0129]
rslail
‑
2的另外的示例性组合物包含根据上式的化合物,其中该分子的整个聚合物部分的重均分子量在约250道尔顿至约90,000道尔顿的范围内。其他合适的范围包括在以下范围的重均分子量:在选自约1,000道尔顿至约60,000道尔顿的范围内,在约5,000道尔顿至约60,000道尔顿的范围内,在约10,000道尔顿至约55,000道尔顿的范围内,在约15,000道尔顿至约50,000道尔顿的范围内,以及在约20,000道尔顿至约50,000道尔顿的范围内。
[0130]
聚乙二醇聚合物部分的其他说明性重均分子量包括约200道尔顿、约300道尔顿、约400道尔顿、约500道尔顿、约600道尔顿、约700道尔顿、约750道尔顿、约800道尔顿、约900道尔顿、约1,000道尔顿、约1,500道尔顿、约2,000道尔顿、约2,200道尔顿、约2,500道尔顿、约3,000道尔顿、约4,000道尔顿、约4,400道尔顿、约4,500道尔顿、约5,000道尔顿、约5,500道尔顿、约6,000道尔顿、约7,000道尔顿、约7,500道尔顿、约8,000道尔顿、约9,000道尔顿、约10,000道尔顿、约11,000道尔顿、约12,000道尔顿、约13,000道尔顿、约14,000道尔顿、约15,000道尔顿、约20,000道尔顿、约22,500道尔顿、约25,000道尔顿、约30,000道尔顿、约35,000道尔顿、约40,000道尔顿、约45,000道尔顿、约50,000道尔顿、约55,000道尔顿、约60,000道尔顿、约65,000道尔顿、约70,000道尔顿和约75,000道尔顿。在一些实施例中,支化聚乙二醇聚合物的重均分子量为约20,000道尔顿。
[0131]
如上所述,rslail
‑
2可以呈药学上可接受的盐的形式。典型地,此类盐通过与药学
上可接受的酸或酸等效物反应而形成。术语“药学上可接受的盐”在此方面通常将是指相对无毒的无机和有机酸加成盐。这些盐可以在施用媒介物或剂型制造过程中原位制备,或通过将如本文描述的长效白介素
‑
2与适合的有机酸或无机酸分别反应并分离因此形成的盐来制备。代表性盐包括氢溴酸盐、盐酸盐、硫酸盐、硫酸氢盐、磷酸盐、硝酸盐、乙酸盐、戊酸盐、油酸盐、棕榈酸盐、硬脂酸盐、月桂酸盐、苯甲酸盐、乳酸盐、磷酸盐、甲苯磺酸盐、柠檬酸盐、马来酸盐、富马酸盐、琥珀酸盐、酒石酸盐、萘酸盐(napthylate)、草酸盐、甲磺酸盐、葡庚糖酸盐、乳糖醛酸盐、和月桂基磺酸盐等。(参见,例如berge等人(1977)"pharmaceutical salts"[药用盐],j.pharm.sci.[药物科学杂志]66:1
‑
19)。因此,如所描述的盐可以衍生自无机酸,这些无机酸诸如盐酸、氢溴酸、硫酸、氨基磺酸、磷酸、硝酸等;或由有机酸制备,这些有机酸诸如乙酸、丙酸、琥珀酸、乙醇酸、硬脂酸、乳酸、苹果酸、酒石酸、柠檬酸、抗坏血酸、棕榈酸、马来酸、羟基马来酸、苯基乙酸、谷氨酸、苯甲酸、水杨酸、磺胺酸、2
‑
乙酰氧基苯甲酸、富马酸、甲苯磺酸、甲烷磺酸、乙烷二磺酸、草酸、衣康酸等。
[0132]
关于rslail
‑
2,如本文所用的术语“il
‑
2”是指具有人il
‑
2活性的部分。在il
‑
2残基的背景下,术语
‘
残基’意指il
‑
2分子在一个或多个共价附接位点处共价附接至聚合物(如聚乙二醇)之后保留的部分,如以上式中所示。应理解的是,当未修饰的il
‑
2附接至聚合物(如聚乙二醇)时,由于存在与这种或这些聚合物的键联相关的一个或多个共价键而使il
‑
2轻微改变。有时将这种附接至另一个分子的il
‑
2的轻微改变形式称为il
‑
2的“残基”。
[0133]
具有对应于国际专利公开号wo 2012/065086中描述的seq id no:1至4中任一者的氨基酸序列的蛋白质是示例性il
‑
2蛋白。术语基本上同源意指特定主题序列(例如突变序列)因一个或多个取代、缺失或添加而不同于参考序列,其净效应不导致在该参考序列与主题序列之间不利的官能差异。出于本文的目的,具有大于95%的同源性、等效的生物活性(不过不必需是等效强度的生物活性)、以及等效的表达特征的序列被认为是基本上同源的。出于确定同源性的目的,应当忽略成熟序列的截短。il
‑
2可以是天然存在的或者可以是重组产生的。另外,il
‑
2可以来源于人类来源、动物来源以及植物来源。最优选地,il
‑
2是阿地白介素。
[0134]
rslail
‑
2通常被称为是长效的。出于本文的目的,il
‑
2rβ偏向性激动剂的长效性质典型地使用流式细胞术来测定以测量在给予有待在小鼠中评估的激动剂之后的不同时间点在淋巴细胞中的stat5磷酸化。作为参考,在il
‑
2的情况下信号丢失约24小时,但是持续时间段大于长效il
‑
2rβ偏向性激动剂的时间段。作为说明,对于(2,7
‑
(双
‑
甲氧基peg
10kd
‑
甲酰胺)(9h
‑
芴
‑9‑
基)甲基n
‑
氨基甲酸酯)
6avg
白介素
‑
2,信号持续几天。
[0135]
rslail
‑
2具有免疫调节特性
‑
在肿瘤环境中,rslail
‑
2通过靶向在抗癌细胞表面上发现的cd122受体,优先于阻抑调节性t细胞(treg),诸如cd4 treg来激活cd8 效应t细胞和天然杀伤(nk)细胞。参见例如pct公开号wo 2018/132496中的实例20,其还描述了rslail
‑
2的某些免疫治疗特性。尤其是,rslail
‑
2还诱导cd4 t细胞激活并促进外周血中cd4 细胞、cd8 细胞和nk细胞的增殖。因此,由于rslail
‑
2优先于treg有效地激活和扩增效应cd8 t细胞和nk细胞,因此适合用作本文所述的t细胞扩增剂。
[0136]
根据本文所述的方法、组合物和组合,rlsail
‑
2以il
‑
2rβ激活量提供,从而产生t细胞扩增活性。本领域的普通技术人员可以确定多少rslail
‑
2足以提供针对il
‑
2rβ的临床相关激动活性。
[0137]
然而,在一个或多个示例中,rslail
‑
2的il
‑
2rβ激活量是以蛋白质的量表示的由以下范围中的一个或多个所涵盖的量:约0.01至100mg/kg;约0.01mg/kg至约75mg/kg;约0.02mg/kg至约60mg/kg;约0.03mg/kg至约50mg/kg;约0.05mg/kg至约40mg/kg;约0.05mg/kg至约30mg/kg;约0.05mg/kg至约25mg/kg;约0.05mg/kg至约15mg/kg;约0.05mg/kg至约10mg/kg;约0.05mg/kg至约5mg/kg;约0.05mg/kg至约1mg/kg。特定的说明性给药范围包括例如约0.1mg/kg至约10mg/kg、或约0.2mg/kg至约7mg/kg、或约0.2mg/kg至小于约0.7mg/kg。
[0138]
在一些优选的实施例中,rslail
‑
2的il
‑
2rβ激活量为约0.0005至0.3mg/kg;约0.001mg/kg至约0.3mg/kg;约0.001mg/kg至约0.25mg/kg;约0.001mg/kg至约0.15mg/kg;约0.001mg/kg至约0.05mg/kg;约0.001mg/kg至约0.01mg/kg;约0.001mg/kg至约0.008mg/kg;约0.001mg/kg至约0.005mg/kg;约0.002mg/kg至约0.005mg/kg;约0.002mg/kg至约0.004mg/kg,或约0.003mg/kg至约0.006mg/kg。在一些特定的实施例中,以约0.006mg/kg的剂量施用rslail
‑
2。
[0139]
为了确认,关于rslail
‑
2,当与施用基于新抗原的dna癌症疫苗,任选地与检查点抑制剂诸如抗pd
‑
1抗体相结合时,激活的量和程度可以广泛变化并且仍然有效,以有效地驱动新表位特异性t细胞的扩增。检查点抑制剂
[0140]
组合疗法还可以包括施用另外的免疫治疗剂,诸如检查点抑制剂。适合在本文提供的方法中使用的检查点抑制剂包括靶向pd
‑
1、pd
‑
l1或ctla
‑
4的抗体,诸如单克隆抗体。在如本文所提供的某些治疗组合中,检查点抑制剂是抗pd
‑
1抗体或抗pd
‑
l1抗体。例如,示例性pd
‑
1抑制剂包括但不限于派姆单抗(pembrolizumab)、纳武单抗(nivolumab)和西米普利单抗(cemiplimab)。代表性的pd
‑
l1抑制剂包括例如阿特珠单抗(atezolizumab)、阿维单抗(avelumab)和度伐利尤单抗(durvalumab)。
[0141]
替代性地,伊匹单抗(ipilimumab)或替西木单抗(tremelimumab),抗ctla
‑
4单克隆抗体,也可用于治疗方法中。两者分别是igg1和igg2的全人源化抗ctla
‑
4单克隆抗体。
[0142]
作为实例,可以施用pd
‑
1途径抑制量的抗pd
‑
1抗体诸如纳武单抗。本领域的普通技术人员可以确定多少抗pd
‑
1抗体(诸如纳武单抗)或抗pd
‑
l1抗体分别足以提供pd
‑
1途径或pd
‑
l1途径的临床相关抑制。例如,本领域的普通技术人员可以参考文献和/或施用一系列增加量的纳武单抗或另一种抗pd
‑
1抗体或抗pd
‑
l1抗体以确定哪个或哪些量提供pd
‑
1途径或pd
‑
l1途径的临床相关抑制。类似地,可以施用ctla
‑
4途径抑制量的抗ctla
‑
4抗体。
[0143]
然而,在一个或多个示例中,抗pd
‑
1抗体(例如纳武单抗)或抗pd
‑
l1抗体的pd
‑
1途径抑制量由以下范围中的一个或多个涵盖:约1mg/kg至约1000mg/kg;约2mg/kg至约900mg/kg;约3mg/kg至约800mg/kg;约4mg/kg至约700mg/kg;约5mg/kg至约600mg/kg;约6mg/kg至约550mg/kg;约7mg/kg至约500mg/kg;约8mg/kg至约450mg/kg;约9mg/kg至约400mg/kg;约5mg/kg至约200mg/kg;约2mg/kg至约150mg/kg;约5mg/kg至约100mg/kg;约10mg/kg至约100mg/kg;以及从约10mg/kg至约60mg/kg。可以基于癌症疗法中施用免疫检查点抑制剂的现行护理标准提供进一步的指导。治疗
[0144]
为了确认,如本文所用,关于抗pd
‑
1抗体诸如纳武单抗或其他合适的检查点抑制
剂的pd
‑
1途径抑制量,抑制的量和程度可广泛变化且甚至当与施用t细胞扩增剂和基于新抗原的dna癌症疫苗组合时仍可有效。例如,仅最低限度地抑制pd
‑
1途径的抗pd
‑
1抗体即纳武单抗的量仍然可以是如本文所用的抑制量,只要该方法产生临床上有意义的应答。对于每种免疫治疗组分而言,待施用的实际剂量将根据受试者的年龄、体重和一般状况,以及所治疗的癌症的严重程度、健康专家的判断以及每种免疫治疗组分的具体性质和特性而变化。
[0145]
在组合疗法的某些实施例中,受试者已经接受了一种、两种、三种、四种、五种或更多种先前的癌症治疗。在其他实施例中,受试者是未经治疗的。在一些实施例中,受试者已经进行了其他癌症治疗。在某些实施例中,先前的癌症治疗包括免疫疗法。在其他实施例中,先前的癌症治疗包括化疗。在一些实施例中,肿瘤已经复发。在一些实施例中,肿瘤是转移性的。在其他实施例中,肿瘤不是转移性的。
[0146]
在一些实施例中,受试者已经接受了治疗肿瘤的先前疗法并且肿瘤是复发性或难治性的。在一些实施例中,受试者已经接受了治疗肿瘤的先前免疫肿瘤学疗法并且肿瘤是复发性或难治性的。在一些实施例中,受试者已经接受了一种以上治疗肿瘤的先前疗法并且肿瘤是复发性或难治性的。
[0147]
在一些治疗方式中,首先施用基于新抗原的dna癌症疫苗以在受试者中产生新抗原特异性免疫应答,接着一次或多次后续施用基于新抗原的dna癌症疫苗(诱导期)。基于新抗原的dna癌症疫苗的后续施用可以在第一次施用后1周、2周、3周或4周或更长时间内施用。
[0148]
本文描述的治疗方法可以持续长达监督患者护理的临床医生认为该治疗方法有效的时间。指示该治疗方法有效的非限制性参数包括以下中的任何一个或多个:肿瘤缩小(就重量和/或体积而言);个体肿瘤集落的数量减少;肿瘤消除;以及无进展存活期。肿瘤大小的变化可以通过任何合适的方法如成像来确定。可以采用各种诊断成像方式,如计算机断层摄影术(ct扫描)、双能cdt、正电子发射断层摄影术和mri。
[0149]
关于任选地与检查点抑制剂组合施用基于新抗原的dna癌症疫苗和t细胞扩增剂的频率和计划,本领域的普通技术人员将能够确定该组合的每种组分的适当频率。例如,在治疗周期中,临床医生可以决定以单剂量或一系列剂量(例如,在数天或数周的过程内)施用基于新抗原的dna癌症疫苗。与基于新抗原的dna癌症疫苗同时,在疫苗接种之前,或在施用癌症疫苗之后施用t细胞扩增剂。优选地,并且在一些治疗方式中,在疫苗接种诱导期后施用t细胞扩增剂,例如rslail
‑
2。基于说明性t细胞扩增剂rslail
‑
2的长效性质,此类组合物可以相对不频繁地施用(例如,每四周一次、每三周一次、每两周一次、每8
‑
10天一次、每周一次等)。
[0150]
在优选的给药方案中,将新表位特异性的基于dna的癌症疫苗和t细胞扩增剂的给药计划为调准或基本上调准两种治疗剂的峰值t细胞应答,从而实现优化的(优选协同的)应答。
[0151]
例如,在一个或多个实施例中,t细胞扩增剂诸如rslail
‑
2的初始施用是在新表位特异性的基于dna的癌症疫苗的一次或多次施用之后,并且优选以这样的方式,其中由于每种免疫治疗剂的施用而引起的峰值t细胞应答基本上匹配,特别是在初始或早期多轮疫苗接种和/或施用t细胞扩增剂之后。
[0152]
在一些实施例中,治疗方案包括筛选和制造针对肿瘤特异性新抗原的基于新抗原的治疗性dna癌症疫苗的时间段,施用抗癌疫苗的疫苗接种诱导期,和施用t细胞扩增剂的疫苗接种维持期。在疫苗接种维持期间,抗癌疫苗优选与t细胞扩增剂同时或分开施用一次或多次。在施用前,可以通过本领域已知的任何手段制备抗癌疫苗。在一些实施例中,针对肿瘤特异性新抗原的抗癌疫苗通过以下方式制备:对肿瘤的基因组或外显子组测序;鉴定包含来自肿瘤的新表位的肿瘤新抗原;并基于预测的抗原性选择新表位。在美国专利公开号2019/0022202中描述了制备此类抗癌疫苗的示例性方法,该制备方法通过援引并入本文。在筛选肿瘤和制造抗癌疫苗后,例如约12
‑
16周,更优选约6
‑
10周,或6
‑
8周,根据提供抗癌疫苗和t细胞扩增剂之一或两者的峰值应答的给药计划或方案施用针对肿瘤特异性新抗原的基于新抗原的dna癌症疫苗和/或t细胞剂。基于新抗原的dna癌症疫苗最初可以作为疫苗接种诱导施用一段时间(例如4
‑
8周或更长时间)。在诱导期期间,患者可以用基于新抗原的dna癌症疫苗接种一次或多次。在诱导期后,在施用或不施用另外抗癌疫苗的或维持抗癌疫苗的情况下,施用t细胞扩增剂一次或多次。t细胞扩增剂和/或基于新抗原的dna癌症疫苗可以根据治疗需要施用一段时间(例如1
‑
12个月或更长时间)。下面提供了用于治疗的示例性施用计划:
[0153]
表1.示例性施用计划
[0154]
与治疗过程相关的示例性时间长度包括约一周;约两周;约三周;约四周;约五周;约六周;约七周;约八周;约九周;约十周;约十一周;约十二周;约十三周;约十四周;约十五周;约十六周;约十七周;约十八周;约十九周;约二十周;约二十一周;约二十二周;约二十三周;约二十四周;约七个月;约八个月;约九个月;约十个月;约十一个月;约十二个月;约十三个月;约十四个月;约十五个月;约十六个月;约十七个月;约十八个月;约十九个月;约二十个月;约二十一个月;约二十二个月;约二十三个月;约二十四个月;约三十个月;约三年;约四年以及约五年。
[0155]
本文描述的治疗方法典型地持续长达监督患者护理的临床医生认为该治疗方法有效(即该患者对治疗有应答,包括疾病(例如,癌症)没有进一步进展)的时间。指示该治疗方法有效的非限制性参数可以包括以下中的一个或多个:肿瘤缩小(就重量和/或体积和/或视觉外观而言);个体肿瘤集落的数量减少;肿瘤消除;无进展存活期;通过合适的肿瘤标志物(如果适用)的适当应答、nk(自然杀伤)细胞的数量增加、t细胞的数量增加、记忆t细胞的数量增加、中心记忆t细胞的数量增加、调节性t细胞(诸如cd4 treg、cd25 treg和foxp3 treg)的数量减少等。
[0156]
本文提供的方法(尤其)可用于治疗患有癌症的患者。例如,患者可对单独的基于新抗原的dna以及对与t细胞扩增剂,任选地与检查点抑制剂(cpi)的组合有应答,但对组合的施用应答性更强。通过另一个实例,患者可对基于新抗原的dna癌症疫苗,或t细胞扩增
剂,或检查点抑制剂无应答或仅少量应答,但对该组合的应答更强。再通过另一个实例,患者可对基于新抗原的dna癌症疫苗,或对t细胞扩增剂,或对检查点抑制剂无应答,但对该组合有应答。
[0157]
施用例如基于新抗原的dna癌症疫苗和/或t细胞扩增剂(例如,rslail
‑
2)和/或检查点抑制剂典型地经由注射进行。还涵盖其他施用方式,诸如经肺、经鼻、经颊、经直肠、舌下和经皮施用。如本文所使用,术语“肠胃外”包括皮下、静脉内、动脉内、瘤内、淋巴管内、腹膜内、心脏内、鞘内和肌肉内注射,以及输注注射。
[0158]
当前描述的方法、组合和组合物等可以用于治疗患有可以通过本文提供的方法医治或预防的任何病状诸如癌症的患者。示例性的病状是癌症,如例如纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、成骨肉瘤、脊索瘤、血管肉瘤、内皮肉瘤、淋巴管肉瘤、淋巴管内皮肉瘤、滑膜瘤、间皮瘤、尤因氏瘤、平滑肌肉瘤、横纹肌肉瘤、结肠癌、胰腺癌、脑癌、乳腺癌、卵巢癌、前列腺癌、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌、支气管癌、肾细胞癌、肝癌、胆管癌、绒毛膜癌、精原细胞瘤、胚胎性癌、维尔姆斯氏肿瘤、宫颈癌、霍奇金淋巴瘤、非霍奇金淋巴瘤、睾丸癌、肺癌、小细胞肺癌、脑癌、膀胱癌、上皮癌、胶质瘤、星形细胞瘤、成神经管细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、成血管细胞瘤、听神经瘤、少突神经胶质瘤、脑膜瘤、黑素瘤、多发性骨髓瘤、成神经细胞瘤、成视网膜细胞瘤、以及白血病。
[0159]
在一些特定实施例中,有待治疗的癌症是实体癌,如例如乳腺癌、卵巢癌、结肠癌、前列腺癌、骨癌、结肠直肠癌、胃癌、淋巴瘤、恶性黑素瘤、肝癌、小细胞肺癌、非小细胞肺癌、胰腺癌、甲状腺癌、肾癌、胆管癌、脑癌、宫颈癌、上颌窦癌、膀胱癌、食管癌、霍奇金病和肾上腺皮质癌。
[0160]
本发明的方法、组合和组合物可用于例如通过改善受试者对基于新抗原的dna癌症疫苗组合物的免疫应答而增强基于新抗原的dna癌症疫苗的治疗有效性。可以在治疗期间、单轮治疗之后、2
‑
3个治疗周期之后等的任何合适的时间点并且通过多种合适方法中的任一种来评估增强的应答,包括肿瘤的缩小(部分应答)(即肿瘤大小或体积的评估)、肿瘤的消失、疾病进展的减少(癌症未进展)以及在适当时一种或多种肿瘤测试标志物的分析。本文提供的方法、试剂盒、组合物等也可用于减少经历治疗的受试者的肿瘤生长或大小(或体积)。在一个或多个实施例中,通过施用如本文所述的治疗组合的治疗有效减少受试者中的肿瘤生长或大小。例如,在一些实施例中,当与治疗前肿瘤的尺寸比较时,一个或多个治疗周期有效于使肿瘤尺寸减少约25%、或约30%、或约40%、或约50%、或甚至约60%、或约70%或更多。
[0161]
在又一些其他实施例中,本文提供的方法、组合物等有效抑制经历癌症治疗的受试者中调节性t细胞(treg)的积聚。在又一些其他实施例中,本文提供的方法、组合物等有效刺激受试者中的t细胞和/或nk细胞活性和/或增殖。在一些实施例中,该方法是有效的,例如,当在相应癌症的癌症小鼠模型中评价时,与单独用基于新抗原的dna癌症疫苗接种相比,增加受试者中cd8 t细胞和/或cd4 t细胞的数目是有效的。例如,当与单独用基于新抗原的dna癌症疫苗治疗相比时,受试者的cd8 t细胞可增加2倍或更多,或3倍或更多,或甚至4倍或更多。在一些实施例中,当与未治疗的受试者相比时,该治疗可以有效地使受试者的针对新抗原的cd8 t细胞或cd4 t细胞增加至少2倍或更多、或3倍或更多、或甚至4倍或更
多、或5倍或更多、或6倍或更多。
[0162]
转到实例,支持性临床前研究提供了当伴随施用示例性t细胞扩增剂rslail
‑
2和任选的检查点抑制剂时由于施用基于新抗原的dna癌症疫苗引起的协同效应的指示。
[0163]
如实例1所示,发现当在小鼠的临床前黑素瘤模型中进行评价时,与针对来自肿瘤新抗原的多个新表位的示例性个性化抗癌dna疫苗(例如,vb4011)组合施用示例性t细胞扩增剂rslail
‑
2不仅可有效增加新表位特异性t细胞的频率,而且可有效增加新表位特异性t细胞的总数。
[0164]
因此,用治疗性新表位特异性的基于dna的癌症疫苗接种可有效诱导新表位特异性t细胞应答,然后通过施用t细胞扩增剂诸如rslail
‑
2进一步扩增新表位特异性t细胞应答,该t细胞扩增剂有效地非特异性地进一步扩增现有的t细胞群。通过调准或基本上调准两种治疗剂(即,新表位特异性的基于dna的癌症疫苗和t细胞扩增剂)的峰值t细胞应答,可以实现优化的(优选协同的)应答。参见,例如,图5a和图5b中所示的结果,其基于该临床前癌症模型支持下述方法作为优选方法,t细胞扩增剂诸如rslail
‑
2的施用在新表位特异性的基于dna的癌症疫苗的一次或多次施用之后,并且优选以这样的方式,其中由于每种免疫治疗剂的施用而引起的峰值t细胞应答基本上匹配,特别是在初始或早期多轮疫苗接种和/或施用t细胞扩增剂之后。例如,在双联体组合中,并且仅基于疫苗的单次初始施用,当t细胞扩增剂rslail
‑
2的施用发生在疫苗施用后11天时,观察到最佳应答。因此,这些结果表明,通过基于施用后每种治疗剂的峰值t细胞应答对每种治疗剂的给药进行策略性调准,可以实现优化应答。如图5b所示,相对于施用第二剂的新表位特异性的基于dna的癌症疫苗的时间,施用t细胞扩增剂rslail
‑
2的时间影响t细胞应答。也就是说,如图5b所示,在施用第二剂疫苗后的一段时间处(在这种情况下,是3天后)施用rslail
‑
2,引起特异性t细胞应答的显著增强。
[0165]
图5c提供了在示例性疫苗接种计划的不同阶段施用rslail
‑
2的结果,例如在同一天施用第3剂疫苗和rslail
‑
2,以及施用第3剂疫苗并延迟施用rslail
‑
2。如果两次或更多次疫苗接种,则rslail
‑
2施用延迟3天;在单次疫苗接种的情况下,rslail
‑
2的施用延迟7天、11天或14天。基于该临床前b16模型中的这些结果,似乎t细胞扩增剂rslail
‑
2与第二剂基于新抗原的dna癌症疫苗的施用适度地协同加强特异性t细胞应答,并且在该相同模型中,rslail
‑
2与第3剂疫苗的施用似乎以相似的程度协同地影响特异性t细胞应答,无论是在同一天施用还是延迟。基于这些结果,似乎可优选在新表位特异性的基于dna的癌症疫苗诱导期后(例如,在多于一次的疫苗接种后,例如在2次或3次或4次或更多次疫苗接种后)施用t细胞扩增剂诸如rslail
‑
2,从而协同加强或至少最大化特异性t细胞应答,优选降低对施用t细胞扩增剂的时间的敏感性。
[0166]
如实例2中所述,还进行了研究以调查t细胞扩增剂即(2,7
‑
(双
‑
甲氧基peg
10kd
‑
甲酰胺)(9h
‑
芴
‑9‑
基)甲基n
‑
氨基甲酸酯)
6avg
白介素
‑
2(“rlsail
‑
2”)当在结肠癌ct 26小鼠肿瘤模型中进行的疫苗接种研究中与示例性的基于dna的免疫治疗性新抗原疫苗vb10.neo组合施用时是否可以加强新表位特异性ifn
‑
γt细胞应答,并且评价任何增强的新表位特异性t细胞应答的程度。这些数据清楚地证明并且在另一个不同的临床前小鼠模型中证实,rslail
‑
2在接种vb4061的小鼠中强烈地协同加强新表位特异性ifn
‑
γt细胞应答,因此进一步验证了本文提供的方法,其通过借助于施用基于dna的个性化新抗原疫苗与t细胞增强
剂诸如rslail
‑
2的组合而引起强烈的、新抗原聚焦的免疫应答,从而改善患者的临床结果。更具体地,当在结肠癌ct 26小鼠肿瘤模型中评价时,示例性的新表位癌症疫苗vb10.neo和t细胞扩增剂rslail
‑
2的组合显著协同加强新表位特异性t细胞应答,导致新表位特异性t细胞应答的量与vb10.neo单一疗法相比增加多达5倍。而且,在这些实验中,为小鼠注射肿瘤细胞以模拟荷瘤临床环境。观察到vb4061 rslail
‑
2的组合有效增加新表位特异性t细胞应答的广度(更多的新表位)和深度(对每种新表位更强的应答)。
[0167]
在实例3中进一步证明了组合疗法的意外优点,该实例探索了在ct26肿瘤模型中,t细胞扩增剂rslail
‑
2是否可以增加接种了vb4061和抗pd
‑
1抗体的小鼠(作为用检查点抑制剂进一步联合施用基于新抗原的个性化dna癌症疫苗进行癌症治疗的受试者的例证)中的肿瘤保护性免疫应答。单独用vb4061治疗和与抗pd
‑
1组合治疗诱导肿瘤保护性应答(数据未示出)。然而,在实例3所述的研究中,证实疫苗接种可诱导肿瘤保护性免疫应答(图4a
‑
4d)。而且,结果进一步说明,当与t细胞扩增剂rslail
‑
2组合施用时,接种vb4061和抗pd
‑
1的小鼠中的肿瘤保护被进一步且显著地加强。在三联疗法vb4061 抗pd
‑
1抗体 rslail
‑
2治疗组中观察到肿瘤生长减少,其中50%的三联治疗小鼠保持无肿瘤并且从未建立肿瘤。相比之下,仅20%接受vb4061 抗pd
‑
1抗体而无rslail
‑
2的小鼠(图4b)受到保护。在两个治疗分组中,观察到建立的肿瘤的肿瘤消退,并且在vb4061 抗pd
‑
1和vb4061 抗pd
‑
1 rslail
‑
2治疗组的总存活率分别为70%和80%(图4c)。在再次激发实验中,两个治疗组都对致死剂量的ct26细胞具有完全的保护作用,并且两组在肿瘤生长和总存活率方面与对照组均有统计学差异。
[0168]
如在接种了vb4061 抗pd1的小鼠中观察到的肿瘤保护作用,当与t细胞扩增剂即rslail
‑
2组合时进一步强化。这些结果证明这些独特且非重叠的机制的整合可用于产生对已建立肿瘤的有效治疗。在用致死剂量的肿瘤细胞再次激发的小鼠中,两个治疗组都受到完全保护,证明该疗法诱导长效的肿瘤保护性记忆免疫应答。
[0169]
未治疗的小鼠(对照)和用vb4061 抗pd
‑
1 rslail
‑
2治疗的小鼠组的肿瘤长度通过使用电子卡尺测量肿瘤长度大小(mm)来进一步定期监测。在该研究中,证实在ct26结肠癌小鼠模型中疫苗接种可以诱导肿瘤消退和稳定(图7a
‑
7b)。该实验的结果说明,当与rslail
‑
2组合施用时,接种了vb4061和抗pd
‑
1的小鼠中的肿瘤保护作用得以进一步加强。如图7b所示,用vb4061和检查点抑制剂抗pd
‑
1为小鼠接种并联合施用rslail
‑
2在具有相对较小肿瘤(例如小于约5
‑
6mm的肿瘤)的小鼠中引起快速、完全且持久的肿瘤消退,以及较大肿瘤(例如大于约5
‑
6mm且甚至大于约10mm的肿瘤)的持久稳定。
[0170]
本文援引的所有论文、书籍、专利、专利公开和其他出版物都明确地通过援引以其全文并入本文。在本说明书的传授内容与通过援引并入的技术之间不一致的情况下,以本说明书中的传授内容和定义的含义为准(特别是关于在本文所附的权利要求中使用的术语)。例如,如果本技术和通过援引并入的出版物以不同方式定义了同一术语,则将该术语的定义保留在该定义所处文件的传授内容内。实例
[0171]
应理解,前述描述以及随后的实例旨在说明而不是限制本文提供的本发明的范围。本发明范围内的其他方面、优点和修改对本发明所属领域的技术人员而言将是显而易见的。
材料与方法
[0172]
(2,7
‑
(双
‑
甲氧基peg
10kd
‑
甲酰胺)(9h
‑
芴
‑9‑
基)甲基n
‑
氨基甲酸酯)
6avg
白介素
‑
2:克隆并表达具有与阿地白介素(脱丙氨酰
‑
1,丝氨酸
‑
125人白介素
‑
2)相同的氨基酸序列的重组人il
‑
2,并将其用于制备示例性的t细胞扩增剂(2,7
‑
(双
‑
甲氧基peg
10kd
‑
甲酰胺)(9h
‑
芴
‑9‑
基)甲基n
‑
氨基甲酸酯)
6avg
白介素
‑
2(cas号1939126
‑
74
‑
5),也称为bempegaldesleukin,或更一般地在这些实例中称为“rslail
‑
2”。(2,7
‑
(双
‑
甲氧基peg
10kd
‑
甲酰胺)(9h
‑
芴
‑9‑
基)甲基n
‑
氨基甲酸酯)
6avg
白介素
‑
2的制备例如在wo 2018/132496(实例19)中有描述;实例20描述了该分子的受体偏向/选择性。对于临床前研究,将rslail
‑
2在稀释缓冲液中稀释到0.1mg/ml的浓度,并基于小鼠的肿瘤确定体积以达到0.8mg/kg的最终剂量,并注射到小鼠的尾静脉中。对于临床研究,以无菌的白色至黄色冻干粉形式提供rslail
‑
2用于复溶,如实例4所述。
[0173]
vb10.neo(用于临床前研究的基于新抗原的治疗性dna疫苗)。在下述临床前研究中,对照质粒vb1026和两种vb10.neo pdna构建体即vb4011和vb4061,用作示例性的基于新抗原的dna抗癌疫苗。如下表2所述,pdna构建体vb4011和vb4061分别编码来自b16的10个新表位和来自ct26的20个新表位。小鼠的疫苗接种与电穿孔组合进行。图13中示出了pvb10.neo质粒的不同功能元件。
[0174]
抗pd
‑
1抗体(临床前实验):invivomab抗小鼠pd
‑
1,克隆rmp1
‑
14。目录号:be0146(bio x)。
[0175]
表2.vb10.neo pdna质粒描述pdna质粒描述
[0176]
vb4011的氨基酸序列对应于seq id no:1(图1)。vb4061的氨基酸序列对应于seq id no:2(图8)。vb4061小鼠构建体中包含的20种新表位的列表示于图9并且对应于seq id no:3
‑
22。vb4011构建体中包含的10种单独新表位的列表示于图10并且对应于seq id no:23
‑
32。在美国专利公开号2019/0022202中描述了以上示例性疫苗体疫苗的构建和表达方法,其内容明确地以其全文并入本文。
[0177]
脾脏的收获、脾细胞的分离以及cd4
±
或cd8
±
t细胞耗竭型脾细胞:处死小鼠,并无菌收获脾脏。将来自单独小鼠的脾脏通过70μm组织过滤器进行筛选以分离单个脾细胞。将脾细胞在重悬于1xack缓冲液中的培养基中洗涤一次以溶解红细胞。洗涤后,将细胞重悬于培养基中并计数。为了耗竭cd4 或cd8 脾细胞,根据制造商的说明使用小鼠cd4(l3t4)或小鼠cd8(lyt2)。
[0178]
ifn
‑
γelispot测定法:简言之,将脾细胞、cd4 或cd8 t细胞耗竭型脾细胞重悬至6
×
105个细胞的细胞浓度。将细胞一式三份平板接种(如果细胞数目有限,则使用一式两份)并用2μg/ml对应于疫苗接种期间使用的原始vb10.neo构建体(表2)中的新表位的单独肽再刺激24小时。用ifn
‑
γelispot plus试剂盒(瑞典迈博太科公司(mabtech ab,sweden))分析免疫原性。在来自细胞技术公司(cellular technology)的ctl elispot读数器immunospot 5.0.3中对斑点形成单位(spu)计数。结果示为ifn
‑
γ 斑点数/106个脾细胞或ifn
‑
γ 斑点/个脾脏。
[0179]
用ct26结肠癌细胞系进行的皮下肿瘤激发:简言之,将ct26肿瘤细胞(#crl
‑
2638,atcc)在具有培养基(rpmi 1640,10mm hepes、1mm丙酮酸钠、1%非必需氨基酸溶液、1%青霉素/链霉素、10%fbs)的瓶中培养。注射前,将细胞在1x pbs中洗涤两次,同时仍粘附于烧瓶上,然后用胰蛋白酶处理,洗涤并重悬于1xpbs中达到5
×
105个细胞/ml的最终浓度。在左大腿为balb/cjrj小鼠皮下注射100μl的5
×
104个ct26细胞。
[0180]
vb10.neo(用于临床研究的基于新抗原的治疗性dna疫苗)。个性化新抗原疫苗pvb10.neo是6297
‑
7407个碱基对的非复制、非整合、遗传稳定和非致病性的裸露的、共价闭合、环状和超螺旋的双链脱氧核糖核酸(dna)质粒,这取决于个性化人类疫苗中所包含的新表位的数目。dna质粒基于pumvc4a载体主链,其编码包括三个模块的单一重组同型二聚体蛋白:靶向模块、二聚化模块和新表位抗原模块。靶向模块编码与抗原呈递细胞(apc)的细胞表面上的其同源受体结合的人趋化因子巨噬细胞炎性蛋白
‑
1α(hmip
‑
1α),而二聚化模块编码来自人igg3的上铰链区和下铰链区以及重链3(c
h
3)恒定结构域。下铰链区通过二硫桥连接两个疫苗体单体,而c
h
3结构域通过疏水相互作用促进二聚化。上铰链区促进靶向模块与其同源受体的柔性二价结合,从而增强疫苗的免疫原性。
[0181]
新表位抗原模块由多个(10
‑
20个)包括跨越几个(14
‑
27个)氨基酸总长的体细胞突变/改变以形成新表位序列并通过10个氨基酸的富含甘氨酸/丝氨酸的柔性接头连接在一起的患者特异性新表位组成。基于对连接序列的评价,富含甘氨酸/丝氨酸的接头典型地在个性化疫苗的构建体之间变化,使得所选择的接头典型地将排除类似于在人前蛋白质组中发现的序列的连接表位。新表位抗原模块经由如上所述源自人igg3的二聚化模块与天然人趋化因子巨噬细胞炎性蛋白
‑
1α(靶向模块)连接。转录物翻译为大约100kda的含603
‑
973个氨基酸的蛋白质,其形成大约200kda的二聚体蛋白。
[0182]
一旦通过肌内施用递送给患者,pvb10.neo就被细胞摄取并且导致vb10.neo蛋白的局部瞬时产生和分泌。设计并选择所编码的蛋白质的结构以支持针对患者特异性新抗原的强细胞免疫应答的诱导。
[0183]
pvb10.neo dna主链序列(具有新表位抗原模块的通用指示物)示于图12并作为seq id no:77提供。图13中示出了pvb10.neo质粒的不同功能元件。实例1在黑素瘤小鼠模型(b16)中用vb10.neo新抗原dna疫苗和(2,7
‑
(双
‑
甲氧基peg
10kd
‑
甲酰胺)(9h
‑
芴
‑9‑
基)甲基n
‑
氨基甲酸酯)
6avg
白介素
‑
2进行的组合疗法
[0184]
进行了研究以调查t细胞扩增剂即(2,7
‑
(双
‑
甲氧基peg10kd
‑
甲酰胺)(9h
‑
芴
‑9‑
基)甲基n
‑
氨基甲酸酯)
6avg
白介素
‑
2当在黑素瘤b16小鼠肿瘤模型中进行的疫苗接种研究中与示例性的基于dna的免疫治疗性新抗原疫苗vb10.neo组合施用时是否可以加强新表位
特异性ifn
‑
γt细胞应答,并且评价任何增强的新表位特异性t细胞应答的程度。
[0185]
从詹维尔实验室(janvier laboratories)获得15只雌性c57bl/6小鼠。研究设计和疫苗接种计划的概述示于表3。
[0186]
b16模型:在第0、21和35天用20μg对照pdna vb1026或20μg vb4011为c56bl/6小鼠接种3次。在第三次vb4011疫苗接种的同一天静脉内施用rslail
‑
2(0.8mg/kg)。在第一次vb4011疫苗接种后第42天(第三次疫苗接种后第7天)通过ifn
‑
γelispot测量免疫原性。表3.b16小鼠模型疫苗接种计划
[0187]
如本文进一步所述,还探索了其他疫苗接种/施用计划。
[0188]
b16黑素瘤小鼠模型中的elispot结果:如图2a和表4所示,rslail
‑
2与vb4011组合施用有效加强新表位特异性ifn
‑
γt细胞应答。在接种vb4011的小鼠中,新表位m2、m3、m4、m7、m9和m10是免疫原性的(表4(免疫原性应答以灰色方框示出)和图2a)。对于从经过vb4011 rslail
‑
2处理的小鼠分离的脾细胞,新表位m2、m4、m6、m7、m9和m10是免疫原性的。对于在两个治疗分组中都具有免疫原性的新表位,与vb4011单一疗法相比,在用vb4011 rslail
‑
2组合疗法治疗的小鼠中观察到更强的免疫应答。
[0189]
免疫原性表位的标准定义为与平均阴性对照(pdna vb1026) 2xsd相比,≥25个ifn
‑
γ 斑点/106个细胞和>ifn
‑
γ 斑点数/106个细胞。然而,在该实验中,由于合并了脾细胞(5只小鼠),不能使用2xsd。表4.当用对应于vb4011疫苗中编码的新表位的肽再刺激时(b16黑素瘤模型),来自单独接种vb4011或与rslail
‑
2组合接种vb4011的小鼠的合并脾细胞(n=5)的ifn
‑
γ 斑点数(spu)组别vb1026vb4011vb4011 rslail
‑
2肽spu/106个脾细胞spu/106个脾细胞spu/106个脾细胞b
‑
pep m0116722b
‑
pep m0251262907b
‑
pep m0302820b
‑
pep m0415109367b
‑
pep m0511712b
‑
pep m063232b
‑
pep m07069222b
‑
pep m08039b
‑
pep m093261565b
‑
pep m108142306总斑点数6118902461
[0190]
数字代表elispot中一式三份的平均值,并且表示为spu/106个脾细胞。从针对每个新表位引发的平均spu中减去培养基对照中spu的平均数。将斑点计数<0的孔报告为0。将
免疫原性表位的标准定义为≥25spu/106个细胞。确定为免疫原性的表位加灰色方框。
[0191]
报告ifn
‑
γ 斑点/106个细胞证明在用rslail
‑
2 vb4011(双联体)处理的小鼠中新表位特异性t细胞的频率增加。在双联体处理的小鼠中,观察到当与接种vb4011的小鼠相比时,脾脏通常增大2
‑
3倍(表5)。因此,在用vb4011
‑
rslail
‑
2组合治疗的小鼠中,新表位特异性t细胞的总数也增加。为了适应这种增加,计算每个脾脏中分泌ifn
‑
γ 的t细胞的总数(spu)(表5),并因此,确定新表位特异性t细胞增加3.7倍(也参见图2b)。这种增加对于cd8 t细胞和cd4 t细胞都很明显(分别为图2c和图2d)。这一发现证明rslail
‑
2与vb4011组合施用不仅有效增加小鼠临床前黑素瘤模型中新表位特异性t细胞的频率,而且有效增加小鼠临床前黑素瘤模型中新表位特异性t细胞的总数。表5.经治疗的小鼠(b16黑素瘤模型)中的脾细胞总数
[0192]
另外的研究:在达到上述研究方案之前和之后,探索了替代的给药计划。假设为了获得由于主题组合疗法引起的特别强烈且持久的t细胞应答,rslail
‑
2的施用优选在新表位特异性t疫苗诱导的t细胞应答建立后进行,即在疫苗接种后(即在第一剂、第二剂或后续剂量的疫苗后)进行。因此,用治疗性新表位特异性的基于dna的癌症疫苗接种可有效诱导新表位特异性t细胞应答,然后通过施用t细胞扩增剂诸如rslail
‑
2进一步扩增新表位特异性t细胞应答,该t细胞扩增剂有效地非特异性地进一步扩增现有的t细胞群。研究揭示通过调准或基本上调准两种治疗剂(即,新表位特异性的基于dna的癌症疫苗和t细胞扩增剂)的峰值t细胞应答,可以实现优化的(优选协同的)应答。参见,例如,图5a和图5b中所示的结果,其基于该临床前癌症模型支持t细胞扩增剂诸如rslail
‑
2的施用在新表位特异性的基于dna的癌症疫苗的一次或多次施用之后,并且优选以这样的方式,其中由于每种免疫治疗剂的施用而引起的峰值t细胞应答基本上匹配,特别是在初始或早期多轮疫苗接种和/或施用t细胞扩增剂之后。例如,在双联体组合中,并且仅基于疫苗的单次初始施用,当t细胞扩增剂rslail
‑
2的施用发生在疫苗施用后11天时,观察到最佳应答。因此,这些结果表明,通过基于施用后每种治疗剂的峰值t细胞应答对每种治疗剂的给药进行策略性调准,可以实现优化应答。如图5b所示,相对于施用第二剂的新表位特异性的基于dna的癌症疫苗的时间,施用t细胞扩增剂rslail
‑
2的时间影响t细胞应答。也就是说,如图5b所示,在施用第二剂疫苗后的一段时间处(在这种情况下,是3天后)施用rslail
‑
2,引起特异性t细胞应答的显著增强。
[0193]
在进一步探索给药计划时,图5c提供了在疫苗接种计划的不同阶段施用rslail
‑
2的结果,例如在同一天施用第3剂疫苗和rslail
‑
2,以及施用第3剂疫苗并延迟施用rslail
‑
2。如果两次或更多次疫苗接种,则rslail
‑
2施用延迟3天;在单次疫苗接种的情况下,rslail
‑
2的施用延迟7天、11天或14天。基于该b16模型中的这些结果,似乎t细胞扩增剂rslail
‑
2与第二剂疫苗的施用适度地协同加强特异性t细胞应答,并且在该相同模型中,
rslail
‑
2与第3剂疫苗的施用似乎以相似的程度协同地影响特异性t细胞应答,无论是在同一天施用还是延迟。基于这些结果,似乎可优选在新表位特异性的基于dna的癌症疫苗诱导期后(例如,在多于一次的疫苗接种后,例如在2次或3次或4次或更多次疫苗接种后)施用t细胞扩增剂诸如rslail
‑
2,从而协同加强特异性t细胞应答,优选降低对施用t细胞扩增剂的时间的敏感性。实例2在结肠癌小鼠模型(ct26)中用vb10.neo新抗原dna疫苗和(2,7
‑
(双
‑
甲氧基peg
10kd
‑
甲酰胺)(9h
‑
芴
‑9‑
基)甲基n
‑
氨基甲酸酯)
6avg
白介素
‑
2进行的组合疗法
[0194]
进行了研究以调查t细胞扩增剂即(2,7
‑
(双
‑
甲氧基peg10kd
‑
甲酰胺)(9h
‑
芴
‑9‑
基)甲基n
‑
氨基甲酸酯)
6avg
白介素
‑
2当在结肠癌ct 26小鼠肿瘤模型中进行的疫苗接种研究中与示例性的基于dna的免疫治疗性新抗原疫苗vb10.neo组合施用时是否可以加强新表位特异性ifn
‑
γt细胞应答,并且评价任何增强的新表位特异性t细胞应答的程度。
[0195]
从詹维尔实验室获得20只雌性balb/cjrj小鼠。研究设计和疫苗接种计划的概述示于表5。
[0196]
ct26模型:在ct26模型中,用50μg对照pdna vb1026或50μg vb4061为balb/c小鼠接种1次。在vb4061疫苗接种后第7天静脉内施用rslail
‑
2(0.8mg/kg)。为了模拟疫苗接种过程中的肿瘤环境,在pdna(vb1026或vb4061)疫苗接种前7天注射5
×
104个ct26肿瘤细胞。在vb4061疫苗接种后第14天通过ifn
‑
γelispot测量免疫原性。表6.ct26小鼠模型疫苗接种计划也可将肿瘤日视为发生在第(
‑
)7天,疫苗接种发生在第0天且rslail
‑
2的施用在第7天。
[0197]
还探索了其他疫苗接种/施用计划。
[0198]
ct26结肠癌模型中的elispot:与上述实例1中描述的示例性b16黑素瘤模型中观察到的强烈协同作用一致,在ct26小鼠肿瘤模型中vb4061和rslail
‑
2的组合的新表位特异性ifn
‑
γt细胞应答也显著升高(图3a
‑
3d和表7)。
[0199]
在接种vb4061的小鼠中,引发了针对新表位m1、m30、m103和m106的免疫应答(图3a和表7,免疫原性表位以灰色方框指出)。相比之下,在用vb4061 rslail
‑
2治疗的小鼠中,还有6种新表位诱导了免疫应答(m2、m8、m65、m112和m125)。从经过rslail
‑
2单一疗法治疗的小鼠中分离的脾细胞仅引发针对新表位m112的免疫应答。
[0200]
这些数据清楚地证明并且在另一个不同的临床前小鼠模型中证实,rslail
‑
2在接种vb4061的小鼠中强烈地协同加强新表位特异性ifn
‑
γt细胞应答,因此进一步验证了本文提供的方法,其通过借助于施用基于dna的个性化新抗原疫苗与t细胞增强剂诸如rslail
‑
2的组合而引起强烈的、新抗原聚焦的免疫应答,从而改善患者的临床结果。而且,
在这些实验中,为小鼠注射肿瘤细胞以模拟荷瘤临床环境。观察到vb4061 rslail
‑
2的组合有效增加新表位特异性t细胞应答的广度(更多的新表位)和深度(对每种新表位更强的应答)。
[0201]
在elispot测定法中分析单独小鼠的脾细胞,并且免疫原性表位的标准定义为≥25个ifn
‑
γ 斑点/106个细胞和>平均阴性对照(vb1026) 2xsd(表7,平均阴性对照(vb1026 2xsd)的数目在第二列中加阴影。
[0202]
数字代表elispot中各个小鼠的重复,并且表示为spu/106个脾细胞。从每份样品针对每个新表位引发的平均spu中减去培养基对照中spu的平均数。将斑点计数<0的样品报告为0。免疫原性表位定义为≥25个spu/106个脾细胞和>平均阴性对照(vb1026) 2xsd。被认为具有免疫原性的表位由灰色方框指出。表7.当用对应于vb4061疫苗中编码的新表位的肽再刺激时,来自分离自在有或没有rslail
‑
2的情况下接种vb4061的小鼠的脾细胞的ifn
‑
γ 细胞数(spu)
[0203]
如在b16小鼠模型中观察到的,观察到用rslail
‑
2治疗的小鼠的脾脏与接种vb4061的小鼠相比增大约2
‑
3倍(表8)。正如b16模型的情况一样,计算每个脾脏中分泌ifn
‑
γ 的t细胞的总数。在经过rslail
‑
2 vb4061治疗的小鼠中观察到新表位特异性t细胞总数增加4倍(图3b)。
[0204]
rslail
‑
2与vb4061组合对cd8 t细胞限制性新表位的协同作用甚至更显著,在组合治疗组中增加6倍(参见图3c和图3d)。效应cd8 t细胞的诱导激活与rslail
‑
2的机制一致,已经证实rslail
‑
2通过il
‑
2rβγ特异性地发出信号,已经证实il
‑
2rβγ由于il
‑
2r链的不同表达会促进肿瘤杀伤性淋巴细胞诸如nk细胞和cd8 t细胞的扩增和激活超过cd4 t细胞。每个ct26肿瘤模型研究组关于总cd4 t细胞应答的结果示于图3d,其显示组合治疗组增
加2.5倍。表8.每个脾脏中的脾细胞总数和t细胞应答(spu)
[0205]
至少基于上述结果,示例性的新表位癌症疫苗vb10.neo和rslail
‑
2的组合显著协同加强新表位特异性t细胞应答,导致新表位特异性t细胞应答的量与vb10.neo单一疗法相比增加多达5倍。用vb10.neo与rslail
‑
2组合治疗的小鼠对每种新表位并且还对更多的新表位表现出更强烈的应答,证明该组合增加了免疫应答的广度和深度。另外,新表位特异性t细胞的频率和总数均升高。而且,与cd4 t细胞应答相比,对cd8 t细胞应答的协同作用甚至更显著,这支持了该组合诱导强烈的新表位特异性cd8 t细胞应答的能力。实例3在ct26结肠癌小鼠模型中用vb10.neo新抗原dna疫苗和(2,7
‑
(双
‑
甲氧基peg
10kd
‑
甲酰胺)(9h
‑
芴
‑9‑
基)甲基n
‑
氨基甲酸酯)
6avg
白介素
‑
2以及抗pd
‑
1抗体进行的组合疗法
[0206]
进行该实验以探索rslail
‑
2是否能在ct26肿瘤模型中增加接种了vb4061和抗pd
‑
1抗体的小鼠中的肿瘤保护性免疫应答。采用的示例性治疗性新抗原dna疫苗vb4061编码来自ct26的20种新表位,如上表2以及图7和图8所示。
[0207]
在该研究中,从詹维尔实验室获得36只雌性balb/cjrj小鼠。所有balb/c小鼠在第0天用致死剂量的5
×
104个ct26肿瘤细胞激发。在第0天、第3天、第7天、第10天、第14天、第27天和第64天,经电穿孔肌内(i.m.)施用50μg vb4061。腹膜内(i.p.)注射200μg抗pd
‑
1抗体。第7天开始每天7次(q7d),并静脉内(i.v.)注射0.8mg/kg rslail
‑
2。第18天开始每天9次(q9d)。vb1026(如表2所述)用作阴性对照,并与vb4061同一天施用。本研究中使用的pdna质粒示于表2并且疫苗接种方案示于表9。表9.治疗性疫苗接种计划
[0208]
在肿瘤细胞注射后第56天,用vb4061 抗pd
‑
1抗体(n=6)或用vb4061 抗pd
‑
1抗体 rslail
‑
2的三重组合(n=7)治疗的无肿瘤小鼠用第二致死剂量的5
×
104个ct26肿瘤细胞
再次激发。包括原初balb/c小鼠(n=6)作为体内肿瘤细胞生长的对照。未进行进一步疫苗接种。
[0209]
通过使用电子卡尺来测量体重和肿瘤体积大小而定期监测ct26细胞的肿瘤生长。根据评分表密切跟踪小鼠的健康状况。在肿瘤达到>体重的10%之前处死小鼠。
[0210]
单独的和与抗pd
‑
1组合的vb4061诱导肿瘤保护性应答(数据未示出)。在该研究中,证实疫苗接种可诱导肿瘤保护性免疫应答(图4a
‑
4d)。而且,该实验的结果说明,当与rslail
‑
2组合施用时,接种了vb4061和抗pd
‑
1的小鼠中的肿瘤保护作用得以进一步加强。肿瘤生长、无瘤小鼠和总存活率示于图4a
‑
4c。
[0211]
再次激发:用第二致死剂量的5
×
104个ct26肿瘤细胞再次激发两个治疗分组中在第56天无肿瘤的balb/c小鼠,而不进一步治疗。包括原初balb/c小鼠(n=6)作为对照以监测肿瘤生长。在再次激发后观察小鼠的肿瘤生长直至第71天。所有6只对照小鼠快速发展肿瘤并处死。相比之下,用vb4061 抗pd
‑
1或vb4061 抗pd
‑
1 rslail
‑
2预处理的所有小鼠受到针对第二致死剂量的ct26肿瘤细胞的完全保护
‑
证明诱导保护性记忆免疫应答(图4d)。
[0212]
统计分析:两个治疗组的肿瘤生长曲线(图4a)与对照组有统计学差异,然而,两个治疗组没有统计学差异(表10)。表10.治疗组肿瘤生长的统计分析(来自双因素anova的邓尼特多重比较检验)(各组肿瘤生长(平均值)的多重比较(通过graph pad prism 6.05分析)ns=不显著,p<0.05。*=p<0.05,**=p≤0.01,***=p≤0.001,****=p≤0.0001。
[0213]
在三联疗法vb4061 抗pd
‑
1抗体 rslail
‑
2治疗组中观察到肿瘤生长减少,其中50%的三联治疗小鼠保持无肿瘤并且从未建立肿瘤。相比之下,仅20%接受vb4061 抗pd
‑
1抗体而无rslail
‑
2的小鼠(图4b)受到保护。尽管治疗组之间存在数值差异,但使用mantel
‑
cox检验的统计学分析得到p=0.2083的p值(表11)。
[0214]
在两个治疗分组中,观察到建立的肿瘤的肿瘤消退,并且在vb4061 抗pd
‑
1和
vb4061 抗pd
‑
1 rslail
‑
2治疗组的总存活率分别为70%和80%(图4c)。使用两个治疗分组的存活曲线的mantel
‑
cox检验的统计学分析显示,在这两组中没有统计学显著差异,但是与对照组相比时,两个治疗组都达到显著性(表11)。表11.治疗组的统计分析(mantel
‑
cox检验):原发性肿瘤激发中的肿瘤生长和总存活率ns=不显著且****=p≤0.0001。在graph pad prism 6.05中进行分析
[0215]
在再次激发实验中,两个治疗组都对致死剂量的ct26细胞具有完全的保护作用,并且两组在肿瘤生长和总存活率方面与对照组均有统计学差异(表12)。表12.治疗组的统计分析(mantel
‑
cox检验):再次激发中的肿瘤生长和总存活率ns=不显著且****=p≤0.0001。
[0216]
如在接种了vb4061 抗pd1的小鼠中观察到的肿瘤保护作用,当与t细胞扩增剂即rslail
‑
2组合时进一步强化。这些结果证明这些独特且非重叠的机制的整合可用于产生对已建立肿瘤的有效治疗。在用致死剂量的肿瘤细胞再次激发的小鼠中,两个治疗组都受到完全保护,证明该疗法诱导长效的肿瘤保护性记忆免疫应答。
[0217]
在小鼠中进行的肿瘤激发实验中,似乎在开始用rslail
‑
2治疗时的肿瘤负荷可以预测应答
‑
例如,当施用第一剂rslail
‑
2时肿瘤大小小于6mm时,对于更多数目的小鼠观察到完全应答。
[0218]
未治疗的小鼠(对照)和用vb4061 抗pd
‑
1 rslail
‑
2治疗的小鼠组的肿瘤长度通过使用电子卡尺测量肿瘤长度大小(mm)来进一步定期监测。在该研究中,证实在ct26结肠癌小鼠模型中疫苗接种可以诱导肿瘤消退和稳定(图7a
‑
7b)。该实验的结果说明,当与rslail
‑
2组合施用时,接种了vb4061和抗pd
‑
1的小鼠中的肿瘤保护作用得以进一步加强。如图7b所示,用vb4061和抗pd
‑
1为小鼠接种并联合施用rslail
‑
2在具有相对较小肿瘤(例如小于约5
‑
6mm的肿瘤)的小鼠中引起快速、完全且持久的肿瘤消退,以及较大肿瘤(例如大于约5
‑
6mm且甚至大于约10mm的肿瘤)的持久稳定。实例4在患有局部晚期或转移性黑素瘤、非小细胞肺癌(nsclc)、透明肾细胞癌、尿路上
皮癌或头颈部鳞状细胞癌的用现行护理标准免疫检查点阻断未达到完全应答的患者中单独用个性化vb10.neo新抗原dna疫苗或用(2,7
‑
(双
‑
甲氧基peg
10kd
‑
甲酰胺)(9h
‑
芴
‑9‑
基)甲基n
‑
氨基甲酸酯)
6avg
白介素
‑
2进行的人类1/2a期研究。
[0219]
目的:该1/2a期研究的主要目的是评估(i)多个剂量的3mg vb10.neo免疫疗法和(ii)多个剂量的3mg vb10.neo免疫疗法与0.006mg/kg rslail
‑
2组合的安全性/耐受性。次要目的包括(i)评估多个剂量的3mg vb10.neo免疫疗法的免疫原性和多个剂量的3mg vb10.neo免疫疗法与0.006mg/kg rslail
‑
2组合的免疫原性,以及(ii)另外初步评估多个剂量的3mg vb10.neo免疫疗法的功效和多个剂量的3mg vb10.neo免疫疗法与0.006mg/kg rslail
‑
2组合的功效。另外的探索性目的包括,例如,在治疗期间免疫特征改变的研究,以及在单独的vb10.neo免疫疗法或与rslail
‑
2组合之后免疫应答和临床功效之间的相关性的探索。
[0220]
理由:临床前研究(上文)已经证实,vb10.neo和rslail
‑
2的组合协同加强新表位特异性t细胞应答,导致新表位特异性t细胞应答的量与单独的vb10.neo相比增加5倍。用vb10.neo与rslail
‑
2组合治疗的小鼠表现出对每种新表位和增加数目的新表位更强的应答,表明免疫应答的广度和深度都升高。该组合对cd8 t细胞应答显示出甚至更明显的作用,因为与任一种药剂单独施用时相比,该组合引起对更多新表位的新表位特异性cd8 t细胞应答,进一步强化了该组合诱导强烈的新表位特异性cd8 t细胞应答的能力。在治疗性肿瘤模型中,在用vb10.neo、rslail
‑
2和检查点抑制剂即抗pd
‑
1抗体的三重组合治疗的小鼠中观察到增加数目的完全应答者,证明将已在临床前模型中证实会产生对已建立肿瘤的有效治疗的这些独特且非重叠的机制集合在一起的强有力的理由。
[0221]
该试验研究了多个剂量的vb10.neo与rslail
‑
2组合对局部晚期或转移性实体瘤患者中检查点抑制背景的安全性、免疫原性和有效性。在组合分组中,患者接受vb10.neo疫苗接种和0.006mg/kg iv rslail
‑
2,第一剂在vb10.neo疫苗接种开始后11周施用。更具体地,这项开放标签的首次人体1/2a期研究设计用于评价在局部晚期或转移性实体瘤(包括黑素瘤、nsclc(非小细胞肺癌)、透明细胞rcc(肾细胞癌)、尿道上皮癌或scchn(头颈部鳞状细胞癌))的患者中以个性化vb10.neo或vb10.neo和rslail
‑
2免疫疗法组合多次给药的安全性和功效,这些患者用现行护理标准(即,检查点抑制剂疗法,cpi)没有达到完全应答。cpi护理标准包括,例如,纳武单抗、派姆单抗或阿特珠单抗。该研究方案可在研究过程中进行修改。
[0222]
该研究的a部分由5个不同肿瘤实体中的6个分组组成。所有患者在cpi疗法背景下施用vb10.neo。患者至少从疫苗制造开始接受cpi(分组1、5a和5b)或再持续≥12周(分组2
‑
4)。分组5(scchn)分为分组5a和分组5b。分组5a施用vb10.neo,而分组5b接受vb10.neo和rslail
‑
2的组合。
·
分组1黑素瘤
ꢀꢀꢀꢀꢀꢀꢀꢀ
vb10.neo
·
分组2 nsclc
ꢀꢀꢀꢀꢀꢀꢀꢀ
vb10.neo
·
分组3 rcc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
vb10.neo
·
分组4尿路上皮癌
ꢀꢀꢀꢀ
vb10.neo
·
分组5a scchn
ꢀꢀꢀꢀꢀꢀꢀ
vb10.neo
·
分组5b scchn
ꢀꢀꢀꢀꢀꢀꢀ
vb10.neo rslail
‑
2(组合)
[0223]
在研究的第一阶段(部分a)中,每个分组中治疗最多10名患者。
[0224]
研究的部分b将在一定数量的患者入组并在部分a中分析后开放。扩展部分b将包括最多3个肿瘤特异性扩展队列。
[0225]
该研究分为3个周期:筛选及制造期、治疗期和长期随访期。
[0226]
新抗原疫苗pvb10.neo是6297
‑
7407个碱基对的非复制、非整合、遗传稳定和非致病性的裸露的、共价闭合、环状和超螺旋的双链脱氧核糖核酸(dna)质粒,这取决于个性化疫苗中所包含的新表位的数目。它编码由3个模块组成的单一重组同型二聚体蛋白:靶向模块、二聚化模块和新表位抗原模块。后者由多个(10
‑
20个)包括跨越几个(14
‑
27个)氨基酸总长的体细胞突变/改变以形成新表位序列并通过10个氨基酸的富含甘氨酸/丝氨酸的柔性接头连接在一起的患者特异性新表位组成。新表位抗原模块经由源自人igg3的二聚化模块与天然人趋化因子巨噬细胞炎性蛋白
‑
1α(靶向模块)连接。转录物翻译为大约100kda的含603
‑
973个氨基酸的蛋白质,其形成大约200kda的二聚体蛋白。参见图12。
[0227]
在新表位之间使用的富含甘氨酸/丝氨酸的接头典型地对于不同患者疫苗而言基于对连接序列的评价在构建体之间变化,使得优选的接头是排除类似于在人类基因组中发现的序列的连接表位的接头。可在新表位之间使用的说明性接头包括seq id no:67
‑
76中提供的接头。
[0228]
vb10.neo疫苗的筛选、制造和递送:vb10.neo在2ml无菌环烯烃共聚物小瓶中作为在磷酸盐缓冲盐水ph7.4中浓度为3mg/ml的无菌即用型溶液提供。将小瓶储存在
‑
20℃(
±
5℃)。使用无针注射系统,stratis 0.5ml无针注射系统施用疫苗。
[0229]
为了制备个性化疫苗,基于鉴定诱导自身免疫性风险低的免疫原性新表位的合格算法选择新表位。然后合成单独的vb10.neo疫苗;估计从肿瘤取样到施用的过程将花费大约12至16周,优选6
‑
10周,更优选4
‑
6周。通过肌内注射给予疫苗接种。
[0230]
满足所有合格标准(例如,预期寿命≥6个月且持续良好的体力状态(东部肿瘤协作组[ecog]体力状态≤1)的患者可接受进入试验。
[0231]
分组1
‑
4:作为患者的护理标准并根据当前批准的适应症,筛选的患者必须接受至少12周的检查点抑制剂(抗pd
‑
1或抗pd
‑
l1)。
[0232]
分组5a和分组5b:只要按照患者的scchn护理标准开始了cpi治疗,就可以筛选患者。
[0233]
在筛选访视时,合格患者提供一份血样和至少一份肿瘤标本。血样和肿瘤标本是强制性的。一旦获得足够的肿瘤标本,患者就入组,并且开始个性化新抗原疫苗制造期(大约12
‑
16周)。
[0234]
将血液和组织样品纳入外显子组测序程序,其中将从血液和肿瘤样品测序的外显子组进行比较以鉴定患者的个体体细胞肿瘤特异性突变(新表位)。将血液和组织样品纳入外显子组测序程序,其中将从血液和筛选肿瘤样品测序的外显子组进行比较以鉴定患者的个体体细胞肿瘤特异性突变(新表位)。当设计/组装vb10.neo疫苗时,优先选择在多于一份样品(新鲜活检组织、可获得的存档肿瘤标本和来自血液中的无细胞(cf)dna)中发现的新表位。
[0235]
对肿瘤样品进行rna测序以选择在肿瘤中表达的蛋白质中发现的新表位。另外,将血样用于hla分型以选择结合个体患者的hla分子的新表位。一旦获得患者特异性vb10.neo
疫苗并且如果患者特异性疫苗在制造后满足所有预先指定的产品发布标准,就开始用个性化vb10.neo免疫疗法进行疫苗接种。
[0236]
作为冻干粉提供的rslail
‑
2在施用前由临床医生复溶,并且每个患者的剂量由患者的体重(以千克计)决定。根据给药计划,在30(
±
5)分钟内以0.006mg/kg的起始剂量静脉内施用rslail
‑
2。除第一剂以外,rslail
‑
2与vb10.neo在同一天施用。首先进行疫苗接种,2小时后进行rslail
‑
2施用。如果在同一天进行cpi治疗,则给药以一定时间间隔按以下顺序进行:(1)vb10.neo(等待2小时);(2)rslail
‑
2(等待30分钟);(3)cpi。
[0237]
rslail
‑
2容许剂量延迟和减少。rslail
‑
2的施用可以延迟或基于观察到的药物相关毒性将剂量减少至0.003mg/kg。如果rslail
‑
2的剂量减少到0.003mg/kg,则在剩余研究整个期间剂量水平都应该保持在该水平。
[0238]
在个性化疫苗制造期间,成像程序(计算机断层扫描/磁共振成像,例如ct/mri)作为标准患者护理的一部分进行,并且最新的成像程序用作功效评估的基线。具有完全应答的患者或在治疗期开始之前已经停止cpi治疗的患者或已经开始另一种抗癌治疗的患者将仍有可能在疫苗制造完成后与研究人员和申办者达成协议后接受vb10.neo(和rslail
‑
2(对于分组5b而言))。
[0239]
vb10.neo(所有分组):疫苗接种在第1次访视时开始。患者将至少从制造开始接受cpi(分组5a和分组5b)或再持续≥12周(分组1
‑
4)。除cpi外,患者在预先指定的时间点接受最多14次每次3mg vb10.neo的疫苗接种,持续长达1年。将vb10.neo疫苗添加到这种持续的cpi治疗中,并且不会代替、省略、推迟或终止标准疗法。在疫苗接种诱导期,除了他们的cpi之外,患者还接受3次3mg vb10.neo的疫苗接种,每周3次。从第10周起,除了他们的cpi之外,患者还将接受每周4次疫苗接种的维持治疗,从第一次疫苗接种起持续长达1年。
[0240]
rslail
‑
2(分组5b):rslail
‑
2给药开始于第11周(第8a次访视),第四次vb10.neo疫苗接种后1周,并且是预计vb10.neo已经产生稳健的新抗原特异性t细胞应答时。入组到分组5a中的scchn患者,如果愿意并满足分组5b的所有纳入标准,可移入分组5b(在研究人员和申办者同意后),并且在第11周或在持续到第34周的维持期中任何稍后vb10.neo疫苗接种访视1周后开始用rslail
‑
2治疗(即vb10.neo剂量10,第18周 1周)。接受至少1剂vb10.neo疫苗接种的患者有资格施用rslail
‑
2。
[0241]
分组5b中的患者除了vb10.neo和cpi之外还接受0.006mg/kg iv rslail
‑
2。前2剂rslail
‑
2 4以每周3次的间隔施用,随后剂量以每周4次的间隔施用。继续治疗直至第18次访视(第50周)时治疗结束(eot)。根据rslail
‑
2开始的时间点,患者接受最多11个剂量的rslail
‑
2。除第一rslail
‑
2剂量外,所有随后剂量均与vb10.neo在同一天施用。活检和血液程序:
[0242]
分组1
‑
4:为了捕获筛选与第一次vb10.neo疫苗接种之间的变化以及对vb10.neo疫苗接种的应答的变化,在第1次访视(第一次vb10.neo疫苗接种)时进行至多3次活检并且在第10次访视(第18周)时进行1次活检。这样产生总共最多10次活检(筛选时3次,第1次访视时3次,第10次访视时1次,以及在第一次疫苗接种后的任何时间点最多3次另外的活检)。
[0243]
分组5a和分组5b:为了表征rslail
‑
2施用之前与之后的变化,要求患者在第一次施用rslail
‑
2之前7天和之后15
‑
21天内提供任选的活检。另外,可在第1次访视时进行活检。在这些时间点中的每个时间点,进行最多3次活检。这样产生总共最多13次活检(筛选时
3次,第1次访视时3次,第一rslail
‑
2剂量前1周3次,第一次施用后15
‑
21天3次,和第一次疫苗接种后任何时间点1次另外的活检)。
[0244]
如果患者在试验过程中因任何原因接受切除,则应保护肿瘤材料以进一步分析。
[0245]
上述所有活检都是可选的,仅应在患者同意和安全可触及的病变的情况下进行,根据研究人员的意见,该病变不会将患者置于不合理的风险中。研究人员将决定哪些肿瘤病变是优选的,以及是否需要ct引导活检来保护具有足够肿瘤细胞含量的高质量样品。为了最大程度降低患者的辐射负担,在本研究过程中,将ct引导活检限制为最多5次活检。
[0246]
所有分组:在筛选,第2、8、10、13和18次访视时采集血样以分离cfdna用于外显子组测序和监测治疗期间血浆中的患者特异性肿瘤突变。
[0247]
所有分组:在第1次访视(基线)、第8a次访视(第11周)、第11次访视(第22周)、第14次访视(第34周)和第19次访视(最后一次疫苗接种后30天)时采集血样(外周血单核细胞[pbmc]),以定量外周新表位特异性t细胞应答。对于在第50周之前终止参与或停止治疗的患者,在最后一次疫苗接种后30天的随访时采集pbmc的血样。
[0248]
在分组5a和分组5b中,在第8b次访视/第12周时采集另外的血样(pbmc)。该样品用于定量由t细胞扩增剂rslail
‑
2诱导的外周新表位特异性t细胞应答。
[0249]
在分组5a和分组5b中,在第三次vb10.neo疫苗接种后7
‑
14天(第7a次访视/第7周)和第一次rslail
‑
2施用后7天(第8b次访视/第12周)采集血样,以便精细表征新表位特异性t细胞。功能分析可包括例如流式细胞术、elispot、酶联免疫吸附测定法和细胞毒性测定法,并将与分离自肿瘤组织/标本的t细胞克隆进行比较。
[0250]
对治疗功效的评估如下。根据实践标准定定期通过irecist评估肿瘤对vb10.neo和rslail
‑
2的应答。成像程序作为标准患者护理的一部分进行,并且由于参与本研究,患者不暴露于任何进一步的辐射。
[0251]
由于vb10.neo的12至16周的制造期,按照标准实践进行的至少2次成像程序应该在治疗开始前可用,其中这两次中的后一次在第1次访视4周以内。
[0252]
第1次访视4周以内进行的成像是根据irecist进行肿瘤评估的基线。对于分组5b,成像评估应优选尽可能接近第一剂rslail
‑
2之前进行。
[0253]
理想地,使用相同的评估方法(成像方式,例如mri或ct),根据个体场所的标准护理实践,在基线和所有随访检查期间,对个体患者表征每个鉴定和报告的病变。
[0254]
功效分析:vb10.neo免疫疗法单独或与rslail
‑
2组合的功效的早期迹象将基于总应答率(orr)、应答持续时间(dor)、无进展存活期(pfs)、总存活期(os)。对部分a和部分b中的每个肿瘤实体特异性队列单独进行功效分析。将描述性地分析功效终点,包括适用比例的95%置信区间。将使用kaplan
‑
meier乘积极限方法分析dor、pfs和os。
[0255]
进行的其他评估包括生命体征(体温、氧合、脉率、收缩和舒张bp、bp监测、脉搏和ecg,以及血液评估。血液分析包括以下内容:白细胞差异分析、血红蛋白、血细胞比容、红细胞计数、血小板计数、尿素、钙、氯化物、磷
‑
无机、钾、钠、肌酸酐、尿酸、c反应蛋白、alt、ast、γ
‑
谷氨酰转移酶、胆红素、脂肪酶、碱性磷酸酶、乳酸脱氢酶、促甲状腺激素(tsh)、游离三碘甲状腺原氨酸(ft3)、游离甲状腺素(ft4)、葡萄糖、蛋白质、白蛋白、部分促凝血酶原激酶时间、国际标准化比率、胆固醇、甘油三酯、胆碱酯酶、肌酸激酶。如果需要,还将收集血清并冷冻以进行评估。还将进行尿分析。还将收集血样用于pbmc的分离和冷冻保存。
[0256]
通过ifn
‑
γ酶联免疫斑点测定法(elispot)(一种t细胞活性的替代物)测量个性化vb10.neo疫苗策略的外周免疫应答。将单独地评估对疫苗中包含的每种新表位的免疫应答。对于具有足够pbmc的患者,可以通过细胞表面标志物的流式细胞术分析、四聚体分析和细胞内细胞因子染色来进行进一步分析,以表征t细胞分布。另外,可通过tcr测序进行t细胞受体(tcr)库的进一步分析。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。